银杏花提取物的制备方法及应用
文献发布时间:2023-06-19 10:11:51
技术领域
本发明涉及生物医药技术领域,尤其涉及银杏花提取物的制备方法及应用。
背景技术
血管内皮细胞死亡与动脉粥样硬化,组织缺血和肿瘤等多种血管疾病有关。随着人们生活水平的提高,心血管疾病发生率呈上升趋势,越来越受到研究者们的关注。此病主要出现血管功能异常,血管内皮细胞受损等病理特征,病理生理上表现在动脉壁变厚,血管弹性变差,以及动脉粥样硬化斑块的产生。此外,氧化应激状态失常,造成的血管氧化损伤导致血管功能状态失常和血管内皮不同程度的病理损伤。铁死亡是新发现的一种细胞死亡形式,近两年被大量研究报道。多种化学和生物因素能够诱导细胞的铁死亡。Erastin是一种选择性靶向癌基因RAS的抑制肿瘤生长小分子。Erastin主要通过胱氨酸/谷氨酸转运系统,抑制胱氨酸的摄取,避开抗氧化的防护,最终导致铁依赖和脂质ROS依赖的氧化死亡,被称之为铁死亡。铁死亡能被小分子DFO,Fer-1等所挽救,因此被认为是铁死亡的抑制剂。铁死亡是基因调控的细胞死亡形式,在不同疾病中众多调控分子参与调控这一新的死亡过程。目前,银杏花提取物内在抑制血管内皮细胞铁死亡的作用尚未见报道。
发明内容
本发明的目的在于提供银杏花提取物的制备方法及应用,本发明制备得到银杏花提取物具有良好的血管内皮细胞保护作用,可通过调控铁死亡相关蛋白,发挥铁死亡抑制作用。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种银杏花提取物的制备方法,包括以下步骤:
将银杏花的花序于体积分数为65%~70%的乙醇水溶液中浸泡,加热进行回流提取,收集提取液,得到银杏花提取物。
优选的,所述银杏花包括银杏雄花。
优选的,所述回流提取的温度为70~80℃,所述回流提取的次数为3~4次,每次回流提取的时间为1~2h。
优选的,所述收集提取液后还包括:
1)去除所述提取液中的乙醇,得到粗提物;
2)采用石油醚对所述粗提物进行第一萃取,去除石油醚萃取物,收集石油醚萃余物;
3)采用氯仿对所述石油醚萃余物进行第二萃取,收集氯仿萃取物和氯仿萃余物,所述氯仿萃取物为银杏花提取物。
优选的,所述第二萃取后还包括:采用乙酸乙酯对所述氯仿萃余物进行第三萃取,收集乙酸乙酯萃取物和乙酸乙酯萃余物,所述乙酸乙酯萃取物为银杏花提取物。
优选的,所述乙酸乙酯萃取物包括山柰酚、芹菜素、木犀草素和山柰酚-3-O-α-L-鼠李糖苷中的一种或几种。
优选的,所述第三萃取后还包括:采用正丁醇对所述乙酸乙酯萃余物进行第四萃取,收集正丁醇萃取物,所述正丁醇萃取物为银杏花提取物。
本发明还提供了银杏花提取物在制备抑制血管内皮细胞铁死亡的药物中的应用;所述银杏花提取物选自上述方案所述制备方法得到的银杏花提取物。
本发明提供了银杏花提取物的制备方法。本发明的制备方法能够极大程度上将银杏花中有效成分提取出来。本发明制备得到的银杏花提取物具有良好的血管内皮细胞保护作用,可通过调控铁死亡相关蛋白,ACSL4的表达显著下调,GPX4蛋白的表达显著上调,从而发挥铁死亡抑制作用。在提取物浓度为100mg/L时,同erastin诱导的铁死亡模型组相比,银杏花乙醇提物组细胞存活率明显上升(
附图说明
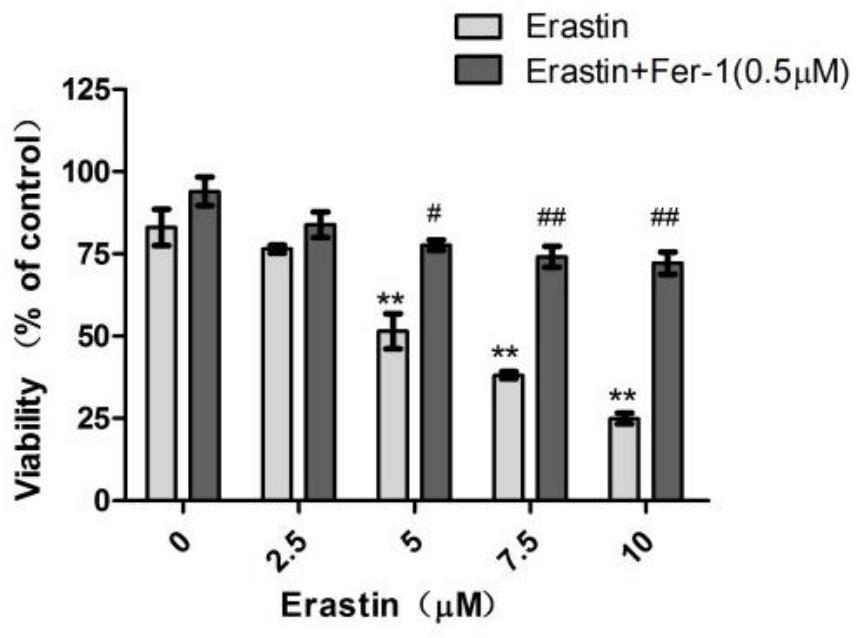
图1表示erastin诱导的HUVEC细胞活力的影响,同DMSO组相比,
图2表示吉姆萨染色法观察erastin对HUVEC细胞形态学影响,图2为为40X镜下观察结果,DMSO组;erastin(5μM)组;erastin(5μM)+Fer-1(1μM)组;
图3表示银杏花总提物及萃取部位对erastin诱导的HUVEC细胞活力的影响;注:同erastin模型组相比,
图4表示式1~式9所示结构式的化合物对erastin诱导的HUVEC细胞活力的影响;注:同erastin模型组相比,
图5表示WB检测木犀草素对铁死亡相关蛋白ACSL4及GPX4表达的影响,其中A为化合物7木犀草素(luteolin)对ACSL4及GPX4表达影响的WesternBlot条带,B为luteolin对ACSL4蛋白表达影响的统计图,C为luteolin对GPX4蛋白表达影响的统计;注:同erastin模型组相比,
具体实施方式
本发明提供了一种银杏花提取物的制备方法,包括以下步骤:
将银杏花的花序于体积分数为65%~70%的乙醇水溶液中浸泡,加热进行回流提取,收集提取液,得到银杏花提取物。
在本发明中,所述银杏花优选的包括银杏雄花。
在本发明中,所述银杏雄花序的含水量优选为3.7%~7.9%;所述银杏雄花序和所述乙醇水溶液的质量比优选为1:(5~7),更优选为1:6。在本发明中,所述浸泡的温度优选为20~30℃,进一步优选为25℃;所述浸泡的时间优选为40~60h,进一步优选为48h。在本发明中,所述回流提取的温度优选为70~80℃,所述回流提取的次数优选为3~4次,每次回流提取的时间优选为1~2h。
本发明在所述收集提取液后优选的还包括:
1)去除所述提取液中的乙醇,得到粗提物;
2)采用石油醚对所述粗提物进行第一萃取,去除石油醚萃取物,收集石油醚萃余物;
3)采用氯仿对所述石油醚萃余物进行第二萃取,收集氯仿萃取物和氯仿萃余物,所述氯仿萃取物为银杏花提取物。
本发明首先去除所述银杏花乙醇提取物中的乙醇,得到粗提物。在本发明中,去除所述银杏花乙醇提取物中的乙醇的方法优选为:对所述银杏花乙醇提取物进行减压蒸馏;所述减压蒸馏的温度优选为60℃。本发明在进行减压蒸馏后,优选的还包括将所述减压蒸馏后的浸膏和水混合;所述浸膏和水的质量比优选为1:1。
得到粗提物后,本发明采用石油醚对所述粗提物进行第一萃取,去除石油醚萃取物,收集第一剩余物;所述第一萃取的时间以石油醚层无色为准;所述第一萃取的温度优选为20~25℃;所述第一萃取的次数优选为3~5次;每次第一萃取所述石油醚和所述粗提物的体积比优选为(2~4):1,进一步优选为3:1。
得到第一剩余物后,本发明采用氯仿对所述第一剩余物进行第二萃取,收集氯仿萃取物和第二剩余物;所述第二萃取的温度优选为20~25℃;所述第二萃取的次数优选为3~5次,所述第二萃取的时间以氯仿层无色为准;每次第二萃取所述氯仿和所述第一剩余物的体积比优选为(2~4):1,进一步优选为3:1。
本发明在所述第二萃取后优选的还包括:采用乙酸乙酯对所述氯仿萃余物进行第三萃取,收集乙酸乙酯萃取物和乙酸乙酯萃余物,所述乙酸乙酯萃取物为银杏花提取物。
在本发明中,所述第三萃取的时间以乙酸乙酯层无色为准;所述第三萃取的温度优选为20~25℃;所述第三萃取的次数优选为3~5次;每次第三萃取所述乙酸乙酯和所述第二剩余物的体积比优选为(2~4):1,进一步优选为3:1。
在本发明中,得到乙酸乙酯萃取物后,优选的还包括采用硅胶柱对乙酸乙酯进行梯度洗脱;所述梯度洗脱的程序优选为:依次采用氯仿、体积分数为100:0的氯仿甲醇溶液(A)、体积分数为80:1的氯仿甲醇溶液(B)、体积分数为40:1的氯仿甲醇溶液(C)、体积分数为20:1的氯仿甲醇溶液(D)、体积分数为10:1的氯仿甲醇溶液(E)、体积分数为6:1的氯仿甲醇溶液(F)和体积分数为3:1的氯仿甲醇溶液(G)、体积分数为1:1的氯仿甲醇溶液(H)进行洗脱,收集获得8个部分的洗脱液,依次命名为Fr.A、Fr.B、Fr.C、Fr.D、Fr.E、Fr.F、Fr.G和Fr.H。在本发明中,所述乙酸乙酯萃取物的质量和所述硅胶柱的体积的比例优选为1kg:10L;所述梯度洗脱中每个梯度采用的洗脱液的体积优选为10mL,洗脱液的流速优选为3mL/min。
得到Fr.C、Fr.D、Fr.F和Fr.G后,采用Sephadex LH-20凝胶色谱柱分别对Fr.C、Fr.D、Fr.F和Fr.G进行交叉等度洗脱,得到洗脱液;所述交叉等度洗脱采用的流动相包括:流动相A、流动相B和流动相C;所述流动相A包括氯仿和甲醇,所述氯仿和甲醇的体积比优选为1:1;所述流动相B为甲醇;所述流动相C为体积分数为80%的甲醇水溶液。在本发明中,所述洗脱液中包括式1~式9所示结构式的化合物;
其中Fr.C反复用流动相A及流动相B洗脱得到式8所示化合物;本发明具体实施过程中,包括以下步骤:对Fr.C进行第一洗脱;所述第一洗脱的的条件包括:流动相为流动相A;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为10mL;洗脱液的流速优选为3mL/min。经过第一洗脱得到Fr.C1、Fr.C2、Fr.C3、Fr.C4和Fr.C5共5个组分。对Fr.C3进行第二洗脱,第二洗脱和第一洗脱的条件相同,经过第二洗脱得到Fr.C3a、Fr.C3b、Fr.C3c和Fr.C3d。对Fr.C3b进行第三洗脱,第三洗脱采用的流动相为流动相B,每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,其余洗脱条件和第一洗脱的条件相同。第三洗脱共收集22瓶流份,其中流份19~21为式8所示化合物。
Fr.D反复用流动相A等度洗脱得到式2所示化合物,经流动相A及流动相B反复洗脱析出黄色沉淀经过滤分别得到式5、6、7所示化合物,反复经流动相A、流动相B等度交叉洗脱得到式3、4所示化合物。本发明具体实施过程中,包括以下步骤:对Fr.D进行第1洗脱;所述第1洗脱的条件包括:流动相为流动相A;色谱柱为内径为2.5cm、长度为150cm的SephadexLH-20凝胶色谱柱;每份洗脱液体积为25mL;洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.D1、Fr.D2、Fr.D3、Fr.D4、Fr.D5、Fr.D6、Fr.D7、Fr.D8、Fr.D9,共9个流份;对Fr.D4进行第2洗脱,所述第2洗脱的条件包括:流动相为流动相A;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱,每份洗脱液体积为10mL,洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.D4a、Fr.D4b、Fr.D4c和Fr.D4d,共4个流份;对Fr.D4a进行第3洗脱,所述第3洗脱的条件和第2洗脱相同,经TLC点板将洗脱液合并分段为Fr.D4a1、Fr.D4a2和Fr.D4a3共3个流分;对Fr.D4a1进行第4洗脱,所述第4洗脱的条件和第2洗脱相同,第4洗脱共收集31瓶流份,其中流份18~19为式2所示化合物;对Fr.D4a2进行第5洗脱,所述第5洗脱的条件包括:流动相为流动相B;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,第5洗脱共收集25瓶流份,其中流份23~24为式4所示化合物。
对Fr.D7进行第6洗脱,所述第6洗脱的条件和第5洗脱相同,经TLC点板将洗脱液合并分段为Fr.D7a、Fr.D7b、Fr.D7c、Fr.D7d、Fr.D7e和Fr.D7f,共6个流份,其中洗脱液Fr.D7d中析出黄色沉淀,经过滤后,收集沉淀得到式6所示化合物,洗脱液Fr.D7f中析出黄色沉淀,经过滤后,收集沉淀得到式7所示化合物。
对Fr.D8进行第7洗脱,所述第7洗脱的条件和第5洗脱相同,经TLC点板将洗脱液合并分段为Fr.D8a、Fr.D8b、Fr.D8c、Fr.D8d和Fr.D8e,共5个流份,对Fr.D8b进行第8洗脱,所述第8洗脱的条件和第5洗脱相同,第8洗脱共收集得到41瓶流份,其中流份23~26为式3所示化合物。
对Fr.D9进行第9洗脱,所述第9洗脱的条件和第5洗脱相同,洗脱液析出黄色沉淀,经过滤后,收集沉淀得到式5所示化合物。
对Fr.F反复用流动相B及流动相C等度洗脱得到式9所示化合物;本发明具体实施过程中,包括以下步骤:对Fr.F进行第I洗脱,所述第I洗脱的条件包括:流动相为流动相A;色谱柱:内径为2.5cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为25mL,洗脱液的流速优选为3mL/min;经TLC点板将洗脱液合并分段为Fr.F1、Fr.F2、Fr.F3、Fr.F4和Fr.F5,共5个流份。对Fr.F5进行第II洗脱,所述第II洗脱的条件包括:流动相为流动相B;色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,经TLC点板将洗脱液合并分段为Fr.F5a、Fr.F5b、Fr.F5c、Fr.F5d、Fr.F5e和Fr.F5f,共6个流份;对Fr.F5b进行第III洗脱,所述第III洗脱的条件包括:流动相为流动相C;色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为1.5mL/min,第III洗脱共收集40瓶流份,其中流份19~20为式9所示化合物。
对Fr.G进行第i洗脱,所述第i洗脱的条件包括:流动相为流动相A,色谱柱:内径为2.5cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为25mL,洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.G1、Fr.G2、Fr.G3、Fr.G4、Fr.G5、Fr.G6、Fr.G7、Fr.G8和Fr.G9,共9个流份;对Fr.G3进行第ii洗脱,所述第ii洗脱的条件包括:流动相流动相A,色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,经TLC点板将洗脱液合并分段为Fr.G3a、Fr.G3b、Fr.G3c、Fr.G3d、Fr.G3e、Fr.G3f、Fr.G3h和Fr.G3g 7个流份,其中Fr.G3d流份中析出白色沉淀,过滤后,收集沉淀得到式1所示化合物。
在本发明中,所述乙酸乙酯萃取物优选的包括山柰酚、芹菜素、木犀草素和山柰酚-3-O-α-L-鼠李糖苷中的一种或几种。
本发明在所述第三萃取后优选的还包括:采用正丁醇对所述乙酸乙酯萃余物进行第四萃取,收集正丁醇萃取物,所述正丁醇萃取物为银杏花提取物。
在本发明中,所述第四萃取的时间以正丁醇层无色为准;所述第四萃取的温度优选为20~25℃;所述第四萃取的次数优选为3~5次;所述第四萃取所述正丁醇和所述第三剩余物的体积比优选为(2~4):1,进一步优选为3:1。
本发明还提供了银杏花提取物在制备抑制血管内皮细胞铁死亡的药物中的应用;所述银杏花提取物选自上述方案所述制备方法得到的银杏花提取物。本发明对所述药物的剂型没有特殊要求。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
1.材料和方法
1.1仪器与试剂
RE-85A型旋转蒸发仪(河南巩义予华仪器公司);柱层析硅胶(100-200目,200-300目),薄层层析硅胶(HF254,GF254;青岛海洋化工厂);羟丙基葡聚糖凝胶(Sephadex LH-20;瑞典Pharmacia公司);石油醚、氯仿、乙酸乙酯、正丁醇等试剂为分析纯(国药集团化学试剂有限公司)。erastin(tocris,美国R&D Systems公司);Ferrostatin-1(selleck,美国Selleck Chemicals公司);L-DMEM培养基(Gibco,美国Thermo Fisher Scientific公司);胎牛血清(fetal bovine serum,FBS,四季青,浙江天杭生物科技公司);胰蛋白酶粉(Sigma,美国Sigma-Aldrich公司);CCK-8(Bimake,美国Bimake生物科技公司);ACSL4、GPX4antibody(Abcam,英国Abcam公司);GAPDH(CST,美国CST公司)。
1.2植物来源
银杏新鲜雄花于2018年4月人工采摘自山东郯城,标本(No.GBF180420)现存于辐射医学研究所抗辐射药物研究室中。
1.3细胞模型
用erastin诱导的人脐静脉血管内皮细胞(HUVEC)为体外铁死亡模型进行实验(参见【Xiao F J,Zhang D,WuY,et al.MiRNA-17-92protects endothelial cells fromerastin-induced ferroptosis through targeting the A20-ACSL4 axis[J].BBRC,2019,515(2019):448-454.】)。HUVEC细胞在含10%FBS、100U/mL青霉素、100μg/mL链霉素的L-DMEM培养基中传代培养,细胞在37℃、5%CO
具体造模步骤:将处于对数生长期的HUVEC细胞胰酶消化,离心后计数,细胞在37℃、5%CO
造模成功:HUVEC细胞加入erastin后,细胞发生死亡,随着erastin药物浓度的增大,呈剂量依赖关系。而铁死亡抑制剂fer-1组能逆转erastin诱导的细胞死亡,结果显示后续实验可以用此细胞作为诱导细胞铁死亡的模型。
1.4银杏花提取与分离
1)取银杏干燥雄花序2kg,用70%乙醇水溶液充分浸泡48h后,加热回流提取4次,每次2h,每次采用的乙醇水溶液的质量为12kg,将提取物于60℃条件下减压蒸馏至无醇味,得到银杏花浸膏。
2)在得到的银杏花浸膏中加入体积比1:1的水分散后,加入3倍量石油醚,充分混匀后静置分层,收集上层石油醚层,反复萃取,萃取至石油醚层无色后;将剩余水层继续依次加入3倍量氯仿、乙酸乙酯、正丁醇,重复上述萃取步骤。合并各萃取部位,60℃减压蒸馏各萃取部位,至无有机溶剂味。
4)取1.96g乙酸乙酯部位上硅胶柱,依次采用体积分数为100:0的氯仿甲醇溶液(A)、体积分数为80:1的氯仿甲醇溶液(B)、体积分数为40:1的氯仿甲醇溶液(C)、体积分数为20:1的氯仿甲醇溶液(D)、体积分数为10:1的氯仿甲醇溶液(E)、体积分数为6:1的氯仿甲醇溶液(F)和体积分数为3:1的氯仿甲醇溶液(G)、体积分数为1:1的氯仿甲醇溶液(H)进行洗脱,收集获得8个部分的洗脱液,依次命名为Fr.A、Fr.B、Fr.C、Fr.D、Fr.E、Fr.F、Fr.G和Fr.H;所述乙酸乙酯萃取物的质量和所述硅胶柱的体积的比例优选为1kg:10L;所述梯度洗脱中每个梯度采用的洗脱液的体积优选为10mL,洗脱液的流速优选为3ml/min。
5)得到Fr.C、Fr.D、Fr.F和Fr.G后,采用Sephadex LH-20凝胶色谱柱分别对Fr.C、Fr.D、Fr.F和Fr.G进行交叉等度洗脱,得到洗脱液;所述交叉等度洗脱采用的流动相包括:流动相A、流动相B和流动相C;所述流动相A包括氯仿和甲醇,所述氯仿和甲醇的体积比为1:1;所述流动相B为甲醇;所述流动相C为体积分数为80%的甲醇水溶液。在本发明中,所述洗脱液中包括式1~式9所示结构式的化合物;
其中Fr.C反复用流动相A及流动相B洗脱得到式8所示化合物;本发明具体实施过程中,包括以下步骤:对Fr.C进行第一洗脱;所述第一洗脱的的条件包括:流动相为流动相A;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为10mL;洗脱液的流速优选为3mL/min。经过第一洗脱得到Fr.C1、Fr.C2、Fr.C3、Fr.C4和Fr.C5共5个组分。对Fr.C3进行第二洗脱,第二洗脱和第一洗脱的条件相同,经过第二洗脱得到Fr.C3a、Fr.C3b、Fr.C3c和Fr.C3d。对Fr.C3b进行第三洗脱,第三洗脱采用的流动相为流动相B,每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,其余洗脱条件和第一洗脱的条件相同。第三洗脱共收集22瓶流份,其中流份19~21为式8所示化合物。
Fr.D反复用流动相A等度洗脱得到式2所示化合物,经流动相A及流动相B反复洗脱析出黄色沉淀经过滤分别得到式5、6、7所示化合物,反复经流动相A、流动相B等度交叉洗脱得到式3、4所示化合物。本发明具体实施过程中,包括以下步骤:对Fr.D进行第1洗脱;所述第1洗脱的条件包括:流动相为流动相A;色谱柱为内径为2.5cm、长度为150cm的SephadexLH-20凝胶色谱柱;每份洗脱液体积为25mL;洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.D1、Fr.D2、Fr.D3、Fr.D4、Fr.D5、Fr.D6、Fr.D7、Fr.D8、Fr.D9,共9个流份;对Fr.D4进行第2洗脱,所述第2洗脱的条件包括:流动相为流动相A;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱,每份洗脱液体积为10mL,洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.D4a、Fr.D4b、Fr.D4c和Fr.D4d,共4个流份;对Fr.D4a进行第3洗脱,所述第3洗脱的条件和第2洗脱相同,经TLC点板将洗脱液合并分段为Fr.D4a1、Fr.D4a2和Fr.D4a3共3个流分;对Fr.D4a1进行第4洗脱,所述第4洗脱的条件和第2洗脱相同,第4洗脱共收集31瓶流份,其中流份18~19为式2所示化合物;对Fr.D4a2进行第5洗脱,所述第5洗脱的条件包括:流动相为流动相B;色谱柱为内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,第5洗脱共收集25瓶流份,其中流份23~24为式4所示化合物。
对Fr.D7进行第6洗脱,所述第6洗脱的条件和第5洗脱相同,经TLC点板将洗脱液合并分段为Fr.D7a、Fr.D7b、Fr.D7c、Fr.D7d、Fr.D7e和Fr.D7f,共6个流份,其中洗脱液Fr.D7d中析出黄色沉淀,经过滤后,收集沉淀得到式6所示化合物,洗脱液Fr.D7f中析出黄色沉淀,经过滤后,收集沉淀得到式7所示化合物。
对Fr.D8进行第7洗脱,所述第7洗脱的条件和第5洗脱相同,经TLC点板将洗脱液合并分段为Fr.D8a、Fr.D8b、Fr.D8c、Fr.D8d和Fr.D8e,共5个流份,对Fr.D8b进行第8洗脱,所述第8洗脱的条件和第5洗脱相同,第8洗脱共收集得到41瓶流份,其中流份23~26为式3所示化合物。
对Fr.D9进行第9洗脱,所述第9洗脱的条件和第5洗脱相同,洗脱液析出黄色沉淀,经过滤后,收集沉淀得到式5所示化合物。
对Fr.F反复用流动相B及流动相C等度洗脱得到式9所示化合物;本发明具体实施过程中,包括以下步骤:对Fr.F进行第I洗脱,所述第I洗脱的条件包括:流动相为流动相A;色谱柱:内径为2.5cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为25mL,洗脱液的流速优选为3mL/min;经TLC点板将洗脱液合并分段为Fr.F1、Fr.F2、Fr.F3、Fr.F4和Fr.F5,共5个流份。对Fr.F5进行第II洗脱,所述第II洗脱的条件包括:流动相为流动相B;色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,经TLC点板将洗脱液合并分段为Fr.F5a、Fr.F5b、Fr.F5c、Fr.F5d、Fr.F5e和Fr.F5f,共6个流份;对Fr.F5b进行第III洗脱,所述第III洗脱的条件包括:流动相为流动相C;色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为5mL,洗脱液的流速优选为1.5mL/min,第III洗脱共收集40瓶流份,其中流份19~20为式9所示化合物。
对Fr.G进行第i洗脱,所述第i洗脱的条件包括:流动相为流动相A,色谱柱:内径为2.5cm、长度为150cm的Sephadex LH-20凝胶色谱柱;每份洗脱液体积为25mL,洗脱液的流速优选为3mL/min,经TLC点板将洗脱液合并分段为Fr.G1、Fr.G2、Fr.G3、Fr.G4、Fr.G5、Fr.G6、Fr.G7、Fr.G8和Fr.G9,共9个流份;对Fr.G3进行第ii洗脱,所述第ii洗脱的条件包括:流动相流动相A,色谱柱:内径为1cm、长度为150cm的Sephadex LH-20凝胶色谱;每份洗脱液体积为5mL,洗脱液的流速优选为2mL/min,经TLC点板将洗脱液合并分段为Fr.G3a、Fr.G3b、Fr.G3c、Fr.G3d、Fr.G3e、Fr.G3f、Fr.G3h和Fr.G3g 7个流份,其中Fr.G3d流份中析出白色沉淀,过滤后,收集沉淀得到式1所示化合物。
经前期波谱解析其结构依次鉴定为甲基松柏苷(式1),3-(4-hydroxy-3-methoxyphenyl)propane-1,2-diol(式2),银杏内酯B(式3),银杏内酯C(式4),山柰酚(式5),芹菜素(式6),木犀草素(式7),芹菜素-7-O-β-D-葡萄糖苷(式8),山柰酚-3-O-α-L-鼠李糖苷(式9)。银杏花提取物、萃取部位及式1~式9所示结构式的化合物分别用DMSO配制成溶液用于活性筛选实验。
本发明中,银杏花提取物、萃取部位为100μg/mL,化合物浓度为10μM。
1.5吉姆萨染色法观察细胞形态
取对数生长期的HUVEC胰酶消化计数,取5×10
1.6CCK-8法检测细胞存活率
取对数生长期的HUVEC细胞消化后,制成细胞悬液以2×10
1.7Westernblot检测目的蛋白表达
取对数生长期的HUVEC细胞以5×10
1.8统计学分析
以上实验分别独立重复三次,实验数据表示为均值±标准差(x±s),应用GraphPadPrism 5软件,采用单因素方差分析法进行统计学分析。
2.结果
2.1用erastin处理HUVEC细胞,建立内皮细胞的铁死亡模型
不同浓度的erastin(μM)0、2.5、5、7.5、10处理HUVEC细胞后,细胞存活率显著降低,可被铁死亡抑制剂(Fer-1)挽救(图1)。
显微镜下观察DMSO组,erastin(5μM)组,erastin+Fer-1(1μM)组的细胞形态,镜下形态学上看出erastin组诱导的细胞死亡发生核和胞浆的固缩,胞浆结构完全消失,细胞膜光滑完整;而erastin+Fer-1组可以逆转细胞死亡(图2)。
2.2银杏花总提物及萃取部位对erastin诱导的HUVEC细胞活力的影响Erastin诱导细胞发生铁死亡,给药24h后,结果显示,在提取物浓度为100mg/L时,同erastin诱导的铁死亡模型组相比,银杏花总提物组细胞存活率明显上升(
2.3化合物对erastin诱导的HUVEC细胞活力的影响
选取前期从活性部位乙酸乙酯部位分离纯化得到的式1~式9所示结构式的化合物对erastin诱导的HUVEC细胞进行抗铁死亡活性筛选,结果显示(图4),同erastin模型组相比,化合物浓度为10μM时,式5、式6、式7和式9所示结构式的化合物均能显著提高细胞存活率(
2.4式7所示结构式的化合物对ACSL4及GPX4表达的影响
为了探究活性最好的式7所示结构式的化合物-木犀草素(luteolin)对内皮细胞铁死亡抑制作用的初步机制,用木犀草素处理HUVEC细胞后检测其对铁死亡相关蛋白ACSL4及GPX4表达的影响,结果显示(图5),erastin造模后能够上调ACSL4并下调GPX4,同erastin模型组相比,木犀草素及阳性药Fer-1均能够显著地下调ACSL4(
ACSL4及GPX4是铁死亡发生过程中的已明确的关键蛋白,通过调控该蛋白可以抑制或促进铁死亡的发生。上述实验结果表明木犀草素可通过调控这两个铁死亡关键蛋白抑制铁死亡进而发挥内皮细胞保护作用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 银杏花提取物的制备方法及应用
- 一种咖啡银皮提取物及其制备方法和应用
