一种检测piRNA的量子点纳米传感器的制备方法和应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及一种检测piRNA的量子点纳米传感器的制备方法和应用,属于生物分析技术领域。
背景技术
PIWI相互作用RNA(piRNA)是一种长度为24-31个核苷酸的小型非编码RNA,通过抑制转座子活性来维持基因组完整性。此外,piRNA广泛参与多种生理过程,包括RNA沉默、mRNA周转、端粒保护,和表观遗传学调控。piRNA的异常表达可能损害基因组稳定性,并与多种癌症的发生密切相关,包括肾癌、胃癌、乳腺癌、肺癌和结直肠癌。即使在复杂的生物基质中,piRNA 3′端的2′-O-甲基化修饰也可以保护piRNA不被降解或氧化,这使得piRNA成为非常可靠和有前景的癌症生物标志物。因此,piRNA的检测对癌症的基础研究和诊断具有很高的价值。微阵列和northern印迹适用于piRNA检测,但它们存在洗涤和分离程序费力、样品消耗大、结果半定量、特异性差和灵敏度有限等问题。
聚合酶链式反应能够高灵敏度地定量piRNA,但需要复杂的逆转录步骤才能将piRNA转化为互补DNA。另外,已经报道了几种基于光电化学和荧光检测的新方法用于piRNA检测,荧光法由于其快速、简单和高灵敏度的突出优点而更加流行。这些荧光piRNA测定通常使用有机染料(例如,黑洞猝灭剂2、黑洞猝灭剂1、Cy3、Cy5和Cy5.5)来构建荧光猝灭探针,其具有低量子产率、差光稳定性和小斯托克斯位移的局限性,并且由于光谱干扰和不完全荧光猝灭可能产生非特异性结果。
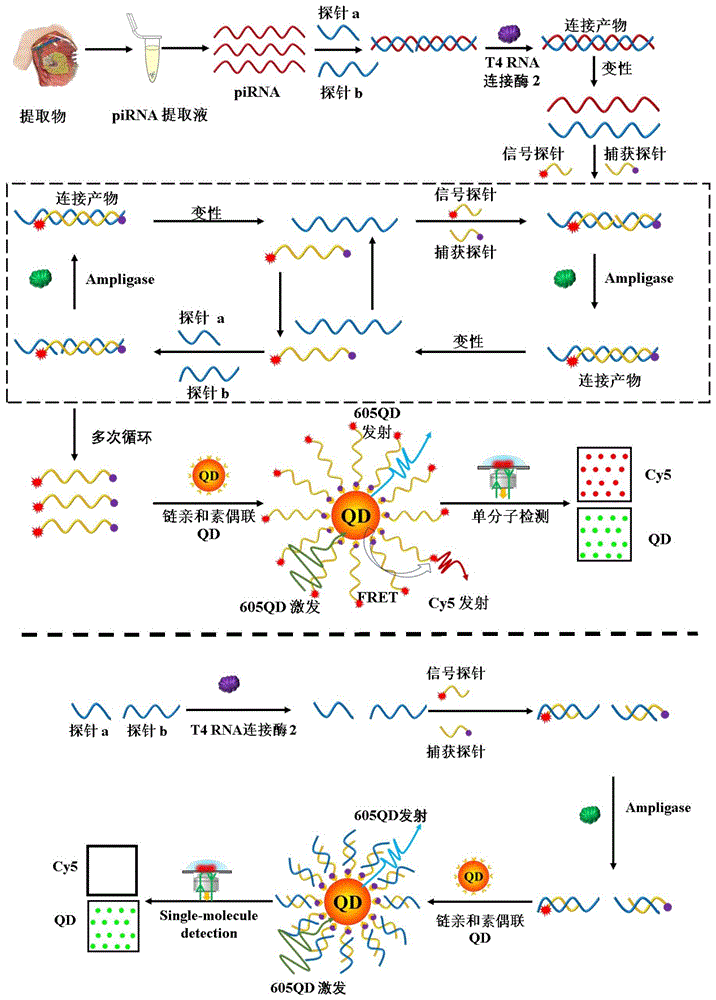
半导体量子点(QD)是一种新型荧光纳米材料,具有高量子产率、窄而对称的发射、高亮度、良好的生物相容性和优异的光稳定性等优点,被认为是生物传感应用的理想荧光标记和构建块。特别是,QD可以作为有效的能量供体来构建荧光共振能量转移(FRET)系统,该系统能够灵敏、均匀地检测不同的生物分子,具有最小化数据变化的能力,并由微环境变化、不稳定光源和不对称探针分布系统地诱导。在此,开发了一种基于连接介导的指数扩增的单量子点纳米传感器,该传感器可以简单、选择性和灵敏地定量piRNA,具有单碱基辨别能力和单细胞敏感性,甚至可以检测癌症患者临床组织样本中的piRNA。
发明内容
技术问题:本发明的目的是提供一种检测piRNA的量子点纳米传感器的制备方法和应用,该方法具有单碱基辨别能力和单细胞敏感性,可进一步应用于测定piRNA在不同细胞系中的表达水平,以及临床癌症和健康组织中piRNA水平的区分,为piRNA相关的生物医学研究、药物发现提供了一个简单而强大的平台。
技术方案:PIWI相互作用RNA(piRNA)是一种小型非编码RNA,对维持基因组完整性至关重要。异常的piRNA水平与多种癌症密切相关,使其成为癌症研究和检测的有前途的生物标志物。然而,已报道的piRNA检测往往存在采购费力、特异性差、样品消耗量大和灵敏度不令人满意的问题,这使得它们难以在实际临床应用中应用。在此,开发了一种用于简单、灵敏和选择性定量piRNA的催化单量子点纳米传感器。在这种纳米传感器中,piRNA信号可以通过T4 RNA连接酶2特异性识别并连接探针a和探针b后,实现ssDNA信号转移。得到的探针ab可以触发扩增酶DNA连接酶催化的Cy5标记的报告探针c和生物素标记的报告探针d的连接,形成探针cd。探针cd反过来促进新探针a和b的连接。因此,可以实现指数信号放大,产生大量Cy5-和生物素标记的探针cd。这些探针cd可以组装在605QD表面上,以诱导有效的Förster共振能量转移信号。由于连接反应的高保真度、高效的指数信号放大和先进的单分子荧光检测,该纳米传感器具有单碱基识别能力和高灵敏度,检测极限为104aM,它可以准确灵敏地定量不同细胞系甚至临床组织样本中的内源性piRNA,为piRNA相关的生物医学和临床研究提供了一个新的平台。
本发明的检测piRNA的量子点纳米传感器的制备方法具体步骤如下:
步骤1,piRNA与T4 RNA连接酶2缓冲液、探针a、探针b、T4 RNA连接酶2和ATP反应,得到反应产物;
其中,piRNA是与Piwi蛋白相互作用的核糖核酸;
T4 RNA连接酶2是一种可以催化单链核糖核酸、单链脱氧核糖核酸或单核苷酸分子间或分子内5'磷酸基末端与3'羟基末端之间形成磷酸二酯键的酶;
T4 RNA连接酶2缓冲液为T4 RNA连接酶2产品中自带的反应缓冲液;
ATP是腺嘌呤核苷三磷酸;
步骤2,将步骤1的反应产物加入含有Ampligase缓冲液、探针c和探针d以及Ampligase的反应体系,连接链反应进行热循环,得到连接产物;
其中,Ampligase是一种扩增连接酶;
Ampligase缓冲液为Ampligase产品中自带的反应缓冲液;
步骤3,将605QDs与步骤2得到的连接产物在含有1×QD缓冲液的溶液中混合,在室温下孵育15min后得到量子点纳米传感器,即可进行后续测量;
其中,605QD是最大发射波长在605nm的半导体量子点。
所述T4 RNA连接酶2缓冲溶液包括Tris-HCl、MgCl
所述Ampligase缓冲溶液包括Tris-HCl,KCl,MgCl
所述QD缓冲溶液包括Tris-HCl,MgCl
所述piRNA序列为:GGC CCC AUG GUG UAA UGG UCA GCA CUC。
所述探针a序列为:GTG CTG ACC AT/rU/rA。
所述探针b序列为:P-CAC CAT GGG GC。
所述探针c序列为:Cy5-GGC CCC ATG GTG。
所述探针d序列为:P-TAA TGG TCA GCA CTC-Biotin。
采用本发明方法制备的量子点纳米传感器的应用为:所述量子点纳米传感器用于基于连接介导的指数放大单量子点纳米传感器的催化组装用于癌症组织中PIWI-相互作用RNA的灵敏检测法的应用,应用于灵敏地检测piRNA,最低检测限达到104aM;与基于DNA四面体探针的荧光方法相比,所提出的纳米传感器的灵敏度提高了6个数量级,与基于滚圈扩增的荧光分析相比,灵敏度提高了2个数量级。
有益效果:在这种纳米传感器中,piRNA信号可以通过T4 RNA Ligase 2特异性识别并连接探针a和探针b后,实现ssDNA信号转移。所得的ssDNA可以通过扩增酶DNA连接酶催化的报告探针c和探针d的环连接来触发指数信号扩增。因此,产生了大量的探针cd,其可以组装在QD表面上,以均匀的方式诱导有效的FRET信号,消除了微阵列、northern印迹、和光电化学等方法测定piRNA中涉及的任何分离和洗涤程序。此外,由于连接反应的高保真度,可以很好地区分单碱基差异。与单分子检测相结合,所提出的纳米传感器具有104aM的低检测限,这优于其他piRNA测定,并且它可以准确灵敏地定量不同细胞系甚至临床组织样本中的piRNA,为piRNA相关的基础和临床研究提供了一个新的平台。
附图说明
图1:基于催化单量子点的piRNA纳米传感器的示意图。
图2:(A-C)605QD-探针cd-Cy5纳米复合物的piRNA定向组装的琼脂糖凝胶分析。泳道1,piRNA存在的情况下;泳道2,piRNA不存在的情况下。605QD、Cy5的信号及其共定位分别显示为绿色(A)、红色(B)和黄色(C)。(D)在存在(红色曲线)和不存在(蓝色曲线)piRNA的情况下连接产物的熔解曲线分析。温度以0.5℃/5s的速率从45℃升高到85℃。使用一阶负导数图[-d(RFU)/dT]来确定熔融温度。(E)对照(蓝色曲线)和实验(红色曲线)的Cy5和605QD荧光发射光谱的测量。(F)605QD在不存在(对照,蓝色曲线)和存在(红色曲线)piRNA时的荧光寿命曲线。
图3:存在(A,B,C)和不存在(D,E,F)piRNA时的单分子荧光图像。605QD信号用绿色(A,D)表示,Cy5信号用红色(B,E)表示,605QD和Cy5信号的共定位用黄色(C,F)表示。比例尺为2μm。。
图4:(A)Cy5计数在0至1×10
图5:(A)分别通过qRT-PCR(蓝色柱)和所提出的纳米传感器(红色柱)测量不同细胞系中的piRNA水平,包括MCF-7细胞、A549细胞、HepG2细胞、Hela细胞和HCT-116细胞。误差条是从三个独立实验中获得的标准推导。“n.s.”表示无显著差异。(B)响应不同细胞数的Cy5计数的测量。插图显示了Cy5计数与MCF-7细胞数的对数之间的线性相关性。误差棒显示了三个独立实验的标准偏差。
具体实施方式
试剂和材料:
所有寡核苷酸由Sangon Biotech Co.,有限公司(中国上海)合成。
荧光光谱的检测和实际样品的测量:
使用FLS1000光致发光光谱仪(Edinburgh Instruments有限公司,Livingston,UK)记录荧光发射光谱,发射和激发狭缝均为5nm。激发波长为488nm。分别使用605nm处的605QD荧光强度和670nm处的Cy5荧光强度进行数据分析。采用时间相关单光子计数法测量了605QDs的荧光寿命。
本发明为一种检测piRNA的量子点纳米传感器。在这种纳米传感器中,piRNA信号可以通过T4 RNA Ligase 2特异性识别并连接探针a和探针b后,实现ssDNA信号转移。所得的ssDNA可以通过扩增酶DNA连接酶催化的报告探针c和探针d的环连接来触发指数信号扩增。因此,产生了大量的探针cd,其可以组装在QD表面上,以均匀的方式诱导有效的FRET信号,消除了微阵列、northern印迹、和光电化学等方法测定piRNA中涉及的任何分离和洗涤程序。此外,由于连接反应的高保真度,可以很好地区分单碱基差异。与单分子检测相结合,所提出的纳米传感器具有104aM的低检测限,这优于其他piRNA测定,并且它可以准确灵敏地定量不同细胞系甚至临床组织样本中的piRNA,为piRNA相关的基础和临床研究提供了一个新的平台。
实施例1:
步骤1,将含有1×T4 RNALigase 2缓冲液、50nM探针a、50nM探针b、一定量piRNA、1U T4 RNA连接酶2和160μM ATP的10μL反应体积在37℃下孵育1小时;
步骤2,将反应产物加入含有1×Ampligase缓冲液、30nM信号探针和30nM捕获探针以及1.5U Ampligase的10μL反应体积中,连接链反应进行40次热循环(在80℃进行30s,45℃进行2min);
步骤3,将2.7nM 605QDs与20μL连接产物在含有1×QD缓冲液的30μL溶液中混合,在室温下孵育15min后进行后续测量。
其中,piRNA是与Piwi蛋白相作用的核糖核酸;
T4 RNA连接酶2是一种可以催化单链核糖核酸、单链脱氧核糖核酸或单核苷酸分子间或分子内5'磷酸基末端与3'羟基末端之间形成磷酸二酯键的酶;
T4 RNA连接酶2缓冲液为T4 RNA连接酶2产品中自带的反应缓冲液;
ATP是腺嘌呤核苷三磷酸;
Ampligase是一种扩增连接酶;
Ampligase缓冲液为Ampligase产品中自带的反应缓冲液;
605QD是最大发射波长在605nm的半导体量子点。
所述T4 RNA Ligase 2缓冲溶液包括500mM Tris-HCl,20mM MgCl
所述Ampligase缓冲溶液包括200mM Tris-HCl,250mM KCl,100mM MgCl
所述QD缓冲溶液包括Tris-HCl,MgCl
所述piRNA序列为:GGC CCC AUG GUG UAA UGG UCAGCACUC。
所述探针a序列为:GTG CTG ACC AT/rU/rA。
所述探针b序列为:P-CAC CAT GGG GC。
所述探针c序列为:Cy5-GGC CCC ATG GTG。
所述探针d序列为:P-TAATGG TCAGCACTC-Biotin。
实施例2:基于RNA去甲基化驱动功能性超分子结构用于无标记FTO检测
一对鉴别探针,探针A和探针b,用于检测piRNA的存在,它可以同时与靶piRNA杂交,形成探针a/探针b/piRNA夹心结构。通过添加T4 RNA连接酶2,将夹持结构中的探针a和探针b连接在一起以形成探针ab/piRNA。变性后,探针ab可以与一对报告探针,Cy5标记的探针c和生物素标记的探针d退火,以促进它们通过扩增酶连接,产生探针cd/探针ab双链。在双链体变性后,探针ab可以与新的探针c和探针d退火,以触发下一轮连接并产生新的探针cd,探针cd也可以与新探针a和探针b退火,以引发下一轮结合并产生新探针ab。由于这种循环变性-退火-连接过程,实现了指数连接链式反应,导致产生大量Cy5-和生物素标记的探针cd。然后,探针cd可以通过特异性链亲和素-生物素相互作用与有链亲和素偶联的605QD结合,导致605QD/探针cd/Cy5纳米复合物的组装,其中发生了从605QD到Cy5的有效FRET。FRET信号可以通过敏感的单分子成像和检测来容易地量化。相反,当piRNA不存在时,没有任何连接反应被激活。只有生物素标记的探针d将与605QD结合,因此没有检测到FRET信号。
实施例3:验证实验的可行性
首先使用琼脂糖凝胶分析来验证605Q-探针cd-Cy5 FRET纳米结构的piRNA定向组装。在不存在piRNA的情况下,仅检测到605QD信号(图2A,泳道2),而未观察到Cy5带(图2B,泳道2中),表明未形成FRET纳米结构。相反,当piRNA存在时,检测到605QD(图2A,泳道1)和Cy5(图2B,泳道2)的信号及其共定位(图2C,泳道3),证明605QD-探针cd-Cy5 FRET纳米结构的成功组装。同样的,如图3所示,当不存在piRNA时,仅观察到605QD点(图3D),但没有产生Cy5信号(图3E),表明没有发生FRET。相反,在piRNA处理后,605QD(图3A)和Cy5(图3B)斑点在其完美共定位的同时产生(图3C),表明piRNA在单个605QD/探针cd/Cy5纳米复合物中诱导了从605QD到Cy5的有效FRET。这也再次证明了纳米传感器的成功组装。熔解曲线分析显示,在54℃的温度下,对照组产生了一个熔点峰(图2D,蓝色曲线),而当靶标存在时,在70.5℃的高温下,另一个熔点峰值(图2D,红色曲线),表明piRNA诱导形成了探针ab和探针cd的较长连接产物。
实施例4:灵敏度的检测
为了评估纳米传感器的灵敏度,我们在最佳条件下测量了不同目标浓度产生的Cy5计数。随着目标浓度的逐渐增加,Cy5计数以浓度依赖的方式增加(图4)。Cy5计数(N)与piRNA浓度对数值(C)在1×10
实施例5:特异性的检测
为了研究所提出的piRNA纳米传感器的特异性,我们选择了五条RNA链miR-155、miR-21、let-7a、let-7b、let-7c和两个具有一个碱基错配(错配-1和错配-2)的piRNA类似物作为干扰(图4B)。piRNA产生显著增强的Cy5信号,而miR-155、miR-21、let-7a、let-7b、let-7c、错配-1和错配-2仅产生弱Cy5信号。这些结果清楚地证明了所提出的具有单碱基辨别能力的纳米传感器的优异特异性,这可能归因于连接反应的高保真度。
实施例6:实际样品分析
我们进一步将所提出的纳米传感器应用于测量不同人类细胞系中内源性piR-36026水平。所有测试的细胞系都产生可检测的piRNA信号,并且piRNA水平按MCF-7>A549>HepG2>Hela>HCT-116的顺序降低(图5A,红柱)。这些结果与标准qRT-PCR获得的结果一致(图5A,蓝柱)。此外,Cy5信号随着MCF-7细胞数量的增加而逐渐增加(图5B),并且在1至1×10
- 一种封闭环槽表面粗糙度的测量方法
- 一种封闭环槽表面粗糙度测量的辅助装置
