用于鉴定肝癌小鼠的寡聚核苷酸标志物
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及基因工程技术领域。具体地说是用于鉴定肝癌小鼠的寡聚核苷酸标志物。
背景技术
在人工构建肝癌小鼠模型时,通常需要对小鼠模型进行检测和鉴定,以确认模型是否构建成功。检测和鉴定时一种常用的方法是对小鼠进行解剖,并进行生理切片表观检测,但这一方法操作较为繁琐。
另一种常用的方法是检测小鼠体内肿瘤标志物的含量。检测肿瘤标志物的含量常使用酶联免疫吸附法(ELISA),但该方法成本较高。
编码肿瘤标志物的基因在转录起始时普遍存在流产性起始现象。流产性起始是指RNA聚合酶在启动子区合成2~10nt的寡聚核苷酸(即流产性转录本,AT)而不能脱离启动子区,最终释放这些寡聚核苷酸并终止转录的现象。流产性起始的重复过程被称为流产性循环,通常要经过10~100次循环以后,RNA聚合酶才能从启动子区逃逸出来,开始全长RNA的转录,这意味着一次转录过程中,即从转录开始到全长RNA的转录完成时,产生的流产性转录本的丰度是全长RNA丰度的10~100倍。
2009年Goldman等报道了流产性转录现象发生在所有以RNA聚合酶为特征生物的每一次转录中,而且流产性转录本在体内能够积累到可检测的水平。专利文献CN108384831A中公开了一种将寡聚核苷酸逆转录成cDNA的方法,可用于将流产性转录本逆转录为cDNA。以这些逆转录出的cDNA为模板,借助荧光定量PCR(qPCR)技术,可实现对流产性转录本进行相对定量检测。但是,关于将流产性转录本作为标志物,以荧光定量PCR来鉴定肝癌小鼠模型是否构建成功的方法目前却仍未见报道。
发明内容
为此,本发明所要解决的技术问题在于提供用于鉴定肝癌小鼠的寡聚核苷酸标志物,以用于人工构建肝癌小鼠模型时对小鼠进行检测和鉴定。
为解决上述技术问题,本发明提供如下技术方案:
用于鉴定肝癌小鼠的寡聚核苷酸标志物,为小鼠Afp基因和/或Gpc3基因转录过程中产生的流产性转录本,Afp基因流产性转录本的核苷酸序列如SEQ ID NO.7所示,Gpc3基因流产性转录本的核苷酸序列如SEQ ID NO.8所示。本发明对小鼠体内外周血中的流产性转录本进行荧光定量PCR检测,从而在多个小鼠肝癌标志基因的流产性转录本中筛选出了这两个与正常组小鼠存在显著差异的基因的流产性转录本序列。Afp基因为甲胎蛋白基因,甲胎蛋白含量是肝癌诊断时常用的指标;Gpc3基因编码了磷脂酰肌醇蛋白聚糖3,磷脂酰肌醇蛋白聚糖3在细胞的生长发育中起着重要的调控作用,其含量异常是肿瘤发生的重要原因之一。本发明将这两种基因的流产性转录本作为鉴定肝癌小鼠模型的寡聚核苷酸标志物具有较好的准确性。
上述用于鉴定肝癌小鼠的寡聚核苷酸标志物,流产性转录本SEQ ID NO.7逆转录出的核苷酸序列如SEQ ID NO.13所示;流产性转录本SEQ ID NO.8逆转录出的核苷酸序列如SEQ ID NO.14所示。
上述用于鉴定肝癌小鼠的寡聚核苷酸标志物,用于筛选肝癌小鼠模型时,以SEQID NO.6所示序列作为内参序列,利用荧光定量PCR检测小鼠体内的Afp基因和/或Gpc3基因的流产性转录本的含量。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,荧光定量PCR检测过程中所用上游引物F1的核苷酸序列如SEQ ID NO.11所示,下游引物R1的核苷酸序列如SEQ ID NO.12所示。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,Afp基因的流产性转录本荧光定量PCR检测过程中使用的探针的核苷酸序列如SEQ ID NO.9所示;Gpc3基因的流产性转录本荧光定量PCR检测过程中使用的探针的核苷酸序列如SEQ ID NO.10所示。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,SEQ ID NO.9探针及SEQ IDNO.10探针的5’端连接有荧光报告基团,3’端连接有荧光淬灭基团;荧光报告基团为FAM,荧光淬灭基团为MGB。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,荧光定量PCR反应体系为:10uL 2×Mix with UNG,20μM上游引物F1 0.5μL,20μM下游引物R1 0.5μL,2μL cDNA模板,2μM探针1μL,加ddH
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,当Afp基因的流产性转录本相对于内参序列的含量大于或等于8,或者,当Gpc3基因的流产性转录本相对于内参序列的含量大于或等于8,说明待测小鼠为肝癌小鼠。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,采用专利文献CN 111500676A中的寡聚核苷酸逆转录方法对流产性转录本进行逆转录作为荧光定量PCR检测的cDNA;Afp基因逆转录过程中的A链为如SEQ ID NO.4所示的核苷酸序列,B链为如SEQ ID NO.1所示的核苷酸序列,C链为如SEQ ID NO.2所示的核苷酸序列,特异性引物SPR为如SEQ ID NO.3所示的核苷酸序列。
上述的用于鉴定肝癌小鼠的寡聚核苷酸标志物,采用专利文献CN 111500676A中的寡聚核苷酸逆转录方法对流产性转录本进行逆转录作为荧光定量PCR检测的cDNA;Gpc3基因逆转录过程中的A链为如SEQ ID NO.5所示的核苷酸序列,B链为如SEQ ID NO.1所示的核苷酸序列;C链为如SEQ ID NO.2所示的核苷酸序列,特异性引物SPR为如SEQ ID NO.3所示的核苷酸序列。
本发明的技术方案取得了如下有益的技术效果:
1、本发明将Afp基因、Gpc3基因的流产性转录本作为鉴定肝癌小鼠的寡聚核苷酸标志物,这两种寡聚核苷酸标志物可用于肝癌小鼠模型构建时的检测与鉴定,可以在不需要解剖小鼠的条件下,仅通过外周血中寡聚核苷酸标志物的检测即可确定小鼠是否已患肝癌,从而以一种成本较为低廉且便利的方式达到检测和鉴定的目的。
2、本发明还提供了一对可用于扩增Afp基因、Gpc3基因的流产性转录本的引物,在使用Afp基因、Gpc3基因的流产性转录本序列作为鉴定肝癌小鼠的寡聚核苷酸标志物时,可使用该对引物进行荧光定量PCR扩增。
3、本发明还提供了可用于荧光定量PCR的探针,这两种探针可指示模板中的Afp基因、Gpc3基因的流产性转录本序列,用于Afp基因、Gpc3基因的流产性转录本的含量检测,并进一步用于肝癌小鼠模型的荧光定量PCR鉴定。
附图说明
图1本发明实施例中A~D链间的碱基互补关系图;
图2本发明实施例中肝癌模型小鼠与健康小鼠中各基因流产性转录本相对含量差异性分析结果图。
具体实施方式
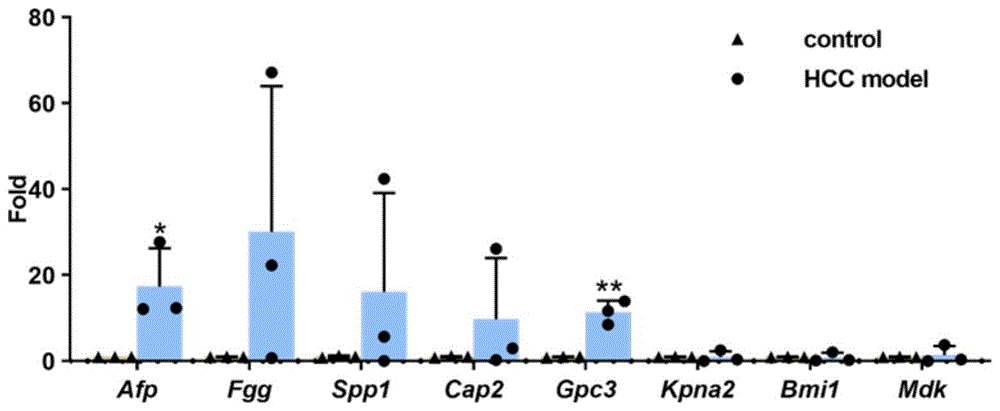
本实施例选择了小鼠的Afp,Fgg,Spp1,Cap2,Gpc3,Kpna2,Bmi1,Mdk基因作为候选基因,它们分别编码:甲胎蛋白(Afp)、纤维蛋白原(Fgg)、分泌型磷蛋白1(Spp1)、腺苷酸环化酶相关蛋白2(Cap2)、磷脂酰肌醇蛋白聚糖3(Gpc3)、核转运蛋白2(Kpna2)、多梳环指蛋白1(Bmi 1)、肝素结合细胞因子2(Mdk)。以上蛋白都属于肝癌标志物,编码它们的基因都属于肝癌标志基因。当肝癌小鼠模型构建成功时,肝癌小鼠体内的肝癌标志基因流产性转录本的含量理论上应显著高于健康小鼠体内的。
流产性转录本存在于小鼠的血浆、血浆外泌体中,其化学本质为RNA。本实施例在对流产性转录本进行定量检测时,以小鼠的外周血血浆为材料,利用荧光定量PCR(qPCR)来进行相对定量检测。
本实施例通过查找并分析DBTSS及NCBI数据库中的数据,获得了Afp,Fgg、Spp1、Cap2、Gpc3、Kpna2、Bmi1、Mdk八个在小鼠中具有肝癌标志性的基因的转录起始位点及附近的序列,在其中确定了将在转录后产生流产性转录本的8nt长度的DNA碱基序列(目标序列)。使用软件Pr imer Express3.0,参考专利文献CN 111500676 A中将寡聚核苷酸逆转录成cDNA的方法,根据目标序列设计并合成了单链DNA(A链),其中目标序列位于A链的中间部分。根据A链中目标序列的下游和上游的序列,设计合成了两条辅助RNA,即B链和C链。B链和C链的两端分别与A链的两端形成碱基互补配对,且B链的3’端含有单羟基,C链的5’端含有单磷酸基团。
如图1所示,将A链、B链、C链及目标序列转录成的流产性转录本(D链)置于同一T4DNA连接酶连接反应体系中,在T4 DNA连接酶的催化下,B、C、D链将连接成一条完整的RNA链(E链),E链与A链碱基互补配对。紧接着使用DNA酶Ⅰ(无RNA酶)消化A链,仅保留E链。以E链为模板,进一步设计并合成了TaqMan-MGB探针序列。该探针在上海生工公司合成并修饰(5’-FAM;3’-MGB),可用于qPCR相对定量检测对应基因的流产性转录本。
根据E链的序列设计了特异性引物(SPR),SPR和E链之间可形成碱基互补配对,可用于对E链进行逆转录,得到编码E链的cDNA。
上述八个基因的流产性转录本及作为内参的Gapdh基因的流产性转录本逆转录时需要的A~D链及SPR,qPCR时需要的TaqMan-MGB探针的碱基序列如表1,其中B链、C链及特异性引物SPR为所有基因的流产性转录本逆转录时所通用:
表1各基因流产性转录本、A链及TaqMan-MGB探针序列(5’→3’)
B链(SEQ ID NO.1)序列:5’-UCACCACUACGCUCACGGCACGAACGCUAUUCCAG-3’
C链(SEQ ID NO.2)序列:5’-AUAGGAAGGGAGUGGGCUCACGACCAUGGAUUGGA-3’
特异性引物SPR(反转录引物)序列(SEQ ID NO.3):5’-TCCAATCCATGGTCG-3’
Gapdh的8nt流产性转录本(Gapdh 8nt AT)在小鼠体内含量相对稳定,将其作为内参,使用qPCR法测量肝癌小鼠模型中上述8个基因流产性转录本的相对含量,并与健康小鼠体内的相应流产性转录本相对含量进行比较,发现了含量存在显著性差异的流产性转录本,此即为用于筛选肝癌小鼠的寡聚核苷酸标志物。
1.小鼠体内small RNA提取
本实施例中使用SPF级C57BL/6J雄鼠6只,8周龄,体重(23+2)g,使用Hepa1-6细胞对其中3只小鼠肝脏进行原位注射诱导肝癌,另外3只留作对照组,与诱导肝癌组在相同且适宜的条件下饲养。在注射诱导肝癌之日起3周后用摘眼球取血的方式获取健康小鼠与肝癌小鼠模型的外周血样品。使用离心柱方法提取并分离出其中的small RNA。使用到的试剂如表2:
表2提取小鼠small RNA所需试剂
具体操作步骤为:
(1)取新鲜小鼠血清0.25mL,向其中加入0.75mL裂解液RZ,充分振荡混匀,室温放置8~10分钟;
(2)4℃,12000rpm(约13400g)条件下离心5分钟,取上清,转入一个新的无RNA酶的离心管中;
(3)加入150μL抽提液(苯酚:氯仿:异戊醇=25:24:1),盖好管盖,剧烈振荡(握住管上下剧烈摇晃,或旋涡震荡)15~30秒,室温静置2分钟;
(4)4℃,12000rpm(约13400g)离心10分钟,离心后样品将会分成三层:黄色的有机相、中间层和无色的水相,RNA主要在水相中,水相的体积约为所用裂解液RZ试剂的一半;把水相转移到一个新的无RNA酶的离心管中,得到转移液;
(5)用移液器准确量取400μL步骤(4)中得到的转移液,缓慢向转移液中加入268μL预冷的无水乙醇,用移液器吹打混匀(此时可能会出现沉淀);
(6)将步骤(5)得到的溶液和沉淀一起转入吸附柱CR3(RNAsimple Total RNAKit,货号DP419)中,室温条件下12000rpm(约13400g)离心30秒,若一次不能将步骤(5)得到的全部溶液和沉淀转入吸附柱CR3中,可分两次转入,离心后弃掉吸附柱CR3,保留流出液;
(7)量取650μL步骤(6)中得到的流出液,向其中加入65μL的3M乙酸钠(pH 5.2)溶液,混合均匀;
(8)向步骤(7)得到的溶液中加入6.5μL乙醇沉淀共沉剂(宝日医,货号9094),混合均匀;
(9)向步骤(8)得到的溶液中加入其体积2.5倍的无水乙醇,充分混匀,-80℃静置24小时;
(10)4℃,15000g离心30~60分钟,弃上清;
(11)使用-20℃预冷的80%乙醇洗涤沉淀1次,80%乙醇是由无水乙醇和无酶水按照体积比为4:1配制而成,瞬时离心后弃去上清,如此反复3次;
(12)在超净台内室温干燥5分钟左右,也可使用移液枪将未被去除的液体吸干;
(13)加入30~50μL无酶水溶解沉淀,即可得到小鼠血清中的small RNA。
2.流产性转录本的逆转录及qPCR检测
使用如表3中的试剂及上述A~C链、特异性引物SPR对上述步骤提取到的小鼠small RNA中的流产性转录本进行逆转录及qPCR检测:
表3逆转录所需试剂
操作步骤如下:
(1)取15ng(约1pmol)提取的small RNA样品于无酶管中,加入1μL热敏小牛肠碱性磷酸酶(即1U)和2μL 10×CutSmart buffer混匀;
(2)用无酶水将反应体系补齐至20μL,于PCR仪中37℃反应10min,结束后80℃加热2min,使热敏小牛肠碱性磷酸酶彻底失活,以便产物直接加入下一步反应体系中。
(3)取1μL RNA 5’多磷酸酶与2μL 10×react ion buffer于无酶管中混匀;
(4)加入0.5μL RNA酶抑制剂后,取16.5μL步骤(2)的反应产物补齐反应体系至20μL,吹打混匀;
(5)置于PCR仪中37℃反应20min,反应结束后加热至65℃,20min,使RNA 5’多磷酸酶失活。
(6)取新的0.2mL无酶管,加入A、B、C链各1μL,T4 DNA连接酶缓冲液2μL,加入步骤(5)的反应产物15μL,混匀,于PCR仪中梯度杂交至25℃保持10min后取出,加入1μL T4 DNA连接酶混匀,于PCR仪中45℃连接反应过夜;
(7)在新管中加入2μL DNA酶Ⅰ缓冲液,0.2mL DNA酶Ⅰ,17.8μL上一步的连接反应产物,于37℃反应30min;
(8)反应结束后,取16μL反应产物与2μL DSN buffer、2μL DSN酶在新管中混匀,65℃反应30min;
(9)反应结束后取出,用20μL无酶水定容至40μL后加入等体积的核酸抽提液混匀。室温,12000rpm离心5min,取上清30μL;
(10)加入3μL的3M乙酸钠(pH 5.2)溶液到核酸样品中,均匀混合;
(11)加入0.33μL核酸乙醇沉淀共沉剂混匀;
(12)加入83.25μL的-20℃预冷无水乙醇,用移液枪充分混匀;
(13)在-80℃冰箱中静置沉淀过夜后于次日取出,4℃,15000rpm,离心30min,弃上清;
(14)加入8.6μL无酶水溶解沉淀,得到RNA抽提纯化液;
(15)取特异性引物SPR(SEQ ID NO.6,100μM)0.4μL加入上述RNA抽提纯化液中,反应体系9μL;设置PCR仪退火杂交程序:60℃,1min;55℃,1min;50℃,1min;45℃,1min。反应完成后置于冰上,补充反应体系至20μL,体系如表4:
表4逆转录反应体系
(16)设置PCR仪程序为42℃,15min;85℃,5s,逆转录反应结束后得到的产物为cDNA;
(17)以步骤(16)中得到的cDNA为模板,进行qPCR反应,qPCR反应体系如表5所示:
表5荧光定量PCR反应体系
其中使用到的上游引物F1和下游引物R1的序列分别为:
上游引物F1(SEQ ID NO.11):5’-TCACCACTACGCTCACGGC-3’;
下游引物R1(SEQ ID NO.12):5’-TCCAATCCATGGTCGTGAG-3’。
上述荧光定量PCR反应后,可测得各个样品中流产性转录本的Cq值。Cq值是指荧光信号大于荧光阈值时的PCR循环数。Cq值越大,说明样品中流产性转录本含量越高。
3.检测结果
本实施例中对对照组的3只健康小鼠和构建的3只肝癌小鼠模型血清中的有关基因的流产性转录本的Cq值进行了测定,并将检测到的Cq值用相对定量公式2
表6相对定量计算结果
使用Graphpad Prism软件对检测结果进行分析,如图2所示,正常小鼠与肝癌小鼠模型中Afp和Gpc3基因的8nt流产性转录本的相对含量存在显著差异(P<0.05),说明Afp和Gpc3基因的8nt流产性转录本可以作为小鼠外周血中肝癌检测的寡聚核苷酸标志物。二者逆转录出的cDNA序列分别为:
Afp cDNA序列(SEQ ID NO.13):5’-TGGGATGT-3’;
Gpc3 cDNA序列(SEQ ID NO.14):5’-AGCTACCT-3’。
在实际应用中,为了判断某一待测小鼠是否为肝癌小鼠,可用qPCR法测量其体内Afp基因和Gpc3基因的8nt流产性转录本相对含量,当这两种流产性转录本中至少一种的含量高于某个阈值时,则认为该待测小鼠极为可能是肝癌小鼠。由肝癌小鼠的Gpc3基因相对定量结果可知,这一阈值最低为8左右。在对肝癌小鼠进行鉴定时,可以此作为参考阈值。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本专利申请权利要求的保护范围之中。
- 一种用于区别肝癌和非肝癌的肠道微生物基因标志物及其应用
- 一种发现和鉴定肝癌血清差异表达蛋白和验证标志物蛋白方法
- 用于肝癌患者预后或肝癌病理分期的标志物
