一种检测成纤维细胞活化蛋白的生物发光探针、及其制备方法和应用
文献发布时间:2023-06-19 11:16:08
技术领域
本发明属于有机合成及分析检测领域,具体涉及一种检测成纤维细胞活化蛋白的生物发光探针、及其制备方法和应用。
背景技术
成纤维细胞活化蛋白(Fibroblast activation protein,FAP)主要存在于肿瘤相关成纤维细胞、间充质细胞和肿瘤细胞表面,是II型跨膜丝氨酸蛋白酶家族的一员,具有二肽肽酶和胶原酶活性。FAP在多种癌症中高度上调,表达于90%以上的上皮恶性肿瘤,通常作为促肿瘤基质生长的标志物。
肿瘤生长环境中存在着大量肿瘤因子,这些肿瘤因子可以诱导FAP上调,上调的FAP可以激活生长因子,促进血管生成、肿瘤生长及浸润;同时,由于FAP具有胶原酶活性,可以水解细胞外基质(Extracellular Matrix,ECM)中的胶原,从而破坏ECM,促进肿瘤的侵袭和转移。综上所述,FAP可以直接促进肿瘤细胞的增殖、迁移和侵袭;与FAP高表达细胞共培养也能促进肿瘤、内皮细胞和免疫细胞的增殖、活化和侵袭。
目前检测成纤维细胞活化蛋白的方法,主要包括酶联免疫吸附法、免疫荧光法、免疫组化法和小分子探针技术。其中,小分子探针技术具有高灵敏度、无损快速分析和实时监测等优势,可实现FAP的可视化、原位检测。
生物发光成像(Bioluminescence imaging)是生物体内一种由化学反应产生的特殊可见发光现象,主要是指在酶的催化作用下生物能转变成光能的过程,而该过程不依赖于有机体对光的吸收。最常见的生物发光体系是萤火虫萤光素酶-萤光素体系,其发光原理是萤光素在O
如何高选择性识别FAP,是该类探针开发的技术难点。DPP IV是FAP的同工酶,具有50%的同源性,是检测FAP过程中影响最大的干扰物之一。Li报道的探针Probe 1与相同浓度的FAP和DPP IV孵育后,两者产生的生物发光信号仅相差1个数量级。因此,检测FAP探针的选择性还需要进一步提高,迫切需要开发出具有高选择性、高信噪比、高灵敏度的FAP可视化检测方法。
发明内容
本发明的目的是在现有技术的基础上,提供一种用于检测成纤维细胞活化蛋白的生物发光探针,该探针能够定量的检测成纤维细胞活化蛋白,检测限可达18.1pg/mL,表明该探针具有较高的检测灵敏度,并且对FAP具有较高的选择性。
本发明的另一目的是提供一种上述生物发光探针制备方法。
本发明的又一发明目的是提供上述生物发光探针在成纤维细胞活化蛋白检测中的应用。
本发明的技术方案如下:
一种生物发光探针,其探针的结构式如下所示:
本发明基于萤光素酶-萤光素生物发光成像的原理,以N-[乙酰基]甘氨酰-L-脯氨酸(Boc-Gly-Pro-OH)作为成纤维细胞活化蛋白的识别基团,以萤光素作为萤光素酶的识别底物(在D-氨基萤光素的6位氨基上通过酰胺键连接FAP的识别基团),构建得到识别成纤维细胞活化蛋白的探针BL-FAP。此外,成纤维细胞活化蛋白(FAP)还具有脯氨酰内肽酶的作用:FAP可以水解多肽链内部氨基末端第二个氨基酸为脯氨酸的寡肽。基于FAP的这种酶促反应特征,通过构建N-[乙酰基]甘氨酰-L-脯氨酸作为FAP识别基团,从而实现生物发光探针BL-FAP对FAP的特异性识别。
成纤维细胞活化蛋白生物发光探针BL-FAP的识别原理为:D-氨基萤光素的6位氨基被N-[乙酰基]甘氨酰-L-脯氨酸保护后,D-氨基萤光素无法被萤光素酶识别,无法进行酶促反应,不能产生生物发光;当探针BL-FAP与FAP反应后,由于FAP的脯氨酰内肽酶特性,脯氨酸与D-氨基萤光素之间的酰胺键断裂,发生水解内切反应,释放出D-氨基萤光素,进而被萤光素酶识别发生酶促反应,产生生物发光。为了验证探针BL-FAP与FAP的反应机理,BL-FAP与FAP的Tris-HCl缓冲液于37℃下反应120min,产生了黄绿色萤光物质,将其提取分离,通过HRMS证实BL-FAP与FAP反应生成的黄绿色萤光物质是D-氨基萤光素。
识别FAP的生物发光探针BL-FAP可以由如下方法制备,包括:
进一步识别FAP的生物发光探针BL-FAP,包括以下步骤:
第一步:在HATU和DIPEA存在的条件下,化合物I与化合物Boc-Gly-Pro-OH进行化学反应,制备化合物BL-NH
第二步:化合物BL-NH
第三步:在碳酸钾存在的条件下,化合物BL-NH
更进一步详细的制备方法如下:以2-氰基-6-氨基苯并噻唑(化合物Ⅰ)和N-[叔丁氧羰基]甘氨酰-L-脯氨酸(化合物Boc-Gly-Pro-OH)为起始原料,在DIPEA和HATU的作用下进行缩合,得到化合物BL-NH
在一种优选方案中,在第一步中,化合物I、化合物Boc-Gly-Pro-OH、HATU和DIPEA的摩尔比为1:1~2:1.5~2.5:1.5~2.5,化合物I、化合物Boc-Gly-Pro-OH、HATU和DIPEA的摩尔比可以但不局限于1:1.5:2:2。
进一步地,在第一步中,反应的温度为0~40℃,可以但不局限于0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃。
在一种更优选方案中,在第一步中,将化合物Boc-Gly-Pro-OH、HATU和DIPEA溶于无水二氯甲烷中,再滴加含化合物I的无水二氯甲烷溶液,于0~40℃进行化学反应,制备化合物BL-NH
对于本发明而言,在第二步中,化合物BL-NH
进一步地,化合物BL-NH
进一步地,在第二步中,反应的温度为10~40℃,可以但不局限于10℃、15℃、20℃、25℃、30℃、35℃或40℃。
在一种更优选方案中,在第二步中,化合物BL-NH
本发明在第三步中,化合物BL-NH
本发明制备的生物发光探针BL-FAP可以作为检测成纤维细胞活化蛋白的应用,特别在肿瘤细胞和组织内作为检测成纤维细胞活化蛋白的应用。
采用本发明的技术方案,优势如下:
本发明提供的识别FAP的生物发光探针BL-FAP,与已报道探针相比,具有选择性好、灵敏度(18.1pg/mL)高、信噪比高(15558倍)及良好生物相容性的优点。
在Tris-HCl缓冲液中,生物发光强度与成纤维细胞活化蛋白浓度(0-0.2mg/mL)呈现良好的线性关系,说明探针适合定量检测成纤维细胞活化蛋白;探针BL-FAP能够检测MGC-803-luc细胞表达的FAP;进一步成功应用该探针检测到了裸鼠移植瘤模型中肿瘤组织内的FAP水平。
采用本发明提供的探针BL-FAP,可以检测健康成人、胃部良性病变和胃癌患者血浆中FAP酶活水平,初步提示胃癌患者血浆中FAP的酶活水平显著高于健康成人和胃部良性病变患者。
附图说明
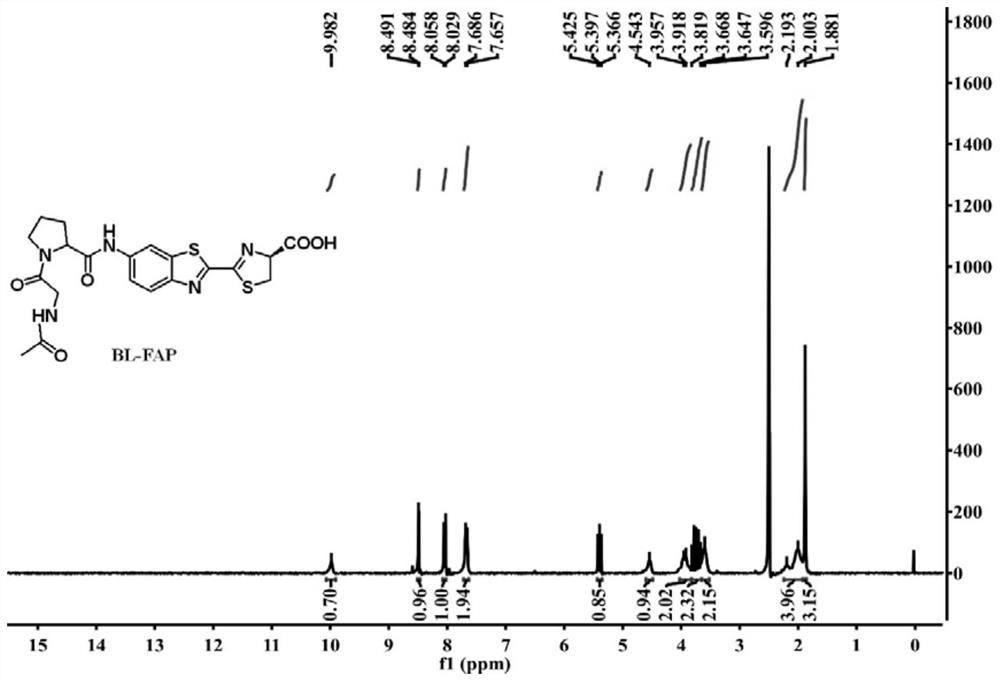
图1是生物发光探针BL-FAP的
图2是生物发光探针BL-FAP的
图3是生物发光探针BL-FAP的HRMS图谱,HRMS(ESI
图4是BL-FAP与FAP反应产物D-氨基萤光素的HRMS,HRMS(ESI
图5是BL-FAP对FAP的生物发光响应;(A)BL-FAP(2μM)与FAP(0,0.02,0.04,0.06,0.08,0.1,0.2,0.3,0.4,0.5μg/mL)在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl2=10mM)中37℃孵育120min,再加入ATP(2mM,50μL)和Luciferase(0.1mg/mL,3μL),测量相对生物发光强度;(B)定量表示图A中BL-FAP与FAP(0-0.5μg/mL)孵育后,产生生物发光信号的总光子通量(p/sec/cm
图6是BL-FAP对FAP的反应时间;(A)BL-FAP(2μM)与FAP(0.3μg/mL)在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl
图7是BL-FAP对FAP的选择性:(A)1.Blank;2.0.1μg/mL FAP;3.0.2μg/mL FAP;4.0.3μg/mL FAP;5.1mM KCl;6.1mM CaCl
图8是BL-FAP对FAP的选择性;(A)1.Blank;2.0.1μg/mL FAP;3.0.2μg/mL FAP;4.0.3μg/mL FAP;5.100μM Cys;6.1mM Cys 7.1mM Arg;8.1mM Trp;9.1mM Lys;10.1mMThr;11.1mM His;12.1mM Phe;13.10μg/mL Trypsin;14.1μg/mL Prolidase;15.1μg/mLLAP;16.10μg/mL Esterase;17.0.3μg/mL DPP IV;(B)定量表示图A中BL-FAP与不同干扰物孵育后,产生生物发光信号的总光子通量(p/sec/cm2/sr);数据以mean±SD表示(n=3);
图9是BL-FAP酶催化反应的Lineweaver-Burk图,BL-FAP的浓度分别为2.5,5,10,20,30,40μM,FAP的浓度为0.06μg/mL,孵育时间120min;米氏方程描述为:V=Vm[BL-FAP]/(Km+[BL-FAP]),其中V是反应速率,[BL-FAP]是探针浓度(底物),Km是米氏常数;线性拟合相关系数R
图10是分子对接得到的三个探针分子与靶标蛋白FAP的结合模式图;(A)三个探针与FAP结合的整体图;(B-D)探针BL-FAP(绿色)、Probe 1(青色)和Probe 2(蓝色)分别与FAP的结合模式图;探针分子以stick模型显示,蛋白FAP以蓝色cartoon模型显示.FAP活性位点区域与探针分子发生强相互作用的氨基酸残基以黄色stick模型显示;氢键相互作用以红色虚线显示;
图11是分子对接得到的三个探针分子与靶标蛋白DPP IV的结合模式图;(A)三个探针与DPP IV结合的整体图;(B-D)探针BL-FAP(绿色)、Probe 1(青色)和Probe 2(蓝色)分别与DPP IV的结合模式图;探针分子以stick模型显示,蛋白FAP以灰色cartoon模型显示;FAP活性位点区域与探针分子发生强相互作用的氨基酸残基以黄色stick模型显示;氢键相互作用以红色虚线显示;
图12是MGC-803-luc细胞与BL-FAP(0,2,5,10,20,50,100μM)孵育24h后细胞的存活率;数据以mean±SD表示(n=3);
图13是MGC-803-luc细胞与2μM的BL-FAP分别孵育0,6,12,18,24h后细胞的存活率;数据以mean±SD表示(n=3);
图14是活细胞内FAP的生物发光成像;(A)MGC-803-luc细胞与PT-100(0,5,10μM)孵育1.5h后,再与BL-FAP(2μM)孵育50min;(B)定量表示图A中BL-FAP在不同浓度PT-100预孵育下,产生生物发光信号的总光子通量(p/sec/cm2/sr);数据以mean±SD表示(n=3).***p<0.0001vs 0μM;***p<0.0001vs 0μM;
图15是不同孵育时间细胞内FAP的生物发光成像;(A)MGC-803-luc细胞与BL-FAP(2μM)分别孵育0,10,20,30,40,50,60,70,80,90min后,进行生物发光成像;(B)定量表示图A中产生生物发光信号的总光子通量(p/sec/cm
图16是肿瘤组织内FAP的生物发光检测;裸鼠尾静脉注射生理盐水(100μLsaline,1%DMSO)作为第一组对照;第二组瘤内注射50μL生理盐水,1h后,尾静脉注射BL-FAP(4mM,100μL saline,1%DMSO);第三组瘤内注射抑制剂PT-100(100μM,50μL saline),1h后,尾静脉注射BL-FAP(4mM,100μL saline,1%DMSO).之后进行0-100min生物发光成像;
图17是定量表示图16中各组裸鼠肿瘤组织内产生生物发光信号的总光子通量(p/sec/cm
图18是BL-FAP测定健康人、胃部良性病变和胃癌患者血浆中FAP的酶活水平。
具体实施方式
通过以下实施例并结合附图对本发明的识别FAP的生物发光探针作进一步的说明,但这些实施例不对本发明构成任何限制。
一、实施方法
1、材料与仪器
1.1试剂
2-氰基-6-氨基苯并噻唑 盐城希曼生物技术有限公司
N-[叔丁氧羰基]甘氨酰-L-脯氨酸 萨恩化学技术(上海)有限公司
N,N-二异丙基乙胺(DIPEA) 成都格雷西亚化学技术有限公司
三氟乙酸(TFA) 上海阿拉丁试剂有限公司
乙酸酐(Ac
吡啶 成都西亚化工股份有限公司
碳酸钾 国药集团化学试剂有限公司
盐酸 国药集团化学试剂有限公司
重组人成纤维细胞活化蛋白(FAP) 美国Sigma-Aldrich公司
三羟甲基氨基甲烷(Tris) 大连美伦生物技术有限公司
D-氨基虫萤光素 美国AAT Bioquest公司
BCA蛋白浓度检测试剂盒(增强型) 上海碧云天生物技术有限公司
三磷酸腺苷(ATP) 上海将来实业股份有限公司
萤光素酶(Luciferase) 美国普洛麦格(Promega)公司
无水氯化镁(MgCl
谷胱甘肽(GSH) 上海麦克林生化技术有限公司
半胱氨酸(Cys) 上海麦克林生化技术有限公司
酯酶(Esterase) 美国Sigma-Aldrich公司
胰蛋白酶(Trypsin) 上海麦克林生化技术有限公司
脯氨酸二肽酶(PLD) 美国Sigma-Aldrich公司
亮氨酸氨肽酶(LAP) 美国Sigma-Aldrich公司
二肽基肽酶(DPP IV) 美国免疫克隆生物科学(I&C)有限公司
Gibco DMEM高糖培养基 美国Life Technologies公司
Gibco胎牛血清 美国Life Technologies公司
青霉素-链霉素溶液(100×) 上海碧云天生物技术有限公司
胰酶消化液 上海碧云天生物技术有限公司
磷酸盐缓冲液(PBS) 徐州微科曼得生物工程有限公司
GF
200-300目硅胶 青岛海洋化工有限公司
其余试剂都是国产分析纯。
1.2仪器
ECZ-400S核磁共振仪 日本JEOL公司
MTQ III q-TOF高分辨质谱仪 德国Bruker(布鲁克)公司
超净工作台 苏州净化设备有限公司
二氧化碳细胞培养箱 美国Thermo Fisher Scientific公司
WHB TC处理全黑96孔细胞培养板 上海蔚宏生物科技有限公司
Varioskan LUX多功能微孔板读数仪 美国Thermo Fisher Scientific公司
LB983 NightOWL II小动物活体成像仪 德国BERTHOLD公司
SHB-IIIS循环水式多用真空泵 郑州长城科工贸有限公司
RTC basic磁力搅拌器 德国IKA公司
旋转蒸发仪 东京理化器械株式会社
精宏鼓风干燥箱 精宏实验设备有限公司
PHS-25型pH计 上海雷磁仪器有限公司
1.3溶液的配制
(1)BL-FAP储备液的配制:BL-FAP(4.8mg,0.01mmol)溶解于DMSO(10mL)中,得到1.0mM的探针溶液。将储备液稀释成200μM的母液备用。-20℃避光保存。
(2)FAP储备液的配制:重组FAP(10μg,250μg/mL)溶解于Tris-HCl(50mM,pH=7.4,60μL)中,得到100μg/mL的FAP溶液。将储备液稀释成10μg/mL和1.0μg/mL的母液备用。-80℃避光保存。
(3)含1.0mg/mL BSA(人血清白蛋白)的Tris-HCl缓冲液的配制:将10mg BSA溶解于Tris-HCl(50mM,pH=7.4,10mL)中,得到含1.0mg/mL BSA的Tris-HCl缓冲液。4℃保存。
(4)Luciferase(萤光素酶)储备液的配制:Luciferase(1.0mg,13.8mg/mL)溶解于927.5μL含1.0mg/mL BSA的Tris-HCl缓冲液中,得到1.0mg/mL的Luciferase储备液。将储备液稀释成100μg/mL的母液备用。-80℃避光保存。
(5)含MgCl
(6)KCl(氯化钾)储备液的配制:KCl(74.6mg,1mmol)溶解于去离子水(10mL)中,得到100mM的KCl储备液。
(7)Cys(L-半胱氨酸)储备液的配制:Cys(12.1mg,0.1mmol)溶解于去离子水(10mL)中,得到10.0mM的Cys储备液。将储备液稀释成1.0mM和100μM的母液备用。
(8)GSH(谷胱甘肽)储备液的配制:GSH(30.7mg,0.1mmol)溶解于去离子水(10mL)中,得到10.0mM的GSH储备液。将储备液稀释成1.0mM和100μM的母液备用。
(9)LAP(亮氨酸氨肽酶)储备液的配制:LAP(10μL,6.6mg/mL)溶解于超纯水(12μL)中,得到3.0mg/mL的LAP储备液。将储备液稀释成100μg/mL的母液备用。-20℃避光保存。
(10)Esterase(酯酶)储备液的配制:Esterase(6μL,24mg/mL)溶解于超纯水(10μL)中,得到9.0mg/mL的LAP储备液。将储备液稀释成1.0mg/mL的母液备用。-20℃避光保存。
(11)其他生物分析物的储备液,包括CaCl
(12)D-氨基萤光素(D-Aminoluciferin)储备液的配制:D-氨基萤光素(2.8mg,0.01mmol)溶解于DMSO(1.0mL)中,得到10mM的探针溶液备用。将储备液稀释成1.0mM母液备用。-20℃避光保存。
1.4细胞
种属和品系:MGC-803-luc(人胃癌萤光素酶表达细胞株)。来源:上海美轩生物科技有限公司。
1.5实验动物
种属和品系:健康BALB/c Nude裸鼠(雌雄各半,SPF级别),4-5周龄。来源:北京维通利华实验动物技术有限公司。
2.2生物发光探针BL-FAP识别FAP原理
避光条件下,将BL-FAP(终浓度10μM)与FAP(终浓度1μg/mL)在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl
2.3生物发光探针BL-FAP对FAP的检测性能研究
2.3.1溶液配制
测试体系包含有机相和水相,其比例是1:99。其中,有机相包括DMSO作溶剂的BL-FAP探针溶液;水相包括用Tris-HCl缓冲液(50mM,pH=7.4,含MgCl
2.3.2实验过程
将测试体系加入黑色96孔细胞培养板中,摇床37℃孵育120min,再向每个孔加入ATP(2mM,50μL)和Luciferase(100μg/mL,3μL)。以不加入FAP的测试液作为空白对照,用LB983 NightOWL II小动物活体成像仪进行成像。选择生物发光模式,曝光时间15s。采用indiGo软件进行图像和数据分析。每个数据至少平行测定3次,数据以mean±SD表示。
2.4检测限测定
探针BL-FAP的自身生物发光强度(未加入识别物FAP时的生物发光强度)测定10次后,计算10次测定的生物发光强度标准差;再将探针与FAP(0-0.2μg/mL)反应,得到生物发光强度与FAP浓度的线性方程。检测限计算公式为:3σ/k。k代表生物发光强度与FAP浓度的线性方程斜率,σ代表空白样的标准差。
2.5生物发光探针BL-FAP酶促反应动力学测定
2.5.1建立标准曲线
在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl
2.5.2实验过程
在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl
2.5.3米氏方程的计算
根据标准曲线和各个BL-FAP浓度下所测得的荧光值,计算出各自对应的D-Aminoluciferin生成浓度。再根据反应时间120min,计算出反应速率V;
根据这些数据可以做出Linewearver-Burk双倒数图,即横坐标是BL-FAP浓度C的倒数,单位是μM
根据米氏方程V
2.6分子对接
分子对接是通过几何匹配和能量匹配来研究受体分子与配体分子相互识别的过程,可以揭露受体分子与配体分子相互作用模式及结合能力。从蛋白质数据库(ProteinData Bank,PDB)中获得FAP和DPP IV的晶体结构分别为:1z68和4a5a。在准备受体结构时考虑到两个晶体结构都为蛋白的多聚体,只保留两个晶体结构中分别的A链,同时删除所有的水分子。在Sybyl-X2.1中构建三个化合物Probe 1,Probe 2和BL-FAP的3D结构,给化合物分别添加氢原子和Gasteiger-Huckel电荷,同时使用Tripos力场来实现化合物的能量最小化,优化的最大步数为1000。利用Surflex模块进行分子对接研究。分子对接的时候,将2个晶体结构中的催化位点作为对接口袋。其他参数保持默认,利用分子对接打分值来评估化合物与靶标的结合亲和力大小。
2.7细胞培养
MGC-803-luc是从上海美轩生物科技有限公司购买的萤光素酶表达的人胃癌细胞。培养细胞所用培养基是含10%胎牛血清和100μg/mL青霉素-链霉素的DMEM高糖培养基。细胞生长到对数期时,按1:3传代,2-3天传代一次。对数期细胞用胰酶消化,制成5×10
2.8细胞毒性测试
MTT法测定BL-FAP的细胞毒性,采用Huber and Koella方法计算IC
2.9细胞水平生物发光成像
2.9.1活细胞内FAP的生物发光成像
在细胞培养箱内,第一组MGC-803-luc细胞37℃下孵育FAP的特异性抑制剂PT-100(5,10μM)1.5h后,再与BL-FAP(2μM)孵育50min;第二组MGC-803-luc细胞37℃下与BL-FAP(2μM)孵育50min。避光条件下,磷酸盐缓冲液温和的洗三次后,用LB983NightOWL II小动物活体成像仪,选择生物发光模式,曝光时间120s,进行成像。采用indiGo软件进行图像和数据分析。
2.9.2不同孵育时间细胞内FAP的生物发光成像
在细胞培养箱内,将MGC-803-luc细胞与BL-FAP(0.2mM,1μL)分别在37℃下孵育0,10,20,30,40,50,60,70,80,90min。避光条件下,磷酸盐缓冲液温和的洗三次后,用LB983NightOWL II小动物活体成像仪,选择生物发光模式,曝光时间120s,进行成像。采用indiGo软件进行图像和数据分析。
2.10动物饲养
BALB/c Nude裸鼠(雌雄各半),体重20-25g,4-5周龄,购于北京维通利华实验动物技术有限公司。所购裸鼠用来检测MGC-803-luc移植瘤中的FAP。以上所用动物协议由徐州医科大学动物保护与使用委员会批准,进行的动物实验符合中国法律在保护和使用实验动物的规定。BALB/c Nude小鼠饲养在特定的无菌病原体环境中。实验前一周使动物适应实验环境,置于自然昼夜节律光照条件下分笼群养(每笼最多5只),温度(22±2)℃,湿度为50±10%,自由摄食饮水。
2.11裸鼠移植瘤模型的制备
胰酶消化对数期的MGC-803-luc细胞,制成5×10
2.12肿瘤组织内FAP的生物发光检测
活体成像前,BALB/c Nude裸鼠腹腔注射10%水合氯醛(100μL)进行麻醉,之后随机分组进行实验。尾静脉注射生理盐水(100μL saline,1%DMSO)作为第一组对照;第二组瘤内注射50μL生理盐水,1h后,尾静脉注射BL-FAP(4mM,100μL saline,1%DMSO);第三组瘤内注射抑制剂PT-100(100μM,50μL saline),1h后,尾静脉注射BL-FAP(4mM,100μL saline,1%DMSO)。用LB983 NightOWL II小动物活体成像仪,选择生物发光模式,曝光时间60s,进行0-100min成像。采用indiGo软件进行图像和数据分析。
2.13数据处理
数据以均数±标准差(Mean±SD)表示,使用SPSS 16.0软件进行统计分析。多组间比较采用完全随机设计的单因素方差分析(one-way ANOVA)。P<0.05表示差异有统计学意义。
二、实施例
实施例1:
BL-NH
BL-NH2-Ac的制备:在冰浴条件下,将BL-NH2-Boc(100mg,0.23mmol)溶于15mL三氟乙酸和15mL无水二氯甲烷的混合液中,然后将混合物于25℃下反应2h;之后,将得到的反应液用10%NaHCO
BL-FAP的制备:将BL-NH
三、效果验证
1、生物发光探针BL-FAP对FAP的检测性能研究
1.1 BL-FAP与FAP反应的线性关系及检测限
将BL-FAP(2μM)与不同浓度的FAP(0-0.5μg/mL)孵育,探讨生物发光强度与FAP浓度之间的关系。如图5,随着FAP浓度的增加,生物发光强度逐渐增强,当FAP浓度达到0.3μg/mL时,生物发光强度达到峰值(15558倍)。在Tris-HCl缓冲液中,生物发光强度与FAP(0-0.2μg/mL)浓度范围内呈现良好的线性关系,检测限可达到18.1pg/mL。上述结果说明,探针BL-FAP具有较高的检测灵敏度,可以对生物样本中pg/mL级别的FAP进行定量检测。化合物BL-FAP与FAP反应产物D-氨基萤光素的HRMS图,如图4所示。
1.2 BL-FAP与FAP反应的时间
将BL-FAP(2μM)与FAP(0.3μg/mL)孵育(0-210min),探讨生物发光强度与孵育时间之间的关系。如图6,随着孵育时间的增加,生物发光强度逐渐增强;当孵育时间达到120min时,生物发光强度达到峰值。
1.3 BL-FAP与FAP的选择性研究
将BL-FAP与各种生物活性物质共同孵育,观察生物发光强度。由图7、8可知,在各种金属盐,包括KCl,CaCl
2、BL-FAP的酶促反应动力学性质
不同浓度的BL-FAP与0.06μg/mL的FAP反应后,通过计算所得反应速率值。如图9所示,根据这些数据可以做出Linewearver-Burk双倒数图,获得公式y=549.99x+41.37,R
3、分子对接
利用Surflex分子对接方法得到了两个靶标FAP和DPP IV分别与表1中3个探针化合物的分子对接打分值。分子对接打分值越高,表示化合物与靶标的结合力越大,可能会有较高的活性。一般来说,这个数值大致表征为结合常数pK
表1靶标FAP和DPP IV分别与3个探针化合物的分子对接打分值
3.1三个探针分别于蛋白FAP和DPP IV的相互作用模式
为了更加清晰的阐述清楚三个探针与两个蛋白的相互作用模式,我们对6个复合物体系分别进行了结合模式分析,如图10和图11所示。可知,三个探针分子都可以良好的结合在FAP的活性位点区域(图10A)。从图10B可知,探针分子BL-FAP与靶标FAP可形成6条氢键,即分别与FAP的Asn704的侧链羰基、Ser624的侧链羟基、Tyr625的主链氨基、Tyr541的侧链羟基、Ser548的侧链羟基和Gln539的主链羰基。BL-FAP的末端甲酰基也正好伸入到由Tyr625、Val650、Trp653、Tyr656、Tyr660等疏水性氨基酸构成的疏水口袋中。同时,BL-FAP的芳香双环结构也与Tyr541形成了强的π-π堆积相互作用。与探针BL-FAP相比,探针Probe1和Probe 2均具有比BL-FAP的甲酰基末端更长或更大官能团,导致探针Probe 1虽具有与BL-FAP类似的氢键相互作用,但其末端的苯环结构片段无法伸入到由Tyr625、Val650、Trp653、Tyr656、Tyr660等疏水性氨基酸构成的疏水口袋中(图10C);也导致探针分子Probe2虽占据了以上的疏水口袋,但无法与靶标FAP形成较多较稳定的氢键相互作用(图10D)。因此,相比其他两个探针分子,探针BL-FAP可与靶标FAP形成较多的氢键和较强的疏水相互作用。
三个探针分子都可以结合在DPP IV的活性位点区域(图11A)。从图11B可知,探针分子BL-FAP与蛋白DPP IV也形成6条氢键,但该探针分子的末端甲酰基无法与其周围极性较强的多个氨基酸形成稳定的(疏水)相互作用,这也与该探针具有较弱的DPP IV结合强度的实验结果相吻合。同样的,相比探针BL-FAP,探针Probe 1(图11C)和Probe2(图11D)也与DPP IV间的氢键数量较少,表现出较弱的相互作用力。这2个探针分子末端均具有疏水性更强的取代基,也无法与周围较为极性的环境良好匹配,从而导致这2个探针分子与DPP IV发生相互作用时,末端的疏水性部分发生明显偏转。
可见,探针分子BL-FAP与靶标FAP的结合亲和力较高,而与DPP IV结合较弱。因此,探针分子BL-FAP有良好的靶标选择性,且选择性方面均优于其他两个已报道的探针Probe1和Probe 2。
4、细胞毒性测试
在进行细胞和活体动物成像前,首先进行了BL-FAP的细胞毒性测试研究。采用的是MTT比色法,如图12所示,MGC-803-luc细胞与BL-FAP(0,2,5,10,20,50,100μM)孵育24h后,当BL-FAP的浓度低于20μM时,细胞的存活率在90%以上;另外,如图13所示,MGC-803-luc细胞与2μM的BL-FAP分别孵育0,6,12,18,24h后,细胞存活率接近100%。该实验结果初步说明,2μM的BL-FAP不会影响细胞的正常形态和活力,对细胞几乎没有毒性。
5、细胞水平生物发光成像
5.1细胞内FAP的生物发光成像
在对BL-FAP的体外检测分析中显示,该探针具有较高的响应倍数、良好的选择性和检测灵敏度,提示可能是检测活细胞中FAP的理想工具。人胃癌细胞(MGC-803细胞)中的FAP高表达,本发明选取人胃癌细胞进行一系列实验。MGC-803-luc是萤光素酶表达的人胃癌细胞。本发明继续考察了BL-FAP能否在活MGC-803-luc细胞中进行FAP的检测。第一组MGC-803-luc细胞37℃下孵育FAP的特异性抑制剂PT-100(5,10μM)1.5h后,再与BL-FAP(2μM)孵育50min;第二组MGC-803-luc细胞37℃下与BL-FAP(2μM)孵育50min。避光条件下,用37℃的PBS清洗三遍后,每孔加入100μL的PBS,用小动物活体成像系统进行生物发光成像。如图14所示,只孵育BL-FAP的细胞,发出了比较强烈的生物发光信号,提示该信号可能是探针识别细胞内FAP引起的;而当细胞预孵育FAP的特异性抑制剂PT-100后,生物发光信号明显降低,并且随着预孵育抑制剂浓度的增加,生物发光信号越低。由此可见,生物发光信号是由BL-FAP识别细胞内FAP引起的。
5.2不同孵育时间细胞内FAP的生物发光成像
此外,本发明也进行了不同孵育时间对细胞内FAP生物发光成像影响的探索。如图15A所示,随着孵育时间的增加,生物发光信号也逐渐增加,50min时,生物发光强度达到顶峰,响应倍数是195618倍(图15B)。
由此可知,BL-FAP能够实现活细胞中FAP的特异性、高灵敏成像,是检测活细胞中FAP的理想工具。
6、活体水平生物发光成像
基于BL-FAP在体外检测和活细胞成像中表现出的优良性能,能够高灵敏、特异性实现FAP的有效检测,本发明推测该探针也适用于活体动物肿瘤组织内FAP的成像研究。于是,本发明进行了MGC-803-luc细胞的裸鼠移植瘤模型构建,当肿瘤体积长至300mm
由此可知,BL-FAP能够实现活体水平中FAP的生物发光成像,可以作为体内检测肿瘤组织内FAP水平的有效工具。
实施例2:生物发光探针BL-FAP用于人血浆中FAP的定量检测
1实验方法
1.1纳入标准
1.1.1胃癌组:术前经胃镜活检病理及术后病理检查为胃癌患者;具有详细完整的临床病理资料和手术记录的患者。
1.1.2良性病变组:经胃镜检查及病灶组织活检病理证实为胃良性病变,包括胃炎、胃息肉、胃溃疡患者;具有详细完整的临床病理资料的患者。
1.1.3健康对照组:体检查体为健康的人群;与胃癌组性别、年龄相匹配。
1.2排除标准
术后病理诊断为非胃癌的患者;接受化、放疗和免疫治疗的患者;合并肝、肾、心功能不全的患者;严重感染患者;合并其他系统肿瘤患者;合并妊娠、糖尿病等代谢性疾病患者;长期服用皮质类固醇和非甾体类抗炎药物的患者;没有详细完整病理数据的患者。
试验得到了徐州医科大学附属医院伦理委员会的批准。伦理审查批件号:XYFY2020-KL059-01。
1.3建立标准曲线
在Tris-HCl缓冲液(50mM,pH=7.4,1%DMSO,MgCl
1.4实验步骤
1.4.1收集徐州医科大学附属医院以往保存的血浆样本。
1.4.2用BCA工作液对样品进行总蛋白测定,设值为A,单位mg protein/mL。
1.4.3避光条件下,将探针BL-FAP(0.2mM,1μL)与99μL的血浆在37℃孵育120min,孵育体积是100μL。之后,再加入ATP(2mM,50μL)和Luciferase(0.1mg/mL,3μL),用Varioskan LUX多功能微孔板读数仪测其相对生物发光单位RLU。根据以上绘制的标准曲线,计算出生成D-Aminoluciferin浓度,设值为B,单位nM。
1.4.4计算酶催化速率:
B÷A÷120=C,单位fmol/min/mg protein
1.5数据处理
数据以均数±标准差(Mean±SD)表示,使用SPSS 16.0软件进行统计分析。多组间比较采用完全随机设计的单因素方差分析(one-way ANOVA)。P<0.05表示差异有统计学意义。
2结果与讨论
2.1临床样本的选取
收集血浆样本60例,其中健康对照组20例,胃部良性病变组20例,胃癌组20例。样本基本信息及胃癌主要肿瘤标志物指标信息如表2。
表2临床样本基本信息(Mean±SD)
注:采用SPSS 16.0软件进行one-way ANOVA分析,*p<0.05vs健康对照组;*p<0.05vs胃部良性病变组。
如图18所示,通过应用探针BL-FAP测定健康人(n=20)、胃部良性病变(n=20)和胃癌患者(n=20)血浆中的FAP活性水平,其中健康人、胃部良性病变和胃癌患者血浆中FAP活性水平平均值分别为0.2290±0.06、10.45±2.64和28.89±8.06fmol/min/mg protein。结果表明,健康人血浆中FAP活性水平较低,几乎为零;与健康对照组相比,胃癌组血浆中FAP的酶活水平显著升高(***p<0.0001),与胃部良性病变组相比,胃癌组血浆中FAP的酶活水平显著升高(***p<0.0001)。上述结果说明:(1)探针BL-FAP可以定量检测人血浆中FAP酶活水平;(2)该结果初步提示了胃癌患者血浆中FAP酶活水平显著增加,初步提示FAP可能是胃癌的潜在标志物。这对开发胃癌早期诊断、治疗和预后的标志物具有重要意义。
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可能对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 一种检测成纤维细胞活化蛋白的生物发光探针、及其制备方法和应用
- 一种经改造的萤光素酶突变体蛋白、生物发光探针、探针组、制备方法和检测方法
