减少表达基于NKG2D的受体的免疫细胞的杀伤剂
文献发布时间:2023-06-19 09:30:39
技术领域
本发明涉及免疫疗法领域,更具体地涉及用于过继细胞疗法的细胞的制造。本文提供在这种细胞,特别是表达NKG2D受体细胞的细胞的生产过程中预防和/或减少杀伤剂的方法。还提供了细胞和包含预防和/或减少杀伤剂的细胞的组合物。
背景技术
我们对免疫系统的了解的改善导致了许多针对免疫的疗法的发展,这些疗法目前正在为晚期癌症患者提供客观的临床反应。这些方法之一是嵌合抗原受体(CAR)T细胞,其中患者的T细胞经过基因修饰以表达靶向 CAR的肿瘤,然后大量返还给患者(1)。这种过继性细胞疗法通过对血液系统恶性肿瘤患者的客观临床反应已经达到了一定水平的验证,并且正在进一步探索以治疗更广泛的癌症适应症(2-7)。CAR的概念也已超越T细胞,人们正在探索包括自然杀伤细胞在内的多种细胞类型(8)。
CAR是模块化蛋白质受体,其由连接至结构域的靶结合域组成,所述结构域通常包括细胞外间隔域和与细胞内信号传导域融合的跨膜区。配体结合后,从CAR引发的下游信号传导会激活T细胞的效应子功能,从而驱动直接的肿瘤细胞杀伤和免疫细胞因子的产生。
CAR T生产的一个常见问题是自我杀灭(或自相残杀)。当CAR靶标在T细胞群体上表达时,会发生这种现象。众所周知,T细胞杀伤剂是维持T细胞动态平衡的一种机制(13)。但是,在治疗方面,T细胞杀伤剂阻止了产生用于临床应用的所需CAR T细胞群体的能力。在针对T细胞谱系特异性选择靶标本身(例如CD7(14)或CD5(15))以实现T细胞白血病靶向的情况下,这尤其相关。但是,问题不仅仅限于CAR T细胞疗法。对靶蛋白(BIRC5)具有特异性的T细胞受体具有高亲和力TCR的T细胞由于靶抗原的表达而遭受杀伤(16,17)。同样,表达NK受体配体的NK细胞也显示出患有杀伤症(24)。
总之,借助于人工细胞表面嵌合抗原受体(CAR)构建体以预定的靶特异性赋予免疫细胞(例如T或NK细胞)提供了一种假定地靶向任何肿瘤细胞的方法。该方法的成功在很大程度上取决于靶抗原本身的概况,其中大多数已知的肿瘤抗原对肿瘤不是特异性的,但可能在非肿瘤细胞上表达。在某些情况下,靶抗原可以在免疫细胞上组成性或瞬时表达,这意味着CAR修饰的细胞可以进行自杀或杀伤。
在这里,重点是针对对天然杀伤组2D(NKG2D)蛋白靶向的应激配体进行特异性改造的CAR T细胞。全长NKG2D序列与CD3ζ的胞质结构域融合产生了一个CAR构建体,该结构在配体被NKG2D细胞外结构域结合后导致CD3ζ结构域激活T细胞(18)。NKG2D具有八个已知的配体,包括主要的组织相容性复合物I类相关的A和B基因(分别为MICA和 MICB)和UL16结合蛋白(ULBP)家族(ULBP1-6)(19)。已知这些NKG2D 配体的表达是在“应激”条件下诱导的,例如细胞损伤、感染、氧化或热应激或恶性转化,导致表达NKG2D配体的各种人类肿瘤突显了NKG2D作为在 CAR环境中要利用的受体的吸引力(19,20)。确实,带有小鼠NKG2D CAR 的小鼠T细胞在同基因模型系统中有效根除了一系列已建立的血液学和实体瘤,证明了该方法的概念性证明(18)。
带有人NKG2D CAR的人T细胞(也称为NKR-2)在体外可发挥效应细胞对多种肿瘤细胞的功能,并可在NSG小鼠模型中挑战已建立的人肿瘤 (21)。然而,事实证明,NKR-2细胞产量的增加以产生更高的细胞数量以用于临床应用,由于被激活的T细胞瞬时表达NKG2D配体而被确定为原因的T细胞杀伤剂被证明存在很大问题。
因此,由NKG2D蛋白与CD3ζ(NKR-2)融合体组成的CAR使T细胞对NKG2D配体具有广泛的特异性。然而,T细胞在活化过程中瞬时表达这些配体,因此,NKR-2 T细胞遭受杀伤,从而大大阻碍了利用NKG2D 作为疗法的能力。此外,为了在临床中使用疗法,需要大量的升级和冷冻保存以递送所需的给药时间表。众所周知,冷冻保存和冻融循环会对细胞产生压力,从而导致压力诱导蛋白(如NKG2D配体)的表达增加。实际上已经观察到,表达嵌合的NKG2D受体的T细胞的按比例放大和冷冻保存均导致差的细胞产量,这大概是由于自杀作用或杀伤剂造成的。
因此,预防或减少这些细胞中杀伤剂的产生将是有利的,因为这不仅会增加细胞的产量,而且会降低制造成本并提高这些细胞的治疗功效-简而言之,从实用和商业角度来看,这将使临床应用所需的升级和冷冻保存变得可行。
发明概述
表达NKG2D蛋白与CD3ζ融合的修饰免疫细胞,特别是嵌合抗原受体 (CAR)T细胞(NKG2D-CAR T细胞),对在血液和实体癌中表达的应激诱导配体具有特异性。但是,这些应激配体也可以通过活化的免疫细胞或T 细胞瞬时表达,这意味着基于NKG2D的免疫细胞可能会在细胞制造过程中或输注患者之前的冻融循环中经历自杀(杀伤)。
本发明的一个目的是提供在表达嵌合NKG2D受体的免疫细胞的制造过程中减少和/或预防杀伤剂的方法,包括在细胞制造过程中对NKG2D信号传导的功能性抑制。本发明的又一个目的是提供在表达嵌合的NKG2D 受体的冷冻免疫细胞的冷冻和/或解冻过程中减少和/或防止杀伤分子的方法,包括在细胞的冷冻和/或解冻过程中对NKG2D信号传导的功能性抑制。
通过靶向抑制NKG2D表达,NKG2D配体表达或抑制酶功能,特别是 PI3K功能,可以克服靶标驱动的CAR T杀伤分子。特别设想可以通过以下一种或多种方式来实现NKG2D信号传导的功能抑制:
-永久或暂时抑制所述免疫细胞的一种或多种NKG2D配体;
-嵌合NKG2D受体的瞬时抑制;
-所述嵌合NKG2D受体的下游信号传导的瞬时抑制。
根据设想到一种或多种NKG2D配体的永久抑制的实施方案,这尤其可以通过基因敲除来实现。为此,可以使用基因编辑技术,包括但不限于 Crispr/Cas、TALEN、ZFN、大范围核酸酶、MegaTAL核酸酶。
根据设想到下游信号传导的瞬时抑制的特定实施方案,这是PI3K信号传导的瞬时抑制。根据另外的特定实施方案,可以使用大范围的PI3K抑制剂来抑制PI3K信号传导。这种抑制剂的一个例子是LY294002。另一种合适的抑制剂是艾代拉里斯(Cal-101)。
根据特定的实施方案,可以使用抑制性RNA(例如shRNA或siRNA) 或针对NKG2D受体或其一种或多种配体的抗体来实现受体或配体的功能性抑制。
根据另外的具体实施方案,功能性抑制是在受体水平上实现的,并且通过抑制性RNA或针对NKG2D受体的抗体来完成。根据一方面,使用了针对NKG2D受体的抗体。在此方面的特定实施例中,抗NKG2D受体的抗体是结合受体而不激活嵌合受体的抗体(即封闭性或拮抗性抗体)。根据最特定的实施方案,抗NKG2D受体的抗体是可商购的1D11抗体(以从其分离的克隆命名)。
根据替代的特定实施方案,功能性抑制在配体水平上实现,并且通过抑制性RNA或针对一种或多种NKG2D配体的抗体来完成。特别设想配体是MICA和MICB之一或两者。根据一方面,使用针对一种或多种NKG2D 配体的shRNA。
根据特定的实施方案,要制造的免疫细胞是用于过继性细胞转移的细胞,例如T细胞、NK细胞、NKT细胞、干细胞或iPSC。
在另一方面,提供了当被制造用于过继转移时遭受较少杀伤剂的细胞。根据这个方面,提供了工程化的免疫细胞,其包含编码嵌合的NKG2D受体和以下至少一种的核酸分子:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种 shRNA。
在这些免疫细胞中,NKG2D配体选自:MICA、MICB、ULBP1、ULBP2、 ULBP3、ULBP4、ULBP5和ULBP6。特别设想的配体是MICA和/或MICB。
根据另外的特定实施方案,提供了工程化的免疫细胞,其包含编码嵌合的NKG2D受体和以下至少一种的核酸分子:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对一种或多种NKG2D配体的一种或多种shRNA。
根据另一方面,提供了包含免疫细胞的组合物,所述免疫细胞包含编码嵌合NKG2D受体的核酸分子和
a)所述细胞进一步包括
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种 shRNA;
和/或
b)该组合物进一步包括
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种抗体;
-NKG2D受体的下游信号传导的抑制剂,特别是PI3K抑制剂。
根据该方面的特定实施方案,提供了包含免疫细胞的组合物,所述免疫细胞包含编码嵌合NKG2D受体的核酸分子,所述组合物还包含
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种抗体;和/或
-NKG2D受体的下游信号传导的抑制剂,特别是PI3K抑制剂。
根据另外的特定实施方案,提供了包含免疫细胞的组合物,所述免疫细胞包含编码嵌合NKG2D受体的核酸分子,所述组合物还包含
-一种或多种针对嵌合NKG2D受体的抗体;和/或
-PI3K抑制剂,特别是LY294002或艾代拉里斯。
根据又一方面,提供了本文所述的工程免疫细胞或组合物用作药物。
它们特别适合用于治疗癌症。
这等效于说明提供了治疗癌症的方法,包括给予包含编码嵌合NKG2D 受体的核酸分子和以下至少一种的工程化免疫细胞:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种 shRNA。
给有此需要的对象。
同样地,提供了治疗癌症的方法,其包括向有此需要的受试者施用组合物,其中所述组合物包含免疫细胞,所述免疫细胞包含编码嵌合NKG2D 受体的核酸分子和
a)单元格进一步包含
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种 shRNA;
和/或
b)组合物还含有
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种抗体;
-An NKG2D受体的下游信号传导的抑制剂,特别是PI3K抑制剂.
治疗方法可以是自体方法(受试者接收来自他或她身体的细胞),也可以是同种异体方法(免疫细胞来自非受试者的供体)。
附图简述
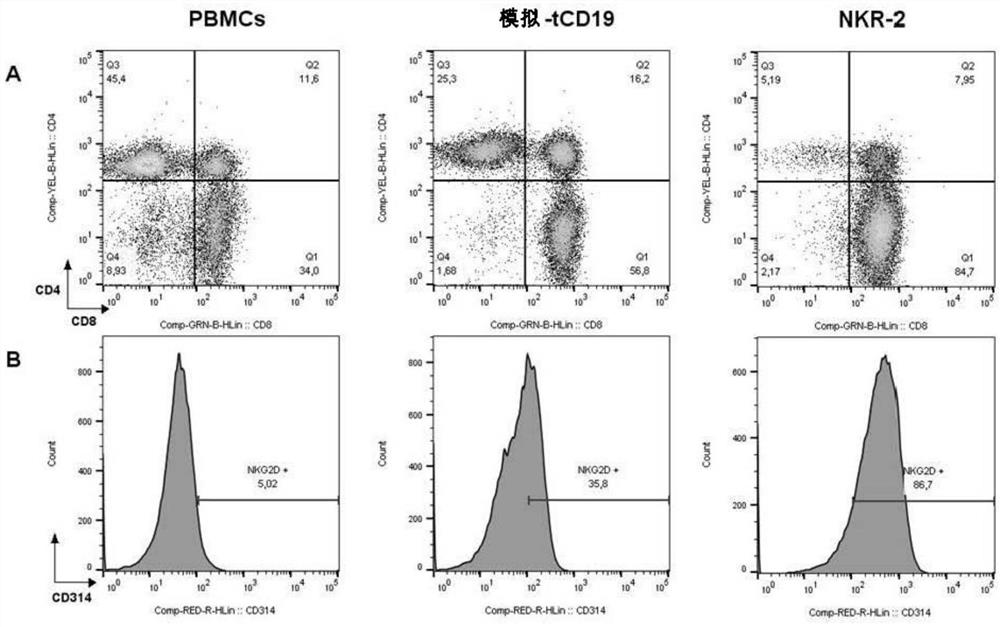
图1:代表性NKR-2 T细胞过程中PBMC,tCD19和NKG2D-CAR T 细胞的流式细胞仪表征。使用密度梯度法从血液中纯化的单核细胞在 NKR-2 T细胞过程之前(PBMC)和之后(tCD19和NKR-2 T细胞)进行了分析。采集后,将细胞在SSC/FSC上选通淋巴细胞。然后将淋巴细胞门控在CD3上。然后显示所有CD3阳性细胞,如下所示:(A)CD4/CD8 分布。(B)NKG2D(CD314)的表面表达。(C)记忆表型。CD62L和CD45RA 用于区分幼稚(CD62L+CD45RA+),中枢记忆(CD62L+CD45RA-),效应子记忆(CD62L-CD45RA-)和表达CD45RA的终末分化T细胞(CD62L- CD45RA+)和(D)CD223(Lag-3)和CD279(PD-1)染色的疲惫表型。显示了三分之一的代表性供体。
图2.CD314的平均荧光强度(MFI)。A-B)收获非转导,模拟CD19 转导或NKR2转导的T细胞后,CD3
图3:NKR-2 T细胞识别慢性髓细胞性白血病(K562)和胰腺癌(PANC-1),但由于NKG2DL表达而表现出杀伤效应。(A)用tCD19载体(tCD19 T细胞)或NKR-2 T细胞载体(NKG2D-CAR T细胞)转导健康供体的T细胞,并与指定的细胞系一起或单独培养(-)。共培养过夜后,通过ELISA对IFN-γ分泌(ng/ml)进行定量。每个数据点代表来自独立实验的重复孔的平均值。显示的是(N=3)。(B)NKR-2 T细胞表现出细胞溶解活性。将PANC-1与解冻的NKG2D-CAR T细胞以E:T比例1:1 进行共培养。20小时后确定Alamar蓝信号。通过与未处理的癌细胞 (PANC-1)的吸光度比较确定裂解百分比。所示数据为N=3个独立T 细胞供体的平均值±SD。-:仅PANC-1细胞;NKR-2 T细胞:NKR-2 T细胞和PANC-1细胞的共培养;tCD19:对照tCD19 T细胞与PANC-1细胞共培养。(C)将转导的T细胞在完全X-体内(100IU/mL IL-2)中培养4 天。接种96小时后分析T细胞,以分析相对于初始细胞接种密度的倍数膨胀。所示数据为N=3个独立T细胞供体的平均值±SD。(D)代表性的共培养实验(三分之二)。GFP阳性T细胞可以单独培养(模拟GFP),也可以与从同一供体产生的NKR-2 T细胞共培养(模拟GFP+NKR-2 T细胞)。在培养开始时(T=0h)或在培养24小时后(T=24h)进行流式细胞术分析GFP阳性。(E-F)PBMC用40ng/mL的抗CD3和100IU/mL的IL-2 激活,并按照正常生产流程共培养8天。每两天收集一次细胞样品,并以细胞表面(F)上的RNA(E)或蛋白质的形式分析NKG2D配体的表达。使用两尾不成对t检验来评估统计显着性。p<0.05被认为是显着(*),p<0.01(**)。对于qPCR和流式细胞术比较,使用配对的两尾t检验。
图4:NKR-2 T细胞显示NKG2D介导的杀伤剂,可被NKG2D阻断抗体或PI3K抑制剂抑制。(A)用增加的LY294002浓度处理或未处理的 NKR-2 T细胞上NKG2D表达的MFI。显示的数据是N=3个独立供体的平均值±SD。(B)将转导的T细胞在完全X-vivo(100IU/ml IL-2)中培养,所述X-vivo补充或不补充递增浓度的LY294002进行扩增。接种96小时后分析T细胞相对于初始细胞接种密度的倍数扩展。显示的数据是N=3个独立供体的平均值±SD。(C)冷冻保存后细胞的活力。在浓度增加的 LY294002存在下产生NKR-2 T细胞。生产后,收获细胞,洗涤并配制用于冷冻保存。冷冻保存后,使用水浴将细胞融化,并重悬于5%的血浆/人血清白蛋白(HSA)中。解冻后(T0h)或在4℃下于血浆/HSA5%(T6h) (N=715 3)中6小时后,直接评估细胞活力。(D)在LY294002浓度增加的情况下产生NKR-2 T细胞。生产后,收获细胞,洗涤,转移至Plasmalyte /HSA1%(50×106NKR-2 T细胞/ml)中,并在4℃下保存48小时。48小时后,使用锥虫蓝染色(N=3)评估细胞活力,并在冷冻保存时对细胞数量进行标准化(E)将tCD19 T细胞与由相同供体产生的NKR-2 T细胞共培养,同时存在增加浓度的封闭性Ab(从0(-)至10μg/ml)。温育44 小时后,获得CD19阳性和生存力的流式细胞仪分析。数据用无NKR-2 T 细胞培养的Mock的CD19阳性率进行标准化(N=3)。(F)在存在CD314 阻断抗体,同种型对照或无抗体的情况下,将解冻的NKR-2T细胞与PANC-1 细胞或K562细胞以1:1的比例共培养。温育24小时后,收集上清液并测量IFN-γ(N=3)。(G)在同种型对照存在下,将解冻的NKR-2 T细胞培养24小时,测量CD314阻断Ab(或无Ab)和IFN-γ水平。显示的数据是 N=3个独立供体的平均值±SD。使用两尾不成对t检验来评估统计显着性。 p<0.05被认为是显着(*),p<0.01(**)。
图5:用升高浓度的LY294002处理或未处理的NKR-2 T细胞上 NKG2D表达的MFI。
图6:存在或不存在PI3K抑制剂时tCD19细胞的倍数扩增
图7:使用PI3K抑制剂产生的NKR-2 T细胞产生了大量的IFN-γ(A),并显示出记忆表型增加(B)
图8:有和没有抗体阻断的NKR-2 T细胞的倍数扩增
图9:NKR-2 T细胞的抗体阻断过程适应性恢复了CD4/CD8的比例。 (A)细胞分解活性动力学,是三分之一的代表性杀伤试验。在存在NucLight 阳性PANC-1的情况下,培养用PI3K抑制剂LY294002或阻断性Ab处理的对照tCD19 T细胞或NKR-2 T细胞。通过IncuCyteS3设备每2小时评估一次PANC-1的生存能力。(B)收获时CD4/CD8的分布。在扩增阶段,将NKR-2 T细胞与5μM LY294002或5μg/mL的封闭Ab一起培养96小时,收获并通过流式细胞仪测量CD4和CD8群体。显示的数据是相对于对照 tCD19比率的N=4个独立T细胞供体的平均值±SD。(C)收获时CD4/CD8 的分布,延迟添加了封闭抗体。在扩增阶段(第4天到第8天),将NKR-2 T细胞直接用5μM封闭的Ab(第4天)或在48小时后(第6天)处理。在收获时(第8天),收获T细胞并通过流式细胞术分析CD4和CD8群体。显示的数据是相对于对照tCD19 CD4/CD8比的N=3个独立T细胞供体的平均值±SD。(D)扩大比较。将NKR-2 T细胞在存在LY或封闭Ab的情况下培养8天或10天(在第4天或第6天添加)。在收获时分析T细胞相对于初始细胞接种密度的倍数扩展。(E)通过IFN-γ分泌的效力测定。在 PANC-1细胞的存在下,共培养通过两种方法处理过的解冻的NKR-2 T细胞。共培养44小时后,通过ELISA测量IFN-γ的分泌。所示数据为N=4 个独立T细胞供体的平均值±SD。(F)细胞分解活性动力学,三分之一为代表性的杀灭测定。在存在NucLight阳性PANC-1细胞的情况下,培养用 PI3Ki或阻断抗体处理的解冻对照tCD19 T细胞或NKR-2 T细胞。通过 IncuCyte S3设备每2小时评估一次PANC-1的生存能力。使用两尾不成对t 检验来评估统计显着性。p<0.05被认为是显着(*),p<0.01(**)和p<0.001 (***)。
图10.艾代拉里斯(Cal101)vs NKG2D封闭抗体。与在阻断性NKG2D 抗体或5μMCAL101存在下培养的细胞的K562细胞(C)共培养后,通过 IFNγ分泌测量的细胞扩增(A),活力(B)和效能的比较。
图11.NKG2D配体在CD4+(A)和CD8+(B)T细胞表面的表达
图12.靶向shRNA的MICA/B的共表达减少了杀伤剂
图13.减少杀伤剂可增加癌细胞的杀伤力。
发明详述
定义
将针对特定实施例并参考某些附图来描述本发明,但是本发明不限于此,而是仅由权利要求书来限定。权利要求中的任何附图标记不应被解释为限制范围。所描述的附图仅是示意性的而非限制性的。在附图中,出于说明目的,一些元件的尺寸可能被放大并且未按比例绘制。在本说明书和权利要求书中使用术语“包括”时,它不排除其他元素或步骤。当提及单数名词例如“一”或“一个”时,使用不定冠词或定冠词,除非特别说明,否则该词包括该名词的复数形式。“基本上由……组成”是指必须包括任何所列举的要素,排除了将对所列举的要素的基本和新颖特征产生实质性影响的要素,并且可以可选地包括其他要素。“由……组成”是指除所列要素外的所有要素。这些术语中的每一个所定义的实施方案都在本发明的范围内。
此外,说明书和权利要求书中的术语第一、第二,第三等用于区分相似的元件,而不必用于描述顺序或时间顺序。应当理解,如此使用的术语在适当的情况下是可互换的,并且本文描述的本发明的实施方式能够以不同于本文描述或示出的其他顺序来操作。
仅提供以下术语或定义以帮助理解本发明。
除非本文具体定义,否则本文使用的所有术语具有与本发明领域的技术人员相同的含义。从业人员特别针对Green和Sambrook,《分子克隆:实验室手册》,第四版,冷泉港实验室出版社,纽约(2012年);和Ausubel 等人,《现代分子生物学实验方案》(直至补编114),约翰·威利父子出版社,纽约(2016年),以了解现有技术的定义和术语。本文所提供的定义不应被解释为具有小于本领域普通技术人员所理解的范围。
本文所用的术语“杀伤剂”是指被遗传上相同的细胞,最特别是免疫细胞杀死细胞。
如本文所用,与合适的对照细胞群(通常但并非必须是其中没有发生NKG2D配体抑制作用的相同细胞群)相比,术语“减少和/或预防杀伤剂”涉及减少细胞群中杀伤剂的发生。减少量可以表示为与对照相比减少的百分比,例如,杀伤剂减少了10%、20%、25%、30%、40%、50%、60%、 70%、75%、80%、90%甚至100%。也可以通过增加最终细胞的产量或数量来评估杀伤剂的减少(因为杀死更少的细胞后,更多的细胞可以存活并可以繁殖)。因此,可以通过细胞产率提高10%、20%、25%、30%、40%、 50%、60%、70%、75%、80%、90%、100%或什至超过100%来评估。重要的是,还可通过抗原特异性细胞因子产生(例如干扰素γ分泌)的增加和/或在T细胞的情况下,T细胞记忆表型(CD62L
可以在杀灭杀伤剂过程开始之前(通常更可取,因为这样更有效)或在杀灭杀灭杀伤剂的过程中采取减少杀虫剂的措施。预防杀伤是指在杀伤过程开始之前采取的措施。根据特定的实施方案,杀伤剂的绝对预防是指不发生NKG2D诱导的杀伤剂(理想情况下根本不发生杀伤剂),相当于杀伤剂减少了100%。
本文所用的术语“免疫细胞”是指属于免疫系统(可以是适应性免疫系统或先天性免疫系统)一部分的细胞。特别设想的免疫细胞包括白细胞(白细胞)、包括淋巴细胞、单核细胞、巨噬细胞和树突细胞。特别设想的淋巴细胞包括T细胞、NK细胞和B细胞,最特别设想的是T细胞。本文所用的免疫细胞通常是为过继性细胞转移(自体转移或同种异体转移)而制造的免疫细胞。在过继转移的情况下,请注意免疫细胞通常将是原代细胞(即直接从人或动物组织中分离出来的细胞,而不是或仅经过短暂培养的细胞),而不是细胞系(即长时间连续传代并获得同质的基因型和表型特征的细胞)。根据特定的实施方案,免疫细胞是原代细胞。根据替代的具体实施方案,免疫细胞不是来自细胞系的细胞。
本文所用的短语“嵌合NKG2D受体”是指对NKG2D配体具有特异性的非天然存在的受体。它是嵌合的,因为结合部分与一个或多个不同的部分 (包括至少一个信号传导部分)融合,其中至少一个部分与结合部分来自不同的来源(例如不同的蛋白质)。嵌合NKG2D受体的特别设想的实例包括NKG2D CAR,即具有衍生自NKG2D受体的结合部分的嵌合抗原受体。这样的NKG2D CAR已经例如在WO2006/036445和WO2014/117121中描述了这种方法。在本文的嵌合NKG2D受体的定义中还包括具有结合部分的CAR,该结合部分可识别一种或多种非源自NKG2D受体(例如一种或多种NKG2D配体的抗体)或抗体样部分(例如scFv,VHH,sdAb等)的NKG2D配体。然后通常将其融合至在免疫细胞,特别是T细胞(例如CD3ζ链或Fcε受体γ链)中转导信号的信号传导部分。
本申请中使用的术语“对NKG2D信号传导的功能抑制”是指在DNA水平(通过抑制NKG2D基因产物或其一种或多种配体的形成,即通过阻止或干扰转录来形成)、RNA水平(通过中和或稳定mRNA来防止或干扰翻译- 该mRNA也可以是嵌合NKG2D受体和/或一种或多种NKG2D配体的)或蛋白质水平(通过中和或抑制嵌合的NKG2D蛋白和/或其一种或多种配体)上都会干扰NKG2D基因产物(即嵌合NKG2D受体基因的产物)的功能。可以在细胞表面(例如通过抑制受体-配体相互作用)或在蛋白质在表面表达之前(例如通过将蛋白质保留在细胞内细胞器中)实现蛋白质水平的中和。通常,抑制NKG2D诱导的信号传导的最终功能作用是通过嵌合NKG2D 受体产生的信号抑制免疫细胞的活化,尽管这可以间接实现(例如在DNA水平上,或通过抑制一种或多种配体)。
NKG2D信号传导的功能性抑制并不一定意味着NKG2D诱导的信号完全消融,尽管也可以设想。众所周知,特别是对于反义RNA和siRNA,但对于抗体也是如此,抑制通常是部分抑制而不是完全抑制。但是,降低功能性NKG2D基因产物或NKG2D配体的水平即使在没有完全抑制的情况下也可能具有有益的作用-特别是因为杀伤剂通常是细胞密度依赖性的,因此功能性配体或受体利用率的降低可能会导致较低的细胞密度。(请注意,鉴于将来的临床试验需要大量细胞,通过使用培养物稀释液降低实际细胞密度对于生成合适的产品是不可行的)。
因此,根据特定的实施方案,所述抑制将导致功能性嵌合NKG2D受体基因产物或一种或多种NKG2D配体的减少10%、20%、25%、30%、40%、 50%、60%、70%、75%、80%、90%或最多100%。测量功能性NKG2D受体基因产物或配体的水平的方法是技术人员已知的,并且可以在添加抑制剂之前和之后进行测量以评估功能性基因产物的水平的降低。
如本文所用,术语“瞬时抑制”是指抑制是暂时的(或在时间上受调节),并且嵌合NKG2D受体的功能在稍后的时间点恢复。通常,NKG2D诱导的信号转导将在免疫细胞的生产过程中被抑制(即,在将它们用作药物之前),而一旦将细胞施用于患者,信号转导能力就会恢复。这是因为NKG2D介导的信号传导对于治疗功效很重要。
本申请中使用的术语“NKG2D配体”是指人类基因MICA(Gene ID: 100507436),MICB(Gene ID:4277),ULBP1(Gene ID:80329),ULBP2(Gene ID:80328),ULBP3(Gene ID:79465),ULBP4或RAET1E(Gene ID:135250), ULBP5或RAET1G(Gene ID:353091),ULBP6或RAET1L(Gene ID:154064) 及其基因产物(或使用其他物种的细胞时的相关同源物)。
本申请是第一个表明表达嵌合的NKG2D受体的免疫细胞的杀伤剂可以通过抑制该受体的功能(通过抑制该受体或其一种或多种配体或两者) 来预防或减少。杀伤剂的这种减少提高了细胞的产量并降低了治疗的成本,从而促进了在临床环境中治疗的可用性。
所述抑制作用可以是短暂的(在免疫细胞的体外制造过程中,而不是在施用于患者时,因为所述细胞的治疗性免疫细胞功能需要嵌合的NKG2D 受体)或可以是永久性的(当仅抑制免疫细胞中的配体时,因为这不会干扰治疗功效)。
因此,本发明的目的是提供在表达嵌合的NKG2D受体的免疫细胞的制造过程中减少和/或预防杀伤分子的方法,包括在细胞的制造过程中功能性抑制NKG2D信号传导。这些制造方法在体外或离体进行。同样地,提供了减少和/或预防表达嵌合NKG2D受体的免疫细胞的冷冻/融化循环期间的杀微生物方法,包括在冷冻/融化循环期间对NKG2D信号传导的功能性抑制。这些冷冻/解冻方法也可以在体外或离体进行。
值得注意的是,尽管NKG2D是参与识别诱导型自身抗原的研究最深入的受体,但它并不是该家族中唯一识别应激诱导的配体(或诱导的自身抗原或异常自身的标记物,均在本文中用作等效物)。能够结合诱导自身抗原的其他受体是NKG2C、NKG2E、NKG2F、NKG2H(如NKG2D,所有 CD94分子)或天然细胞毒性受体(NCR),例如NKp 46、NKp30和NKp44,并且可以设想,该方法和组合物也可作必要的变通用于此类嵌合受体。因此,无论在应用中使用NKG2D的位置如何,这也适用于NKG2C、NKG2E、 NKG2F、NKG2H、NKp46、NKp30和NKp44。注意,NKG2C、E、F和H 的配体是I类非经典MHC糖蛋白(人类中的HLA-E)。
这些方法是体外方法(因为它们与细胞的制造同时发生)。
NKG2D信号传导的功能性抑制是通过以下一种或多种方式实现的:
-永久或暂时抑制所述免疫细胞的一种或多种NKG2D配体;
-嵌合NKG2D受体的瞬时抑制;
-所述嵌合NKG2D受体的下游信号传导的瞬时抑制。
抑制作用可以通过多种方式发生:接触抑制(竞争性抑制或非竞争性抑制),通过干扰配体或受体的表达来抑制,干扰配体或受体的定位(例如以防止迁移到细胞表面),通过与配体或受体结合或通过抑制两者的相互作用来抑制,以及抑制下游信号传导,仅举几例。
通常通过基因敲除来永久抑制一种或多种NKG2D配体。确实已经表明,基因编辑是一种专门消除工程化T细胞中靶抗原表达的潜在方法(14)。但是,鉴于可能表达八个不同的配体,消除所有这些多态性靶标的基因编辑技术提出了挑战,因此,特别需要设想只有一个或几个配体需要永久灭活的情况。如果表达更多的配体,则替代策略之一可能更适合于控制杀灭杀伤剂。本发明人已经确定,在八个NKG2D配体中,MICA和MICB主要在CD4
通常,可以在三个层面上实现功能性抑制。首先,在DNA水平,例如通过在所述免疫细胞中去除或破坏基因(通常为NKG2D配体基因),或防止转录发生(在两种情况下均阻止基因产物的合成)。其次,在RNA水平,例如通过阻止发生有效的翻译-这可能是通过使mRNA不稳定来使其在转录本上发生翻译之前被降解,或者是与mRNA杂交。第三,在蛋白质水平,例如通过与蛋白质结合,抑制其功能,将蛋白质保留在不同的细胞位置和/ 或标记蛋白质进行降解。
如果要在DNA水平上实现抑制,可以使用基因疗法敲除或破坏基因来完成。因为这通常会导致永久性抑制,所以特别可以设想在免疫细胞中抑制NKG2D配体。如本文所用,“敲除”可以是基因敲除或基因可以通过突变 (例如,点突变,插入,缺失,移码或错义突变)通过本领域已知的技术被敲除,包括但不限于逆转录病毒基因转移。可以敲除基因的另一种方法是使用工程核酸酶。这样的工程核酸酶的实例包括但不限于大范围核酸酶、锌指核酸酶、TALEN、megaTAL和CRISPR核酸酶。
在微生物物种中常见的大范围核酸酶具有独特的特性,即具有非常长的识别序列(>14bp),可在核酸中进行位点特异性双链断裂。这使得它们天然地对靶序列非常特异性,并且通过诱变和高通量筛选,可以制备识别独特序列的杂交大范围核酸酶变体。与大范围核酸酶相反,ZFN和TALEN 技术背后的概念是基于非特异性DNA切割酶,然后可以将其连接到识别特定DNA序列的肽,如锌指和转录激活因子样效应物(TALE)。锌指核酸酶 (ZFN)是通过将锌指DNA结合域与DNA裂解域融合而产生的人工限制性酶。锌指结构域可以被工程化以靶向所需的DNA序列,这使得锌指核酸酶能够靶向复杂基因组内的独特序列。通过利用内源性DNA修复机制,这些试剂可用于精确地改变高等生物的基因组。TALEN的作用类似于锌指,但依赖转录激活因子样效应物(TALE)进行DNA识别。在重复序列中发现TALE,氨基酸和识别的核苷酸对之间的识别比例为一比一。由于TALE 以重复模式发生,因此可以尝试使用不同的组合来创建各种各样的序列特异性。
MegaTALs源自两种不同类别的DNA靶向酶的组合。大范围核酸酶(也称为归巢核酸内切酶)是单肽链,具有在同一域中同时具有DNA识别和核酸酶功能的优势。然而,大范围核酸酶靶标的识别难以修改,并且与其他基因组靶向核酸内切酶相比,它们通常具有降低的特异性和更低的靶标切割效率。转录激活子样(TAL)效应子是DNA识别蛋白,已连接到单独的 DNA内切核酸酶结构域,以实现目标DNA双链断裂。与大范围核酸酶相比,TALs易于工程化以靶向特定的DNA序列。当前平台依赖一对TAL效应子,每个TAL效应子都与非特异性DNA切割结构域偶联,其中仅当两个TAL效应子结合各自的序列并且两个核酸内切酶结构域二聚化以切割 DNA时,才发生DNA切割。但是,TAL效应子核酸酶可引起脱靶活性,比大范围核酸酶大得多,并且需要递送两种单独的蛋白质。megaTAL是TAL 效应子与大范围核酸酶的统一。
CRISPR/Cas(聚类的规则间隔的短回文重复序列/Crispr相关蛋白) 是一种基因组编辑技术,使用了原核防御机制的改良版,可以对生物体内的基因进行永久性修饰。通过将与合成的指导RNA(gRNA)复合的Cas (通常为Cas9)核酸酶输送到细胞中,可以在所需位置切割细胞的基因组,从而去除现有的基因和/或添加新的基因。
通常通过遗传敲除来永久抑制一种或多种NKG2D配体基因,这种免疫作用通常也在存在NKG2D受体的免疫细胞中进行。一个或多个NKG2D 配体基因可能意味着抑制MICA、MICB、ULBP1、ULBP2、ULBP3、ULBP4、 ULBP5和ULBP6的任何组合;因此可能意味着敲除一个、两个、三个、四个、五个、六个、七个或八个基因。
除了对NKG2D配体的永久抑制外,对NKG2D信号转导的功能性抑制也可以通过瞬时抑制来实现。瞬时抑制可以是免疫细胞上一种或多种 NKG2D配体的抑制,也可以是嵌合NKG2D受体的抑制或下游信号传导的抑制。
瞬态抑制的时间范围通常将与制造时间范围一致。表达嵌合NKG2D 受体的免疫细胞的制造涉及几个步骤,并且方案可能会有所不同,但从本质上讲,它们将始终包含转导步骤(其中将嵌合NKG2D受体引入分离的免疫细胞中)、扩增步骤(在其中培养细胞并增加数量)和收获步骤(在向患者给药或冷冻保存之前,分离并重新配制或浓缩细胞)。瞬态抑制将特别意味着在扩展步骤中的抑制,因为这是最有可能发生杀灭杀伤剂的时间,但是瞬态可以发生在整个制造过程中(从或什至在转导步骤之前直至收获步骤或之后)。通常,当使用外部抑制剂(例如抗体)时,将在收获/重组过程中将其去除。因此,该方法可以包括去除所用抑制剂的活性步骤。但是,在其他情况下,抑制剂可能是暂时性的(例如由于半衰期短)或处于诱导型启动子的控制之下,该启动子在制造过程后不再具有活性,因此无需采取任何主动步骤即可结束对功能性NKG2D信号的抑制。在典型的设置中,瞬时抑制将需要从转导步骤到给药/输注步骤的抑制,但是也可以设想更短或更长的时间范围。
瞬时抑制的一种形式是瞬时基因失活。瞬时基因失活可以例如通过在免疫细胞中表达反义RNA或通过对所述细胞施用反义RNA来实现。反义构建体可以例如作为表达质粒递送,当其在细胞中转录时,其产生与靶 mRNA(此处为NKG2D配体或嵌合NKG2D受体的mRNA)的至少独特部分互补的RNA。
抑制基因表达的更快速方法是基于使用较短的反义寡聚体,该寡聚体由DNA或其他合成结构类型组成,例如磷酸硫酯,2'-O-烷基核糖核苷酸嵌合体,锁核酸(LNA),肽核酸(PNA)或吗啉代。除了RNA低聚物,PNA 和吗啉代之外,所有其他反义低聚物均通过RNase H介导的靶标裂解机制在真核细胞中发挥作用。PNA和吗啉代以高亲和力和特异性结合互补的 DNA和RNA靶标,因此通过对RNA翻译机制的简单空间封锁起作用,并且似乎完全抵抗核酸酶攻击。“反义寡聚物”是指包含长度至少约10个核苷酸的寡聚物的反义分子或反基因剂。在实施方案中,反义寡聚物包含至少 15、18、20、25、30、35、40或50个核苷酸。反义方法涉及寡核苷酸(DNA 或RNA或其衍生物)的设计,该寡核苷酸与FMR1的多核苷酸序列编码的mRNA互补。可以将反义RNA引入细胞以通过与其互补配对并在物理上阻碍翻译机制来抑制互补mRNA的翻译。因此,该作用是化学计量的。绝对互补,尽管是首选,但不是必需的。如本文所指,与RNA的一部分“互补”的序列是指具有足够的互补性以能够与RNA杂交形成稳定的双链体的序列;在双链反义多核苷酸序列的情况下,可以测试双链DNA的单链,或者可以检测三链体的形成。杂交的能力将取决于互补程度和反义多核苷酸序列的长度。通常,杂交多核苷酸序列越长,与其可能包含的RNA的碱基错配就越多,并且仍然形成稳定的双链体(视情况而定)。本领域技术人员可以通过使用标准程序确定杂交复合物的熔点来确定可容许的错配程度。与消息的5'末端互补的寡聚物,例如直至和包括AUG翻译起始密码子的5' 非翻译区(UTR),应在抑制翻译方面最有效。然而,最近已显示出与mRNA 3'UTR互补的序列也可有效抑制mRNA的翻译(Wagner,R.(1994)Nature 372,333-335)。因此,与靶基因的5',3'UTR或非编码区互补的寡聚物可用于反义方法中,以抑制靶基因编码的所述内源mRNA的翻译。与所述mRNA 的5'UTR互补的寡聚体应包括AUG起始密码子的互补体。与mRNA编码区互补的反义寡聚物是效率较低的翻译抑制剂,但是可以根据本发明使用。无论是设计为与所述mRNA的5',3'或非编码区杂交,反义寡聚物的长度应至少为10个核苷酸,并且优选寡聚物的长度为15至约50个核苷酸。在某些实施方案中,寡聚物的长度为至少15个核苷酸,至少18个核苷酸,至少20个核苷酸,至少25个核苷酸,至少30个核苷酸,至少35个核苷酸,至少40个核苷酸或至少50个核苷酸。一种相关方法使用核酶代替反义RNA。核酶是具有酶样切割特性的催化性RNA分子,可以设计为靶向特定的RNA序列。据报道,在小鼠、斑马鱼和果蝇中,使用核酶成功实现了靶基因的失活,包括时间和组织特异性基因的失活。RNA干扰(RNAi) 是转录后基因沉默的一种形式。首次在秀丽隐杆线虫中观察到并描述了 RNA干扰现象,该现象表明外源双链RNA(dsRNA)通过诱导靶RNA快速降解的机制特异性,有效地破坏了含有同源序列的基因的活性。一些报告描述了在其他生物体中相同的催化现象,包括表明基因失活的空间和/或时间控制的实验,包括植物(拟南芥),原生动物(Trypanosoma bruceii),无脊椎动物(Drosophila melanogaster)和脊椎动物(Danio rerio和非洲爪蟾 (Xenopuslaevis)。序列特异性信使RNA降解的介质是由较长的dsRNA裂解的核糖核酸酶III产生的小干扰RNA(siRNA)。通常,siRNA的长度在 20-25个核苷酸之间(Elbashir et al.(2001)Nature 411,494-498)。siRNA通常包含通过标准Watson Crick碱基配对相互作用(以下称为“碱基配对”)退火在一起的有义RNA链和互补反义RNA链。有义链包含与靶mRNA中包含的靶序列相同的核酸序列。本siRNA的有义和反义链可包含两个互补的单链RNA分子,或可包含一个单分子,其中两个互补部分碱基配对并通过单链“发夹”区共价连接(通常称为shRNA)。术语“分离的”是指通过人为干预而从自然状态改变或去除。例如,不是“分离”天然存在于活体动物中的 siRNA,而是“分离”了合成的siRNA或与天然状态的共存物质部分或完全分离的siRNA。分离的siRNA可以以基本上纯化的形式存在,或可以存在于非天然环境中,例如已经将siRNA递送到其中的细胞。
本发明的siRNA可以包含部分纯化的RNA,基本上纯的RNA,合成 RNA或重组产生的RNA,以及通过添加,缺失,取代和/或改变一个或多个核苷酸而不同于天然RNA的改变的RNA。此类改变可包括将非核苷酸物质添加至诸如siRNA的末端或siRNA的一个或多个内部核苷酸,包括使 siRNA对核酸酶消化具有抗性的修饰。
本发明的siRNA的一条或两条链也可以包含3'突出端。“3'突出端”是指从RNA链的3'末端延伸的至少一个未配对的核苷酸。因此,在一个实施方案中,本发明的siRNA包含长度为1至约6个核苷酸(包括核糖核苷酸或脱氧核苷酸)的至少一个3'突出端,优选长度为约1至约5个核苷酸,更优选长度为约1至约4个核苷酸,特别优选长度为约1至约4个核苷酸。
在siRNA分子的两条链都包含3'突出端的实施方案中,对于每条链,突出端的长度可以相同或不同。在最优选的实施方案中,3'突出端存在于 siRNA的两条链上,并且长度为两个核苷酸。为了增强本发明siRNA的稳定性,还可以稳定3'突出端以防止降解。在一个实施方案中,通过包含嘌呤核苷酸,例如腺苷或鸟苷核苷酸来稳定突出端。
备选地,容许嘧啶核苷酸被修饰的类似物取代,例如,在3'突出端的尿苷核苷酸被2'脱氧胸苷取代,并且不影响RNAi降解的效率。特别地,在 2'脱氧胸苷中不存在2'羟基显着增强了组织培养基中3'突出端的核酸酶抗性。
siRNA可以使用本领域技术人员已知的多种技术获得。例如,可以使用本领域已知的方法化学合成或重组产生siRNA。优选地,使用适当保护的核糖核苷亚磷酰胺和常规DNA/RNA合成仪化学合成本发明的siRNA。 siRNA可以合成为两个单独的互补RNA分子,也可以合成为具有两个互补区域的单个RNA分子。合成RNA分子或合成试剂的商业供应商包括Proligo (德国汉堡),Dharmacon Research(美国科罗拉多州拉斐特),Pierce Chemical(Perbio Science的一部分,美国伊利诺伊州罗克福德),Glen Research(Sterling,Va.,USA),ChemGenes(美国马萨诸塞州阿什兰)和 Cruachem(英国格拉斯哥)。
或者,也可以使用任何合适的启动子从重组环状或线性DNA质粒表达 siRNA。用于从质粒表达本发明的siRNA的合适的启动子包括,例如,U6 或H1 RNA pol III启动子序列和巨细胞病毒启动子。其他合适的启动子的选择在本领域技术范围内。本发明的重组质粒还可以包含用于在特定组织中或在特定细胞内环境中表达siRNA的诱导型或调控型启动子。从重组质粒表达的siRNA可以通过标准技术从培养的细胞表达系统中分离,或者可以在细胞内表达,例如在乳腺组织或神经元中。
本发明的siRNA也可以从重组病毒载体在细胞内表达。重组病毒载体包含编码本发明的siRNA的序列和用于表达siRNA序列的任何合适的启动子。合适的启动子包括例如U6或H1 RNA pol Ill启动子序列和巨细胞病毒启动子。其他合适的启动子的选择在本领域技术范围内。本发明的重组病毒载体还可以包含可诱导的或可调节的启动子,用于在肿瘤所在的组织中表达siRNA。
如本文所用,siRNA的“有效量”是足以引起RNAi介导的靶mRNA降解的量,或足以减少NKG2D信号传导的量。可以通过使用如上所述的分离和定量mRNA或蛋白质的标准技术,通过测量对象细胞中的靶mRNA或蛋白质的水平来检测RNAi介导的靶mRNA的降解。
已经显示,斑马鱼和青蛙中的吗啉代反义寡核苷酸克服了RNase H感受态反义寡核苷酸的局限性,由于其他低水平的RNase H严格要求引起的其他mRNA分子的非目标特异性切割,其具有许多非特异性作用。因此, Morpholino低聚物代表了重要的一类新的反义分子。本发明的低聚物可以通过本领域已知的标准方法合成。例如,硫代磷酸酯低聚物可以通过Stein 等人(1988)Nucleic Acids Res.16,3209-3021的方法合成,膦酸甲酯低聚物可通过使用可控孔玻璃聚合物载体制备(Sarin et al.(1988)Proc.Natl.Acad.Sci.USA.85,7448-7451)。可以通过Summerton和Weller的美国专利No. 5,217,866和5,185,444的方法合成吗啉代低聚物。
抑制,特别是瞬时抑制,也可以通过蛋白质水平的抑制剂来实现。其典型实例是针对嵌合NKG2D受体的抗体,或针对一种或多种NKG2D配体的抗体。
术语“抗体”指特征在于特异性针对NKG2D受体,NKG2D配体或其任何功能衍生物的抗体,所述抗体优选为单克隆抗体;F(ab')2,F(ab) 或单链Fv类型的抗体或其抗原结合片段,或其衍生的任何类型的重组抗体。本发明的这些抗体,包括针对靶蛋白或其任何功能性衍生物制备的特异性多克隆抗血清,与其他蛋白无交叉反应性。例如,本发明的单克隆抗体可以由易于根据经典方法由动物(特别是针对目标蛋白或其任何功能性衍生物免疫的小鼠或大鼠)的脾细胞和骨髓瘤细胞系的细胞形成的任何杂交瘤产生,并根据杂交瘤产生识别靶蛋白或其任何功能性衍生物的单克隆抗体的能力进行选择,这些单克隆抗体最初已用于动物免疫。根据本发明该实施方案的单克隆抗体可以是通过重组DNA技术制备的小鼠单克隆抗体的人源化形式,不同于编码H和L链的小鼠和/或人类基因组DNA序列或编码H和L链的cDNA克隆。或者,根据本发明该实施方案的单克隆抗体可以是人单克隆抗体。这样的人单克隆抗体例如通过如PCT/EP 99/03605所述通过严重的联合免疫缺陷(SCID)小鼠的人外周血淋巴细胞(PBL)的再繁殖,或如美国专利No.5,545,806所述使用能够产生人抗体的转基因非人动物,来制备。源自这些单克隆抗体的片段,例如Fab,F(ab)'2和scFv (“单链可变片段”),只要它们保留了原始的结合特性,就构成了本发明的一部分。此类片段通常通过例如用木瓜蛋白酶,胃蛋白酶或其他蛋白酶酶促消化来产生。本领域技术人员众所周知,单克隆抗体或其片段可以被修饰用于各种用途。可以用酶促、荧光或放射性类型的适当标记物来标记本发明中涉及的抗体。在一个特定的实施方案中,所述针对靶蛋白或其功能片段的抗体衍生自骆驼。骆驼抗体在WO94/25591、WO94/04678和WO97 /49805中有完整描述。
在蛋白质水平上的其他NKG2D信号抑制剂包括但不限于NKG2D配体或嵌合受体的肽抑制剂,NKG2D配体或嵌合NKG2D受体的肽-适体抑制剂 (Tomai et al.,J BiolChem.2006),以及蛋白质干扰素或Pept-Ins
在蛋白质水平上抑制的另一种方法是通过干扰分泌转运,从而使受体和/或配体不转运至细胞膜。通常,这是暂时的抑制形式,当向细胞提供适当的信号后,即可恢复正常的细胞定位。根据该原理的示例性方法是RUSH (使用选择性钩子的保持)系统(Boncompainet al.,Nature Methods 2012 and WO2010142785)。特别设想这是为了瞬时抑制嵌合NKG2D受体。
小分子抑制剂,例如有机小分子和其他候选药物可以从例如组合和天然产品库中获得。
对于瞬时抑制功能性NKG2D信号传导特别设想的是对通过嵌合 NKG2D受体的下游信号的抑制。本文证明了所观察到的杀伤剂的重要部分通过NKG2D诱导的PI3K信号传导途径介导,这是NKG2D/DAP10复合物的主要信号传导途径。因此,有效抑制PI3K信号传导是NKG2D信号传导的功能抑制,因为它降低了配体-受体结合的功能作用。因此,可以通过瞬时抑制PI3K信号来实现下游信号传导的瞬时抑制。示例性抑制剂包括可商购的PI3K抑制剂。一种特别预期的抑制剂是大范围的PI3K抑制剂 LY294002。另一种特别设想的抑制剂是Cal101(艾代拉里斯)。其他示例包括例如Copanlisib,Taselisib,Buparlisib,Duvelisib,Alpelisib和Umbralisib。
本文所述的方法适用于表达NKG2D的免疫细胞的制备。通常,免疫细胞的制备是在制备或培养细胞以进行过继转移时发生的。这可以是自体过继转移(受试者接受自己已被修饰和/或扩增的细胞),或同种异体过继移植(受试者接受来自不同个体的细胞)。
许多不同类型的免疫细胞用于过继治疗,因此被设想用于本文所述的方法。免疫细胞的实例包括但不限于T细胞、NK细胞、NKT细胞、淋巴细胞、干细胞或iPSC。后两者本身不是免疫细胞,但可用于过继细胞转移以进行免疫治疗(见Jiang et al.,Cell Mol Immunol2014;Themeli et al.,Cell Stem Cell 2015)。通常,虽然制造从干细胞或iPSC开始(或什至可以从免疫细胞向iPSC的去分化步骤开始),但制造将需要在给药前向免疫细胞分化。由于本发明方法涉及制造过程(即给药前的步骤),因此在用于过继转移的免疫细胞的制造中使用的干细胞和iPSC在本文中被视为免疫细胞。根据特定的实施方案,该方法中设想的干细胞不涉及破坏人类胚胎的步骤。
用于本发明方法的特别设想的细胞是T细胞和NK细胞。
根据另一方面,提供了工程化免疫细胞,其中减少了杀灭杀伤剂。这些细胞的特征在于细胞内NKG2D信号转导的功能性抑制,例如通过敲除 NKG2D配体,永久或暂时抑制NKG2D配体或瞬时抑制嵌合受体(例如通过表达瞬时抑制剂,瞬时表达抑制剂或暂时保留受体或配体)。
因此,这些细胞包含编码嵌合的NKG2D受体和以下至少之一的核酸分子:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-一种或多种针对嵌合NKG2D受体和/或一种或多种NKG2D配体的抑制剂;
-与嵌合NKG2D受体和/或与一种或多种NKG2D配体融合的结合标签。
结合标签(例如抗生蛋白链菌素)可以用于诸如RUSH(使用选择性钩保留)的方法中(Boncompain et al.,Nature Methods 2012和 WO2010142785),并且特别设想用于瞬时抑制嵌合NKG2D受体。
特别设想的细胞包括编码嵌合的NKG2D受体和以下至少一种的核酸分子:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种抑制剂。
内源基因的失活可以如上所述进行,例如使用基因组编辑,工程核酸酶,如CRISPR/Cas,TALEN,锌指核酸酶,大范围核酸酶,MegaTAL核酸酶或其他合适的方法(包括但不限于Cre/Lox或基于Flp/FRT的系统)。尽管不是先决条件,但在大多数情况下,失活的内源基因将永久失活(即无明显的失活逆转)。这就是为什么这种方法特别适合于配体的失活(免疫细胞不需要发挥配体的免疫治疗作用),而适合NKG2D受体的失活,因为配体在免疫治疗中需要该受体,因此该方法特别少。
包含抑制剂的细胞通常将包含编码抑制剂的质粒,因为这是确保抑制剂包含在细胞中的最方便方法。因此,特别设想抑制剂可以从质粒表达。尽管这可以用抗体或肽完成,但最特别设想的是核酸抑制剂,例如RNA干扰技术,例如siRNA或shRNA。抑制剂(例如RNA抑制剂)可以针对嵌合的NKG2D受体和/或针对一种或多种NKG2D配体。这些NKG2D配体选自MICA、MICB、ULBP1、ULBP2、ULBP3、ULBP4、ULBP5和ULBP6。
这些细胞可以本身或以组合物的形式提供。还可以提供这样的组合物,其中通过向细胞中添加(外部)抑制剂来抑制NKG2D信号转导,该抑制剂被细胞吸收,或者在细胞外发挥其抑制作用。因此,根据另一方面,提供了表达嵌合NKG2D受体并且还包含抑制剂的免疫细胞的组合物。这些细胞可以包含编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;和/或一种或多种针对嵌合NKG2D受体的抑制剂和/或一种或多种在细胞中被编码为核酸的NKG2D配体,和/或与嵌合NKG2D受体和/或一种或多种融合的结合标签NKG2D配体(“内部抑制剂”,如上所述)。
另外地或可替代地,所述组合物可以包含一种或多种针对嵌合NKG2D 受体的抑制剂和/或一种或多种NKG2D配体(在细胞中未被编码为核酸);和/或嵌合NKG2D受体的下游信号传导抑制剂(“外部抑制剂”)。
特别设想的针对嵌合NKG2D受体和/或一种或多种NKG2D配体的抑制剂包括针对这些蛋白质的抗体。特别设想的嵌合NKG2D受体的下游信号传导抑制剂包括PI3K抑制剂。
在两种情况下,抑制剂可包含在细胞内,或组合物包含免疫细胞和抑制剂作为单独的成分,即在细胞外。注意,即使组合物可以作为单独的成分提供,抑制剂也可以被免疫细胞吸收。例如,下游信号传导抑制剂(例如PI3K抑制剂)通常是容易被细胞吸收的小分子。抗体可以被细胞吸收也可以不被细胞吸收,但是由于NKG2D受体与其配体之间的相互作用发生在细胞外,因此细胞摄取并不是抑制的先决条件,例如竞争性抑制剂可能在细胞外起作用。
根据另一方面,提供了本文所述的工程化免疫细胞或组合物用作药物。根据另一方面,提供了本文所述的工程化免疫细胞或组合物用于治疗以 NKG2D配体表达为特征的疾病。众所周知,NKG2D配体(如MICA,MICB 或RAET1/ULBP家族的配体)是诱导的自身抗原,即它们是在异常条件或细胞应激条件下表达的细胞配体,最特别是在应激(例如发炎)、转化或感染的细胞中表达。因此,提供细胞或组合物用于治疗选自炎性疾病,癌症或感染的疾病(例如病毒,细菌,真菌感染)。由于细胞疗法非常昂贵,因此特别设想用于威胁生命的疾病。因此,最特别地,本文所述的细胞和组合物被提供用于治疗癌症。原则上所有癌症都可以治疗,包括但不限于膀胱癌,脑癌,乳腺癌,宫颈癌,结肠直肠癌,食道癌,胶质母细胞瘤,头颈癌,肾癌,白血病,肝癌,肺癌,淋巴瘤,黑素瘤,间皮瘤,多发骨髓瘤,卵巢癌,胰腺癌,前列腺癌,肉瘤,胃癌和甲状腺癌;最特别设想的癌症包括白血病(包括AML),多发性骨髓瘤,膀胱癌,乳腺癌,结肠直肠癌,卵巢癌和胰腺癌。这是因为这7种癌症通常具有较高的NKG2D 配体表达。
提供用于治疗的细胞和组合物等同于说提供了治疗疾病的方法,包括将这些细胞或组合物给予有需要的受试者的步骤。因此,提供了治疗炎性疾病,癌症或感染的方法,包括施用细胞
特别设想的是在有此需要的受试者中治疗癌症的方法,该方法包括对所述受试者施用工程化免疫细胞的步骤,该免疫细胞包含编码嵌合NKG2D 受体的非天然核酸分子和以下至少一种:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-一种或多种针对嵌合NKG2D受体和/或一种或多种NKG2D配体的抑制剂;
-与嵌合NKG2D受体和/或与一种或多种NKG2D配体融合的结合标签。
甚至更特别设想的是在有此需要的受试者中治疗癌症的方法,其包括向所述受试者施用工程化免疫细胞的步骤,所述免疫细胞包含编码嵌合 NKG2D受体的非天然核酸分子和至少一种:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;
-针对嵌合NKG2D受体和/或一种或多种NKG2D配体的一种或多种抑制剂。
同样地,提供了在有此需要的受试者中治疗癌症的方法,其包括向所述受试者施用组合物的步骤,其中所述组合物包含表达嵌合NKG2D受体的免疫细胞和一种或多种:
-编码已被工程化为可灭活的NKG2D配体的一种或多种内源基因;和 /或
-一种或多种针对嵌合NKG2D受体的抑制剂和/或一种或多种在细胞中被编码为核酸的NKG2D配体,和/或
-与嵌合的NKG2D受体和/或一种或多种NKG2D配体融合的结合标签;和/或
-一种或多种针对嵌合NKG2D受体的抑制剂和/或一种或多种NKG2D 配体(在细胞中未编码为核酸);和/或
-嵌合NKG2D受体下游信号的抑制剂。
免疫细胞对于要对其施用细胞的受试者可以是自体的,或者可以是同种异体的,即源自不同的受试者。
应当理解,尽管本文已经针对根据本发明的细胞和方法讨论了特定的实施方案,特定的构造以及材料和/或分子,但是在不脱离本发明的范围和精神的情况下,可以对形式和细节进行各种改变或修改。提供以下实施例以更好地说明特定实施方案,并且不应认为它们限制了本申请。本申请仅受权利要求书的限制。
实施例
鉴于可以在T细胞中表达过多的NKG2D配体,因此认为消除所有配体表达的基因编辑不是最有效的选择。因此,已经研究了控制杀伤剂的替代策略,以促进NKG2D靶向CAR T细胞疗法的交付。探索了两种不同的方法,即使用信号抑制剂或基于抗体的方法。两者均导致对杀伤剂的抑制,尽管程度不同。
包含磷酸肌醇-3-激酶抑制剂(LY294002)使杀灭杀伤剂的作用减弱,并提供了产生NKR-2CAR T细胞的通用方法。PI3K抑制剂的使用进一步增强了NKR-2驱动的效能,并使细胞转变为记忆表型。涉及CAR自身抗体阻断的靶标特异性方法引起NKR-2CAR T细胞产量的进一步提高,效力降低,CD4/CD8比改变。通过延迟添加封闭抗体,这些因子可以成功地在体外偏斜以增强效力并改变细胞表型。尽管在方法上存在差异,但基于抑制剂或抗体的方法仍产生具有高度相似的表型和体内活性的NKR-2CAR T 细胞。最后,尽管抑制所有NKG2D配体不切实际,但通过瞬时(shRNA) 或永久(Crispr/Cas)方法抑制两个最重要的配体也会产生具有高度相似表型的NKR-2CAR T细胞。
这些结果表明可以使用不同的方法克服靶标驱动的杀伤剂,这些方法可以开发T细胞疗法,而靶标配体的自我表达是限制因素。
材料和方法
抗体和流式细胞仪
细胞用荧光标记的CD3(BD,345766),CD4(BD,345809),CD8 (BD,345772),CD314(BD,558071),CD45RA(BD,550855),CD62L (BD,555544),CD279(eBioscience,12-2799-42),CD19(BD,345791), CD223(eBioscience,25-2239-41),MICA/B(R&D Systems,FAB13001G-100), MICB(R&D Systems,FAB1599G),ULBP1(R&D Systems,FAB1380C),ULBP2/5/6(R&D Systems,FAB1298A),ULBP3(R&D Systems,FAB1517P), ULBP4(R&DSystems:FAB6285A),以及根据标准方案的相应同种型。简而言之,收获细胞并将其重悬于含有DPBS(Life Technologies,A1285801) 的缓冲液中,所述DPBS补充有5%人血清白蛋白(Octapharma, 68209-633-02)和0.01%NaN 3(Sigma,S2002)。将细胞与抗体在4℃下孵育30分钟,用PBS洗涤,然后在Guava easyCyte 6HT细胞仪(Millipore) 上进行分析。在实验使用前将所有抗体滴定。基于FSC/SSC选择活细胞。在所有情况下,均使用未标记的对照和同种型对照。使用FlowJo v10进行分析。
质粒和载体生产
如先前所述(Zhang,Barber,&Sentman,2006)制备嵌合的NKG2D (chNKG2D)构建体,并将其克隆到NcoI和XhoI限制性位点之间的基于 Mo-MLV的核转录病毒载体SFG中。pSFG GFP质粒和pSFG htCD19.1(编码人CD19(tCD19)的截短形式)是Celdara Medical LLC(黎巴嫩,新罕布什尔州,美国)提供的一种礼物。用相关质粒和VSV-G包膜质粒瞬时转染GP2-293包装细胞。在PG2-293细胞中产生的逆转录病毒悬浮液用于自旋转导PG13细胞以获得稳定的生产细胞系。培养物汇合后,从PG13稳定生产细胞中收获用于转导人T淋巴细胞的载体颗粒。使用Retro-XTM qRT-PCR滴定试剂盒(Life Technologies,CL 631453)测量载体滴度。
NKG2D-CAR T细胞生产
根据标准程序通过ficoll密度梯度(VWR,17-5442-03)从健康供体(ImmuneHealth,CHU,Tivoli)的全血中分离外周血单核细胞(PBMC)。简而言之,将全血用DPBS稀释3倍,然后小心地添加到50ml管中的聚蔗糖层上。将试管以500g离心,并小心除去中间层。PBMC随后用DPBS洗涤3次,收获并随后在含有5%人血清(Access Biologicals,515-HI)的X-Vivo 15培养基(Westburg,BE02-061Q)中激活,并补充40ng/ml OKT3(Miltenyi, 170-076-124)和100IU/ml IL-2(Miltenyi,170-076-146)。将细胞在保持在37℃,5%CO
细胞系和培养试剂
慢性粒细胞白血病癌细胞系K562和胰腺癌细胞系PANC-1购自ATCC,分别保存在IMDM(Westburg,LO BE12-722F)或DMEM(Westburg,LO BE12-604F)中,含有178个10%FBS(Gibco,16140071)和1%青霉素/ 链霉素(ThermoFisher Scientific,15140122)直至使用。PI3K抑制剂LY294002 购自Selleck Chemicals(S1105)。NKG2D或相应同种型的抑制抗体购自 BioLegend(抑制抗体(Ultraleaf CD314)克隆:1D11,ImTec Diagnostics NV,320814)。
细胞溶解测定
在有或没有融化的NKR-2 T细胞或tCD19转导的细胞存在或不存在的情况下,在无含有5%的人类血清(HS)的酚红的X-Vivo 15中以1:1的比例在平底96孔板中培养粘附的PANC-1细胞20小时。洗涤T细胞,并用alamarBlue(ThermoFisher Scientific,DAL1025)标记剩余的粘附PANC-1 细胞4小时。使用SpectraMax M2(Molecular Devices)在530nm下使用荧光测量活细胞,并计算相对细胞溶解活性。
细胞因子释放测定
将新鲜的NKR-2 T细胞和/或对照tCD19细胞与K562或PANC-1细胞以1:1的比例在含有5%HS的X-Vivo 15中孵育。孵育24小时后,根据制造商的协议收集上清液并通过ELISA(R&D Systems,SIF50)测定IFN-γ。作为阳性对照,细胞被PMA(Sigma-Aldrich,P8139-5MG)和离子霉素 (Sigma-Aldrich,I0634-1MG)激活。为了评估激活的背景水平,细胞不接受刺激。
抗体抑制测定
将NKR-2 T细胞与1μg/mL的NKG2D封闭抗体,同种型对照或无抗体孵育24小时,然后测量NKR-2 T细胞介导的IFN-γ分泌。类似地,在抗体存在下将NKR-2细胞与癌细胞共培养,并测量细胞因子分泌。
RNA提取和qPCR
用40ng/mL OKT3和IL-2(100IU/mL)刺激PBMC 2天,转导并用 40ng/mL OKT3和IL-2(100IU/mL)再培养两天,然后在IL-2存在下扩增(100IU/mL),直到第8天或第10天,如本文中详细所述。使用RNeasy Mini Kit(Qiagen,74104)每两天分离一次总RNA。使用预先设计的TaqMan 基因表达测定法(Hs04187752_mH,Hs01026642_m1,Hs00607609_mH,Hs00906262_m1,Hs00741286_m1,Hs01584111_mH,Hs04194671_s1, Hs00360941_m1,ThermoFisher Scientific)对NKG2D配体和Light Cycler 480RNA主混合物(Roche,04991885001)进行定量PCR反应。相对表达是基于内部设计的引物(5'-GACGGCGAGCCCTTGG-3'和 5'-GCACGAAAATTTTCTGCTGTCTT-3')和探针 (5'TEX615-TCTCCTTTGAGCTGTTTGCAGACAAGGT-3'BHQ
动物研究
所有体内实验均在Voxcan(Marcy l'Etoile-France)进行。简而言之,在肿瘤注射前24小时(第-1天)辐照NOD/scid IL2rgnull(NSG)小鼠。在第0天,通过IV注射200μl含有5×10
统计分析
在适用的情况下,使用未配对,配对的两个尾部t检验或非参数 Mann-Whitney U检验来评估统计学显着性。当p<0.05时,考虑统计学意义。
转导和体外培养后,在缺乏控制杀伤剂的方法的情况下,与用对照载体转导的T细胞相比,NKR-2 T细胞群体显示出主要的CD8
有趣的是,与tCD19相比,NKR-2 T细胞群体的幼稚细胞相对频率降低(由CD45RA+和CD62L+细胞定义为双阳性),而与提示效应细胞表型增加的tCD19对照T细胞群体相比时(图1C-1D),CD279(PD-1)和CD223 (Lag-3)的频率增加。与癌细胞系共培养后,NKR-2 T细胞表现出高水平的靶细胞诱导的IFN-γ分泌(图3A)和溶细胞活性(图3B),证实了NKR-2 T细胞的功能。但是,与tCD19对照T细胞相比,培养期间和收获时NKR-2 T细胞的产量/倍数扩增(图3C)和生存力(数据未显示)一直降低。
NKG2D配体的表达已在有丝分裂激活过程中在T细胞中得到了证实 (22),而众所周知,由于NKG2D受体的参与,自然杀伤细胞会遭受杀灭性杀伤(23、24)。在一起,这提出了一个问题,即NKR-2 T细胞在转导后是否正在经历杀灭性杀伤剂,从而推定了低细胞产量和活力,CD4/CD8 比偏差和增强的效应记忆分化。为了测试这一点,将来自供体的T细胞用eGFP表达载体转导,并与由相同供体产生的NKR-2 T细胞混合,以探究是否发生了一般性的T细胞杀伤。二十四小时后,NKR-2 T细胞共培养中的 eGFP T细胞明显丢失,这意味着NKR-2T细胞可杀死自体T细胞(图3D)。
为了了解活化T细胞中NKG2D配体的表达谱,将三名健康供体用作T 细胞的来源,无需转导即可进行活化,并进行qPCR分析以检查NKG2D配体mRNA表达谱的动力学(图3E)。在T细胞活化的两天内检测到MICA 和ULBP2 mRNA水平迅速增加。但是,尽管ULBP2 mRNA的水平仍然很高,但MICA又在两天内迅速降至基线。ULBP3的mRNA在整个时间过程中逐渐增加,而MICB、ULBP5、ULBP1或ULBP6的转录本没有相对增加。相反,第4天ULBP4 mRNA略有增加,但随后又降至基础水平。在细胞表面蛋白水平,MICA/B遵循与相应的mRNA类似的表达模式,在第2天出现了短暂的MICA,随后逐渐减少(图3F)。不幸的是,没有合适的抗体可用于检测单个ULBP2/5和6蛋白。然而,用识别所有三个家族成员的抗体观察到的免疫反应性最可能是由于基于mRNA表达谱的ULBP2,这是第2 天后唯一增加的一种。尽管在mRNA 295水平被高度诱导,但是没有检测到细胞表面ULBP3。ULBP4+细胞在第6天达到了阳性峰值,然后按照mRNA表达模式(延迟了两天)在第8天降至基线(图3F)。这些观察结果反映在平均荧光强度的平行动力学中(表1)。
表1.在制造过程之后,三个不同供体的所有配体及其对应的SD的平均荧光强度(MFI)(在第0、2、4、6和8天分析了样品)。.
总之,这些数据暗示在用MICA、ULBP4和推定的ULBP2为有丝分裂活化后,T细胞调节NKG2D配体的表达,尽管它们具有不同的表达动力学,但它们是在蛋白质水平上占优势的NKG2D配体。
配体结合后,NKG2D及其相关的DAP10以类似于CD28的方式启动通过PI3K途径的信号转导(25、26)。因此,我们质疑PI3K信号传导的抑制是否可以在T细胞培养过程中废除NKR-2介导的杀伤剂。为此,将增加浓度的LY294002(作为广泛的PI3K抑制剂)加入到NKR-2产生的转导和扩增阶段。
LY294002的添加导致了几个观察结果。首先,NKR-2T在NKR-2 T细胞上的细胞表面表达以剂量依赖性方式降低,达到对照tCD19 T细胞的水平,为10μM(图4A和图5)。这种减少是可逆的,因为从培养物中除去 LY导致NKG2D表达增加直至未处理的NKR-2T细胞水平(数据未显示)。但是,抑制剂的细胞产量未见明显改善,表明培养过程中的杀伤剂未得到完全控制,或者PI3K抑制剂对增殖具有有害作用(图3B)。为了评估 LY294002是否具有抗增殖作用,在培养过程中用PI3K抑制剂处理了对照tCD19 T细胞。与未处理的tCD19细胞相比,这些对照T细胞的增殖能力明显降低(图6)。
如预期的那样,用PI3K抑制剂制造的NKR-2 T细胞在冷冻保存后或在4℃储存48小时后均显示出细胞活力的增加(图3C,3D)。使用PI3K 抑制剂产生的NKR-2 T细胞以LY294002剂量依赖性方式产生了大量IFN-γ (图7A)。最后,与LY294002培养的NKR-2 T细胞似乎也具有增加的 CD62L
总体而言,PI3K抑制剂的添加对NKR-2 T细胞的生存能力具有有益的影响,这对治疗应用具有吸引力。
在NKR-2 T细胞培养期间包含抗NKG2D抗体(克隆1D11)的初始实验表明,培养结束时的NKR-2 T细胞产量与对照T细胞相当(NKR-2 T细胞的2.6倍扩增,NKR-2 T细胞具有抗体阻断能力的13.8倍扩增(图8)。这表明抗体阻滞可以消除NKG2D目标驱动的杀伤剂。剂量滴定实验表明,2.5μg/mL及以上的抗体浓度可保护tCD19 T细胞358免受NKR-2 T细胞靶向杀伤的作用(图4E)。抗NKG2D抗体还可有效阻断靶细胞参与过程中的 IFN-γ释放(图4F),从而确认NKR-2 T细胞的特异性。使用抗-NKG2D抗体有效杀灭杀伤剂得到以下事实的进一步支持:NKR-2 T细胞产生过程中观察到的IFN-γ释放,可能是由于T细胞杀灭性杀伤剂引起的,通过添加阻断抗体而明显降低了(图4G)。由于小鼠阻断抗体可能通过抗体依赖性细胞介导的细胞毒性(ADCC)引起毒性,因此收获后实现了广泛的洗涤步骤。IgG ELISA和流式细胞术实验表明,收获后在上清液或细胞表面未检测到污染抗体(数据未显示)。为了评估ADCC,在没有ADCC证据的情况下 (数据未显示),在5μg/mL Ab的存在下,将NK细胞与自体NKR-2细胞共培养。这些数据一起表明,抗NKG2D阻断抗体的添加对照NKR-2 T细胞CAR驱动的杀伤剂。
在体外NKR-2细胞扩增过程中对Ab阻断过程的适应性提高了体外和体内活性相等的产量。
使用抗体和PI3K抑制剂过程产生的NKR-2 T细胞之间的比较显示了不同的溶细胞动力学,这意味着Ab过程会改变T细胞特征(图9A)。在比较这两个过程时,观察到的主要差异是CD4/CD8比率,在加入PI3K抑制剂后的第8天,该比率始终偏向CD8群体。有趣的是,阻断NKR-2 T细胞可以拯救CD4+种群,这表明观察到的偏斜的CD4/CD8比值是杀伤剂依赖性的(图9B)。比率差异的最可能解释是由于CD4 T细胞增殖导致比率相对增加,或者是CD8 T细胞去除了CD4 T细胞。
我们假设PI3K抑制剂产生的NKR-2 T细胞裂解活性增强可能是由于较低的CD4/CD8比。为了解决这个问题,我们通过在第6天而不是在转导后立即添加(第4天)添加封闭抗体来适应封闭抗体的过程。这种修饰导致NKR-2 T细胞的产生具有与PI3K抑制剂产生的细胞相似的CD4/CD8 比(图9C),同时保持了与对照T细胞相当的倍数扩展(图9D)。随后,尽管这两个过程之间的某些参数存在细微差异,例如激活标记CD25的表达和记忆表型(数据未显示),但在这两个过程之间,NKR-2 T细胞对靶癌细胞的功能性细胞因子分泌和细胞溶解活性相当(图9E,F)。
在使用NOD SCID的初步体内实验中,接受LY和Ab过程生成的 NKR-2细胞的γ小鼠在已建立的急性髓样白血病(THP-1)肿瘤模型中显示出相似的抗肿瘤活性(输注后8天,通过生物发光观察;tCD19:5.76E10+/- 4.46E10;NKR-2 LY:7.15E08+/-1.01E09;NKR-2 Ab:6.43E08+/-1.25E08;数据未显示)。用Tukey事后检验进行单因素方差分析的方法表明,LY和 tCD19对照细胞之间存在显着差异(p:0.02),而Ab产生的NKR-2与tCD19 相比(p=0.03)。LY和Ab组之间没有观察到差异(p=0.95)。此外,在 NKR-2LY和Ab组中(LY组:1.838+/-1.07%;Ab组:1.792+/-0.56%;数据未显示),在24小时后都观察到了类似的植入,这表明在两组之间的短期植入中未检测到显着差异。
综上所述,这些组合数据表明,采用适应性阻断抗体过程产生的NKR-2 T细胞表现出与使用PI3K抑制剂产生的细胞相似的短期植入和效能。
对NKR2生产的影响是PI3K介导的,而不是由于特定的抑制剂
为了进一步确认LY294002的作用是否确实与其PI3K抑制活性有关,还测试了其他几种PI3K抑制剂,包括渥曼青霉素和CAL-101(艾代拉里斯)。在图10中显示了CAL-101的代表性数据。在倍数扩展(图10A)和细胞生存力(B)方面,Cal-101的表现与封闭抗体相似。像其他PI3K抑制剂一样,细胞似乎会产生更多的干扰素(图10C),这可能有助于提高效力。
还测试了PI3K途径的下游抑制剂(例如糖原合酶激酶3β抑制剂 TWS119或mTOR抑制剂雷帕霉素)。获得的结果是相似的(数据未显示),尽管与PI3K抑制相比,PI3K的抑制似乎导致细胞具有最理想的特性,但与不抑制NKG2D信号传导的细胞相比,其扩增增加。这可能至少部分是由于例如雷帕霉素的毒性。
已知NKG2D可以与8种不同的应激诱导配体(NKG2DL)结合,这些配体广泛存在于肿瘤中,但在健康组织中却不存在。我们旨在鉴定激活后在T细胞上表达的关键NKG2DL。PBMC在第0天用OKT3和抗CD3 抗体激活。每隔一天在CD4+和CD8+T细胞表面评估八个NKG2DL的表达(图11)。激活后,MICA/B和MICB在CD4和CD8 T细胞的细胞表面上调,表达在激活后的2-4天达到峰值。随后,表达下降直至第10天。ULBP1 和ULBP2低水平表达,而ULBP2仅限于CD4+T细胞(图11)。几乎没有证据表明其他配体在T细胞上表达。
并行研究确定了MICA和MICB是NKG2D CAR的主要刺激物(数据未显示),这使我们提出MICA和MICB是负责T细胞杀伤的主要NKG2DL。
然后,我们通过单个shRNA探索了针对MICA和MICB的特异性靶向,由于存在高度的序列相似性,因此可行。用不同的shRNA转导原代T细胞,并评估MICA和MICB蛋白表达。该屏幕鉴定了两个shRNA,以减少MICA 和MICB的细胞表面表达(数据未显示)。接下来,我们设计了一个编码NKG2D CAR并共表达候选shRNA的逆转录病毒载体。我们通过细胞扩增评估了用基于NKG2D的CAR改造的T细胞或共表达shRNA的T细胞中的杀伤水平(图12)。与没有shRNA的细胞相比,编码NKG2D CAR和 shRNA的单个逆转录病毒载体的工程改造产生的T细胞在体外杀伤力大大降低(图12),并提高了NKG2D CAR T细胞的扩增速率,使其接近对照T 细胞。
随后,我们评估了带有和不带有靶向MICA/B的shRNA的基于 NKG2D的CAR T细胞的体外抗肿瘤功效。缺少shRNA的细胞在效应子与靶标(E:T)的不同比率下显示出对AML HL-60细胞的特异性杀伤。但是, MICA/B shRNA#2或#4的共表达改善了癌细胞的杀伤力,尤其是在较低的E:T比下(图13A)。共培养后24小时,shRNA表达提高了T细胞的回收率,杀伤力降低可能是杀伤剂的减少(图13B)。
总之,敲除T细胞中的NKG2D配体显示出与NKG2D抑制或PI3K抑制相同的改善的制造结果。
使用Crispr/Cas永久禁用MICA和MICB时,获得了相似的数据(数据未显示)。一个显着的区别是,shRNA抑制可以瞬时方式完成(例如,仅在制造过程中进行),而基因敲除(此处使用Crispr/Cas)则是永久的。根据上下文,这可能是合乎需要的,也可能不是。
讨论
CD19 CAR T细胞疗法在B细胞急性淋巴细胞白血病(bALL)和弥漫性大B细胞淋巴瘤(DLBCL)中的最新批准为该方法提供了强有力的临床验证,并为发展CD19+B恶性肿瘤以外的CAR T细胞疗法提供了动力。目标的选择对于治疗成功至关重要。迄今为止,肿瘤排他性抗原的鉴定一直具有挑战性。最近一项有关蛋白质组学和基因组学方法在急性髓细胞白血病(AML)中的生物信息学研究,结果表明,没有肿瘤特异性的细胞表面抗原,基于抗体的CAR T靶向AML可能需要复杂的组合靶向策略(29)。因此,目前测试的大多数靶标抗原是肿瘤相关抗原,其中靶标的表达也可能存在于正常的健康细胞上。有很多例子包括B19恶性肿瘤的CD19(3,4), AML(30)中的CD123,CD7(14)和一系列实体瘤中的CEA(31)。但是,在靶抗原可能在T细胞上永久性或瞬时表达的情况下,这会造成问题,因为CAR工程化的T细胞随后很可能会靶向自身和培养物中的其他抗原,从而导致T细胞杀伤剂,实际上转化为降低的电池产量或什至为零。
现在,基因编辑提供了一种与临床相关的方法来防止特定蛋白质的表达,从而使CAR T细胞能够扩增,否则CD特异性CAR T细胞(14)可能会遭受杀伤剂的侵袭。然而,基于NKG2D的CAR的多靶点特异性意味着,从表面上看,基因编辑以消除原代T细胞中的8种不同蛋白质以及有效表达CAR构建体的可能性,尽管如此,但要在临床上付诸实践具有挑战性。因此,本文提出了其他策略以避免在细胞培养过程中发生杀伤剂,从而能够产生和递送聚焦于NKG2D的CAR T细胞疗法。
在这些实施例中,PI3K抑制剂通过减少细胞表面上的NKG2D表达提供了一种控制杀伤剂的通用方法。据我们所知,这是第一次报告这种观察。 PI3K抑制剂治疗后造成细胞表面NKG2D丧失的机制目前未知。已知 NKG2D细胞表面定位是通过其与DAP10的缔合来介导的(Upsahw等人, 2006)。细胞表面NKG2D丧失的一种假设可能是DAP10受PI3K抑制剂治疗的影响(例如,降低RNA水平,抑制转录,甚至抑制翻译后修饰(例如糖基化),这是DAP10与NKG2D结合所必需的(Park YP et al.,2011, Blood))。这些可能最终导致阻止NKG2D-DAP10复合物在细胞表面表达,从而抑制杀伤剂。但是,PI3K抑制也与细胞增殖减少有关(Aagaard-Tillery KM,Jelinek DF.Phosphatidylinositol 3-kinase activation innormal human B lymphocytes.J Immunol.1996;156:4543-4554.11.Fruman DA,SnapperSB, Yballe CM,et al.Impaired B cell development and proliferation in absenceof phosphoinositide 3-kinase p85alpha.Science.1999;283:393-397.12.Shi J,Cinek T,Truitt KE,Imboden JB.Wortmannin,a phosphatidylinositol 3-kinaseinhibitor,blocks antigen-mediated,but not CD3 monoclonal antibody-induced,activation of murine CD4 T cells.J Immunol.1997;158:4688-4695.13.Truitt KE,Shi J,Gibson S,Segal LG,Mills GB,Imboden JB.CD28 delivers costimulatorysignals independently of its association with phosphatidylinositol 3-kinase.JImmunol.1995;155:4702-4710.),因此,在需要相对低剂量的CAR T细胞的情况下,这种抑制剂方法提供了一种有效的解决方案来控制T细胞杀灭性杀伤剂,但是在需要大量细胞的情况下,使用这种方法的局限性更大。
在制造NKR-2 T细胞过程中抑制杀伤分子的另一种方法是在扩增阶段使用特异性阻断抗体。这使得能够控制T细胞杀伤分子并将T细胞扩增至与对照tCD19 T细胞相同的水平。该方法在很大程度上取决于所使用的抗体,因为它需要在不诱导CAR活化的情况下阻断杀灭杀伤剂(如在缺乏靶抗原的情况下培养过程中细胞因子产生的水平大大降低所示)。特异性封闭抗体的添加提供了使NKR-2 T细胞大规模扩增的解决方案。
与阻断抗体过程有关的一个主要问题是,很有可能用抗体修饰扩增的 NKR-2CART细胞,从而在输注后通过抗体依赖性清除机制迅速消除细胞。然而,分析清楚地表明,NKR-2细胞缺乏抗CD314抗体涂层,并进行了重新表达分析,这表明抗体结合似乎会导致NKG2D和NKR-2 CAR从细胞表面损失。与目标配体结合后,内源性NKG2D已显示出快速内在化,作为控制NK细胞活化的机制。此处的观察结果表明,在NKR-2的背景下,CAR 似乎也被内在化了。从过继T细胞疗法的观点来看,这是有利的,因为不需要开发去除结合的抗体的特定方法。
除了观察到的过程之间的差异以及PI3K抑制剂的影响外,这些临床前数据首次证实NKR-2在AML小鼠模型中是有效的疗法。此外,这些结果与其他研究一致,在这些研究中,缺乏预处理以及多次注射NKR-2是导致根除肿瘤和治疗小鼠长期存活的标准(Zhang etal.Cancer Res. 2007;67(22):11029-36;Barber et al.,Gene Ther.2011;18(5):509-16)。
此外,尽管敲除或敲除所有NKG2D配体被认为是不可行或不可行的,但已通过shRNA或CRISPR对T细胞中两种最常见的配体进行了抑制,从而实现了类似的产量提高,这表明,即使部分抑制NKG2D信号传导也可以改善杀伤力。
综上所述,这项工作表明可以通过通用方法(作用于下游信号传导)(例如PI3K抑制)或受体特异性方法(例如阻断抗体或消除受体配体)来管理 T细胞杀伤剂。特别是,PI3K抑制剂和封闭抗体方法可用于生成杀伤水平较低的免疫细胞产物,并且每种方法均具有潜在的优势,可用于生成T细胞产物,而其他方法例如基因编辑以消除T细胞群体中的靶标,具有挑战性,或者目前尚不可行或不可取。
参考文献
1.Fesnak AD,June CH,Levine BL(2016)Engineered T cells:the promise andchallenges of cancer immunotherapy.Nat Rev Cancer.16:566-81. doi:10.1038/nrc.2016.97
2.Brenner MK(2017)Next Steps in the CAR Journey of a ThousandMiles.Mol Ther.25:2226-7.doi:10.1016/j.ymthe.2017.09.013
3.Davila ML,Brentjens RJ(2016)CD19-Targeted CAR T cells as novelcancer immunotherapy for relapsed or refractory B-cell acute lymphoblasticleukemia.Clin Adv Hematol Oncol.14:802-8.
4.Kochenderfer JN,Somerville RPT,Lu T et al.(2017)Long-DurationComplete Remissions of Diffuse Large B Cell Lymphoma after Anti-CD19 ChimericAntigen Receptor T Cell Therapy.Mol Ther.25:2245-53.doi: 10.1016/j.ymthe.2017.07.004
5.Park JH,Geyer MB,Brentjens RJ(2016)CD19-targeted CAR T-celltherapeutics for hematologic malignancies:interpreting clinical outcomes todate.Blood.127:3312-20.doi:10.1182/blood-2016-02-629063
6.Rossig C(2017)CAR T cell immunotherapy in hematology and beyond.Clin Immunol.doi:10.1016/j.clim.2017.09.016
7.Turtle CJ,Hay KA,Hanafi LA et al.(2017)Durable Molecular Remissionsin Chronic Lymphocytic Leukemia Treated With CD19-Specific Chimeric AntigenReceptor-Modified T Cells After Failure of Ibrutinib.J Clin Oncol.35:3010-20.doi:10.1200/JCO.2017.72.8519
8.Rezvani K,Rouce R,Liu E,Shpall E(2017)Engineering Natural KillerCells for Cancer Immunotherapy.Mol Ther.25:1769-81.doi: 10.1016/j.ymthe.2017.06.012
9.Adair PR,Kim YC,Zhang AH,Yoon J,Scott DW(2017)Human Tregs MadeAntigen Specific by Gene Modification:The Power to Treat Autoimmunity andAntidrug Antibodies with Precision.Front Immunol.8: 1117.doi:10.3389/fimmu.2017.01117
10.Guest RD,Kirillova N,Mowbray S et al.(2014)Definition andapplication of good manufacturing process-compliant production of CEA-specific chimeric antigen receptor expressing T-cells for phase I/II clinicaltrial.Cancer Immunol Immunother.63:133-45.doi: 10.1007/s00262-013-1492-9
11.Levine BL,Miskin J,Wonnacott K,Keir C(2017)Global Manufacturing ofCAR T Cell Therapy.Mol Ther Methods Clin Dev.4:92-101. doi:10.1016/j.omtm.2016.12.006
12.Wang X,Riviere I(2016)Clinical manufacturing of CAR T cells:foundation of a promising therapy.Mol Ther Oncolytics.3:16015.doi: 10.1038/mto.2016.15
13.Callard RE,Stark J,Yates AJ(2003)Fratricide:a mechanism for Tmemory-cell homeostasis.Trends Immunol.24:370-5.
14.Gomes-Silva D,Srinivasan M,Sharma S et al.(2017)CD7-edited T cellsexpressing a CD7-specific CAR for the therapy of T-cell malignancies.Blood.130:285-96.doi:10.1182/blood-2017-01-761320
15.Mamonkin M,Rouce RH,Tashiro H,Brenner MK(2015)A T-cell-directedchimeric antigen receptor for the selective treatment of T-cellmalignancies.Blood.126:983-92.doi:10.1182/blood-2015-02-629527
16.Leisegang M,Wilde S,Spranger S,Milosevic S,Frankenberger B, UckertW,Schendel DJ(2010)MHC-restricted fratricide of human lymphocytes expressingsurvivin-specific transgenic T cell receptors.J Clin Invest.120:3869-77.doi:10.1172/JCI43437
17.Schendel DJ,Frankenberger B(2013)Limitations for TCR gene therapyby MHC-restricted fratricide and TCR-mediated hematopoietic stem celltoxicity.Oncoimmunology.2:e22410.doi:10.4161/onci.22410
18.Sentman CL,Meehan KR(2014)NKG2D CARs as cell therapy forcancer.Cancer J.20:156-9.doi:10.1097/PPO.0000000000000029
19.Lanier LL(2015)NKG2D Receptor and Its Ligands in HostDefense.Cancer Immunol Res.3:575-82.doi: 10.1158/2326-6066.CIR-15-0098
20.Spear P,Wu MR,Sentman ML,Sentman CL(2013)NKG2D ligands astherapeutic targets.Cancer Immun.13:8.
21.Demoulin B,Cook WJ,Murad J,Graber DJ,Sentman ML,Lonez C, GilhamDE,Sentman CL,Agaugue S(2017)Exploiting natural killer group 2D receptors forCAR T-cell therapy.Future Oncol.13:1593-605.doi: 10.2217/fon-2017-0102
22.Molinero LL,Fuertes MB,Rabinovich GA,Fainboim L,Zwirner NW(2002)Activation-induced expression of MICA on T lymphocytes involves engagement ofCD3 and CD28.J Leukoc Biol.71:791-7.
23.Madera S,Rapp M,Firth MA,Beilke JN,Lanier LL,Sun JC(2016) Type IIFN promotes NK cell expansion during viral infection by protecting NK cellsagainst fratricide.J Exp Med.213:225-33.doi: 10.1084/jem.20150712
24.Nakamura K,Nakayama M,Kawano M,Amagai R,Ishii T,Harigae H,Ogasawara K(2013)Fratricide of natural killer cells dressed with tumor-derived NKG2D ligand.Proc Natl Acad Sci U S A.110:9421-6.doi: 10.1073/pnas.1300140110
25.Smith-Garvin JE,Koretzky GA,Jordan MS(2009)T cell activation. AnnuRev Immunol.27:591-619.doi: 10.1146/annurev.immunol.021908.132706
26.Upshaw JL,Arneson LN,Schoon RA,Dick CJ,Billadeau DD, Leibson PJ(2006)NKG2D-mediated signaling requires a DAP10-bound Grb2-Vav1 intermediateand phosphatidylinositol-3-kinase in human natural killer cells.NatImmunol.7:524-32.doi:10.1038/ni1325
27.Abu Eid R,Ahmad S,Lin Y et al.(2017)Enhanced Therapeutic Efficacyand Memory of Tumor-Specific CD8 T Cells by Ex Vivo PI3K-deltaInhibition.Cancer Res.77:4135-45.doi:10.1158/0008-5472.CAN-16-1925
28.Perkins MR,Grande S,Hamel A et al.(2015)Manufacturing an EnhancedCAR T Cell Product By Inhibition of the PI3K/Akt Pathway During T CellExpansion Results in Improved In Vivo Efficacy of Anti-BCMA CAR TCells.Blood.126:1893.
29.Perna F,Berman SH,Soni RK,Mansilla-Soto J,Eyquem J,Hamieh M,Hendrickson RC,Brennan CW,Sadelain M(2017)Integrating Proteomics andTranscriptomics for Systematic Combinatorial Chimeric Antigen ReceptorTherapy of AML.Cancer Cell.32:506-19 e5.doi:10.1016/j.ccell.2017.09.004
30.Mardiros A,Dos Santos C,McDonald T et al.(2013)T cells expressingCD123-specific chimeric antigen receptors exhibit specific cytolytic effectorfunctions and antitumor effects against human acute myeloid leukemia.Blood.122:3138-48.doi:10.1182/blood-2012-12-474056
31.Thistlethwaite FC,Gilham DE,Guest RD et al.(2017)The clinicalefficacy of first-generation carcinoembryonic antigen(CEACAM5)-specific CAR Tcells is limited by poor persistence and transient pre-conditioning-dependentrespiratory toxicity.Cancer Immunol Immunother. 66:1425-36.doi:10.1007/s00262-017-2034-7
32.Barber A,Sentman CL.NKG2D receptor regulates human effector T-cellcytokine production.Blood(2011)117:6571–81. doi:10.1182/blood-2011-01-329417。
- 减少表达基于NKG2D的受体的免疫细胞的杀伤剂
- 表达免疫细胞刺激受体激动剂的腺病毒
