动物细胞增殖促进剂、动物细胞培养用培养基和动物细胞培养装置
文献发布时间:2023-06-19 11:32:36
技术领域
本发明涉及一种动物细胞增殖促进剂、动物细胞培养用培养基和动物细胞培养装置。
背景技术
在动物细胞的培养中,一般使用作为具有维持细胞增殖的功能的因子,在培养基中添加有胎牛血清等的血清培养基或代替血清而添加有激素或增殖因子等的无血清培养基。
除这些因子以外,在日本特开2013-247927号公报中公开了米糠提取物对培养动物细胞具有增殖促进作用。另外,在日本特开2011-182736号公报中公开了:在添加有β-伴大豆球蛋白浓缩物的水解物的培养基中培养动物细胞时,可以提高细胞增殖率。此外,在日本特开平7-188292号公报中公开了:源自人的成纤维细胞的培养上清液中所含的糖蛋白促进人血管内皮细胞和肝实质细胞的增殖。此外,在日本特开平5-301893号公报中公开了:培养源自人的胶质瘤细胞系得到的细胞培养上清液中所含的蛋白质具有对胶质细胞或成纤维细胞的增殖促进效果。
发明内容
发明所要解决的技术问题
本发明的目的在于,提供一种新的动物细胞增殖促进剂、动物细胞培养用培养基和动物细胞培养装置。
用于解决技术问题的技术方案
本发明涉及的一个实施方式为一种动物细胞增殖促进剂,其含有鸟类或爬行类的卵的胚膜的培养上清液作为有效成分。上述卵可以为鸡蛋。上述动物细胞增殖促进剂可以为对于肌肉系细胞、内脏系细胞或神经系细胞的细胞增殖剂,也可以为对于肝脏细胞、胰腺细胞、输卵管细胞的细胞增殖剂。
本发明涉及的另一个实施方式为一种细胞培养用培养基,其含有上述任一项所述的细胞增殖促进剂。
本发明涉及的又一个实施方式为一种动物细胞培养装置,其包括:第一培养槽,培养源自鸟类或爬行类的卵的胚膜的细胞;第二培养槽,培养以增殖为目的的动物细胞;第一流路,使培养基从第一培养槽向第二培养槽流动;第二流路,使培养基从第二培养槽向第一培养槽流动;培养基流量控制部,以第一培养槽、第一流路、第二培养槽、第二流路的顺序使细胞培养用培养基回流,根据上述动物细胞和/或上述细胞培养用培养基的状态,控制第一流路和第二流路中的上述细胞培养用培养基的流动。另外,该动物细胞培养装置还具有:培养基导入通路,其用于将新鲜的细胞培养用培养基导入上述回流的上述细胞培养用培养基;和培养基除去通路,其用于从上述回流的上述细胞培养用培养基中除去培养后的细胞培养用培养基,上述培养基流量控制部也可以根据上述动物细胞和/或上述细胞培养用培养基的状态,控制来自上述培养基导入通路的上述新鲜的细胞培养用培养基的导入和来自上述培养基除去通路的上述培养后的细胞培养用培养基的除去。
==与相关文献的交叉引用==
本申请基于2018年11月8日所申请的日本专利申请2018-210910,主张优先权,通过引用该基础申请,将其包含于本说明书中。
附图说明
图1是本发明的一个实施方式中的细胞增殖装置的示意图。
图2是表示在本发明的一个实施例中,在将鸡胚绒毛尿囊膜的培养上清液添加于培养基的情况下,源自图中所示的组织(胃、骨骼肌、心脏、胆囊、肠、脑、法氏囊和骨)的细胞的细胞增殖被促进的观察结果的照片。
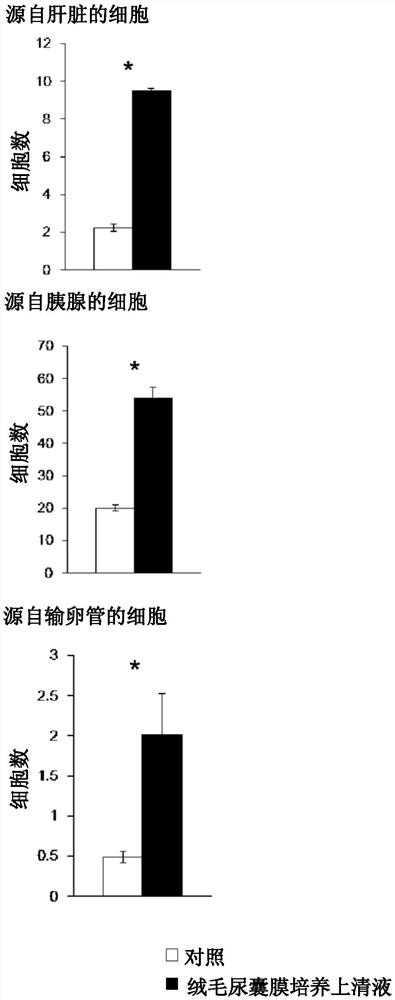
图3是在本发明的一个实施例中,对源自肝脏、胰腺和输卵管的细胞,定量地表示图1的结果的图表。
图4是表示在本发明的一个实施例中,在将鸡蛋卵黄囊的培养上清液添加于培养基的情况下,源自图中所示的组织(胃、肌肉、心脏、肝脏、肠、脑、法氏囊和骨)的细胞的细胞增殖被促进的图表。
具体实施方式
本发明的目的、特征、优点及其思想,通过本说明书的记载,对本领域技术人员而言是显而易见的,如果是本领域技术人员,则可以由本说明书的记载容易地再现本发明。以下所记载的发明的实施方式和具体的实施例等表示本发明的优选的实施方式,是为了例示或说明而示出的,本发明并不限定于这些。在本说明书中所公开的本发明的意图和范围内,基于本说明书的记载,可以进行各种改变以及修饰,这对本领域技术人员而言是显而易见的。
==动物细胞增殖促进剂==
本发明的动物细胞增殖促进剂含有鸟类或爬行类的卵的胚膜的培养上清液作为有效成分。
作为采集胚膜的卵的来源的鸟类或爬行类可以例示鹌鹑、鸡、蜥蜴、蛇、鳄鱼、龟等,但并不限定于这些,只要是具有卵的胚膜的鸟类或爬行类的动物即可。
在此,胚膜是指:在鸟类、爬行类的发育过程中,形成于胚体外,发挥胚的保护、营养、呼吸等功能,在孵化或出生后的身体的构建中不参与的膜组织,可列举例如:位于胚的最外侧的浆膜(绒毛膜)、包裹胚体的羊膜、形成尿囊的尿囊膜、浆膜和尿囊膜部分愈合而成的绒毛尿囊膜(chorioallantoic membrane:CAM)、包裹卵黄的卵黄囊等。
胚膜的培养上清液是指将胚膜分离并培养得到的培养基。培养的胚膜可以培养上述的浆膜、羊膜、尿囊膜、尿囊绒膜、卵黄囊等膜中的一种,也可以将多种混合来培养。
胚膜可以用公知的方法从卵中采集(例如,参照一岛英治:化学和生物,13卷8号,p489-497(1975)等)。例如,具体而言,可以用如下的方法分离胚膜。首先,将受精卵在适于人工孵化的条件下孵育规定时间后,将卵壳打破,(1)尿囊膜可以通过取出从胚的消化管后部的腹侧产生的膨大的膜而得到;(2)羊膜可以通过取出存在于胎儿的周围的没有血管的透明的膜组织而得到;(3)卵黄囊可以通过取出包裹卵黄的膜组织而得到;(4)浆膜可以通过取出包围卵内的全部要素的位于最外侧的膜组织而得到。此外,延长孵育的时间时,浆膜和尿囊膜部分地融合,成为绒毛尿囊膜。在该时期,绒毛尿囊膜可以通过取出与卵壳接触、存在血管的膜组织而得到。孵育的时间根据各动物、另外根据目标膜组织而适当确定最适时间即可,例如鸡蛋的情况下,优选4天~21天,更优选10天~18天,进一步优选13天~15天。将这些胚膜进行培养时,可以以膜状的状态直接进行培养,也可以通过物理性地将膜破碎、或用蛋白酶(例如胶原酶、弹性蛋白酶、分散酶(中性蛋白酶)、木瓜蛋白酶等)进行酶处理,从胚膜将源自胚膜的细胞分离而培养。
在胚膜的培养中,可以使用在通常的动物细胞培养中利用的培养基,可以例示例如DMEM、F12等,但并不限定于这些。在该培养基中,可以添加作为培养基添加剂通常所配合的补充剂。培养条件也可以使用用于通常的动物细胞培养的条件,典型而言,使用碳酸缓冲剂系的培养基,在5%CO
在添加有该培养上清液的细胞培养用培养基中培养的动物细胞的种类没有特别限定,可以例示:平滑肌细胞、心肌细胞、骨骼肌细胞等肌肉系细胞、心脏细胞、肝细胞、源自胃的细胞、源自肠的细胞等内脏系细胞、或神经细胞或胶质细胞等神经系细胞。细胞来源的动物种类也没有特别限定,可以例示人、小鼠、大鼠、猴子、猪等。
这样,通过在动物细胞培养用培养基中添加将源自胚膜的细胞进行培养而得到的培养上清液,可以促进培养的动物细胞的增殖。因此,可以将该培养上清液用作动物细胞增殖促进剂。
此外,将源自胚膜的细胞的培养上清液用作动物细胞增殖促进剂的情况下,也可以同时使用其它细胞增殖因子。
==细胞增殖装置==
本发明的细胞增殖装置包括:第一培养槽,培养源自鸟类或爬行类的卵的胚膜的细胞;第二培养槽,培养以增殖为目的的动物细胞;第一流路,使培养基从第一培养槽向第二培养槽流动;第二流路,使培养基从第二培养槽向第一培养槽流动;和培养基流量控制部,以第一培养槽、第一流路、第二培养槽、第二流路的顺序使细胞培养用培养基回流,根据上述动物细胞和/或上述细胞培养用培养基的状态,控制第一流路和第二流路中的上述细胞培养用培养基的流动。
在第一培养槽中,按照如上所述的在制备动物细胞增殖促进剂时进行的源自胚膜的细胞的培养方法进行培养。在第二培养槽中,按照如上所述的在添加有动物细胞增殖促进剂的培养基中培养动物细胞的培养方法进行培养。
第一培养槽和第二培养槽由第一流路和第二流路被流体连接。例如,如图1的(A)所示,第一培养槽11和第二培养槽12可以由第一流路21和第二流路22直接连接。只要第一培养槽11和第二培养槽12进行流体连接,也可以设置1个或多个其它培养槽,其它培养槽和第一培养槽11或第二培养槽12的连接也可以考虑各种构成。例如,可以如图1的(B)所示,在第一流路21的中途设置第三培养槽13,流路从第一培养槽11通过第三培养槽13而连接于第二培养槽12。或者,可以如图1的(C)所示,与第二培养槽12独立地设置第三培养槽13,流路也与第一流路21和第二流路22不同地设置将第一培养槽11和第三培养槽13进行流体连接的第三流路31和第四流路32。(B)或(C)的情况下,通过适当地选择在第三培养槽13中培养的细胞,该细胞可以受到第一培养槽11中的培养或第二培养槽12中的培养的影响,或影响这些培养。
在此,第一培养槽11中的培养或第二培养槽12以外的培养槽中的培养受到第一培养槽中的培养或第二培养槽中的培养的影响、或者对第一培养槽中的培养或第二培养槽中的培养产生的影响可以考虑各种影响,可以例示例如:细胞的增殖、细胞的分化、组织的形态形成、培养基的pH调节、培养基中的细菌混入的预防等。
例如,具体而言,通过在第三培养槽13中放入与第二培养槽12中细胞不同的且在培养源自胚膜的细胞的培养基中能够增殖的细胞,可以在第二培养槽12和第三培养槽13中同时使细胞增殖。或者,通过在第三培养槽13中培养与第一培养槽11不同的源自胚膜的细胞,可以进一步促进在第二培养槽12中培养的细胞的增殖。或者,在第三培养槽13中培养的细胞也可以为在培养源自胚膜的细胞的培养基中能够增殖、且分泌使在第二培养槽12中培养的细胞增殖的因子的细胞。
槽和槽之间用管连接,该管可以形成流路。另外,可以在这些管上设置阀。培养基流量控制部可以监视培养的细胞和/或细胞培养用培养基的状态,根据该状态,经由该阀控制各流路中的细胞培养用培养基的流动(例如流速、流量等)。
阀的结构没有特别限定,只要是凸缘形、螺纹形等公知的结构即可,阀的调整方法也没有特别限定,只要是空气驱动式、电磁式、电动式、油压式等公知的调整方法即可。另外,为了防止细胞培养用培养基在管内的逆流,在管中也可以具备逆止阀。
培养基流量控制部所监视的细胞和/或细胞培养用培养基的状态可以例示例如细胞的增殖的情形,或细胞的分化的情形、培养基的pH等,但并不限定于这些。细胞的增殖的情形可以通过例如对每单位面积的细胞数进行计数、或测定细胞相对于培养皿的底面积所占的面积的比例等而进行判断。细胞的分化的情形例如可以通过将进行分化时表达的进行荧光发光的标记基因预先导入细胞,通过测定荧光来判断。培养基的pH例如可以直接测定pH,或可以将因pH而变化的色素添加于培养基,根据其颜色来进行判断。
实施例
(1)绒毛尿囊膜或卵黄囊的分离方法
用于试验的绒毛尿囊膜或卵黄囊通过以下的方法分别进行分离。
将鸡的受精卵在37℃下孵育,在14天后打破蛋壳,将与蛋壳接触且存在血管的膜组织作为绒毛尿囊膜取出,同时,另一方面,将包裹蛋黄的膜组织作为卵黄囊取出,将这些膜组织分别浸渍于HBSS(Hank’s Balanced Salt Solution,Hanks平衡盐溶液)中。用镊子等将这些膜组织物理性地切碎之后,进行离心分离,除去上清液。
在分离的各膜组织中加入胶原酶溶液(200IU/mL),在37℃下保持1小时后,再次进行离心分离,除去其上清液。在该胶原酶处理过的各膜组织中加入HBSS,用40μm的过滤器过滤,通过将得到的滤液进行离心分离并除去上清液,而回收源自绒毛尿囊膜的细胞或源自卵黄囊的细胞。此外,在保存源自绒毛尿囊膜的细胞或源自卵黄囊的细胞的情况下,通过将其悬浮于细胞冻结液(10%DMSO溶液),缓慢地冷却至-80℃而冻结,在-80℃下进行保存。
(2)绒毛尿囊膜或卵黄囊的培养方法
在含有10%胎牛血清(FBS)和1%青霉素-链霉素溶液(PS)溶液的DMEM(以下称为含FBS·PS的DMEM)中加入在(1)中得到的源自绒毛尿囊膜的细胞或源自卵黄囊的细胞,以4×10
(3)培养上清液的回收方法
将通过(2)所示的培养方法制备得到的绒毛尿囊膜培养液或卵黄囊培养液使用0.22μm的过滤器过滤,将得到的滤液作为动物细胞增殖促进剂用于动物细胞培养。此外,在保存制备得到的培养上清液的情况下,在-20℃冻结保存。
(4)动物细胞培养
(4-1)来自各组织的细胞的分离方法
用于培养的鸡细胞通过以下的方法进行分离。
首先,将鸡的受精卵在37℃下孵育,在14天后打破蛋壳,取出鸡胚。从该鸡14天胚中分离胃、骨骼肌、心脏、胆囊、肠、脑、法氏囊和骨,分别浸渍于HBSS溶液。然后,用与(1)同样的方法将源自各组织的细胞进行分离。
(4-2)来自各组织的细胞的培养方法
源自各组织的细胞使用在含FBS·PS的DMEM中加入有等量的(3)中制备的绒毛尿囊膜培养上清液或卵黄囊培养上清液的培养用培养基,用与(2)同样的方法进行培养。此外,作为对照,使用不添加绒毛尿囊膜培养上清液或卵黄囊培养上清液而仅含FBS·PS的DMEM的培养基,除此之外,使用在相同的条件下进行培养的细胞。
(4-3)各培养中的细胞数的测量方法
对源自肝脏、胰腺、输卵管、胃、肌肉、心脏、肠、脑、法氏囊和骨的细胞,定量地评价(4-2)的结果。在此,源自各组织的细胞数通过以下的方法进行测量。
首先,将源自各组织的细胞的培养液从培养皿中除去,加入PBS将细胞分别进行清洗。去掉PBS之后,加入胰蛋白酶-EDTA溶液,在37℃下孵育1~2分钟而使细胞剥离后,加入含FBS·PS的DMEM使反应停止。将含有剥离的细胞的溶液全部回收,通过将其进行离心分离而得到细胞。此外,在该细胞中加入FBS·PS进行悬浮,将该细胞悬浮液20μL和台盼蓝溶液20μL进行混合。在该细胞悬浮液中,在显微镜下使用血细胞计数器测量没有被台盼蓝染色的活细胞的数。
(4-4)结果
首先,用相位差显微镜观察在添加有绒毛尿囊膜培养上清液的培养基中培养了约3~5天时的细胞。图2中示出该细胞的照片,无论在培养何种细胞的情况下,添加有(3)中制备的绒毛尿囊膜培养上清液的情况与未添加绒毛尿囊膜培养上清液的情况相比,细胞数都多。其显示:通过添加的绒毛尿囊膜培养上清液,促进了细胞的增殖。
为了定量地表示该结果,将对源自肝脏、胰腺、输卵管的细胞,使用绒毛尿囊膜培养上清液,在3个培养皿中进行了实验时的细胞数的平均和标准误差示于图3,在源自肝脏、胰腺、输卵管的细胞的任一种情况下,都是添加有绒毛尿囊膜培养上清液的一方与未添加绒毛尿囊膜培养上清液的情况相比,细胞增殖到约2.5~4倍。
接着,使用添加有卵黄囊培养上清液的培养基,关于对源自胃、肌肉、心脏、肝脏、肠、脑、法氏囊和骨的细胞的增殖促进效果也同样地进行研究(n=2),结果,如图4所示,在任一种情况下,添加有卵黄囊培养上清液的情况与未添加绒毛尿囊膜培养上清液的情况相比,细胞数都多。其显示:通过添加的卵黄囊培养上清液,促进了细胞的增殖。
产业上的可利用性
根据本发明,能够提供新的动物细胞增殖促进剂、动物细胞培养用培养基和动物细胞培养装置。
- 动物细胞增殖促进剂、动物细胞培养用培养基和动物细胞培养装置
- 家畜组织细胞制备动物细胞培养液的方法及其制得的动物细胞培养液的应用
