具有缓解胰岛素抵抗功能的组合物及其应用
文献发布时间:2023-06-19 13:46:35
技术领域
本发明涉及具有缓解胰岛素抵抗功能的组合物及其应用,属于微生物技术及微生物添加剂技术领域。
背景技术
胰岛素抵抗(insulin resistance,IR)是指胰岛素靶器官(骨骼肌、肝脏和白色脂肪组织)的胰岛素敏感性下降,导致机体葡萄糖摄取和利用的效率下降,胰岛素代偿性分泌增多的一种症状。流行病学研究表明,胰岛素抵抗与高血压、冠心病、脑血管疾病及2型糖尿病等多种慢病的发生发展关系密切。二甲双胍是糖尿病前期和胰岛素敏感性受损的一线药物,可以通过提高IRS酪氨酸磷酸化、刺激GLUT4从胞质向细胞膜转位进而有效降低肝脏、肌肉和脂肪组织的胰岛素抵抗。然而药物治疗会导致外周水肿、体重增加、心衰加重、抑制机体免疫功能及血小板凝集等副作用。近年来有大量研究表明,益生元和肠道有益菌具有治疗胰岛素抵抗及其相关代谢性疾病且无明显副作用。在动物和临床研究中,多种益生元和肠道有益菌的单独使用或联合使用能不同程度地缓解胰岛素抵抗,表现出极强的保健功能。
临床研究结果表明,肥胖症和2型糖尿病患者肠道中的长双歧杆菌和普拉梭菌等肠道有益菌的数量明显低于正常人。长双歧杆菌和普拉梭菌可以显著改善代谢性疾病的胰岛素抵抗程度及糖脂代谢水平。但其对胰岛素抵抗程度的改善能力有限。目前,国内外虽有采用长双歧杆菌来达到缓解胰岛素抵抗目的的报道,但是长双歧杆菌在宿主肠道中的定殖率较低,其缓解胰岛素抵抗的功能没有充分发挥。
因此,如何得到一种有效的改善胰岛素抵抗小鼠症状的组合物,对于为缓解胰岛素抵抗和预防糖尿病的药物开发提供新思路。
发明内容
本发明第一个目的是提供了一种组合物,所述组合物包含肠道菌和益生元;所述肠道菌与益生元添加的比例为(1×10
所述肠道菌为长双歧杆菌(Bifidobacterium longum)NSP008和/或普拉梭菌(Faecalibacterium prausnitzii);
所述长双歧杆菌NSP008,已于2021年8月25日保藏于广东省科学院微生物研究所,保藏地址为广州市先烈中路100号大院59号楼5楼,保藏编号为GDMCC No:61889。
在本发明的一种实施方式中,所述长双歧杆菌(Bifidobacterium longum)NSP008是从来源于河南地区的2型糖尿病病人体粪便样本发酵液中分离得到的,该菌株经测序分析,并将测序得到的序列在NCBI中进行核酸序列比对,结果显示该菌株为长双歧杆菌,将其命名为长双歧杆菌(Bifidobacterium longum)NSP008,同时,需要指出的是,生物材料保藏证明上的Bifidobacterium longum BL41与长双歧杆菌(Bifidobacterium longum)NSP008是同一株菌的不同命名方式,本发明正文采用长双歧杆菌(Bifidobacterium longum)NSP008的命名。
所述的长双歧杆菌NSP008具有下列性质:菌体特征:革兰氏染色阳性杆状细菌,有时呈Y型或V型,无孢子,无鞭毛,菌体约0.5-1.5μm宽,1.3-8μm长。菌落特征:在培养基上形成明显地菌落,直径在0.3-2mm之间,正面形态圆形,中间凸起,边缘整齐,微白,不透明,表面湿润光滑。生长特性:该菌株为专性厌氧菌,最适生长温度是36℃-38℃,最适生长pH值为6.6-7.0,在含有葡萄糖的培养基中生长良好,16-24h可进入对数后期或稳定前期。
在本发明的一种实施方式中,所述普拉梭菌为普拉梭菌A2-165。
在本发明的一种实施方式中,所述肠道菌为长双歧杆菌NSP008和普拉梭菌A2-165,所述长双歧杆菌NSP008和普拉梭菌A2-165按照菌体数为(5×10
在本发明的一种实施方式中,所述肠道菌为长双歧杆菌NSP008,所述益生元为阿拉伯半乳聚糖,所述长双歧杆菌NSP008和阿拉伯半乳聚糖的剂量比例为(1×10
在本发明的一种实施方式中,所述肠道菌为普拉梭菌A2-165,所述益生元为阿拉伯半乳聚糖,所述普拉梭菌A2-165和阿拉伯半乳聚糖的剂量比例为(1×10
在本发明的一种实施方式中,所述肠道菌为长双歧杆菌NSP008和普拉梭菌A2-165,所述益生元为阿拉伯半乳聚糖,所述长双歧杆菌NSP008、普拉梭菌A2-165和阿拉伯半乳聚糖的剂量比例为(5×10
本发明第二个目的是提供了上述组合物在制备具有改善胰岛素抵抗功能的产品中的应用。
在本发明的一种实施方式中,所述产品为药品或保健品。
在本发明的一种实施方式中,所述药品或保健品的剂型包括颗粒剂、胶囊剂、片剂、丸剂、口服液。
在本发明的一种实施方式中,所述药品包含上述长双歧杆菌(Bifidobacteriumlongum)NSP008,还含有药物载体和/或药用辅料。
在本发明的一种实施方式中,所述药用辅料是药学上可接受的辅料。
在本发明的一种实施方式中,所述可接受的辅料包括增稠剂、抗氧化剂、酸碱调节剂、乳化剂、防腐剂、填充剂、粘合剂、润湿剂、崩解剂、润滑剂及矫味剂中的一种或多种。
本发明的一种实施方式中,所述填充剂为淀粉、蔗糖、乳糖、硫酸钙和/或微晶纤维素。
在本发明的一种实施方式中,所述粘合剂为纤维素衍生物、藻酸盐、明胶和/或聚乙烯吡咯烷酮。
在本发明的一种实施方式中,所述润湿剂为水、乙醇、淀粉和/或糖浆。
在本发明的一种实施方式中,所述崩解剂为羧甲基淀粉钠、羧丙纤维素、交联羧甲基纤维素、琼脂、碳酸钙和/或碳酸氢钠。
在本发明的一种实施方式中,所述润滑剂为滑石粉、硬脂酸钙、硬脂酸镁、微粉硅胶和/或聚乙二醇。
在本发明的一种实施方式中,所述矫味剂为单糖浆、蔗糖、卵磷脂、橙皮糖浆、樱桃糖浆、柠檬、茴香、薄荷油、海藻酸钠、阿拉伯胶、明胶、甲基纤维素、羧甲基纤维素钠、柠檬酸、酒石酸和/或碳酸氢钠。
本发明第三个目的是提供了一种含有上述组合物的产品。
在本发明的一种实施方式中,所述产品为食品、药品或保健品。
在本发明的一种实施方式中,所述食品包括饮料、奶制品或其他含有上述长双歧杆菌(Bifidobacterium longum)NSP008的食品。
在本发明的一种实施方式中,所述药品包含上述长双歧杆菌(Bifidobacteriumlongum)NSP008,还含有药物载体和/或药用辅料。
本发明的第四个目的是提供了上述组合物及含有上述组合物的制剂在制备预防、辅助治疗、修复改善胰岛素抵抗症状的营养补充剂、保健食品或药品中的应用。
有益效果
本发明的组合物具有缓解胰岛素抵抗的作用,具体体现在:
(1)组合物能够明显改善胰岛素抵抗小鼠的空腹血糖、胰岛素水平及口服葡萄糖耐受能力;
(2)组合物能够显著抑制胰岛素抵抗小鼠体重的增加及脂肪的堆积;
(3)组合物能够显著缓解胰岛素抵抗对小鼠肝脏功能的损伤;
(4)组合物能够改善胰岛素抵抗小鼠肠道菌群的紊乱。
生物材料保藏
一株长双歧杆菌(Bifidobacterium longum)NSP008,已于2021年8月25日保藏于广东省科学院微生物研究所,分类学命名为:Bifidobacterium longum,保藏编号为GDMCCNo:61889,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省科学院微生物研究所。
附图说明
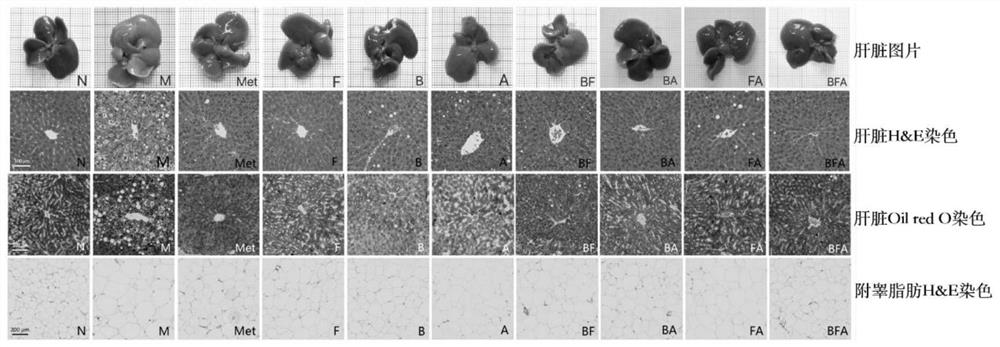
图1:组合物对胰岛素抵抗小鼠干预5周后肝脏图片、肝组织H&E染色和油红O染色结果以及附睾脂肪H&E染色结果。
图2:组合物对胰岛素抵抗小鼠干预5周后粪便中肠道菌群的α多样性影响。
图3:组合物对胰岛素抵抗小鼠干预5周后粪便中肠道菌群的β多样性影响。
其中,正常饲料喂养组(正常对照,N)、胰岛素抵抗组(模型对照组,M)、二甲双胍组(治疗组,Met)、普拉梭菌组(干预组,F)、长双歧杆菌组(干预组,B)、阿拉伯半乳聚糖组(干预组,A)、长双歧杆菌+普拉梭菌组(干预组,BF)、长双歧杆菌+阿拉伯半乳聚糖组(干预组,BA)、普拉梭菌+阿拉伯半乳聚糖组(干预组,FA)、长双歧杆菌+普拉梭菌+阿拉伯半乳聚糖组(干预组,BFA)。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。下述仅给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
下述实施例中涉及到的实验材料
所述小鼠购自湖南斯莱克景达实验动物有限公司,饲养于25±2℃、恒湿50±5%、光照12小时(8:00-20:00),隔音,自由摄食、饮水,适应性喂养一周后开始实验。
所述普拉梭菌(Faecalibacterium prausnitzii)A2-165购自广东省微生物研究所,阿拉伯半乳聚糖购自美国sigma公司,货号:10830。
胰岛素试剂盒(购自crystal chem,货号:90080)、血糖试纸和血糖仪购自罗氏公司、TNF-α炎症因子试剂盒(FMS-ELM028)和IL-10炎症因子试剂盒(FMS-ELM009)购自南京福麦斯生物技术有限公司;游离脂肪酸(NEFA)测试盒(A042-2-1)、血清总胆固醇TC试剂盒(A111-1-1)、低密度脂蛋白LDL-C试剂盒(A113-1-1)、高密度脂蛋白HDL-C试剂盒(A112-1-1)、甘油三酯TG试剂盒(A110-1-1)购自南京建成生物工程研究所。
下述实施例中所涉及的培养基成分均购买自上海源叶公司、二甲双胍购自美国Sigma公司(D150959)、高脂饲料购自美国Research Diets公司(D12492)、正常饲料购湖南斯莱克景达实验动物有限公司(大小鼠繁殖饲料)。
下述实施例中涉及培养基:
活化培养基的制备(g/L):碳源:果胶0.047,木聚糖0.047,阿拉伯半乳聚糖,支链淀粉0.04,可溶性淀粉0.392;氮源:细菌蛋白胨24,胰蛋白胨24;无机盐:七水硫酸镁0.5,磷酸二氢钾2.5,氯化钠4.5,二水合氯化钙0.45,七水合硫酸铁0.005;胆盐0.4,厌氧剂半胱氨酸盐酸盐0.2和酸碱缓冲液(MES)19.52。首先将以上成分配制完成,并调节pH至6后进行除氧和灭菌(121℃,15min)。灭菌结束后将培养基转移至厌氧手套箱中,将不耐高温的血红素1μg、维生素K3(VK3)1μg和维生素混合液(Wolfe's Vitamin Solution)0.1mL过0.22μm滤膜添加至1L培养基,在厌氧手套箱中过夜除氧,即得到所述活化液体培养基。
富集培养基的制备:每升富集培养基由350mL A液,150mL B液,500mL C液,1mL D液和0.08mL维生素混合物(Wolfe's Vitamin Solution)混合而成,配方(g/L)包括:A液:细菌蛋白胨68.57,胰蛋白胨68.57,胆盐1.14,厌氧剂半胱氨酸盐酸盐1.43,硫酸镁1.14,磷酸二氢钾5.48,氯化钠12.86,氯化钙0.97,七水合硫酸铁0.014;B液:酸碱缓冲剂(MES)130,C液:阿拉伯半乳聚糖10,D液:血红素10mg、维生素K3(VK3)8mg。首先将可高压灭菌成分(A-C液)配制完成,调节pH至6后进行除氧,而后进行灭菌(121℃,15min)。灭菌结束后将培养基转移至厌氧手套箱中过夜。最后将D液和Wolfe's Vitamin Solution过0.22μm滤膜后的按比例加入培养基中,即得到所述富集培养基。
MRS液体培养基的制备(g/L):蛋白胨10.0,牛肉浸粉8.0,酵母浸粉4.0,葡萄糖20.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温1.0,,溶解于1L蒸馏水中,并加入半胱氨酸盐酸盐0.5-1g/L,混合均匀,然后调整其pH为6.6-7.0,115-121℃灭菌15-20min后,即得到所述MRS液体培养基。
MRS固体培养基的制备(g/L):在MRS液体培养基的基础上添加1.5-2%琼脂。混合均匀,然后调整其pH为6.6-7.0,115-121℃灭菌15-20min后,即得到所述MRS固体培养基。
MRS选择性培养基的制备(g/L):将蛋白胨10.0,牛肉浸粉8.0,酵母浸粉4.0,磷酸氢二钾2.0,柠檬酸氢二铵2.0,乙酸钠5.0,硫酸镁0.2,硫酸锰0.04,吐温1.0,阿拉伯半乳聚糖10.0溶解于蒸馏水中,并加入半胱氨酸盐酸盐0.5-1g/L,混合均匀,然后调整其pH为6.6-7.0,115-121℃灭菌15-20min后,即得到所述液体培养基。
YCFA液体培养基的制备(g/L):Casitone 10.0,酵母浸粉2.5,葡萄糖5.0,七水合硫酸镁0.045,氯化钙0.09,磷酸氢二钾0.45,磷酸二氢钾0.45,氯化钠0.9,碳酸氢钠4.0,半胱氨酸盐酸盐1.0,血红素0.01。将以上成分溶于1L蒸馏水中,调节pH至6.5-7.0。进行灭菌(115-121℃,15-20min),灭菌结束后将培养基转移至厌氧手套箱中过夜。每升培养基加入1.9mL乙酸,0.7mL丙酸,异丁酸0.09mL,戊酸0.1mL,异戊酸0.1mL及维生素混合物(Wolfe'sVitamin Solution)0.08mL。即得到所述YCFA液体培养基。
YCFA固体培养基的制备:
固体培养基的制备:按照YCFA液体培养基的配方,再加入1.5-2%的琼脂,混合均匀,然后调整其pH为6.5-7.0,115-121℃灭菌15-20min后,每升培养基加入1.9mL乙酸,0.7mL丙酸,异丁酸0.09mL,戊酸0.1mL,异戊酸0.1mL及维生素混合物(Wolfe's VitaminSolution)0.08mL。即得到所述YCFA固体培养基。
下述实施例中所涉及的检测方法如下:
小鼠肝功能的测定:组合物干预治疗5周后,将小鼠麻醉后处死。从小鼠眼眶取血,收集血液,3000rpm离心15min,获得的小鼠血清。采用血生化仪测定小鼠血清中反映肝功能的谷丙转氨酶(ALT)、谷草转氨酶(AST)水平。
小鼠附睾脂肪、肝脏组织的重量测定:组合物干预治疗5周后,将小鼠麻醉后处死,分离出小鼠完整的附睾脂肪和肝脏,称重并记录。
小鼠附睾脂肪、肝脏的组织形态观察:(1)H&E染色:将组织包埋于石蜡中,冰冻后切割成切片,染色前将石蜡切片脱蜡,分别用苏木素和伊红染色,脱水后的切片封片后显微观察;(2)油红O染色:将组织包埋于石蜡中,冰冻后切割成切片,切片入油红染液浸染后用用苏木素复染,使用甘油明胶封片后显微观察。
口服葡萄糖耐量测试(OGTT):组合物干预治疗4周后,各组小鼠禁食5h后灌胃葡萄糖溶液(2.0g/kg),使用血糖仪和配套试纸通过小鼠尾静脉采血测定各组小鼠灌胃前0min,灌胃后30,60,90,120min血糖。
口服葡萄糖耐受量曲线下面积计算公式如下:
其中,BG0,BG30,BG60,BG90和BG120是在0min,30min,60min,90min和120min测得的血糖值。
空腹血糖(FBG)的测定:组合物干预治疗4周后,各组小鼠禁食6h后,使用血糖仪和配套试纸通过小鼠尾静脉采血测定各组小鼠血糖。
血清胰岛素的测定:组合物干预治疗5周后,将小鼠麻醉后处死,获取血清,参照试剂盒说明书测定其血清中胰岛素含量。胰岛素抵抗指数(HOMA-IR)的计算方法:
胰岛素敏感指数(ISI)的计算方法:
胰岛素敏感指数=ln(空腹血糖(mg/dL)×空腹胰岛素(mIU/L))-1
肝脏中甘油三酯和炎症因子的测定:使用甘油三酯试剂盒和TNF-α炎症因子试剂盒测定。
肝脏炎症因子的测定:组合物干预治疗5周后,将小鼠麻醉后处死,获取肝脏,参照试剂盒说明书测定其肝脏中炎症因子的含量。
粪便中肠道菌群的测定:组合物干预治疗5周后,收集各组小鼠粪便,获取粪便中总DNA,采用16S rDNAV4区引物对其进行扩增,采用Illumina MiSeq测序仪进行测序,采用QIIME1.9对测序数据进行分析。
实施例1:长双歧杆菌NSP008的分离筛选
1、样品采集
采集河南商丘地区的2型糖尿病人体粪便样本,样本置于保藏管中,加入5倍重量的保护液(保护剂的制备:称取半胱氨酸盐酸盐1g/L,甘油200-300g/L,均匀溶解于PBS(1×)中,115-121℃灭菌15-20min)保存于装有干冰的保温盒中,带回实验室后迅速置于-80℃冰箱待分离筛选。
2、粪菌的富集
将上述粪菌液从-80℃冰箱取出,解冻后低速低温离心(500g,5min,4℃)获得上清,然后过100μm滤膜除去上清中杂质,将上清粪菌液接种至活化培养基中(粪菌液:活化培养基=1:9,(v/v)),37℃下,140rpm培养16h,然后将其接种至富集培养基中,接种比例为10%(v/v),37℃下,140rpm培养24h。获得用阿拉伯半乳聚糖富集后的粪菌液。
3、双歧杆菌的分离纯化
(1)粪菌液梯度稀释:在无菌厌氧环境中,取上述富集后的粪菌液,加入到9mL生理盐水,得到第一梯度稀释液,吸取1mL第一梯度稀释液于9mL生理盐水,得到第二梯度稀释液,以此类推,共配制5个梯度稀释液;
(2)涂布培养:分别吸取100μL上述所有梯度稀释液分别置于MRS固定培养基上,涂布后至于37℃厌氧条件下培养48h,得到稀释涂布平板;
(3)纯化培养:挑取固体培养基上边缘整齐,微白,不透明,表面湿润光滑,且形态一致的纯的单菌落接种于5mL液体MRS选择性培养基中,至于37℃厌氧条件下培养24h,得到纯化培养液。
4、菌种保藏与鉴定
将步骤3获得的长势最好的纯化培养液8000r/min离心10min,弃上清得菌体。用细菌16S rDNAPCR特异性引物(见表1)进行PCR,PCR产物经核酸电泳分析确认后,扩增产物送至公司进行测序,测序结果与NCBI数据库中序列进行比对分析;将其命名为长双歧杆菌(Bifidobacterium longum)NSP008。
表1引物名称
实施例2:组合物对胰岛素抵抗小鼠的空腹血糖、胰岛素水平及口服葡萄糖耐受能力的改善
1、长双歧杆菌NSP008制剂的制备:
(1)培养方法:在无菌厌氧环境中,将长双歧杆菌NSP008菌种在MRS固体培养基上划线,在厌氧条件下培养48h,长出单菌落后,挑取单菌落,并将其接种至MRS液体培养基,在37℃下厌氧培养16-24h,达到稳定期,此时的OD值为:1.0-1.4,制备得到种子液。
(2)保护剂的制备:称取半胱氨酸盐酸盐1g/L,甘油200-300g/L,均匀溶解于PBS(1×)中,115-121℃灭菌15-20min。
(3)长双歧杆菌NSP008菌剂的制备:将步骤(1)培养至稳定期的长双歧杆菌NSP008种子液离心(8000rpm,10min,4℃)后,取菌体,用无菌的磷酸盐缓冲液(pH 7.0)清洗1-2次后,用步骤(2)制备的保护剂重悬菌体,使菌液浓度为1×10
2、普拉梭菌制剂的制备:
(1)培养方法:将普拉梭菌A2-165在YCFA固体培养基上划线,在厌氧条件下培养48h,长出单菌落后,并将其接种至YCFA液体培养基,在37℃下厌氧培养16-24h,达到稳定期,此时的OD值为:0.9-1.2,制备得到种子液。
(2)保护剂的制备:称取半胱氨酸盐酸盐1g/L,甘油200-300g/L,均匀溶解于PBS(1×)中,115-121℃灭菌15-20min。
(3)菌剂的制备:将步骤(1)培养至稳定期的普拉梭菌A2-165种子液离心(8000rpm,10min,4℃)后,将菌体用无菌的磷酸盐缓冲液(pH 7.0)清洗1-2次后,用步骤(2)制备的保护剂重悬,使菌液浓度为2×10
3、阿拉伯半乳聚糖制剂的制备:
将阿拉伯半乳聚糖配置成浓度为39~78mg/mL的水溶液制剂,灌胃剂量为390mg/kg/天,灌胃小鼠体积为0.2mL/只,现配现用,备用。
4、二甲双胍制剂的制备:
将二甲双胍配制成浓度为20~40mg/mL的二甲双胍水溶液制剂,灌胃剂量为200mg/kg/天,灌胃体积为0.2mL/只,现配现用。
5、实验方法:
本发明采用高脂饲料喂养的方法诱导小鼠产生胰岛素抵抗。
取6周龄健康雄性C57BL/6J小鼠正常饮食适应性喂养1周,然后开始为期15周的试验。期间正常对照组(10只,为描述方便,以N表示)一直饲喂正常饲料。高脂组小鼠在适应性喂养1周之后,开始为期10周的高脂喂养。然后,将实验组小鼠随机分为9组(每组10只):胰岛素抵抗组(模型组,以M表示)、二甲双胍组(治疗组,以Met表示)、普拉梭菌组(干预组,以F表示)、长双歧杆菌组(干预组,以B表示)、阿拉伯半乳聚糖组(干预组,以A表示)、长双歧杆菌+普拉梭菌组(干预组,以BF表示)、长双歧杆菌+阿拉伯半乳聚糖组(干预组,以BA表示)、普拉梭菌+阿拉伯半乳聚糖组(干预组,以FA表示)、长双歧杆菌+普拉梭菌+阿拉伯半乳聚糖组(干预组,以BFA表示),每24h灌胃一次对应制剂(每只小鼠获得的制剂的溶剂量保持一致),连续干预5周,期间饲喂高脂饲料。详细实验流程见表3。
将各组小鼠在正常喂养1周后,开始造模,具体步骤如下:
正常组(N):第2~11周饲喂正常饲料;第12~16周:继续正常饲料,每天灌胃一次0.2mL灭菌的PBS和0.2mL无菌蒸馏水;
造模过程:第2~11周其余各组开始喂养高脂饲料,经过10周的高脂饮食,测定各高脂饮食组小鼠口服葡萄糖耐受量、空腹血糖、空腹血清胰岛素水平并计算口服葡萄糖耐受量曲线下面积和胰岛素敏感指数,结果显示,上述指标高脂饮食组小鼠均显著高于正常组小鼠,认为高脂诱导的胰岛素抵抗小鼠模型造模成功(每组10只);具体指标如表2所示:
表2高脂诱导的胰岛素抵抗小鼠模型造模成功指标
干预治疗实验过程:
模型组(M):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.2mL灭菌PBS和0.2mL无菌蒸馏水;
治疗组(Met):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.2mL灭菌PBS和0.2mL二甲双胍水溶液(200mg/kg);
普拉梭菌组(F):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL普拉梭菌制剂(2×10
长双歧杆菌组(B):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL长双歧杆菌制剂(1×10
阿拉伯半乳聚糖组(A):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.2mL灭菌PBS和0.2mL阿拉伯半乳聚糖制剂(390mg/kg);
长双歧杆菌+普拉梭菌组(BF):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL长双歧杆菌制剂(1×10
长双歧杆菌+阿拉伯半乳聚糖组(BA):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL长双歧杆菌制剂(1×10
普拉梭菌+阿拉伯半乳聚糖组(FA):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL普拉梭菌制剂(2×10
长双歧杆菌+普拉梭菌+阿拉伯半乳聚糖组(BFA):第12~16周继续饲喂高脂饲料,每只小鼠每天灌胃一次0.1mL长双歧杆菌制剂(1×10
第16周实验结束后,处死所有小鼠,并收集血清和组织样本。
表3实验流程
6、组合物对胰岛素抵抗小鼠的空腹血糖、胰岛素水平及口服葡萄糖耐受能力的改善
具体实验过程同步骤1~5,区别在于,在干预治疗4周后,分别对各组小鼠进行口服葡萄糖耐量实验(OGTT),即禁食5h后灌胃2.0g/kg的葡萄糖溶液,使用血糖仪和配套试纸通过小鼠尾静脉采血测定各组小鼠灌胃前0min,灌胃后30min,60min,90min,120min后血糖,结果如表4所示。在干预治疗5周后,处死小鼠获得小鼠血清,通过检测血清中胰岛素含量和计算胰岛素抵抗程度(HOMA-IR指数)对其胰岛素抵抗程度进行评估,结果如表5所示。
表4干预4周后小鼠口服葡萄糖耐受量(OGTT)
结果显示,与模型组(M)相比,各组合物均能显著改善胰岛素抵抗小鼠的葡萄糖耐受能力。同时,与模型组(M)相比,各组合物均能显著改善胰岛素抵抗小鼠的禁食12h的空腹血糖。
表5干预5周后小鼠胰岛素抵抗水平
结果显示,与模型组(M)相比各组合物均能显著缓解小鼠的胰岛素抵抗程度。
综合本实施例结果,组合物对小鼠胰岛素抵抗程度的有着显著的逆转能力且优于单独灌胃益生元和肠道菌组。
实施例3:组合物对胰岛素抵抗小鼠体重的增加及脂肪堆积的改善
具体实验过程同实施例2的步骤1~5,区别在于,在第12~16周(干预期间)分别对各组小鼠进行每周2次的称重。
1、组合物对胰岛素抵抗小鼠体重、饮食的影响
本发明在组合物对胰岛素抵抗小鼠治疗过程中,对小鼠的体重和饮食进行监测,结果如表6所示。
表6干预期间小鼠体重变化及饮食量
结果表明,与模型组(M)相比各组合物在不影响摄食量的前提下,均能显著抑制胰岛素抵抗小鼠体重的增加。
2、组合物对胰岛素抵抗小鼠脂肪堆积的影响
检测处死后的小鼠的附睾脂肪,小鼠的附睾脂肪重量可用于衡量动物的肥胖程度;结果如图1和表7所示。
表7干预5周后小鼠体重及脏器重量
实验结果表明,与模型组(M)相比,各组合物能显著降低胰岛素抵抗对小鼠带来的肝脏肿大,同时组合物能够有效缓解小鼠附睾脂肪的堆积。
3、组合物对胰岛素抵抗小鼠血清中的脂类物质含量
干预治疗5周后,处死所有小鼠,收集血清,并检测血清中的脂类物质含量,结果如表8所示。
表8干预5周后小鼠血清脂类物质含量
结果表明,与模型组(M)相比,各组合物能有效降低胰岛素抵抗小鼠血清中的中胆固醇、总甘油三酯和游离脂肪酸等脂类物质含量。
综合本实施例结果,组合物对胰岛素抵抗小鼠的体重和体脂有优异的逆转能力且优于单独灌胃益生元和肠道菌组。
实施例4:组合物对胰岛素抵抗小鼠肝损伤的缓解
(1)具体实验过程同实施例2的步骤1~5,区别在于,在干预治疗5周后,通过血清对小鼠的肝功能进行评估,同时对其肝组织进行了病理检查和炎症因子测定,结果如表9所示。
表9干预5周后小鼠肝功能及肝脏炎症因子水平
结果表明,与模型组(M)相比,各组合物能显著改善胰岛素抵抗对小鼠带来的肝功能下降(降低肝脏中谷丙转氨酶和谷草转氨酶的含量),同时能够显著缓解小鼠肝脏中的炎症反应(升高肝脏中抑炎因子IL-10的含量,降低肝脏中促炎因子TNF-α的含量)。
(2)具体实验过程同实施例2的步骤1~5,实验结束后,采用直接拍照、H&E染色法和油红O染色法对小鼠肝脏进行观察,结果如图3所示。
结果显示(图1),与模型组(M)相比个组合物可缓解胰岛素抵抗小鼠肝脏的弥漫性脂肪变性(空泡化)和纤维化。综合本实施例结果,组合物对胰岛素抵抗小鼠的肝脏损伤有着显著的改善作用。
实施例5:组合物对胰岛素抵抗小鼠粪便菌群的影响
具体实验过程同实施例2的步骤1~5,本发明在组合物对胰岛素抵抗小鼠治疗5周后收集粪便,对其粪便中菌群组成进行分析,实验结果如图2~3,表10~11所示。
表10小鼠粪便菌群门水平相对丰度变化
表11小鼠粪便菌群目/科/属水平相对丰度变化
本实验分析比较了各组小鼠肠道菌的Chao1指数和Shannon指数以评价各组微生物群落的α多样性。Chao1指数越高,表明样本中物种丰富度越高;Shannon指数越大,说明样品中群落多样性越高。
实验结果显示(图2),与模型组(M)相比各组合物均能显著提高胰岛素抵抗小鼠粪便菌群的α多样性,提高粪便菌群中的丰富度和多样性。
之外,模型组(M)与组合物组小鼠的肠道菌群在β多样性上存在明显差异(图3),组合物组的干预使小鼠肠道菌群β多样性发生了一定的变化。
实验结果表明(表10~11),与模型组(M)相比各组合物均能有效提高胰岛素抵抗小鼠粪便菌群中厚壁菌门的比例以及益生菌的丰度。
综合本实施例结果,组合物对胰岛素抵抗小鼠的粪便菌群结构有非常显著的影响,主要是提高了小鼠粪便菌群的丰富度和多样性以及有益菌的比例。这表明,组合物对胰岛素抵抗小鼠肠道环境有良好的改善作用。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 具有缓解胰岛素抵抗功能的组合物及其应用
- 具有缓解视疲劳功能的组合物、制备方法及应用
