一种检测MPN变异位点的试剂盒及检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医学技术领域,尤其涉及了一种检测MPN变异位点的试剂盒及检测方法。
背景技术
骨髓增殖性肿瘤(MPN)是以骨髓中分化成熟相对正常的一系或多系髓系(粒系、红系、巨核系)细胞持续异常增殖为特征的一组克隆性造血干细胞疾病大多数真性红细胞增多症(PV)患者有Janus蛋白酪氨酸激酶-2基因(JAK2)的体细胞突变。该突变在血液髓系细胞中可检测到。该突变造成JAK2负调节区域功能的缺失,从而导致JAK2持续性活动性增强。最常见的是JAK2 V617F突变,几乎所有的PV患者都可见JAK2 V617F突变;少部分PV患者有JAK2的其他位点突变(如第12外显子)。
目前已发现与MPN相关的分子标志物主要有JAK2,CARL、CSF3R及MPL等。2005年发现该类疾病中JAK2基因获得性突变-JAK2V617F点突变,该突变被证实在MPN中具有重要的诊断及预后意义。超过90%的PV患者及约60%的ET和PMF患者均具有V617F点突变。除此以外,近年来多项研究表明在JAK2V617F突变呈阴性的MPN病人中发现MPL突变及体细胞钙网蛋白(CALR)突变。如MPL515位点的突变,CALR 9号外显子的移码突变等。
对MPN进行多基因检测对于其诊断、进一步危险分层以及最终实现更为精确的个体化治疗显得尤为重要。目前检测MPN相关基因突变的方法主要有直接测序,等位基因特异性PCR(AS-PCR),高分辨率溶解曲线(HRMA)等。AS-PCR方法是根据突变位点设计特异性引物进而通过PCR检测基因突变,一般适用于点突变,如JAK2V617F的检测。HRMA方法曾被报道用来检测MPN病人中CALR的基因突变,并被证实具有较高的灵敏度。然而,由于AS-PCR,HRMA只适合少数的突变类型的检测,当临床病人需要检测较多相关的基因突变时,此类方法不能够满足检测要求。而直接测序的方法能够对需要检测样本的相关基因序列进行精确测序,从而分析相关基因是否发生突变,具有简便、准确且适合批量操作的特点。目前有不少关于直接测序检测MPN相关基因突变的报道,然而往往由于引物特异性不是很好,造成测序峰图有较高背景峰,从而对突变的判断造成一定困难;同时PCR方法不能直观地得到具体的突变序列,而一代测序的方法受到测序通量的影响,无法一次性检测多个基因的全部外显子区域。
发明内容
针对现有技术中MPN检测方法的不足和实际需求,本发明提供了一种检测MPN变异位点的试剂盒及检测方法,解决了现有技术中MPN检测周期长,不能快速确定致病基因突变位点的问题。
本发明提供了一种检测MPN变异位点的试剂盒,所述试剂盒包括用于对样本基因组DNA进行多重PCR构建文库的试剂包、用于对文库样本进行测序的测序设备、用于对文库样本测序结果进行数据分析的数据分析软件、用于对变异检测数据进行注释的注释软件和用于注释的变异位点注释数据库。
进一步,所述试剂包包括用于扩增CARL、JAK2、MPL和CSF3R基因突变位点的引物组合,所述引物组合包括正向引物和反向引物,所述正向引物的核苷酸序列如SEQ ID NO.1-SEQ ID NO.19所示,所述反向引物的核苷酸序列如SEQ ID NO.20-SEQ ID NO.38所示。
进一步,所述引物组合包括引物组合A和引物组合B;
所述引物组合A中正向引物的核苷酸序列为:
所述引物组合A中反向引物的核苷酸序列为:
;
所述引物组合B中正向引物的核苷酸序列为:
;
所述引物组合B中反向引物的核苷酸序列为:
。
进一步,所述数据分析软件包括质控软件、比对软件和变异检测软件;
所述质控软件用于对原始测序信号文件的数据进行质控处理,形成有效测序数据;
所述比对软件用于将有效测序数据比对到人类hg19参考基因组得到比对数据;
所述变异检测软件用于对比对数据进行变异检测得到变异检测数据;
进一步,所述注释软件为ANNOVAR软件。
进一步,所述变异位点注释数据库包括第一数据库和第二数据库,所述第一数据库包括1000Genoms数据库、gnomAD数据库、ExAC数据库、SIFT数据库、Polyphen2数据库、Mutationtaster数据库、COSMIC数据库、ClinVar数据库、OMIM数据库和HGMD数据库,所述第二数据库包括用于解读MPN相关基因的蛋白功能和临床意义的MPN基因数据库和用于解读检测到的热点突变临床意义的MPN热点数据库。
进一步,所述MPN基因数据库包括记录MPN相关基因的功能数据和基因异常相应的临床数据,所述MPN热点数据库包括记录MPN相关基因特定热点突变对蛋白功能的影响和热点突变相应的临床分级和临床意义解读数据。
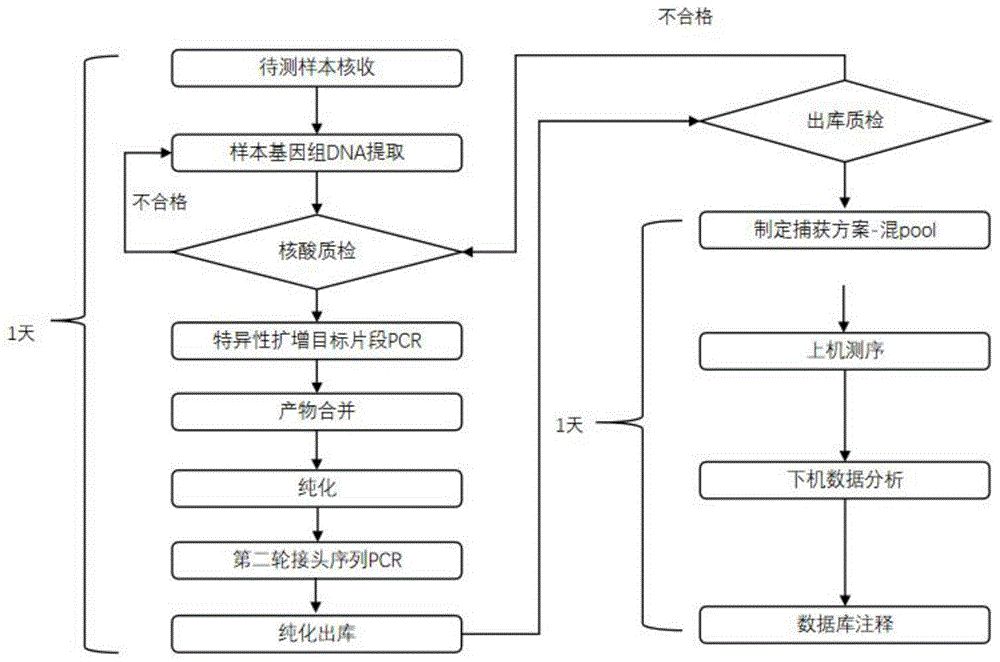
本发明还提供了一种检测MPN变异位点的检测方法,所述检测方法包括以下步骤:
S1、多重PCR文库构建
第1轮多重PCR反应,以待测样本基因组DNA为模板,进行多重PCR反应;磁珠纯化PCR产物;对纯化的PCR产品进行第2轮接头序列PCR反应,进行第2轮磁珠纯化;
S2、文库浓度测定;
S3、上机测序,获得原始测序信号文件;
S4、对原始测序信号文件进行数据分析和变异检测注释。
进一步,所述S1中的第1轮多重PCR反应包括T1反应管体系、T2反应管体系;
所述T1反应管体系包括第一引物池和第一反应液;所述第一引物池包括引物组合A;
所述T2反应管体系包括第二引物池和第二反应液;所述第二引物池包括引物组合B。
进一步,所述S4中的变异检测注释为利用变异位点注释数据库的信息为参考对变异检测数据进行变异位点临床分级和注释。
本发明的优点在于:
1)本发明提供的MPN检测试剂盒采用两轮PCR反应进行文库构建,设计的引物组合的扩增范围包括CARL、JAK2、MPL和CSF3R基因的全部热点区域,包括了插入或缺失引起的序列改变的突变位点、无义突变位点、拼接区突变位点或错义突变位点,覆盖范围全面;通过设计引物组合A和引物组合B,结合高通量测序和多重PCR富集技术,可以一次性准确检测多个基因的热点突变区域,具有检测效率高、检测周期短等优点;
2)利用注释软件依据变异位点注释数据库对变异检测出的突变位点进行注释,确定致病基因突变位点;
3)本发明整体相对于现有技术中一代测序对MPN的检测准确,弥补了一代测序中存在未检出的缺陷,同时能够快速确定突变基因、突变位点及突变频率。
附图说明
图1本发明的MPN检测方法的流程图;
图2现有技术中MPN检测方法的流程图;
具体实施方式
对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应DNA/RNA的5′末端核苷酸,末位均为相应DNA/RNA的3′末端核苷酸。
实施例1一种基于生物标记的MPN检测试剂盒
一种基于生物标记的MPN检测试剂盒包括用于对样本基因组DNA进行多重PCR构建文库的试剂包、用于对文库样本进行测序的设备、用于对文库样本测序结果进行数据分析的数据分析软件、用于对变异检测数据进行注释的注释软件和用于注释的变异位点注释数据库。
试剂包包括用于扩增CARL、JAK2、MPL和CSF3R基因突变位点的引物组合,引物组合包括正向引物和反向引物,引物组合中的引物序列与对应基因关系见表1。
表1引物组合中引物序列与CARL、JAK2、MPL和CSF3R基因对应关系
引物组合扩增的范围包括CARL、JAK2、MPL和CSF3R的热点区域,CARL、JAK2、MPL和CSF3R基因的外显子区域包括88个突变位点,88个突变位点及CARL、JAK2、MPL和CSF3R基因的对应关系如表2。
表2:突变位点与CARL、JAK2、MPL和CSF3R基因的对应关系
/>
引物组合包括引物组合A和引物组合B;引物组合A包括13对引物,13对引物中的正向引物和反向引物的核苷酸序列如表3所示。
表3引物组合A中的正向引物和反向引物列表
/>
引物组合B包括6对引物,6对引物中的正向引物和反向引物的核苷酸序列如表4所示。
表4引物组合B中的正向引物和反向引物列表
测序设备,用于对文库样本进行测序,测序设备为Hiseq Xten PE150。
数据分析软件包括质控软件、比对软件和变异检测软件;
质控软件用于对原始测序信号文件的数据进行质控处理,形成有效测序数据;原始测序信号文件由测序设备得到,质控软件为fastp软件。
比对软件用于将有效测序数据比对到人类hg19参考基因组得到比对数据;比对软件为BWA软件。
变异检测软件用于对比对数据进行变异检测得到变异检测数据;变异检测软件为VarDcct软件。
注释软件用于对变异检测数据进行注释,注释软件为ANNOVAR软件。
变异位点注释数据库用于注释,包括第一数据库和第二数据库,第一数据库包括1000Genoms数据库、gnomAD数据库、ExAC数据库、SIFT数据库、Polyphen2数据库、Mutationtaster数据库、COSMIC数据库、ClinVar数据库、OMIM数据库和HGMD数据库,第二数据库包括用于解读MPN相关基因的蛋白功能和临床意义的MPN基因数据库和用于解读检测到的热点突变临床意义的MPN热点数据库。MPN基因数据库包括记录MPN相关基因的功能数据和基因异常相应的临床数据,MPN热点数据库包括记录MPN相关基因特定热点突变对蛋白功能的影响和热点突变相应临床数据。
实施例2中的T1反应管体系、T2反应管体系和接头序列PCR反应体系,
T1反应管体系包括引物组合A,T2反应管体系包括引物组合B;
引物组合A和引物组合B中的正向引物和反向引物的工作浓度均为0.1μM,
接头序列PCR反应体系包括接头序列,接头序列包括IGT-I7 Index和IGT-I5Index,工作液浓度均为10μM。接头序列是illumina测序平台所通用的接头序列,通过样本进行标记接头序列,以实现样本间的区分。
试剂盒还包括将目标DNA制成可上机测序的试剂。
实施例2一种检测MPN变异位点的检测方法
S1多重PCR文库构建
S1-1第1轮多重PCR反应:
S1-1-1以目标DNA为模板,使用特异性检测MPN相关基因组合的引物组合进行多重PCR反应;目标DNA为待检测样本基因组DNA,可以来自唾液样本、血液样本、骨髓样本,目标DNA中DNA总量≥200ng,核酸浓度≥10ng/ul,OD260/280:1.8-2.0。
多重PCR反应分为2个反应管,分别标记T1反应管、T2反应管;分别为T1反应管体系、T2反应管体系;T1反应管体系包括第一引物池和第一反应液;T2反应管体系包括第二引物池和第二反应液;所述第一引物池包括所述引物组合A;所述第二引物池包括所述引物组合B;所述T1反应管体系和T2反应管体系的体积为30μL,并按照表5所示反应体系进行配置。
表5 T1反应管和T2反应管反应体系
S1-1-2多重PCR反应合并:
运行PCR扩增反应,T1反应管体系获得反应产物A;T2反应管体系获得反应产物B;将所述反应产物A、反应产物B混合合并,且体积比为1:1;
S1-1-3磁珠纯化合并产物A;
向30ul的合并产物A中加入27ul室温平衡后的AMPure XP磁珠,用移液器吸打混匀20次;
瞬时离心,室温孵育5min后,将PCR管置于磁力架上3min,移除上清;S1-2-3将PCR管从磁力架取下,向管内加入50ul YF buffer B并用移液器吸打混匀20次;
瞬时离心,室温孵育5min后,将PCR管置于磁力架上3min,移除上清;
加入180ul体积百分比浓度为80%的乙醇溶液,静置30s,移除上清;80%乙醇共洗2次;
瞬时离心,用移液器移除上清液,室温干燥3min-5min;
加入24μl的Nuclease-free water,移液器轻轻吸打重悬磁珠,避免产生气泡,室温静置2min;
瞬时离心,置于磁力架上静置3min,用移液器吸取13.5μl上清液转移到新的200μl的PCR管内,管内移入的上清液为纯化后的合并产物A;
S1-2第2轮接头序列PCR反应
S1-2-1按表6配方配制接头序列PCR反应体系,涡旋混匀。其中,PCR productmixture为纯化后的合并产物A;
表6接头序列PCR反应体系
接头序列PCR反应条件:先95℃210s,之后执行循环程序:98℃20s、58℃1min、72℃30s循环9次,最后72℃延伸5min,4℃保存;
Index接头序列:IGT-I7 Inde和IGT-I5 Index,为北京艾吉泰康公司所定制合成,工作液浓度均为10μM。接头序列是illumina测序平台所通用的接头序列,通过样本进行标记接头序列,以实现样本间的区分。
S1-2-2第2轮磁珠纯化
取30ul S2.4处理的PCR反应体系并加入27ul室温平衡后的AMPure XP磁珠,用移液器吸打混匀20次;
瞬时离心,室温孵育5min后,将PCR管置于磁力架上3min,移除上清;S2.5.3将PCR管从磁力架取下,向管内加入50ul YF buffer B用移液器吸打混匀20次;
瞬时离心,室温孵育5min后,将PCR管置于磁力架上3min,移除上清;
向管内加入180ul体积百分数为80%的乙醇溶液,静置30s,移除上清;80%的乙醇共洗2次;
瞬时离心,移除上清,室温静置3min-5min;
加入24μl的Nuclease-free water,用移液器吸打重悬磁珠,避免产生气泡,室温静置2min;
瞬时离心,置于磁力架上静置3min,用移液器吸取22μl上清液转移到新的1.5ml的EP管中,EP管中的上清液为制备好的多重PCR文库;
S2文库浓度测量,取2μL文库使用Qubit进行文库浓度测定,记录文库浓度,测量文库浓度,判断文库质量,是否达到上机测序的标准。当文库片段大小为300bp-500bp且文库浓度为3ng/ul-25ng/ul时,文库质量为合格。
S3上机测序
将多重PCR文库使用Hiseq Xten PE150进行测序获得基因序列表,为原始测序信号文件;
S4数据分析注释
S4-1原始测序信号文件利用bcl2fastq程序转化成fastq格式文件,为第一格式文件;
S4-2第一格式文件经过fastp软件质控得到clean data,clean data为有效测序数据;
S4-3利用BWA软件将有效测序数据比对到人类hg19参考基因组,得到有效测序数据在人类hg19参考基因组上的比对信息文件BAM,比对信息文件BAM为比对数据;
S4-4利用VarDcct软件对比对数据进行变异检测,得到VCF格式文件,为变异检测数据;
S4-5利用ANNOVAR软件对变异检测数据进行变异位点注释数据库注释。
以变异位点注释数据库的信息为参考对变异检测数据进行变异位点注释。
变异位点注释数据库包括对CARL、JAK2、MPL和CSF3R基因的热点突变的医学解释。变异位点注释数据库包括第一数据库和第二数据库,第一数据库包括1000Genoms数据库、gnomAD数据库、ExAC数据库、SIFT数据库、Polyphen2数据库、Mutationtaster数据库、COSMIC数据库、ClinVar数据库、OMIM数据库和HGMD数据库,第二数据库包括用于解读MPN相关基因的蛋白功能和临床意义的MPN基因数据库和用于解读检测到的热点突变临床分级和临床意义的MPN热点数据库。MPN基因数据库包括记录MPN相关基因的功能数据和基因异常相应的临床数据,MPN热点数据库包括记录MPN相关基因特定热点突变对蛋白功能的影响和热点突变相应临床数据。
临床分级包括Ⅰ类变异、Ⅱ类变异和Ⅲ类变异
若变异位点为证据等级A或证据等级B的变异,或为CALR Exon9移码突变,则属于Ⅰ类变异MPN相关具有明确临床意义;
若变异位点为证据等级C或证据等级D的变异,或为证据等级A或证据等级B的相同氨基酸位置的不同氨基酸改变的变异且符合人群条件:MAF<0.02或MAF为“.”或ExAC、genomeAD和1000Genomes中东亚人种均小于0.01(包括“.”)且MAF<0.05,则属于Ⅱ类变异MPN相关具有潜在临床意义;
若变异位点为E证据等级的变异、无义/移码突变/经典剪接位点(±1/2时)/起始密码丢失/终止密码子丢失的变异、为证据等级C或证据等级D的相同氨基酸位置的不同氨基酸改变的变异或ClinVar或HGMD数据库记录为P/LP的变异,且符合人群条件:MAF<0.02或MAF为“.”或ExAC、genomeAD和1000Genomes中东亚人种均小于0.01(包括“.”)且MAF<0.05,则为Ⅲ类变异临床意义未明。
证据等级A为美国FDA批准靶向治疗药物相关突变位点(特定肿瘤)或者是临床诊疗指南中治疗、诊断或者预后判断相关突变位点(特定肿瘤)。
证据等级B为基于证据充分临床研究基础上专家共识认为与靶向治疗、某一疾病诊断或者预后相关的突变位点。或多项权威研究报道的业界比较公认的热点突变,参与疾病发生、进展等相关机制,或对诊疗预后有提示作用。
证据等级C为美国FDA批准靶向治疗药物相关突变位点(不同肿瘤)或者是临床诊疗指南中治疗、诊断或者预后判断相关突变位点(不同肿瘤),即非适应证的用药;临床试验的入组标准或者基于多个小规模研究表明具有指导诊断和预后判断的意义。或参与疾病发生、进展等相关机制
证据等级D为临床前研究表明可能有治疗指导意义,或者在小规模研究、病例报道(非共识)中表明该突变(或者和其他标志物联合)具有指导诊断和预后判断的意义;或参与疾病发生、进展等相关机制。
证据等级E为在人群数据库和肿瘤相关数据库中均没有较高的发生率;没有确定的与肿瘤相关的文献证据(热点区域/功能保守区域/酶活性区域的突变位点,并可能会影响蛋白功能)。
实施例3 MPN检测试剂盒和一代测序比对结果
使用实施例3中的试剂盒,依照实施例2中的方法对30例初诊患病阶段的MPN患者样本的基因组DNA进行筛查检测,同时使用一代测序(Sanger)对30例MPN患者样本的基因组DNA进行检测,MPN检测试剂盒和一代测序检测比对结果如表7所示。样本突变频率小于等于7.3的样本在一代测序检测中均未检出,但本发明试剂盒均检测出。表7中突变频率为变异基因突变频率:也称为变异等位基因频率(VAF),指突变等位基因占总等位基因的百分比,即VAF=突变reads数/(野生型+突变型read数)。
表7MPN检测试剂盒和一代测序比对结果
/>
- 一种ALDH2的SNP位点的快速扩增检测试剂盒及检测方法
- 一种MTRR的SNP位点的快速扩增检测试剂盒及检测方法
- 一种检测MTHFR基因rs1801133位点基因型的引物组、方法及试剂盒
- 一种用于人类BRCA1和BRCA2基因全编码序列突变位点检测的引物、方法和试剂盒
- 不同位点白血病MEF2D-BCL9融合基因寡核苷酸的检测方法及检测试剂盒
- 检测自闭症患者多基因位点拷贝数变异的试剂盒及方法
- 一种检测肺癌EGFR基因突变靶向治疗相关耐药变异位点的试剂盒
