晚疫病抗性基因、生物材料及应用
文献发布时间:2024-04-18 19:58:30
技术领域
本申请涉及基因分离和植物改良技术领域,具体涉及晚疫病抗性基因、生物材料及应用。
背景技术
马铃薯的野生近缘种是抗晚疫病基因(Rpi)的优良来源,新的马铃薯晚疫病广谱抗性基因发掘与克隆是晚疫病研究的热点。在早期的晚疫病抗病育种研究中,最初的抗病基因主要来自于墨西哥六倍体野生种Solanum demissum,其所含的11个(R1-R11)抗晚疫病基因,均为小种专化型的主效抗病基因。但随着致病疫霉各生理小种的不断变异,早期的抗病基因已全部失去抗病功能。
随着现代分子生物学与高通量测序技术的快速发展,利用抗病基因图位克隆结合比较基因组学,抗性基因富集测序(Renseq)以及病原菌效应子组学等方法,欧美的马铃薯育种学家不断从各类野生马铃薯资源中克隆全新的抗病基因,最著名广谱抗性基因包括Rpi-vnt1.1、Rpi-blb1、R8、Rpi-amr1等,然而晚疫病菌毒性变异能力强,新的毒力生理小种形成接连不断,大多已克隆的抗晚疫病基因在田间都已被克服,抗病基因寿命短暂,马铃薯品种抗病性丧失问题日益加剧。
此外,马铃薯的野生近缘种是抗晚疫病的优良来源,但我国并非马铃薯的起源地,晚疫病抗性资源相对匮乏,并且缺乏系统性、有组织的抗病资源挖掘与利用,在生产上缺乏具有自主产权的抗病基因,品种抗性不清。因此,挖掘具有自主产权的新型马铃薯晚疫病抗性基因,培育具有晚疫病持久抗性的马铃薯新品种是一项要务。
发明内容
有鉴于此,本发明提供了一种新的晚疫病抗性基因、生物材料及应用。本发明提供的晚疫病抗性基因Rpi-HMA3的发现,为马铃薯抗晚疫病育种提供了重要的基因资源。
为了实现上述发明目的,本发明提供以下技术方案:
第一方面,本发明提供了一种Rpi-HMA3核酸分子,其包含如下核苷酸序列中的至少一种:
(a1) SEQ ID NO:1所示的核苷酸序列(基因组序列);
(a2) SEQ ID NO:2所示的核苷酸序列(编码区序列);
(a3) 编码SEQ ID NO:3所示的氨基酸序列的核苷酸序列;
(a4) 与所述(a1)和(a2)中任一所示的核苷酸序列具有至少75%序列同一性的核苷酸序列,其中所述核酸分子能够赋予包含所述核酸分子的植物对由至少一个疫霉属的种(Phytophthora sp.)的至少一个小种引起的植物疾病的抗性,并且任选地,其中所述核苷酸序列不是天然存在的;
(a5) 与所述(a3)所示的氨基酸序列具有至少75%序列同一性的氨基酸序列的核苷酸序列,其中所述核酸分子能够赋予包含所述核酸分子的植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性,并且任选地,其中所述核苷酸序列不是天然存在的。
任选的,上述核酸分子为合成的和/或分离的核酸分子。
本发明通过大量实验挖掘到了对晚疫病有极强抗性的野生二倍体马铃薯Solanumburkartii材料,并对其进行全基因组测序分析及进化分析等,发现了本发明候选基因Rpi-HMA3。与已知的许多晚疫病抗性基因不同,上述基因编码的氨基酸序列中含有一个CC结构域、一个NB-ARC结构域、一个LRR结构域以及一个HMA结构域,其为整合了HMA结构域的CNL基因,该基因被命名为Rpi-HMA3。将该基因通过遗传转化的方式在栽培马铃薯品种中进行稳定表达后,可赋予马铃薯对于致病疫霉的抗性。
上述(a4)中,具有至少75%序列同一性的核苷酸序列示例性的为具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%或99.9%同一性的核苷酸序列,优选的为具有97.0%-98.0%、97.5%-98.5%、98.0%-99.0%、98.5%-99.5%、99.0%-100%同一性的核苷酸序列。
上述(a5)中,具有至少75%序列同一性的氨基酸序列的核苷酸序列示例性的为具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%或99.9%同一性的氨基酸序列的核苷酸序列,优选的为具有97.0%-98.0%、97.5%-98.5%、98.0%-99.0%、98.5%-99.5%、99.0%-100%同一性的氨基酸序列的核苷酸序列。
在一些实施方式中,本发明相关核酸分子的天然核苷酸序列可为来源于茄属不同种和或不同株的变体序列,其人工核苷酸序列可为天然核苷酸序列通过适当修饰得到的变体序列,所述修饰包括但不限于不影响目标蛋白的生物活性的适当核苷酸取代/添加/缺失、N-端氨基酸被截短、适用于宿主细胞偏好的密码子优化、标签的添加、融合等对应的核苷酸变体序列。
优选地,Rpi-HMA3核酸分子包含(a1)- (a3)所示的核苷酸序列及其人工变体序列中的至少一种。
本发明的Rpi-HMA3核苷酸序列包括但不限于包含天然启动子和含有编码区的3'邻近区域的核苷酸序列、cDNA序列和仅包含编码区的核苷酸序列。
第二方面,本发明提供了一种核酸分子组合物,其包含上述核酸分子和另外的抗性(R)基因;
任选地,另外的R基因包含但不限于如下基因中的至少一种:Rpi-amr3i(登录号KT373889;WO 2016/182881的SEQ ID NO:1)、Rpi-blb1(也称为“RB”;登录号FB764493.1和AY336128.1)、Rpi-sto1(登录号EU884421)、Rpi-pta1(登录号EU884422)、Rpi-blb2(登录号DQ122125)、Rpi-blb3(登录号FJ536326)、Rpi-abpt(登录号FJ536324)、R2-like(登录号FJ536323)、R2(登录号FJ536325)、Rpi-edn1.1(登录号GU563963)、Rpi-edn1.2、Rpi-snk1.1、Rpi-snk1.2、Rpi-hjt1.1-Rpi-hjt1.3(登录号GU563971-3)、Rpi-bt1(登录号FJ188415)、R1(登录号AF447489)、R3a(登录号AY849382)、R3b(登录号JF900492)、Rpi-vnt1.1(登录号FJ423044)、Rpi-vnt1.2(登录号FJ423045)、Rpi-vnt1.3(登录号FJ423046)、Rpi-mcq1(登录号GN043561)、Rpi-chc、Ph-3(登录号KJ563933)和R8(登录号KU530153)。
对应于上文列出的基因或本文其他地方公开的任何基因或蛋白质的登录号的核苷酸序列可从可公开获得的在线核苷酸和氨基酸序列数据库,例如GenBank和EMBL数据库(分别可在ncbi.nlm.nih.gov/genbank和ebi.ac.uk于万维网上获得)获得。
第三方面,本发明提供了一种生物材料,所述生物材料为下述(b1)~(b3)中的任一种:
(b1) 含有上述核酸分子或核酸分子组合物的表达盒或表达盒组合物;
(b2) 含有上述核酸分子或核酸分子组合物的载体或载体组合物,或,含有(b1)所述表达盒或表达盒组合物的载体或载体组合物;
(b3) 含有上述核酸分子或核酸分子组合物的宿主细胞,或,含有(b1)所述表达盒或表达盒组合物的宿主细胞,或,含有(b2)所述载体或载体组合物的宿主细胞。
任选地,宿主细胞包括细菌、真菌细胞或动物细胞。
在本发明一实施方式中,生物材料为表达盒或表达盒组合物。
在本发明实施方式中,上述核酸分子或核酸分子组合物包括至少两种核酸分子时,可将其制备成一个表达盒,也可将其制备成由至少两个表达盒组成的组合物。
在本发明实施方式中,表达盒或表达盒组合物还包括调控元件,调控元件包括启动子、增强子、前导序列、转座子、终止子、标记基因中的至少一种。
在本发明实施方式中,表达盒或表达盒组合物还包括可操作地连接的启动子。
任选地,启动子包括可操作地连接的内源启动子和/或可操作地连接的异源启动子。
任选地,可操作地连接的内源启动子为Rpi-HMA3基因的天然启动子,如内源启动子PHMA3。
在本发明实施方式中,内源启动子PHMA3包含如SEQ ID NO: 4所示的核苷酸序列,和/或,与SEQ ID NO: 4所示的核苷酸序列具有至少75%序列同一性的核苷酸序列。具有至少75%序列同一性的核苷酸序列示例性的为具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
在本发明实施方式中,可操作地连接的异源启动子的选择可取决于许多因素,例如期望的时间安排、定位和表达模式以及对特定生物或非生物刺激的响应性。任选地,可操作地连接的异源启动子包括病原体诱导型启动子、组成型启动子、组织优选启动子、伤口诱导型启动子、化学调节型启动子中的至少一种。例如,pblb3启动子(Lokossou A A等(2009)Molecular plant-microbe interactions,22(6): 630-641.);核心CaMV 35S启动子(Odell等(1985)Nature 313:810-812);稻肌动蛋白(McElroy等(1990)Plant Cell2:163-171);遍在蛋白(Christensen等(1989)Plant Mol .Biol .12:619-632和Christensen等(1992)PlantMol .Biol .18:675-689);pEMU(Last等(1991)Theor .Appl .Genet .81:581-588);MAS(Velten等(1984)EMBO J .3:2723-2730);ALS启动子(美国专利第5,659,026号)等。优选适用于在茄属作物上稳定表达同类抗病基因的启动子。
基因表达所需调控序列的确切性质在物种或细胞类型之间可能会有所不同,但一般按需要应包括转录和翻译起始的5'非转录和5'非翻译序列,例如TATA盒、加帽序列、CAAT序列等等。尤其是,这种5'非转录调控序列将包括启动子区域,其包括控制对有效连接的基因进行转录控制的启动子序列。调控序列也可包括增强子序列或所需的上游激活子序列。本发明表达盒可任选地包括5'前导或信号序列。
在本发明实施方式中,核酸分子的表达可通过操作基因或操纵子在细胞中的拷贝数来调节。
在一些实施方案中,核酸分子的表达可通过操作模块内核酸分子的顺序来调节。
在一些实施方案中,核酸分子的表达通过将一个或更多个核酸分子或操纵子整合到染色体上来调节。
在本发明另一实施方式中,生物材料为载体或载体组合物。
在一些实施方案中,一个或更多个本发明相关的核酸分子在表达载体中表达。本文所用的“载体”可是大量核酸中的任何一种,其中可通过限制性酶切和连接来插入所需的一个或更多个序列,以便在不同的遗传环境中运送或在宿主细胞中表达。载体通常是由DNA组成,也可由RNA组成。
在本发明实施方式中,载体包括质粒、叶绿体、病毒载体、噬菌体、噬菌粒、黏粒、F黏粒、细菌噬菌体或人工染色体,并且任选地,病毒载体包括腺病毒载体、反转录病毒载体或腺相关病毒载体,并且任选地,载体包括细菌人工染色体(BAC)、质粒、细菌噬菌体P1-衍生的载体(PAC)、酵母人工染色体(YAC)或哺乳动物人工染色体(MAC)。例如载体包括pFastBac1、pYES2、pYES2.1、pESC-Ura、pESC-Trp、pESC-Leu、pESC-His、pGEX2T、pTAex3、pUSA、pYMB0、pHT43、pET28b、pIJ702、pUCP19、pYMB03、pHT43、pEAQ、pBin307、pPZP、pSAT、pCAMIA-1300等。
克隆载体能自主复制或整合在宿主细胞基因组中,其还以一个或更多个限制性内切酶位点为特征,可以在该位点以确定的方式切割载体并可将期望的DNA 序列连接到载体中,从而新的质粒保留了它在宿主细胞中复制的能力。在质粒的情况下,期望序列的复制可随着质粒在宿主细胞(如细菌宿主) 中的拷贝数增加而多次发生,或仅在宿主通过有丝分裂繁殖前在每个宿主中发生一次。在噬菌体的情况下,复制可在裂解期过程中主动发生或在溶原期过程中被动发生。
表达载体可通过限制性酶切和连接将期望的DNA序列插入其中,以使其与调控序列有效连接中并可表达为RNA转录本。载体还可包含适合用于鉴定细胞是否已被载体转化或转染的一种或更多种标记序列。标记包括如编码提高或降低其对抗生素或其他化合物之抗性或敏感性的蛋白质的基因,编码可通过本领域已知标准方法检测活性的酶的基因(例如β-半乳糖苷酶、萤光素酶或碱性磷酸酶),以及对转化或转染细胞、宿主、菌落或菌斑的表型有可见影响的基因(例如绿色荧光蛋白)。优选的载体是能够自主复制和表达与其有效连接的DNA片段中所存在的结构基因产物的载体。
在本发明实施方式中,核酸分子或核酸分子组合物包括至少两种核酸分子时,可将其制备成一个载体,也可将其制备成由至少两个载体组成的组合物。
在本发明另一实施方式中,生物材料为宿主细胞。
任选地,宿主细胞包括细菌、真菌细胞或动物细胞。
第四方面,本发明还提供了一种启动子,该启动子用于驱动Rpi-HMA3基因的转录,该启动子(PHMA3)包含如SEQ ID NO: 4所示的核苷酸序列,和/或,与SEQ ID NO: 4所示的核苷酸序列具有至少75%序列同一性的核苷酸序列。具有至少75%序列同一性的核苷酸序列示例性的为具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
第五方面,本发明提供了一种用于产生宿主细胞的方法,该方法包括用上述核酸分子或核酸分子组合物、表达盒或表达盒组合物、载体或载体组合物中的至少一种转化宿主细胞。
第六方面,本发明提供了本发明核酸分子、核酸分子组合物、生物材料中的任一种在增强植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性中的应用。
第七方面,本发明提供了一种增强植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性的方法,所述方法包括修饰至少一种植物细胞以包含异源多核苷酸,所述异源多核苷酸包含上述核酸分子或核酸分子组合物。
在本发明的优选实施方案中,疫霉属的种是致病疫霉(Phytophthorainfestans),例如JH19、88069等。在其他实施方案中,疫霉属的种是一个能够在至少一种植物上引起植物疾病的疫霉属的种。对于本发明,疫霉的某些种包括但不限于致病疫霉、寄生疫霉(Phytophthora parasitica)、枝干疫霉(Phytophthora ramorum)、番薯疫霉(Phytophthora ipomoeae) 、米拉疫霉(Phytophthora mirabilis)、辣椒疫霉(Phytophthora capsici)、由葱疫霉(Phytophthora porri)、大豆疫霉(Phytophthorasojae)、棕榈疫霉(Phytophthora palmivora)和菜豆疫霉(Phytophthoraphaseoli)。
在本发明实施方式中,植物细胞包括茄科植物细胞。
任选地,茄科植物细胞包括马铃薯细胞、番茄细胞、茄子细胞、辣椒细胞、烟草细胞、矮牵牛细胞中的至少一种。
优选地,茄科植物细胞为马铃薯细胞。
在本发明的实施方式中,植物细胞包括非生物性转换(non-biologicallytransformed)的重组植物细胞。
在本发明实施方式中,相对于对照植物(不包含异源多核苷酸的对照植物),包含所述异源多核苷酸的植物具有增强的对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性。
在本发明实施方式中,修饰至少一种植物细胞以包含异源多核苷酸具体为:将本发明的核酸分子,核酸分子组合物,或生物材料中的表达盒或表达盒组合物、载体或载体组合物中的至少一种,转化植物细胞中,使植物细胞表达蛋白。
在上述方法中,将核酸分子、核酸分子组合物、表达盒、载体转化植物细胞的方法包括但不限于农杆菌介导的转化、基因枪转化、电穿孔、聚乙二醇(PEG)转化、脂质转染、热休克、磷酸钙沉淀、病毒介导、显微注射、基因工程编辑技术。
在本发明具体实施方式中,表达蛋白的方法例如为:(1)构建包含本发明核酸分子或核酸分子组合物的载体;(2)将所得的载体转化植物细胞;(3)将所得的植物细胞进行培养,使基因表达生成蛋白。
在本发明实施方式中,增强植物抗性的方法还包括将所述植物细胞再生成在其基因组中包含所述异源多核苷酸的植物。
优选地,相对于对照植物对所述植物疾病的抗性,再生植物包含增强的对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性。
优选地,相对于对照植物,包含所述异源多核苷酸的植物具有增强的对由疫霉属的某一个种的至少两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个或更多个小种引起的植物疾病的抗性。
在本发明实施方式中,与对照植物相比,在其基因组中包含所述异源多核苷酸的植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性增强或增加至少25%。例如增强或增加至少25%、至少50%、至少75%、至少100%、至少150%、至少200%、至少250%、至少300%、至少350%、至少400%、至少450%、至少500%或更多。
在一些实施方案中,由至少一个疫霉属的种的至少一个小种引起的植物疾病为晚疫病。
根据所需的结果,可将本发明的异源多核苷酸稳定地整合到植物细胞的基因组中或不稳定地整合到植物细胞的基因组中。
例如,如果期望的结果是产生具有增强的对由疫霉属的某一个种的至少一个小种引起的植物疾病的抗性的稳定转化的植物,那么可将异源多核苷酸例如融合至适合于将异源多核苷酸稳定整合到植物细胞基因组中的植物转化载体中。在一些实施方案中,可将本发明的核酸分子或核酸分子组合物(异源多核苷酸)稳定地整合到宿主细胞的基因组中。这种稳定转化的植物能够通过有性繁殖和/或无性繁殖将异源多核苷酸传递给后续世代的后代植物。
在本发明实施方式中,所述修饰至少一种植物细胞以包含异源多核苷酸的方式包括基因组编辑技术。
在其中不希望将异源多核苷酸稳定地整合到植物基因组中的本发明的其他实施方案中,可以利用瞬时转化方法将异源多核苷酸引入植物的一种或多种植物细胞中。在另一些实施方案中,通过显微注射、微粒轰击、病毒载体侵染等方式,或者通过喷雾、灌溉、撒粉等向植物或其部分施用经修饰的病毒和/或经修饰的病毒核酸,将异源多核苷酸不是稳定地整合到宿主细胞的基因组中,使宿主或宿主细胞瞬时表达目的基因。
在本发明实施方式中,所述植物包括任意植物物种,例如单子叶植物、双子叶植物、针叶类植物。
在具体的实施方案中,本发明的植物包括作物植物,例如玉米、大豆、小麦、水稻、棉花、苜蓿、向日葵、芸苔(芸苔属的某些种,特别是甘蓝型油菜、白菜型油菜、芥菜型油菜)、油菜籽(甘蓝型油菜)、高粱、黍属、大麦、黑小麦、红花、花生、甘蔗、烟草、马铃薯、番茄、茄子和辣椒。
优选地,植物包括茄科植物。
优选地,茄科植物包括但不限于马铃薯、番茄、茄子、辣椒、烟草、矮牵牛、粘果酸浆、灯笼果中的至少一种。
在更优选实施方案中,茄科植物是马铃薯和/或番茄。
第八方面,本发明提供了一种在农作物生产中防治由至少一个疫霉属的种的至少一个小种引起的植物疾病的方法,所述方法包括:
修饰至少一种植物细胞以包含异源多核苷酸,所述异源多核苷酸包含上述核酸分子或核酸分子组合物;
将所述植物细胞再生成在其基因组中包含所述异源多核苷酸的植物;
种植所述植物的幼苗、块茎或种子,并在有利于所述植物生长和发育的条件下培育幼苗、块茎或种子。
在本发明实施方式中,所述方法还包括从所述植物收获果实、块茎、叶、种子中的至少一种。
第九方面,本发明提供了一种鉴定植物抗病性的方法,所述方法包括在植物、其植物部分或植物细胞中检测上述核酸分子或核酸分子组合物的存在。
在本发明实施方式中,植物抗病性包括对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性。
在一些实施方案中,由至少一个疫霉属的种的至少一个小种引起的植物疾病为晚疫病。
在一些实施方案中,鉴定植物抗病性的方法可用于培育抵抗由疫霉属的某些种引起的植物疾病(例如,晚疫病)的茄科植物。这种抗性植物可用于供人或动物消费或其他用途的果实、块茎、叶和/或种子的农业生产。
在本发明实施方式中,检测所述核酸分子或核酸分子组合物的存在的方法包括:通过检测完整的核酸分子或核酸分子组合物,或者检测核酸分子或核酸分子组合物中的至少一个分子标记,来检测所述核酸分子或核酸分子组合物的存在。
在本发明实施方式中,检测上述核酸分子或核酸分子组合物的存在的方法包括PCR扩增、核酸测序、核酸杂交或用于检测由所述核酸分子或核酸分子组合物编码的蛋白或多肽的免疫学测定法。
在一些实施方案中,在鉴定显示出新赋予的或增强的对由疫霉属的某一个种的至少一个小种引起的植物疾病的抗性的茄科植物的方法中,检测茄科植物中Rpi-HMA3核苷酸序列的存在可涉及本领域已知的以下分子生物学技术中的一种或多种,所述分子生物学技术包括但不限于从植物中分离基因组DNA和/或RNA,通过PCR扩增来扩增包含本文中的Rpi-HMA3核苷酸序列和/或标记的核酸分子,对包含Rpi-HMA3核苷酸序列和/或标记的核酸分子进行测序,通过核酸杂交鉴定Rpi-HMA3核苷酸序列、标记或Rpi-HMA3核苷酸序列的转录物,以及进行用于检测由Rpi-HMA3核苷酸序列编码的R蛋白的免疫学测定。具体的,可以设计寡核苷酸探针和PCR引物以鉴定本发明的Rpi-HMA3核苷酸序列,并且此类探针和PCR引物可以用于本文其他地方公开或本领域已知的方法以在植物群体中快速鉴定包含本发明的Rpi-HMA3核苷酸序列的存在的一株或多株植物。
在本发明的其他实施方案中,检测Rpi-HMA3核苷酸序列的存在包括使用例如涉及对R蛋白特异的抗体的免疫学检测方法检测由Rpi-HMA3核苷酸序列编码的R蛋白的存在。
第十方面,本发明提供了一种将上述核酸分子或核酸分子组合物引入植物的方法,所述方法包括:
(c1) 将第一植物与第二植物杂交,产生后代植物;
所述第一植物为在其基因组中包含至少一个拷贝的上述核酸分子或核酸分子组合物的植物;
所述第二植物为在其基因组中缺少所述核酸分子或核酸分子组合物的植物;
(c2) 选择在其基因组中包含至少一个拷贝的所述核酸分子或核酸分子组合物的后代植物。
在本发明实施方案中,(c2)具体为:
在后代植物、其植物部分或其植物细胞中检测上述核酸分子或核酸分子组合物的存在;
选择在其基因组中包含至少一个拷贝的所述核酸分子或核酸分子组合物的后代植物。
在本发明实施方案中,第一植物和第二植物可以是同一个种或可以是不同的种。植物的第一物种与植物的第二物种的这种杂交被称为种间杂交,并且可用于将一种或多种目标基因从一个物种渗入缺乏该一种或多种目标基因的相关物种,并且通常涉及后代与相关物种的多代回交以及在每一代选择包含一种或多种目标基因的后代。这种种间杂交、基因渗入和回交方法是本领域熟知的,并且可以用于本发明的方法。
在用于将本发明的至少一种Rpi-HMA3基因引入在其基因组中缺乏所述至少一种Rpi-HMA3基因的植物中的本发明的方法中,第一植物或第二植物可以是花粉供体植物。例如,如果第一植物是花粉供体植物,则第二植物是花粉受体植物。同样地,如果第二植物是花粉供体植物,则第一植物是花粉受体植物。在杂交后,将花粉受体植物在有利于植物生长和发育的条件下生长,并且生长足够的时间以使种子成熟或实现用于随后的体外萌发过程(例如胚胎拯救)的其他想要的生长阶段。然后可以收获种子,并且通过本领域已知的任何方法鉴定包含所述Rpi-HMA3基因的那些种子,所述方法包括例如在本文其他地方描述的用于鉴定显示出新赋予的或增强的对由疫霉属的某一个种的至少一个小种引起的植物疾病的抗性的茄科植物的方法。在某些实施方案中,第一植物是包含一种或多种Rpi-HMA3基因的马铃薯植物,第二植物是缺乏所述一种或多种Rpi-HMA3基因的马铃薯植物。
第十一方面,本发明提供了一种植物或其植物部分,植物为如下植物之一:
(d1) 包含上述核酸分子、核酸分子组合物、表达盒、载体或宿主细胞(不包括动物细胞)中至少一种的植物;
(d2) 上述生物材料中的植物细胞生长形成的植物;
(d3) 采用上述增强植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性的方法生产获得的植物;
(d4) 所述(d1)-(d3)中任一植物自交所形成的后代,以及后代生长形成的植物;
(d5) 所述(d1)-(d3)中任一植物与其它品种杂交所形成的后代,以及后代生长形成的植物;
上述植物部分为根、茎、块茎、叶、花、果实、花粉或种子。
本发明提供的包含核酸分子、核酸分子组合物(异源多核苷酸)的植物,异源多核苷酸包含本发明的R基因核苷酸序列。优选地,这种R基因核苷酸序列编码本发明的全长R蛋白,或至少其一个或多个功能部分或一个或多个结构域。
本文公开的植物可用于在农业作物生产中,特别是在这种植物疾病普遍并且已知会对农业产量产生负面影响或至少可能产生负面影响的地区,防治由至少一个疫霉属的种的至少一个小种引起的植物疾病的方法。
第十二方面,本发明提供了一种植物或其植物部分,植物包括含有上述核酸分子或核酸分子组合物的转基因植物。
第十三方面,本发明提供了一种用于产生植物的方法,该方法包括用上述核酸分子或核酸分子组合物、表达盒或表达盒组合物、载体或载体组合物中的至少一种转化植物。
本发明还提供了采用上述用于产生植物的方法制备得到的植物。
第十四方面,本发明提供了一种供人或动物消费的农产品,供人或动物消费的农产品包括上述植物或其植物部分,或者,供人或动物消费的农产品为由上述植物或其植物部分制成的产品。
在本发明的实施方案中,供人或动物消费的农产品包括食品和其他农业产品。其他农产品包括例如从烟叶生产的烟制品(例如香烟、雪茄、烟斗和嚼烟)以及从马铃薯块茎生产的食品和工业淀粉产品。此类食品可以被人和其他动物消费或使用,所述动物包括但不限于宠物(例如狗和猫)、牲畜(例如猪、牛、鸡、火鸡和鸭)以及在淡水和海水养殖系统中生产的动物(例如鱼、虾、对虾、小龙虾和龙虾)。
第十五方面,本发明提供了一种Rpi-HMA3蛋白,其包含如下氨基酸序列中的至少一种:
(e1) SEQ ID NO:3所示的氨基酸序列;
(e2) 由SEQ ID NO:1所示的核苷酸序列编码的氨基酸序列;
(e3) 由SEQ ID NO:2所示的核苷酸序列编码的氨基酸序列;
(e4) 与SEQ ID NO:3所示的氨基酸序列具有至少75%序列同一性的氨基酸序列,其中包含所述氨基酸序列的蛋白能够赋予包含所述蛋白的植物对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性。
上述(e4)中,具有至少75%序列同一性的氨基酸序列示例性的为具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%或99.9%同一性的氨基酸序列,优选的为具有97.0%-98.0%、97.5%-98.5%、98.0%-99.0%、98.5%-99.5%、99.0%-100%同一性的氨基酸序列。
在一些实施方式中,上述蛋白的天然氨基酸序列可为来源于茄属不同种和或不同株的变体序列。上述蛋白的人工氨基酸序列可为天然氨基酸序列通过适当修饰得到的变体序列,所述修饰包括但不限于不影响目标蛋白的生物活性的适当氨基酸取代/添加/缺失、N-端的氨基酸被截短、适用于宿主细胞偏好的密码子优化、标签的添加、融合等。
优选地,Rpi-HMA3的氨基酸序列为(e1)- (e3)所示的氨基酸序列及其人工变体序列中的至少一种。
与现有技术相比,本发明具有的有益效果为:
本发明在本氏烟叶片中瞬时表达Rpi-HMA3基因可以赋予本氏烟叶片对晚疫病的抗性;
本发明在马铃薯中遗传转化Rpi-HMA3基因,在获得的阳性转化植株中进行晚疫病接种测试,证明其能够介导马铃薯对于晚疫病的抗性;
本发明为马铃薯抗晚疫病育种提供了重要的基因资源,克服马铃薯品种抗病性丧失问题,为马铃薯持久抗病提供新的保障。
附图说明
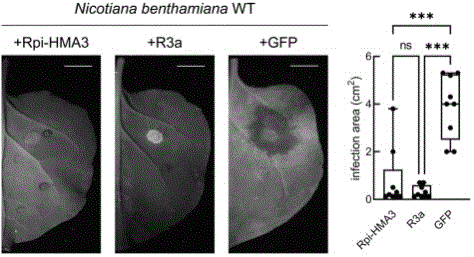
图1 瞬时表达Rpi-HMA3的本氏烟(Nicotiana benthamiana)叶片接种结果;ns表示无显著性差异;***表示P值小于0.001。
图2 瞬时表达Rpi-HMA3同源基因的本氏烟叶片接种结果;ns表示无显著性差异;**表示P值小于0.01;***表示P值小于0.001。
图3 转Rpi-HMA3基因马铃薯PCR验证结果;M表示DNA maker,即DNA标记;#1、#3、#8表示成功转入了马铃薯基因组的Rpi-HMA3的株系编号。
图4 转Rpi-HMA3基因马铃薯接种结果。
图中英文注释如下:
WT:野生型;
Infection area:感染面积;
Desiree RB:转入Rpi-blb1基因的马铃薯品种Desiree。
具体实施方式
本发明公开了晚疫病抗性基因、生物材料及应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
术语解释:
本发明中,术语“核酸分子”(或“核酸”或“多核苷酸”)可以指核苷酸的聚合形式,其可以包括RNA、cDNA、基因组DNA的有义和反义链,以及上述的合成形式和混合聚合物。核苷酸可以指核糖核苷酸、脱氧核糖核苷酸或任一类型核苷酸的修饰形式。本文中使用的“核酸分子”与“核酸”和“多核苷酸”同义。一个核酸分子的长度通常至少有10个碱基,除非另有说明。该术语可以指长度不确定的RNA或DNA分子。这个术语包括单链和双链形式的DNA。核酸分子可以包括通过天然存在和/或非天然存在的核苷酸连接在一起的天然存在和修饰的核苷酸中的一种或两者。本发明提供了包含Rpi-HMA3基因(特别是Rpi-HMA3的等位基因、同源物、直系同源物和其它天然存在的变体以及其合成或人工(即非天然存在的)变体)的核苷酸序列的核酸分子。因此,本发明的基因和多核苷酸包括天然存在的序列以及突变体和其他变体形式。
术语“变体”旨在表示基本相似的序列。对于多核苷酸,变体包含在5'和/或3'末端具有缺失(即截短);和/或在天然多核苷酸中的一个或多个内部位点处具有一个或多个核苷酸的缺失和/或添加;和/或在天然多核苷酸中的一个或多个位点处具有一个或多个核苷酸的取代的多核苷酸。如本文中所用,“天然”多核苷酸或多肽分别包含天然存在的核苷酸序列或氨基酸序列。对于多核苷酸,保守变体包括由于遗传密码的简并性而编码本发明的R蛋白之一的氨基酸序列的那些序列。可以使用公知的分子生物学技术(例如聚合酶链式反应(PCR)和杂交技术)鉴定天然存在的等位基因变体。变体多核苷酸还包括合成衍生的多核苷酸,例如通过使用定点诱变产生的但仍编码本发明的R蛋白产生的那些多核苷酸。通常,如通过序列比对程序和参数确定的,本发明的特定多核苷酸的变体将与该特定多核苷酸具有至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性。在本发明的某些实施方案中,本发明的特定多核苷酸的变体将与SEQ ID NO:1所示核苷酸序列具有至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同一性,并且任选地包含非天然存在的核苷酸序列,其与SEQ ID NO:1所示的核苷酸序列相异在于选自至少一个核苷酸的取代、至少一个核苷酸的添加和至少一个核苷酸的缺失中的至少一个核苷酸修饰。应理解,至少一个核苷酸的添加可以是在本发明的核苷酸序列内的一个或多个核苷酸的添加、向本发明的核苷酸序列的5'末端的一个或多个核苷酸的添加和/或向本发明的核苷酸序列的3'末端的一个或多个核苷酸的添加。
如本领域技术人员容易理解的,核酸分子可以被化学或生物化学修饰,或者可以包含非天然或衍生的核苷酸碱基这种修饰包括例如标记、甲基化、用类似物取代一种或多种天然存在的核苷酸、核苷酸间修饰(例如,不带电荷的键:例如膦酸甲酯、磷酸三酯、亚磷酰胺、氨基甲酸酯等;带电荷的键:例如硫代磷酸酯、二硫代磷酸酯等;悬垂部分:例如肽;嵌入剂:例如吖啶、补骨脂素等。螯合剂;烷基化剂;和修饰的键:例如α异头核酸等。),术语“核酸分子”也包括任何拓扑构象,包括单链、双链、部分双链、三链、发夹、环状和挂锁构象。
如本领域技术人员容易理解的,可在严格条件下通过杂交技术鉴定天然存在的等位基因变体,“严格条件”可为低严格条件、中严格条件、高严格条件中的任一种。“低严格条件”,例如,为5×SSC、5×Denhardt溶液、0.5% SDS、50%甲酰胺、32℃的条件。“中严格条件”,例如,为5×SSC、5×Denhardt溶液、0.5% SDS、50%甲酰胺、42℃的条件。“高严格条件”,例如,为5×SSC、5×Denhardt溶液、0.5% SDS、50%甲酰胺、50℃的条件。在上述条件中,越提高温度,越能期待高效地获得具有高同源性的DNA。影响杂交严格性的因素可为温度、探针浓度、探针长度、离子强度、时间、盐浓度等多种因素,本领域技术人员通过适宜选择这些因素,可实现同样的严格条件。
本发明中,术语“同一性”指与示例性核酸序列或氨基酸序列的序列相似性。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
本文提供的序列同一性值是指利用Dispatcher tools framework (https://www.ebi.ac.uk/services)对所述序列进行全长序列的同一性评价。也可以使用其它软件获取序列的同一性值,例如所述序列通过Jalview 2.11.2.7版(Waterhouse, A.M.,Procter, J.B., Martin, D.M.A, Clamp, M. and Barton, G. J. (2009) "JalviewVersion 2 - a multiple sequence alignment editor and analysis workbench"Bioinformatics 25 (9) 1189-1191 doi: 10.1093/bioinformatics/btp033)使用多重比对软件包MUSCLE v3.8.31版("MUSCLE: multiple sequence alignment with highaccuracy and high throughput" Nucleic Acids Res. 32(5):1792 (2004))中的默认参数;或其任何等同程序)获得的值。
另外的数学算法是本领域中已知的并且可以用于比对两个序列。参见例如Karlinand Altschul(1990)Proc.Natl.Acad.Sci.USA 87:2264的算法,如Karlin andAltschul(1993)Proc.Natl.Acad.Sci.USA 90:5873-5877中改动。这种算法被引入Altschul et al.(1990)J.Mol.Biol.215:403的BLAST程序内。可以用BLASTN程序(针对核苷酸序列搜索的核苷酸查询)执行BLAST核苷酸搜索,以获得与本发明的核酸分子同源的核苷酸序列,或用BLASTX程序(针对蛋白质序列搜索的翻译核苷酸查询),以获得与本发明的核酸分子同源的蛋白质序列。可以用BLASTP程序(针对蛋白质序列搜索的蛋白质查询)执行BLAST蛋白质搜索,以获得与本发明的蛋白质分子同源的氨基酸序列,或用TBLASTN程序(针对翻译的核苷酸序列搜索的蛋白质查询),以获得与本发明的蛋白质分子同源的核苷酸序列。为了获得用于比较目的的缺口比对,Gapped BLAST(在BLAST2.0中)可以如Altschul etal.(1997)Nucleic Acids Res.25:3389中所述利用。可替代地,PSI-Blast可以用于执行迭代搜索,其检测分子之间的遥远关系。参见Altschul et al.(1997)supra。当利用BLAST、Gapped BLAST和PSI-Blast程序时,可以使用相应程序(例如BLASTX和BLASTN)的默认参数。比对也可以通过检查手动执行。
本发明中,术语“同源性”有时用于指两个或多个核酸或氨基酸序列之间以位置同一性百分比表示的相似性水平(即序列相似性或同一性)。同源性也指进化相关性的概念,通常由共享相似序列的不同核酸或蛋白质之间相似的功能特性来证明。
在一些实施方案中,本发明相关的同源性序列可以通过示例性序列在进化关系相近的物种样本基因组或转录组数据中比对得到。例如在相同属的不同种之间、相同种的不同株之间,通过示例性序列在样本基因组或转录组数据中经比对得到该序列的同源序列,本领域技术人员可以预期其具有相同或相似的功能。
本发明中,术语“CDS序列”是指编码序列(Coding sequence)。DNA转录成mRNA,mRNA经剪接等加工后翻译出蛋白质,所谓CDS就是与蛋白质序列一一对应的DNA序列,且该序列中间不含其它非该蛋白质对应的序列,不考虑mRNA加工等过程中的序列变化,其与蛋白质的密码子完全对应。
在一些实施方案中,本发明相关的核酸分子可从来自任何来源的包含给定核酸分子的DNA中克隆出来,例如通过PCR扩增和/或限制性酶切。在一些实施方案中,本发明相关的核酸分子是合成的。任何获得发明相关的核酸分子的方法都是与本发明相容的。
本发明中,术语“合成的”是指通过作为体外过程的化学合成产生的多核苷酸(即DNA或RNA)分子。例如,可以在Eppendorf™管内的反应过程中产生合成DNA,使得合成DNA由天然DNA或RNA链酶促产生。可以利用其他实验室方法来合成多核苷酸序列。寡核苷酸可以通过使用亚磷酰胺的固相合成在寡核苷酸合成器上化学合成。合成的寡核苷酸可以作为复合物彼此退火,从而产生“合成的”多核苷酸。用于化学合成多核苷酸的其他方法在本领域是已知的,并且可以容易地实施用于本公开。
本发明中,术语“基因”是指表达特定蛋白质的核酸片段。“基因”包括编码基因产物的DNA区域,以及调节基因产物产生的所有DNA区域,无论这种调节序列是否与编码和/或转录序列相邻。因此,基因包括但不一定限于启动子序列、终止子、翻译调节序列如核糖体结合位点和内部核糖体进入位点、增强子、沉默子、绝缘体、边界元件、复制起点、基质附着位点、内含子和基因座控制区。
本发明中,术语“基因产物”是指基因产生的任何产物。例如,基因产物可以是基因的直接转录产物(如mRNA、tRNA、rRNA、反义RNA、干扰RNA、核糖酶、结构RNA或任何其他类型的RNA),也可以是由mRNA翻译产生的蛋白质。
本发明中,术语“蛋白质”(或“蛋白”或“肽”或“多肽”或“肽组合物”),既包括天然存在的蛋白质,又包括其变体及修饰形式。本文所用的术语“蛋白质”和“多肽”可互换使用,因此术语多肽可用于指全长多肽,也可用于指全长多肽的一个片段。术语“片段”指多肽序列的一部分。“片段”或“生物学活性部分”包括包含足够数目的邻接氨基酸残基以保留生物学活性的多肽,例如N-端的氨基酸被截短的多肽。
“变体”蛋白质指通过天然蛋白质的N-末端和/或C-末端处一个或多个氨基酸的缺失(所谓的截短)、天然蛋白质中一个或多个内部位点处一个或多个氨基酸的缺失和/或添加或者天然蛋白质中一个或多个位点处一个或多个氨基酸的取代而从天然蛋白质衍生的蛋白质。此类变体可以由例如遗传多态性或人工操作产生。如通过序列比对程序和参数测定的,R蛋白的生物活性变体将与本发明的氨基酸序列(例如SEQID NO:3所示的氨基酸序列)具有至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同一性。本发明的蛋白质的生物活性变体可与该蛋白质相异在于少至1-15个氨基酸残基,少至1-10个,诸如6-10个、少至5个、少至4个、3个、2个或甚至1个氨基酸残基。更优选地,此类变体赋予包含所述变体的植物或其部分以增强的对由至少一个疫霉属的种的至少一个小种引起的植物疾病的抗性。在一些实施方案中,将在编码变体的DNA中产生的突变不会将序列置于读框之外。最理想的是,突变不会产生可产生二级mRNA结构的互补区域。
可以以各种方式改变本发明的蛋白质,包括氨基酸取代、缺失、截短和插入。用于此类操作的方法通常是本领域已知的。用于诱变和多核苷酸改变的方法是本领域熟知的。对于不影响目标蛋白的生物活性的适当氨基酸取代的指导,可见于Dayhoff等(1978)Atlasof Protein Sequence andStructure(蛋白质序列和结构图册)(Natl.Biomed.Res.Found.,Washington,D.C.)的模型,通过引用结合到本文中。诸如将一个氨基酸取代成具有类似特性的另一个氨基酸的保守取代,可以是最优的。
预期本文包括的蛋白质序列的缺失、插入和取代不会产生蛋白质特征的根本变化。然而,当难以预测取代、缺失或插入的确切效果时,本领域技术人员将理解,将通过常规筛选测定来评估该效果。也就是说,可以通过下文公开的测定来评估活性。
变体多核苷酸和蛋白质还包括衍生自诱变和重组过程(诸如DNA改组)的序列和蛋白质。这种DNA改组的策略在本领域中是已知的。
本发明中,术语“氨基酸”是指任何氨基酸(标准和非标准氨基酸二者),包括但不限于α-氨基酸、β-氨基酸、γ-氨基酸和δ-氨基酸。适合的氨基酸的实例包括但不限于丙氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸、酪氨酸、精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯基丙氨酸、苏氨酸、色氨酸和缬氨酸。
本发明中,术语“分离”是指已从其自然环境中移除,或从首次形成化合物时存在的其他化合物中移除。术语“分离的”包括从天然来源分离的材料以及通过在宿主细胞中重组表达制备后回收的材料(如核酸和蛋白质),或化学合成的化合物,如核酸分子、蛋白质和肽。任何获得发明相关的蛋白质的方法都是与本发明相容的。
本发明中,术语“表达盒”是指可以在特定限制性位点或通过同源重组插入核酸或多核苷酸的DNA片段。如本文所用,DNA片段包含编码目的多肽的多核苷酸,并且表达盒和限制性位点被设计成确保表达盒插入到用于转录和翻译的适当阅读框中。在一个实施方案中,表达盒可以包括编码目的多肽的多核苷酸,并且除了多核苷酸之外还具有促进特定宿主细胞转化的元件。在一个实施方案中,表达盒还可以包括允许在宿主细胞中增强编码目的多肽的多核苷酸表达的元件。这些元件可以包括但不限于:启动子、最小启动子、增强子、应答元件、终止子序列、聚腺苷酸化序列等。
表达盒还可以包含用于选择转化细胞的选择标记基因。选择标记基因用于选择转化的细胞或组织。标记基因包括编码抗生素抗性的基因,诸如编码新霉素磷酸转移酶II(NEO)和潮霉素磷酸转移酶(HPT)的基因,以及赋予对除草化合物(诸如草铵膦、溴苯腈、咪唑啉酮和2,4-二氯苯氧基乙酸酯(2,4-d))抗性的基因。另外的选择标记包括表型标记诸如β-半乳糖苷酶和荧光蛋白,诸如绿色荧光蛋白(GFP)、青色荧光蛋白(CYP)以及黄色荧光蛋白。
本发明中,术语“载体”与“构建体”、“克隆载体”和“表达载体”可互换使用,并且意味着可以将DNA或RNA序列(例如外源基因)引入宿主细胞以转化宿主并促进所引入序列的表达(例如转录和翻译)的载体。“非病毒载体”是指不包含病毒或逆转录病毒的任何载体。在一些实施方案中,“载体”是包含至少一个DNA复制起点和至少一个选择性标记基因的DNA序列。例子包括但不限于携带外源DNA进入细胞的质粒、粘粒、噬菌体、细菌人工染色体(BAC)或病毒。载体还可以包括一个或多个基因、反义分子和/或选择性标记基因和本领域已知的其他遗传元件载体可以转导、转化或感染细胞,从而导致细胞表达由载体编码的核酸分子和/或蛋白质。术语“质粒”是指能够在原核或真核宿主细胞中进行常染色体复制的核酸环状链。该术语包括核酸,其可以是DNA或RNA,并且可以是单链或双链的。该定义的质粒也可以包括对应于细菌复制起点的序列。
在一些实施方案中,“克隆载体”能自主复制或整合在宿主细胞基因组中,其还以一个或更多个限制性内切酶位点为特征,可以在该位点以确定的方式切割载体并可将期望的DNA序列连接到载体中,从而新的重组质粒保留了它在宿主细胞中复制的能力。在质粒的情况下,期望序列的复制可随着质粒在宿主细胞(如细菌宿主)中的拷贝数增加而多次发生,或仅在宿主通过有丝分裂繁殖前在每个宿主中发生一次。在噬菌体的情况下,复制可在裂解期过程中主动发生或在溶原期过程中被动发生。
在一些实施方案中,“表达载体”可通过限制性酶切和连接将期望的DNA序列插入其中,以使其与调控序列有效连接中并可表达为RNA转录本。载体还可包含适合用于鉴定细胞是否已被载体转化或转染的一种或更多种标记序列。标记包括如编码提高或降低其对抗生素或其他化合物之抗性或敏感性的蛋白质的基因,编码可通过本领域已知标准方法检测活性的酶的基因(例如β-半乳糖苷酶、萤光素酶或碱性磷酸酶),以及对转化或转染细胞、宿主、菌落或菌斑的表型有可见影响的基因(例如绿色荧光蛋白)。优选的载体是那些能够自主复制和表达与其有效连接的DNA片段中所存在的结构基因之产物的载体。
在本发明中,术语“表达”是指基因产物的生物合成,包括所述基因产物的转录和/或翻译。从DNA分子“表达”或“产生”蛋白质或多肽是指转录和翻译编码序列以产生蛋白质或多肽,而从RNA分子“表达”或“产生”蛋白质或多肽是指翻译RNA编码序列以产生蛋白质或多肽。
基因表达可受外部信号的影响,例如,细胞、组织或生物体暴露于一种可增加或减少基因表达的物质。基因的表达也可以在从DNA 到RNA 再到蛋白质的过程中的任何地方受到调控。基因表达的调控可通过对转录、翻译、RNA 转运和加工、中间分子(如mRNA)降解的控制,或通过特定蛋白质分子生成后的激活、失活、区隔或降解,或通过它们的组合来实现。基因表达所需调控序列的确切性质在物种或细胞类型之间可能会有所不同,但一般按需要应包括,分别涉及转录和翻译起始的5′非转录和5′非翻译序列,例如TATA盒、加帽序列、CAAT序列等等。尤其是,这种5′非转录调控序列将包括启动子区域,其包括控制对有效连接的基因进行转录控制的启动子序列。调控序列也可包括增强子序列或所需的上游激活子序列。本发明载体可任选地包括5′前导或信号序列。合适载体的选择和设计是在本领域普通技术人员的能力和判断范围内的。
在一些实施方案中,当编码本发明任何酶的核酸分子在细胞中表达时,多种转录控制序列(例如启动子/增强子序列)可用于指导其表达。启动子可是天然的启动子,即基因的启动子在其内源环境中,这提供了基因表达的正常调节。在一些实施方案中,启动子可是组成型的,即启动子持续转录其相关基因而不受调节。也可用多种条件启动子,例如由分子的存在与否控制的启动子。化学物质调控的启动子可用于通过应用外源化学调节剂调节宿主中基因的表达。取决于目的,启动子可以是化学物质诱导型启动子,其中化学物质的应用诱导基因表达,或是化学物质阻遏型启动子,其中化学物质的应用阻遏基因表达。化学物质诱导型启动子是本领域已知的,包括但不限于玉米In2-2启动子(其由苯磺酰胺除草剂安全剂激活)、玉米GST启动子(其被用作萌发前除草剂的疏水性亲电子化合物激活)以及烟草PR-1a启动子(其被水杨酸活化)。其他感兴趣的化学物质调控的启动子包括类固醇反应性启动子中的糖皮质激素诱导型启动子以及四环素诱导型和四环素阻遏型启动子。
包含所有必需表达元件的表达载体是市售的,而且是本领域技术人员熟知的。例如见Sambrook等,Molecular Cloning:A Laboratory Manual,第二版,Cold SpringHarbor Laboratory Press,1989。通过将外源性DNA(RNA)导入细胞而对细胞进行遗传工程。该外源性DNA(RNA)被置于转录元件的有效控制下,以允许外源性DNA在宿主细胞中表达。
本发明中,术语“转化”包括可将核酸分子引入这种细胞的所有技术。例子包括但不限于:用病毒载体转染;质粒载体转化;电穿孔;脂肪感染;显微注射;农杆菌介导的转移;直接DNA摄取;WHISKERS™介导的转化;和微射弹轰击。这些技术可用于宿主细胞的稳定转化和瞬时转化。“稳定转化”是指将核酸片段引入宿主生物的基因组,导致遗传稳定。一旦稳定转化,核酸片段就稳定地整合到宿主生物和任何后续世代的基因组中。含有转化核酸片段的宿主生物被称为“转基因”生物。“瞬时转化”是指将核酸片段引入宿主生物的细胞核或含DNA的细胞器,导致基因表达而没有遗传稳定的遗传。
在一些实施方案中,为了转化宿主和宿主细胞,可以使用标准技术将本发明的核苷酸序列插入本领域已知的适合于在宿主或宿主细胞中表达核苷酸序列的任何载体中。载体的选择取决于优选的转化技术和待转化的目标宿主物种。转化方法取决于待转化的宿主细胞、所用载体的稳定性、基因产物的表达水平和其他参数。
本发明中,术语“植物”包括种子、植物细胞、植物原生质体、可从其再生植物的植物细胞组织培养物、植物愈伤组织、植物块以及在植物或植物部分诸如胚胎、花粉、胚珠、种子、块茎、繁殖体、叶、花、分枝、果实、根、根尖、花药等中是完整的植物细胞。再生植物的后代、变体和突变体也包括在本发明的范围内,条件是这些部分包含引入的多核苷酸。如本文中所用,除非另有明确说明或从使用的背景中显而易见,否则“后代”和“后代植物”包括植物的任何后续世代,无论是由有性生殖和/或无性繁殖产生的。
术语“转基因植物”和“转化植物”是指如上所述的“植物”的等同术语,其中植物包含通过例如本文其他地方公开的或另外地本领域已知的任何稳定和瞬时转化方法引入植物的异源核酸分子、异源多核苷酸或异源多核苷酸构建体。此类转基因植物和转化植物还指例如首先引入异源核酸分子、异源多核苷酸或异源多核苷酸构建体的植物以及包含所述异源核酸分子、异源多核苷酸或异源多核苷酸构建体的任何其后代植物。
在其他实施方案中,使用本发明的方法产生包含异源多核苷酸的植物,所述异源多核苷酸包含本发明的R基因核苷酸序列,所述方法涉及基因组编辑以修饰所述植物的基因组中的天然或非天然基因的核苷酸序列。此处天然或非天然基因包含与本发明的R基因核苷酸序列不同的核苷酸序列,经修饰的天然或非天然基因包含本发明的R基因核苷酸序列。通常,此类方法包括使用在其基因组中包含天然或非天然基因的植物,其中所述天然或非天然基因包含与本发明的R基因核苷酸序列同源的核苷酸序列,并且还包括向植物中引入包含本发明的R基因核苷酸序列的至少一部分的核酸分子。优选地,天然或非天然基因的核苷酸序列与本发明的至少一种R基因核苷酸序列有约70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高的核苷酸序列同一性。这种天然或非天然基因可以是例如R基因,特别是Rpi-HMA3基因的不能赋予或不知能否赋予植物对植物疾病的抗性的非功能性同源物。
术语“茄科植物”旨在包括在成熟或发育的任何阶段的茄科植物,以及除非上下文另有明确说明,否则为从任何此类植物中获得或衍生的任何细胞、组织或器官(植物部分)。茄科植物部分包括但不限于果实、茎、块茎、根、花、胚珠、雄蕊、叶、胚、分生组织区、愈伤组织、花药培养物、配子体、孢子体、花粉、小孢子、原生质体等。如本文所用,术语“块茎”旨在表示整个块茎或其任何部分,例如包含一个或多个芽(即“眼”)的马铃薯块茎的切片或部分,所述芽适于在田间种植以产生马铃薯植物。本发明还包括由本发明的茄科植物产生的种子。
在本发明的某些实施方案中,本发明的植物,特别是茄科植物,可包含一种、两种、三种、四种、五种、六种或更多种编码R蛋白的核苷酸序列。通常但非必要地,两种或更多种R蛋白质彼此不同。对于本发明,当两种R蛋白具有不同的氨基酸序列时,R蛋白与另一种R蛋白不同。在本发明的某些实施方案中,用于抵抗由疫霉属的某一个种引起的植物疾病的不同R蛋白中的每一种在抗性特征方面具有一种或多种差异,例如针对同一疫霉属的种的不同小种和/或小种的组或甚至不同的疫霉属的种的抗性。通过将两种、三种、四种、五种、六种或更多种核苷酸序列与编码用于抵抗疫霉属的某一个种的不同小种或疫霉属的某些种(spp.)的不同R蛋白的每种核苷酸序列组合,可以产生包含针对疫霉属的单个种的多个小种或甚至疫霉属的多个种的广谱抗性的茄科植物。这种茄科植物,特别是马铃薯或番茄植物,可用于其中疫霉属的某一个种的多个小种(例如致病疫霉的多个小种)普遍存在的地区的农业中。
包含多个R基因的本发明的植物可以例如通过用包含至少一种本发明的Rpi-HMA3核苷酸序列的异源多核苷酸转化已包含一种或多种其他R基因核苷酸序列的植物来生产。已包含一种或多种其他R基因核苷酸序列的这种植物可包含所述基因组或植物天然的R基因,通过有性生殖引入植物的R基因或通过用R基因核苷酸序列转化植物或其祖先引入的R基因。或者,可以通过例如转化或有性生殖将所述一种或多种其他R基因核苷酸序列引入本发明的植物中,所述植物已经包含本发明的异源多核苷酸。
在其他实施方案中,可通过用包含两种或更多种R基因核苷酸序列的异源多核苷酸或载体稳定地转化植物,来将两种或更多种不同的R基因序列引入植物中。或者,可使用本文其他地方描述的或本领域已知的基于同源重组的基因组修饰方法将本发明的异源多核苷酸整合到植物的基因组中,紧邻另一个R基因核苷酸序列。
本发明中,术语“DNA”或“RNA”的使用无意将本发明限制于包含DNA或RNA的多核苷酸分子。本领域普通技术人员将认识到,本发明的方法和组合物包括由脱氧核糖核苷酸(即DNA)、核糖核苷酸(即RNA)或核糖核苷酸和脱氧核糖核苷酸的组合组成的多核苷酸分子。此类脱氧核糖核苷酸和核糖核苷酸包括天然存在的分子和合成类似物,包括但不限于核苷酸类似物或经修饰的骨架残基或键联,其是合成的、天然存在的和非天然存在的,其具有与参考核酸相似的结合特性,并且其以与参考核苷酸相似的方式代谢。此类类似物的实例包括但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯、2-O-甲基核糖核苷酸、肽-核酸(PNA)。本发明的多核苷酸分子还包括所有形式的多核苷酸分子,包括但不限于单链形式、双链形式、发夹、茎环结构等。此外,本领域普通技术人员应理解,本文公开的核苷酸序列还包括该示例性核苷酸序列的互补序列。
表1 本发明基因的物种信息
本发明中所用试剂、仪器、菌种或生物材料等如非特殊说明均可通过商业渠道获得。以下实施例中所用致病疫霉菌株JH19、88069从南京农业大学植物保护学院植物病理系作物疫病基因组学实验室处获取。
下面结合实施例,进一步阐述本发明:
实施例1 Rpi-HMA3基因的获得与载体制备:
根据Solanum burkartii基因组序列信息设计特异性引物Rpi-HMA3-F和Rpi-HMA3-R。
用高保真酶从Solanum burkartii基因组中克隆获得Rpi-HMA3基因,反应条件为:95℃5 min;95℃30 sec,58℃50 sec,72℃3 min 30 sec,Go to 35 cycles;72℃10 min。
通过同源重组的方法将片段构建至pBin308表达载体中,通过热激法将连接产物转化至大肠杆菌DH5α感受态细胞中,在含有100 mg/L卡那霉素的LB固体培养基上37℃倒置培养12到16 h,挑选单菌落送测,获得测序正确的阳性转化子pBin308-Rpi-HMA3。
Rpi-HMA3基因组序列(SEQ ID NO:1):
ATGGAAGTCATGGATGTTTTTGTGGAGAACCTCAATGTTCTATTGAAGATCACTGATCCATGTTCGTGGTTTTTTGTTCCAGGACACATGAAGGAACAAATAGAACAAGTGTTAAAGGAGTTGAAGTTATTGAGATTTTTTGTCTGCTTTGTTTCAAACAAATGTAGTATACAGCCTCAATACCGACATACTACTTTTTATATTCATGCTTTAATTGAGGCTAGCCACATTGCAATGGTTGTCTGGTTGCATTTGCCAGTCGTCTATGGCAACGGAAATCCAGACTTGTCTCCAAGTGAAGTCAGACGTTTGCGTTCTGATTTCATGGAAATGAAGATTAAGTCCATTCAGCCAGACATCAGCCGCAACAATATTTATATTGATGTCCTGCAAGCTTTGAAGTCGACCATACCACCAGCTCAAAAGAAGCATGCAGCTGAGAGTGGCATTGTGGAGATTCCGACACACAGTCTGATGGTTGGTTTGAGTGATCAAATGGTTAACCTTCAGGAGATGCTCTGCCTTCTAAGAGACAATCTCATTCATCTGCCAATACTAGATCTGCAATTTCATCTTCAAGATATGGATTCTGTTATTGTTGATGCCGGACTTCTTATTTACTCATTATATGATATCAAGGGGGAGAAGGAAGACACAACATTGGATGATATGAACCAAGCACTTGGTTTTGATCTTCCAAGAAACATTGAGCCTATCAAGGTGATGGTCTACCTCGTCATGCAAAAGGCATTTCAATGTAACTTGCCAAGGGTTCATGGACTAGGCTATGTCGATTTTCTATTGAAAAACCTGAAGGATTTCCAAGGCCGTTATTCAGATTCACTCGCTTTCCTCAAGAATCAAATTCAAGTAATTCAAACGGAATTTGAGAGCTTGCAACCTTTCCTGAAGGTTATCGTAGAAGAGCCACACAATACGTTCAAGAGGCTGAATGAAGATTGTGCTATACAGATAATTAGGAAAGCACATGAAGTGGAATATGTAGTTGATGCTTGTATAAACAAAGGCATTCCTCATTGGTGCCTCGAGCGTTGGCTCCAGGATATCATAGAGGAGATTACTTGTATCAAAGCAAAGATTCAGGAAAAGAACACGGTTGACGATACAATGAAGACTGTCATTGCTCGTACATCATCAAAACTGGCAAGGACTCCAAGGATGAATGAAGAAATTGTTGGGTTTGAGGATGTCATAGAAAATTTAAGAAAAAAACTACTGAGTGGAGCCAAAGGGCAAGATGTCATTTCAATTCACGGCATGCCAGGTCTAGGTAAGACGACTTTAGCCAACACACTCTATTCTGACAGGTCAGTTGTCTCTCAATTTGATATTTGTGCACAATGTTGTGTGTCTCAAGTATATTCGTATAAGGACTTGTTATTGTCCTTGCTATGTGATGCTATTGGTGAGGCTTCTGTGCATAGAGAACTTCATGCCAACGAATTAGCTGATAAGCTTCGCAAAACTTTATTGCCCCAAAGGTACCTTATCCTTGTTGATGACGTGTGGGAAAATAGTGCTTGGGATGATTTAAGAGGTTGTTTTCCAGATGCCAATAACAGAAGCAGAATCATTCTAACAACAAGACATCATGATGTTGCTAAATATGCTAGTGTTCTTAGTGATCCCCTTCATCTTCGTATGTTTGACGAAAGTGAAAGTTGGAAGTTGCTTGAAAAGAAGGTGTTTGGTGAACAAAGCTGTTCCCCTCTCCTAAAAGATGTTGGGCTAAGAATAGCAAAAATGTGTGGACAACTCCCTCTTTCAATTGTTTTGGTGGCTGGTATTCTGTCAGAGATGGAAAAGGAAGTAGAATGTTGGGAACAAGTGGCCAACAATTTGGGTACCCACATTCACAATGACTCAAGGGCCATTGTAGACAACAGTTATCATGTTTTACCCTGTCATCTTAAGGCTTGCTTCCTTTATTTTGGAGCATTTTTAGAGGATAGAGTGATTGATATTTCAAGGTTAATAAGGTTATGGATATCAGAATCATTTATAAAAAGTAGTGAAGGCAGGAGCTTGGAGGATATAGCAGAAGGTTACTTGGAGAATCTTATTGGAAGAAATCTAGTAATGGTTACTCAGAGGGCCGATTCAGATGGTAAGGTCACAGCATGTCGCCTTCATGATGTATTACTCGACTTCTGCAAGGAAATAGCAGCTGAGGAGAATTTTCTACTATGGATAAAACGGTAATATGATAAGTAATGGTACTTTCAATCATTCAAGTATTTCAAGTTATATTTGAAAATTAATGATATGATTTTGCTAATTGATATATTCACAGAGATCAGATTACCAAAGCTGTTTACTCTCACAAGCAGCATGCTCACTTGGTGTTCACTGAAATGGATAATCTTTTAGAATGGAATACGTCTGGCTCACTTGTTGGCTCTGTACTTTTTAAGAATTATGACCTAAACTTCACCCGTCGTCTCTTATCCTCTCATGCTTTTGAAATTTCACACATTTTACCACATTTCAAGTTTCTAAAAGTAATGGATTTGGAGCACCAGGTTGTTATTGATTTTATTCCAACTGAGCTCCCTTACTTGAAGTATTTCTCTGCGCTCATTGATCAGAATTCAATTCCTTCAAGCATATCCAATCTTTGGAACCTTGAAACTCTTGTATTAAAATGTAGATCAGCTGCCAGACATGACAGGGTATTACTACCTAGTACAGTTTGGGATATGGTTAAATTGAGATATCTGTATATTCCTAAGTTCATCCCTGAAAATAAAAAAGCATTACTCGAGAACTCTCCAAAACTTGATGATTTGGAAACCCTTTCCAATCCATATTGCGCTTGTGTTGAGGATGCAGAATTGATGCTGAGAAAAACACCTAATCTTCGAAAACTGAAATGTGGAGTCGAGTGCTTAGAATACCGCCATCAGTACCATGCGTTGAATTTTCCAATATGGCTTGAAATACTAAAGCTTTATCGATCAAAAGCCTTTAAAACCATCCCCTTCTGCATCTCTGCACCAAATCTCAAATACCTGAAACTCTCTGGCTTTTACCTGGATTCTCCGTACTTATCAGAAACTGCTGATCACCTGAAGAACCTTGAGGTACTCAAACTGTACTACGTTGAATTTGGTAATCAAAGGGAATGGAAAGTGAGCAATGGCAAGTTCCCTCAACTCAAAATCTTGAAACTAGAAGATTTGTCCTTGATTAAATGGATTGTAGCTGATGATGCCTTTCCTAACCTTGAACAATTGGTTTTGCGTGGATGTCGAGATCTTATGGAGATCCCTTCTTGTTTCATGGACATCCTTTCTCTGCAATACATCAAGGTAGAAAACTGCAATGAGTCGGTTGTCAAGTCAGCCATGAATATACAAGAAACACAAGTCGAAGATAATCAAAATACTAATTTCAAGCTCGTTCTCATCGAGGTACACTACTGAAAAAAGCTTTATTCTGCATGATTTTGATGAATCAGAAATGGCCTAAATTTTATGAACTGTTTTCTCTGTTATCTTTACCTGGTGGCCTCATTTTACATTTGGGTTTTTCCTTGCAGAAAAAGACGTTGAAATTAAATTTATCTTTTGATGAAGATATAGACAATGTATTGCAAAGATTGTTTATTTTTCAAGGTACTATTTTTTTTTCTTTCTTTCCTTTTTTGAGTACACCAAATAGATAGATTCATCTTTTTTGTCTTTTCGATATGAAAGGGATAGAATCAATTTCAACTGATATGAAAGAGAAGATACTTACTGTAACCGGAGATGTGGATGCTGATGAAGTTCAATTAGTTGTGGAGTAA
Rpi-HMA3 CDS序列(SEQ ID NO:2):
ATGGAAGTCATGGATGTTTTTGTGGAGAACCTCAATGTTCTATTGAAGATCACTGATCCATGTTCGTGGTTTTTTGTTCCAGGACACATGAAGGAACAAATAGAACAAGTGTTAAAGGAGTTGAAGTTATTGAGATTTTTTGTCTGCTTTGTTTCAAACAAATGTAGTATACAGCCTCAATACCGACATACTACTTTTTATATTCATGCTTTAATTGAGGCTAGCCACATTGCAATGGTTGTCTGGTTGCATTTGCCAGTCGTCTATGGCAACGGAAATCCAGACTTGTCTCCAAGTGAAGTCAGACGTTTGCGTTCTGATTTCATGGAAATGAAGATTAAGTCCATTCAGCCAGACATCAGCCGCAACAATATTTATATTGATGTCCTGCAAGCTTTGAAGTCGACCATACCACCAGCTCAAAAGAAGCATGCAGCTGAGAGTGGCATTGTGGAGATTCCGACACACAGTCTGATGGTTGGTTTGAGTGATCAAATGGTTAACCTTCAGGAGATGCTCTGCCTTCTAAGAGACAATCTCATTCATCTGCCAATACTAGATCTGCAATTTCATCTTCAAGATATGGATTCTGTTATTGTTGATGCCGGACTTCTTATTTACTCATTATATGATATCAAGGGGGAGAAGGAAGACACAACATTGGATGATATGAACCAAGCACTTGGTTTTGATCTTCCAAGAAACATTGAGCCTATCAAGGTGATGGTCTACCTCGTCATGCAAAAGGCATTTCAATGTAACTTGCCAAGGGTTCATGGACTAGGCTATGTCGATTTTCTATTGAAAAACCTGAAGGATTTCCAAGGCCGTTATTCAGATTCACTCGCTTTCCTCAAGAATCAAATTCAAGTAATTCAAACGGAATTTGAGAGCTTGCAACCTTTCCTGAAGGTTATCGTAGAAGAGCCACACAATACGTTCAAGAGGCTGAATGAAGATTGTGCTATACAGATAATTAGGAAAGCACATGAAGTGGAATATGTAGTTGATGCTTGTATAAACAAAGGCATTCCTCATTGGTGCCTCGAGCGTTGGCTCCAGGATATCATAGAGGAGATTACTTGTATCAAAGCAAAGATTCAGGAAAAGAACACGGTTGACGATACAATGAAGACTGTCATTGCTCGTACATCATCAAAACTGGCAAGGACTCCAAGGATGAATGAAGAAATTGTTGGGTTTGAGGATGTCATAGAAAATTTAAGAAAAAAACTACTGAGTGGAGCCAAAGGGCAAGATGTCATTTCAATTCACGGCATGCCAGGTCTAGGTAAGACGACTTTAGCCAACACACTCTATTCTGACAGGTCAGTTGTCTCTCAATTTGATATTTGTGCACAATGTTGTGTGTCTCAAGTATATTCGTATAAGGACTTGTTATTGTCCTTGCTATGTGATGCTATTGGTGAGGCTTCTGTGCATAGAGAACTTCATGCCAACGAATTAGCTGATAAGCTTCGCAAAACTTTATTGCCCCAAAGGTACCTTATCCTTGTTGATGACGTGTGGGAAAATAGTGCTTGGGATGATTTAAGAGGTTGTTTTCCAGATGCCAATAACAGAAGCAGAATCATTCTAACAACAAGACATCATGATGTTGCTAAATATGCTAGTGTTCTTAGTGATCCCCTTCATCTTCGTATGTTTGACGAAAGTGAAAGTTGGAAGTTGCTTGAAAAGAAGGTGTTTGGTGAACAAAGCTGTTCCCCTCTCCTAAAAGATGTTGGGCTAAGAATAGCAAAAATGTGTGGACAACTCCCTCTTTCAATTGTTTTGGTGGCTGGTATTCTGTCAGAGATGGAAAAGGAAGTAGAATGTTGGGAACAAGTGGCCAACAATTTGGGTACCCACATTCACAATGACTCAAGGGCCATTGTAGACAACAGTTATCATGTTTTACCCTGTCATCTTAAGGCTTGCTTCCTTTATTTTGGAGCATTTTTAGAGGATAGAGTGATTGATATTTCAAGGTTAATAAGGTTATGGATATCAGAATCATTTATAAAAAGTAGTGAAGGCAGGAGCTTGGAGGATATAGCAGAAGGTTACTTGGAGAATCTTATTGGAAGAAATCTAGTAATGGTTACTCAGAGGGCCGATTCAGATGGTAAGGTCACAGCATGTCGCCTTCATGATGTATTACTCGACTTCTGCAAGGAAATAGCAGCTGAGGAGAATTTTCTACTATGGATAAAACGAGATCAGATTACCAAAGCTGTTTACTCTCACAAGCAGCATGCTCACTTGGTGTTCACTGAAATGGATAATCTTTTAGAATGGAATACGTCTGGCTCACTTGTTGGCTCTGTACTTTTTAAGAATTATGACCTAAACTTCACCCGTCGTCTCTTATCCTCTCATGCTTTTGAAATTTCACACATTTTACCACATTTCAAGTTTCTAAAAGTAATGGATTTGGAGCACCAGGTTGTTATTGATTTTATTCCAACTGAGCTCCCTTACTTGAAGTATTTCTCTGCGCTCATTGATCAGAATTCAATTCCTTCAAGCATATCCAATCTTTGGAACCTTGAAACTCTTGTATTAAAATGTAGATCAGCTGCCAGACATGACAGGGTATTACTACCTAGTACAGTTTGGGATATGGTTAAATTGAGATATCTGTATATTCCTAAGTTCATCCCTGAAAATAAAAAAGCATTACTCGAGAACTCTCCAAAACTTGATGATTTGGAAACCCTTTCCAATCCATATTGCGCTTGTGTTGAGGATGCAGAATTGATGCTGAGAAAAACACCTAATCTTCGAAAACTGAAATGTGGAGTCGAGTGCTTAGAATACCGCCATCAGTACCATGCGTTGAATTTTCCAATATGGCTTGAAATACTAAAGCTTTATCGATCAAAAGCCTTTAAAACCATCCCCTTCTGCATCTCTGCACCAAATCTCAAATACCTGAAACTCTCTGGCTTTTACCTGGATTCTCCGTACTTATCAGAAACTGCTGATCACCTGAAGAACCTTGAGGTACTCAAACTGTACTACGTTGAATTTGGTAATCAAAGGGAATGGAAAGTGAGCAATGGCAAGTTCCCTCAACTCAAAATCTTGAAACTAGAAGATTTGTCCTTGATTAAATGGATTGTAGCTGATGATGCCTTTCCTAACCTTGAACAATTGGTTTTGCGTGGATGTCGAGATCTTATGGAGATCCCTTCTTGTTTCATGGACATCCTTTCTCTGCAATACATCAAGGTAGAAAACTGCAATGAGTCGGTTGTCAAGTCAGCCATGAATATACAAGAAACACAAGTCGAAGATAATCAAAATACTAATTTCAAGCTCGTTCTCATCGAGAAAAAGACGTTGAAATTAAATTTATCTTTTGATGAAGATATAGACAATGTATTGCAAAGATTGTTTATTTTTCAAGGGATAGAATCAATTTCAACTGATATGAAAGAGAAGATACTTACTGTAACCGGAGATGTGGATGCTGATGAAGTTCAATTAGTTGTGGAGTAA
Rpi-HMA3蛋白质序列(SEQ ID NO:3):
MEVMDVFVENLNVLLKITDPCSWFFVPGHMKEQIEQVLKELKLLRFFVCFVSNKCSIQPQYRHTTFYIHALIEASHIAMVVWLHLPVVYGNGNPDLSPSEVRRLRSDFMEMKIKSIQPDISRNNIYIDVLQALKSTIPPAQKKHAAESGIVEIPTHSLMVGLSDQMVNLQEMLCLLRDNLIHLPILDLQFHLQDMDSVIVDAGLLIYSLYDIKGEKEDTTLDDMNQALGFDLPRNIEPIKVMVYLVMQKAFQCNLPRVHGLGYVDFLLKNLKDFQGRYSDSLAFLKNQIQVIQTEFESLQPFLKVIVEEPHNTFKRLNEDCAIQIIRKAHEVEYVVDACINKGIPHWCLERWLQDIIEEITCIKAKIQEKNTVDDTMKTVIARTSSKLARTPRMNEEIVGFEDVIENLRKKLLSGAKGQDVISIHGMPGLGKTTLANTLYSDRSVVSQFDICAQCCVSQVYSYKDLLLSLLCDAIGEASVHRELHANELADKLRKTLLPQRYLILVDDVWENSAWDDLRGCFPDANNRSRIILTTRHHDVAKYASVLSDPLHLRMFDESESWKLLEKKVFGEQSCSPLLKDVGLRIAKMCGQLPLSIVLVAGILSEMEKEVECWEQVANNLGTHIHNDSRAIVDNSYHVLPCHLKACFLYFGAFLEDRVIDISRLIRLWISESFIKSSEGRSLEDIAEGYLENLIGRNLVMVTQRADSDGKVTACRLHDVLLDFCKEIAAEENFLLWIKRDQITKAVYSHKQHAHLVFTEMDNLLEWNTSGSLVGSVLFKNYDLNFTRRLLSSHAFEISHILPHFKFLKVMDLEHQVVIDFIPTELPYLKYFSALIDQNSIPSSISNLWNLETLVLKCRSAARHDRVLLPSTVWDMVKLRYLYIPKFIPENKKALLENSPKLDDLETLSNPYCACVEDAELMLRKTPNLRKLKCGVECLEYRHQYHALNFPIWLEILKLYRSKAFKTIPFCISAPNLKYLKLSGFYLDSPYLSETADHLKNLEVLKLYYVEFGNQREWKVSNGKFPQLKILKLEDLSLIKWIVADDAFPNLEQLVLRGCRDLMEIPSCFMDILSLQYIKVENCNESVVKSAMNIQETQVEDNQNTNFKLVLIEKKTLKLNLSFDEDIDNVLQRLFIFQGIESISTDMKEKILTVTGDVDADEVQLVVE
Rpi-HMA3内源启动子序列(SEQ ID NO:4):
GGGACGTTCTCAGTTTCTTATAAAAGTAATTTTTAAAAAATTAAAAAAGGAATAGCGGGACTCCTCGATTTTTAAGAACGATGTTGTCCGTCGATTTTGACCCAATTTTTAGCGTTGTTGCTTGCAGTTCCTATTCTTTCATAATTCTTCTTTGATTTTGTTTTTTCGAGCACCACACATATCTCAATTGAACTATTCAATCAATTATTGACATACAATTATTCCAATGCCCATACGTCATATCATCAGTAGGGCCTGAGCTAAGACATATGAATTCGGTAGTGTGTAATAATTTTGATTTGAACTTTTGATATATATATTTATTCTAGATTTGTCTCTGCACTTTATCCGCACTTTATCCATCTGCCTTGCTTGAATACTTTACAATATTTTATCTTTAGTGTGCCAGCAATGACTTTGTTTTTTGTTTGTAGGGCATTTTATCTTCACTATTTTTGGCAGAATTAAATATTTTATTATTGCTATGGAGTATCACTGGTTGTCATTCTTATGATCTTATCTTCTACACCCTTTTTCTGAAACTTTTTTTTTCCTTTTTTAGCTAGAAATGATATTTGTATAATTTTATATAAATTTTAAATATTTACGTGTACACCCTAAATTGAAGGATACGTATTATGCCAAAAGTAACGGTGGAATAGTAAATTAACTGTGAGGTGCGGAAGTGAAGAAACTAACTATAATACTGTATTTTTTTTTAAAAATGAAAGACCACATGGGTCAAGATTTTTATTAAACTAAGAAAATATATACAAAATCATGTGGGTTGCCTAAGTGTACAGCCCACCAAAATAAATAAACGAAATAATAAGGGCCGTTTGGTAGGCCGCATTAAAAGAAATAGTTCATGTATTATATATGATATTATTTAGTACTATGTTTGGTAGGAATTTGATCCTATGTATAACTAATTTATGGATTAGTTATACATCCTACATGGTATTATAGGATGTATTACTAATATCTTCCATTTAGAGATATTAGTATAACATAGGATATAATACCATGGGATAAGTCACATAAAGACACAAATATCCCTCAAATCATTTTAATTATTTTTTTCATTTTCTTGATTTTATGTTTAATATTTGTACTAGTAAAAGTAAATTTATTTAAATAAATTAGCTTACAAATTATTTAGAGAGAGTTGTTTGTTACTAAATATATCTAATACAAATCAATACAAATTTAAAATGTGAGTTATTTAACATTTACTAATTAAAAGGCAAATATATCACTAATTTATTCGTATTTTGAACAATTTAAAAAATGACATACATATTAAAATTATAACTTTCAATTTTTATGTGTAAATGTATATGGTTTATTCAATTTTATCATTGTTGACCGTCTTTTTAATTTTAAAAGTAGTTGGTTTATCTTTTTAAAATTGAAAATTGACATTTTGTGAGTGATCAATTTATTAAGATGAAAATTATTTATCCTCAAATAATTCAAGTAGAAAATTGAAAACGTGACAACAAAATTATTCATCTCATAGCTAGTTAGAAGGCCATAAAAAAATATCTACTTTGACCCAATTACATAATAATTTAAGGGGTTTATTTGGAAAGAAAATTTTTAAAGAATTTTAATCCAAACACAAGTTGAAATTGAAAATAATAAACCAAAACACTTGATAAAAATATAGCATGCATTACTAATCCTTTTGTATCAAAGGAGCCCTAAAAGACAACACCTACTCTGTATTGTATCTCAATTGTTCTTCTTTCCCAGTGCACAACAGTTTAATTCTTGTGTCACAAGGATGTGTTTCAACAATGAATTGTCTGATCTGAAAGATTATCTCCGTAGCATTCTGCAAGATCCAAATTACTCGGATGCTGCAAGGGATCTAATAAATTTCATTATATGGGAGTTAAAATTCCTTGATTGTTTTCTCCATT
表2Rpi-HMA3引物序列
实施例2本氏烟叶片瞬时表达Rpi-HMA3及致病疫霉接种:
通过热激法将实施例1获得的重组质粒pBin308-Rpi-HMA3转化至农杆菌GV3101中,过夜培养含有pBin308-Rpi-HMA3的农杆菌菌株,5000 r离心收集5 min,并将菌株重新悬浮于MES缓冲液中,调节OD
同时,采用上述方法验证Rpi-HMA3的直系同源基因Rpi-HMA3-C369(其CDS序列如SEQ ID NO:7所示)、Rpi-HMA3-C509(其CDS序列如SEQ ID NO:8所示)、Rpi-HMA3-C550(其CDS序列如SEQ ID NO:9所示)对致病疫霉JH19的抗性。
结果显示,相较于阴性对照,瞬时表达Rpi-HMA3使本氏烟对致病疫霉JH19可产生显著抗性,且Rpi-HMA3赋予的抗性和阳性对照赋予的抗性无显著性差异(图1)。
但Rpi-HMA3的直系同源基因Rpi-HMA3-C369、Rpi-HMA3-C509、Rpi-HMA3-C550不能赋予本氏烟对致病疫霉JH19产生抗性(图2)。
实施例3马铃薯稳定表达Rpi-HMA3及致病疫霉接种:
以下实施例以CamV 35S启动子驱动抗病基因Rpi-HMA3的表达,构建于植物表达载体pBin308中。利用农杆菌介导的稳定转化马铃薯感病品种Desiree的茎秆,最终获得转基因植株,通过卡那霉素抗性筛选和表型验证,得到了抗晚疫病和耐卡那霉素除草剂的转基因材料。具体的转基因方法如下:
(1)茎段预培养:
在Z1N2培养基上铺2张灭菌滤纸,加2 mL PACM(含有1μg/mL 2,4-二氯苯氧乙酸与0.5μg/mL激动素的植物MS液体培养基),切一定数目的茎段,整齐摆放,光照培养(48 h)。
(2)菌种活化:
从-80℃取待转化的菌液100 μL,于1.5 mL离心管,加1mL LB (kana+Rif)液体培养基,28℃,220 r,摇床培养12 h后,取100 μL 于50 mL 离心管,加10 mL LB (kana+Rif )液体培养基,28℃,220 r,摇床培养过夜,检测OD值,要求OD
(3)侵染:
将农杆菌菌液离心(4℃,4000 r,10 min),收集菌沉淀,用MS20液体(加1%的乙酰丁香酮AS,每10 mL液体MS20培养基加10 μL AS)培养基重悬OD
(4)分化:
取茎段于分化培养基Z2N0.01中培养。每隔两周更换培养基,当愈伤分化出芽时,转移至生根培养基(每升MS30 + 2mL 300mg/mL 特美汀TMT +1mL 50mg/mL卡那霉素)中,每3到4周继代一次。
(5)筛选转基因阳性植株
待生根培养基上的马铃薯苗生根且长到一定大小即可进行筛选。取植株的叶片并提取DNA进行PCR的验证。
根据pBin308-Rpi-HMA3重组质粒序列设计特异性引物pBin308-F(5’→3’:TGATAACAGCGGGTTAATTAACG,SEQ ID NO:10)和pBin308-R(5’→3’:CTCTAGATCAGGTGGATCCC,SEQ ID NO:11)。以转基因马铃薯叶片基因组DNA为模板,进行PCR扩增。反应条件为:95℃5min;95℃30 s,60℃30 s,72℃20 s,Go to 25 cycles;72℃10 min。PCR 产物大小为441bp。附图结果证明目标基因Rpi-HMA3整合到了马铃薯基因组中(图3)。
实施例4转基因马铃薯叶片接种致病疫霉:
本实施例中的转基因马铃薯晚疫病抗性鉴定使用从培养皿中收集所得致病疫霉菌株88069的游动孢子,将每毫升50,000个孢子的10微升液滴接种到4至6周龄的马铃薯植株的离体叶片上。接种后的第5天记录结果。每次接种实验使用1-2片独立的叶片,每个实验至少重复3次。
结果显示,与未转化马铃薯Desiree相比,稳定表达Rpi-HMA3的转基因马铃薯植株对致病疫霉菌株88069产生显著抗性(图4)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 镁盐改性生物炭材料及其在降低抗生素抗性基因丰度中的应用
- 一种用于检测大白菜根肿病抗性基因CRs的生物材料及其应用
