通过施用经遗传修饰的病毒载体用于基因治疗的系统和方法
文献发布时间:2024-04-18 19:59:31
相关申请的交叉引用
本申请要求以下的权益和优先权:2021年2月5日提交的美国临时申请No.63/146,538;2021年5月14日提交的美国临时申请No.63/188,652;和2022年2月2日提交的美国临时申请No.63/305,836,其各自通过引用整体并入本文。
背景
技术领域
本公开内容一般性地涉及基因治疗方法和在该方法中使用的组合物。更具体地,本公开内容涉及经遗传修饰的病毒载体及其施用方法,用于维持或改善接受者的寿命和/或生理健康的一个或更多个方面。
相关技术
过去三十年来,遗传学和细胞生物学的研究进展已经极大地增强了描述许多人疾病的分子基础的能力。分子遗传技术特别有效。这些技术允许分离出与由单个基因的损伤引起的常见遗传疾病(例如鸟氨酸氨甲酰基转移酶(ornithine transcarbamylase,OTC)缺乏症、囊性纤维化、血友病、免疫缺陷综合征等)相关的基因,以及那些导致更复杂疾病例如癌症的基因。因此,定义为将遗传物质引入到细胞中以改变其表型或基因型的基因治疗在过去几十年中已经得到深入研究。
为了有效的基因治疗,有必要在体内将治疗性基因高效地递送至相关细胞,以在延长的(治疗性)时间段内表达治疗性基因并确保转导事件没有有害作用。为了满足这些标准,已经评价了多种载体系统。这些系统包括病毒载体,例如逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒和单纯疱疹病毒,以及非病毒系统,例如脂质体、分子缀合物和其他颗粒载体。尽管病毒系统在实验室研究中是有效的,但在人临床应用中还尚未确定是治愈性的。
一般来说,基因治疗载体可以分为两种主要类型——病毒和非病毒的。最常用的病毒基因治疗系统是逆转录病毒载体和腺病毒载体,部分是因为历史原因,以及部分是因为它们相对简单地以临床上有用的量制备。逆转录病毒载体和腺病毒载体在一些情况下二者均被用于临床中,并且还使用腺相关病毒载体、弹状病毒(rhabdovirus)、疱疹病毒载体和基于痘苗病毒或痘病毒的载体进行了一些临床试验。这些病毒具有不同的优势和缺点,但都相对有效地将基因递送至靶组织。局限性包括难以制备足够的量、不能在体内准确靶向基因递送、或者病毒基因产物具有毒性或免疫副作用。然而,应该注意的是,即使使用相对有效的病毒载体,用常规技术预期基因可被递送至每个受影响的细胞(或期望的靶细胞)也是不合理的。
非病毒基因治疗系统包括裸DNA、配制在脂质体中的DNA、用聚阳离子缩合剂或杂交系统配制的DNA,以及这样的DNA,所述DNA与肽或蛋白质(例如单链抗体)缀合,以将它们靶向特定组织。这些系统更易于构建在合理的调节步骤中,以实现在体内的长的半衰期、递送至目标靶细胞/组织并进入靶细胞的胞质和核并伴随表达。尽管对于这些问题中的每一个都有可能的解决方案,但是它们还没有被有效地组合,并且在体内的基因转移效率仍然难以实现。因此,同样对于这些系统来说,目前预期基因可被递送至每一个期望的靶细胞或以其他方式提供生物体范围的有益健康的作用是不合理的。
为了使基因递送事件得到一些程度的放大,先前的努力尝试了免疫系统的刺激、多种形式的旁观者作用、凋亡的扩散、抗血管生成作用、促凝作用、感受态病毒载体的复制和其他机制。
腺病毒科(adenoviridae)是在1953年首次从儿童的扁桃体和腺样体组织中分离出来的DNA病毒家族。六个亚属(A、B、C、D、E和F)和超过49种血清型的腺病毒已被鉴定为人中的感染原。尽管一些分离株与动物中的肿瘤相关,但没有一个与人中的肿瘤相关。最常用于基因治疗的腺病毒载体属于亚属C,血清型2或5(Ad2或Ad5)。这些血清型与肿瘤形成无关。Ad2或Ad5感染导致上呼吸道、眼、淋巴组织的急性黏膜感染,以及类似于普通感冒的那些的轻微症状。在群体中暴露于C型腺病毒是普遍的,其中大多数成年人对这类型的腺病毒呈血清阳性。
腺病毒病毒体是直径为65nm至80nm的二十面体,其包含13%的DNA和87%的蛋白质。病毒DNA的长度为约36kb,并且作为通过与线性基因组每一个5’末端共价连接的蛋白质相互作用而结合在一起的环状附加体而天然存在于受感染细胞的核中。对腺病毒基因组的功能性环状克隆进行操作的能力极大地促进了分子操作,并允许产生复制缺陷型载体。
腺病毒生物学的两个方面对常用的复制缺陷型腺病毒载体的产生至关重要。第一是以反式产生必需调节蛋白的能力,以及第二是腺病毒核心不能包装超过总基因组尺寸的105%。第一种最初是通过293细胞的产生来利用的,293细胞是转化的人胚肾细胞系,其具有来自包含病毒基因组E1区的左手端(0至11个图谱单位)的稳定整合的腺病毒序列。这些细胞提供反式的E1A基因产物,并因此允许产生具有缺乏E1A的基因组的病毒体。这样的病毒体被认为是复制缺陷型的,因为它们不能在缺乏E1A基因的细胞中保持活跃的复制(尽管复制可能在高载体浓度下发生)。293细胞允许产生这些复制缺陷型载体并且已经用于许多(如果不是全部的话)经批准使用腺病毒载体的基因治疗方案中。
第二种是通过创建超过105%极限的骨架以迫使其与携带期望的转基因的穿梭质粒重组来利用的。大多数目前使用的腺病毒载体系统是基于C亚群腺病毒,血清型2或5的骨架。缺失单独的E1/E3区或与E2/E4组合的E1/E3区分别产生了第一代或第二代复制缺陷型腺病毒载体。如上所述,腺病毒病毒体可包装高达野生型基因组尺寸的105%的基因组,允许插入约1.8kb的另外的异源DNA。E1序列的缺失添加了另外的3.2kb,而E3区的缺失提供了另外的3.1kb外源DNA空间。因此,E1和E3缺失的腺病毒载体提供了总容量为约8.1kb的异源DNA序列包装空间。
腺病毒已被广泛表征并成为基因治疗的有吸引力的载体,这是因为它们相对良性的症状(即使作为野生型感染),它们在体外的易于操作,持续产生高滴度的经纯化病毒的能力,它们转导静止期细胞的能力,以及它们靶组织的广泛范围。另外,腺病毒DNA不整合到宿主细胞染色体中,这使对插入诱变或潜在种系效应的担忧最小化。这使得它们成为肿瘤基因治疗方案和其他可期望瞬时表达的方案的有吸引力的载体。然而,这些载体对于代谢疾病和其他可期望长期表达的应用不是很有用。已经在针对癌症、囊性纤维化和其他未描述主要毒性的疾病的I期临床试验中对缺乏全部或部分E1A和E1B区的人C亚群腺病毒载体进行了评价。这些载体的安全性的主要例外是一名接受非常大剂量的直接进入肝动脉的E1、E4缺失的载体的年轻男子的死亡。浓注大剂量的腺病毒病毒体导致肝毒性、DIC样响应,并最终导致呼吸窘迫和死亡。
使用“复制条件性”腺病毒用于癌症治疗已在临床研究中显示出一些作用。“复制条件性”载体或病毒缺少对“正常”细胞中的复制很重要但在靶细胞中不太关键的基因组部分,或者包含靶向特定组织的调节元件(例如,用于表达病毒E1A、E1B、E2或E4区的组织特异性启动子)。对于复制缺陷型腺病毒载体,这些载体效力的主要问题是对所递送病毒体的原始宿主应答,以及由于宿主的抗病毒免疫应答而有限的重复施用能力,这降低了在初次和后续应用中使用这些病毒载体的有效性。为了解决病毒载体的免疫中和问题,通过非病毒方法递送产生病毒体所需的核酸序列是有利的,尤其是如果这些核酸序列可通过靶向方法递送的话。
逆转录病毒是近年来最严格审查的一组病毒。主要基于感染的致病作用而不是系统发育关系,逆转录病毒家族传统上被细分为三个亚家族。这些亚家族的常见名称是肿瘤病毒、慢病毒和泡沫病毒。后者与任何疾病均不相关并且也是最不为人所知的。逆转录病毒也基于其以下嗜性进行描述:嗜生态性,指那些仅感染起源物种(或密切相关物种)的病毒;双嗜性,指那些有广泛物种范围(通常包括人和原始物种)的病毒;和异嗜性,指那些感染多种物种但不感染起源物种的病毒。
肿瘤病毒包含最大的逆转录病毒亚家族,并与快速或缓慢的肿瘤产生相关。基于病毒体的结构和成熟过程,肿瘤病毒被细分为A型、B型、C型或D型。迄今为止开发的大多数逆转录病毒载体属于这一组的C型。这些病毒包括鼠白血病病毒和长臂猿病毒并且是几乎没有调节基因的相对简单的病毒。像大多数其他逆转录病毒一样,基于C型的逆转录病毒载体不利地需要靶细胞分裂用于整合和生产性转导。
在慢病毒亚家族中发现了细胞分裂要求的一个重要例外。人免疫缺陷病毒(humanimmunodeficiency virus,HIV),即最著名的慢病毒和获得性免疫缺陷综合征(acquiredimmunodeficiency syndrome,AIDS)的病原体,表明整合在非分裂细胞中。尽管逆转录病毒整合至分裂细胞的限制可能是一些方案(例如癌症治疗方案)的安全因素之一,但它可能是其用于治疗先天性代谢缺陷和退化性状的唯一最大限制因素。
几乎在所有的脊椎动物中均发现了逆转录病毒的实例,并且尽管分离的逆转录病毒株种类繁多,并且与它们相关的疾病多种多样,但是所有的逆转录病毒共有相似的结构、基因组组织和复制模式。逆转录病毒是直径约100nm的包膜RNA病毒。该基因组由两条最大尺寸为约10kb的正RNA链组成。该基因组由两个位于结构基因gag、pol和env的侧翼的长末端重复序列(two long terminal repeat,LTR)组成。另外的基因(调节基因或癌基因)的存在在病毒株之间广泛变化。env基因编码病毒外包膜中存在的蛋白质。这些蛋白质传递病毒体的嗜性(物种和细胞特异性)。pol基因编码数种对病毒复制周期重要的酶蛋白。这些酶包括负责将单链RNA基因组转化为双链DNA的逆转录酶、将双链病毒DNA整合到宿主基因组中所必需的整合酶,以及加工病毒结构蛋白所必需的蛋白酶。gag或组特异性抗原基因编码形成病毒体核衣壳所必需的蛋白质。这些基因对于逆转录病毒载体的产生性感染和生命周期的必要性限制了可成功使用的基因的核苷酸长度和/或数目。
虽然重组逆转录病毒被认为是将遗传物质稳定转移到活跃复制的哺乳动物细胞的基因组中的有效载体,但逆转录病毒载体是非复制型递送系统,具有编码仅8kb遗传信息的能力。为了组装和传播(propagate)重组逆转录病毒载体,缺失的病毒gag-pol-env功能必须以反式提供。
自从它们在1980年代早期发展以来,来源于C型逆转录病毒的载体代表了在人和哺乳动物细胞中基因表达的一些最有用的基因转移工具。它们的感染机制和基因表达已被充分了解。逆转录病毒载体的优点包括它们相对缺乏内在的细胞毒性以及它们整合到活跃复制细胞基因组中的能力。然而,逆转录病毒作为基因递送系统有许多限制,包括有限的宿主范围、病毒体的不稳定性、对细胞复制的要求以及有限的基因组/衣壳空间,这限制了载物基因的尺寸和数目。
虽然双嗜性逆转录病毒具有广泛的宿主范围,但一些细胞类型相对难以感染。扩大逆转录病毒载体宿主范围的一种策略是使用其他病毒的包膜蛋白来衣壳化载体的基因组和核心组分。这样的假型病毒体表现出包膜蛋白所来源于的病毒的宿主范围和其他特性。例如,逆转录病毒的包膜基因产物可被VSV-G替换,以产生能够感染对亲本载体不应(refractory)的细胞的假型载体。虽然逆转录病毒感染通常需要病毒包膜蛋白和特异性细胞表面受体之间的特异性相互作用,但VSV-G与磷脂酰丝氨酸和可能的细胞膜其他磷脂组分相互作用,通过膜融合介导病毒进入。由于病毒的进入不依赖于特定蛋白受体的存在,因此VSV具有极其广泛的宿主细胞范围。另外,VSV可通过超速离心浓缩至滴度大于10
然而,由于VSV-G蛋白介导细胞融合,因此其对表达它的细胞是有毒性的。这导致了产生稳定的假型逆转录病毒包装细胞系的技术困难。产生VSV-G假型载体颗粒的一种方法是在表达逆转录病毒基因组和逆转录病毒的gag/pol组分的细胞进行DNA转染之后,瞬时表达VSV-G基因。通过这种方法来产生载体颗粒是麻烦的、需要大量人力,并且不容易扩大用于大量实验。
其他人已经通过腺病毒介导的诱导型基因表达制造了VSV-G假型逆转录病毒包装。例如,四环素可控表达已被用于产生编码细胞毒性VSV-G蛋白的重组腺病毒。通过同时转导以下三种重组腺病毒拯救了稳定转染的逆转录病毒基因组:一种编码在tet启动子控制下的VSV-G基因,另一种编码逆转录病毒gag/pol基因,以及第三种编码四环素反式激活子基因。这导致了VSV-G假型逆转录病毒载体的产生。尽管这两种系统均产生假型逆转录病毒,但它们都不太可能用于需要重复性(reproducible)、经鉴定的载体制备的临床应用。
将逆转录病毒载体用于人基因治疗应用的另一限制是其体内半衰期短。这部分地是由于人和非人灵长类血清迅速灭活C型逆转录病毒。病毒灭活是通过不依赖抗体的机制发生的,所述机制涉及经典补体途径的激活。显示人补体蛋白Clq通过与跨膜包膜蛋白p15E相互作用来直接与MLV病毒体结合。基于在鼠细胞中产生的表面糖蛋白含有半乳糖-α-(1,3)-半乳糖糖部分的观察结果,提出了补体灭活的另一机制。人和其他灵长类有针对这种碳水化合物部分的循环抗体。这些抗碳水化合物抗体能够固定补体,这导致人血清随后灭活鼠逆转录病毒和鼠逆转录病毒生产细胞。因此,人血清中补体对逆转录病毒载体的灭活由用于产生载体的细胞系和病毒包膜组分确定。
先前实现更好的基因治疗系统的努力包括使用多腺病毒载体系统来瞬时转导细胞以产生逆转录病毒后代。编码逆转录病毒骨架(LTR、包装序列和报道基因)的腺病毒载体和编码所有反式作用逆转录病毒功能(调节gag、pol和env的CMV启动子)的另一腺病毒载体已被证明高效地完成体内基因转移至靶实质细胞,使它们成为瞬时逆转录病毒产生细胞。用人卵巢癌细胞系SKOV3原位异种移植无胸腺小鼠并随后用两种腺病毒载体系统进行腹膜内攻击,其表明了这样的概念:腺病毒转导已经随着逆转录病毒颗粒的原位产生而发生,所述逆转录病毒颗粒稳定地转导靶实质中的邻近细胞。虽然这些实验系统已经建立了腺病毒载体可用于使靶细胞成为瞬时逆转录病毒载体生产细胞的基础,但是由于体内单细胞的多载体转导的随机性质,它们不太可能容易地用于需要重复性、经鉴定的载体制备的临床应用。
腺病毒相关病毒是包含简单DNA的病毒,通常需要其他病毒(例如腺病毒或疱疹病毒)的功能以获得完整的复制效率。该病毒体由rep和cap基因构成,侧翼为两个反向末端重复序列(inverted terminal repeat,ITR)。这些载体具有整合到细胞基因组中用于稳定基因转移的能力。然而,进一步使用这些载体的主要障碍是体外大规模产生它们的能力。这一努力的主要障碍是rep和所需辅助病毒基因的毒性细胞作用。AAV载体的产生方法的实例包括用rep-cap表达盒和辅助病毒基因共转染递送目的ITR侧翼基因的质粒,以及将目的ITR侧翼基因和辅助病毒基因共递送至稳定表达rep-cap的细胞,递送具有所有必需组分的嵌合病毒载体,例如疱疹病毒载体。
本领域中关于利用腺病毒、逆转录病毒和腺相关元件稳定递送治疗性基因的方法的缺陷包括缺乏单一载体。对多种载体的需求决定了使用更多的抗生素,这是成本更高并且也是不期望的,因为越来越多数目的毒株对常用的抗生素产生了抗性。另外,多载体的使用降低了效率,这是因为需要不止一次进入单个细胞的转导事件,这在统计学上以降低的量发生(与一次转导事件的需求相比)。本领域中其他值得注意的缺陷包括对病毒载体的快速清除和宿主免疫,对它们的长期使用的限制,来自病毒整合的可能致癌作用,有限的细胞嗜性,以及单一载体中可递送的基因的有限尺寸和/或数目。
因此,基因治疗方法存在许多缺点,这些缺点可以被解决以解决本领域中长期感觉到的和未满足的需求。
附图说明
为了描述可获得本公开内容的上述和其他优点和特征的方式,将通过参考其中示出的本公开内容的具体实施方案来呈现上面简要描述的本公开内容的更具体描述。应当理解,这些附图仅描绘了本公开内容的典型实施方案,并因此不应被认为是对其范围的限制。将通过使用附图更具体且详细地描述和说明本公开内容,在附图中:
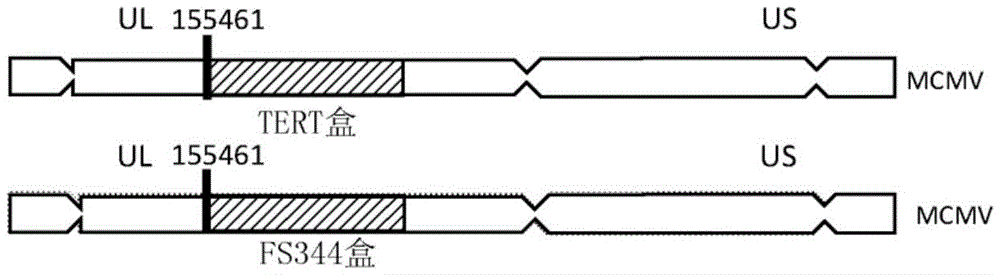
图1A至1D示出了表达mTERT和mFS344(本文也简称为mFST)的重组MCMV
图2A至2D是示出了用重组MCMV
图3A是示出了用MCMV
图3B是通过qPCR比较WT、MCMV
图3C示出了在24月龄的小鼠中,在经处理组和未经处理组的不同器官中相对端粒长度的确定。还测量了8月龄的小鼠。使用特定的端粒引物对基因组DNA进行qPCR。将一对36B4基因引物用作用于归一化的单拷贝基因。
图4A至C示出了通过ELISA在WT、MCMV
图5A至5D提供了用重组MCMV
图6示出了未经处理和经处理组群中小鼠的平均体重的图;每个组群在两个不同的处理组中进行测试。
图7A和7B示出了未经处理和经处理组群中小鼠的存活;每个组群在两个不同的处理组中进行测试。
图8A至8C示出了通过电子显微术对小鼠心肌的分析。图6A示出了取自未经感染对照(UN)、野生型MCMV感染对照(MCVM)、MCMV
图9A至9C示出了通过电子显微术对小鼠骨骼肌的分析。图7A示出了取自未经感染对照(UN)、野生型MCMV感染对照(MCVM)、MCMV
图10示出了小鼠骨骼肌组织匀浆物的结果,其从未经感染小鼠和用表达小鼠TERT和小鼠FS344基因的重组MCMV感染的小鼠中获得,并通过Western印迹探测多种线粒体和自噬标志物。PGC1α和TFAM表示线粒体生物发生的转录因子;复合物I、复合物II、复合物III和复合物V表示线粒体功能的标志物;以及LCI、LC3II和p62表示自噬标志物。将GAPDH用作上样对照。
图11示出了小鼠心肌组织匀浆物的结果,其从未经感染小鼠和用表达小鼠TERT和小鼠FS344基因的重组MCMV感染的小鼠中获得,并通过Western印迹探测多种线粒体和自噬标志物。PGC1α表示线粒体生物发生的转录因子;复合物I、复合物II、复合物III和复合物V表示线粒体功能的标志物;以及LC3I、LC3II和p62表示自噬标记。将GAPDH用作上样对照。
图12A至12E示出了可用于产生本文中公开的CMV载体的示例性细菌人工染色体(BAC)构建体,该构建体包含一种或更多种适于向人对象施用的治疗性基因。图12A示出了包含人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)作为外源插入物的示例性构建体。图12B示出了包含人卵泡抑素-344(hFST)作为外源插入物的示例性构建体。图12C示出了包含klotho(KL或KLOTHO)作为外源插入物的示例性构建体。图12D示出了包含Dsup作为外源插入物的示例性构建体,以及图12E示出了包含PGC1α作为外源插入物的示例性构建体。
图13A至13F示出了可用于产生本文中公开的CMV载体的示例性BAC构建体,每个构建体包含多个适于向人对象施用的治疗性基因。图13A示出了包含hTERT和hFST二者作为外源插入物的示例性构建体。图13B示出了包含hFST和KLOTHO二者作为外源插入物的示例性构建体。图13C示出了包含hTERT和KLOTHO二者作为外源插入物的示例性构建体。图13D示出了包含hTERT、hFST和PGC1α作为外源插入物的示例性构建体。图13D示出了包含hTERT、hFST和KLOTHO作为外源插入物的示例性构建体。图13E示出了包含hTERT、hFST和Dsup作为外源插入物的示例性构建体,以及图13F示出了包含hTERT、hFST和PGC1α作为外源插入物的示例性构建体。
图14示出了通过同源重组制备CMV-hFST重组BAC的方法。
图15示出了通过同源重组制备CMV-hTERT重组BAC的方法。
图16示出了通过同源重组制备CMV-hFST+hTERT重组BAC的方法。
图17示出了通过同源重组制备CMV-hFST+hTERT+KL重组BAC的方法。
发明详述
所选术语和定义
在详细描述本公开内容的多个实施方案之前,应当理解,本文中使用的任何标题仅用于组织目的,并不意味着用于限制说明书或权利要求书的范围。还应当理解,本公开内容的多个方面,包括设备、系统和方法,可以参考一个或更多个实施方案或实施方式来说明,这些实施方案或实施方式本质上是示例性的。本文中使用的术语“示例性”意指“用作示例、实例或说明”,并且不应该被解释为比本文中公开的其他实施方案更优选或更有利。另外,对本公开内容或发明的“实施方式”的参考包括对其一个或更多个实施方案的具体参考,并且反之亦然,并且旨在提供说明性实例而不限制本发明的范围,本发明的范围由所附权利要求书而非以下描述来表示。本公开内容不限于具体示例性的系统、方法、设备、产品、过程和/或套件的参数,这些参数当然可以变化。类似地,虽然本文中将使用特定的语言来描述示例性实施方案,但是将会理解,这并不意指由此限制本公开内容的范围。相反,应当理解的是,用于描述示例性实施方案的语言仅仅是举例说明性的,而不应被解释为限制本公开内容的范围(除非这样的语言在本文中被明确描述为必要的)。
除非另有说明,否则在本说明书和权利要求书中使用的表示量、成分、距离或其他测量值的数字应理解为任选地由术语“约”或其同义词进行修饰。当术语“约”、“大约”、“基本上”等与规定的量、值或条件结合使用时,其可被认为是意指偏离规定的量、值或条件的小于20%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%的量、值或条件。至少,并不试图将等同原则的应用限制在权利要求书的范围内,每个数值参数应当根据报告的有效数字的数值并通过应用一般的舍入技术来解释。
注意,在本公开内容中并且特别是在权利要求和/或段落中,术语例如“包含/包括”及其变化形式等可以具有美国专利法赋予其的含义(例如,其可意指“包含/包括”等);并且术语例如“基本上由……组成”及其变化形式具有美国专利法赋予其的含义(例如,其允许未明确列举的要素,但排除在现有技术中发现或者影响本发明要求保护的实施方案的基本或新的特征的要素)。因此,应当理解,术语“包括”、“具有”、“涉及”、“包含”、“特征在于”及其变体以及本文中使用的类似术语,包括在权利要求中,应该是包含性的和/或开放式的,应该具有与单词“包含”及其变体相同的含义,并且不说明性地排除另外的未记载的要素或方法步骤。
如本申请通篇所使用的,词语“可/可以”及其变化形式以允许的意义(即,意指具有潜力),而不是强制意义(即,意指必须)使用。此外,将注意到,除非上下文另有明确指示,否则本说明书和所附权利要求书中使用的没有数量词修饰的名词包括复数指示物。因此,例如,对单数指示物(例如,“小部件(widget)”)的提及包括一个、两个或更多个指示物。类似地,除非内容和/或上下文另有明确规定,否则对多个指示物的提及应该被解释为包括单个指示物和/或多个指示物。例如,对复数形式(例如,“小部件(widgets)”)的指示物的提及不一定需要多个这样的指示物。相反,将会理解,独立于指示物的所推断的数目,除非另有说明,否则一个或更多个指示物在本文中是预期的。除非另有说明,否则“或”的使用意指“和/或”。出于举例说明的目的,但不作为限制,“X和/或Y”可意指“X”或“Y”或者“X和Y”。
本说明书中引用的所有文献,包括但不限于专利、专利申请、文章、书籍和论文,出于任何目的均明确地通过引用整体并入。如果任何并入的文献与本文中定义的任何术语相矛盾,则以本说明书为准。
应当理解,所公开的治疗方法可以是来自健康护理医师的角度或者来自患者的角度。例如,从健康护理提供者的角度来看,提供了将治疗有效量的一种或更多种重组病毒载体施用于有此需要的患者的上述示例性实施方案。该相同的方法行为也可以从患者的角度来表达,例如,接受治疗有效量的一种或更多种重组病毒载体。除非另有明确说明,否则相同或类似的修改可应用于本文中公开的任何记载的方法动作,以从健康护理提供者的角度或从患者/对象自身的角度来描述公开的方法。
本文中所述的供体基因可同义地称为外源基因、外源供体基因、插入基因等。供体基因可以用基因本身的名称来指代,或用基因编码的蛋白质的名称来指代。例如,Oct-4蛋白在技术上是由POU5f1基因编码的,但是应当理解,相同的基因在本文中也可以称为Oct-4基因。
病毒载体
如上所提供的,目前的基因治疗方法存在许多缺点,这些缺点可被解决以解决本领域中长期感觉到的和未满足的需求。特别地,没有一种传统的逆转录病毒、腺病毒或腺相关基因治疗系统能够以可促进维持或改善接受者的生理健康和/或寿命的方面的方式长期全身表达其载荷。相反,大部分(如果不是全部的话)上述基因治疗系统旨在永久校正靶细胞内的生理或遗传缺陷(例如,通过在靶位点整合遗传载荷),或者以其他方式经改造以靶向肿瘤或提供癌症治疗。显然缺乏解决与衰老相关的许多症状、影响和/或障碍的解决方案。
本公开内容的一些实施方案解决了现有技术中的一个或更多个注意到的问题。例如,公开了编码一种或更多种治疗性基因的重组巨细胞病毒(recombinantcytomegalovirus,CMV)载体,并且这些治疗工具可用于促进维持或改善接受者的生理健康和/或寿命。例如,所公开的重组CMV载体可安全地施用于患者(例如,鼻内和/或作为可注射制剂),并从而向多个器官递送基因治疗,其具有长期益处并且没有致癌性或任何其他可观察到的有害副作用。结果,所公开的载体和相关的治疗方法可将患者的寿命延长至少10%,优选至少20%,并且在一些实施方案中,延长至少30%。另外,所公开的治疗方法可令人惊讶且出乎意料地提高血糖耐受性、保持或提高肌肉质量、提高身体协调性、提高心脏和骨骼肌中的线粒体生物发生、提高自噬、促进毛发保持(或防止年龄相关的毛发脱落)或其组合。
这些有益健康的作用是出乎意料的。例如,关于载体选择,CMV是存在于超过60%的群体中的遍在病毒。在初次感染之后,CMV在宿主的生命周期内持续存在,并且尽管CMV在健康个体中通常是良性的,但该病毒可在免疫低下的群体中引起毁灭性的疾病,导致高发病率和死亡率。CMV也是已知的最具免疫原性的病毒之一。在健康个体的初次感染期间,高抗体效价针对许多病毒蛋白。另外,大部分宿主T细胞库也针对CMV抗原,对CMV的CD4+T细胞应答频率中值是急性病毒(例如麻疹、腮腺炎、流感、腺病毒)或甚至其他持久性病毒(例如单纯疱疹和水痘-带状疱疹病毒)的应答频率的5至10倍高。通常还观察到CD8+T细胞对确定的CMV表位或蛋白质的高频率应答。在对CD4+和CD8+T细胞对整个CMV基因组的应答进行量化的大规模人研究中,CMV特异性CD4+和CD8+T细胞的平均频率超过了两个亚类记忆群体的10%,并且在一些个体中,CMV特异性T细胞占记忆T细胞库的>25%。
矛盾的是,对CMV的稳健免疫应答既不能根除来自健康受感染个体的病毒,也不能赋予防止再感染的保护。长期以来,CMV逃避免疫系统根除并再感染血清阳性宿主的能力被认为与该病毒编码的多种病毒免疫调节剂有关。HCMV US6家族蛋白是这些免疫调节剂中研究最广泛的。已知至少四种不同的基因US2、US3、US6和US11干扰MHC-1分子的组装和转运。
因此,表达异源抗原的基于CMV的载体不会诱导针对这些异源抗原的免疫显性表位的细胞毒性T细胞。如果将基于CMV的载体改造成疫苗或肿瘤特异性治疗,这是特别不利的,因为其限制了由这样的基于CMV的疫苗产生的T细胞防止病原体感染或以其他方式产生针对肿瘤的细胞免疫应答的效力。在另一方面,虽然基于CMV的载体是用于疫苗开发的差的候选物,但宿主对感染的持续易感性为基因治疗的系列施用提供了独特的机会—只要载体无毒且载荷不致癌。
CMV可感染体内不同的细胞类型,并因此能够将靶蛋白递送至许多细胞类型。更具体地,CMV可感染成纤维细胞、肝细胞、内皮细胞、巨噬细胞、上皮细胞、淋巴细胞、视网膜色素上皮细胞和胃肠道细胞。因此,CMV可感染并将其靶抗原递送至身体多种器官中的不同细胞类型。此外,CMV可克服预先存在的免疫以高效表达目的蛋白。此外,由于CMV具有并入多个基因并同时表达它们的巨大能力,所以CMV具有大的基因组尺寸。
如以下更详细地讨论的,BAC工程方法可用于产生包含一种或更多种期望的治疗性供体基因的重组CMV。与具有小鼠端粒酶逆转录酶(mouse telomerase reversetranscriptase,mTERT)基因的MCMV载体相关的某些BAC方法描述于Qiyi Tang,B.S.,HuaZhu.Protocol of a Seamless Recombination with Specific Selection Cassette inPCR-Based Site-Directed Mutagenesis.Applied Biological Engineering–Principlesand Practice,461-478(2012)。
载体载荷
本文中公开的重组CMV载体可被配置成携带载荷(本中也称为供体基因、外源基因、插入物等),所述载荷包括以下中的一种或更多种:人端粒酶逆转录酶(hTERT)基因、人卵泡抑素-344(hFST)基因、klotho(KL)基因、损伤抑制(Dsup)基因、过氧化物酶体增殖物激活受体γ共激活因子1-α(PGC-1-α)基因(即,PPARGC1A基因)、及其组合。
关于公开的载荷,TERT基因用于转录端粒酶的催化组分即端粒酶逆转录酶(telomerase reverse transcriptase,TERT),其在端粒酶激活中发挥主要作用。端粒是染色体末端的短重复DNA区段(脊椎动物中的5’-TTAGGG-3’),在细胞分裂期间不完全复制。它们通过充当染色体帽来保护遗传物质,防止它们相互结合或分解。一旦端粒变得太短,细胞就会停止分裂并经历凋亡。端粒酶负责在染色体末端添加碱基对以维持端粒长度。端粒酶在具有不断且快速的细胞分裂的组织(例如细胞生殖组织、骨髓和胃肠道内膜)中高度表达。相反,在有丝分裂组织中端粒酶通常检测不到或活性最低,这导致每次细胞分裂时更短的端粒并导致衰老细胞的积累。从生物体水平角度来看,这表现为衰老。编码端粒酶RNA组分的基因中的罕见的常染色体显性突变会引起过早衰老和死亡,最常见的原因是骨髓衰竭相关的感染。因为端粒酶通过降低染色体末端的侵蚀来维持细胞增殖和分裂,所以TERT缺陷的小鼠与TERT缺陷的人一样,具有较短的端粒和较短的寿命。
在每一个老年个体中均观察到端粒缩短。已经发现60岁或更年长的人,端粒较短,患心脏病的风险高三倍,并且较长的端粒与较长的寿命呈正相关。尽管如此,没有数据证明端粒长度是提高心脏疾病风险或延长寿命的原因。衰老和端粒长度的确切机制和相关性仍不清楚。
最近的研究表明,表达外源性TERT可逆转由TERT缺陷引起的过度衰老过程,这表明TERT在衰老过程中的直接作用或平衡作用。
关于卵泡抑素(FS344),这种单体分泌型蛋白在几乎所有组织中表达。在肌细胞中,卵泡抑素作为肌生成抑制蛋白(一种肌生成抑制信号蛋白)的负调节物发挥作用。因此,已知卵泡抑素可提高骨骼肌质量,并且研究已经表明它通过与Act RIIB受体结合来中和多种TGF-β配体(包括肌生成抑制蛋白和激活素抑制复合物)的作用。卵泡抑素基因敲除小鼠生长迟缓、具有骨骼缺陷、体重降低并且在出生之后几小时内死亡,这表明卵泡抑素在骨骼和肌肉发育中的重要作用。表达增强的卵泡抑素水平的转基因小鼠显示肌肉质量提高194%至327%,这表明卵泡抑素在体重发育中的直接作用。缺乏肌生成抑制蛋白基因的小鼠具有降低的肌纤维数和更小的肌纤维尺寸。肌生成抑制蛋白抑制体重发育的转录调节因子myoD和Pax-3的表达,从而导致低体重和小纤维尺寸。这些发现强烈表明卵泡抑素在肌营养不良和其他年龄相关疾病的治疗中的重要作用。
klotho蛋白是一种遍在的跨膜蛋白,其功能是酶水解类固醇β-葡萄糖醛酸苷。Klotho在调节胰岛素敏感性、促进成纤维细胞生长因子与其相应受体的结合、调节钙稳态、使氧化应激和炎症最小化、预防内皮功能障碍以及促进髓鞘完整性和伴随的认知功能方面发挥作用。klotho有三种亚型,称为α-klotho、β-klotho和γ-klotho。这些亚型中的每一种都包括在本公开内容中,并且一种或更多种klotho亚型可用作重组CMV载荷的一部分。通常来说,如果没有特别说明,则通用短语klotho是指α-klotho亚型。klotho蛋白的亚最佳水平与退化过程(例如骨萎缩、骨质疏松和动脉硬化)相关。已知低水平的循环klotho蛋白与衰老有关。缺乏α-klotho酶的转基因小鼠出现过早衰老症状,而过表达klotho的转基因小鼠比野生型小鼠活得更长。
Dsup蛋白被认为是缓步动物门(phylum Tardigrada)动物所特有的,所述动物通常被称为缓步动物(tardigrade)。缓步动物普遍存在于整个地球生物圈中,包括相对不适宜居住的位置,例如深海喷口和南极。缓步动物是已知最具适应力的生命形式之一,如果不是最具适应力的话。已知缓步动物能够在是人致死水平的数百倍高的剂量下的电离辐射、接近绝对零度的低温、接近150℃的高温、是海洋最深处约6倍高的压力,并且甚至是外部空间的真空中存活。Dsup的功能是保护DNA免受电离辐射的损害,即使缓步动物处于活跃的非干燥状态。表明向培养的人细胞添加Dsup蛋白将由X射线辐射引起的DNA损伤降低40%。虽然Dsup的确切DNA保护机制尚不清楚,但认为是形成与细胞中的核小体缔合的保护性分子聚集体来保护DNA。
PGC-1-α调节线粒体生物合成和肝糖异生。具体地,PGC-1-α是转录共激活因子,其作为促进参与能量代谢的基因的转录(包括促进新线粒体的产生)的外部刺激的整合子发挥作用。由有氧运动导致的PGC-1-α水平的提高也表明提高了骨骼肌中的自噬。
Oct-4(八聚体结合转录因子4;也称为POU5F1)、Sox2(性别决定区Y-box 2)和KLF4(Krüppel样因子4)是转录因子,其功能是激活或失活与干细胞分化相关的某些表达。这些蛋白质在维持某些干细胞的多能性方面发挥作用,并且较低的水平促进了干细胞分化。这些和其他类似的因素也可以能够诱导多能性,具有再生医学的潜在应用。
出乎意料的是,本文中公开的包括施用重组CMV载体(例如,本文中所述小鼠模型实例中使用的鼠CMV(MCMV)载体)的治疗方法表明了数种有益作用。特别地,MCMV
重组病毒载体及制备和使用方法
本公开内容还包括含有重组CMV载体和可药用载体或稀释剂的治疗性组合物。所述治疗性组合物可用于本公开内容的基因治疗和免疫治疗实施方案中,例如,用于将遗传信息转移至有这样的需要的动物或人的方法中,所述方法可包括向对象施用所述组合物。因此,本公开内容的实施方案包括用于转移遗传信息的方法。
在另一个实施方案中,提供了用于产生重组病毒载体(例如,CMV)的方法,所述重组病毒载体被配置成在体外或体内感染或转导细胞后表达蛋白质、基因产物或表达产物。在体外环境中,本公开内容的实施方案提供了克隆或复制异源DNA序列的方法,该方法可包括用本文中公开的重组CMV载体体外感染或转染细胞,以及任选地从细胞或子代病毒中提取、纯化和/或分离DNA。
在另一个方面中,本公开内容的实施方案提供了用于制备本文中公开的重组CMV载体的方法,该方法可包括将外源DNA插入CMV基因组的非必需区中。该方法还可包括从CMV基因组中缺失非必需区,优选在插入外源DNA之前。
本文中提供的方法可包括体内和/或体外重组。因此,本公开内容的方法可包括在供体DNA存在的情况下,将具有CMV DNA的细胞转导至细胞相容培养基中。供体DNA可包含侧翼为与CMV基因组部分同源的DNA序列的外源DNA,由此通过同源重组将外源DNA引入到CMV基因组中,并且随后任选地回收通过体内重组修饰的CMV。
该方法还可包括切割CMV DNA以获得经切割的CMV DNA,将外源DNA与经切割的CMVDNA连接以获得杂合CMV-外源DNA,用杂合CMV-外源DNA转染细胞,并且随后任选地回收通过存在的外源DNA修饰的重组CMV。
由于理解了体内重组,因此本公开内容的实施方案还提供了质粒,P1来源的人工染色体(P1-derived artificial chromosome,PAC)和/或细菌人工染色体(BAC)系统,其包含非天然存在于CMV中的供体DNA,并且其编码对CMV来说是外来物的多肽。可提供CMV DNA区段内的供体DNA,否则该区段将与CMV基因组的非必需区共线,使得在插入供体DNA之后,来自CMV非必需区的DNA被供体DNA替代或位于供体DNA的侧翼。这样的构建体的实例在下面更详细的描述。
当期望时,可将外源DNA插入到CMV中以产生任何取向的重组CMV,从而产生该DNA的稳定整合及其表达。
示例性CMV构建体
图12A至12E示出了可用于产生本文中公开的CMV载体的示例性BAC构建体。如所示出的,该构建体包含一种或更多种适于向人对象施用的治疗性基因。图12A示出了包含hTERT作为外源插入物的示例性构建体。在示出的实例中,hTERT序列通过编码自切割2A肽的序列与即早期(immediate-early,IE1)基因的C端(即编码C端的部分)融合。IE1蛋白是CMV感染早期阶段期间高水平表达的早期蛋白质。
图12B示出了包含hFST作为外源插入物的示例性构建体。在该实例中,hFST序列通过编码自切割2A肽的序列与pp65(ppUL83)基因的C端融合。
图12C示出了包含KLOTHO作为外源插入物的示例性构建体。在该实例中,KLOTHO序列通过编码自切割2A肽的序列与gB(包膜糖蛋白B)基因的C端融合。
图12D示出了包含Dsup作为外源插入物的示例性构建体。在该实例中,Dsup序列通过编码自切割2A肽的序列与gB(包膜糖蛋白B)基因的C端融合。
图12E示出了包含PGC1α作为外源插入物的示例性构建体。在该实例中,PGC1α序列通过编码自切割2A肽的序列与gB(包膜糖蛋白B)基因的C端融合。
图13A至13F示出了示例性BAC构建体,每个BAC构建体均包含多个适于施用于人对象的治疗性供体基因。图13A示出了包含hTERT和hFST二者作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hTERT与IE1基因的C端连接并且hFST与pp65基因的C端连接。
图13B示出了包含hFST和KLOTHO二者作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hFST与pp65基因的C端连接并且KLOTHO与gB基因的C端连接。
图13C示出了包含hTERT和KLOTHO作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hTERT与IE1基因的C端连接并且KLOTHO与gB基因的C端连接。
图13D示出了包含hTERT、hFST和KLOTHO作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hTERT与IE1基因的C端连接,hFST与pp65基因的C端连接并且KLOTHO与gB基因的C端连接。
图13E示出了包含hTERT、hFST和Dsup作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hTERT与IE1基因的C端连接,hFST与pp65基因的C端连接并且Dsup与gB基因的C端连接。
图13F示出了包含hTERT、hFST和PGC1α作为外源插入物的示例性构建体,其中各自通过编码自切割2A肽的序列,hTERT与IE1基因的C端连接,hFST与pp65基因的C端连接并且PGC1α基因与gB基因的C端连接。
本公开内容的构建体不限于图中所示的具体实施方案。例如,其他构建体可包含选自hTERT、hFST、KL、Dsup、PGC1-α、Oct-4、Sox2、KLF4的一种或更多种供体基因或其任意组合。所述一种或更多种供体基因可在选自IE1基因、IE2基因、pp65基因、UL21.1基因、UL21.5、gB基因、TRL4基因、UL89基因、US3基因、R160461基因、R27080基因或其他合适的CMV基因或阅读框(其具有足够的表达)的CMV基因的C端或其附近融合。可用作融合位点的其他CMV基因包括基因家族RL11、UL14、UL18、UL25、UL82、UL120、US6、US7、US12和US22中的基因。作为补充或替代,CMV基因可用作一种或更多种供体基因的融合位点。优选的融合位点是那些以相对高的水平表达从而能够实现融合基因产物的相对高的表达的位点。目前用作一种或更多种供体基因的融合位点的优选CMV基因包括IE1基因、pp65基因和gB基因。一种或更多种供体基因可通过编码选自例如T2A、P2A、E2A或F2A的2A自切割肽的序列与其相应的CMV基因融合。
在一些实施方案中,构建体包含两个供体基因。例如,构建体可包含:hTERT和hFST;hTERT和KLOTHO;hTERT和Dsup;hTERT和PGC1-α;hTERT和Oct-4;hTERT和Sox2;hTERT和KLF4;hFST和KLOTHO;hFST和Dsup;hFST和PGC1-α;hFST和Oct-4;hFST和Sox2;hFST和KFL4;KLOTHO和Dsup;KLOTHO和PGC1-α;KLOTHO和Oct-4;KLOTHO和Sox2;KLOTHO和KLF4;Dsup和PGC1-α;Dsup和Oct-4;Dsup和Sox2;Dsup和KLF4;PGC1-α和Oct-4;PGC1-α和Sox2;PGC1-α和KLF4;Oct-4和Sox2;Oct-4和KLF4或者Sox2和KLF4。
在一些实施方案中,构建体包含三个供体基因。例如,构建体可包含:hTERT、hFST和KLOTHO;hTERT、hFST和Dsup;hTERT、hFST和PGC1-α;hTERT、hFST和Oct-4;hTERT、hFST和Sox2;hTERT、hFST和KLF4;hTERT、KLOTHO和Dsup;hTERT、KLOTHO和PGC1-α;hTERT、KLOTHO和Oct-4;hTERT、KLOTHO和Sox2;hTERT、KLOTHO和KLF4;hTERT、Dsup和PGC1-α;hTERT、Dsup和Oct-4;hTERT、Dsup和Sox2;hTERT、Dsup和KLF4;hTERT、PGC1-α和Oct-4;hTERT、PGC1-α和Sox2;hTERT、PGC1-α和KLF4;hTERT、Oct-4和Sox2;hTERT、Oct-4和KLF4;hTERT、Sox2和KLF4;hFST、KLOTHO和Dsup;hFST、KLOTHO和PGC1-α;hFST、KLOTHO和Oct-4;hFST、KLOTHO和Sox2;hFST、KLOTHO和KLF4;hFST、Dsup和PGC1-α;hFST、Dsup和Oct-4;hFST、Dsup和Sox2;hFST、Dsup和KLF4;hFST、PGC1-α和Oct-4;hFST、PGC1-α和Sox2;hFST、PGC1-α和KLF4;hFST、Oct-4和Sox2;hFST、Oct-4和KLF4;hFST、Sox2和KLF4;KLOTHO、Dsup和PGC1-α;KLOTHO、Dsup和Oct-4;KLOTHO、Dsup和Sox2;KLOTHO、Dsup和KLF4;KLOTHO、PGC1-α和Oct-4;KLOTHO、PGC1-α和Sox2;KLOTHO、PGC1-α和KLF4;KLOTHO、Oct-4和Sox2;KLOTHO、Oct-4和KLF4;KLOTHO、Sox2和KLF4;Dsup、PGC1-α和Oct-4;Dsup、PGC1-α和Sox2;Dsup、PGC1-α和KLF4;Dsup、Oct-4和Sox2;Dsup、Oct-4和KLF4;Dsup、Sox2和KLF4;PGC1-α、Oct-4和Sox2;PGC1-α、Oct-4和KLF4;PGC1-α、Sox2和KLF4;或Oct-4、Sox2和KLF4。
其他实例可包含任意组合的超过三个的供体基因。例如,CMV构建体可包含hTERT、hFST、KL、Dsup、PGC1-α、Oct-4、Sox2和KLF4中超过三个的任意组合。
在前述的每一个中,用作融合位点的CMV基因可选自本文中公开的任何CMV融合位点;优选地,融合位点选自IE1基因、pp65基因和gB基因。
在包含多于一个供体基因的构建体实施方案中,每个供体基因可位于单独的开放阅读框中。或者,一个或更多个供体基因可共有相同的开放阅读框。例如,每个供体基因可与单独的CMV基因融合,或者替代地,一个或更多个供体基因可融合在一起以形成供体基因融合产物,然后该融合产物与适当的CMV基因融合。这样的融合供体基因可通过编码2A自切割肽的序列融合(彼此融合和/或与CMV基因融合),如本文中所述的另外的实施方案一样。供体基因的表达可由相同的启动子诱导。或者,供体基因可独立地与单独和/或独特的启动子缔合,所述启动子使得每个供体基因单独或分别表达。
此外,尽管BAC构建体代表了目前优选的构建体实施方案,但是其他构建体实施方案可利用替代的骨架,例如P1来源的人工染色体(PAC)和/或合适的质粒。在利用质粒的情况下,由于更严格的尺寸限制,因此转导方法可利用一起提供供体基因的期望组合的单独的、不同的质粒。
图14至17示出了通过同源重组分别制备CMV-hFST重组BAC、CMV-hTERT重组BAC、CMV-hFST+hTERT重组BAC和CMV-hFST+hTERT+KL重组BAC的方法。如这些图所示,插入物在上游端和下游端二者均提供有同源臂(HR臂)。HR臂与CMV基因组中的靶位点具有显著同一性。例如,上游HR臂可与用于融合的靶CMV基因的下游部分(即,更靠近C端)具有显著同一性,而下游HR臂可与直接位于靶CMV基因C端下游的3’非翻译区具有显著同一性。以这种方式,可通过同源重组将插入物插入靶CMV基因的C端与3’非翻译区之间的位置。
HR臂可以是任何长度,只要能提供足够的插入物向BAC骨架中的整合和同源重组。在一些实施方案中,同源臂的长度为至少约25个碱基对,或长度为至少约30个碱基对,或长度为至少约35个碱基对,长度为至少约40个碱基对,长度为至少约45个碱基对,并且长度可高达约50个碱基对,或长度高达约55个碱基对,或长度高达约60个碱基对,或长度高达约65个碱基对,或长度高达约70个碱基对,或长度高达约75个碱基对,或长度高达约80个碱基对,或长度高达约90个碱基对,或长度高达约100个碱基对。HR臂的长度可在由任何两个前述值限定的端点范围内。使用约50个碱基对至约80个碱基对的HR臂已经获得了有效的结果。较小的尺寸可导致重组效率降低,而过大的尺寸提高了方法的复杂性,并且更可能引入不希望的副反应。
另外的重组病毒载体详情
本文中所述的重组CMV病毒或载体中的外源DNA可包含启动子。启动子可来自疱疹病毒。例如,启动子可以是巨细胞病毒(CMV)启动子,例如人CMV(HCMV)或鼠CMV(MCMV)启动子。启动子也可以是非病毒启动子,例如EFla启动子。启动子可以是截短的转录活性启动子,其可包含用病毒提供的反式激活蛋白反式激活的区域和从中获得截短的转录活性启动子的全长启动子的最小启动子区域。出于本说明书的目的,“启动子”由对应于最小启动子和上游调节序列的DNA序列的缔合物构成;“最小启动子”由CAP位点加上TATA盒(基本转录水平的最小序列;未调节的转录水平)构成;并且“上游调节序列”由上游元件和增强子序列构成。此外,术语“截短的”表示全长启动子不完全存在(即全长启动子的一些部分已经被去除),并且截短的启动子可来源于疱疹病毒,例如MCMV或HCMV(例如,HCMV-IE或MCMV-IE)。基于碱基对,示例性的截短启动子在尺寸上可从全长启动子降低多至40%并且降低甚至多至90%。启动子也可以是经修饰的非病毒启动子。
本公开内容的实施方案还提供了用于插入重组病毒或质粒中的表达盒,其可包含截短的转录活性启动子。表达盒还可包含功能性的截短的多腺苷酸化信号,例如截短的但仍具有功能的SV40多腺苷酸化信号。考虑到自然界提供了更大的信号,截短的多腺苷酸化信号是有功能的,这一点确实出乎意料;并且截短的多腺苷酸化信号解决了重组病毒例如CMV的插入物尺寸限制问题。表达盒还可包含相对于其所插入的病毒或系统而言是外源或异源的DNA,并且该DNA可以是如本文中所述的外源或异源DNA。该DNA可被合适地定位并与用于表达的启动子可操作地连接。关于HCMV启动子,参考美国专利No.5,168,062和5,385,839,其各自均并入本文。
示例性公开的重组体中的异源或外源DNA优选地编码表达产物,例如治疗性基因(例如,TERT和/或FS344,包括其人和/或小鼠形式,或其适用于靶对象的其他形式)和/或融合蛋白(例如,与报道基因例如萤光素酶融合,或与N或C端表位标签例如FLAG、6X-His或本领域技术人员已知的其他表位标签融合)。关于这些术语,参考下面的讨论,并且一般参考Kendrew,THE ENCYCLOPEDIAOF MOLECULAR BIOLOGY(Blackwell Science Ltd 1995)和Sambrook,Fritsch,Maniatis,Molecular Cloning,A LABORATORY MANUAL(第二版,ColdSpring Harbor Laboratory Press,1989)。
关于并入以形成重组病毒/载体的DNA的尺寸:技术人员可使待被插入到所选病毒载体中的DNA序列编码的蛋白质的尺寸最大化(记住载体的包装限制)。为了使插入的DNA最小化,同时使表达的蛋白质的天然尺寸最大化或匹配,DNA序列可排除内含子(被转录但随后在翻译前从初级RNA转录物中切除的基因的区域)。
关于本文中公开的融合蛋白的表达,参考Sambrook,Fritsch,Maniatis,Molecular Cloning,ALABORATORY MANUAL(第二版,Cold Spring Harbor LaboratoryPress,1989)(尤其是第3卷),和KKendrew,THE ENCYCLOPEDIAOF MOLECULAR BIOLOGY(Blackwell Science Ltd1995.。Sambrook等人的教导可以根据本公开内容进行适当的修改,而无需过度的实验,以便技术人员产生表达融合蛋白的重组体。关于基因治疗,参考美国专利No.5,252,479,该专利与其中及其表面上看(on its face)引用的文献通过引用并入本文。
应当理解,蛋白质和编码它们的核酸可与本文中所示和所述的确切序列不同。因此,本发明考虑了对所示序列的缺失、添加、截短和替换,只要该序列根据本发明的方法发挥作用即可。在这方面,替换通常在性质上是保守的(即,在氨基酸家族内发生的那些替换)。例如,氨基酸一般分为四种家族:(1)酸性的——天冬氨酸和谷氨酸;(2)碱性的——赖氨酸、精氨酸、组氨酸;(3)非极性的——丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸;和(4)不带电荷的极性的——甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸苏氨酸、酪氨酸。苯丙氨酸、色氨酸和酪氨酸有时被分类为芳族氨基酸。可合理地预测以下通常不会对生物活性产生重大影响:用异亮氨酸或缬氨酸单独替代亮氨酸,或反之亦然;用谷氨酸替代天冬氨酸,或反之亦然;用丝氨酸替代苏氨酸,或反之亦然;或者用结构相关的氨基酸进行氨基酸的类似的保守替代。因此,具有与所示和所述序列基本相同的氨基酸序列,但具有基本上不影响蛋白质活性或功能的少量氨基酸替换的蛋白质在本发明的范围内。
在一些实施方案中,治疗性基因包含重组核苷酸序列。例如,在一个实施方案中,核苷酸序列可以是经密码子优化的,例如密码子可以优化用于人使用。关于密码子优化,本发明的核酸分子具有编码本发明的治疗性蛋白质(即端粒酶和/或卵泡抑素)的核苷酸序列,并且可被设计成利用产生该蛋白质的对象基因中使用的密码子。许多病毒使用大量稀有密码子,通过改变这些密码子使其对应于期望的对象中常用的密码子,可实现重组基因的增强表达。在一个优选的实施方案中,使用的密码子是“人源化”密码子,即密码子是在高表达的人基因中频繁出现的那些(参见Andre et al.,J.Virol.72:1497-1503,1998)而不是载体/病毒经常使用或编码的那些密码子。这样的密码子使用提供了转基因病毒蛋白在人细胞中的有效表达。可使用任何合适的密码子优化方法。这样的方法和这样的方法的选择是本领域技术人员公知的,并且根据本公开内容提供的另外的教导,本文中描述的本发明载体的核苷酸序列可容易地进行密码子优化。
本发明还涵盖编码本文中公开的CMV载体的功能等同变体和衍生物的核苷酸序列。这些功能等同变体、衍生物和片段显示出保留功能活性的能力。例如,DNA序列中的不改变编码的氨基酸序列的变化,以及导致氨基酸残基的保守替换、一个或数个氨基酸缺失或添加以及氨基酸残基被氨基酸类似物替换的变化是不显著影响编码的多肽的特性的那些。保守氨基酸替换包括甘氨酸/丙氨酸;缬氨酸/异亮氨酸/亮氨酸;天冬酰胺/谷氨酰胺;天冬氨酸/谷氨酸;丝氨酸/苏氨酸/甲硫氨酸;赖氨酸/精氨酸;和苯丙氨酸/酪氨酸/色氨酸。在一些实施方案中,核苷酸与目的多肽的天然形式具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同源性或同一性。
为了本发明的目的,通过当对齐以使得重叠和同一性最大化而序列空位最小化时对序列进行比较来确定序列同一性或同源性。特别地,可使用多种数学算法中的任何一种来确定序列同一性。用于比较两个序列所使用的数学算法的非限制性实例是Karlin&Altschul,Proc.Natl.Acad.Sci.USA1990;87:2264-2268的算法,该算法在Karlin&Altschul,Proc.Natl.Acad.Sci.USA1993;90:5873-5877中有修改。用于序列比较所使用的数学算法的另一实例是Myers&Miller,CABIOS1988;4:11-17的算法。这样的算法被并入到ALIGN程序(2.0版)中,该程序是GCG序列比对软件包的一部分。当利用ALIGN程序比较氨基酸序列时,可使用PAM120权重残基表、12的空位长度罚分和4的空位罚分。另一种用于鉴定局部序列相似性和比对的区域的有用算法是Pearson&Lipman,Proc.Natl.Acad.Sci.USA1988;85:2444-2448中描述的FASTA算法。根据本发明,有利地使用WU-BLAST(Washington University BLAST)2.0版软件。用于数个UNIX平台的WU-BLAST2.0版可执行程序可从ftp://blast.wustl.edu/blast/executables下载。该程序基于WU-BLAST 1.4版本,该版本又基于公共领域NCBI-BLAST 1.4版(Altschul&Gish,1996,Localalignment statistics,Doolittle ed.,Methods in Enzymology 266:460-480;Altschulet al.,Journal of Molecular Biology 1990;215:403-410;Gish&States,1993;NatureGenetics 3:266-272;Karlin&Altschul,1993;Proc.Natl.Acad.Sci.USA90:5873-5877)。
多种重组核苷酸序列和重组载体可以使用标准重组DNA和克隆技术来制备,所述技术例如在“Molecular Cloning:ALaboratory Manual”,第二版(Sambrook et al.1989)中公开的那些。然而,通常应当理解,根据本公开内容的实施方案使用的载体通常被选择使得它们包含合适的基因调节区,例如启动子或增强子,以允许编码的治疗性基因的期望的表达水平。因此,本领域技术人员可以产生表达目的治疗性基因的重组体,并使用来自本公开内容的重组体和本领域的知识,而无需过度的实验。此外,根据本文中的公开内容和本领域的知识,技术人员构建表达目的治疗性基因的重组病毒/载体或技术人员使用这样的重组病毒/载体不需要过多的实验。
本公开内容的实施方案能够实现多种治疗方法。例如,治疗方法可包括纵向治疗方法,其中在一段时间内向患者提供多个治疗有效剂量。在一些情况下,该时间段长达6至12个月或更长,例如,每年、每半年、每隔一个月、每月、每三周、每隔一周、每周或更有规律地向患者施用剂量。在一个示例性的治疗方法中,每月向患者施用治疗有效剂量,持续8个月。在一些实施方案中,患者是中年患者或老年患者。例如,患者可以是30岁或更大、35岁或更大、40岁或更大、45岁或更大、50岁或更大、55岁或更大、60岁或更大、65岁或更大、70岁或更大、或更年长(或者可以是落入由前述年龄形成的范围内的任何年龄)的人患者。患者也可以是类似中年或老年的动物患者。
药物组合物
虽然本文中所述的化合物可单独施用,但可优选将化合物配制成药物组合物(例如制剂)。因此,在另一方面中,提供了可用于所公开实施方案的方法和用途的药物组合物。药物组合物是可以在体外或体内或者在体外和体内二者施用于对象以治疗、预防或改善病症,或者可以以其他方式预防性地施用以改善或维持对象的健康的任何组合物。在一个优选的实施方案中,药物组合物可以体内施用。对象可包括一种或更多种细胞或组织,或生物体。在一些示例性实施方案中,对象是动物。在一些实施方案中,动物是哺乳动物。在一些实施方案中,哺乳动物可以是人、小鼠或灵长类。哺乳动物包括任何哺乳动物,作为非限制性实例,例如牛、猪、绵羊、山羊、马、骆驼、水牛、灵长类、猫、狗、大鼠、小鼠和人。
本发明的组合物可以是可注射的混悬剂、溶液剂、喷雾剂、冻干粉末剂、糖浆剂、酏剂等。可以使用任何合适形式的组合物。为了制备这样的组合物,将具有期望纯度的本发明的核酸或载体与一种或更多种可药用载体和/或赋形剂混合。
本文中使用的术语“可药用”和“生理学上可接受的”意指生物学上相容性的制剂、气体、液体或固体或者其混合物,其适合于一种或更多种施用途径、体内递送途径或接触途径。制剂是相容的,因为它不破坏经改造病毒载体或由此产生的蛋白质的活性,或不诱导超过任何预防或治疗作用或益处的副作用。
在一个实施方案中,药物组合物可与可药用赋形剂例如载体、溶剂、稳定剂、佐剂、稀释剂等一起配制,这取决于特定的施用方式和剂型。药物组合物通常应配制成达到生理学上相容的pH并且范围可以是pH约3至pH约11,优选约pH 3至约pH 7的pH,这取决于制剂和施用途径。在一些替代实施方案中,优选将pH调节至约pH 5至约pH 8。更具体地,药物组合物可包含治疗或预防有效量的至少一种如本文中所述的化合物,以及一种或更多种可药用赋形剂。任选地,药物组合物可包含本文中所述化合物的组合,或可包含第二重组载体或由其编码的第二蛋白质,其可用于治疗或预防衰老或衰老相关的现象,如本文中所讨论的。
例如,用于肠胃外或经口施用的制剂最典型地是固体、液体溶液、乳液或混悬液,而用于鼻内或肺部施用的可吸入制剂通常是液体或粉末。示例性的药物组合物可被配制成冻干固体,其在施用前用生理学上相容的溶剂或载体重构。其他合适的载体或稀释剂可以是有或无防腐剂的缓冲盐水或水。重组载体可被冻干以用于在施用时重悬,或者可以在溶液中。
可接受的载体、赋形剂或稳定剂在所使用的剂量和浓度下对接受者是无毒的,并且包括但不限于:水、盐水、磷酸盐缓冲盐水、右旋糖、甘油、乙醇、或其组合,缓冲剂,例如磷酸、柠檬酸和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如,十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如EDTA;糖,例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐反荷离子,例如钠;金属配合物(例如,Zn-蛋白质配合物);和/或非离子表面活性剂,例如
可药用赋形剂部分地根据所施用的特定组合物,以及根据用于施用该组合物的特定方法来确定。因此,存在药物组合物的广泛多种合适制剂(参见,例如,Remington'sPharmaceutical Sciences)。
合适的赋形剂可以是载体分子,其包括大的、缓慢代谢的大分子,例如蛋白质、多糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物和无活性病毒颗粒。另一些示例性赋形剂包括:抗氧化剂,例如抗坏血酸;螯合剂,例如EDTA;碳水化合物,例如糊精、羟烷基纤维素、羟烷基甲基纤维素、硬脂酸;液体,例如油、水、盐水、甘油和乙醇;润湿剂或乳化剂;pH缓冲物质;等。脂质体也包括在可药用赋形剂的定义中。
例如,特别地适合于与片剂结合使用的可药用赋形剂包括例如:惰性稀释剂,例如纤维素、碳酸钙或碳酸钠、乳糖、磷酸钙或磷酸钠;崩解剂,例如交联聚维酮、玉米淀粉或藻酸;黏合剂,例如聚维酮、淀粉、明胶或阿拉伯胶;以及润滑剂,例如硬脂酸镁、硬脂酸或滑石。药物组合物也可被配制为适合于通过添加合适的赋形剂而制备混悬剂的可分散的散剂和颗粒剂。
作为另一个实例,药物组合物可配制成混悬剂,其包含与至少一种适合于制备混悬剂的可药用赋形剂混合的本文中公开的重组载体/病毒。适合于与混悬剂结合使用的赋形剂包括:助悬剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、藻酸钠、聚乙烯吡咯烷酮、黄蓍胶、阿拉伯胶;分散剂或润湿剂,例如天然存在的磷脂(例如卵磷脂)、环氧烷与脂肪酸的缩合产物(例如聚氧乙烯硬脂酸酯)、环氧乙烷与长链脂肪醇的缩合产物(例如十七碳乙烯氧基乙醇)、环氧乙烷与来源于脂肪酸和己糖醇酐的偏酯的缩合产物(例如,聚氧乙烯脱水山梨糖醇单油酸酯)、多糖和多糖样化合物(例如硫酸右旋糖酐);葡糖氨基聚糖和葡糖氨基聚糖样化合物(例如,透明质酸);以及增稠剂,例如卡波姆、蜂蜡、硬石蜡或鲸蜡醇。混悬剂还可包含:一种或更多种防腐剂例如乙酸、对羟基苯甲酸甲酯和/或对羟基苯甲酸正丙酯;一种或更多种着色剂;一种或更多种矫味剂;以及一种或更多种甜味剂例如蔗糖或糖精。
免疫原性组合物可被设计成将病毒载体引入期望的作用位点并以适当且可控的速率将其释放。例如,可通过使用聚合物以复合或吸收免疫原和/或免疫原性组合物来产生控制释放制剂。可使用已知提供期望的控制释放特性或释放谱的适当大分子(例如,聚酯、聚氨基酸、聚乙烯、吡咯烷酮、乙烯乙酸乙烯酯、甲基纤维素、羧甲基纤维素或硫酸鱼精蛋白)来制备控制释放制剂。通过控制释放制剂控制作用持续时间的另一可能方法是将活性成分并入聚合物材料(聚合物材料例如如聚酯、聚氨基酸、水凝胶、聚乳酸、聚乙醇酸、这些酸的共聚物或乙烯乙酸乙烯酯共聚物)的颗粒中。
或者,代替将这些活性成分并入聚合物颗粒中,可以将这些材料包载在微囊中。微囊化已经应用于微囊化药物的注射,以提供受控的释放。许多因素有助于选择用于微囊化的特定聚合物。聚合物合成和微囊化过程的再现性、微囊化材料和过程的成本、毒理学谱、可变释放动力学的要求以及聚合物和病毒载体的理化相容性都是必须考虑的因素。可用的聚合物的实例是聚碳酸酯、聚酯、聚氨酯、聚原酸酯和聚酰胺,特别是生物可降解的那些。
微囊可例如通过凝聚技术或通过界面聚合来制备,例如分别在胶体药物递送系统(例如脂质体、白蛋白微球、微乳液、纳米粒和纳米胶囊)中或在粗乳剂(macroemulsion)中的羟甲基纤维素或明胶-微囊和聚(甲基甲基丙烯酸酯)微囊。这样的技术公开于NewTrends and Developments in Vaccines,Voller et al.(eds.),University ParkPress,Baltimore,Md.,1978和Remington's Pharmaceutical Sciences,第16版。
药物载体的常见选择是聚(d,1-丙交酯-共-乙交酯)(PLGA)。这是一种生物可降解的聚酯,其在医用易腐蚀缝线、骨板和其他临时假体方面有着悠久的历史,并且没有表现出任何毒性。广泛多种药物(包括肽和抗原)已经被配制成PLGA微囊。已经积累了大量关于将PLGA用于化合物的控制释放的数据,例如,如Eldridge,J.H.,et al.,Current Topics inMicrobiology and Immunology.1989,146:59-66中所综述的。当经口施用时,在直径为1至10微米的PLGA微球中包裹的化合物显示出显著的佐剂作用。PLGA微囊化过程使用油包水乳液的相分离。将目的化合物制备成水溶液,并将PLGA溶解在合适的有机溶剂例如二氯甲烷和乙酸乙酯中。这两种不混溶的溶液通过高速搅拌来助乳化(co-emulsified)。然后添加聚合物的非溶剂,引起聚合物在水滴周围沉淀,以形成胚胎微囊。收集微囊,并用多种物质(聚乙烯醇(PVA)、明胶、藻酸盐、聚乙烯吡咯烷酮(PVP)、甲基纤维素)中的一种来稳定化,并在真空中干燥或通过溶剂萃取来除去溶剂。
药物组合物还可以是水包油乳剂的形式。水包油乳剂可以基于例如轻质液体石蜡油(欧洲药典类型);类异戊二烯油,例如角鲨烷、角鲨烯、EICOSANE
另外,药物组合物可以是无菌可注射制剂(例如无菌可注射水性乳剂或油性混悬剂)的形式。所述乳剂或混悬剂可根据已知技术使用上面已经提到的那些合适的分散剂或润湿剂和助悬剂来配制。无菌可注射制剂也可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或混悬液,例如在1,2-丙二醇中的溶液。
无菌注射制剂也可被制备制为冻干粉末。可以使用的可接受的载剂和溶剂有水、林格(Ringer’s)溶液和等张氯化钠溶液。另外,无菌不挥发油可用作溶剂或助悬介质。出于该目的,可使用任何温和的不挥发油,包括合成的甘油单酯或甘油二酯。另外,脂肪酸(例如油酸)可用于制备注射剂。
在一些实施方案中,可添加环糊精作为水溶解性增强剂。优选的环糊精包括α-环糊精、β-环糊精和γ-环糊精的羟丙基、羟乙基、葡糖基、麦芽糖基和麦芽三糖基衍生物。示例性的环糊精溶解性增强剂是羟丙基-邻-环糊精(BPBC),其可被添加至任何上述组合物以进一步改善一些实施方案的化合物的水溶解性特征。在一个实施方案中,组合物包含约0.1%至约20%的羟丙基-邻-环糊精,更优选约1%至约15%的羟丙基-邻-环糊精,并且甚至更优选约2.5%至约10%的羟丙基-邻-环糊精。所使用的溶解性增强剂的量将取决于组合物中一些实施方案的化合物的量。
可以向制剂中添加助溶剂和佐剂。助溶剂的非限制性实例包括羟基或其他极性基团,例如醇,例如异丙醇;二元醇,例如丙二醇、聚乙二醇、聚丙二醇、乙二醇醚;甘油;聚氧乙烯醇和聚氧乙烯脂肪酸酯。佐剂包括但不限于矿物盐(例如AlK(SO
示例性的剂量和治疗方案
本文中公开的药物组合物包含的活性成分的总量足以实现预期的治疗作用。为了方便起见,药物组合物可作为单位剂型制备或提供。制备技术包括将活性成分(例如,重组病毒/载体)和药物载体和/或赋形剂缔合。一般来说,药物组合物是通过将活性成分与液体载体或细分的固体载体或二者均匀且紧密地缔合,并且然后,如果需要的话,将产品成型来制备的。例如,片剂可通过压缩或模制制成。压缩片剂可通过在合适的机器中压缩任选地与黏合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合的例如粉末或颗粒的自由流动形式的活性成分来制备。模制片剂可通过在合适的装置中模制用惰性液体稀释剂润湿的粉末状化合物的混合物来产生。片剂可任选地进行包衣或刻痕,并且可被配制以提供其中活性成分的缓慢或控制释放。
包含公开的化合物的药物组合物可以包装成单位剂型,以便于施用和剂量的均一性。本文中使用的“单位剂型”是指适合作为用于待治疗对象的单位剂量的物理分散单位;包含预定量的化合物的每个单位任选地与药物载体(例如,赋形剂、稀释剂、载剂或填充剂)缔合,当以一个或更多个剂量施用药物载体时,计算该药物载体以产生期望的作用(例如,预防或治疗作用或益处)。单位剂型可包含施用化合物的周剂量或月剂量,或其适当的一部分。单位剂型还包括例如,胶囊剂、糖锭剂(troch)、扁囊剂、锭剂(lozenge)、片剂、可包含冷冻干燥或冻干状态的组合物的安瓿和小瓶;例如,可在体内施用或递送之前添加无菌液体载体。单位剂型还包括例如,其中装有液体组合物的安瓿和小瓶。单个单位剂型可包含在多剂量药盒或容器中。为了便于施用和剂量的均一性,药物制剂可以包装成单个或多个单位剂型。
本文中公开的组合物可根据所述方法以任何频率施用,并且只要合适,可以以单次浓注(bolus)或多次剂量施用。示例性的频率通常为每月1至5次、1至3次、2次或一次。离体或体内接触和施用的时间可由所使用的病毒载体的感染或发病机制或者由患者体内(例如,血清中或特定器官组织内)的治疗性蛋白质的浓度决定。在一些实施方案中,将在连续治疗的一段时间内施用化合物,例如一周或更长时间,或者数月或数年。长效药物组合物可以每周两次、每3至4天、每周或每月一次施用,这取决于特定制剂的半衰期和清除率。例如,在一个实施方案中,药物组合物包含一定量的如本文中所述的化合物,其被选择用于每月一次向患者施用,持续6至12个月。
剂量可根据治疗是治疗性的还是预防性的,年龄相关症状的发作、进展、严重程度、频率、持续时间、概率或易感性,治疗所针对的发病机理类型,期望的临床终点,先前、同时或随后的治疗,对象的一般健康状况、年龄、性别或种族,生物利用度,潜在的全身性、区域性或局部副作用,对象中存在的其他病症或疾病,以及本领域技术人员将理解的其他因素(例如,病史或家族史)而变化。剂量量、频率或持续时间可以是提高或降低的,如通过期望的临床结局、症状或病理状况的状态以及治疗或疗法的任何不良副作用所指示的。本领域技术人员将理解可影响提供足以或有效提供预防或治疗性作用或益处的量所需的剂量、频率和时间的因素。根据与需要治疗的对象相关的因素,医师将确定确切的剂量。调整剂量和施用以提供足够水平的活性剂或维持期望的作用。
剂量可以是宽范围的,这取决于期望的作用和治疗适应证。或者,如本领域技术人员所理解的,剂量可以基于患者的每单位体重来计算。在已经为至少一些病症确立了化合物的人剂量的情况下,可使用那些相同的剂量,或者是所确立的人剂量的约0.1%至500%,更优选约25%至250%的剂量。在没有确立人剂量的情况下,如新发现的药物组合物的情况,合适的人剂量可以从ED
可单独调整剂量的量和间隔以提供足以维持调节作用或其最小有效浓度(minimal effective concentration,MEC)的活性蛋白质的血浆水平。例如,卵泡抑素的治疗剂量可产生以下的血浆水平:0.05mg/mL、0.1mg/mL、0.5mg/mL、1mg/mL、5mg/mL、10mg/mL、15mg/mL、20mg/mL、25mg/mL、30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL、55mg/mL、60mg/mL、65mg/mL、70mg/mL、75mg/mL、80mg/mL、85mg/mL、90mg/mL、95mg/mL、100mg/mL、由上述数字中任两个界定的范围,或约任何上述数字和范围。作为另一个实例,端粒酶的治疗剂量可产生以下的血浆水平:100mg/mL、150mg/mL、200mg/mL、250mg/mL、300mg/mL、350mg/mL、400mg/mL、450mg/mL、500mg/mL、550mg/mL、600mg/mL、由上述数字中任两个界定的范围,或约任何上述数字和范围。在一些实施方案中,治疗剂量足以确立约250mg/mL至约400mg/mL的血浆水平。每种化合物的MEC可不同,但可从体外或离体数据中估算。达到MEC所需的剂量将取决于个体特征和施用途径。然而,HPLC测定或生物测定可用于确定血浆浓度。剂量间隔也可使用MEC值来确定。应该使用保持血浆水平在10%至90%,优选30%至90%并且最优选50%至90%的时间内高于MEC的方案来施用组合物。在局部施用或选择性摄取的情况下,药物的有效局部浓度可与血浆浓度无关。应当理解,可以根据达到期望的血清浓度所需的病毒基因组总数/每千克患者体重来调整或给药靶蛋白的期望的血清浓度。
如本文中所述,一些实施方案的方法还包括将本文中所述的一种或更多种化合物与一种或更多种另外的治疗剂一起用于治疗衰老相关的疾病或病症。因此,例如,所公开的载体可以是:(1)在组合的制剂中共同配制并同时施用或递送;(2)作为单独的制剂交替或并行递送;或(3)通过本领域已知的任何其他组合治疗方案。当以交替治疗递送时,本文中所述的方法可包括顺序地施用或递送活性成分(例如,在单独的溶液剂、乳液剂、混悬剂、片剂、丸剂或胶囊剂中)或通过在单独的注射器中的不同注射剂来施用或递送活性成分。一般而言,在交替治疗期间,每种活性成分的有效剂量顺序(例如,连续)施用,而在同时治疗中,有效剂量的两种或更多种活性成分一起施用。也可使用不同顺序的间歇性组合治疗。
除非上下文另有明确说明,否则本文中使用的所有数值或数值范围包括在这样的范围内的整数和在范围内的值或整数的分数。因此,举例来说,对90%至100%的范围的提及包括91%、92%、93%、94%、95%、95%、97%等,以及91.1%、91.2%、91.3%、91.4%、91.5%等;92.1%、92.2%、92.3%、92.4%、92.5%等,并依次类推。
本文中使用的“共施用”意指同时进行或施用一种物质,随后在24小时、20小时、16小时、12小时、8小时、4小时、1小时、30分钟、15分钟、5分钟、1分钟内,由上述数字中任两个和/或约任何上述数字界定的范围内开始施用第二种物质。在一些实施方案中,共施用是同时进行的。
一些实施方案涉及使用伴随诊断来为患者确定适当的治疗。伴随诊断是一种体外诊断测试或装置,其提供的信息对于安全且有效地使用相应的治疗性组合物非常有益,或者在一些情况下是必需的。这样的测试或装置可确定由于用特定治疗性组合物治疗而可能处于不良反应之风险中的患者。这样的测试或装置还可监测对治疗的响应(或估计对可能的治疗的响应)。这样的监测可包括治疗性组合物的时间表、剂量、中断或组合。在一些实施方案中,通过测量患者中的生物标志物来选择治疗性基因。术语生物标志物包括但不限于遗传元件(例如,遗传元件的表达水平)或蛋白质(例如,特定组织或器官内蛋白质表达水平或浓度的提高/降低)。
示例性实施方案
以下项的列表表示某些优选实施方案的非详尽列表:
1.重组CMV病毒载体,其包含选自以下的一种或更多种外源供体基因:端粒酶逆转录酶(TERT)基因、卵泡抑素-344(FST)基因、klotho(KL)基因、损伤抑制(Dsup)基因、过氧化物酶体增殖物激活受体γ共激活因子1-α(PGC-1-α)基因、八聚体结合转录因子4(Oct-4)基因、性别决定区Y-box 2(Sox2)基因和Krüppel样因子4(KLF4)基因。
2.项1所述的重组CMV病毒载体,其中一种或更多种外源供体基因选自TERT、FST、KL、Dsup和PGC-1-α。
3.项1或项2所述的重组CMV病毒载体,其中所述TERT基因是人端粒酶逆转录酶(hTERT)基因。
4.项1至3中任一项所述的重组CMV病毒载体,其中所述FST基因是人卵泡抑素-344(hFST)基因。
5.项1至4中任一项所述的重组CMV病毒载体,其中所述一种或更多种外源供体基因与选自以下的天然CMV基因融合:IE1基因、IE2基因、pp65基因、UL21.1基因、UL21.5、gB基因、TRL4基因、UL89基因、US3基因、R160461基因和R27080基因。
6.项5所述的重组CMV病毒载体,其中一种或更多种外源供体基因与选自IE1基因、pp65基因和gB基因的天然CMV基因融合。
7.项1至6中任一项所述的重组CMV病毒载体,其中所述一种或更多种外源供体基因经由编码2A自切割肽的序列与天然CMV基因融合。
8.项7所述的重组CMV病毒载体,其中所述2A自切割肽选自T2A、P2A、E2A和F2A。
9.项8所述的重组CMV病毒载体,其中所述2A自切割肽是P2A。
10.项1至9中任一项所述的重组CMV病毒载体,其中所述病毒载体包含多种外源供体基因。
11.项10所述的重组CMV病毒载体,其中所述病毒载体包含三种外源供体基因。
12.项1至11中任一项所述的重组CMV病毒载体,其中所述病毒载体包含其中配置有一种或更多种外源供体基因的细菌人工染色体(BAC)。
13.项1至12中任一项所述的重组CMV病毒载体,其中所述CMV是小鼠CMV(MCMV)、灵长类CMV或人CMV(HCMV)。
14.用于治疗、逆转或预防年龄相关疾病或病症的方法,其包括施用治疗有效量的项1至13中任一项所述的重组病毒载体。
15.项14所述的方法,其中所述重组病毒载体经由鼻内递送或作为可注射治疗剂来施用。
16.项14或项15所述的方法,其中施用治疗有效量的重组病毒载体预防年龄相关的毛发脱落。
17.项14至16中任一项所述的方法,其中施用治疗有效量的重组病毒载体提高了血糖耐受性。
18.项14至17中任一项所述的方法,其中根据通过以下中的一种或更多种所测得的,施用治疗有效量的所述重组病毒载体提高了线粒体健康:骨骼肌或者心肌内的具有连接嵴的线粒体百分比;或与未经处理的年龄匹配的平均值相比线粒体密度提高的线粒体百分比。
实施例
实施例1:细胞、培养基和病毒
使用MCMV细菌人工染色体(MCMV-BAC)Smith菌株。将小鼠成纤维细胞3T3细胞用于MCMV培养和生长测定,并将其在37℃、5% CO
实施例2:重组MCMV
最近,CMV载体已成为表达治疗性分子(包括蛋白质)的潜在递送载体。CMV可感染体内不同的细胞类型并因此能够将靶蛋白递送至许多细胞类型。更具体地,CMV可感染成纤维细胞、肝细胞、内皮细胞、巨噬细胞、上皮细胞、淋巴细胞、视网膜色素上皮细胞和胃肠道细胞。因此,CMV可感染其靶抗原并将其靶抗原递送至身体多种器官中的不同细胞类型。此外,CMV可克服预先存在的免疫以高效表达目的蛋白。此外,由于CMV具有并入多个基因并同时表达它们的巨大能力,所以CMV具有大的基因组尺寸。
如前所述,使用BAC改造方法来产生包含小鼠端粒酶逆转录酶(mTERT)基因的重组MCMV(参见Qiyi Tang,B.S.,Hua Zhu.Protocol of a Seamless Recombination withSpecific Selection Cassette in PCR-Based Site-Directed Mutagenesis.AppliedBiological Engineering–Principles and Practice,461-478(2012))。类似地,产生了包含小鼠卵泡抑素(mFS344)基因的重组MCMV(图1A)。包含小鼠TERT基因(MR226892)和小鼠卵泡抑素基因(MR225488)的质粒从Origene获得。mTERT和mFS344在C端与FLAG标签融合。产生重组MCMV的策略显示在图1A中。由于CMV启动子的强转录活性,因此将其用于表达mTERT和mFS344基因。使用单步整合事件(single-step integration event)将mTERT和mFS344表达盒在无任何缺失的情况下插入到MCMV
通过生长曲线和Western印迹对重组MCMV
对于Western印迹分析,用MCMV
使用萤光素酶测定来确定MCMV
实施例3:MCMV
使用18月龄的C57BL/6J小鼠来确定所公开和测试的重组病毒的治疗效力和安全性。在小鼠中选择了两种病毒施用途径,即鼻内(intranasal,IN)和腹膜内(intraperitoneal,IP)。将小鼠分成以下7组,每组9只18月龄的C57BL/6J小鼠:(1)MCMV
实施例4:葡萄糖不耐受试验
在22月龄时从每组中选择三只小鼠:(1)MCMV
在施用葡萄糖30分钟时观察到葡萄糖水平的峰(图2A)。在30分钟之后,未经感染或WT处理的小鼠表现出高血糖,平均值分别为310mg/dl和316mg/dl,而mTERT和mFS344处理的小鼠表现出154mg/dl和165mg/dl葡萄糖。此外,在mFS344和mTERT处理的小鼠中,血糖水平在180分钟时回归至正常基础水平。WT或未经感染的小鼠花费约480分钟使血糖水平达到正常基础水平(图2A)。葡萄糖曲线的曲线下面积(area under curve,AUC)显示在图2B中,并且证实了用mTERT和mFS34重组病毒处理的小鼠的葡萄糖不耐受。
实施例5:MCMV
糖基化血红蛋白的血清水平是代谢缺陷和指示糖尿病小鼠的直接量度。根据制造商的方法,通过ELISA试剂盒(M0476F041,Mybiosource)分析每组小鼠的血清,以计算糖基化血红蛋白的水平。
糖基化血红蛋白的水平是血糖水平的直接量度,并且它的提高指示糖尿病。在此,测量了23月龄的小鼠在5次连续施用相应的治疗之后的糖基化血红蛋白水平。发现感染重组mTERT和mFS344病毒的小鼠与对照或未经处理的小鼠相比,其血液中含有更少的糖基化血红蛋白。高水平的糖基化血红蛋白与糖尿病病症相关。这一发现与葡萄糖耐量试验结果密切相关,进一步支持了为何MCMV
实施例6:MCMV
每月两次测量并记录每组中所有小鼠的体重。体重的提高被认为是体内更多肌细胞积聚的量度。通过对每组中的小鼠进行尸检来分析其肌肉增加。
随着年龄的增长,身体活动性和协调性逐渐降低。活动性量度被认为是患者整体健康状况的指标。因此,进行烧杯试验以确定每组中经处理的老年小鼠的活性。该试验在小鼠23月龄时进行。将每组中的三只小鼠放入一升的玻璃烧杯中,并测量一般活动性和爬出烧杯的尝试。如前所述(参见,例如,Magno,et al.Optogenetic Stimulation of the M2Cortex Reverts Motor Dysfunction in a Mouse Model of Parkinson's Disease.JNeurosci 39,3234-3248,doi:10.1523/Jneurosci.2277-18.2019(2019)和Magno,etal.Cylinder Test to Assess Sensory-motor Function in a Mouse Model ofParkinson's Disease.Bio-Protocol 9,doi:ARTN e333710.21769/BioProtoc.3337(2019)),正确遵循方案。
MCMV
衰老小鼠的协调性和运动技能降低。如前所述,使用横梁行走测定分析了经处理和未经处理小鼠的协调性(参见Luong,et al.Assessment of Motor Balance andCoordination in Mice using the Balance Beam.Jove-J Vis Exp,doi:10.3791/2376(2011))。简言之,将每组三只23月龄的小鼠训练成连续两天穿越4英尺长、10mm宽的横梁,然后在第三天进行测试。结果以每只小鼠穿过该横梁所花费的时间量获得。与未经感染或MCMV
实施例7:组织RNA分离、cDNA制备和实时PCR
为了确定感染MCMV
实施例8:经处理和未经处理小鼠器官中的相对端粒长度的确定
图3C示出了在24月龄的小鼠中,经处理组和未经处理组的不同器官(例如,心脏、脑、肝、肾、肺和肌肉)中相对端粒长度的确定。还测量了一只8月龄的小鼠。将组织匀浆,并使用Sigma基因组DNA分离试剂盒(GeneElute基因组DNA分离试剂盒)分离基因组DNA。使用特定的端粒引物对基因组DNA进行qPCR。将一对36B4基因引物用作归一化的单拷贝基因。如前所述,通过ΔCT值计算相对端粒长度。(M.V.Joglekar et al.,An Optimised Step-by-Step Protocol for Measuring Relative Telomere Length.Methods Protoc 3(2020))。使用Cy3 PNA探针和Q-FISH在肾和肌肉中确定端粒长度。简言之,从每组中处死的24月龄的小鼠中收获肾和肌肉,并如前所述进行组织学切片处理。(M.M.Tong et al.,Mitophagy IsEssential for Maintaining Cardiac Function during High Fat Diet-InducedDiabetic Cardiomyopathy.Circ Res 124,1360-1371(2019))。从PAN BIO(目录#F1002)获得用于荧光原位杂交(fluorescence in situ hybridization,FISH)的经Cy3标记的肽核酸(peptide nucleic acid,PNA)探针。按照制造商说明(PNA BIO,F1002)进行端粒染色。使用Axiovert 200M显微镜获取Z-堆栈图像。如前所述,确定每个样品的每个组织中的相对端粒长度。(A.Suram et al.,Oncogene-induced Telomere Dysfunction EnforcesCellular Senescence in Human Cancer Precursor Lesions.Embo J 31,2839-2851(2012);N.Razdan,T.Vasilopoulos,U.Herbig,Telomere Dysfunction PromotesTransdifferentiation of Human Fibroblasts into Myofibrobalsts.Aging Cell 17(2018))。
如所示出的,经卵泡抑素处理的小鼠相对于未经处理的小鼠显示出提高的端粒长度。相对于未经处理的小鼠,经TERT处理的小鼠显示出更大的端粒长度提高。出乎意料的是,经TERT处理的小鼠显示端粒长度接近年轻(8月龄)小鼠的端粒长度(或者在一些情况下与后者没有统计学差异)。
实施例9:用MCMV
在18月龄的小鼠中连续6个月施用重组MCMV
用8月龄的C57BL/6J小鼠重复该实验,以确定一个月内mTERT和mFS344表达的动力学(图4C)。用MCMV
实施例10:MCMV
在每组小鼠中观察到毛发脱落。观察MCMV
经过MCMV
实施例11:MCMV
将重组病毒每月一次注射到每组18月龄的C57BL/6J小鼠中,以确定治疗效力。每月两次测量各组所有小鼠的体重,以观察重组病毒对正常健康的任何作用。体重的提高被解释为肌细胞的积聚和肌肉组织的增加。MCMV
在小鼠到达29月龄之后,停止施用MCMV
实施例12:MCMV
将Kaplan-Meier试验用于确定在给定时间间隔的活的和死的MCMV
这些结果表明,与对照或未经处理的小鼠相比,MCMV
实施例13:用MCMV
先前已经表明,随着时间的推移,端粒缩短导致的加速衰老涉及线粒体退化,这表明端粒酶和线粒体在衰老过程中存在联系。线粒体功能障碍与衰老有关,这是因为细胞代谢受损。
为了观察发生在细胞水平的变化,对从每组动物中收集的组织样品进行电子显微术。在连续6个月施用重组病毒之后,从每组处死一只小鼠,并分离心脏和骨骼肌。将组织样品固定在EM缓冲液中,并保持在4℃下直到处理。如本领域已知的那样进行常规的EM。
来自MCMV
实施例14:自噬和抗衰老标志物
为了阐明观察到的线粒体数目及其表面积增加背后的机制,测量了PGC1α的水平,PGC1α是正常线粒体功能和控制细胞衰老的细胞信号传导途径调节所需的转录共激活因子。线粒体和自噬在生物衰老过程中发挥关键作用。死亡或衰老细胞的积累导致细胞和系统功能障碍,并从而引起衰老。为了确定经处理的老年小鼠体内的确切变化,测量了自噬和衰老的多种整合标志物的蛋白质水平。将Western印迹用于确定经处理小鼠和对照小鼠的组织匀浆物中PGC1α(Novus Bio,NBP1-04676)、复合物I、II、III和V(Thermofisher,45-8099)、TFAM(Abcam,ab131607)、LC3(BML,M183-3)和p62(Abcam,ab91526)标志物的水平。将特异性单克隆抗体用于特异性标志物。
通过Western印迹,MCMV
实施例15:MCMV
因为癌细胞中TERT活性提高,所以担心诱导mTERT的过表达可能会提高肿瘤或癌症发生的风险。然而,在任一处理组的尸体解剖中均没有检测到恶性病。另外,生前每日观察结果未显示任何其他缺陷,例如瘫痪、身体机能障碍或失明。值得注意的是,在衰老增加的模型中重新表达端粒酶不能检测到癌症。这些结果表明,在重组CMV载体的情况下,老年小鼠中mTERT的过表达不会导致任何癌症表型或恶性病,也不会导致任何其他明显的系统性功能障碍。
总之,用重组TERT或FS344病毒感染的小鼠显示出体重增加、高葡萄糖耐量、高血清TERT和FS344水平、提高的活性和其他抗衰老特性。经处理的小鼠心脏和肌肉组织中的线粒体更年轻,并且控制导致衰老的基因表达的PGC1α水平提高。此外,经处理的小鼠显示出复合物III、V、TFAM和lC3II水平的提高,导致对老年小鼠的抗衰老作用。这些结果表明,CMV是用于在患者中递送治疗性TERT和/或FS344蛋白的优异载体,并且具有用于基因治疗的巨大潜力。
- 搬运装置和方法、搬运机器人以及串焊机
- 一种货物搬运装置及其搬运方法
- 大尺寸PCB压合叠板搬运装置
- 一种平移式座板电容搬运装置
- 承接板、转运部滑槽、搬运装置和搬运方法
- 承接板、转乘部滑槽、输送装置及输送方法
