一种精细化分离枸杞多糖的方法及所分离的枸杞多糖
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物大分子制备技术领域,具体涉及一种精细化分离枸杞多糖的方法及所分离的枸杞多糖。
背景技术
多糖是由10个或以上的单糖分子缩合而成的带有酮基或醛基的天然聚合物。这些聚合物的来源包括植物、藻类、动物和真菌。植物多糖是天然多糖的主要来源之一,具有重要的生物活性,其在食品和医药行业具有潜在的开发价值。不同来源的植物多糖具有不同的结构和药理特性。因此,从天然来源中获取新的食源性活性多糖在食品和保健品行业中意义重大。
枸杞在中国一直被用作传统中药,具有滋补肝肾、明目等功效。此外,在美国、欧盟、大洋洲和东南亚等许多地区,枸杞还作为膳食补充剂出售。从枸杞果实中提取的枸杞多糖(LBPs)具有多种生物活性,例如抗氧化、抗糖尿病、抗老年痴呆症和免疫调节活性等。尤其是近十年来,枸杞多糖在预防和治疗各种疾病方面的临床效果显著。
在以往的大量研究中,枸杞多糖是通过一系列复杂的分离过程获得的,包括分级沉淀、脱蛋白、脱色、阴离子交换和Sephadex凝胶色谱。此外,在传统方法中引入的有毒试剂会改变天然多糖的结构特性,从而影响其生物活性。因此,系统地开发一种具有良好应用价值的分离和纯化枸杞多糖的新方法是枸杞多糖精细化分离应用的关键所在。
发明内容
本发明提供一种精细化分离枸杞多糖的方法及所分离的枸杞多糖,从而解决现有的枸杞多糖分离纯化过程中存在的工序繁杂、使用有毒危险试剂、损坏多糖原始结构等缺陷。
本发明首先提供一种枸杞多糖的纯化方法,是使用高速逆流色谱方法来分离纯化枸杞粗多糖,其中所使用的两相溶液系统为PEG1000、KH
更进一步的,所述的两相溶液系统中上相溶液和下相溶液的体积比为30:50。
作为优选,所述的高速逆流色谱方法的流速为0.8mL/min、转速为900rpm。
所述的枸杞粗多糖,其一种制备方法是使用亲水性离子液体提取的;
作为实施例的一个具体记载,所述的亲水性离子液体为6%[C
本发明再一个方面还保护使用上述方法分离纯化的枸杞多糖组分,其中三种枸杞多糖组分,其分子量分别为1.40×10
本发明所纯化获得的分子量为1.40×10
本发明所分离纯化的枸杞多糖组分还可用于抑制醛糖还原酶的活性。
本发明再一个方面还提供分子量为1.40×10
本发明通过优化的分离方法,从枸杞多糖中分离纯化出三种多糖组分,且建立的方法具有更好的色素去除效果。同时,分离纯化的枸杞多糖组分在体外表现出更好的降血糖活性。本发明的方法是一种高效的分离纯化方法,在分离纯化生物样品中的活性多糖方面具有很大的潜力。
附图说明
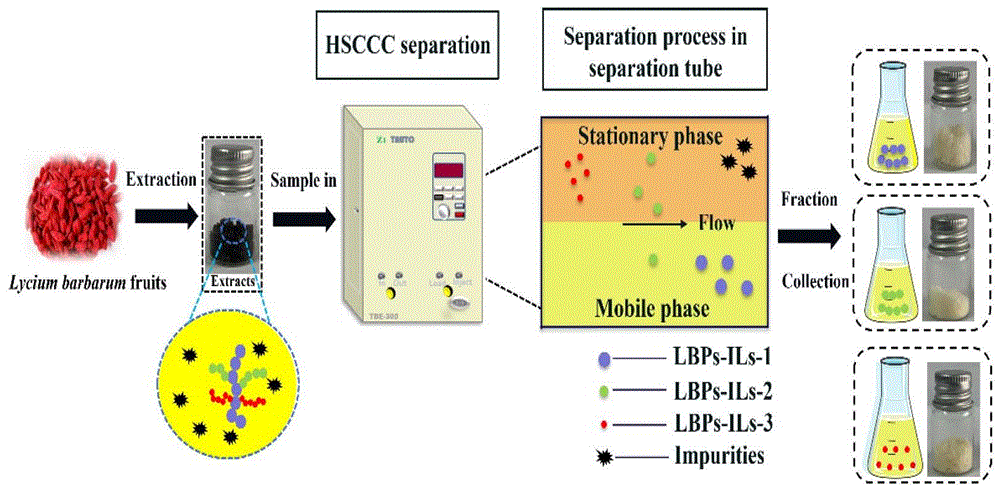
图1:高速逆流色谱(HSCCC)装置和分离LBPs-ILs的流程图,
图2:HSCCC的分离效果检测图,其中图A为HSCCC纯化的LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的洗脱曲线图,图B为LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的HPSEC-MALLS-RI图谱;
图3:枸杞多糖的脱色效果比较图,其中图A为多糖样品经H
图4:枸杞多糖的傅立叶变换红外光谱图和枸杞多糖的TG和DSC热图,傅立叶变换红外光谱图,其中(A)LBPs-ILs-1;(B)LBPs-ILs-2;(C)LBPs-ILs-3。TG和DSC热图,其中(D)LBPs-ILs-1;(E)LBPs-ILs-2;(F)LBPs-ILs-3。
图5:LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的SEM图像。
图6:不同浓度枸杞多糖的表观粘度随剪切速率的变化图,其中(A)
LBPs-ILs-1;(B)LBPs-ILs-2;(C)LBPs-ILs-3。
图7:不同浓度下不同样品的降血糖活性(平均值±SD,n=3)图,其中(A)α-葡萄糖苷酶抑制活性;(B)α-淀粉酶抑制活性;(C)AR抑制活性。
图8:LBPs-ILs对HepG2细胞葡萄糖消耗量和糖原含量的影响图(平均值±SD,n=5),其中(A)细胞活力;(B)葡萄糖消耗量;(C)糖原含量;(D)PK含量。*P<0.05vs.NC组;**P<0.01vs.NC组。
具体实施方式
本发明中采用的高速逆流色谱(HSCCC)是一种连续液-液分配色谱法,利用互不相溶的两相体系中溶质的分配差异进行分离,消除了固体基质的不可逆吸附损失和样品污染问题,无需预处理即可实现高效、快速、大批量的样品制备。但HSCCC的溶剂体系多为有机试剂,多糖在溶剂体系中的溶解度太小,导致溶剂体系筛选受限,分离难度大。已有方法中利用HSCCC去除粗多糖组分中的非糖杂质,而并不能很好的分离多糖。
虽然利用离子液体从枸杞果实中提取的枸杞多糖(LBPs-ILs)具有很高的生物活性,但LBPs-ILs中的主要活性成分尚未确定。为进一步系统研究LBPs-ILs中具有高生物活性的主要有效成分,本发明建立了一种基于HSCCC的分离LBPs-ILs的有效方法;分离获得了三种纯化多糖组分,并对三种纯化多糖的结构和生物活性进行了评估。
本发明实施例中使用的枸杞果实来自中国宁夏中杞集团,D-(+)甘露糖(Man)、D-(+)半乳糖(Gal)、D-(+)葡萄糖(Glc)、L-(+)鼠李糖(Rha)、D-(+)葡萄糖醛酸(GlcA)、D-(+)半乳糖醛酸(GalA)、D-(+)氨基葡萄糖(GlcN)和L-(+)阿拉伯糖(Ara)等单糖标准品购自美国国家食品药品控制研究院。HepG2细胞系(
本发明实施例中的HSCCC仪器为TBE-300B HSCCC系统(上海同田生物技术有限公司),配有温度和转速控制系统、260mL盘管容积、20mL进样系统和BSZ-100自动馏分收集器。每次分离时,开启高速逆流色谱仪,通过恒温循环装置将色谱柱温度控制在25℃。上相作为固定相以10.0mL/min的流速泵入色谱柱,流动相以0.5、0.8或1.0mL/min的流速泵入色谱柱。装置以800或900rpm的速度旋转。当流动相流出色谱柱时,将20mL提取液注入进样环,每管收集流出液的6mL,并使用苯酚-硫酸法进行检测。将属于相同多糖成分的试管合并透析(截留分子量:3500Da)以去除PEG和盐。最后通过冷冻干燥获得纯化的多糖组分。
下面结合实施例和附图对本发明进行详细的描述。
实施例1:建立精细化分离枸杞多糖的方法
从枸杞多糖粉LBPs-ILs进一步使用高速逆流色谱(HSCCC)方法进行分离纯化。其中枸杞多糖粉末LBPs-ILs的一种具体的制备方法如下:
将30.0g干燥的枸杞加入6%的[C
用高速逆流色谱(HSCCC)方法进行分离纯化的枸杞多糖粉末LBPs-ILs还可以是使用其它亲水性离子液体方法制备的枸杞多糖。
对高速逆流色谱(HSCCC)方法进行优化,从而更有效的分离不同的多糖组分,而HSCCC的成功分离取决于选择合适的两相溶剂系统。
1、双水相溶剂系统的选择
研究PEG分子量(400、600、1000、1500)、PEG浓度(8%、10%、12%、14%)和磷酸盐浓度(16%、18%、20%、22%)对枸杞多糖分配系数的影响。为HSCCC选择最佳水性两相体系。分配系数K值的计算公式为平衡状态下多糖在两相溶剂之间的分布比率,公式如下:
K=CU/CL,其中,CU和CL分别代表LBPs-ILs在上相和下相的含糖量。
1)PEG分子量对LBPs-ILs的K值的影响
在12%PEG-20%磷酸盐体系中,选择了不同分子量的PEG(包括400、600、1000和1500Da)来构建双水相体系(ATPS),以研究它们对LBPs-ILs的影响。表1列出了不同分子量的PEG在LBPs-ILs上的分布特性。结果表明,随着PEG分子量的增加,LBPs-ILs的K值不断降低,这可能是由于PEG分子量增加,分子内极性基团密度相对较低,极性降低所致。PEG400、600和1000的K值分别为1.72、1.43和0.73,符合HSCCC分离的K值范围。PEG400和PEG600的K值过大,导致多糖的洗脱时间延长,造成设备磨损。因此,选择PEG1000作为分离LBPs-ILs的试剂。
表1:PEG-磷酸盐溶剂体系对LBPs-ILs的K值的影响表
2)PEG质量分数对LBPs-ILs的K值的影响
在PEG1000-20%磷酸盐体系中,研究了不同质量分数的PEG对LBPs-ILs分布特性的影响。如表1所示,当PEG浓度增加时,LBPs-ILs的K值呈先增大后减小的趋势,这表明LBPs-ILs与PEG分子链之间的亲和力增强,导致更多的LBPs-ILs分布在上相中。但当PEG浓度为14%时,K值为0.31,这可能是由于溶剂体系的粘度较高,多糖在溶剂体系中的传质阻力增大,从而降低了K值。因此,选择PEG的质量分数为12%。
3)磷酸盐浓度对LBPs-ILs的K值的影响
在12%的PEG1000-磷酸盐体系中,磷酸盐在低浓度时难以分层,在高浓度时也不能完全溶解。因此,研究了质量分数为16%-20%的磷酸盐对LBPs-ILs分布特性的影响。在表1中,K值随着磷酸盐浓度的增加而逐渐增大。然而,当磷酸盐浓度增加到22%时,K值降至0.63。由于盐化作用的增强,盐离子与水分子之间的水合作用增强,这可能会改变相间电位。LBPs-ILs在下相中的分布逐渐减少。因此,分布系数发生了变化。因此,选择磷酸盐的质量分数为20%。
在研究了PEG分子量、PEG浓度和磷酸盐浓度对LBPs-ILs分配系数的影响上,最终选择PEG1000:K
2、优化HSCCC分离条件
旋转速度、流动相流速和固定相保留率对HSCCC分离方法也至关重要。根据单因素实验筛选,选择两相体积比(V-up/V-down)为30:50的PEG1000-KH
表2:不同流速和转速下固定相的保留率表(%)
最终对枸杞多糖粉末LBPs-ILs采用高速逆流色谱(HSCCC)方法进行分离纯化的条件如下:
流速为0.8mL/min、转速为900rpm、溶剂系统为PEG1000-KH
其中多糖组分LBPs-ILs-1的保留时间范围为300-400min,LBPs-ILs-2的保留时间范围为400-500min,LBPs-ILs-3的保留时间范围为600-80 0min。
而且,本发明的高速逆流色谱(HSCCC)方法分离的三种多糖馏分均为白色粉末,而不是分离前粗提物的深褐色。通过比较H
实施例2:分离的三种多糖的理化性质分析
1、分子量分布
使用配备OPTILAB和DAWN检测器(Wyatt Technology Co.,Ltd.,SantaBarbara,California,USA)的Agilent 1290UPLC Series(Palo Alto,California,USA),通过HPGPC测定LBPs-ILs的分子量。多糖样品以5.0mg/mL的浓度制备,经0.22微孔滤膜过滤后进行分析。然后使用Shodex Ohpak 806HQ(13μm,8.0mm×300mm,Tokyo,Japan)和Shodex Ohpak804HQ(10μm,8.0mm×300mm)测量分子量,流动相为0.2M NaCl,流速为1.0mL/min。数据被导入ASTRA8软件进行分析。
配备折射率检测器(RID)的高效凝胶色谱法(HPGPC)是准确表征枸杞多糖分子量分布的灵敏方法。图2B显示LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的HPGPC分布,分子量分别为1.40×10
2、单糖成分的测定
采用高效液相色谱(HPLC)-1-苯基-3-甲基-5-吡唑啉酮(HPLC-PMP)柱前衍生法测定枸杞LBPs-ILs的单糖组成。样品(5.0mg)多糖与5.0mL三氟乙酸(3mol/L)在110℃处理8h。残渣用N
LBPs-ILs的单糖组成结果见表3。LBPs-ILs-1的单糖组成显示,它主要由Ara(57.03%)和Gal(33.99%)构成,没有Man和Rha。LBPs-ILs-2的Gal含量最高(46.40%),不含GlcA。LBPs-ILs-3的Glc含量最高(41.97%),Man和Rha含量相对较高,表明Man和Rha主要存在于LBPs-ILs的低分子量多糖部分。LBPs-ILs-1和LBPs-ILs-2主要由Ara和Gal组成,推测可能存在阿拉伯半乳聚糖成分。这些结果表明,LBPs-ILs-2和LBPs-ILs-3的分配系数差异较大,可能与单糖组成不同有关。含有Ara和Gal的多糖组分的分配系数较小,更容易首先被洗脱。
表3:单糖组成表(摩尔比,%)
3、傅立叶变换红外(FT-IR)光谱法检测
准确称取1.5mg样品,用200.0mg KBr充分研磨,用红外光谱仪(VERTEX70v,Advance Bruker,Ettlingen,Germany)在4000-400cm
4、热重稳定性测量
在热重分析仪(STA449F3,NETZSCH Co.,Ltd.,Selb,Germany)上对多糖样品进行TG分析、导热热重分析(DTG)和差示扫描量热分析(DSC),温度为22℃-800℃,10℃/min,氮气作为保护气体,流速为50mL/min。
如图4D-E所示,三种多糖的DSC图在25℃-800℃范围内有三个突出的放热峰,表明多糖的热分解主要分为三个阶段。结合水的蒸发引起约70℃的放热峰,天然多糖具有许多亲水基团,可以吸附一定量的水。380℃处的放热峰是由于结晶水挥发和糖链解聚产生结晶转变所致。约580℃的放热峰表明多糖中一些较稳定结构的分解和断裂,这些结构仍处于失重过程中。三种多糖的失重主要发生在300℃-500℃的温度节点上,其质量损失在81.82%-93.71%之间。三种多糖的最终残基降序为LBPs-ILs-2>LBPs-ILs-1>LBPs-ILs-3。结果表明三种多糖的热稳定性能基本相同。
5、扫描电子显微镜(SEM)
样品的形态由扫描电子显微镜(JSM-6701F,JEOL Co.,Ltd.,Tokyo,Japan)检测。测试前,将带有薄金层的冻干样品安装在支架上,以确保导电性。扫描电子显微镜(SEM)图像是在5.0kV的加速电压下以2000×放大倍率记录的。
扫描电子显微镜(SEM)是观察分离多糖的大小、形状和孔隙率等形态特征的有效工具。图5显示了三种枸杞多糖在2000倍放大率下的扫描电子显微镜图像。三种枸杞多糖的显微形态存在明显差异。其中,LBPs-ILs-1的表面粗糙,主要由相互连接的疏松多孔的薄片组成。LBPs-ILs-2的微观结构表现为片状和多枝线状杆状结构,片状表面观察到微小的孔隙结构。LBPs-ILs-3呈片状形态,表面光滑。具有疏松多孔结构的多糖可暴露出更多的活性位点,并提供更强大的氢供应,从而与降糖酶结合并抑制其活性。
6、甲基化和气相色谱-质谱分析
LBPs-ILs的甲基化检测方法是将10.0mg LBPs完全溶解在2.0mL DMSO中,然后加入无水NaOH粉末(30.0mg)。用1.0mL CH
如表4所示,LBPs-ILs-1有10个糖残基,其中1,6-Galp、1,3-Galp、1,5-Araf、1,3-Araf、1,2-Araf和1,4-Glcp为线性残基。同时,在糖类残基中观察到大量的T-Araf(24.00%)和1,3,6-Galp(24.79%),且T-Araf的数量与1,3,6-Galp相似,表明这两种残基主要分布在多糖的支链结构中。LBPs-ILs-2有9个糖残基,主要的线性残基是1,3-Araf、1,5-Araf、1,3-Galp和1,4-Glcp。LBPs-ILs-2的多糖残基类型与LBPs-ILs-1相似,但T-Araf(27.58%)和1,3,6-Galp(30.35%)糖残基含量较高,这些都表明LBPs-ILs-1和LBPs-ILs-2中存在阿拉伯半乳聚糖片段。此外,LBPs-ILs-3的分子量最小,但14个糖残基的种类最多。LBPs-ILs-3与其他糖残基相当,主要的线性残基是3,4-Glcp和1,4-Glcp,表明Glc主要存在于骨架结构中。在LBPs-ILs-3中,末端残基和支链残基主要是T-Glcp和1,3,6-Galp。在这三种多糖中,1,3-Galp和1,6-Galp两条支链的含量依次降低,具体情况如下:LBPs-ILs-1(15.05%)>LBPs-ILs-3(5.33%)>LBPs-ILs-2(5.31%)。
表4:不同枸杞多糖的甲基化分析和连接模式表
a未检测到。
7、流变特性分析
使用带有平行钢板(间隙1.0mm,直径40mm)的模块化紧凑型流变仪(MCR-302,Anton Paar,Steiermark,Austria)估算不同浓度枸杞多糖溶液(1%、2%、3%和4%)的粘度。流变仪在0.01到100S
多糖的流变特性有助于其食品工业的应用,预测多糖的凝胶或增稠特性有助于食品的生产和储存。因此,评估多糖的流变特性对于确定多糖在食品应用中的潜力至关重要。如图6B所示,三种枸杞多糖的粘度随着浓度的增加而增加,这表明枸杞多糖的缠结和分子间的结合随着浓度的增加而增加,因此表现出假塑性特征(剪切稀化)。此外,三种样品溶液的表观粘度都随着剪切速率(γ)的增加而降低,呈对数线性关系,这表明三种枸杞多糖都是剪切稀化流体。枸杞多糖溶液的表观粘度依次为η(LBPs-ILs-1)>η(LBPs-ILs-2)>η(LBPs-ILs-3)。枸杞多糖的表观粘度可能与其分子量有关,多糖的分子量越大,粘度越高,这与我们的研究结果一致。高粘度多糖可广泛应用于食品工业,因为在食品中添加高粘度多糖对调节食品的稠度有很大作用。
实施例3:分离的三种多糖的活性分析
1、α-葡萄糖苷酶抑制活性的测定
用于α-葡萄糖苷酶抑制活性检测的LBPs-ILs是将50μL LBPs(0.1-1.0mg/mL)和50μLα-葡萄糖苷酶溶液加入96孔板中,在37℃下放置15分钟。然后加入50μL pNPG(1mol/L)溶液作为反应底物,再培养15分钟。Na
2、α-淀粉酶抑制活性的测定
用于α-淀粉酶抑制活性检测的LBPs-ILs的方法,是将不同浓度(0.1-1.0mg/mL)的LBPs-ILs溶液与15μLα-淀粉酶溶液(0.02mg/mL)混合。混合物在37℃下保持10分钟。然后向混合物中加入60μL淀粉溶液(0.08%),并在37℃温育15分钟。加入1.0mol/L HCl关闭反应。碘液(0.01mol/L)染色后,在630nm波长下测量反应液。阿卡波糖作为阳性对照。
3、醛糖还原酶(AR)抑制活性的测定
枸杞多糖-ILs样品的AR抑制活性检测方法是将100μL PBS(0.1mol/L,pH 7.0)、20μL样品(0.1-1.0mg/mL)、20μL醛糖还原酶溶液、20μL硫酸铵溶液(4.0mol/L)和20μL NADPH(辅助因子,2.4mmol/L)混合后放入96孔板中。然后加入20μL底物(DL-甘油醛二聚体,25mmol/L)开始反应,在340nm波长处持续6分钟测量吸光度。槲皮素作为阳性对照,PBS缓冲液作为空白对照。
4、检测结果
在2型糖尿病患者中,体内血糖水平与α-葡萄糖苷酶和α-淀粉酶的活性密切相关,这两种酶可延缓碳水化合物分子在胃肠道中的吸收和消化,从而防止血糖升高。高血糖被认为是导致糖尿病慢性并发症的一个重要因素。醛糖还原酶(AR)是多元醇途径中的一种关键酶,属于醛酮还原酶家族。高血糖通过激活多元醇途径转化为山梨醇,山梨醇无法通过细胞膜,从而诱发氧化应激和渗透应激,导致糖尿病并发症。因此,AR抑制剂能改善糖尿病并发症。
图7A显示了四种样品(包括LBPs-ILs、LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3)对α-葡萄糖苷酶活性的抑制作用。所有样品对α-葡萄糖苷酶的抑制作用都在0.1-1.0mg/mL的范围内。经测定,LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的最大抑制率分别为74.63±3.67%、52.24±2.98%和37.21±0.44%。与LBPs-ILs相比,LBPs-ILs-1对α-葡萄糖苷酶的抑制作用呈相似趋势,且抑制效果明显高于其他两种多糖组分。这一结果表明,LBPs-ILs-1是LBPs-ILs中抑制α-葡萄糖苷酶活性的主要成分。此外,LBPs-ILs-2和LBPs-ILs-3也有一定的抑制作用。
α-淀粉酶检测结果见图7B,在0.1-1mg/mL浓度范围内,LBPs-ILs-1的α-淀粉酶抑制活性最高(61.21±1.64%),LBPs-ILs-2的抑制活性最低(21.26±1.30%)。与LBPs-ILs相比,LBPs-ILs-1的α-淀粉酶活性高LBPs-ILs,而LBPs-ILs-2和LBPs-ILs-3的抑制指标远低于LBPs-ILs,表明LBPs-ILs-1是抑制α-淀粉酶活性的主要成分。
如图7C所示,在0.25-1.0mg/mL范围内,所有样品对AR都表现出剂量依赖性抑制作用。其中,LBPs-ILs-1对AR的抑制率最高(91.31±2.08%),其次是1.0mg/mL浓度的LBPs-ILs-3(63.29±4.43%)和LBPs-ILs-2(53.13±2.30%)。与对α-葡萄糖苷酶活性和α-淀粉酶的抑制作用相比,低浓度的枸杞多糖具有更高的AR抑制活性。这可能是AR与α-葡萄糖苷酶和α-淀粉酶之间的作用机制不同造成的。
实施例4:枸杞多糖对HepG2细胞活力、葡萄糖消耗量和糖原含量的影响
1、细胞活力测定
人肝母细胞瘤HepG2细胞来自国家鉴定细胞培养物保藏中心(中国上海)。如前所述,建立了高浓度胰岛素耐药(IR)的HepG2细胞模型。简而言之,将处于对数生长期的细胞(1×10
2、葡萄糖消耗测定
通过离心制备抗IR的HepG2的培养上清。上清液中的葡萄糖含量由葡萄糖检测试剂盒按照生产商提供的方法进行检测。
3、细胞内糖原含量测定
细胞内糖原含量是在6孔板中以2.5×10
所有实验均进行三次,数据以均数±标准差(SD)表示,使用SPSS19.0软件进行单因素方差分析,以确定组间的显著差异。平均值以P<0.05为差异显著。
胰岛素抵抗(IR)是T2DM的致病因素之一,其特征是外周血细胞对葡萄糖的摄取和利用减少。细胞功能紊乱是在血糖平衡的背景下发生的。首先检测了样品对HepG2细胞的毒性。用不同浓度的样品处理细胞,并用MTT法测定细胞活力。如图8A所示,在测试浓度下,四种多糖不会明显降低细胞存活率。然而,当加入500μg/mL的LBPs-ILs-3时,存活率明显下降。因此,我们用50-200μg/mL的多糖对样品的降血糖活性
进行了进一步的体外研究。此外,还利用IR-HepG2细胞模型观察样品是否能改善葡萄糖代谢。如图8B所示,与普通组相比,用30mmol/L葡萄糖和1μmol/L胰岛素处理HepG2细胞可显著降低葡萄糖消耗量和糖原水平(P<0.01)。成功建立了稳定的IR-HepG2细胞模型。与模型组相比,用所有样品处理细胞24小时后,葡萄糖消耗以剂量依赖的方式得到改善。LBPs-ILs-1的降糖活性最强,在浓度为100和200μg/mL时可显著提高葡萄糖消耗量,与空白组相比差异显著(P<0.05)。浓度为200μg/mL时,葡萄糖消耗量增至4.68mmol/L,比模型组高出近2.3倍。然而,LBPs-ILs-3的表现最弱。此外,糖原是维持平均健康血糖平衡的重要因素。随着血糖的升高,肝脏会合成糖原以降低血糖。与模型组相比,四组样品中糖原含量的增加呈浓度依赖性,表明样品能够通过促进糖原的合成来缓解糖尿病(图8C)。其中,三种枸杞多糖的作用强度依次为LBPs-ILs-1>LBPs-ILs>LBPs-ILs-2>LBPs-ILs-3。即使LBPs-ILs-1的浓度为200μg/mL,糖原含量也比模型组增加了2.27倍(P<0.01)。
为了评估枸杞多糖是否参与了糖酵解和葡萄糖代谢过程,对IR-HepG2细胞中的关键肝酶活性进行了评估。图8D中的结果表明,与模型组相比,LBPs处理组的丙酮酸激酶(PK)活性以浓度依赖性的方式变化。与MC组相比,LBPs-ILs、LBPs-ILs-1、LBPs-ILs-2和LBPs-ILs-3的PK活性分别提高了47.53%、106.09%、80.57%和65.11%(P<0.01)。其中,LBPs-ILs-1比其他种类的枸杞多糖更有效。这一结果表明,LBPs-ILs-1对促进糖酵解和糖代谢有积极作用。上述结果表明,枸杞多糖,尤其是LBPs-ILs-1具有显著的降血糖作用,这可能是由于枸杞多糖改善了糖原合成和肝脏胰岛素敏感性。
体外降糖结果表明,LBPs-ILs-1具有更高的活性抑制作用。根据不同枸杞多糖的理化性质和结构分析,LBPs-ILs-1和LBPs-ILs-2的单糖组成相似,但分子量差异较大。因此,LBPs-ILs-1的抑制活性最高,可能是因为其分子量较高、结构稀疏多孔、侧链为1,6-Galp和1,3-Galp的阿拉伯半乳聚糖含量最高。
综上,用PEG1000-K
- 一种煤矿采煤水处理药剂及其对煤矿采煤水的处理方法
- 一种煤矿煤泥清淤采煤一体化设备及方法
- 一种煤矿井下煤泥池智能清淤装置
