馥芳艾纳香中咖啡酰奎宁酸的提取和检测方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物提取技术领域,具体涉及馥芳艾纳香中咖啡酰奎宁酸的提取和检测方法。
背景技术
酚类化合物是植物在生长过程中产生的次生代谢产物。它们在蔬菜、水果和药用植物中丰富存在。酚类化合物具有多种结构和生物活性。它们可以充当抗氧化剂、抗微生物、抗癌剂、抗衰老剂、抗炎剂和抗高血压剂。因此,植物酚类化合物在食品和药物领域有广泛的应用。咖啡酰奎宁酸(CQAs)是酚类化合物的一个重要组成部分,来源于苯丙素生物合成途径。这些化合物由奎宁酸与一个到四个咖啡酸基团酰化而成,共有15种可能的组合,包括四种单咖啡酰奎宁酸,六种双咖啡酰奎宁酸,四种三咖啡酰奎宁酸和一种四咖啡酰奎宁酸。咖啡酰奎宁酸具有多种生物活性,如抗氧化、抗菌、抗癌、抗病毒、抗阿尔茨海默病和神经保护活性。咖啡酰奎宁酸通常通过植物性食品(如水果、蔬菜和咖啡饮料)摄入,由于其多样的生物活性,咖啡酰奎宁酸越来越引起人们的关注,它们具有开发为新药物的潜力。
尽管对咖啡酰奎宁酸的定性和定量方法已有一些研究,但咖啡酰奎宁酸同分异构体的表征和准确的定量分析仍然具有较大挑战性。这主要归因于几个因素,包括存在具有相似物化性质的多个同分异构体、商业标准的缺乏,以及在样品处理过程中咖啡酰奎宁酸的降解和转化。这些挑战阻碍了咖啡酰奎宁酸同分异构体的准确表征和咖啡酰奎宁酸的综合表征方法的开发。为了克服这些挑战并推动对咖啡酰奎宁酸的研究,包括食品添加剂、保健产品和药品等各个领域,有必要进一步研究用于咖啡酰奎宁酸的提取方法以及定性和定量分析技术。
酚类化合物主要通过有机溶剂或物理辅助技术从植物基质中提取。然而,有机溶剂提取具有高挥发性、毒性、易燃性和低生物降解性等缺点。低共熔溶剂(DESs)是一种新型的环保溶剂,通常由氢键供体(HBD)和氢键受体(HBA)组成。DESs的熔点低于任何组分的熔点,因此它们可以在室温下以液体形式稳定存在。与有机溶剂相比,DESs易于合成、成本低廉、稳定、不挥发、可生物降解且环保等特点。近年来,DESs引起了更多的关注,并广泛应用于天然产物提取。
馥芳艾纳香(Blumea aromatica DC.)是艾纳香属的多年生草本植物,在中国西南和东南亚地区生长。在中医药中被称为“山风”,广泛用于治疗风湿病、关节痛和湿疹等疾病。尽管已经认识到它的潜力,但对馥芳艾纳香的化学成分和生物活性仍知之甚少。值得注意的是,在以前的研究中,从馥芳艾纳香中分离的化合物主要为labdane和bisnor二萜类化合物,这些化合物展示的多样生物活性,包括抗炎、免疫抑制和腺苷酸环化酶活化性质。然而,目前还没有关于馥芳艾纳香中咖啡酰奎宁酸的提取方法和含量测定的相关报道。
发明内容
本发明的目的之一在于,提供一种从馥芳艾纳香中提取咖啡酰奎宁酸的方法。本发明研究显示,使用七种DESs从馥芳艾纳香中提取九种咖啡酰奎宁酸时与三种传统溶剂相比,具有良好的提取效率,并且针对特定咖啡酰奎宁酸衍生物,使用特定的DESs能获得更高的提取效率。
本发明的目的之二在于,提供一种馥芳艾纳香中咖啡酰奎宁酸的检测方法。本发明开发了一种UPLC-Q-Orbitrap HRMS方法,能同时测定馥芳艾纳香中九种咖啡酰奎宁酸的含量;方法学研究表明,该方法具有出色的精密度、准确度、重复性和稳定性。
为实现上述目的,本发明采用如下技术方案:
一种从馥芳艾纳香中提取咖啡酰奎宁酸的方法,包括以下步骤:将馥芳艾纳香植株干燥后压碎,过筛,取馥芳艾纳香粉末,加入低共熔溶剂,振荡混合后进行超声处理,冷却至室温后,离心,取上清液,即得;所述的低共熔溶剂是由氯化胆碱与乳酸、乙酸、乙二醇、尿素、甘油、1,4-丁二醇、草酸中的任意一种复配组成。
优选的,所述的咖啡酰奎宁酸包括绿原酸、隐绿原酸、新绿原酸、1,5-O-二咖啡酰奎宁酸、1,3-O-二咖啡酰奎宁酸、1,4-O-二咖啡酰奎宁酸、异绿原酸A、异绿原酸B和异绿原酸C。
优选的,所述的低共熔溶剂中氯化胆碱与乳酸、乙酸、乙二醇、尿素、甘油、1,4-丁二醇或草酸复配的摩尔比为1:2~3。
优选的,所述的低共熔溶剂是由氯化胆碱与乙二醇或1,4-丁二醇按摩尔比1:3复配组成。
优选的,所述的超声处理的条件为功率100~800W,频率40kHZ,温度30~80℃,时间10~60min。
优选的,所述的馥芳艾纳香粉末与低共熔溶剂混合的料液比为1g:10~200mL。
一种馥芳艾纳香中咖啡酰奎宁酸的检测方法,包括以下步骤:
(1)制备标准溶液:分别准确称取绿原酸、隐绿原酸、新绿原酸、1,5-O-二咖啡酰奎宁酸、1,3-O-二咖啡酰奎宁酸、1,4-O-二咖啡酰奎宁酸、异绿原酸A、异绿原酸B和异绿原酸C的对照品,以甲醇溶液为溶剂,配制不同浓度的混合标准溶液;
(2)制备待测样品溶液:将按照权利要求1所述的方法提取获得的上清液与甲醇溶液涡旋混匀,过滤,得到待测样品溶液;
(3)检测:采用UPLC-Q-Orbitrap HRMS分别对混合标准溶液和待测样品溶液进行检测,以对照品的浓度为横坐标,定量用子离子的质量色谱图峰面积为纵坐标,绘制标准曲线,根据标准曲线,对待测样品溶液中不同咖啡酰奎宁的成分进行检测。
优选的,所述的甲醇溶液的浓度为质量分数50%。
优选的,所述的过滤是使用0.22μm的微孔膜过滤。
优选的,所述的UPLC-Q-Orbitrap HRMS的色谱条件为:
色谱柱:Thermo Fisher Scientific Bremen Hypersill GOLD AQ(100mm×2.1mm,1.9μm);流动相A:含体积分数0.1%甲酸的乙腈溶液,流动相B:含体积分数0.1%甲酸的水溶液;梯度洗脱:0~15min,B 97%;15~20min,B 97%~96%;20~25min,B 96%~90%;25~50min,B 90%~87%;50~54min,B 87%~5%;流速为0.3mL/min,进样量为2μL;柱温为42℃,检测波长为330nm,使用DAD进行检测。
质谱条件为:采用负离子扫描模式,检测条件如下:HESI离子源,电喷雾电压为3.5kV,毛细管温度为325℃,辅助气体温度为300℃;质谱扫描范围为m/z 200~600;氮气用于鞘气、辅助气体和吹扫气体;鞘气流速为50L/min,辅助气体流速为8L/min,吹扫气体流速为1L/min;分辨率为60000。
本发明具有以下有益效果:
1.本发明利用七种低共熔溶剂作为提取剂,与三种传统溶剂(乙醇、甲醇、水)相比,从馥芳艾纳香中提取特定的咖啡酰奎宁酸表现出显著优势。其中,DES-6(氯化胆碱:1,4-丁二醇)是提取3-O-咖啡酰奎宁酸和4,5-O-二咖啡酰奎宁酸的最佳溶剂,浓度分别为4.71±0.31和2.28±0.19mg/g。DES-7(氯化胆碱:草酸)是提取4-O-咖啡酰奎宁酸的最佳溶剂,浓度为2.05±0.05mg/g。DES-5(氯化胆碱:甘油)是提取5-O-咖啡酰奎宁酸,1,3-O-二咖啡酰奎宁酸,1,4-O-二咖啡酰奎宁酸和3,4-O-二咖啡酰奎宁酸的最佳溶剂,浓度分别为1.70±0.14,2.17±0.04,1.39±0.14和2.30±0.06mg/g。DES-2(氯化胆碱:乙酸)是提取1,5-O-二咖啡酰奎宁酸和3,5-O-二咖啡酰奎宁酸的最佳溶剂,浓度分别为7.60±0.38和5.70±0.23mg/g。
2.本发明对来自馥芳艾纳香的十种溶剂提取物进行了DPPH和ABTS自由基清除实验以及还原能力测定,结果显示:DES提取物表现出出色的抗氧化活性,超越了传统溶剂的抗氧化活性,其中,DES-3(氯化胆碱:乙二醇)提取物表现出最突出的清除自由基活性,DPPH和ABTS自由基的IC
3.本发明开发了一种UPLC-Q-Orbitrap HRMS方法,能同时测定馥芳艾纳香中九种咖啡酰奎宁酸的含量。方法学研究表明,该方法具有出色的精密度、准确度、重复性和稳定性。分析确定了在本研究中确定的九种咖啡酰奎宁酸中的两组异构体:三个单咖啡酰奎宁酸和六个双咖啡酰奎宁酸。尽管每组中的成分在结构上存在极小的差异,但它们在取代基的位置上有所不同。馥芳艾纳香中九种咖啡酰奎宁酸的含量存在显著差异,存在微量成分。因此,同时确定这九种咖啡酰奎宁酸的含量构成了一个相当大的挑战。在本发明中,通过不断优化色谱分离条件并利用UPLC-Q-Orbitrap HRMS技术的分析优势,我们实现了对九种咖啡酰奎宁酸的同时定量分析。本发明研究为类似化合物的分析技术的研究和探索提供了有价值的参考。
附图说明
图1为负离子模式下9种咖啡酰奎宁酸混合参考溶液(a)和馥芳艾纳香甲醇提取物(b)的总离子色谱图。(A:4-O-咖啡酰奎宁酸;B:3-O-咖啡酰奎宁酸;C:5-O-咖啡酰奎宁酸;D:1,3-O-二咖啡酰奎宁酸;E:1,4-O-二咖啡酰奎宁酸;F:3,4-O-二咖啡酰奎宁酸;G:3,5-O-二咖啡酰奎宁酸;H:1,5-O-二咖啡酰奎宁酸;I:4,5-O-二咖啡酰奎宁酸)。
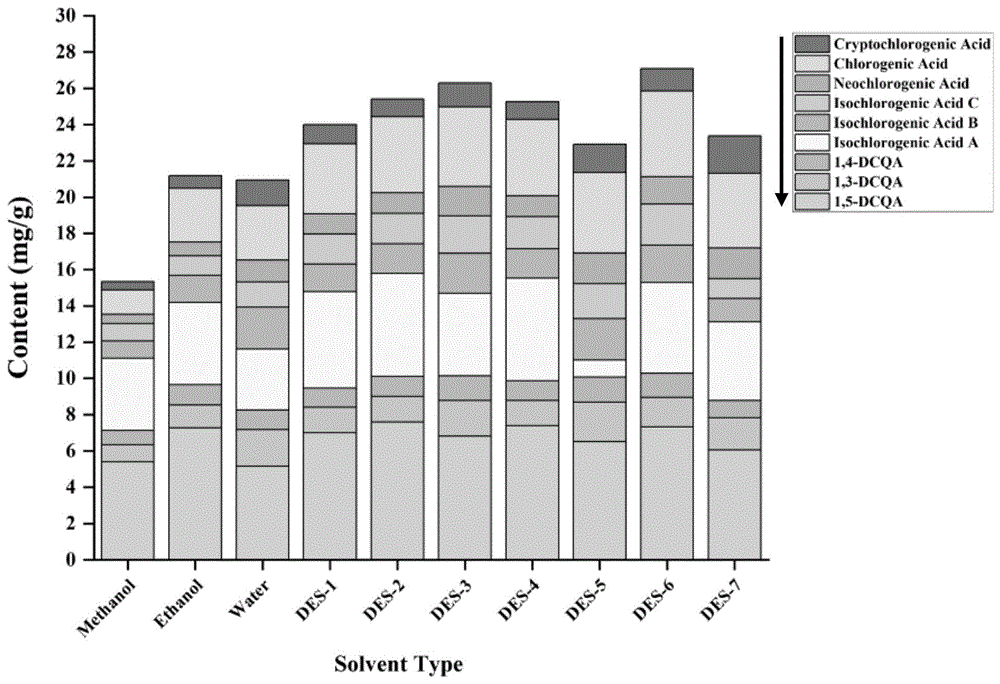
图2为不同溶剂提取的馥芳艾纳香中九种咖啡酰奎宁酸的含量。
图3为抗坏血酸(VC)对照和不同溶剂提取的馥芳艾纳香的DPPH自由基清除活性。
图4为抗坏血酸(VC)对照和不同溶剂提取的馥芳艾纳香的ABTS自由基清除活性。
图5为(a)抗坏血酸(VC)对照和(b)不同溶剂提取的馥芳艾纳香的还原力。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
1.化学品、试剂和材料
用于色谱的乙腈、甲醇和甲酸由Thermo Fisher Scientific获得。色谱用水由广州屈臣氏食品与饮料有限公司(中国广州)采购。3-O-咖啡酰奎宁酸(绿原酸,3-CQA)、4-O-咖啡酰奎宁酸(隐绿原酸,4-CQA)、5-O-咖啡酰奎宁酸(新绿原酸,5-CQA)、1,5-O-二咖啡酰奎宁酸(1,5-diCQA)、1,3-O-二咖啡酰奎宁酸(1,3-diCQA)、1,4-O-二咖啡酰奎宁酸(1,4-diCQA)、3,5-O-二咖啡酰奎宁酸(异绿原酸A,3,5-diCQA)、3,4-O-二咖啡酰奎宁酸(异绿原酸B,3,4-diCQA)和4,5-O-二咖啡酰奎宁酸(异绿原酸C,4,5-diCQA)的对照品从成都阿尔法生物有限公司(中国成都)获得,批号分别为AZ22011851、AFBL221、AZ21102901、AFBG1302、AFBL1284、AFCC1605、AZ22042903、AZ21092203和AFCB0705,纯度不低于98%。氯化胆碱来源于阿勒山(广州)生物科技有限公司。抗坏血酸、乳酸、乙酸、乙二醇、尿素、甘油、1,4-丁二醇和草酸从广州化学试剂厂购买。1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(纯度>98%)来源于上海阿拉丁生化科技股份有限公司。
本实验使用的植物材料为馥芳艾纳香(Blumea aromatica DC.),采集自中国肇庆,并由广东药科大学中药资源学院的郑希龙副研究员鉴定。
2.仪器
色谱分离系统采用Thermo Fisher Scientific的Vanquish Flex超高效液相色谱仪。用于化学成分的检测和定量是Thermo Fisher Scientific的Orbitrap Exploris 120四极-静电轨道高分辨率质谱仪。样品称量使用来自岛津(中国)有限公司的ATY124万分之一天平。
3.咖啡酰奎宁酸的含量测定
(1)检测条件
色谱条件:色谱分离使用Thermo Fisher Scientific Bremen Hypersill GOLDAQ色谱柱(100mm×2.1mm,1.9μm)。流动相由两部分组成:A,含0.1%甲酸(体积比)的乙腈溶液,B,含0.1%甲酸(体积比)的水溶液。采用渐进洗脱,具体条件如下:0~15min,B 97%;15~20min,B 97%~96%;20~25min,B 96%~90%;25~50min,B 90%~87%;50~54min,B 87%~5%。流速设定为0.3mL/min,进样量为2μL。柱温保持在42℃,检测波长为330nm,使用DAD进行检测。
质谱条件:本研究采用负离子模式的扫描模式。检测条件如下:HESI离子源,电喷雾电压设定为3.5kV,毛细管温度维持在325℃,辅助气体温度设定为300℃。质谱扫描范围设定为m/z 200~600。氮气用于鞘气、辅助气体和吹扫气体;鞘气流速为50L/min,辅助气体流速为8L/min,吹扫气体流速为1L/min;分辨率为60000。
(2)低共熔溶剂(DESs)的制备
低共熔溶剂通过将氢键受体(HBA,氯化胆碱)与七种不同的氢键供体(HBD)以特定摩尔比加热混合制备而成。采用改进的方法,具体参照参考文献(Ivanovic,M.,IslamcevicRazborsek,M.,Kolar,M.,2020.Innovative extraction techniques using deepeutectic solvents and analytical methods for the isolation andcharacterization of natural bioactive compounds from plant material.Plants 9(11),1428.)。将规定量的反应物放入150mL烧杯中,加入磁力搅拌棒。然后用保鲜膜和封口膜覆盖混合物,加热并在60℃的磁力搅拌器上搅拌40分钟,直至获得均匀透明液体。冷却至室温后,加入30%的水并充分混合。将得到的混合物转移到50mL离心管中,并储存在4℃的冰箱中备用。不同类型DESs的组成见表1。
表1.七种不同低共熔溶剂(DESs)的组成
(3)样品溶液和标准溶液的制备
样品溶液的制备:馥芳艾纳香的整株植物经过干燥后,被压碎并通过50目筛子筛选。精确称量的馥芳艾纳香粉末(0.1g,三个平行组)放入15mL的离心管中。然后,单独加入5mL乙醇、甲醇、水和七种不同的低共熔溶剂。离心管密封,通过振荡混合,并称重。超声处理在特定条件下进行,包括功率400W,频率40kHZ,温度50℃,持续20min。冷却至室温后,重新称重,并加入相应的提取溶剂以补偿重量损失。以4000转/分钟的速度进行离心,收集2mL上清液并存储在一个单独的离心管中。这个过程平行重复三次,得到的上清保存液即为提取物。从上清保存液中,转移总共200μL的样品到一个2mL的离心管中。随后,加入800μL 50%甲醇水溶液,并通过涡旋混合均匀。然后,将混合物通过0.22μm的微孔膜过滤以获得测试溶液。
标准溶液的制备:分别准确称取九种咖啡酰奎宁酸的对照品各1.00mg,并置于5mL容量瓶中,九种咖啡酰奎宁酸的名称和结构如表2所示。这些对照品在50%甲醇水溶液中溶解并稀释到刻度线,得到浓度为0.2mg/mL的母液。接下来,取异绿原酸A、异绿原酸B和异绿原酸C的母液各0.4mL,以及其他六个咖啡酰奎宁酸的母液各0.625mL转移到单独的5mL容量瓶中。使用50%甲醇水溶液调整到刻度线,摇动混合以获得浓度不同的混合参考溶液。最后,将所有样品存放在4℃的冰箱中。
表2.9种咖啡酰奎宁酸的化合物名称和结构
(4)色谱条件的优化
为了提高样品的分辨率和峰形,我们考虑了两种色谱柱:Thermo FisherHypersill GOLD AQ柱(100mm×2.1mm,1.9μm)和Fisher Hypersil GOLD C
(5)方法验证
本研究进行了校准曲线、检测限(LODs)和定量限(LOQs)、精密度(包括日内和日间精密度)、稳定性和回收率的研究。九个化合物的校准曲线是通过将储备溶液稀释到合适的浓度来生成的,使用50%甲醇-水混合溶液。检测限(LOD)和定量限(LOQ)是分别使用信噪比(S/N)比为3和10来确定的。日内精密度是通过计算单日内进行的6次注射的相对标准偏差(RSD%)来评估的。日间精密度是通过计算在连续3天内每天进行的6次注射的平均RSD%来评估的。稳定性是通过计算在0、2、4、8、12、24和48小时进行的6次注射的RSD%来评估的。该方法的准确性是使用3个样品水平(80%,100%,120%)进行验证的。回收率是使用下面的方程(1)来计算的。
回收率(%)=(C-A)/B×100% (1)
其中,A代表样品中被测试组分的量;B代表添加的纯物质的量;C代表实际测得的值。
在本实验中,使用上述方法在特定浓度范围内生成了九种咖啡酰奎宁酸的标定曲线,如表3所示。获得的结果显示了良好的线性关系,相关系数R
表3.九种咖啡酰奎宁酸的标定曲线、线性范围、检测限(LOD)、定量限(LOQ)、精度和重复性
表4.不同浓度下九种咖啡酰奎宁酸的回收率和相对标准偏差(RSD)(80%,100%和120%)
(6)定量分析
每批样品均以三重复制备,并使用校准曲线确定每批样品中的化合物含量,结果如表5和图2所示,揭示了使用不同溶剂从馥芳艾纳香中提取的九种CQA的含量存在显著差异(P<0.05)。CQA的浓度范围为0.46-7.60mg/g。九种咖啡酰奎宁酸的降序排列如下:1,5-diCQA>3,5-diCQA>3-CQA>3,4-diCQA>4,5-diCQA>1,3-diCQA>5-CQA>4-CQA>1,4-diCQA。此外,样品中的总酚酸含量范围在15.35至27.08mg/g之间。在检测的溶剂中,由氯化胆碱+1,4-丁二醇(DES-6)组成的提取溶剂表现出提取酚酸的最高效率。在DESs提取中存在的单体CQA相比传统提取溶剂显示出明显更高的含量(p<0.05)。值得注意的是,氯化胆碱+1,4-丁二醇(DES-6)显示出最高的3-CQA和4,5-diCQA浓度,分别为4.71±0.31和2.28±0.19mg/g。氯化胆碱+草酸(DES-7)具有最高的4-CQA含量,为2.05±0.05mg/g。氯化胆碱+甘油(DES-5)显示出最高的5-CQA,1,3-diCQA,1,4-diCQA和3,4-diCQA含量,分别为1.70±0.14,2.17±0.04,1.39±0.14和2.30±0.06mg/g。此外,氯化胆碱+乙酸(DES-2)显示出最高的1,5-CQA和3,5-diCQA含量,分别为7.60±0.38和5.70±0.23mg/g。
表5.来自不同溶剂提取的馥芳艾纳香的九种咖啡酰奎宁酸含量(mg/g,平均±标准差,n=3)
实施例2
按照实施例1的方法制备得到10种不同的溶剂(乙醇、甲醇、水和7种DESs)的提取物,并对不同溶剂提取物进行抗氧化活性评价。
1.DPPH自由基清除试验
1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除实验是一种简单、有效、经济和可靠的方法,用于确定物质的抗氧化活性。参考方法(Li,Z.,Li,Q.,2022.Ultrasonic-AssistedEfficient Extraction of Coumarins from Peucedanum decursivum(Miq.)Maxim UsingDeep Eutectic Solvents Combined with an Enzyme Pretreatment.Molecules.27(17),5715.),使用10种不同的溶剂(乙醇、甲醇、水和7种DESs),将对应溶剂得到的提取物分别稀释到不同的浓度(3.33、166.67、333.33、500、666.66、1000和1666.67μg/mL),取1mL不同浓度的提取物吸入5mL管中,然后加入1mL的DPPH溶液(2mM)。充分摇匀后,放置在黑暗中30分钟,然后在517nm处测量吸光度。清除率根据以下方程(2)计算。
DPPH清除活性(%)= (1-(A
其中,A
馥芳艾纳香使用不同溶剂提取得到的提取物的DPPH自由基清除活性如图3所示。从不同溶剂提取的提取物表现出一定的对DPPH自由基的清除能力。然而,它们都相对较低,低于抗坏血酸的清除能力。在0至500μg/mL的浓度范围内,清除率与浓度呈现出显著的变化,呈剂量依赖性关系。当浓度超过500μg/mL时,清除率的增加速度减慢。值得注意的是,当浓度超过1666.7μg/mL时,抗坏血酸达到了最大的清除率,为96.88%±0.002%。在使用不同溶剂提取的提取物中,DES1-6表现出了超过90%的清除率,而DES-7表现出了84.69%±0.005%的清除率。但与水、乙醇和甲醇等传统溶剂相比,仍然较高。
抗氧化活性的强度随着IC
2.ABTS自由基清除试验
2,2'-联氮-双(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)在溶液中呈绿色,并被去除自由基的抗氧化剂使其变淡。类似于ABTS通常用于体外试验,以表征物质的抗氧化能力。参考文献中的方法稍作修改(Jo,Y.,Cho,H.,Chun,J.,2021.Antioxidant activity ofβ-cyclodextrin inclusion complexes containing trans-cinnamaldehyde by DPPH,ABTSand FRAP.Food Sci.Biotechnol.30(6),807-814.)。ABTS溶液(7mM)和K
ABTS清除活性(%)= (1-(A
其中,A
如图4所示,馥芳艾纳香的各种不同溶剂提取物均表现出对ABTS自由基的清除能力。清除率在0~500μg/mL范围内随着浓度的升高呈现出初始较快然后较慢的增加。在浓度达到500μg/mL时,抗坏血酸达到了最大的清除率,为100%。在使用不同溶剂提取的萃取物中,水提取物和七种不同低共熔溶剂提取物的大多数都超过了95%的清除率。DES 3-6表现出超过99%的清除率。相反,乙醇和甲醇显示出较低的清除率,均低于60%。对于清除ABTS自由基,IC
表6.不同溶剂提取的馥芳艾纳香提取物的抗氧化活性,以DPPH,ABTS自由基清除活性的IC
a-g:不同小写字母表示不同提取溶剂的馥芳艾纳香提取物中9种咖啡酰奎宁酸的含量差异显著(P<0.05);
3.还原力测定
在这个实验中,通过测量产生的Fe
图5展示了馥芳艾纳香的不同溶剂提取物和抗坏血酸的还原力。特别地,抗坏血酸和甲醇提取物均展示出明显的剂量-响应关系,即线性的还原力。抗坏血酸在浓度达到500μg/mL时达到饱和,显示最大吸光度为1.412±0.003。而不同提取溶剂在浓度达到20mg/mL时达到饱和,其中DES-6展示出最强的还原力,最大吸光度为1.593±0.006。其余六种DES和水提取物的最大吸光度值在1.161到1.555之间。不同溶剂提取的馥芳艾纳香的还原力降序排列如下:DES-6>DES-3>DES-4>DES-5>DES-1>DES-2>水>DES-7>乙醇>甲醇。
实施例3
咖啡酸衍生物与抗氧化活性之间的相关性分析:
使用皮尔逊相关系数分析了酚酸含量与不同溶剂提取的馥芳艾纳香的提取物的抗氧化活性之间的关系。结果见表7。DESs提取物中的总酚酸含量与还原能力、DPPH自由基清除能力和ABTS自由基清除能力呈正相关(p<0.01)。这表明DESs提取物中总酚酸含量较高与较强的抗氧化活性对应,暗示总酚酸对体外抗氧化活性有显著贡献。此外,3-CQA与总酚酸含量、还原能力、DPPH自由基清除能力和ABTS自由基清除能力之间存在显著正相关关系(p<0.001)。这些结果表明3-CQA是馥芳艾纳香的DESs提取物中总酚酸的主要抗氧化成分之一。DESs提取物中3-CQA含量较高与较强的抗氧化活性对应。同样,5-CQA与总酚酸、还原能力、DPPH自由基清除能力和ABTS自由基清除能力呈正相关(p<0.05),突出了其在馥芳艾纳香中的重要性。4-CQA、1,3-diCQA、3,4-diCQA、4,5-diCQA和DPPH的自由基清除能力与ABTS自由基清除能力呈显著正相关关系(p<0.05)。此外,1,3-diCQA和4,5-diCQA的还原能力与ABTS自由基清除能力呈显著正相关关系(p<0.05)。这些发现表明4-CQA、1,3-diCQA、3,4-diCQA和4,5-diCQA具有一定的抗氧化活性。
表7.不同溶剂提取的馥芳艾纳香中酚酸与抗氧化活性之间的相关性分析
/>
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
