加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料及其制造方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料及其制造方法。
背景技术
近年来,由于健康意向的提高,对具有健康增进作用的饮食品的关注日益提高。其中,绿茶饮料、红茶饮料等茶饮料包含儿茶素、茶氨酸等健康成分,消费者的需求也在增加。另外,从不论场所、时间都能够饮用茶饮料的观点出发,多种容器装茶饮料已经上市。
已知容器装绿茶饮料在保存中会由于绿茶饮料中的成分被氧化而发生绿茶的颜色由浅绿色变为红褐色的现象,通常称为“褐变”。该褐变现象在茶饮料的制造、尤其是茶提取液的加热灭菌时以及流通/保管时也发生,不仅使商品价值降低,而且会产生不愉快的味道、臭味。另外,已知容器装红茶饮料在加热灭菌时等也会发生液体颜色劣化。因此,期望在绿茶饮料、红茶饮料等茶饮料中抑制液体颜色劣化的方法。
作为用于抑制绿茶饮料的制造过程中和制造后的褐变的方法,例如专利文献1公开了如下方法:在绿茶饮料的制造方法中,使用含有蔗糖酯的40~80℃的热水进行绿茶的提取且提取时或提取后加入抗坏血酸钠,并且在将绿茶提取液填充于容器后将容器中的残留空气用氮气进行置换,专利文献2公开了向绿茶饮料中添加海藻糖的方法,专利文献3公开了向绿茶饮料中添加L-抗坏血酸2-葡糖苷的方法。
此外,作为将乳酸菌用于饮食品的技术,专利文献4公开了下述方法:在培养作为繁殖对象的乳酸菌时添加乳酸菌的死菌体或包含乳酸菌的死菌体的培养物,由此促进作为繁殖对象的乳酸菌的增殖和提高制品中的乳酸菌的存活性,专利文献5公开了通过将乳酸菌等的死菌体配合于容器装咖啡饮料而提高咖啡的醇厚度(厚重感(飲みごたえ))的方法。
但是,使容器装茶饮料中含有乳酸菌时能够抑制茶饮料的加热灭菌时的液体颜色劣化这一点到目前为止尚属未知。
现有技术文献
专利文献
专利文献1:日本专利第1571801号公报
专利文献2:日本特开2001-112414公报
专利文献3:日本特开2007-60972公报
专利文献4:日本特开2008-5811号公报
专利文献5:日本特开2019-122316号公报
发明内容
发明所要解决的问题
本发明的课题在于,提供加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料及其制造方法等。
用于解决问题的方法
本发明人为了解决本发明的课题进行了深入研究,结果发现,通过在容器装茶饮料的制造中含有乳酸菌,可抑制加热灭菌时的茶饮料的液体颜色劣化,能够解决上述课题,从而完成了本发明。
即,本发明涉及:
(1)一种容器装茶饮料,其是茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料,其特征在于,含有乳酸菌;
(2)根据上述(1)所述的容器装茶饮料,其特征在于,乳酸菌的含量为100亿个/100mL以上;
(3)根据上述(1)或(2)所述的容器装茶饮料,其特征在于,乳酸菌为乳球菌属细菌;
(4)根据上述(1)~(3)中任一项所述的容器装茶饮料,其特征在于,乳酸菌为乳酸乳球菌乳酸亚种JCM5805;
(5)根据上述(1)~(4)中任一项所述的容器装茶饮料,其为容器装绿茶饮料或容器装红茶饮料;
(6)一种容器装茶饮料的制造方法,其特征在于,在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中,包括使其含有乳酸菌的工序;
(7)根据上述(6)所述的容器装茶饮料的制造方法,其中,在容器装茶饮料的制造中,在进行加热灭菌前的任意阶段实施使其含有乳酸菌的工序;
(8)一种抑制容器装茶饮料的加热灭菌时的液体颜色劣化的方法,其特征在于,在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中,包括使其含有乳酸菌的工序;以及
(9)根据上述(8)所述的抑制容器装茶饮料的加热灭菌时的液体颜色劣化的方法,其中,在容器装茶饮料的制造中,在进行加热灭菌前的任意阶段实施使其含有乳酸菌的工序。
发明效果
根据本发明,可以提供加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料及其制造方法等。
附图说明
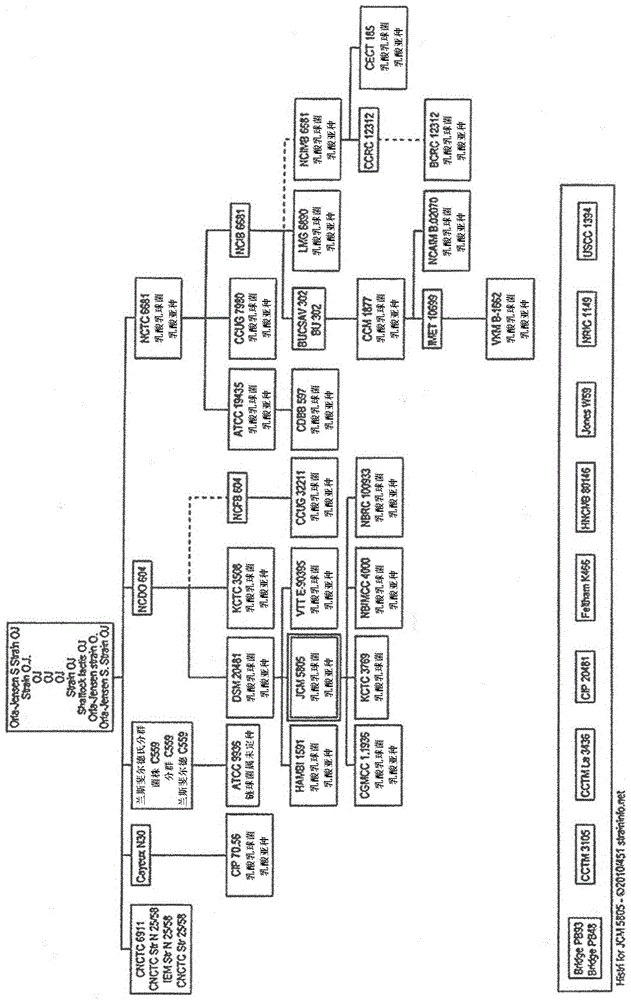
图1为示出乳酸乳球菌乳酸亚种JCM5805株与该株的同等株(源自该株的株和该株所源自的株)之间的关系的图。
具体实施方式
本发明包括下述等实施方式:
[1]一种容器装茶饮料,其是茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料,其特征在于,含有乳酸菌;
[2]一种容器装茶饮料的制造方法,其特征在于,在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中,包括使其含有乳酸菌的工序;和
[3]一种抑制容器装茶饮料的加热灭菌时的液体颜色劣化的方法,其特征在于,在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中,包括使其含有乳酸菌的工序。
(容器装茶饮料)
本发明中的容器装茶饮料是茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料,其特征在于,含有乳酸菌。
作为本发明中的“茶饮料”,没有特别限定,可列举例如未发酵茶(例如绿茶)饮料、发酵茶(例如红茶)饮料和半发酵茶(例如乌龙茶)饮料、以及这些中的一部分或全部的混合茶饮料,其中优选绿茶饮料、乌龙茶饮料、红茶饮料,从更多地享有本发明的效果的观点出发,尤其更优选列举绿茶饮料、红茶饮料。
(茶多酚浓度)
本发明中的容器装茶饮料的茶多酚浓度没有特别限定,从加热灭菌时的液体颜色劣化所致的变化更大、更多地享有本发明的液体颜色劣化抑制效果的观点以及容器装茶饮料的香味优良的观点出发,优选列举10~200mg/100mL,更优选列举40~100mg/100mL。容器装茶饮料的茶多酚浓度可以通过调节制造茶饮料时使用的茶叶的量、茶提取液的浓缩物或纯化物的使用量来调节。
本发明中的容器装茶饮料的茶多酚浓度可以使用作为评价茶类的多酚量时的基准的、日本食品分析中心编“第五次修订日本食品标准成分分析手册的解说”(日本食品分析中心编、中央法规、2001年7月、p.252)中记载的法定方法(酒石酸铁吸光度法)来测定。该测定方法中,对于使液体中的多酚与酒石酸铁试剂反应而生成的紫色成分测定吸光度(540nm),由此可以使用以没食子酸乙酯为标准物质而制作的校准曲线进行定量。可以将这样得到的定量值乘以1.5倍而得的值作为茶多酚量。
茶多酚浓度的测定除了上述酒石酸铁吸光度法以外,也可以使用福林-肖卡(Folin-Ciocalteu)法、福林-丹尼斯(Folin-Denis)法等,在酒石酸铁吸光度法适合的情况下,优选列举酒石酸铁吸光度法。
(pH)
作为本发明中的容器装茶饮料的pH,没有特别限定,可列举例如4.5~7.5,优选列举6~7.3。
茶饮料的pH可以使用pH计通过常规方法进行测定。
(乳酸菌)
本发明中的容器装茶饮料含有乳酸菌。
作为制造本发明的容器装茶饮料时使用的乳酸菌,只要是乳酸菌则没有特别限定,可以为乳酸菌的活菌体,也可以为乳酸菌的死菌体,优选为乳酸菌的死菌体。作为所述乳酸菌的死菌体,可以为干燥物,也可以为非干燥物,从保存稳定性等观点出发,优选列举乳酸菌的干燥物,更优选列举乳酸菌的干燥粉末。
作为干燥粉末化的方法,没有特别指定,可以进行冷冻干燥、热风干燥或喷雾干燥等处理而干燥粉末化,优选通过喷雾干燥而粉末化。
需要说明的是,在制造本发明中的容器装茶饮料时使用乳酸菌的活菌体的情况下,通过加热灭菌工序,基本上大部分乳酸菌也变成了死菌体。
“乳酸菌”是指分类学上认定为乳酸菌的全部菌的总称,不因属、种、株等而受限定。作为所述“乳酸菌”,可列举对糖进行乳酸发酵而生成大量乳酸(优选消耗的糖的50%以上的乳酸)的细菌,可列举乳杆菌(Lactobacillus)属细菌、链球菌(Streptococcus)属细菌、乳球菌(Lactococcus)属细菌、明串珠菌(Leuconostoc)属细菌、片球菌(Pediococcus)属细菌、肠球菌(Enterococcus)属细菌。
本发明中使用的乳酸菌的属、种没有特别限定,可列举选自由乳杆菌属细菌、链球菌属细菌、乳球菌属细菌、明串珠菌属细菌、片球菌属细菌、肠球菌属细菌组成的组中的1种或2种以上的细菌,优选列举选自由乳球菌属细菌组成的组中的1种或2种以上的细菌,更优选列举选自由乳酸乳球菌乳酸亚种(以下也简单地表示为“乳酸乳球菌”。)组成的组中的1种或2种以上的细菌。
作为本发明中的乳酸菌的更具体的优选方式,可列举选自由嗜酸乳杆菌(Lactobacillus acidophilus)、德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.bulgaricus)、德氏乳杆菌德氏亚种(Lactobacillus delbrueckiisubsp.delbrueckii)、德氏乳杆菌乳酸亚种(Lactobacillus delbrueckiisubsp.lactis)、干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillusparacasei)、格氏乳杆菌(Lactobacillus gasseri)、瑞士乳杆菌(Lactobacillus helveticus)、约氏乳杆菌(Lactobacillus johnsonii)、植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、干酪乳杆菌鼠李糖亚种(Lactobacillus caseisubsp.rhamnosus)、戊糖乳杆菌(Lactobacillus pentosus)、发酵乳杆菌(Lactobacillus fermentum)、唾液链球菌嗜热亚种(Streptococcussalivariussubsp.thermophilus)(以下也简单地表示为“嗜热链球菌”)、乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.lactis)(以下也简单地表示为“乳酸乳球菌”)、乳酸乳球菌乳酸亚种(双乙酰型)(Lactococcus lactis subsp.lactis biovar diacetylactis)、乳酸乳球菌乳脂亚种(Lactococcus lactis subsp.cremoris)、棉子糖乳球菌(Lactococcusraffinolactis)、鱼乳球菌(Lactococcus piscium)、植物乳球菌(Lactococcusplantarum)、格氏乳球菌(Lactococcus garvieae)、乳酸乳球菌霍氏亚种(Lactococcuslactis subsp.hordniae)、肠膜明串珠菌乳脂亚种(Leuconostocmesenteroides subsp.cremoris)、乳酸明串珠菌(Leuconostoc lactis)、有害片球菌(Pediococcus damnosus)、戊糖片球菌(Pediococcus pentosaceus)、乳酸片球菌(Pediococcus acidilactici)、粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium)组成的组中的1种或2种以上细菌,优选列举选自由嗜酸乳杆菌、德氏乳杆菌保加利亚亚种、德氏乳杆菌乳酸亚种、德氏乳杆菌德氏亚种、干酪乳杆菌、副干酪乳杆菌、格氏乳杆菌、瑞士乳杆菌、约氏乳杆菌、植物乳杆菌、短乳杆菌、干酪乳杆菌鼠李糖亚种、戊糖乳杆菌、发酵乳杆菌、唾液链球菌嗜热亚种、乳酸乳球菌乳酸亚种、乳酸乳球菌乳酸亚种(双乙酰型)、乳酸乳球菌乳脂亚种、棉子糖乳球菌、鱼乳球菌、植物乳球菌、格氏乳球菌、乳酸乳球菌霍氏亚种、肠膜明串珠菌乳脂亚种和乳酸明串珠菌组成的组中的1种或2种以上细菌,更优选列举选自由乳酸乳球菌、乳酸乳球菌乳酸亚种(双乙酰型)、乳酸乳球菌乳脂亚种、棉子糖乳球菌、鱼乳球菌、植物乳球菌、格氏乳球菌和乳酸乳球菌霍氏亚种组成的组中的1种或2种以上细菌,进一步优选列举乳酸乳球菌,更优选列举选自由乳酸乳球菌JCM5805、乳酸乳球菌JCM20101、乳酸乳球菌NBRC12007和乳酸乳球菌NRIC1150组成的组中的1种或2种以上细菌,尤其优选列举乳酸乳球菌JCM5805。作为所述乳酸乳球菌JCM5805株的优选方式,优选列举JCM5805株的死菌体,更优选列举JCM5805株的死菌体的干燥物,进一步优选列举JCM5805株的死菌体的干燥粉末,更优选列举JCM5805株的死菌体的通过喷雾干燥而得的干燥粉末。
作为本发明中的“JCM5805株”,只要可得到本发明的效果,则JCM5805株的同等菌株也包括在该菌株内。在此,同等菌株是指:源自JCM5805株的菌株(菌株A)、JCM5805株所源自的菌株(菌株B)、或上述菌株A或菌株B的后代菌株。也存在同等菌株保存在其它菌株保藏机构的情况。图1示出源自JCM5805株的菌株及JCM5805株所源自的菌株。即使是图1中记载的JCM5805株的同等菌株,只要可得到本发明的效果,则也可以作为本发明中的“JCM5805株”来使用。
另外,本发明中的“乳酸菌”可以为副干酪乳杆菌KW3110株(以下称为“KW3110株”),但是优选不为KW3110株。
本发明中使用的乳酸菌可以由美国典型培养物保藏中心(American typeculture collection,美国)等保藏机构等获得。另外,作为本发明中使用的乳酸菌,也可以使用市售的起子培养物。
本发明中使用的乳酸菌的制备方法没有特别限制,作为乳酸菌的活菌体的制备方法,可列举例如下述方法:从培养乳酸菌的培养基中,通过过滤、离心分离等收集菌体。另外,作为乳酸菌的死菌体的制备方法,可列举例如下述方法:对培养乳酸菌的培养基进行灭菌后,通过过滤、离心分离等收集菌体;从培养乳酸菌的培养基中,通过过滤、离心分离等收集菌体后,进行灭菌;等,可以根据需要进一步进行干燥处理、破碎处理。
需要说明的是,灭菌的手段没有特别限制,不仅可以使用加热,也可以使用紫外线、γ射线照射等使菌死亡的常规手段。
本发明中,作为容器装茶饮料中的乳酸菌的含量,只要可得到本发明的效果则没有特别限定,从更好地抑制加热灭菌时的液体颜色劣化等观点出发,作为每100mL容器装茶饮料的乳酸菌的菌体个数,可列举例如“60亿个/100mL”以上,优选列举“100亿个/100mL”以上、更优选列举“150亿个/100mL”以上、进一步优选列举“300亿个/100mL”以上、更优选列举“1500亿个/100mL”以上、进一步优选列举“4500亿个/100mL”以上。
另外,作为上限,可列举“1兆个/100mL”以下、优选列举“7500亿个/100mL”以下、进一步优选列举“5000亿个/100mL”以下。
这些上限值和下限值可以任意组合。
作为容器装茶饮料中的乳酸菌的优选含量,更具体而言,可列举例如60~5000亿个/100mL、更优选100~4800亿个/100mL、进一步优选160~4500亿个/100mL、更优选160~3000亿个/100mL、进一步优选160~1500亿个/100mL。
乳酸菌的菌体个数可以通过直接镜检法、粒子电感应区法、PCR法、流式细胞术法等来测量。
需要说明的是,可以通过上述测量法来测定每1g乳酸菌的菌体干燥物中的菌体个数,可以调整容器装茶饮料中的JCM5805株的配合量。
容器装茶饮料中的乳酸菌的菌体个数可以通过直接镜检法、流式细胞术法等来测量。为了更准确,可以使用还考虑了源自饮料中的其它原料的粒子的影响的方法。
(本发明中的容器装茶饮料的制造)
本发明中的容器装茶饮料可以通过在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中包括使其含有乳酸菌的工序的方法来制造。作为本发明的制造方法,除了使其含有乳酸菌以外,可以使用容器装茶饮料的常规制造方法。作为所述常规制造方法,可列举例如制备茶提取液并经过调配工序、填充工序、加热灭菌工序来制造容器装茶饮料的方法。本发明的饮料的制造中,可以添加常规茶饮料的配方设计中所用的饮料用添加剂,这些添加剂的添加时期没有特别限制。需要说明的是,作为上述容器装茶饮料的常规制造方法,更详细而言,可参考例如“修订新版软饮料”(株式会社光琳)。
作为本发明中的“使其含有乳酸菌的工序”,可优选列举为了使茶饮料含有乳酸菌而添加乳酸菌,例如除了向茶提取液本身中添加乳酸菌以外,还包括向用于制备茶提取液的水中添加乳酸菌等。
本发明中,关于使其含有乳酸菌(优选进行添加)的时期,只要可得到本发明的效果,则可以为容器装茶饮料的制造工序的任意阶段,优选为进行加热灭菌前的任意阶段。具体而言,例如可以使茶提取工序的茶提取液中含有乳酸菌,可以使茶提取工序的水中含有乳酸菌,可以使调配工序的茶提取液中含有乳酸菌,可以使向容器填充的填充工序的紧前或紧后的茶提取液中含有乳酸菌。
本发明中的“茶提取液”是指:通过将茶叶(包括抹茶等茶叶粉碎物)供于提取处理而得到的提取液。作为本发明中使用的茶提取液,可列举来自茶叶的提取液(茶叶提取液)本身、其加工品类(例如浓缩液体提取物、粉末提取物)的稀释液等,只要是以往用于制造茶饮料的茶提取原料(优选绿茶提取原料、红茶提取原料和/或乌龙茶提取原料)则没有特别限定,可以适当选择。本说明书中,作为“茶提取液”,可列举未发酵茶提取液(例如绿茶提取液)、发酵茶提取液(例如红茶提取液)、半发酵茶提取液(例如乌龙茶提取液),其中优选列举绿茶提取液、红茶提取液、乌龙茶提取液,其中更优选列举绿茶提取液、红茶提取液。需要说明的是,本发明中,提取处理只要使茶成分溶出到提取溶剂中即可,也包括例如使抹茶等茶叶粉碎物溶解的处理等方式。
作为用于制备茶提取液的茶叶,可以使用属于作为山茶科的常绿树的茶树(Camellia sinensis var.)的茶叶。本发明的茶饮料的制造中使用的茶叶只要发挥本发明的效果则没有特别限定,不限于煎茶、玉露茶、抹茶、炒茶、深蒸茶、番茶、焙茶等绿茶所代表的未发酵茶的茶叶,也可以使用乌龙茶之类半发酵茶的茶叶、红茶之类发酵茶的茶叶等。作为本发明中使用的茶叶,优选列举绿茶叶、红茶叶。另外,在本发明中,也可以使用两种以上的原料和茶叶。
作为茶叶的提取处理的方法,没有特别限定,可以使用食品加工领域中通常使用的各种提取方法,包括例如溶剂提取、气流提取、压榨提取等,根据需要可以进一步实施沉淀或过滤等固液分离、浓缩、离心分离、干燥(例如喷雾干燥、冷冻干燥)或粉末化等处理。
在此,作为溶剂提取中使用的提取溶剂,优选为水(例如硬水、软水、离子交换水和天然水)。提取溶剂的量可以由本领域技术人员适当选择,没有特别限定。例如,在提取溶剂为水时,其量为茶叶的1~100倍量(质量)。
提取温度、提取时间可以由本领域技术人员适当选择,没有特别限定。例如,在提取溶剂为水时,其温度及时间可列举10~120℃下1分钟~12小时。
作为提取处理的一例,可列举将茶叶在水中在0~90℃下浸渍和搅拌1分钟~24小时、然后将茶叶过滤或离心分离的方法。在此,提取时的温度、时间等条件没有特别限定,可以根据茶叶的种类、量由本领域技术人员任意地选择和设定。
茶提取液的制备中,也可以使用茶提取物、茶粉末等茶提取液的浓缩物、纯化物,可以使用例如POLYPHENON(三井农林公司制)、SUNPHENON(太阳化学公司制)、THEA-FLAN(伊藤园公司制)等市售品。另外,这些茶浓缩物(优选绿茶浓缩物、红茶浓缩物和/或乌龙茶浓缩物等)、茶纯化物(优选绿茶纯化物、红茶纯化物和/或乌龙茶纯化物等)可以直接或用水溶解或稀释后单独使用,也可以将两种以上的种类混合使用,还可以与茶提取液混合使用。
需要说明的是,制备茶提取液时,可以配合茶叶以外的任意原料。另外,本发明中使用的茶叶、茶提取液只要可以得到本发明的效果则也可以为用乳酸菌发酵后的茶叶、茶提取液,优选为未用乳酸菌发酵的茶叶(优选绿茶叶、红茶叶和/或乌龙茶叶)、茶提取液(优选绿茶提取液、红茶提取液和/或乌龙茶提取液)。
(加热灭菌)
本发明中的容器装茶饮料为经加热灭菌后的容器装茶饮料。加热灭菌工序可以是在向容器填充前,也可以是在填充后。
作为加热灭菌方法,可以使用食品领域中通常使用的各种加热灭菌方法,可列举例如使用热水喷雾式、热水储水式或蒸气式的蒸煮灭菌装置、管式或板式的液体连续灭菌装置的方法。
作为本发明中的加热灭菌的条件,没有特别限制,可以使用用于容器装茶饮料的加热灭菌的常规条件。作为所述条件,可列举例如F
(任选成分)
本发明的容器装茶饮料中,可以添加通常制造饮料时使用的饮料用添加剂,例如酸味剂、香料、色素、果汁、甜味剂(包括高甜度甜味剂)、乳原料、茶叶粉碎物(抹茶、茶粉等)、食品添加剂(例如抗氧化剂、保存剂、增稠稳定剂、乳化剂、膳食纤维、pH调节剂、苦味剂)等。
本发明中的茶饮料可以不含抗坏血酸和/或抗坏血酸类,但是优选含有。作为本发明中的“抗坏血酸”、“抗坏血酸类”,只要允许配合于饮料则没有特别限定。本发明中的“抗坏血酸”不仅包括L-抗坏血酸,还包括其异构体(异抗坏血酸等)。
本发明中的“抗坏血酸类”包括抗坏血酸的盐、抗坏血酸的衍生物、抗坏血酸的衍生物的盐,其中优选包括抗坏血酸的盐。作为抗坏血酸的衍生物,可列举抗坏血酸脂肪酸酯(例如抗坏血酸硬脂酸酯、抗坏血酸棕榈酸酯等)、抗坏血酸磷酸酯、抗坏血酸硫酸酯、抗坏血酸糖苷等。
作为抗坏血酸或其衍生物的盐,可列举:钠、钾等碱金属盐;钙、镁、钡等碱土金属盐;精氨酸、赖氨酸等碱性氨基酸盐;铵盐、三环己基铵盐等铵盐;单异丙醇胺盐、二异丙醇胺盐、三异丙醇胺盐等烷醇胺盐等,其中优选列举碱金属盐、碱土金属盐。
作为抗坏血酸的盐,具体而言,优选列举抗坏血酸钠、抗坏血酸钙、异抗坏血酸钠。另外,作为抗坏血酸的衍生物或其盐,更具体而言,可列举抗坏血酸2,6-二棕榈酸酯、抗坏血酸6-硬脂酸酯、抗坏血酸-2磷酸钠、抗坏血酸-2硫酸二钠、抗坏血酸2-葡糖苷、抗坏血酸葡糖胺、L-脱氢抗坏血酸、抗坏血酸6-棕榈酸酯、L-抗坏血酸四异棕榈酸酯、抗坏血酸四2-己基癸酸酯、L-抗坏血酸磷酸酯镁等。
作为本发明中使用的“抗坏血酸”、“抗坏血酸类”,可以单独使用1种,也可以组合使用2种以上。另外,作为“抗坏血酸”、“抗坏血酸类”,可以使用市售品。
作为本发明中的抗坏血酸和/或抗坏血酸类的使用量(饮料中的含量或向饮料中的添加量),只要可得到本发明的效果则没有特别限定,以将容器装茶饮料中的“抗坏血酸”和“抗坏血酸类”的合计换算成抗坏血酸酐的浓度计,可列举0.01~0.5重量%、优选列举0.01~0.2重量%、更优选列举0.02~0.1重量%、进一步优选列举0.03~0.08重量%。
茶饮料中的抗坏血酸浓度例如可以使用HPLC进行分析。
(容器)
本发明中的茶饮料为容器装茶饮料。所述容器是指能够阻断内容物与外部气体的接触的密闭容器,可列举例如金属罐、桶容器、塑料制瓶(例如PET瓶、杯)、纸容器、瓶、小袋容器等。
(加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料)
本发明的容器装茶饮料为加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料。本说明书中,“加热灭菌时的液体颜色劣化得到了抑制”是指:与除了不含乳酸菌以外使用同种原材料通过相同制造方法(包括加热灭菌条件)制造的容器装茶饮料(以下也表示为“本发明中的对照饮料”)的加热灭菌时的液体颜色劣化相比,加热灭菌时的液体颜色劣化得到了抑制的容器装茶饮料。
本发明中,“液体颜色劣化”用该样品的与非加热样品的色差ΔE*ab来表示。色差ΔE*ab是指:由L*a*b*色空间中的坐标L*、a*、b*的差、即ΔL*、Δa*、Δb*定义的两个试样(色刺激)之间的色差。色差ΔE*ab利用以下的数学式来定义。
ΔE*ab=[(ΔL*)
某个容器装茶饮料中的、加热灭菌时的液体颜色劣化(ΔE*ab)可以使用市售的分光测色计来测量。
(抑制容器装茶饮料的加热灭菌时的液体颜色劣化的方法)
作为本发明中的抑制加热灭菌时的液体颜色劣化的方法,只要是在茶多酚浓度为10~200mg/100mL且pH为4.5~7.5的、经加热灭菌后的容器装茶饮料的制造中包括使其含有乳酸菌的工序的方法,则没有特别限制。
实施例
[试验1]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价1
为了调查由对茶提取液进行加热灭菌处理而导致的液体颜色劣化是否通过含有乳酸菌而得到抑制,进行了以下试验。
以表1记载的配合量将绿茶叶(秋冬番茶)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表1记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠),混合,制备试验例4~6的各样品饮料。
需要说明的是,在本申请实施例的任一试验(试验1~6)中,饮料中的JCM5805株的菌体浓度(亿个/100mL)都如下测定:用PBS缓冲液(TAKARA公司制)适当稀释,使用BD CellViability Kit withBD Liquid Counting Beads(贝克顿-迪金森公司制)按照规程用噻唑橙进行染色而制备样品,利用流式细胞仪进行测定。需要说明的是,关于菌体浓度(亿个/100mL),在表中记载了2位有效数字的概数。
此外,在试验例1~3中,也以表1记载的配合制备样品饮料。
对于试验例2、3、5和6的样品饮料,在表1记载的加热处理条件下进行加热灭菌处理。
另外,以表1记载的配合量将红茶叶放入到85℃的热水中,提取6分钟,进行固液分离,制作红茶提取液。向该红茶提取液中加入JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例32和33的样品饮料。另外,作为未添加JCM5805株的干燥死菌体粉末的样品饮料,以表1记载的配合制备试验例30和31。需要说明的是,本申请的实施例中使用的红茶叶均为斯里兰卡产。
对于试验例31和33的样品饮料,在表1记载的加热处理条件下进行加热灭菌处理。
对于使用绿茶叶的试验例1~6的样品饮料和使用红茶叶的试验例30~33的样品饮料的茶多酚浓度,通过日本食品分析中心编“第五次修订日本食品标准成分分析手册的解说”(日本食品分析中心编、中央法规、2001年7月、p.252)中记载的法定方法(酒石酸铁吸光度法)进行测定。将其结果示于表1。
另外,利用分光测色计(美能达制CM-5),使用特殊培养皿、白色小盖子、20mm黑色分隔圈通过反射测定来测定以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab,将结果示于表1。需要说明的是,本申请实施例的任一试验(试验1~6)中均通过该方法进行色差ΔE*ab的测定。
[表1]
由表1的结果可知,在使用绿茶叶、红茶叶中的任意一种的情况下,含有JCM5805株的情况与不含JCM5805株的情况相比,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)均得到了抑制。具体而言,对使用绿茶叶的情况进行说明,试验例5相对于对照(试验例4)的色差3.29小于试验例2相对于对照(试验例1)的色差4.61,另外,试验例6相对于对照(试验例4)的色差5.03也小于试验例3相对于对照(试验例1)的色差6.26。另外,对使用红茶叶的情况进行说明,试验例33相对于对照(试验例32)的色差9.65也小于试验例31相对于对照(试验例30)的色差19.4。
这些结果表明,在使用绿茶提取液、红茶提取液中的任意一种的情况下,由对茶提取液进行加热灭菌处理而导致的液体颜色劣化均通过使其含有乳酸菌而被抑制。
[试验2]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价2
为了调查茶饮料中的茶多酚浓度对于通过含有乳酸菌而带来的液体颜色劣化的抑制会带来何种影响,进行了以下试验。
以表2~4记载的配合量将绿茶叶(秋冬番茶)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表2~4记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠),混合,制备试验例9~10、13~14、17~18的各样品饮料。
此外,作为不含JCM5805株的干燥死菌体粉末的样品饮料,试验例7~8、11~12、15~16也以表2~4记载的配合制备样品饮料。
对于试验例8、10、12、14、16和18的样品饮料,在表2~4记载的加热处理条件下进行加热灭菌处理。
对于使用绿茶叶的试验例的样品饮料的茶多酚浓度,通过上述酒石酸铁吸光度法进行测定,将结果示于表2~4。
另外,利用分光测色计(美能达制)对以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab进行测定,将结果示于表2~4。
[表2]
[表3]
[表4]
由表2~4的结果可知,在任一茶多酚浓度下,含有JCM5805株的情况与不含JCM5805株的情况相比,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)均得到了抑制。
[试验3]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价3
为了调查乳酸菌的配合量对通过含有乳酸菌而带来的液体颜色劣化的抑制会带来何种影响,进行了以下试验。
以表5记载的配合量将绿茶叶(秋冬番茶)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表5记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例19~23、34的各样品饮料。
对于试验例19~23、34的样品饮料,在表5记载的加热处理条件下进行加热灭菌处理。
对于使用绿茶叶的试验例的样品饮料的茶多酚浓度,通过上述酒石酸铁吸光度法进行测定,将结果示于表5。
另外,利用分光测色计(美能达制)对以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab进行测定,将结果示于表5。
[表5]
表5的试验例19~23、34中的、与非加热样品的色差ΔE*ab的数值均小于不含JCM5805株时的、与非加热样品的色差ΔE*ab6.26(表1的试验例3),因此表明,在试验例19~23、34中液体颜色劣化均得到了抑制。另外,由表5的结果可知,随着JCM5805株的含有量变多,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)被抑制得更多。
[试验4]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价4
为了调查在使用与试验1~3中使用的绿茶叶(秋冬番茶)不同种类的绿茶叶时是否也能够通过含有乳酸菌而抑制加热灭菌时的液体颜色劣化,进行了以下试验。
以表6记载的配合量将绿茶叶(二番茶)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表6记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例25的样品饮料。
另外,作为不含JCM5805株的干燥死菌体粉末的样品饮料,以表6记载的配合制备试验例24的样品饮料。
对于试验例24和25的样品饮料,在表6记载的加热处理条件下进行加热灭菌处理。
对于使用绿茶叶的试验例的样品饮料的茶多酚浓度,通过上述酒石酸铁吸光度法进行测定,将结果示于表6。
另外,利用分光测色计(美能达制)对以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab进行测定,将结果示于表6。
[表6]
由表6的结果可知,在使用二番茶作为茶叶时,含有JCM5805株的情况与不含JCM5805株的情况相比,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)也得到了抑制。
[试验5]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价5
在试验1~4中使用了间歇式蒸煮灭菌装置,但为了调查在使用连续式UHT灭菌装置时是否也能够通过含有乳酸菌而抑制加热灭菌时的液体颜色劣化、以及在组合使用绿茶叶和茶粉时是否也能够通过含有乳酸菌而抑制加热灭菌时的液体颜色劣化等,进行了以下试验。
以表7记载的配合量将绿茶叶(秋冬番茶;与试验1~3中使用的秋冬番茶相同的制品)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表7记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例27的样品饮料。
另外,作为不含JCM5805株的干燥死菌体粉末的样品饮料,以表7记载的配合制备试验例26的样品饮料。
以表7记载的配合量将绿茶叶(秋冬番茶B;与试验1~3中使用的秋冬番茶不同的制品)放入到75℃的热水中,提取6分钟,进行固液分离,制作绿茶提取液。向该绿茶提取液中以表7记载的配合量添加茶粉、JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例29的样品饮料。
另外,作为不含JCM5805株的干燥死菌体粉末的样品饮料,以表7记载的配合制备试验例28的样品饮料。
对于试验例26~29的样品饮料,在表7记载的加热处理条件下用UHT灭菌装置进行加热灭菌处理。
对于各试验例的样品饮料的茶多酚浓度,通过上述酒石酸铁吸光度法进行测定,将结果示于表7。
另外,利用分光测色计(美能达制)对以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab进行测定,将结果示于表7。
[表7]
由表7的结果可知,使用连续式UHT灭菌装置时、组合使用绿茶叶和茶粉时、将pH调节为7时等,含有JCM5805株的情况与不含JCM5805株的情况相比,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)也得到了抑制。
[试验6]通过含有乳酸菌而带来的、液体颜色劣化的抑制评价6
为了调查在红茶饮料的情况下乳酸菌的配合量对通过含有乳酸菌而带来的液体颜色劣化的抑制会带来何种影响,进行了以下试验。
以表8记载的配合量将红茶叶放入到85℃的热水中,提取6分钟,进行固液分离,制作红茶提取液。向该红茶提取液中以表8记载的配合量添加JCM5805株的干燥死菌体粉末、L-抗坏血酸和小苏打(碳酸氢钠)并混合,制备试验例35~37的各样品饮料。
对于试验例35~37的样品饮料,在表8记载的加热处理条件下进行加热灭菌处理。
对于使用红茶叶的试验例35~37的样品饮料的茶多酚浓度,通过上述酒石酸铁吸光度法进行测定,将结果示于表8。
另外,利用分光测色计(美能达制)对以非加热的样品(对照)为基准的、加热灭菌处理后的色差ΔE*ab进行测定,将结果示于表8。
[表8]
表8的试验例35~37中的、与非加热样品的色差ΔE*ab的数值均小于不含JCM5805株时的、与非加热样品的色差ΔE*ab19.4(表1的试验例31),因此表明,在试验例35~37中液体颜色劣化均得到了抑制。另外,由表8的结果可知,随着红茶饮料中JCM5805株的含有量变多,与非加热的样品饮料的色差ΔE*ab(液体颜色劣化)也被抑制得更多。
- 一种往复杆输送系统
- 一种重载往复式垂直输送机
- 一种磁共振介入手术用水平往复输送系统
- 用于介入手术的操作手柄及具有该操作手柄的介入器械输送系统
