用于检测和治疗前列腺癌的方法
文献发布时间:2024-04-18 20:01:23
相关申请的交叉引用
本申请要求2020年7月8日提交的美国临时专利申请号63/049,521和2020年8月19日提交的美国临时专利申请号63/067,601的权益,将这些申请的披露内容通过引用以其全文并入本文。
本专利或申请文件包含至少一个彩色附图。应请求并且支付必要的费用后,具有一个或多个彩色附图的本专利或专利申请公开的副本将由专利局提供。
关于联邦政府资助研究的声明
本发明是在国立卫生研究院授予的基金号CA223527下由政府支持完成的。政府对本发明拥有一定的权利。
背景技术
血清Cav-1水平升高与高风险前列腺癌、去势抵抗和前列腺切除术后生化复发相关。以前已经证明,在最初表现为临床局限性疾病的前列腺癌个体中,血浆Cav-1升高与早期疾病重新分类相关。Cav-1是如下小窝的同名蛋白质组分:富含鞘糖脂和胆固醇的球茎形50-100nm质膜内陷。Cav-1还在组织膜微域组成和调节跨膜信号转导中起作用。越来越多的证据指示,Cav-1作为一种必需的脂质伴侣,促进细胞脂质运输和体内平衡、胞吞和胞吐作用、以及细胞膜的机械保护作用。已知Cav-1转运包括胰岛素、趋化因子、白蛋白以及低密度和高密度脂蛋白(LDL和HDL)在内的分子。最近,发现白色脂肪组织中含有Cav-1的胞外囊泡响应于系统代谢状态而导流内皮细胞和脂肪细胞之间的蛋白质和脂质细胞内交换。
在癌症中,Cav-1的作用是动态的和依赖于环境的。Cav-1已被证明调节和促进受体酪氨酸激酶、G蛋白偶联受体、整合素和钙粘蛋白的活性。Cav-1的表达与各种肿瘤类型中的侵袭性表型密切相关,并已经将其与上皮-间充质可塑性、肿瘤侵袭和转移潜力以及放射和多药耐药性联系起来。
尽管Cav-1与前列腺癌中的代谢改变相关,但Cav-1影响代谢重组的机制先前还没有得到确定。在前列腺肿瘤代谢的背景下对Cav-1功能的探询揭示了前列腺肿瘤中增强的脂质清除和活跃的差异神经酰胺代谢的综合代谢程序,这些肿瘤在最初纳入主动监测后表现出Gleason分级进展。重要的是,这种代谢表型产生疾病进展的生物标志物,并鉴定治疗易感性点。这种肿瘤支持性代谢程序的关键特征包括Cav-1介导的脂质摄取、胞外鞘磷脂(SM)的肿瘤分解代谢增加、神经酰胺代谢改变偶联鞘糖脂合成增加和循环Cav-1-鞘脂颗粒流出,这些颗粒包含指示着与线粒体重塑的交会的货物。基于这些机制性发现,已经测试了在侵袭性前列腺癌小鼠模型中靶向Cav-1介导的脂质清除和代谢的潜在可操作的代谢脆弱性。
来自前列腺癌主动监测(AS)参与者纵向前瞻性队列的基线血浆代谢组学图谱分析鉴定血浆鞘脂的改变是AS进展受试者的显著特征。这些代谢物特征可以组合起来产生预测早期前列腺癌疾病进展的特征标记。先前的工作表明,基线血浆小窝蛋白-1(Cav-1)是类似AS队列中疾病分类的独立预测因子。本研究基于组织定位和分泌的Cav-1在侵袭性和潜在耐药前列腺癌中的公认作用。血浆Cav-1可另外与血浆鞘脂特征整合成一个组合的预测特征标记。已经进行了机制研究,以阐明肿瘤支持性肿瘤代谢(其是观察到的血浆特征标记特征的潜在原因)中涉及的主要生物学过程。使用前列腺癌的同基因RM-9小鼠模型和已建立的人前列腺癌细胞系,已经获得证据表明Cav-1促进朝向外源性脂质清除和囊泡生物发生(与鞘脂代谢交叉)程序的癌细胞脂质代谢重组;这个程序的激活在血浆特征标记中得到证明;并且该程序呈现出可作为抗肿瘤疗法的靶标的代谢脆弱性。
发明内容
提供了用于评价前列腺癌状态的方法和试剂盒。这些方法和试剂盒使用对从受试者获得的生物样品内包含的生物标志物的多重测定法。对以下生物标志物中的一种或多种的分析为前列腺癌的进展提供了高准确性的风险评估和预后:CAV-1、SM(40:2)、SM(44:2)、乳糖神经酰胺(32:0)(“LacCer 32:0”)、乳糖神经酰胺(36:0)(“LacCer 36:0”)、三己糖神经酰胺(34:1)(“TriHexCer”)和己糖神经酰胺(40:0)(“HexCer 40:0”)。
基于在来自受试者的生物样品中发现的生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中一种或多种的水平,鉴定了可预测受试者中的前列腺癌进展风险的回归模型。
因此,本文提供了确定和/或量化受试者的胰腺癌进展风险的方法,这些方法包括测量来自受试者的样品中的生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer36:0、TriHexCer 34:1和HexCer 40:0中一种或多种的水平。
还提供了治疗或预防受试者中的前列腺癌进展的方法,其中生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中的一种或多种的水平将受试者分类为处于前列腺癌进展的风险中。
还提供了用于以下的对应试剂盒:确定来自受试者的样品中前列腺癌进展的指标的存在、确定前列腺癌受试者中的进展风险、以及确定和/或量化受试者中的前列腺癌进展风险,这些试剂盒包括用于测量样品中的生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中一种或多种的材料。
在一些实施例中,测量从受试者抽取的血液样品中的生物标志物。在一些实施例中,可以确定生物样品中生物标志物的存在或不存在,或者可替代地生物标志物的量。在一些实施例中,可以量化生物样品中生物标志物的水平。
在一些实施例中,提供用以分析生物样品的表面。在一些实施例中,目的生物标志物非特异性地吸附到该表面上。在一些实施例中,对目的生物标志物具有特异性的受体被合并到该表面上。在一些实施例中,该表面与颗粒(例如珠粒)缔合。
在一些实施例中,生物标志物与特定的受体分子结合,并且可以确定生物标志物-受体复合物的存在或不存在,或者可替代地生物标志物-受体复合物的量。在一些实施例中,可以量化生物标志物-受体复合物的量。在一些实施例中,将受体分子与酶连接,以促进检测和量化。
在一些实施例中,生物标志物与特定的中继分子结合,并且生物标志物-中继分子复合物又与受体分子结合。在一些实施例中,可以确定生物标志物-中继-受体复合物的存在或不存在,或者可替代地生物标志物-中继-受体复合物的量。在一些实施例中,可以量化生物标志物-中继-受体复合物的量。在一些实施例中,将受体分子与酶连接,以促进检测和量化。
在一些实施例中,顺序分析生物样品中的各种生物标志物。在一些实施例中,生物样品被分成多个单独的部分,以允许同时分析多种生物标志物。在一些实施例中,在单个过程中分析生物样品的多种生物标志物。
在一些实施例中,生物标志物的存在或不存在可以通过目视检查来确定。在一些实施例中,生物标志物的量可以通过使用光谱技术来确定。在一些实施例中,光谱技术是质谱。在一些实施例中,光谱技术是UV/Vis光谱。在一些实施例中,光谱技术是激发/发射技术,如荧光光谱。在一些实施例中,光谱技术是质谱。在一些实施例中,光谱技术与色谱技术相组合。在一些实施例中,色谱技术是液相色谱。在一些实施例中,色谱技术是高效液相色谱(“HPLC”)。在一些实施例中,色谱技术是气相色谱(“GC”)。
在一些实施例中,对生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer36:0、TriHexCer 34:1和HexCer 40:0的分析可以与对额外的生物标志物的分析相组合。在一些实施例中,额外的生物标志物可以是蛋白质生物标志物。在一些实施例中,额外的生物标志物可以是非蛋白质的生物标志物。
在一些实施例中,提供了用于分析生物样品的试剂盒。在一些实施例中,试剂盒可以包含执行分析所需的化学品和试剂。在一些实施例中,试剂盒包含用于操纵生物样品的装置,以便最小化所需的操作者干预。在一些实施例中,试剂盒可以数字记录分析的结果。在一些实施例中,试剂盒可以对由分析产生的数据执行任何需要的数学处理。
在另一方面,本披露提供了一种利用生物标志物组套和蛋白质标志物组套确定受试者中前列腺癌进展风险的方法,其中该生物标志物组套包括生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中的一种或多种;其中该方法包括对从该受试者获得的生物样品执行以下步骤;测量该生物样品中的这些生物标志物和这些蛋白质生物标志物的水平;其中这些生物标志物和这些蛋白质生物标志物的量确定该受试者中的前列腺癌进展风险。
在另一方面,本披露提供了用于如本文所述的方法的试剂盒,该试剂盒包括包含用于检测CAV-1的第一溶质的第一试剂溶液、包含用于检测SM(40:2)的第二溶质的第二试剂溶液、包含用于检测SM(44:2)的第三溶质的第三试剂溶液、包含用于检测LacCer 32:0的第四溶质的第四试剂溶液、包含用于检测LacCer 36:0的第五溶质的第五试剂溶液、包含用于检测TriHexCer 34:1的第六溶质的第六试剂溶液、以及包含用于检测HexCer 40:0的第七溶质的第七试剂溶液。
在一个实施例中,这种试剂盒包括用于使试剂溶液与生物样品接触的设备。在另一个实施例中,这种试剂盒包括具有用于结合至少一种生物标志物的装置的至少一个表面。在另一个实施例中,该至少一种生物标志物选自由CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组。
在另一方面,本披露提供了一种治疗怀疑有前列腺癌进展风险的受试者的方法,该方法包括:用本文所述的方法分析受试者中的前列腺癌进展风险,并施用治疗有效量的前列腺癌治疗。在一个实施例中,该治疗是手术、化学疗法、放射疗法、靶向疗法或其组合。在另一个实施例中,这种方法包括至少一种受体分子,其选择性地结合选自由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组的生物标志物中的一种或多种。在另一个实施例中,检测CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量包括使用固体颗粒。在另一个实施例中,该固体颗粒是珠粒。在另一个实施例中,至少一种报道分子与酶连接。在另一个实施例中,至少一种蛋白质或代谢物标志物产生可检测信号。在另一个实施例中,该可检测信号可通过光谱法检测。在另一个实施例中,该光谱法是质谱。在另一个实施例中,这种方法包括将患者历史信息纳入到处于前列腺癌进展的风险或不处于癌症进展的风险的分配中。在另一个实施例中,这种方法包括对被分配为处于前列腺癌进展的风险中的患者施用至少一种替代诊断测试。
在另一方面,本披露提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中生物标志物CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中一种或多种的水平鉴定受试者中的前列腺癌进展风险,该方法包括以下中的一项或多项:向患有前列腺癌的受试者施用化学治疗药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。在一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与不处于前列腺癌进展的风险中的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和Hexcer 40:0的水平相比升高。在另一个实施例中,参考受试者或组是健康的。在另一个实施例中,参考受试者或组患有无痛性前列腺癌。在另一个实施例中,相对于健康受试者,受试者中TriHexCer 34:1和SM 40:2的水平升高。在另一个实施例中,TriHexCer 34:1和SM40:2的水平与未患侵袭性前列腺癌的参考受试者或组中的水平相比升高。在另一个实施例中,TriHexCer 34:1和SM 40:2的水平与患有无痛性前列腺癌的参考受试者或组中的水平相比升高。
在另一方面,本披露提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平将受试者鉴定为具有前列腺癌进展的风险或处于前列腺癌进展的风险中,该方法包括以下中的一项或多项:向患有前列腺癌的受试者施用化学治疗药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。在一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与不处于前列腺癌进展的风险中的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,参考受试者或组是健康的。在另一个实施例中,参考受试者或组患有无痛性前列腺癌。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与患有腺癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与患有鳞状细胞癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,受试者处于前列腺癌进展的高风险中。
在另一方面,本披露提供了一种治疗怀疑有前列腺癌进展风险的受试者的方法,该方法包括用本文所披露的方法分析受试者中的前列腺癌进展风险;施用治疗有效量的前列腺癌治疗。在一个实施例中,该治疗是手术、化学疗法、放射疗法、靶向疗法或其组合。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括:(a)使用体外测定法测量来自所述受试者的生物样品中的生物标志物小窝蛋白-1(CAV-1)、鞘磷脂40:2(SM 40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)、三己糖神经酰胺34:1(TriHexCer 34:1)和己糖神经酰胺40:0(HexCer 40:0)中一种或多种的水平,以及(b)将所述样品中的生物标志物CAV-1、SM 40:2、SM 44:2、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0中一种或多种的水平与参考进行比较,其中生物标志物CAV-1、SM 40:2、SM 44:2、LacCer 32:0、LacCer 36:0、TriHexCer34:1和HexCer 40:0中一种或多种相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括:(a)使用体外测定法测量来自所述受试者的生物样品中的鞘磷脂40:2(SM 40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1(TriHexCer 34:1)的水平,以及(b)将所述样品中的SM 40:2、SM 44:2、LacCer 32:0、LacCer 36:0和TriHexCer 34:1的水平与参考进行比较,其中SM 40:2、SM 44:2、LacCer32:0、LacCer 36:0和TriHexCer 34:1相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括:(a)使用体外测定法测量来自所述受试者的生物样品中的鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1(TriHexCer 34:1)的水平,以及(b)将所述样品中的SM 40:2、LacCer 36:0和TriHexCer 34:1的水平与参考进行比较,其中SM 40:2、LacCer36:0和TriHexCer 34:1相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括(a)使用体外测定法测量来自所述受试者的生物样品中的三己糖神经酰胺34:1(TriHexCer 34:1)的水平,以及(b)将所述样品中的TriHexCer 34:1的水平与参考进行比较,其中TriHexCer 34:1相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括(a)使用体外测定法测量来自所述受试者的生物样品中鞘磷脂40:2(SM 40:2)的水平,以及(b)将所述样品中的SM 40:2的水平与参考进行比较,其中SM 40:2相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种将患有前列腺癌的受试者分类为处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中、在受试者中预测对侵袭性前列腺癌的易感性、在患有前列腺癌的受试者中诊断侵袭性前列腺癌、确定受试者患有侵袭性前列腺癌的风险、在患有前列腺癌的受试者中预测前列腺癌的进展可能性、为患有前列腺癌的受试者提供预后、或选择患有前列腺癌的受试者用抗癌疗法治疗的方法,该方法包括(a)使用体外测定法测量来自所述受试者的生物样品中以下的水平:鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1;和/或三己糖神经酰胺34:1;和/或鞘磷脂40:2(SM 40:2),以及(b)将所述样品中的SM 40:2的水平与参考进行比较,其中SM 40:2相对于所述参考的改变量提供选自由以下组成的组的指示:该受试者处于发展为侵袭性前列腺癌的风险中或不处于发展为侵袭性前列腺癌的风险中的指示,该受试者对侵袭性前列腺癌的易感性的指示,该受试者中该前列腺癌的进展可能性的指示,该受试者的无进展生存期的指示,对该前列腺癌的治疗的可能结果的指示,以及该受试者是用抗癌疗法治疗的候选者的指示。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中鞘磷脂40:2(SM40:2)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中三己糖神经酰胺34:1的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中鞘磷脂40:2(SM40:2)水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,该受试者中以下的水平相对于未患前列腺癌的参考升高:(a)鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer36:0)和三己糖神经酰胺34:1;和/或(b)三己糖神经酰胺34:1;和/或(c)鞘磷脂40:2(SM40:2),该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括小窝蛋白-1(CAV-1)、鞘磷脂40:2(SM 40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)、三己糖神经酰胺34:1(TriHexCer 34:1)和己糖神经酰胺40:0(HexCer 40:0)。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括鞘磷脂40:2(SM 40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1(TriHexCer 34:1)。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1(TriHexCer 34:1)。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括三己糖神经酰胺34:1(TriHexCer 34:1)。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括鞘磷脂40:2(SM 40:2)。
还提供了一种用于侵袭性前列腺癌的诊断组套,其包括:鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer 36:0)、和三己糖神经酰胺34:1;和/或三己糖神经酰胺34:1;和/或鞘磷脂40:2(SM 40:2)。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中小窝蛋白-1(CAV-1)、鞘磷脂40:2(SM 40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)、三己糖神经酰胺34:1和己糖神经酰胺40:0的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中鞘磷脂40:2(SM40:2)、鞘磷脂44:2(SM 44:2)、乳糖神经酰胺32:0(LacCer 32:0)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中鞘磷脂40:2(SM40:2)、乳糖神经酰胺36:0(LacCer 36:0)和三己糖神经酰胺34:1的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中三己糖神经酰胺34:1的水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中鞘磷脂40:2(SM40:2)水平相对于未患前列腺癌的参考升高,该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
还提供了一种治疗或预防受试者中的前列腺癌进展的方法,该受试者中以下的水平相对于未患前列腺癌的参考升高:鞘磷脂40:2(SM 40:2)、乳糖神经酰胺36:0(LacCer36:0)和三己糖神经酰胺34:1;和/或三己糖神经酰胺34:1;和/或鞘磷脂40:2(SM 40:2),该方法包括以下中的一项或多项:向该患有前列腺癌的受试者施用抗癌药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
附图说明
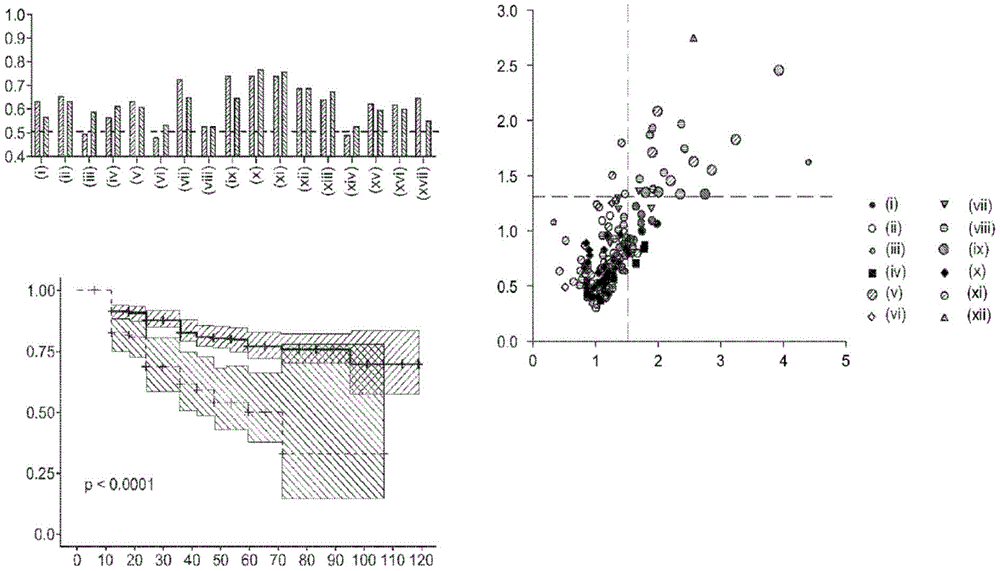
图1描绘了在经历疾病进展的早期前列腺癌患者中(a)鞘磷脂和鞘糖脂的各自ROCAUC(浅灰色=基线;深灰色=12个月)。(i)SM(32:1)(ii)SM(32:2)(ii)SM(34:1)(iv)SM(34:2)(v)SM(36:1)(vi)SM(36:2)(vii)SM(40:2)(viii)SM(42:1)(ix)SM(42:3)(x)葡萄糖神经酰胺(39:2)(xi)乳糖神经酰胺(32:0)(xii)乳糖神经酰胺(32:1)(xiii)乳糖神经酰胺(34:1)(xiv)三己糖神经酰胺(d18:1/16:0)(xv)二己糖神经酰胺(34:1)(xvi)二己糖神经酰胺(36:1)(xvii)三己糖神经酰胺(34:1)。(b)火山图,其示出在使用来自较大前瞻性队列(n=459)的基线血浆样品预测疾病进展时,按脂质结构域分层的各个血浆脂质种类的危险比(横轴);纵轴=–log(p值)。(c)Kaplan-Meier生存曲线示出了具有血浆鞘脂信号(血浆Cav-1加6种鞘脂)的参与者随时间(月;横轴)的无进展生存率(纵轴);血浆鞘脂特征标记水平≤4.33或>4.33。
图2描绘了在发现队列中鉴定的鞘脂的患者内比较。(i)侵袭性_基线;(ii)侵袭性_12M;(a)葡萄糖神经酰胺(38:2)(b)乳糖神经酰胺(32:0)(c)乳糖神经酰胺(32:1)(d)乳糖神经酰胺(34:1)(e)NeuAc?2-3Gal?1-4Glc?-Cer(d18:1/16:0)(f)NeuAc?2-3Gal?-Cer(34:1)(g)NeuAc?2-3Gal?-Cer(36:1)(h)TriHexCer 34:1(i)SM(32:1)(j)SM(32:2)(k)SM(34:1)(l)SM(34:2)(m)SM(36:1)(n)SM(36:2)(o)SM(40:2)(p)SM(42:1)(q)SM(40:3)。
图3描绘了(a)用SFM或含有脂质的SFM处理72小时后PC-3M细胞中Cav-1的免疫印迹。产生具有确定脂质组成的SSALP并将其掺入培养基中。sLDL:合成‘LDL样’颗粒;sHDL:合成“HDL样”颗粒;PC-磷脂酰胆碱;TO-三油酸酯;CE:胆固醇油酸酯;FC:游离胆固醇。(i)SFM(运载体)(ii)sHDL(PC/TO
图4描绘了(a)分别地在LNCaP和PC-3M中过表达或瞬时敲除CAV-1后脂质结构域的倍数变化(纵轴,相对于细胞系特异性对照的中位数)。(i)酰基肉毒碱(ii)心磷脂(iii)神经酰胺(iv)胆固醇酯(v)二酰基甘油(vi)鞘糖脂(vii)溶血磷脂(viii)磷脂(ix)鞘磷脂(x)三酰基甘油。对于脂质结构域,使用对应于相应脂质结构域的各个注释脂质种类的聚集强度。统计学显著性通过双侧学生t检验确定。(b)在LNCaP中过表达CAV-1后或在PC-3M中瞬时敲除CAV-1后乳糖神经酰胺的相对丰度(面积单位±StDev)。(i)乳糖神经酰胺(30:1)(i)乳糖神经酰胺(18:1/20:4)(iii)乳糖神经酰胺(18:1/16:0)。统计学显著性通过双侧学生t检验确定。脂质丰度基于总细胞数进行标准化。
图5显示了生化网络,其示出在按高或低CAV-1表达分层的前列腺癌细胞系(a)和前列腺腺癌(b)中神经酰胺代谢中心酶的基因表达。对于CCLE数据(a),前列腺癌细胞系按平均CAV1 mRNA表达分层为高(log2 mRNA范围:11.01-13.61)或低(log2 mRNA范围4.16-6.88)CAV1表达。对于TCGA数据(b),前列腺腺癌被分层为最高或最低CAV-1表达四分位数。节点大小反映了变化的幅度。边缘和箭头示出了生化反应的方向。增厚黑色节点边界指示统计学上显著的差异。
图6提供神经酰胺生物合成途径的概述。
图7描绘了(a)示出了鞘磷脂(18:1/18:1)-d
图8显示了CAV-1和线粒体形态学之间的关系。(a)用CellLight溶酶体-GFP(溶酶体相关膜蛋白1)和CellLight线粒体-RFP(E1α丙酮酸脱氢酶的前导序列)转染的PC-3M(上)和LNCaP(下)细胞中线粒体和溶酶体的代表性图像。(b)在PC-3M细胞中敲除CAV1后的C11TopFluor-SM摄取。(c)小提琴图,其示出了在PC-3M细胞中敲除CAV1后TopFluor-SM的强度。纵轴=RFU±SEM。使用单因素ANOVA确定统计学显著性;使用Tukey HSD多重比较检验进行成对比较,并报道调整后的p值。(i)siCtrl(ii)模拟品(iii)siCAV-1(iv)siCAV-2。
图9显示了在PC-3M细胞中敲除CAV1后(i)溶酶体(CellLight溶酶体-GFP(溶酶体相关膜蛋白1))、(ii)线粒体(CellLight线粒体-RFP(E1α丙酮酸脱氢酶的前导序列)的代表性图像,以及(iii)合并图像。
图10显示了在PC-3M细胞中敲除CAV1后(a)线粒体团块(MitoTracker Green)的染色的代表性图像。比例尺指示20μm。每个图形旁边都提供了强度比例尺。还显示了小提琴图,其示出了在PC-3M细胞中敲除CAV1后MitoTracker Green(b)和MitoTracker CMXRos(c)的强度。纵轴=RFU±SEM。使用单因素ANOVA确定统计学显著性;使用Tukey HSD多重比较检验进行成对比较,并报道调整后的p值。
图11显示了在PC-3M细胞中敲除CAV1后来自(a)对(ii)CAV1(FITC)和(iii)线粒体电位/活性氧种类的共染色(MitoTracker Red CMXRos)的代表性图像,以及(i)合并图像。(b)在PC-3M细胞中敲除CAV1后通过CellROX Deep red评估的活性氧种类的细胞内水平。(i)siCtrl(ii)ciCAV1-1。
图12显示了在CAV1表达升高时含有Cav-1的胞外囊泡(富含鞘磷脂和乳糖神经酰胺)的分泌。(a)多重分级方法的示意图。(b)在存在或不存在BSA或人源脂蛋白的情况下,在过表达Cav-1或瞬时敲除CAV1后,分别地在衍生自LNCaP和PC-3M的条件培养基的胞外囊泡中的Cav-1水平(ng/mL)。(i)培养基+血清脂蛋白+LDL(ii)培养基+血清脂蛋白+BSA(iii)培养基+血清脂蛋白。纵轴=ng CAV1/mL。(c)在过表达Cav-1或敲除CAV1之后,分别地来自(i)LNCaP和(ii)PC-3M的条件培养基的每毫升颗粒计数(纵轴)。横轴=尺寸/纳米。统计学显著性通过双侧学生T检验确定,相对于相应乱序对照比较了过表达或敲除Cav-1后的曲线下面积。
图13显示了在存在或不存在BSA或人源脂蛋白的情况下,在过表达Cav-1或瞬时敲除CAV-1后,分别地在LNCaP和PC-3M的条件培养基中的(a)鞘磷脂和(b)乳糖神经酰胺的水平。(i)基础培养基(ii)CAV(NC1)(iii)CAV(si8)(iv)CAV-(v)CAV+(vi)基础培养基+BSA(vii)CAV(NC1)/BSA(viii)CAV(si8)/BSA(ix)CAV-/BSA(x)CAV+/BSA(xi)基础培养基+LDL(xii)CAV(NC1)/LDL(xiii)CAV(si8)/LDL(xiv)CAV-/LDL(xv)CAV+/LDL。(c)从LNCaP(左)和PC-3M(右)前列腺癌细胞的条件培养基中分离的Ev的脂质组成。(i)酰基肉毒碱(ii)氧脂素(iii)溶血磷脂(iv)磷脂(v)鞘磷脂(vi)神经酰胺(vii)鞘糖脂(viii)心磷脂(ix)单酰基甘油(x)二酰基甘油(xi)三酰基甘油(xii)胆固醇酯。(d)基于分区定位(COMPARTMENTSlocalization)证据数据库评分被注释为定位于线粒体的PC-3M衍生EV中的蛋白质。(i)过氧化物酶体(ii)高尔基体(iii)内体(iv)溶酶体(v)内质网(vi)线粒体(vii)细胞骨架(viii)胞外区(ix)质膜(x)细胞核(xi)胞质溶胶。
图14显示了示出从(a)PC-3M或(b)LNCaP前列腺癌细胞的条件培养基中分离的EV中鉴定的蛋白质特征的亚细胞定位的热图。亚细胞定位是基于分区定位证据数据库评分。(i)过氧化物酶体(ii)高尔基体(iii)内体(iv)溶酶体(v)内质网(vi)线粒体(vii)细胞骨架(viii)胞外区(ix)质膜(x)细胞核(xi)胞质溶胶。
图15显示了(a)用对照、(i)PPMP、(ii)PDMP或(iii)依利格鲁司特(Eliglustat)处理48小时后(左)RM-9和(右)PC-3M细胞的活力曲线。横轴=log(μΜ);纵轴=相对于对照的活力%。还显示了用运载体(乙醇)或抑制剂处理(左)RM-9和(右)PC-3M 6小时后(b)神经酰胺和(c)鞘糖脂的相对丰度。(i)运载体(ii)128μM依利格鲁司特(iii)64μM PDMP(iv)64μMPPMP。统计学显著性通过双侧学生t检验确定,比较了对应于相应脂质结构域的各个脂质种类的聚集强度。
图16显示了(a)通过将PC-3M前列腺癌细胞暴露于依利格鲁司特来诱导自噬/线粒体自噬。(i)细胞毒性(ii)4小时凋亡(iii)24小时凋亡。每个实验条件下,N=3个生物学上独立的重复。值表示log(相对荧光单位)±StDev。还显示了火山图,其示出在用128μM依利格鲁司特激发6小时后,在(b)PC-3M和(c)RM-9前列腺癌细胞中按脂质结构域分层的注释脂质种类的差异。(i)酰基肉毒碱(ii)心磷脂(iii)二酰基甘油(iv)醚溶血磷脂(v)醚磷脂(vi)溶血磷脂(vii)磷脂(viii)胆固醇酯(ix)三酰基甘油(x)鞘磷脂。每个实验条件下,N=3个生物学上独立的重复。统计学显著性通过双侧学生t检验确定。
图17显示了在用(i)CellLight线粒体-RFP(E1α丙酮酸脱氢酶的前导序列)或(ii)CellLight溶酶体-GFP(溶酶体相关1052膜蛋白1)预转染24小时,接着用(a)运载体或(c)依利格鲁司特(128μM)进行急性(6小时)处理之后,PC-3M细胞的代表性共聚焦显微镜检查图像。(b)和(d)分别对应于来自(a)和(c)的特征的放大。(iii)合并图像。
图18显示了(a)在敲除CAV1后(左)或在用Cav-1单克隆封闭抗体预处理后(右),用128μM依利格鲁司特处理的PC-3M细胞的活力(MTS测定法):(i)siCtrl(ii)siCAV1-1(iii)siCAV1-2(iv)IgG=运载体(v)IgG+依利格鲁司特(vi)abCAV1+运载体(vii)abCAV1+依利格鲁司特。(b)过表达Cav-1后用64μM依利格鲁司特处理的LNCaP细胞的活力(MTS测定法)。
图19显示了在体内小鼠模型中依利格鲁司特的功效。(a)每天腹膜内注射(i)生理盐水(n=23)或(ii)依利格鲁司特(60mg/kg)(n=9)后RM-9肿瘤的相对荧光单位±SEM。(b)用生理盐水(n=15)或依利格鲁司特(60mg/kg)(n=8)治疗后的肿瘤体积±SEM。统计学显著性通过双侧Wilcoxon秩和检验确定。(c)治疗后的代表性IVIS图像。(d)治疗后RM-9肿瘤中糖鞘脂的相对丰度(面积单位±StDev)。统计学显著性通过双侧Wilcoxon秩和检验确定,比较了对应于相应脂质结构域的各个脂质种类的聚集强度。
图20显示了在用生理盐水(n=6-8只小鼠)或依利格鲁司特(n=7只小鼠)治疗后,对RM-9肿瘤中(a)Cav-1、(b)BrdU-TUNEL、(c)PCNA、(d)HMGB1和(e)LC3B的免疫组织化学染色的定量分析。纵轴是(a)Cav-1染色评分,(b)凋亡小体/fd,(c)PCNA标记的%,(d)细胞质HMGB1的%,和(e)LC-3B阳性细胞/fd。统计学显著性通过双侧Wilcoxon秩和检验确定。还显示了(f)火山图,其示出在携带RM-9的C57BL/6N小鼠或对照小鼠的血浆中按脂质结构域分层的各个注释脂质种类的倍数变化。(i)酰基肉毒碱(ii)神经酰胺(iii)胆固醇酯(iv)二酰基甘油(v)游离脂肪酸(vi)鞘糖脂(vii)溶血磷脂(viii)氧脂素(ix)磷脂(x)鞘磷脂(x)三酰基甘油。
图21描绘了三己糖神经酰胺(34:1)、乳糖神经酰胺(36:0)、乳糖神经酰胺(32:0)、SM(44:2)、SM(40:2)、血浆鞘脂特征标记(SphingoSignature)和简化鞘脂特征标记(简化特征标记)的每单位增加的优势比(95%CI),用于在由248名参与者(35名进展者,213名非进展者)组成的独立验证队列中评估主动监测前列腺癌的男性中疾病进展的风险。*指示有统计学显著性,单侧p<0.05。
具体实施方式
在一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:测量该生物样品中的CAV-1的水平、测量该生物样品中的SM(40:2)的水平、测量该生物样品中的SM(44:2)的水平、测量该生物样品中的LacCer 32:0的水平、测量该生物样品中的LacCer 36:0的水平、测量该生物样品中的TriHexCer 34:1的水平以及测量该生物样品中的HexCer 40:0的水平;其中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量确定受试者中的前列腺癌进展风险。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:使该样品与结合CAV-1的第一报道分子、结合SM(40:2)的第二报道分子、结合SM(44:2)的第三报道分子、结合LacCer 32:0的第四报道分子、结合LacCer 36:0的第五报道分子、结合TriHexCer 34:1的第六报道分子和结合HexCer 40:0的第七报道分子接触;其中该第一报道分子、该第二报道分子、该第三报道分子、该第四报道分子、该第五报道分子、该第六报道分子和该第七报道分子的量确定该受试者中的前列腺癌进展风险。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:对CAV-1进行光谱分析,对SM(40:2)进行光谱分析,对SM(44:2)进行光谱分析,对LacCer 32:0进行光谱分析,对LacCer 36:0进行光谱分析,对TriHexCer 34:1进行光谱分析,对HexCer 40:0进行光谱分析,其中这些光谱分析确定受试者中的前列腺癌进展风险。在一些方面,光谱分析是定量分析。在一些方面,光谱分析是质谱分析。在一些方面,光谱分析是并行进行的。在一些方面,光谱分析是顺序进行的。在一些方面,该方法进一步包括色谱步骤。在一些方面,该方法进一步包括液相色谱步骤。在一些方面,该方法进一步包括高效液相色谱(“HPLC”)步骤。在一些方面,该方法进一步包括气相色谱(“GC”)步骤。在一些方面,色谱步骤直接与光谱步骤耦合。在一些方面,色谱步骤将至少一种分析物与至少一种其他分析物分离。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:提供结合CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的表面;将该表面与该生物样品一起孵育;使该表面与结合CAV-1的第一报道分子接触,使该表面与结合SM(40:2)的第二报道分子接触,使该表面与结合SM(44:2)的第三报道分子接触,使该表面与结合LacCer32:0的第四报道分子接触,使该表面与结合LacCer 36:0的第五报道分子接触,使该表面与结合TriHexCer 34:1的第六报道分子接触,以及使该表面与结合HexCer 40:0的第七报道分子接触;测量与该表面缔合的第一报道分子的量;测量与该表面缔合的第二报道分子的量;测量与该表面缔合的第三报道分子的量;测量与该表面缔合的第四报道分子的量;测量与该表面缔合的第五报道分子的量;测量与该表面缔合的第六报道分子的量;测量与该表面缔合的第七报道分子的量;其中该第一报道分子、该第二报道分子、该第三报道分子、该第四报道分子、该第五报道分子、该第六报道分子和该第七报道分子的量确定该受试者中的前列腺癌进展风险。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:提供具有用于结合CAV-1的装置的第一表面,提供具有用于结合SM(40:2)的装置的第二表面,提供具有用于结合SM(44:2)的装置的第三表面,提供具有用于结合LacCer 32:0的装置的第四表面,提供具有用于结合LacCer36:0的装置的第五表面,提供具有用于结合TriHexCer 34:1的装置的第六表面,以及提供具有用于结合HexCer 40:0的装置的第七表面;将该第一表面与该生物样品一起孵育;将该第二表面与该生物样品一起孵育;将该第三表面与该生物样品一起孵育;将该第四表面与该生物样品一起孵育;将该第五表面与该生物样品一起孵育;将该第六表面与该生物样品一起孵育;将该第七表面与该生物样品一起孵育;使该第一表面与结合CAV-1的第一报道分子接触,使该第二表面与结合SM(40:2)的第一报道分子接触,使该第三表面与结合SM(44:2)的第一报道分子接触,使该第四表面与结合LacCer 32:0的第一报道分子接触,使该第五表面与结合LacCer 36:0的第一报道分子接触,使该第六表面与结合TriHexCer 34:1的第一报道分子接触,以及使该第七表面与结合HexCer 40:0的第一报道分子接触;测量与该第一表面缔合的第一报道分子的量;测量与该第二表面缔合的第二报道分子的量;测量与该第三表面缔合的第三报道分子的量;测量与该第四表面缔合的第四报道分子的量;测量与该第五表面缔合的第五报道分子的量;测量与该第六表面缔合的第六报道分子的量;测量与该第七表面缔合的第七报道分子的量;其中该第一报道分子、该第二报道分子、该第三报道分子、该第四报道分子、该第五报道分子、该第六报道分子和该第七报道分子的量确定该受试者中的前列腺癌进展风险。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:提供具有用于结合CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的装置的表面;将该表面与该生物样品一起孵育;使该表面与结合CAV-1的第一中继分子接触,使该表面与结合SM(40:2)的第二中继分子接触,使该表面与结合SM(44:2)的第三中继分子接触;使该表面与结合LacCer 32:0的第四中继分子接触;使该表面与结合LacCer 36:0的第五中继分子接触;使该表面与结合TriHexCer 34:1的第六中继分子接触;以及使该表面与结合HexCer40:0的第七中继分子接触;使该表面与结合该第一中继分子的第一报道分子接触;使该表面与结合该第二中继分子的第二报道分子接触;使该表面与结合该第三中继分子的第三报道分子接触;使该表面与结合该第四中继分子的第四报道分子接触;使该表面与结合该第五中继分子的第五报道分子接触;使该表面与结合该第六中继分子的第六报道分子接触;使该表面与结合该第七中继分子的第七报道分子接触;测量与该第一中继分子和CAV-1缔合的第一报道分子的量;测量与该第二中继分子和SM(40:2)缔合的第二报道分子的量;测量与该第三中继分子和SM(44:2)缔合的第三报道分子的量;测量与该第四中继分子和LacCer 32:0缔合的第四报道分子的量;测量与该第五中继分子和LacCer 36:0缔合的第五报道分子的量;测量与该第六中继分子和TriHexCer 34:1缔合的第六报道分子的量;以及测量与该第七中继分子和HexCer 40:0缔合的第七报道分子的量;其中该第一报道分子、该第二报道分子、该第三报道分子、该第四报道分子、该第五报道分子、该第六报道分子和该第七报道分子的量确定该受试者中的前列腺癌进展风险。
在一个实施例中,相对于健康受试者,受试者中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0或与其结合的报道分子的量升高。在一个实施例中,相对于未患前列腺癌的受试者,受试者中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0或与其结合的报道分子的量升高。在一个实施例中,相对于患有无痛性前列腺癌的受试者,受试者中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0或与其结合的报道分子的量升高。
在另一个实施例中,这些报道分子中至少一种提供可检测信号。在另一个实施例中,可检测信号可通过选自UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱的方法来检测。在另一个实施例中,该光谱法是质谱。在另一个实施例中,该组套包括已经通过选自以下的方法鉴定的生物标志物:UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱。在另一个实施例中,该组套包括已经通过UV-可见光谱或质子NMR光谱鉴定的生物标志物。
在另一个实施例中,第一报道分子选择性地与CAV-1结合。在另一个实施例中,第二报道分子选择性地与SM(40:2)结合。在另一个实施例中,第三报道分子选择性地与SM(44:2)结合。在另一个实施例中,第四报道分子选择性地与LacCer 32:0结合。在另一个实施例中,第五报道分子选择性地与LacCer 36:0结合。在另一个实施例中,第六报道分子选择性地与TriHexCer 34:1结合。在另一个实施例中,第七报道分子选择性地与HexCer 40:0结合。
在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定基本上同时进行。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定以逐步方式进行。在另一个实施例中,这种方法包括将受试者历史信息纳入到前列腺癌进展风险的确定中。在另一个实施例中,这种方法包括对被分配为处于前列腺癌进展风险的风险中的受试者施用至少一种替代诊断测试。
在另一方面,本披露提供了一种治疗怀疑处于前列腺癌进展的风险中的受试者的方法,该方法包括用本文所披露的方法分析受试者中的前列腺癌进展风险,以及施用治疗有效量的癌症治疗。在一个实施例中,治疗是手术、化学疗法、免疫疗法、放射疗法、靶向疗法或其组合。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:
测量该生物样品中的CAV-1的水平;测量该生物样品中的SM(40:2)的水平;测量该生物样品中的SM(44:2)的水平;测定该生物样品中的LacCer 32:0的水平;测定该生物样品中的LacCer 36:0的水平;测量该生物样品中的TriHexCer 34:1的水平;测定该生物样品中的pro-SFTPB的水平;确定相对于第一标准值的CAV-1水平,其中该比率预测前列腺癌进展的风险;确定相对于第二标准值的SM(40:2)水平,其中该比率预测前列腺癌进展的风险;确定相对于第三标准值的SM(44:2)水平,其中该比率预测前列腺癌进展的风险;确定相对于第四标准值的LacCer 32:0水平,其中该比率预测前列腺癌进展的风险;确定相对于第五标准值的LacCer 36:0水平,其中该比率预测前列腺癌进展的风险;确定相对于第六标准值的TriHexCer 34:1水平,其中该比率预测前列腺癌进展的风险;确定相对于第七标准值的HexCer 40:0水平,其中该比率预测前列腺癌进展的风险;以及通过对CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的比率的统计学分析而分配为有前列腺癌进展的风险或不处于前列腺癌进展的风险中。
在另一方面,本披露提供了一种预测受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的来自受试者的生物样品执行以下步骤:测量该生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0生物标志物的水平;以及如通过对CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的统计学分析确定的,计算预测因子。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括对从受试者获得的生物样品执行以下步骤:测量该生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0生物标志物的水平;如通过对该生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平的统计学分析确定的,将该受试者的状况分配为处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中,并通过对CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平的分析,确定前列腺癌进展的风险。
在另一个实施例中,第一报道分子选择性地与CAV-1结合。在另一个实施例中,第二报道分子选择性地与SM(40:2)结合。在另一个实施例中,第三报道分子选择性地与SM(44:2)结合。在另一个实施例中,第四报道分子选择性地与LacCer 32:0结合。在另一个实施例中,第五报道分子选择性地与LacCer 36:0结合。在另一个实施例中,第六报道分子选择性地与TriHexCer 34:1结合。在另一个实施例中,第七报道分子选择性地与HexCer 40:0结合。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定基本上同时进行。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定以逐步方式进行。在另一个实施例中,这种方法进一步包括将受试者历史信息纳入到处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中的分配中。在另一个实施例中,这种方法包括对被分配为处于前列腺癌进展的风险中的受试者施用至少一种替代诊断测试。
在另一方面,本披露提供了一种治疗怀疑处于前列腺癌进展的风险中的受试者的方法,该方法包括用本文所述的方法分析该受试者中的前列腺癌进展风险;以及施用治疗有效量的癌症治疗。在另一个实施例中,治疗是手术、化学疗法、免疫疗法、放射疗法、靶向疗法或其组合。在另一个实施例中,对处于前列腺癌进展的风险中的受试者的分类在78%和94%的特异性下分别具有0.76和0.42的灵敏度。
在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与患有腺癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。
在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与患有鳞状细胞癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。
在另一方面,本披露提供了用于该方法的试剂盒,该试剂盒包括包含以下的试剂溶液:用于检测CAV-1的第一溶质;用于检测SM(40:2)的第二溶质;用于检测SM(44:2)的第三溶质;用于检测LacCer 32:0的第四溶质;用于检测LacCer 36:0的第五溶质;用于检测TriHexCer 34:1的第六溶质;以及用于检测HexCer 40:0的第七溶质。
在另一个实施例中,这种方法进一步包括用于使试剂溶液与生物样品接触的设备。在另一个实施例中,这种方法包括具有用于结合至少一种生物标志物的装置的至少一个表面。在另一个实施例中,该至少一种生物标志物选自由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括生物标志物组套和蛋白质标志物组套:其中该生物标志物组套包括CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0;其中该方法包括:在从该受试者获得生物样品时执行以下步骤;测量该生物样品中的这些生物标志物和这些蛋白质生物标志物的水平;其中这些生物标志物和这些蛋白质生物标志物的量确定该受试者中的前列腺癌进展风险。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括在从受试者获得生物样品时执行以下步骤;测量该生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平;以及通过对生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平的统计学分析来确定该受试者中的前列腺癌进展风险。在一个实施例中,相对于健康受试者,受试者中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0或与其结合的报道分子的水平升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与未患前列腺癌的参考受试者或组中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,参考受试者或组是健康的。在另一个实施例中,这种方法包括至少一种受体分子,其选择性地与选自由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0组成的组的生物标志物结合。在另一个实施例中,样品包括选自血液、血浆和血清的生物样品。在另一个实施例中,生物样品是血清。在另一个实施例中,量化CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量。在另一个实施例中,检测CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0的量包括使用固体颗粒。在另一个实施例中,该固体颗粒是珠粒。在另一个实施例中,至少一种报道分子与酶连接。在另一个实施例中,这些报道分子中至少一种提供可检测信号。在另一个实施例中,可检测信号可通过选自UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱的方法来检测。在另一个实施例中,测量CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的浓度。在另一个实施例中,基于生物标志物的测量浓度,确定受试者处于前列腺癌进展的风险中。在另一个实施例中,使用这些测量浓度基于给定截止值处的灵敏度和特异性值来计算生物标志物评分。在另一个实施例中,这种方法进一步包括以下步骤:将生物样品中的每种生物标志物的测量浓度与统计学模型的预测进行比较。在另一个实施例中,该组套选自由以下组成的组:a.由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组套;或b.由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer34:1和HexCer 40:0组成的组套。在另一个实施例中,该组套包括已经通过选自以下的方法鉴定的生物标志物:UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱。在另一个实施例中,该组套包括已经通过UV-可见光谱或质子NMR光谱鉴定的生物标志物。
在另一个实施例中,第一报道分子选择性地与CAV-1结合。在另一个实施例中,第二报道分子选择性地与SM(40:2)结合。在另一个实施例中,第三报道分子选择性地与SM(44:2)结合。在另一个实施例中,第四报道分子选择性地与LacCer 32:0结合。在另一个实施例中,第五报道分子选择性地与LacCer 36:0结合。在另一个实施例中,第六报道分子选择性地与TriHexCer 34:1结合。在另一个实施例中,第七报道分子选择性地与HexCer 40:0结合。
在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定基本上同时进行。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定以逐步方式进行。在另一个实施例中,这种方法进一步包括将受试者历史信息纳入到处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中的分配中。在另一个实施例中,这种方法包括对被分配为处于前列腺癌进展的风险中的受试者施用至少一种替代诊断测试。
在另一个实施例中,本披露提供了用于如本文所述的方法的试剂盒,该试剂盒包括:包含以下的试剂溶液:用于检测CAV-1的第一溶质;用于检测SM(40:2)的第二溶质;用于检测SM(44:2)的第三溶质;用于检测LacCer 32:0的第四溶质;用于检测LacCer 36:0的第五溶质;用于检测TriHexCer 34:1的第六溶质;以及用于检测HexCer 40:0的第七溶质
在另一方面,本披露提供了用于如本文所述的方法的试剂盒,该试剂盒包括包含用于检测CAV-1的第一溶质的第一试剂溶液、包含用于检测SM(40:2)的第二溶质的第二试剂溶液、包含用于检测SM(44:2)的第三溶质的第三试剂溶液、包含用于检测LacCer 32:0的第四溶质的第四试剂溶液、包含用于检测LacCer 36:0的第五溶质的第五试剂溶液、包含用于检测TriHexCer 34:1的第六溶质的第六试剂溶液、以及包含用于检测HexCer 40:0的第七溶质的第七试剂溶液。
在另一个实施例中,这种试剂盒进一步包括:包含以下的试剂溶液:用于检测CAV-1的第一溶质;用于检测SM(40:2)的第二溶质;用于检测SM(44:2)的第三溶质;用于检测LacCer 32:0的第四溶质;用于检测LacCer 36:0的第五溶质;用于检测TriHexCer 34:1的第六溶质;以及用于检测HexCer 40:0的第七溶质。
在另一方面,本披露提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平将受试者分类为具有前列腺癌进展的风险或处于前列腺癌进展的风险中,该方法包括以下中的一项或多项:向患有前列腺癌的受试者施用化学治疗药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
在另一方面,本披露提供了一种治疗或预防受试者中的前列腺癌进展的方法,其中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer36:0、TriHexCer 34:1和HexCer 40:0的水平将受试者分类为具有前列腺癌进展的风险或处于前列腺癌进展的风险中,该方法包括以下中的一项或多项:向患有前列腺癌的受试者施用化学治疗药物;向该患有前列腺癌的受试者施用治疗性辐射;以及部分或完全手术切除该患有前列腺癌的受试者中的癌组织的手术。
在另一方面,本披露提供了一种用于治疗受试者的前列腺癌的方法,该方法包括:检测从受试者获得的生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0;量化所述收集样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量;根据CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量确定风险评分;将风险评分与截止值进行比较,以确定所述人是否处于前列腺癌进展的风险中;其中如果这些水平高于该截止值,则所述人处于前列腺癌进展的风险中,并且向处于前列腺癌进展的风险中的所述人施用前列腺癌治疗。
在另一方面,本披露提供了一种确定受试者中的前列腺癌进展风险的方法,该方法包括:测量来自需要分析的受试者的生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的浓度;以及将需要诊断的受试者的样品中的生物标志物的浓度与正常或非患病受试者中的浓度进行比较,其中该需要诊断的受试者被诊断出前列腺癌。
在另一方面,本披露提供了一种确定关于生物样品中的前列腺癌进展风险的证据的方法,该方法包括测量生物样品中包括CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer36:0、TriHexCer 34:1和HexCer 40:0在内的生物标志物组套的浓度,并根据CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量确定风险评分。在另一个实施例中,相对于健康受试者,受试者中的CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0或与其结合的报道分子的水平升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平与未患前列腺癌的参考受试者或组中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0的水平与患有无痛性前列腺癌的参考受试者或组中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,参考受试者或组是健康的。在另一个实施例中,至少一个表面进一步包含至少一种受体分子,其选择性地与选自CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的生物标志物结合。在另一个实施例中,至少一个表面是固体颗粒的表面。在另一个实施例中,固体颗粒包括珠粒。在另一个实施例中,这种方法包括:测量该生物样品中的生物标志物的水平;其中这些生物标志物的量将该患者分类为处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中。在另一个实施例中,样品包括选自血液、血浆和血清的生物样品。在另一个实施例中,生物样品是血清。在另一个实施例中,量化CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量。在另一个实施例中,检测CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的量包括使用固体颗粒。在另一个实施例中,该固体颗粒是珠粒。在另一个实施例中,至少一种报道分子与酶连接。在另一个实施例中,这些报道分子中至少一种提供可检测信号。在另一个实施例中,可检测信号可通过选自UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱的方法来检测。在另一个实施例中,测量CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0的浓度。在另一个实施例中,基于生物标志物的测量浓度,确定受试者处于前列腺癌进展的风险中。在另一个实施例中,使用这些测量浓度基于给定截止值处的灵敏度和特异性值来计算生物标志物评分。在另一个实施例中,这种方法进一步包括以下步骤:将生物样品中的每种生物标志物的测量浓度与统计学模型的预测进行比较。在另一个实施例中,该组套选自由以下组成的组:a.由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组套;或b.由CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组套。在另一个实施例中,该组套包括已经通过选自以下的方法鉴定的生物标志物:UV-可见光谱、质谱、核磁共振(NMR)光谱、质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱。在另一个实施例中,该组套包括已经通过UV-可见光谱或质子NMR光谱鉴定的生物标志物。
在另一个实施例中,第一报道分子选择性地与CAV-1结合。在另一个实施例中,第二报道分子选择性地与SM(40:2)结合。在另一个实施例中,第三报道分子选择性地与SM(44:2)结合。在另一个实施例中,第四报道分子选择性地与LacCer 32:0结合。在另一个实施例中,第五报道分子选择性地与LacCer 36:0结合。在另一个实施例中,第六报道分子选择性地与TriHexCer 34:1结合。在另一个实施例中,第七报道分子选择性地与HexCer 40:0结合。
在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定基本上同时进行。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0水平的测定以逐步方式进行。在另一个实施例中,这种方法包括将受试者历史信息纳入到处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中的分配中。在另一个实施例中,这种方法包括对被分配为处于前列腺癌进展的风险中的受试者施用至少一种替代诊断测试。
在另一个实施例中,治疗怀疑处于前列腺癌进展的风险中的受试者的方法,该方法包括用如本文所述的方法分析受试者中的前列腺癌进展风险;以及施用治疗有效量的癌症治疗。在另一个实施例中,治疗是手术、化学疗法、免疫疗法、放射疗法、靶向疗法或其组合。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer34:1和HexCer 40:0的水平与患有腺癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0的水平与患有鳞状细胞癌的参考受试者或组中CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平相比升高。在另一个实施例中,在临界可切除阶段或之前诊断出前列腺癌。在另一个实施例中,在可切除阶段诊断出前列腺癌。
在另一个实施例中,这种方法进一步包括:提供结合CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的表面;将该表面与该生物样品一起孵育;
测量与该表面缔合的第一报道分子的量;测量与该表面缔合的第二报道分子的量;测量与该表面缔合的第三报道分子的量;测量与该表面缔合的第四报道分子的量;测量与该表面缔合的第五报道分子的量;测量与该表面缔合的第六报道分子的量;测量与该表面缔合的第七报道分子的量;其中该第一报道分子、该第二报道分子、该第三报道分子、该第四报道分子、该第五报道分子、该第六报道分子和该第七报道分子的量将该受试者分类为处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中。
在另一个实施例中,这种试剂盒包括用于使试剂溶液与生物样品接触的设备。在另一个实施例中,这种试剂盒包括具有用于结合至少一种生物标志物的装置的至少一个表面。在另一个实施例中,该至少一种生物标志物选自由CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成的组。
在另一方面,本披露提供了一种方法,该方法包括a)在从无前列腺癌症状的受试者获得样品时执行以下步骤;b)测量该样品中的标志物组套,其中这些标志物包括CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0;c)确定每种标志物的生物标志物评分;d)对每种标志物的生物标志物评分求和以获得每个受试者的综合评分,将该受试者中的前列腺癌进展风险的风险量化为风险评分,其中该综合评分与分层受试者群体的分组的风险类别相匹配,其中每个风险类别包括与使用单个阈值相比指示患有前列腺癌的可能性增加的乘数,其与综合评分范围相关联,其中该乘数由回顾性样品的阳性预测评分确定;以及e)对具有前列腺癌进展风险的量化风险的受试者实施计算机断层成像(CT)扫描或其他显像模式。在另一个实施例中,这些标志物由CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0组成。在另一个实施例中,该样品是血液、血清、血浆或其一些部分。在另一个实施例中,从群体的回顾性临床样品中确定分层受试者群体的分组、指示患有该癌症的可能性增加的乘数以及综合评分的范围。在另一个实施例中,风险类别进一步包括风险标识符。在另一个实施例中,风险标识符选自低风险、中低风险、中风险、中高风险和最高风险。在另一个实施例中,针对每个风险类别计算指示患有该癌症的可能性增加的乘数包括基于回顾性生物标志物评分对受试者队列进行分层,并用每个分层群体的阳性预测评分对队列中已知的癌症患病率进行加权。在另一个实施例中,分层受试者群体的分组包括至少三个风险类别,其中指示患有该癌症的可能性增加的乘数为约2或更大。在另一个实施例中,分层受试者群体的分组包括至少两个风险类别,其中指示患有该癌症的可能性增加的乘数为约5或更大。在另一个实施例中,受试者年龄为50岁或更大,并且具有吸烟史。在另一个实施例中,这种方法进一步包括生成风险类别表,其中测量该标志物组套,确定每种标志物的生物标志物评分,通过对这些生物标志物评分求和来获得综合评分;确定用于将综合评分划分到风险组的阈值,并将指示无症状受试者具有癌症进展的量化风险的可能性的乘数分配给每组。在另一个实施例中,这些组处于选自电子表格形式、软件应用、计算机程序和excel电子表格的表中。在另一个实施例中,该标志物组套包括在结合测定法中测量的蛋白质、多肽或代谢物。在另一个实施例中,该标志物组套包括使用流式细胞仪测量的蛋白质或多肽。
提供了用于鉴定受试者中的前列腺癌进展风险的方法,该方法通常包括:(a)应用施加从受试者获得的血液样品来分析四种生物标志物:CAV-1、SM(40:2)、SM(44:2)、LacCer32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0;(b)量化血液样品中存在的四种生物标志物的量;以及(c)应用基于存在的生物标志物量的统计学分析以确定关于对应前列腺癌的生物标志物评分,从而将受试者分类为前列腺癌进展风险阳性或前列腺癌进展风险阴性。可替代地者,提供了用于鉴定受试者中的前列腺癌进展风险的方法,该方法通常包括:(a)应用施加从受试者获得的血液样品来分析四种生物标志物:CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0;(b)量化血液样品中存在的四种生物标志物的量;以及(c)应用基于存在的生物标志物量的统计学分析以确定关于对应前列腺癌的生物标志物评分,从而提供用于评估受试者前列腺癌进展的相对风险(例如,以非二元方式)的工具。
本文呈现的方法能够筛查高危受试者,如有前列腺癌家族史的受试者,或有其他风险因素如肥胖、大量吸烟和可能的糖尿病的受试者。本文披露的逻辑回归模型可以将这些因素并入其分类方法中。
如本文所用,“前列腺癌状态”是指将个体、受试者或患者分类为处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中。在一些实施例中,处于前列腺癌进展的风险中的个体可被称为“前列腺癌阳性”。在其他实施例中,不处于前列腺癌进展的风险中的个体可被称为“前列腺癌阴性”。对于被分类为前列腺癌阳性的受试者,可以提供进一步的方法来阐明前列腺癌状态。可以遵循包括但不限于计算机断层成像(CT)的方法将前列腺癌分类为阳性。
本披露不限于本文报道的用于检测生物标志物的特定生物分子。可以选择其他分子用于其他实施例,包括但不限于基于蛋白质、抗体、核酸、适配体和合成有机化合物的生物分子。其他分子可能在灵敏度、效率、测定速度、成本、安全性或易于制造或储存方面表现出优势。
在一些实施例中,测量生物样品中的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0的水平。在一些实施例中,使CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0与报道分子接触,并测量相应报道分子的水平。在一些实施例中,提供了四种报道分子,它们分别特异性结合CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer40:0。报道分子的使用可以为测定法提供便利性和灵敏度增益。
在一些实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0被吸附到试剂盒中提供的表面上。在一些实施例中,报道分子结合表面吸附的CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0。生物标志物的吸附可以是非选择性的或选择性的。在一些实施例中,该表面包括用于增加对吸附一种或多种生物标志物的选择性的受体功能。
在一些实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0被吸附到对这些生物标志物中一种或多种具有选择性的四个表面上。然后,一个或多个报道分子可以与表面吸附的生物标志物结合,并且与特定表面缔合的一个或多个报道分子的水平可以允许对存在于该表面上的特定生物标志物进行容易的量化。
在一些实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0被吸附到试剂盒中提供的表面上;对这些生物标志物中一种或多种具有特异性的中继分子与表面吸附的生物标志物结合;并且对一个或多个中继分子具有特异性的受体分子与中继分子结合。中继分子可以提供对某些生物标志物的特异性,并且受体分子可以实现检测。
在一些实施例中,提供了四种中继分子,它们分别特异性结合CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0。可以针对对生物标志物的特异性有意地设计中继分子,或者可以根据它们的结合特性从候选者库中选择。
在一些实施例中,CAV-1、SM(40:2)、SM(44:2)、LacCer 32:0、LacCer 36:0、TriHexCer 34:1和HexCer 40:0被吸附到试剂盒中提供的四个离散表面上;对这些生物标志物中一种或多种具有特异性的中继分子与表面吸附的生物标志物结合;并且受体分子与中继分子结合。对该表面的分析可以以逐步或并行的方式完成。
在一些实施例中,将报道分子与酶连接,促进了量化报道分子。在一些实施例中,可以通过催化产生具有所需光谱性质的物质来实现量化。
在一些实施例中,生物标志物的量用光谱来确定。在一些实施例中,所利用的光谱是UV-可见光谱。在一些实施例中,所利用的光谱是质谱。在其他实施例中,所利用的光谱是核磁共振(NMR)光谱,诸如包括但不限于质子NMR光谱、核磁共振(NMR)光谱、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、相关光谱(COSy)、核欧沃豪斯效应谱(NOESY)、旋转坐标系核欧沃豪斯效应谱(ROESY)、LC-TOF-MS、LC-MS/MS和毛细管电泳-质谱。
在特定测定法中发现的一种或多种生物标志物的量可以直接报道给操作者,或者可替代地可以以数字方式存储,并易于使其可用于数学处理。可以提供一种用于执行数学分析的系统,并且可以进一步向操作者报道前列腺癌阳性或前列腺癌阴性的分类。
在一些实施例中,本领域普通技术人员已知的其他测定法可以与本文的披露内容一起发挥作用。其他测定法包括但不限于利用质谱、免疫亲和LC-MS/MS、表面等离子体共振、色谱、电化学、声波、免疫组织化学和阵列技术的测定法。
本文所讨论的各种系统组件可包括以下的一个或多个:包括用于处理数字数据的一个或多个处理器的计算机;短期或长期数字存储器;输入模数转换器,用于提供数字化数据;处理器可用来指导该处理器处理数字数据的应用程序;用于从受试者或操作者收集信息的输入设备,以及用于向受试者或操作者显示信息的输出设备。
本文还提供了用于被分类为前列腺癌阳性的受试者的治疗方法。对前列腺癌阳性患者的治疗可以包括但不限于手术、化学疗法、放射疗法、靶向疗法或其组合。
关于本文详述的生物标志物的检测,本披露不限于本文报道的特定生物分子。在一些实施例中,可以选择其他生物分子来检测和分析所披露的生物标志物,包括但不限于基于蛋白质、抗体、核酸、适配体和合成有机化合物的生物分子。其他分子可能在灵敏度、效率、测定速度、成本、安全性或易于制造或储存方面表现出优势。在这方面,本领域普通技术人员将理解,本文披露的生物标志物的预测和诊断能力不仅可以扩展到对这些生物标志物的蛋白质形式的分析,还可以扩展到对生物标志物的其他表现形式(例如,核酸)的分析。此外,本领域普通技术人员将理解,本文披露的生物标志物的预测和诊断能力也可以与对与前列腺癌相关的其他生物标志物的分析组合使用。在一些实施例中,与前列腺癌相关的其他生物标志物可以是基于蛋白质的生物标志物。
前述内容相当广泛地概述了本披露的特征和技术益处,以便更好地理解具体实施方式。本领域技术人员应该理解,所披露的特定实施例可以容易地用作修改或设计用于实现本披露的相同目的的其他结构或过程的基础。应当理解,本披露不限于所描述的特定实施例,因为可对特定实施例进行变化并且仍然落入所附权利要求书的范围内。
定义
如本文所用,术语“前列腺癌”是指以细胞异常增殖为特征的前列腺恶性赘生物,这些细胞的生长超过周围正常组织的生长并且与其不协调。
如本文所用,术语“前列腺癌阳性”是指将受试者分类为处于前列腺癌进展的风险中。
如本文所用,术语“前列腺癌阴性”是指将受试者分类为不处于前列腺癌进展的风险中。
如本文所用,术语“受试者”或“患者”是指哺乳动物,优选是人,需要将其分类为前列腺癌阳性或前列腺癌阴性,并且可以为其提供进一步的治疗。
如本文所用,“参考患者”、“参考受试者”或“参考组”是指一组患者或受试者,可以将来自怀疑具有前列腺癌进展的风险或处于前列腺癌进展的风险中的患者或受试者的测试样品与之比较。在一些实施例中,这种比较可用于确定测试受试者是否患有前列腺癌。参考患者或组可以作为用于测试或诊断目的的对照。如本文所述,参考患者或组可以是从单个患者获得的样品,或者可以表示样品组,如汇集的样品组。
如本文所用,“健康”是指其中没有发现前列腺癌证据的个体,即,该个体未患前列腺癌。这样的个体可以被分类为“前列腺癌阴性”,或被分类为具有健康的前列腺或正常的未受损前列腺功能。健康患者或受试者没有前列腺癌或其他前列腺疾病的症状。在一些实施例中,健康患者或受试者可用作参考患者,用于与患病或疑似患病样品进行比较,以确定患者或患者组中的前列腺癌。
如本文所用,术语“治疗(“treatment”或“treating”)”是指针对受试者进行的药物施用或医疗程序执行,用于预防(prophylaxis/prevention)或治愈,或在受试者或患者遭受折磨的情况下降低病弱或紊乱或病症或事件的发生或复发的程度或可能性。与本披露相关,该术语也可以指施用药理学物质或配制品,或执行非药理学方法,这些方法包括但不限于放射疗法和手术。本文中使用的药理学物质可包括但不限于本领域中确定的化学治疗药物,如醋酸阿比特龙(Zytiga)、阿帕鲁胺(Erleada)、比卡鲁胺(Casodex)、卡巴他赛(Jevtana)、达罗鲁他胺(Nubeqa)、地加瑞克(Firmagon)、多西他赛(Taxotere)、Eligard(醋酸亮丙瑞林)、恩杂鲁胺(Xtandi)、氟他胺、醋酸戈舍瑞林(Zoladex)、醋酸亮丙瑞林(Lupron或Lupron Depot)、奥拉帕尼(Lynparza)、盐酸米托蒽醌、尼鲁米特(Nilandron)、sipuleucel-T(Provenge)、二氯化镭223(Xofigo)和瑞卡帕布樟脑磺酸盐(rucaparibcamsylate)(Rubraca)。
药理学物质可以包括用于免疫疗法的物质,如检查点抑制剂。治疗可包括多种药理学物质或多种治疗方法,这些方法包括但不限于手术和化学疗法。
如本文所用,术语“ELISA”是指酶联免疫吸附测定。该测定通常包括使荧光标记的蛋白质样品与对这些蛋白质具有特异性亲和力的抗体接触。对这些蛋白质的检测可以用多种方法完成,包括但不限于激光荧光测定法。
如本文所用,术语“回归”指的是一种统计学方法,其可以基于样品的可观察性状(或可观察性状集)为所述样品的潜在特征分配预测值。在一些实施例中,该特性不是直接可观察到的。例如,本文使用的回归方法可以将特定受试者的特定生物标志物测试或生物标志物测试集的定性或定量结果与所述受试者为前列腺癌阳性的概率联系起来。
如本文所用,术语“逻辑回归”指的是回归方法,其中对来自该模型的预测的分配可以具有几个允许的离散值中的一个。例如,本文使用的逻辑回归模型可以为某个受试者分配前列腺癌阳性或前列腺癌阴性的预测。
如本文所用,术语“生物标志物评分”是指通过将特定受试者的特定生物标志物水平输入到统计学方法而计算的所述受试者的数值评分。
如本文所用,术语“综合评分”是指在来自受试者的样品中测量的预定标志物的标准化值的总和。在一个实施例中,标准化值被报道为生物标志物评分,然后对这些生物标志物评分值求和,以提供所每个测试受试者的综合评分。当在风险类别表的背景下使用并与基于风险类别表中的综合评分范围的分层分组相关联时,“综合评分”用于确定每个测试受试者的“风险评分”,其中指示分层分组患有癌症的可能性增加的乘数变成“风险评分”。
如本文所用,术语“风险评分”是指与疾病队列中已知的癌症进展患病率相比,指示无症状人受试者癌症进展风险的单个数值。在某些实施例中,针对人受试者计算综合评分并将其与指示前列腺癌进展风险的乘数相关联,其中基于风险类别表中每个分层分组的综合评分范围来关联综合评分。以这种方式,基于指示分组患有癌症的可能性增加的乘数,将综合评分转换成与综合评分最佳匹配的风险评分。
如本文所用,术语“截止值”或“截止点”是指与特定统计学方法相关的数学值,该方法可用于基于所述受试者的生物标志物评分将前列腺癌阳性或前列腺癌阴性的分类分配给受试者。
如本文所用,当高于或低于截止值的数值“是前列腺癌所特有的”时,意味着对样品的分析产生该值的受试者患有前列腺癌或处于前列腺癌进展的风险中。
如本文所用,有“前列腺癌进展风险”的受试者是可能尚未证明前列腺癌的明显症状或其前列腺癌目前是无痛性的,但是正在产生指示受试者患有前列腺癌或可能在近期发展为前列腺癌的生物标志物水平的受试者。可以对患有前列腺癌或怀疑携带前列腺癌的受试者进行针对该癌症或被怀疑的癌症的治疗。
如本文所用,术语“分类”是指基于针对受试者获得的生物标志物评分的结果,将所述受试者分配为处于前列腺癌进展的风险中或不处于前列腺癌进展的风险中。
如本文所用,术语“Wilcoxon秩和检验”,也称为Mann-Whitney U检验、Mann-Whitney-Wilcoxon检验或Wilcoxon-Mann-Whitney检验,是指用于比较两个群体的特定统计学方法。例如,该检验可在本文中用于将可观察到的性状(特别是生物标志物水平)与特定群体的受试者中前列腺癌进展的不存在或风险联系起来。
如本文所用,术语“真阳性率”是指通过某种方法分类为阳性的给定受试者是真正阳性的概率。
如本文所用,术语“假阳性率”是指通过某种方法分类为阳性的给定受试者是真正阴性的概率。
如本文所用,术语“灵敏度”在各种生化测定法的背景下是指测定法正确鉴定有疾病者的能力(即,真阳性率)。通过比较,如本文所用,术语“特异性”在各种生化测定法的背景下指的是测定法正确鉴定无疾病者的能力(即,真阴性率)。灵敏度和特异性是二元分类检验(即分类函数)性能的统计学度量。灵敏度量化了对假阴性的规避,而特异性对假阳性也有同样的作用。
如本文所用,“样品”是指待测试其中如本文所述的生物标志物的存在及其水平或浓度的测试物质。样品可以是根据本披露的任何合适的物质,包括但不限于血液、血清、血浆或其任何部分。
如本文所用,“代谢物”是指作为细胞代谢的中间体和/或产物的小分子。代谢物可以在细胞中执行多种功能,例如,对酶进行的结构性作用、信号传导作用、刺激作用和/或抑制作用。在一些实施例中,代谢物可以是非蛋白质的血浆衍生的代谢物标志物,诸如包括但不限于乙酰亚精胺、二乙酰精胺、溶血磷脂酰胆碱(18:0)、溶血磷脂酰胆碱(20:3)和吲哚衍生物。
如本文所用,术语“ROC”指的是接受者操作特征,其为本文所用的用于测量特定诊断方法在各个截止点的性能的图解绘图。ROC图可以由不同截止点处真阳性和假阳性的分数构建。
如本文所用,术语“AUC”指的是ROC图曲线下的面积。AUC可用于估计某种诊断测试的预测能力。通常,较大的AUC对应于增加的预测能力,预测误差频率越低。AUC的可能值范围是从0.5到1.0,后一个值是无误差预测方法所特有的。
如本文所用,术语“p值”或“p”是指在Wilcoxon秩和检验的背景下前列腺癌阳性和前列腺癌阴性受试者的生物标志物评分分布相同的概率。通常,接近零的p值指示特定的统计学方法在对受试者进行分类时具有较高的预测能力。
如本文所用,术语“CI”指的是置信区间,即,可以取决于某个置信水平预测某个值的区间。如本文所用,术语“95%CI”指的是可以取决于95%置信水平预测某个值的区间。
如本文所用,术语“疾病进展”或“早期疾病进展”定义为在主动监测开始后18个月内在监测活检时Gleason评分升级和/或肿瘤体积增加。
如本文所用,术语“无痛性疾病”或“无痛性”前列腺癌被定义为在开始主动监测后五年或更长时间内不存在进展。
缩写
AKT=RAC丝氨酸/苏氨酸蛋白激酶;AS=主动监测;AUC=曲线下面积;Cav-1=小窝蛋白-1;CCLE=布罗德研究所癌细胞系百科全书(Broad Institute Cancer Cell LineEncyclopedia);CE=胆固醇酯;CM=条件培养基;DiI=1,1'-双十八烷基-3,3,3',3'-四甲基吲哚羰花菁;DP=疾病进展;FC=游离胆固醇;GS=Gleason评分;HexCer=己糖神经酰胺;HexCer 40:0=己糖神经酰胺(40:0);HR=危险比;LacCer=乳糖神经酰胺;LacCer 32:0=乳糖神经酰胺(32:0);LacCer 36:0=乳糖神经酰胺(36:0);MAPK=MAP-激酶=丝裂原活化蛋白激酶;PC=磷脂酰胆碱;PDMP=1-苯基-2-癸酰氨基-3-吗啉代-1-丙醇;PPMP=D-苏式-1-苯基-2-十六酰氨基-3-吗啉代-1-丙醇;PI3K=磷酸肌醇3-激酶=磷脂酰肌醇-3-激酶;RFU=相对荧光单位;ROC=接受者操作特征;SEM=平均值的标准误差:SFM=无血清培养基;sHDL=合成HDL样颗粒;sLDL=合成LDL样颗粒;SM=鞘磷脂;SSALP=合成自组装脂质颗粒;TCGA=癌症基因组图谱(The Cancer Genome Atlas);TO=三油酸酯;TriHexCer=三己糖神经酰胺;TriHexCer 34:1=三己糖神经酰胺(34:1)。
实例
包括以下实例来说明本披露的实施例。以下实例仅通过说明的方式呈现,并帮助普通技术人员使用本披露。这些实例不旨在以任何方式限制本披露的范围。本领域技术人员根据本披露内容应理解,可以对披露的特定实施例做出许多改变并且仍然获得相同或相似的结果而不背离本发明的精神和范围。
实例1:通过密度梯度浮选来分离胞外囊泡
如前所述分离胞外囊泡。简而言之,通过以2000×g离心20min,随后以16,500×g离心30min,从生物样品中耗尽微囊泡;通过预湿的0.22μm真空过滤器过滤所得上清液。通过与OptiPrep碘克沙醇溶液(Sigma D1556)混合将耗尽微囊泡的生物样本增密至1.16-1.30g mL
实例2:胞外囊泡的蛋白质组学图谱分析
根据以下标准化工作流程进行胞外囊泡的蛋白质组学图谱分析。简而言之,使用建立的方案通过LC-MS/MS进行ECV衍生蛋白质消化和鉴定。使用与WATERS SYNAPT G2-Si质谱仪在线耦合的NanoAcquity UPLC系统来分离汇集的已消化蛋白质级分。该系统配备了Waters Symmetry C18 nanoAcquity捕集柱(180μm×20mm,5μm)和Waters HSS-T3 C18nanoAcquity分析柱(75μm×150mm,1.8μm)。柱温箱温度设定为50℃,自动进样器中托盘室的温度设定为6℃。使用Waters Masslynx(版本4.1,SCN 851)在分辨率模式下用SYNAPTG2-Si采集LC-HDMSE数据。毛细管电压设置为2.80kV,采样锥电压为30V,源偏移量为30V且源温度为100℃。迁移率利用高纯度N2作为IMS TriWave池中的漂移气体。氦池、捕集池、IMSTriWave池和转移池中的压力分别为4.50毫巴、2.47×10
实例3:代谢组学分析
样品萃取转染后,用预冷的0.9%NaCl洗涤细胞裂解物2次,随后添加2.5mL预冷的3:1异丙醇:超纯水。使用25cm细胞刮勺(Sarstedt)在萃取溶剂中刮取细胞,并转移到15mL锥形管(Eppendorf)中。将样品短暂涡旋,随后在4℃下以2,000×g离心10min。此后,将1.2mL代谢物萃取物转移到1.5mL Eppendorf管中,并储存在-20℃下,直至进行代谢组学分析。
初级代谢产物和生物胺在96孔微孔板(Eppendorf)中,用30μL LCMS级甲醇(赛默飞世尔公司)从预等分的EDTA血浆(10μL)中萃取血浆代谢物。将板热封,以750rpm涡旋5min,并在室温下以2000×g离心10分钟。将上清液(10μL)小心地转移到96孔板上,留下沉淀的蛋白质。用10μL 100mM甲酸铵(pH 3)进一步稀释上清液。对于亲水相互作用液相色谱(HILIC)分析,将样品用60μL LCMS级乙腈(赛默飞世尔公司)稀释,而对于C18分析,将样品用60μL水(GenPure超纯水系统,赛默飞世尔公司)稀释。将各样品溶液转移到384孔微孔板(Eppendorf)进行LCMS分析。对于条件培养基,将冷冻样品在冰上解冻,并将30μl转移到96孔微孔板(Eppendorf)。用另外30μL 100mM甲酸铵稀释等分试样。将微孔板热封,以1500rpm涡旋5min,并在室温下以2000×g离心10分钟。对于亲水相互作用液相色谱(HILIC)分析,将25μL样品转移到含有75μL乙腈的新96孔微孔板,而对于C18分析,将样品转移到含有75μL水的新96孔微孔板(GenPure超纯水系统,赛默飞世尔公司)。将各样品溶液转移到384孔微孔板(Eppendorf)进行LCMS分析。将细胞裂解物上清液100μL(3:1异丙醇:超纯水)等分到两个96孔板(Eppendorf),并在真空下蒸发至干燥。然后按如下复溶样品:对于HILIC测定法,将干燥样品溶解于65μL ACN(赛默飞世尔公司):100mM甲酸铵pH 3(9:1),而对于C18反相测定法,将干燥样品溶解于65μL H
复合脂质在96孔微孔板(Eppendorf)中,用30μL LCMS级2-丙醇(赛默飞世尔公司)萃取预等分的EDTA血浆样品(10μL)。将板热封,以750rpm涡旋5min,并在室温下以2000×g离心10分钟。将上清液(10μL)小心地转移到96孔板上,留下沉淀的蛋白质。将上清液进一步用90μL的1:3:2 100mM甲酸铵pH 3(赛默飞世尔公司):乙腈:2-丙醇稀释,并转移到384孔微孔板(Eppendorf),使用LCMS进行脂质分析。对于细胞裂解物,在96孔板中,将10μL(3:1异丙醇:超纯水)的细胞裂解物上清液用90μL 1:3:2 100mM甲酸铵pH 3:乙腈:2-丙醇(赛默飞世尔公司)稀释,并转移到384孔微孔板(Eppendorf),通过LC-MS进行分析。
初级代谢物和生物胺的非靶向分析在与Xevo G2-XS四极杆飞行时间(qTOF)质谱仪耦合的Waters Acquity
复合脂质的非靶向分析对于脂质组学测定法,在与Xevo G2-XS四极杆飞行时间(qTOF)质谱仪耦合的Waters Acquity
实例4:质谱
数据采集。质谱数据是在初级代谢物的50-1200Da范围内和复合脂质的100-2000Da范围内的正负电喷雾电离模式下使用灵敏度模式采集的。对于电喷雾采集,毛细管电压设置为1.5kV(正)、3.0kV(负),采样锥电压为30V,源温度为120℃,锥气流为50L h
数据处理使用Progenesis QI(非线性(Nonlinear),沃特斯公司)处理LC-MS和LC-MSe数据,并以面积单位报道值。通过使用从可信标准品创建的定制文库匹配精确质量和保留时间和/或通过将实验串联质谱数据与NIST MSMS或HMDB v3理论碎片匹配来确定注释。
数据标准化为了校正注射顺序漂移,使用整个运行序列中每10次注射收集的质量控制样品重复注射的数据对每个特征进行标准化。如前所述,通过局部加权散点图平滑(LOESS)信号校正(QC-RLSC)对测量数据进行平滑化。质量控制样品之间的特征值通过三次样条进行插值。通过使用所有样品的历史质量控制峰面积的总体中位数来重调代谢物值。只有在历史或汇集质量控制样品中表现出相对标准偏差(RSD)小于30的检测特征才被考虑用于进一步的统计学分析。为了降低数据矩阵的复杂性,具有多个引证或采集模式重复的注释特征被折叠成代表性的独特特征。基于重复精确度(RSD<30)、最高强度和与理论同位素分布的最佳同位素相似性匹配来选择特征。值是相对于每次分析运行中包括的历史质量控制参考样品(血浆/条件培养基)或调整后的面积单位(裂解物)的比率报道的。
统计学分析为了找到在两个已经定义的组中给出个体之间最大差异的协变量的截止点,采用了前面描述的方法。使用基于由截止值定义的组的对数秩统计得到以下:
其中D是不同事件(疾病进展(DP))的总数,d
为了计算该检验的p值,使用以下公式提供了0.009的值。这表明,Cav-1-鞘脂特征标记水平与无进展生存率高度相关。
p值≈2exp(-2Q
其中:
并且
实例5:通过血浆脂质特征标记预测AS Gleason分级进展
对临床匹配的基线血浆样品(每组n=16)进行非靶向代谢组学分析,这些样品是前瞻性地从正在经受AS的患有临床低风险早期前列腺癌的患者中收集的,这些患者表现出早期DP或无痛性疾病(表1)。在来自发现队列的基线血浆中总共鉴定了269个独特的注释代谢物特征;14个特征表现出统计学显著性(Wilcoxon秩和检验,未调整p值<0.05)ROC AUC值>0.7。
表1:MDACC发现队列的患者特征。
14个特征中有7个是复合脂质;特别是鞘磷脂和鞘糖脂(表2)。
表2:发现队列中鉴定的代谢物特征
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
(a)氨基酸或酰胺(m)单酰基甘油
(b)碳水化合物(n)嘌呤/嘧啶
(c)肉毒碱(o)有机酸
(d)神经酰胺(p)其他
(e)二肽(q)磷脂酰胆碱
(f)外源(r)磷脂酰乙醇胺
(g)脂肪酸(s)磷脂酰肌醇
(h)鞘糖脂(t)前列腺素类
(i)激素(u)鞘磷脂
(j)脂质(v)固醇
(k)溶血磷脂酰胆碱(w)三酰基甘油
(l)溶血磷脂酰乙醇胺(x)维生素
尽管针对多重假设检验调整之后,14个特征中没有一个保持个体显著性,但显著升高的脂质与神经酰胺代谢有生化联系,这表明了协调的信号。此外,与对照(AS开始后至少5年内无疾病进展)相比,进展者案例(早期DP)的基线血浆样品中的鞘磷脂和鞘糖脂总体上升高(图1(a))。重要的是,与随访时间匹配的对照相比,在DP案例中检测到的SM和鞘糖脂仍然升高。在基线与基线后12个月观察到的SM和鞘糖脂的案例内比较没有统计学显著性(图2)。鉴于Cav-1的已知脂质转运功能(Cheng 2016),观察到的血浆鞘脂特征标记升高表明,在疾病进展的背景下,与先前的血浆Cav-1升高发现存在生物学联系。为了探索这一点,分析扩展到包括对459个基线血浆样品进行的非靶向代谢组学图谱分析,这些样品是前瞻性地从正在经受AS的患有早期前列腺癌的患者中收集的(表3)。
表3:MDACC验证队列的患者特征
^双侧Wilcoxon秩和检验
^^双侧Fisher精确检验
与最初的发现队列中的发现一致,多种SM和鞘糖脂与基于GS的DP正相关(危险比>1.5);(图1(b);表4)。
表4:MDACC验证队列中针对无进展生存率的各种代谢物的危险比
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
#作为连续变量处理
p值
(a)酰基肉毒碱 (g)鞘糖脂
(b)神经酰胺 (h)溶血磷脂
(c)胆固醇酯 (i)单酰基甘油
(d)二酰基甘油 (j)磷脂
(e)类花生酸 (k)鞘脂
(f)游离脂肪酸 (l)三酰基甘油
接下来,使用逻辑回归模型,从表现出统计学显著(p<0.05)HR的鞘脂集中开发了一个特征标记组套,其包括血浆Cav-1和在逻辑回归模型中表现出正β-估计值的六种鞘脂:SM(40:2)、SM(44:2)、乳糖神经酰胺(32:0)、乳糖神经酰胺(36:0)、三己糖神经酰胺(34:1)和己糖神经酰胺(40:0)。使用Cox模型的对数秩检验统计,计算血浆Cav-1-鞘脂特征标记的最佳截止点,该截止点将在AS中表现出疾病进展(定义为GS升级和/或肿瘤体积增加)的受试者与未表现出疾病进展的受试者之间产生最大差异。这得到4.33的截止值。使用Cox比例风险模型(Cox-proportional hazard model)实现该特征标记与无进展生存率的相关性的评估。在按年龄、5-α还原酶治疗和基线肿瘤体积调整的多变量分析中,血浆Cav-1-鞘脂特征标记评分>4.33的AS受试者与血浆Cav-1-鞘脂特征标记评分≤4.33的受试者相比,表现出统计学上显著更差的无DP生存率(HR:2.70,95%CI:1.75-4.16,p值:<0.001)(表5)。值得注意的是,非比例风险模型检验产生了不显著的p值。相关的是,在这项分析中,BMI与DP风险增加无关(HR:1.02,95%CI:0.40-2.64,p值:0.965),指示这种脂质特征标记不太可能因肥胖而有偏差。
表5:Cav-1-鞘脂特征标记和无疾病进展生存率的风险模型
表6和图1(c)提供了描绘血浆Cav-1-鞘脂特征标记评分低于截止值(<4.33)或等于截止值或高于截止值(≥4.33)的参与者的无进展生存率的Kaplan-Meier生存曲线。
表6.无进展生存率
Cav-1-鞘脂特征标记的多变量Cox比例风险模型及其与无疾病进展生存率的相关性。使用血浆Cav-1-鞘脂特征标记截止值4.33的Cox比例风险模型。如前所述,使用基于对数秩统计的方法得出血浆Cav-1-鞘脂特征标记的最佳截止值。基于向后逐步选择法(似然比),将年龄、5-α还原酶治疗和基线肿瘤体积(风险组1:1例阳性芯针活检,Gleason 3+3=6个患者中肿瘤病灶<3.0mm,或Gleason 3+4=7个患者中<2.0mm;风险组2:>1芯针或基线肿瘤长度大于风险组1)作为协变量纳入。
使用向后逐步方法(似然比)选择后将变量纳入方程/>
^每单位log 2增加
每单位增加
为了在Cav-1-鞘脂特征标记的背景下更好地定义脂质代谢和Cav-1之间的关系,首先使用癌症基因组图谱(The Cancer Genome Atlas,TCGA)比较了333例前列腺肿瘤中反映脂质管理器(lipid managing apparati)和CAV1 mRNA表达的基因表达谱。发现高CAV1mRNA表达与注释为与脂质清除和代谢、葡萄糖神经酰胺代谢过程以及神经酰胺途径有关的本体的基因正相关。接下来探讨了升高的CAV1和相关的脂质管理器与先前定义的原发性前列腺癌分子亚型(iClusters)的相关性。结果指示,高CAV1mRNA表达主要与iCluster 3相关,iCluster 3的特征在于PI3K/AKT、MAP-激酶和受体酪氨酸激酶活性升高。
实例6:Cav-1与高脂质清除表型的相关性
接下来评估Cav-1对胞外脂质可用性的反应。在比较有和没有脂质的无血清培养基时,脂质剥夺降低了RM-9和PC-3M前列腺癌细胞系中的Cav-1蛋白表达(图3(a)和图3(b))。值得注意的是,载脂蛋白、胆固醇或胆固醇酯的存在对于维持升高的Cav-1蛋白水平是不可或缺的,这表明Cav-1对胞外脂质复合物的磷脂成分具有特异性反应(图3(a)和图3(b))。
接下来探索Cav-1在脂质摄取中的参与。为此,接下来评估低Cav-1(图3(b))LNCaP与Cav-1阳性(图3(a))PC-3M和RM-9前列腺癌细胞系清除胞外荧光DiI缀合SSALP的能力。与LNCaP相比,PC-3M和RM-9前列腺癌细胞表现出显著更高的荧光积累(图3(d))。
实例7:Cav-1对鞘糖脂生物合成的调节
接下来进行LNCaP和PC-3M细胞的基线脂质谱的比较,以及在相应过表达Cav-1或瞬时敲除CAV1后的脂质谱的比较。图3(b)提供比较了分别地过表达Cav-1或瞬时敲除CAV1后LNCaP和PC-3M细胞中的全细胞裂解物Cav-1水平的免疫印迹。相对于基线LNCaP,基线PC-3M细胞表现出三酰甘油、胆固醇酯和溶血磷脂水平升高,而鞘脂降低。过表达Cav-1导致主要脂质分类的总体水平显著增加,而敲除Cav-1导致磷脂、二酰基甘油、鞘磷脂和鞘糖脂(特别是乳糖神经酰胺)的显著降低(图4(a)和图4(b))。然后利用CCLE和TCGA基因表达数据集来评价Cav-1和神经酰胺代谢中心酶之间的关系。对于CCLE数据,基于平均CAV1基因表达将前列腺癌细胞系分层为高表达CAV1的细胞系(log2值>11(范围11-01-13.61);HPrEC、DU145、PC-3)或低表达CAV1的细胞系(log2值<7(范围4.16-6.88);NCIH660、MDAPCa2B、LNCaP、VCaP、CWR22Rv1)。前列腺腺癌的TCGA数据被分层为最高或最低CAV1表达四分位数,以评价差异最大的群体中CAV1 mRNA表达和鞘脂代谢所涉及基因的mRNA表达之间的相关性。表7提供了基于整个TCGA前列腺腺癌数据集的Spearman相关分析,使用CAV1和鞘脂代谢所涉及基因的mRNA表达的连续值。与具有低CAV1 mRNA水平的那些相比,表现出高CAV1mRNA水平的前列腺癌细胞系和前列腺肿瘤也趋于表现出神经酰胺生物发生(包括二氢神经酰胺去饱和酶(DEGS)、神经酰胺合酶(CERS)和鞘磷脂酶(SPMD))所涉及基因的mRNA表达水平的降低(图5(a))和图5(b))。相比之下,鞘糖脂生物合成所涉及酶(包括葡萄糖神经酰胺合酶(UCGC)、乳糖神经酰胺合酶B4GALT5和B4GALT6)的mRNA表达在高CAV1前列腺癌细胞系和前列腺肿瘤中升高。
表7:Spearman相关分析
/>
(a)从头途径 (c)鞘磷脂酶途径
(b)鞘氨醇再循环 (d)鞘糖脂代谢
实例8:鞘磷脂作为神经酰胺和鞘糖脂的来源。
研究对作为神经酰胺及其鞘糖脂衍生物(通过糖基化)的潜在来源的胞外鞘磷脂的摄取。神经酰胺主要通过三种代谢途径衍生:从头途径、再循环途径或补救途径(图6)。通过补救途径进行的神经酰胺生物合成是通过鞘磷脂酶水解鞘磷脂介导的。
用含有鞘磷脂(d18:1/18:1)-氘(d)
实例9:Cav-1对线粒体组分的促进作用。
上述发现表明Cav-1相关机制框架将神经酰胺库导入鞘糖脂,这与鞘糖脂(特别是乳糖神经酰胺)是血浆鞘脂特征标记的关键特征的观察结果一致(图1(b))。神经酰胺是生物活性鞘脂,其积极参与介导细胞死亡,包括通过线粒体释放细胞色素c诱导凋亡,以及使线粒体靶向自噬体而引发致死的线粒体自噬。接下来在PC-3M(Cav-1高)和LNCaP(Cav-1低)细胞系中探讨了Cav-1和线粒体形态学之间的相关性。PC-3M细胞表现出分支更多的融合样线粒体结构,具有弥漫性溶酶体染色,而LNCaP细胞中线粒体和溶酶体的形态学更多呈点状(图8(a))。使用含有C11TopFluor-SM的荧光标记的SSALP,评估敲除CAV1后PC-3M细胞中鞘磷脂的差异运输。敲除CAV1导致统计学上显著地(双侧Tukey多重比较检验,调整后的p<0.001)降低对含有C11 TopFluor-SM的SSALP的摄取(图8(b)和图8(d))。值得注意的是,在PC-3M中敲除CAV1也导致点状线粒体的积累(图9;图10(a)和图10(b))和溶酶体存在率的降低(图9);如通过MitoTracker Red CMXRos(Poot 1996)和CellROX Deep red(图11、图10(c))评估的,这些变化伴随着活性氧种类的增加(双侧Tukey多重比较检验,调整后的p<0.001)。
实例10:富含Cav-1-鞘磷脂/乳糖神经酰胺的EV的释放。
先前已经证明前列腺癌细胞分泌膜相关Cav-1。与该先前报道一致,对CM的评估证实了来自PC-3M和RM-9前列腺癌细胞系的CM中Cav-1的可检测水平,但LNCaP并非如此。分别地过表达Cav-1或敲除CAV1后,从LNCaP和PC-3M的CM中分离胞外脂质囊泡(EV),证实Cav-1存在于EV上(图8(d)和图12(a)和图12(b))。值得注意的是,当培养基补充有外源性低密度脂蛋白时,含有Cav-1的EV的量明显更高(图12(b)),这与早期的观察结果一致,即裂解物Cav-1蛋白表达对胞外脂质可用性有反应(图3(a))。相应地,与相应的对照相比,在LNCaP中过表达Cav-1后,CM中EV颗粒的浓度在统计学上显著更高(曲线下面积的比较,双侧学生t检验,p:0.02),而在敲除CAV1后来自PC-3M的CM中的EV数量在统计学上显著降低(曲线下面积的比较,双侧学生t检验,p<0.001)(图12(c)和图12(d))。此外,通过使用密度梯度分级确定,含有Cav-1的EV最高度富含1.06-1.15g mL
为了确定EV的脂质组成和蛋白货物,分别使用质谱对衍生自LNCaP和PC-3M的EV进行脂质组学和蛋白质组学分析。与其他人的发现一致,对EV-脂质组的分析鉴定特别富含鞘脂以及磷脂酰胆碱。有趣的是,心磷脂(线粒体内膜的重要脂质成分)被发现存在于前列腺癌细胞系衍生的EV中。对EV-蛋白质组的评价分别在LNCaP和PC-3M衍生的EV中鉴定了237和341个(≥5光谱丰度)高置信度蛋白。为了研究蛋白质特征的功能方面,基于分区定位证据数据库评分[doi.org/10.1093/database/bau012],进行亚细胞定位分析,筛选按置信度分配给以下11个亚细胞定位中至少一处的基因(置信度评分≥2):细胞核、胞质溶胶、细胞骨架、过氧化物酶体、溶酶体、内质网、高尔基体、质膜、内体、胞外间隙和线粒体(图14)。对EV衍生的蛋白质特征的亚细胞定位分析为被注释为定位于线粒体的蛋白质的表现形式提供了证据(图13(c);图14)。对在PC-3M衍生的EV中检测到的341个蛋白质特征的IPA分析揭示了小窝介导的内吞作用和吞噬体成熟(作为上层网络),并且作为上层激活疾病功能预测了凋亡和坏死的降低以及细胞运动、脱颗粒和细胞增殖的增加(表8和9)。
表8:疾病功能
表9:独创性规范途径
总之,这些发现指示前列腺癌细胞稳健分泌含有Cav-1的富含鞘脂的EV,这些EV富含不同蛋白质谱,包括线粒体相关蛋白和脂质。基于这些发现,Cav-1介导的鞘磷脂摄取(图8(b))和图8(c))、鞘磷脂转化为神经酰胺及其后续的鞘糖脂衍生物(图7(b))、以及EV货物中线粒体蛋白的纳入(图12(c))、图12(d))和图14)显然与线粒体组分的清除相关。
实例11:使神经酰胺向鞘糖脂分流的靶向性
适应性Cav-1介导的鞘糖脂机制的这些发现表明,神经酰胺向鞘糖脂转化的靶向性可能表示前列腺癌中可操作的代谢脆弱性。为了检验这一假设,然后评价了PDMP、PPMP和依利格鲁司特,即葡萄糖神经酰胺合酶(也称为UGCG;UDP-葡萄糖:神经酰胺葡萄糖基转移酶,鞘糖脂代谢中的限速酶)的三种不同抑制剂,对于降低体外RM-9和PC-3M前列腺癌细胞的活力的功效。用PDMP、PPMP和依利格鲁司特处理RM-9和PC-3M前列腺癌细胞导致剂量依赖性细胞毒性(图15)。接下来,评价了RM-9和PC-3M前列腺癌细胞中UGCG药理学抑制后脂质组的变化。用PDMP、PPMP、依利格鲁司特或运载体激发RM-9和PC-3M细胞,并在处理6小时后进行评价,以捕捉早期代谢变化(特别是鞘脂代谢)并减轻可能导致神经酰胺库升高和GLS表达降低的继发性事件的影响,这些继发性事件可能因细胞生存率降低而发生。用PDMP、PPMP或依利格鲁司特对RM-9和PC-3M前列腺细胞的短期(6小时)激发导致细胞内神经酰胺、酰基肉毒碱、溶血磷脂和二酰基甘油的积累以及鞘糖脂、磷脂和三酰基甘油的降低(图15、图16)。值得注意的是,依利格鲁司特的急性细胞毒性作用是通过非凋亡机制介导的(图16(a))。磷脂和三酰基甘油的降低偶联其下游分解代谢物的升高表明了线粒体自噬。与此一致,用依利格鲁司特处理PC-3M细胞增加了线粒体自噬相关标志物LC3B-II的蛋白表达(图14)。在用依利格鲁司特急性(6小时)处理后对PC-3M细胞中线粒体形态学的评估指示了分支的融合样线粒体结构的丧失和与溶酶体同定位的点状线粒体的积累(图17);这些变化遭遇Parkin和PINK1蛋白表达的增加,进一步表明线粒体自噬的增加。先前的报道表明,神经酰胺使自噬体靶向线粒体,诱导致死的线粒体自噬。值得注意的是,敲除CAV1或用Cav-1特异性单克隆抗体(Cav-1mAb)预处理进一步使PC-3M细胞对依利格鲁司特敏感化,而在LNCaP中过表达Cav-1降低了依利格鲁司特的抗癌作用(图18)。
实例12:依利格鲁司特对RM-9肿瘤生长的抑制
接下来检查依利格鲁司特对肿瘤生长的抑制。RM-9细胞含有驱动致癌RAS和MYC基因,它们模仿与侵袭性原发性前列腺癌相关的RAS-MAPK途径激活和MYC驱动转录活性。将RM-9-萤光素酶细胞皮下植入C57BL/6N小鼠体内。RM-9肿瘤生长被依利格鲁司特抑制(图19(a))、图19(b))和图19(c))。对来自所有处理组的肿瘤组织的代谢组学分析显示,依利格鲁司特与携带RM-9肿瘤的小鼠中鞘糖脂的降低有联系(图19(d))。肿瘤组织的免疫组织化学分析指示,用依利格鲁司特处理在统计学上显著降低了Cav-1和PCNA染色(双侧Wilcoxon秩和检验,分别地,p:0.008和0.001),而BrdU-TUNEL和线粒体自噬相关标志物(LC3B和HMGB1)染色在统计学上显著增加(双侧Wilcoxon秩和检验,p:0.008(对于所有三种标志物))(图20)。值得注意的是,这些结果指示RM-9肿瘤与血浆脂质特征标记相关,这类似于在前列腺癌患者中观察到的,包括几种鞘磷脂和鞘糖脂的升高(图20)。此外,与对照小鼠相比,携带RM-9肿瘤的小鼠的血浆Cav-1水平趋于升高。有趣的是,在携带RM-9肿瘤的小鼠中,用依利格鲁司特处理后,Cav-1和作为Cav-1鞘脂特征标记的一部分的已鉴定脂质种类的血浆水平增加。在携带RM-9肿瘤的小鼠中用依利格鲁司特处理也导致统计学上显著的增加(双侧Wilcoxon秩和检验,p:0.004),表明血浆Cav-1和鞘脂的升高可能是细胞死亡的结果(图19(a)、图19(b)和图19(c))。
实例13:生物标志物评分的计算
使用血浆Cav-1-鞘脂特征标记特征的测量浓度来计算基于逻辑回归模型的生物标志物评分。在该前列腺癌进展模型中,将血浆分析物特征标记特征的值组合成适用于预测疾病进展风险的模型。
下表示出了实际危险率与基线危险率之间的比率,以及在生物标志物组套评分的不同截止点处的危险率。这里,危险被定义为作为时间的函数的事件(即疾病进展)风险,其中危险率>1意味着疾病进展的时间更短。
该表显示了作为模型评分的函数的两个事物。第一个是相对于给定特征标记的计算“基线危险率”的进展风险,第二个考虑了使用特征标记评分作为分类器截点;最后一列则给出了高评分组和低评分组之间疾病进展的相对风险,即“危险比”。
表格的第一列显示了主动监测队列中的生物标志物组套评分,第二列描述了实际危险相对于基线危险的变化,第三列示出了危险比以及对应的95%置信区间,基于使用生物标志物组套评分的不同截止点对群体进行的二分法。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
实例14:验证研究
为了评估主动监测前列腺癌的男性中前列腺癌疾病进展的风险,使用248名参与者(35名进展者,213名非进展者)的队列进行了一项独立的验证研究。在每个参与者中测试了血浆鞘脂特征标记(SphingoSignature)(三己糖神经酰胺(34:1)、乳糖神经酰胺(36:0)、乳糖神经酰胺(32:0)、SM(44:2)、SM(40:2))和简化鞘脂特征标记[简化特征标记,由三己糖神经酰胺(34:1)、乳糖神经酰胺(36:0)和SM(40:2)组成]的水平。Cav-1未被纳入本分析中。该模型是使用先前描述的逻辑回归的固定系数推导出来的。
在队列样品中发现三己糖神经酰胺(34:1)和SM(40:2)连同简化鞘脂特征标记具有统计学上显著的每单位增加优势比,而三己糖神经酰胺(40:0)是不可量化的(参见图21)。
其他实施例
提供以上列出的详细说明以帮助本领域技术人员实践本披露。然而,本文描述和要求保护的披露不限于本文披露的特定实施例的范围,因为这些实施例旨在作为本披露几个方面的说明。任何等效实施例都旨在处于本披露的范围内。事实上,除了本文示出并且描述的那些,本披露的各种修改从前述说明书对于本领域技术人员来说也将变得清楚,这不偏离本发明的精神或范围。这样的修改也旨在落入所附权利要求的范围内。
- 一种分体式环境试验箱及测试方法
- 一种分体式环境试验箱
