用于治疗癌症的组合疗法
文献发布时间:2024-04-18 20:01:23
交叉引用
本申请要求2020年6月24日提交的美国临时申请第63/043,342号和2021年3月17日提交的美国临时申请第63/162,184号的权益,所述美国临时申请通过引用并入本文。
背景技术
癌症,即细胞增殖不受控制,是一种特征在于肿瘤形成、生长,并且在一些情况下转移的多因素疾病。可通过精巧的肿瘤抑制网络阻止携带激活的致癌基因、受损的基因组或其他促进癌症的改变的细胞复制。这个肿瘤抑制网络的中心组分是p53,其是细胞中最强力肿瘤抑制因子之一。p53的野生型构象与突变构象两者均牵涉于癌症的进展中。
援引并入
本申请中引用的每个专利、出版物和非专利文献在此通过引用以它的整体并入本文,就好像各自单独地通过引用并入本文一样。
发明内容
本文提供了一种治疗有需要的对象的癌症的方法,所述方法包括:(i)向所述对象施用治疗有效量的化合物,其中所述化合物结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
本文还提供了一种治疗有需要的对象的癌症的方法,所述方法包括:(i)向所述对象施用治疗有效量的增加所述对象中突变p53蛋白的抗癌活性的化合物;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
本文还提供了一种治疗癌症的方法,所述方法包括:(i)向有需要的对象施用治疗有效量的结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的化合物;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的额外抗癌剂,其中如果在于第一患者群体和第二患者群体中进行的治疗所述癌症的对照研究中:(a)确定所述第一患者群体的第一中值存活时间,其中所述第一患者群体用所述治疗有效量的结合至突变p53蛋白并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的所述化合物治疗;并且(b)确定所述第二患者群体的第二中值存活时间,其中所述第二患者群体用所述治疗有效量的结合至突变p53蛋白并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的所述化合物以及所述治疗有效量的所述额外治疗剂治疗;则所述第二中值存活时间比所述第一中值存活时间长至少约50%。
附图说明
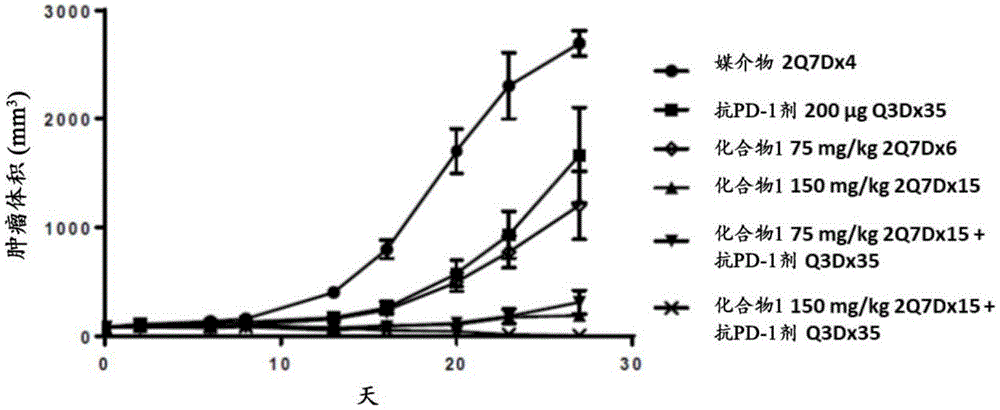
图1显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,小鼠同基因肉瘤模型(MT373)中的肿瘤体积(mm
图2显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,小鼠同基因肉瘤模型(MT373)中的肿瘤体积(mm
图3显示在接受用媒介物;200μg抗PD-1剂;75mg/kg化合物1;150mg/kg化合物1;75mg/kg化合物1+抗PD-1剂;或150mg/kg化合物1+抗PD-1剂进行的治疗后,用MT373小鼠同基因肉瘤肿瘤植入的个体C57B1/6小鼠中肿瘤体积(mm
图4显示在接受用媒介物;抗PD-1剂;75mg/kg化合物1;150mg/kg化合物1;75mg/kg化合物1+抗PD-1剂;或150mg/kg化合物1+抗PD-1剂进行的治疗后,小鼠的存活百分比的变化。
图5显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,用MT373小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠的体重变化百分比的变化。
图6显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠中的肿瘤体积(mm
图7显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠中的肿瘤体积(mm
图8显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的个体C57B1/6小鼠中肿瘤体积(mm
图9提供在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的C57B1/6小鼠的卡普兰-迈耶(Kaplan-Meier)存活曲线。
图10显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的C57B1/6小鼠的体重百分比的变化。
图11显示在接受用媒介物;150mg/kg化合物1(Q7D×2);300mg/kg化合物1(Q7D×2);或600mg/kg化合物1(Q7D×2)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的C57B1/6小鼠的肿瘤体积(mm
图12显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的肿瘤体积(mm
图13显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的肿瘤体积(mm
图14显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的个体C57B1/6小鼠的肿瘤体积(mm
图15显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的存活百分比的变化。
图16显示在接受用媒介物;抗PD-1剂;50mg/kg化合物2(QD);100mg/kg化合物2(QD);或50mg/kg化合物2(QD)+抗PD-1剂进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的存活百分比的变化。
图17显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的体重百分比的变化。
具体实施方式
本发明提供了用于恢复突变p53的野生型功能的化合物和方法。本发明的化合物可结合至突变p53,并且恢复p53突变体结合DNA的能力。p53突变体的活性的恢复可允许激活p53的下游效应物,从而导致抑制癌症进展。本发明还提供了治疗具有p53突变的癌性病变或肿瘤的方法。
癌症是特征在于细胞增殖不受控制,具有全身转移的可能性的一系列相关疾病。癌症可分类成五大类,包括例如:上皮癌,其可由覆盖身体的内部和外部部分诸如肺、乳腺和结肠的细胞产生;肉瘤,其可由位于骨、软骨,脂肪、结缔组织、肌肉和其他支持组织中的细胞产生;淋巴瘤,其可在淋巴结和免疫系统组织中产生;白血病,其可在骨髓中产生,并且在血流中积累;以及腺瘤,其可在甲状腺、垂体腺、肾上腺和其他腺组织中产生。
尽管不同癌症可在几乎任何身体组织中显现,并且含有独特特征,但导致癌症的基本过程在该疾病的所有形式中都可为类似的。当细胞逃脱对细胞分裂的正常约束,并且开始不受控制地生长和分裂时,癌症就开始了。细胞中的遗传突变可阻碍细胞修复受损DNA或引发凋亡的能力,并且可导致细胞的生长和分裂不受控制。
肿瘤细胞群体繁殖的能力不仅由细胞增殖的速率决定,而且还由细胞消耗的速率决定。程序性细胞死亡或凋亡代表细胞消耗的主要机制。癌细胞可通过多种策略逃避凋亡,例如通过抑制p53功能,由此抑制促凋亡蛋白的表达。
致癌基因和肿瘤抑制基因可调节细胞的增殖。遗传突变可影响致癌基因和肿瘤抑制因子,从而潜在地异常激活或抑制活性,这进一步促进不受控制的细胞分裂。尽管致癌基因有助于细胞生长,但肿瘤抑制基因通过修复受损DNA和激活凋亡来减缓细胞分裂。在癌症中可突变的细胞致癌基因包括例如Cdk1、Cdk2、Cdk3、Cdk4、Cdk6、EGFR、PDGFR、VEGF、HER2、Raf激酶、K-Ras和myc。在癌症中可突变的肿瘤抑制基因包括例如BRCA1、BRCA2、周期蛋白依赖性激酶抑制因子1C、视网膜母细胞瘤蛋白(pRb)、PTEN、p16、p27、p53和p73。
肿瘤抑制因子p53。
肿瘤抑制蛋白p53是一种具有393个氨基酸的转录因子,其可响应于细胞应激来调节细胞生长,该细胞应激包括例如紫外辐射、低氧、致癌基因激活和DNA损伤。p53具有各种用于抑制癌症进展的机制,包括例如引发凋亡、维持基因组稳定性、细胞周期阻滞、诱导衰老和抑制血管生成。归因于p53在肿瘤抑制中的关键作用,p53在几乎所有癌症中都通过直接突变或通过涉及于肿瘤抑制中的相关信号传导通路的扰动而失活。p53基因的纯合性丧失发生在几乎所有类型的癌症中,包括乳腺癌、结肠癌和肺癌。在若干类型的人类癌症中,某些p53突变的存在可与不太有利的患者预后相关联。
在不存在应激信号下,通过p53与E3泛素连接酶Mdm2的相互作用,p53水平维持在低水平下。在未受应激的细胞中,Mdm2可靶向p53以通过蛋白酶体进行降解。在应激条件下,Mdm2与p53之间的相互作用被破坏,并且p53积累。导致p53激活的关键事件是由蛋白激酶对p53的N末端结构域的磷酸化,由此转导上游应激信号。p53的磷酸化导致构象变化,该构象变化可促进由p53进行的DNA结合,并且允许下游效应物的转录。p53的激活可诱导例如内在凋亡通路、外在凋亡通路、细胞周期阻滞、衰老和DNA修复。p53可激活涉及于以上通路中的蛋白质,包括例如Fas/Apo1、KILLER/DR5、Bax、Puma、Noxa、Bid、胱天蛋白酶-3(caspase-3)、胱天蛋白酶-6、胱天蛋白酶-7、胱天蛋白酶-8、胱天蛋白酶-9和p21(WAF1)。另外,p53可阻遏包括例如c-MYC、周期蛋白B(Cyclin B)、VEGF、RAD51和hTERT的多种基因的转录。
p53四聚体的每个链由包括反式激活结构域(氨基酸1-100)、DNA结合结构域(氨基酸101-306)和四聚化结构域(氨基酸307-355)的若干功能性结构域组成,该若干功能性结构域可高度移动,并且基本上是非结构化的。大多数p53癌症突变位于蛋白质的DNA结合核心结构域中,该DNA结合核心结构域含有反平行β-片层的中心β-夹层结构,该中心β-夹层结构充当DNA结合表面的基本支架。DNA结合表面由例如在Arg175和Arg248处通过锌离子来稳定的两个β-转角环L2和L3以及环-片层-螺旋基序组成。总之,这些结构元件形成富含带正电荷的氨基酸,并且与各种p53应答元件进行特异性接触的延伸的DNA结合表面。
归因于p53突变在几乎每种类型的癌症中的普遍性,再激活癌性细胞中的野生型p53功能可为一种有效疗法。p53中位于蛋白质的DNA结合结构域或DNA结合表面的周边中的突变导致为DNA识别和结合所需的蛋白质折叠异常。p53中的突变可例如发生在氨基酸Val143、His168、Arg175、Tyr220、Gly245、Arg248、Arg249、Phe270、Arg273和Arg282处。可消除p53的活性的p53突变包括例如R175H、Y220C、G245S、R248Q、R248W、R273H和R282H。这些p53突变可扭曲DNA结合位点的结构,或使折叠的蛋白质在体温下在热力学上去稳定。p53突变体的野生型功能可通过p53突变体与可使折叠-解折叠平衡朝向折叠状态转移,由此降低解折叠和去稳定的速率的化合物的结合来恢复。
氨基酸的非限制性实例包括:丙氨酸(A,Ala);精氨酸(R,Arg);天冬酰胺(N,Asn);天冬氨酸(D,Asp);半胱氨酸(C,Cys);谷氨酸(E,Glu);谷氨酰胺(Q,Gln);甘氨酸(G,Gly);组氨酸(H,His);异亮氨酸(I,Ile);亮氨酸(L,Leu);赖氨酸(K,Lys);甲硫氨酸(M,Met);苯丙氨酸(F,Phe);脯氨酸(P,Pro);丝氨酸(S,Ser);苏氨酸(T,Thr);色氨酸(W,Trp);酪氨酸(Y,Tyr);以及缬氨酸(V,Val)。
本发明的化合物的机制。
本发明的化合物可选择性结合至p53突变体,并且可恢复该p53突变体的野生型活性,包括例如DNA结合功能和激活涉及于肿瘤抑制中的下游靶标。在一些实施方案中,本发明的化合物选择性结合至p53 Y220C突变体。Y220C突变体是一种温度敏感性突变体,其在较低温度下结合至DNA,并且在体温下变性。本发明的化合物可使Y220C突变体稳定以降低蛋白质在体温下变性的可能性。
在一些实施方案中,本公开的化合物使突变p53稳定,并且允许该突变p53结合至DNA,由此使野生型p53蛋白和突变p53蛋白的平衡向野生型p53转移。在一些实施方案中,本公开的化合物再激活突变p53蛋白以提供野生型p53活性。在一些实施方案中,本公开的化合物再激活突变p53蛋白以提供促凋亡p53活性。在一些实施方案中,本公开的化合物再激活突变p53蛋白以阻断血管生成。在一些实施方案中,本公开的化合物再激活突变p53蛋白以诱导细胞衰老。在一些实施方案中,本公开的化合物再激活突变p53蛋白以诱导细胞周期阻滞。
在一些实施方案中,本公开的化合物可使突变p53重新符合p53的展现抗癌活性的构象。在一些实施方案中,使突变p53重新符合p53的野生型构象。在一些实施方案中,使突变p53重新符合p53的促凋亡构象。在一些实施方案中,使突变p53重新符合p53的阻断血管生成的构象。在一些实施方案中,使突变p53重新符合p53的诱导细胞衰老的构象。在一些实施方案中,使突变p53重新符合p53的诱导细胞周期阻滞的构象。
位于连接β-折叠股S7和S8的p53β-夹层结构的周边中,Y220的芳族环是β-夹层结构的疏水性核心的不可缺少的部分。由于内表面空腔的形成,所以Y220C突变可为高度致使去稳定的。本发明的化合物可结合至并占据这个表面裂缝以使β-夹层结构稳定,由此恢复野生型p53 DNA结合活性。
为确定本发明的化合物结合和稳定突变p53的能力,可采用测定来检测例如p53突变体的构象变化或野生型p53靶标的激活。p53的构象变化可通过例如差示扫描荧光测定法(DSF)、等温滴定量热法(ITC)、核磁共振波谱法(NMR)或X射线晶体照相术来测量。另外,可使用对p53的突变构象的野生型具有特异性的抗体来通过例如免疫沉淀(IP)、免疫荧光(IF)或免疫印迹检测构象变化。
用于检测p53突变体结合DNA的能力的方法可包括例如DNA亲和免疫印迹、改良酶联免疫吸附测定(ELISA)、电泳迁移率变动测定(EMSA)、荧光共振能量转移(FRET)、均相时间分辨荧光(HTRF)和染色质免疫沉淀(ChIP)测定。
为确定本文所述的化合物是否能够再激活p53的转录活性,可测量p53信号传导级联中的下游靶标的激活。p53效应蛋白的激活可通过例如免疫组织化学分析(IHC-P)、逆转录聚合酶链式反应(RT-PCR)和western印迹来检测。p53的激活还可通过对经由胱天蛋白酶级联达成的凋亡的诱导以及使用包括例如膜联蛋白V(Annexin V)染色、TUNEL测定、胱天蛋白酶原和胱天蛋白酶水平和细胞色素c水平的方法来测量。p53激活的另一结果是衰老,其可使用诸如β-半乳糖苷酶染色的方法测量。
可用于确定本发明的化合物增加p53突变体的DNA结合能力的有效性的p53突变体是p53截短突变体,其仅含有氨基酸94-312,涵盖p53的DNA结合结构域。举例来说,用于测试化合物功效的p53 Y220C突变体的序列可为:
相较于在不存在本发明的化合物下p53突变体结合DNA的能力,本发明的化合物可使p53突变体结合DNA的能力增加至少或至多约0.1%、至少或至多约0.2%、至少或至多约0.3%、至少或至多约0.4%、至少或至多约0.5%、至少或至多约0.6%、至少或至多约0.7%、至少或至多约0.8%、至少或至多约0.9%、至少或至多约1%、至少或至多约2%、至少或至多约3%、至少或至多约4%、至少或至多约5%、至少或至多约6%、至少或至多约7%、至少或至多约8%、至少或至多约9%、至少或至多约10%、至少或至多约11%、至少或至多约12%、至少或至多约13%、至少或至多约14%、至少或至多约15%、至少或至多约16%、至少或至多约17%、至少或至多约18%、至少或至多约19%、至少或至多约20%、至少或至多约21%、至少或至多约22%、至少或至多约23%、至少或至多约24%、至少或至多约25%、至少或至多约26%、至少或至多约27%、至少或至多约28%、至少或至多约29%、至少或至多约30%、至少或至多约31%、至少或至多约32%、至少或至多约33%、至少或至多约34%、至少或至多约35%、至少或至多约36%、至少或至多约37%、至少或至多约38%、至少或至多约39%、至少或至多约40%、至少或至多约41%、至少或至多约42%、至少或至多约43%、至少或至多约44%、至少或至多约45%、至少或至多约46%、至少或至多约47%、至少或至多约48%、至少或至多约49%、至少或至多约50%、至少或至多约51%、至少或至多约52%、至少或至多约53%、至少或至多约54%、至少或至多约55%、至少或至多约56%、至少或至多约57%、至少或至多约58%、至少或至多约59%、至少或至多约60%、至少或至多约61%、至少或至多约62%、至少或至多约63%、至少或至多约64%、至少或至多约65%、至少或至多约66%、至少或至多约67%、至少或至多约68%、至少或至多约69%、至少或至多约70%、至少或至多约71%、至少或至多约72%、至少或至多约73%、至少或至多约74%、至少或至多约75%、至少或至多约76%、至少或至多约77%、至少或至多约78%、至少或至多约79%、至少或至多约80%、至少或至多约81%、至少或至多约82%、至少或至多约83%、至少或至多约84%、至少或至多约85%、至少或至多约86%、至少或至多约87%、至少或至多约88%、至少或至多约89%、至少或至多约90%、至少或至多约91%、至少或至多约92%、至少或至多约93%、至少或至多约94%、至少或至多约95%、至少或至多约96%、至少或至多约97%、至少或至多约98%、至少或至多约99%、至少或至多约100%、至少或至多约125%、至少或至多约150%、至少或至多约175%、至少或至多约200%、至少或至多约225%或至少或至多约250%。
本文所述的化合物可增加p53突变体的活性,该活性是在不存在该化合物下p53突变体的活性的例如至少或至多约2倍、至少或至多约3倍、至少或至多约4倍、至少或至多约5倍、至少或至多约6倍、至少或至多约7倍、至少或至多约8倍、至少或至多约9倍、至少或至多约10倍、至少或至多约11倍、至少或至多约12倍、至少或至多约13倍、至少或至多约14倍、至少或至多约15倍、至少或至多约16倍、至少或至多约17倍、至少或至多约18倍、至少或至多约19倍、至少或至多约20倍、至少或至多约25倍、至少或至多约30倍、至少或至多约35倍、至少或至多约40倍、至少或至多约45倍、至少或至多约50倍、至少或至多约55倍、至少或至多约60倍、至少或至多约65倍、至少或至多约70倍、至少或至多约75倍、至少或至多约80倍、至少或至多约85倍、至少或至多约90倍、至少或至多约95倍、至少或至多约100倍、至少或至多约110倍、至少或至多约120倍、至少或至多约130倍、至少或至多约140倍、至少或至多约150倍、至少或至多约160倍、至少或至多约170倍、至少或至多约180倍、至少或至多约190倍、至少或至多约200倍、至少或至多约250倍、至少或至多约300倍、至少或至多约350倍、至少或至多约400倍、至少或至多约450倍、至少或至多约500倍、至少或至多约550倍、至少或至多约600倍、至少或至多约650倍、至少或至多约700倍、至少或至多约750倍、至少或至多约800倍、至少或至多约850倍、至少或至多约900倍、至少或至多约950倍、至少或至多约1,000倍、至少或至多约1,500倍、至少或至多约2,000倍、至少或至多约3,000倍、至少或至多约4,000倍、至少或至多约5,000倍、至少或至多约6,000倍、至少或至多约7,000倍、至少或至多约8,000倍、至少或至多约9,000倍或至少或至多约10,000倍。
本发明的化合物可例如用于诱导细胞的凋亡、细胞周期阻滞或衰老。在一些实施方案中,细胞是癌细胞。在一些实施方案中,细胞携带p53中的突变。
本发明的化合物。
在一些实施方案中,本公开的化合物包含被取代的杂环基,其中该化合物结合突变p53蛋白,并且增加该突变蛋白的野生型p53活性。在一些实施方案中,本公开的化合物包含含有卤基取代基的杂环基,其中该化合物结合突变p53蛋白,并且增加该突变蛋白的野生型p53活性。在一些实施方案中,化合物还包含吲哚基团。在一些实施方案中,吲哚基团在吲哚基团的1位处具有1,1,1,-三氟乙基取代基。
在一些实施方案中,吲哚基团在吲哚基团的2位处具有炔丙基取代基。在一些实施方案中,炔丙基取代基通过炔丙基取代基的sp碳原子连接于吲哚基团。在一些实施方案中,炔丙基取代基通过炔丙基取代基的亚甲基连接于苯胺基团的氮原子。在一些实施方案中,吲哚基团在吲哚基团的4位处包含氨基取代基。在一些实施方案中,氨基取代基连接于杂环基。在一些实施方案中,杂环基是哌啶基团。在一些实施方案中,卤基取代基是氟基。在一些实施方案中,卤基取代基是氯基。在一些实施方案中,化合物具有的口服生物利用度比在杂环基上缺乏卤基取代基的类似化合物的口服生物利用度大至少约50%。
本发明的化合物的非限制性实例包括具有下式中的任一者的化合物:
/>
/>
/>
/>
在一些实施方案中,化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-A是连接基团;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,A是亚烷基、亚烯基或亚炔基,其各自是被取代的或未被取代的。在一些实施方案中,A是亚烷基。在一些实施方案中,A是亚烯基。在一些实施方案中,A是亚炔基。
在一些实施方案中,A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。在一些实施方案中,A是被取代的芳基。在一些实施方案中,A是被取代的杂芳基。在一些实施方案中,A是被取代的杂环基。
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-环A是环状基团;
-R
-R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,本发明的化合物是下式化合物:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-环A是环状基团;
-R
-R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,虚线键的模式被选择以提供芳族系统,例如吲哚、吲哚啉、吡咯并吡啶、吡咯并嘧啶或吡咯并吡嗪。
在一些实施方案中,X
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,环A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。在一些实施方案中,环A是被取代的芳基。在一些实施方案中,环A是被氟基-取代的芳基。在一些实施方案中,环A是被氯基-取代的芳基。在一些实施方案中,环A是被取代的杂芳基。在一些实施方案中,环A是被氟基-取代的杂芳基。在一些实施方案中,环A是被氯基-取代的杂芳基。在一些实施方案中,环A是被取代的杂环基。在一些实施方案中,环A是被氟基-取代的杂环基。在一些实施方案中,A是被氯基-取代的杂环基。
在一些实施方案中,环A是哌啶基、哌嗪基、四氢吡喃基、吗啉基或吡咯烷基,其各自独立地是被取代的或未被取代的。在一些实施方案中,环A是哌啶基、哌嗪基、四氢吡喃基、吗啉基或吡咯烷基,其各自独立地被至少卤基-取代。在一些实施方案中,环A是被卤基-取代的哌啶基。在一些实施方案中,环A是被卤基-取代的甲基哌啶基。在一些实施方案中,环A是3-氟-1-甲基哌啶基。在一些实施方案中,环A是3-氟-1-(2-羟基-3-甲氧基丙基)哌啶基。在一些实施方案中,环A是被至少卤基-取代的四氢吡喃基。
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
在一些实施方案中,Q
在一些实施方案中,Y是N。在一些实施方案中,Y是O。在一些实施方案中,Y不存在。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
在一些实施方案中,化合物具有下式:
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
在一些实施方案中,化合物具有下式:
R
在一些实施方案中,R
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
其中该环是被取代的或未被取代的。在一些实施方案中,环被卤基-取代。在一些实施方案中,环被氟基取代。在一些实施方案中,R
R
在一些实施方案中,R
R
在一些实施方案中,R
R
R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
其中:
-R
-每个R
-y是0、1、2、3或4;
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,每个R
在一些实施方案中,y是1。在一些实施方案中,y是2。在一些实施方案中,y是3。在一些实施方案中,y是4。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
在一些实施方案中,化合物具有下式:
在一些实施方案中,化合物具有下式:
在一些实施方案中,每个R
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中:
-Q
-R
-每个R
-每个Z
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,Z
在一些实施方案中,化合物具有下式:
其中:
-R
-每个R
-y是0、1、2、3或4;
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
/>
其中:
-每个R
-y是0、1、2、3或4;
-每个R
-每个R
-R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
其中R
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
/>
/>
或前述化合物中的任一者的药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
/>
或前述化合物中的任一者的药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
/>
/>
或前述化合物中的任一者的药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
/>
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括以下:
或其药学上可接受的盐。
在一些实施方案中,本公开提供了一种化合物,该化合物包含:吲哚基团,其中该吲哚基团包含:a)在该吲哚基团的1位处的卤代烷基;b)在该吲哚基团的2位处的第一取代基,其中该第一取代基是环状基团;和c)第二取代基,其中该第二取代基被至少卤基-取代;或其药学上可接受的盐。
在一些实施方案中,环状基团是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。在一些实施方案中,环状基团是未被取代的芳基。在一些实施方案中,环状基团是被取代的芳基。在一些实施方案中,环状基团是被取代的苯基。在一些实施方案中,环状基团是被取代的或未被取代的杂芳基。在一些实施方案中,杂芳基是芳族5元或6元单环。在一些实施方案中,杂芳基是噻唑基、噻二唑基、吡唑基、噻吩基或噁二唑基。在一些实施方案中,杂芳基是吡啶基或嘧啶基。
在一些实施方案中,第二取代基在吲哚基团的4位处。在一些实施方案中,第二取代基是被取代的或未被取代的第二环状基团。在一些实施方案中,第二环状基团是杂环基。在一些实施方案中,杂环基是哌啶基。在一些实施方案中,杂环基是四氢吡喃基。在一些实施方案中,杂环基被氟基-取代。在一些实施方案中,杂环基被氯基-取代。在一些实施方案中,卤代烷基是三氟乙基。
在一些实施方案中,本公开提供了一种化合物,该化合物包含吲哚基团,其中该吲哚基团包含:a)在该吲哚基团的3位处的被取代的或未被取代的非环状基团;和b)在该吲哚基团的2位处的被取代的或未被取代的环状基团,其中相对于在不存在该化合物下p53突变体的生物活性构象的稳定性,该化合物增加该p53突变体的生物活性构象的稳定性;或其药学上可接受的盐。
在一些实施方案中,非环状基团是氢。在一些实施方案中,非环状基团是卤基-。在一些实施方案中,环状基团是芳基、杂芳基、杂环基或亚环烷基,其各自是被取代的或未被取代的。在一些实施方案中,环状基团是芳基或杂芳基,其各自是被取代的或未被取代的。在一些实施方案中,环状基团是被取代的芳基。在一些实施方案中,环状基团是被取代的苯基。在一些实施方案中,环状基团是被以下取代的苯基:烷基、环烷基、烷氧基、胺基团、羧基、羧酸基团、碳酰胺基团或酰胺基团,其各自是被取代的或未被取代的;氰基、卤基-或氢。
在一些实施方案中,环状基团是被取代的杂芳基。在一些实施方案中,环状基团是包含1、2或3个杂原子作为环成员的芳族5元、6元、7元或8元单环环系统,其中每个杂原子独立地选自O、N或S。在一些实施方案中,环状基团是吡啶基、嘧啶基、噻二唑基、噻唑基、吡唑基、噻吩基或噁二唑基,在一些实施方案中,环状基团是1,3,5-噻二唑-2-基。在一些实施方案中,环状基团是1,3,4-噁二唑-2-基或1,2,4-噁二唑-2-基。在一些实施方案中,环状基团是吡啶基。
在一些实施方案中,吲哚基团还包含在吲哚基团的4位处的取代基。在一些实施方案中,取代基是被取代的或未被取代的氨基。在一些实施方案中,氨基被第二环状基团取代。在一些实施方案中,第二环状基团是被至少卤基-取代的杂环基。在一些实施方案中,杂环基被至少氟基-取代。在一些实施方案中,杂环基被至少氯基-取代。在一些实施方案中,杂环基是哌啶基。在一些实施方案中,杂环基是四氢吡喃基。
本公开的化合物的非限制性实例包括具有下式中的任一者的化合物:
/>
或其药学上可接受的盐。
在一些实施方案中,本公开提供了一种下式化合物:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-A是被取代的或未被取代的环;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,A是被取代的或未被取代的芳基、杂芳基、杂环基、亚环烷基。在一些实施方案中,A是6碳单环或10碳双环芳族环系统,其中每个环的0、1、2、3或4个原子任选地被取代。在一些实施方案中,A是萘基。在一些实施方案中,A是吲唑基。
在一些实施方案中,A是被取代的芳基。在一些实施方案中,A是被取代的苯基。在一些实施方案中,A是被以下取代的苯基:烷基、环烷基、烷氧基、胺基团、羧基、羧酸基团、碳酰胺基团或酰胺基团,其各自是被取代的或未被取代的;氰基、卤素或氢。在一些实施方案中,A是被烷基取代的苯基,其中烷基是被取代的。在一些实施方案中,A是被烷基取代的苯基,其中烷基被氨基取代,该氨基是被取代的或未被取代的。在一些实施方案中,A是被胺基团取代的苯基,该胺基团是被取代的或未被取代的。在一些实施方案中,A是被羧基取代的苯基,该羧基是被取代的或未被取代的。在一些实施方案中,A是被氰基取代的苯基。在一些实施方案中,A是被卤基-取代的苯基。
在一些实施方案中,A是被取代的或未被取代的杂环基。在一些实施方案中,A是被取代的杂环基。
在一些实施方案中,A是包含1、2或3个杂原子作为环成员的芳族5元、6元、7元或8元单环环系统,其中每个杂原子独立地选自O、N或S。在一些实施方案中,A是包含1、2、3、4、5或6个杂原子的芳族8元、9元、10元、11元或12元双环环系统,其中每个杂原子独立地选自O、N或S。在一些实施方案中,A是包含1、2或3个杂原子的芳族5元、6元、7元或8元单环环系统,并且该芳族5元、6元、7元或8元单环环系统是被取代的。在一些实施方案中,A是具有1、2、3、4、5或6个杂原子的8元、9元、10元、11元或12元双环环系统,并且该8元、9元、10元、11元或12元双环环系统是被取代的。
在一些实施方案中,A是吡啶基、嘧啶基、噻二唑基、噻唑基、吡唑基、噻吩基或噁二唑基,其各自独立地是被取代的或未被取代的。在一些实施方案中,A是1,3,5-噻二唑-2-基。在一些实施方案中,A是1,3,4-噁二唑-2-基或1,2,4-噁二唑-2-基。在一些实施方案中,A是1,3,4-噁二唑-2-基。
在一些实施方案中,m是1。在一些实施方案中,m是2。在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,每个R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中R
在一些实施方案中,本公开提供了一种下式化合物:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-Ar是未被取代的或被取代的芳基;
-Q
-m是1、2、3或4;
-n是0、1、2、3或4;
-Y是N、O或不存在;
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
可选择虚线键的模式以提供芳族系统,例如吲哚、吲哚啉、吡咯并吡啶、吡咯并嘧啶或吡咯并吡嗪。在一些实施方案中,X
在一些实施方案中,Ar是6碳单环或10碳双环芳族环系统,其中每个环的0、1、2、3或4个原子任选地被取代。在一些实施方案中,Ar是苯基。在一些实施方案中,Ar是萘基。在一些实施方案中,Ar是吲唑基。
R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,m是1、2、3或4。在一些实施方案中,m是1。在一些实施方案中,X
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,本公开提供了一种下式化合物:
其中变量如上所定义。
在一些实施方案中,本公开提供了一种下式化合物:
其中:
-X
-X
-X
-X
-Ar是未被取代的或被取代的芳基;
-Q
-n是0、1、2、3或4;
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
其中变量如上所定义。
在一些实施方案中,Ar是6碳单环或10碳双环芳族环系统,其中每个环的0、1、2、3或4个原子任选地被取代。在一些实施方案中,Ar是苯基。在一些实施方案中,Ar是萘基。在一些实施方案中,Ar是吲唑基。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,本公开提供了一种下式化合物:
其中:
-Q
-每个R
-每个R
-n是0、1、2、3或4;
每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,n是0、1、2或3。在一些实施方案中,n是1。在一些实施方案中,n是2。在一些实施方案中,n是0。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,n是1、2或3。在一些实施方案中,n是1。在一些实施方案中,n是2。在一些实施方案中,n是0。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
本公开的化合物的非限制性实例包括具有下式中的任一者的化合物:
/>
或其药学上可接受的盐。
在一些实施方案中,本公开提供了一种下式化合物:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-Het是被取代的或未被取代的杂芳基;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
可选择虚线键的模式以提供芳族系统,例如吲哚、吲哚啉、吡咯并吡啶、吡咯并嘧啶或吡咯并吡嗪。在一些实施方案中,X
在一些实施方案中,Het是包含1、2或3个杂原子作为环成员的芳族5元、6元、7元或8元单环环系统,其中每个杂原子独立地选自O、N或S。在一些实施方案中,Het是包含1、2、3、4、5或6个杂原子的芳族8元、9元、10元、11元或12元双环环系统,其中每个杂原子独立地选自O、N或S。在一些实施方案中,Het是包含1、2或3个杂原子的芳族5元、6元、7元或8元单环环系统,并且该芳族5元、6元、7元或8元单环环系统是被取代的。在一些实施方案中,Het是具有1、2、3、4、5或6个杂原子的8元、9元、10元、11元或12元双环环系统,并且该8元、9元、10元、11元或12元双环环系统是被取代的。
在一些实施方案中,Het是吡啶基、嘧啶基、噻二唑基、噻唑基、吡唑基、噻吩基或噁二唑基,其各自独立地是被取代的或未被取代的。在一些实施方案中,Het是1,3,5-噻二唑-2-基。在一些实施方案中,Het是1,3,4-噁二唑-2-基或1,2,4-噁二唑-2-基。在一些实施方案中,Het是1,3,4-噁二唑-2-基。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,m是1、2、3或4。在一些实施方案中,m是1。在一些实施方案中,X
在一些实施方案中,Q
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,本公开提供了一种下式化合物:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中R
在一些实施方案中,化合物具有下式:
其中:
-Q
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
变量如上所定义,并且其中o是1、2、3或4。
在一些实施方案中,化合物具有下式:
其中:
-Q
-每个R
-每个R
-o是0、1、2、3或4;
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,R
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中:
-Q
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中:
-Q
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,每个R
在一些实施方案中,化合物具有下式:
其中:
-Q
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,Q
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,化合物具有下式:
其中:
-Q
-R
-每个R
-每个R
-每个R
-每个R
-每个R
或其药学上可接受的盐。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
或其药学上可接受的盐,其中变量如上所定义。
在一些实施方案中,化合物具有下式:
其中:
-Q
-每个R
-每个R
-每个R
-每个R
-每个R
-每个R
-R
或其药学上可接受的盐。
在一些实施方案中,R
本公开的化合物的非限制性实例包括具有下式中的任一者的化合物:
/>
/>
/>
或其药学上可接受的盐。
本公开的化合物的非限制性实例包括具有下式中的任一者的化合物:
/>
/>
/>
或其药学上可接受的盐。
本文中的化合物可包括其所有立体异构体、对映异构体、非对映异构体、混合物、外消旋物、阻转异构体和互变异构体。
任选的取代基的非限制性实例包括羟基、氢硫基、卤素、氨基、硝基、亚硝基、氰基、叠氮基、亚砜基团、砜基团、磺酰胺基团、羧基、羧醛基团、亚胺基团、烷基、卤代烷基、烯基、卤代烯基、炔基、卤代炔基、烷氧基、芳基、芳基氧基、芳烷基、芳基烷氧基、杂环基、酰基、酰基氧基、氨基甲酸酯基团、酰胺基团、脲基、环氧基和酯基团。
烷基和亚烷基的非限制性实例包括直链、支链和环状烷基和亚烷基。烷基或亚烷基可为例如C
直链烷基的非限制性实例包括甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基和癸基。
支链烷基包括被任何数目的烷基取代的任何直链烷基。支链烷基的非限制性实例包括异丙基、异丁基、仲丁基和叔丁基。
被取代的烷基的非限制性实例包括羟基甲基、氯甲基、三氟甲基、氨基甲基、1-氯乙基、2-羟基乙基、1,2-二氟乙基和3-羧基丙基。
环状烷基的非限制性实例包括环丙基、环丁基、环戊基、环己基、环庚基和环辛基。环状烷基还包括稠合、桥接和螺接双环以及更高级的稠合、桥接和螺接系统。环状烷基可被任何数目的直链、支链或环状烷基取代。环状烷基的非限制性实例包括环丙基、2-甲基-环丙-1-基、环丙-2-烯-1-基、环丁基、2,3-二羟基环丁-1-基、环丁-2-烯-1-基、环戊基、环戊-2-烯-1-基、环戊-2,4-二烯-1-基、环己基、环己-2-烯-1-基、环庚基、环辛烷基、2,5-二甲基环戊-1-基、3,5-二氯环己-1-基、4-羟基环己-1-基、3,3,5-三甲基环己-1-基、八氢并环戊二烯基、八氢-1H-茚基、3a,4,5,6,7,7a-六氢-3H-茚-4-基、十氢薁基、双环[2.1.1]己烷基、双环[2.2.1]庚烷基、双环[3.1.1]庚烷基、1,3-二甲基[2.2.1]庚烷-2-基、双环[2.2.2]辛烷基和双环[3.3.3]十一烷基。
烯基和亚烯基的非限制性实例包括直链、支链和环状烯基。烯基的一种或多种烯烃可呈例如以下形式:E、Z、顺式、反式、末端或外型-亚甲基。烯基或亚烯基可为例如C
炔基或亚炔基的非限制性实例包括直链、支链和环状炔基。炔基或亚炔基的三键可在内部或在末端。炔基或亚炔基可为例如C
卤代烷基可为被任何数目的卤素原子例如氟、氯、溴和碘原子取代的任何烷基。卤代烯基可为被任何数目的卤素原子取代的任何烯基。卤代炔基可为被任何数目的卤素原子取代的任何炔基。
烷氧基可为例如被烷基、烯基或炔基取代的氧原子。醚或醚基团包含烷氧基。烷氧基的非限制性实例包括甲氧基、乙氧基、丙氧基、异丙氧基和异丁氧基。
芳基可为杂环的或非杂环的。芳基可为单环的或多环的。芳基可被任何数目的本文所述的取代基取代,该取代基例如是烃基、烷基、烷氧基和卤素原子。芳基的非限制性实例包括苯基、甲苯甲酰基、萘基、吡咯基、吡啶基、咪唑基、噻吩基和呋喃基。被取代的芳基的非限制性实例包括3,4-二甲基苯基、4-叔丁基苯基、4-环丙基苯基、4-二乙基氨基苯基、4-(三氟甲基)苯基、4-(二氟甲氧基)-苯基、4-(三氟甲氧基)苯基、3-氯苯基、4-氯苯基、3,4-二氯苯基、2-氟苯基、2-氯苯基、2-碘苯基、3-碘苯基、4-碘苯基、2-甲基苯基、3-氟苯基、3-甲基苯基、3-甲氧基苯基、4-氟苯基、4-甲基苯基、4-甲氧基苯基、2,3-二氟苯基、3,4-二氟苯基、3,5-二氟苯基、2,3-二氯苯基、3,4-二氯苯基、3,5-二氯苯基、2-羟基苯基、3-羟基苯基、4-羟基苯基、2-甲氧基苯基、3-甲氧基苯基、4-甲氧基苯基、2,3-二甲氧基苯基、3,4-二甲氧基苯基、3,5-二甲氧基苯基、2,4-二氟苯基、2,5-二氟苯基、2,6-二氟苯基、2,3,4-三氟苯基、2,3,5-三氟苯基、2,3,6-三氟苯基、2,4,5-三氟苯基、2,4,6-三氟苯基、2,4-二氯苯基、2,5-二氯苯基、2,6-二氯苯基、3,4-二氯苯基、2,3,4-三氯苯基、2,3,5-三氯苯基、2,3,6-三氯苯基、2,4,5-三氯苯基、3,4,5-三氯苯基、2,4,6-三氯苯基、2,3-二甲基苯基、2,4-二甲基苯基、2,5-二甲基苯基、2,6-二甲基苯基、2,3,4-三甲基苯基、2,3,5-三甲基苯基、2,3,6-三甲基苯基、2,4,5-三甲基苯基、2,4,6-三甲基苯基、2-乙基苯基、3-乙基苯基、4-乙基苯基、2,3-二乙基苯基、2,4-二乙基苯基、2,5-二乙基苯基、2,6-二乙基苯基、3,4-二乙基苯基、2,3,4-三乙基苯基、2,3,5-三乙基苯基、2,3,6-三乙基苯基、2,4,5-三乙基苯基、2,4,6-三乙基苯基、2-异丙基苯基、3-异丙基苯基和4-异丙基苯基。
被取代的芳基的非限制性实例包括2-氨基苯基、2-(N-甲基氨基)苯基、2-(N,N-二甲基氨基)苯基、2-(N-乙基氨基)苯基、2-(N,N-二乙基氨基)苯基、3-氨基苯基、3-(N-甲基氨基)苯基、3-(N,N-二甲基氨基)苯基、3-(N-乙基氨基)苯基、3-(N,N-二乙基氨基)苯基、4-氨基苯基、4-(N-甲基氨基)苯基、4-(N,N-二甲基氨基)苯基、4-(N-乙基氨基)苯基和4-(N,N-二乙基氨基)苯基。
杂环可为含有不是碳的环原子例如N、O、S、P、Si、B或任何其他杂原子的任何环。杂环可被任何数目的取代基例如烷基和卤素原子取代。杂环可为芳族的(杂芳基)或非芳族的。杂环的非限制性实例包括吡咯、吡咯烷、吡啶、哌啶、丁二酰胺、顺丁烯二酰亚胺、吗啉、咪唑、噻吩、呋喃、四氢呋喃、吡喃和四氢吡喃。
杂环的非限制性实例包括:具有含有一个或多个杂原子的单一环的杂环单元,其非限制性实例包括二氮杂环丙烯基、氮杂环丙烷基、氮杂环丁烷基、吡唑烷基、咪唑烷基、噁唑烷基、异噁唑啉基、噻唑烷基、异噻唑啉基、噁噻唑烷酮基、噁唑烷酮基、乙内酰脲基、四氢呋喃基、吡咯烷基、吗啉基、哌嗪基、哌啶基、二氢吡喃基、四氢吡喃基、哌啶-2-酮基、2,3,4,5-四氢-1H-氮杂环庚三烯基、2,3-二氢-1H-吲哚和1,2,3,4-四氢喹啉;以及ii)具有2个或更多个环,其中的一者是杂环的杂环单元,其非限制性实例包括六氢-1H-吡咯嗪基、3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑基、3a,4,5,6,7,7a-六氢-1H-吲哚基、1,2,3,4-四氢喹啉基和十氢-1H-环辛四烯并[b]吡咯基。
杂芳基的非限制性实例包括:i)含有单一环的杂芳基环,其非限制性实例包括1,2,3,4-四唑基、[1,2,3]三唑基、[1,2,4]三唑基、三嗪基、噻唑基、1H-咪唑基、噁唑基、异噁唑基、异噻唑基、呋喃基、噻吩基、嘧啶基、2-苯基嘧啶基、吡啶基、3-甲基吡啶基和4-二甲基氨基吡啶基;以及ii)含有2个或更多个稠环,其中的一者是杂芳基环的杂芳基环,其非限制性实例包括:7H-嘌呤基、9H-嘌呤基、6-氨基-9H-嘌呤基、5H-吡咯并[3,2-d]嘧啶基、7H-吡咯并[2,3-d]嘧啶基、吡啶并[2,3-d]嘧啶基、4,5,6,7-四氢-1-H-吲哚基、喹喔啉基、喹唑啉基、喹啉基、8-羟基-喹啉基和异喹啉基。
本文中的任何化合物都可为纯化的。本文中的化合物可为至少1%纯、至少2%纯、至少3%纯、至少4%纯、至少5%纯、至少6%纯、至少7%纯、至少8%纯、至少9%纯、至少10%纯、至少11%纯、至少12%纯、至少13%纯、至少14%纯、至少15%纯、至少16%纯、至少17%纯、至少18%纯、至少19%纯、至少20%纯、至少21%纯、至少22%纯、至少23%纯、至少24%纯、至少25%纯、至少26%纯、至少27%纯、至少28%纯、至少29%纯、至少30%纯、至少31%纯、至少32%纯、至少33%纯、至少34%纯、至少35%纯、至少36%纯、至少37%纯、至少38%纯、至少39%纯、至少40%纯、至少41%纯、至少42%纯、至少43%纯、至少44%纯、至少45%纯、至少46%纯、至少47%纯、至少48%纯、至少49%纯、至少50%纯、至少51%纯、至少52%纯、至少53%纯、至少54%纯、至少55%纯、至少56%纯、至少57%纯、至少58%纯、至少59%纯、至少60%纯、至少61%纯、至少62%纯、至少63%纯、至少64%纯、至少65%纯、至少66%纯、至少67%纯、至少68%纯、至少69%纯、至少70%纯、至少71%纯、至少72%纯、至少73%纯、至少74%纯、至少75%纯、至少76%纯、至少77%纯、至少78%纯、至少79%纯、至少80%纯、至少81%纯、至少82%纯、至少83%纯、至少84%纯、至少85%纯、至少86%纯、至少87%纯、至少88%纯、至少89%纯、至少90%纯、至少91%纯、至少92%纯、至少93%纯、至少94%纯、至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.2%纯、至少99.3%纯、至少99.4%纯、至少99.5%纯、至少99.6%纯、至少99.7%纯、至少99.8%纯,或至少99.9%纯。
在一些实施方案中,本发明的化合物可用于治疗对象的癌症。本发明的化合物可例如减缓癌细胞系的增殖,或杀灭癌细胞。可通过本发明的化合物治疗的癌症的非限制性实例包括:急性淋巴母细胞性白血病、急性髓样白血病、肾上腺皮质癌、AIDS相关的癌症、AIDS相关的淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑肿瘤(诸如小脑星形细胞瘤、大脑星形细胞瘤/恶性胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤、视路和下丘脑胶质瘤)、乳腺癌、支气管腺瘤、伯基特淋巴瘤(Burkittlymphoma)、原始起源未知的癌、中枢神经系统淋巴瘤、小脑星形细胞瘤、子宫颈癌、儿童期癌症、慢性淋巴细胞性白血病、慢性髓性白血病、慢性骨髓增生性病症、结肠癌、皮肤T细胞淋巴瘤、结缔组织增生性小圆细胞肿瘤、子宫内膜癌、室管膜瘤、食管癌、尤因氏肉瘤(Ewing's sarcoma)、生殖细胞肿瘤、胆囊癌、胃癌、胃肠类癌肿瘤、胃肠基质肿瘤、胶质瘤、毛细胞白血病,头颈癌、心脏癌、肝细胞(肝)癌、霍奇金淋巴瘤(Hodgkin lymphoma)、下咽癌、眼内黑素瘤、胰岛细胞癌、卡波西肉瘤(Kaposi sarcoma)、肾癌、喉癌、唇和口腔癌、脂肪肉瘤、肝癌、肺癌(诸如非小细胞肺癌和小细胞肺癌)、淋巴瘤、白血病、巨球蛋白血症、恶性骨纤维组织细胞瘤/骨肉瘤、髓母细胞瘤、黑素瘤、间皮瘤、原发灶隐匿的转移性鳞状颈部癌、口癌、多发性内分泌瘤形成综合征、骨髓增生异常综合征、髓样白血病、鼻腔和鼻旁窦癌、鼻咽癌、神经母细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、骨肉瘤/恶性骨纤维组织细胞瘤、卵巢癌、卵巢上皮癌、卵巢生殖细胞肿瘤、胰腺癌、胰岛细胞胰腺癌、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤、松果体生殖细胞瘤、垂体腺瘤、胸膜肺母细胞瘤、浆细胞瘤形成、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌、肾盂和输尿管移行细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、皮肤癌、梅克尔细胞皮肤癌(skin carcinoma merkel cell)、小肠癌、软组织肉瘤、鳞状细胞癌、胃癌、T细胞淋巴瘤、咽喉癌、胸腺瘤、胸腺癌、甲状腺癌、滋养细胞肿瘤(妊娠性)、原发部位未知的癌症、尿道癌、子宫肉瘤、阴道癌、外阴癌、瓦尔登斯特伦巨球蛋白血症(
在一些实施方案中,本发明的化合物显示非致死毒性。
药学上可接受的盐。
本发明提供了本文所述的任何治疗性化合物的药学上可接受的盐的用途。药学上可接受的盐包括例如酸加成盐和碱加成盐。添加至化合物中以形成酸加成盐的酸可为有机酸或无机酸。添加至化合物中以形成碱加成盐的碱可为有机碱或无机碱。在一些实施方案中,药学上可接受的盐是金属盐。在一些实施方案中,药学上可接受的盐是铵盐。
金属盐可由将无机碱添加至本发明的化合物中产生。无机碱由金属阳离子与碱性反离子配对组成,该碱性反离子诸如像是氢氧根、碳酸根、碳酸氢根或磷酸根。金属可为碱金属、碱土金属、过渡金属或主族金属。在一些实施方案中,金属是锂、钠、钾、铯、铈、镁、锰、铁、钙、锶、钴、钛、铝、铜、镉或锌。
在一些实施方案中,金属盐是锂盐、钠盐、钾盐、铯盐、铈盐、镁盐、锰盐、铁盐、钙盐、锶盐、钴盐、钛盐、铝盐、铜盐、镉盐或锌盐。
铵盐可由将氨或有机胺添加至本发明的化合物中产生。在一些实施方案中,有机胺是三乙胺、二异丙胺、乙醇胺、二乙醇胺、三乙醇胺、吗啉、N-甲基吗啉、哌啶、N-甲基哌啶、N-乙基哌啶、二苄胺、哌嗪、吡啶、吡唑、哌吡唑、咪唑、吡嗪或哌吡嗪。
在一些实施方案中,铵盐是三乙胺盐、二异丙胺盐、乙醇胺盐、二乙醇胺盐、三乙醇胺盐、吗啉盐、N-甲基吗啉盐、哌啶盐、N-甲基哌啶盐、N-乙基哌啶盐、二苄胺盐、哌嗪盐、吡啶盐、吡唑盐、哌吡唑盐、咪唑盐、吡嗪盐或哌吡嗪盐。
酸加成盐可由将酸添加至本发明的化合物中产生。在一些实施方案中,酸是有机的。在一些实施方案中,酸是无机的。在一些实施方案中,酸是盐酸、氢溴酸、氢碘酸、硝酸、亚硝酸、硫酸、亚硫酸、磷酸、异烟酸、乳酸、水杨酸、酒石酸、抗坏血酸、龙胆酸、葡萄糖酸、葡萄糖醛酸、糖二酸、甲酸、苯甲酸、谷氨酸、泛酸(pantothenic acid)、乙酸、丙酸、丁酸、反丁烯二酸、丁二酸、甲烷磺酸、乙烷磺酸、苯磺酸、对甲苯磺酸、柠檬酸、草酸或顺丁烯二酸。
在一些实施方案中,盐是盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、亚硝酸盐、硫酸盐、亚硫酸盐、磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酒石酸盐、抗坏血酸盐、龙胆酸盐、葡萄糖酸盐、葡萄糖醛酸盐、糖二酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、泛酸盐、乙酸盐、丙酸盐、丁酸盐、反丁烯二酸盐、丁二酸盐、甲烷磺酸盐(甲磺酸盐)、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐、柠檬酸盐、草酸盐或顺丁烯二酸盐。
本发明的药物组合物。
本发明的药物组合物可例如在用例如另一药剂治疗对象之前、期间或之后使用。
对象可为例如年长的成人、成人、青少年、青春期前的少年、儿童、学步儿、婴儿、新生儿以及非人动物。在一些实施方案中,对象是患者。
本发明的药物组合物可为本文所述的任何药物化合物与其他化学组分诸如载体、稳定剂、稀释剂、分散剂、助悬剂、增稠剂和/或赋形剂的组合。药物组合物有助于化合物向生物体的施用。药物组合物可通过各种形式和途径(包括例如静脉内、皮下、肌肉内、口服、胃肠外、经眼、皮下、经皮、经鼻、经阴道和经局部施用)以药物组合物形式以治疗有效量施用。
药物组合物可以局部方式施用,例如通过将化合物直接注射至器官中,任选地以储库或持续释放制剂或植入物形式。药物组合物可以快速释放制剂的形式,以延长释放制剂的形式,或以中等释放制剂的形式提供。快速释放形式可提供立即释放。延长释放制剂可提供控制释放或持续延迟释放。
对于口服施用,药物组合物可通过将活性化合物与药学上可接受的载体或赋形剂组合来配制。此类载体可用于配制液体、凝胶剂、糖浆、酏剂、浆液或混悬剂,用于由对象口服摄取。用于口服可溶解制剂中的溶剂的非限制性实例可包括水、乙醇、异丙醇、盐水、生理盐水、DMSO、二甲基甲酰胺、磷酸钾缓冲液、磷酸盐缓冲盐水(PBS)、磷酸钠缓冲液、4-2-羟基乙基-1-哌嗪乙烷磺酸缓冲液(HEPES)、3-(N-吗啉代)丙烷磺酸缓冲液(MOPS)、哌嗪-N,N′-双(2-乙烷磺酸)缓冲液(PIPES)和盐水柠檬酸钠缓冲液(SSC)。用于口服可溶解制剂中的共溶剂的非限制性实例可包括蔗糖、脲、克列莫佛(cremaphor)、DMSO和磷酸钾缓冲液。
药物制剂可被配制用于静脉内施用。药物组合物可呈作为在油性或水性媒介物中的无菌混悬剂、溶液或乳剂的适于胃肠外注射的形式,并且可含有配制剂,诸如助悬剂、稳定剂和/或分散剂。用于胃肠外施用的药物制剂包括呈水溶性形式的活性化合物的水溶液。活性化合物的混悬剂可制备成油性注射混悬剂。适合亲脂性溶剂或媒介物包括脂肪油诸如芝麻油,或合成脂肪酸酯诸如油酸乙酯或甘油三酯,或脂质体。混悬剂还可含有适合稳定剂或增加化合物的溶解性以允许制备高度浓缩溶液的剂。或者,活性成分可呈用于在使用之前用适合媒介物例如无菌无热原水复原的粉末形式。
活性化合物可经局部施用,并且可配制成多种可经局部施用的组合物,诸如溶液、混悬剂、洗剂、凝胶剂、糊剂、含药棒、香膏剂、乳膏剂和软膏剂。此类药物组合物可含有增溶剂、稳定剂、张力增强剂、缓冲剂和防腐剂。
本发明的化合物可经局部施加至对象的皮肤或体腔,例如口腔、阴道腔、膀胱腔、颅腔、脊髓腔、胸腔或骨盆腔。本发明的化合物可施加至可及的体腔。
化合物还可配制成含有常规栓剂基质(诸如可可脂或其他甘油酯)以及合成聚合物(诸如聚乙烯吡咯烷酮和PEG)的直肠组合物,诸如灌肠剂、直肠凝胶剂、直肠泡沫剂、直肠气雾剂、栓剂、胶冻栓剂或保留灌肠剂。在组合物的栓剂形式中,低熔点蜡(诸如任选地与可可脂组合的脂肪酸甘油酯的混合物)可熔化。
在实践本文提供的治疗或使用方法时,将治疗有效量的本文所述的化合物以药物组合物形式施用至患有待治疗的疾病或病况的对象。在一些实施方案中,对象是哺乳动物,诸如人。治疗有效量可视疾病的严重性、对象的年龄和相对健康状况、所用化合物的效能以及其他因素而广泛变化。化合物可单独使用,或作为混合物的组分与一种或多种治疗剂组合使用。
药物组合物可使用一种或多种有助于将活性化合物加工成可在药学上使用的制剂的生理上可接受的载体来配制,该载体包括赋形剂和助剂。视所选施用途径而定,配方可加以修改。包含本文所述的化合物的药物组合物可例如通过混合、溶解、乳化、包封、包埋或压制工艺来制造。
药物组合物可包括至少一种药学上可接受的载体、稀释剂或赋形剂以及呈游离碱或药学上可接受的盐形式的本文所述的化合物。药物组合物可含有增溶剂、稳定剂、张力增强剂、缓冲剂和防腐剂。
用于制备包含本文所述的化合物的组合物的方法包括将化合物与一种或多种惰性的药学上可接受的赋形剂或载体一起配制以形成固体、半固体或液体组合物。固体组合物包括例如粉剂、片剂、可分散颗粒剂、胶囊和扁囊剂。液体组合物包括例如化合物溶解在其中的溶液,包含化合物的乳剂,或含有包含如本文公开的化合物的脂质体、胶束或纳米粒子的溶液。半固体组合物包括例如凝胶剂、混悬剂和乳膏剂。组合物可呈以下形式:液体溶液或混悬剂;适于在使用之前在液体中溶解或悬浮的固体形式;或乳剂。这些组合物还可含有少量无毒辅助物质,诸如湿润剂或乳化剂、pH缓冲剂以及其他药学上可接受的添加剂。
适用于本发明中的剂型的非限制性实例包括液体、粉剂、凝胶剂、纳米混悬剂、纳米粒子、微凝胶剂、水性或油性混悬剂、乳剂以及它们的任何组合。
适用于本发明中的药学上可接受的赋形剂的非限制性实例包括粘合剂、崩解剂、抗粘附剂、抗静电剂、表面活性剂、抗氧化剂、包衣剂、着色剂、增塑剂、防腐剂、助悬剂、乳化剂、抗微生物剂、球化剂以及它们的任何组合。
本发明的组合物可为例如立即释放形式或控制释放制剂。立即释放制剂可被配制以允许化合物快速起作用。立即释放制剂的非限制性实例包括可易于溶解的制剂。控制释放制剂可为已被调整以致活性剂的释放速率和释放概况可与生理和时间治疗要求匹配,或替代地,已被配制以实现以程序化速率释放活性剂的药物制剂。控制释放制剂的非限制性实例包括颗粒剂、延迟释放颗粒剂、水凝胶(例如具有合成或天然来源)、其他胶凝剂(例如形成凝胶的膳食纤维)、基于基质的制剂(例如包含具有至少一种分散在其中的活性成分的聚合材料的制剂)、在基质内的颗粒、聚合物混合物和颗粒团。
在一些实施方案中,控制释放制剂是延迟释放形式。延迟释放形式可被配制以延迟化合物的作用,持续延长时期。延迟释放形式可被配制以延迟有效剂量的一种或多种化合物的释放,例如持续约4、约8、约12、约16或约24小时。
控制释放制剂可为持续释放形式。持续释放形式可被配制以例如在延长时期内维持化合物的作用。持续释放形式可被配制以在约4、约8、约12、约16或约24小时内提供有效剂量的本文所述的任何化合物(例如提供生理上有效的血液概况)。
药学上可接受的赋形剂的非限制性实例可例如见于以下中:Remington:TheScience and Practice of Pharmacy,第十九版(Easton,Pa.:Mack Publishing Company,1995);Hoover,John E.,Remington'sPharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.和Lachman,L.编,Pharmaceutical DosageForms,Marcel Decker,New York,N.Y.,1980;以及Pharmaceutical Dosage Forms andDrug Delivery Systems,第七版(Lippincott Williams&Wilkins1999),所述文献中的每一者通过引用以它的整体并入本文。
可以任何顺序或同时施用多种治疗剂。在一些实施方案中,本发明的化合物与用另一治疗剂进行的治疗组合,在该治疗之前,或在该治疗之后施用。如果同时,则多种治疗剂可以单一联合形式或以多个形式例如以多个单独丸剂形式提供。剂可一起或单独包装在单一包装中或多个包装中。治疗剂中的一者或全部可以多次剂量给与。如果不同时,则多次剂量之间的时间选择可变化,直至多达约一个月。
本文所述的治疗剂可在疾病或病况发生之前、期间或之后施用,并且施用含有治疗剂的组合物的时间选择可变化。举例来说,化合物可用作预防剂,并且可连续施用至具有病况或疾病倾向的对象以减小疾病或病况发生的可能性。组合物可在症状发作期间或在症状发作之后尽可能快地施用至对象。治疗剂的施用可在症状发作的前48小时内,在症状发作的前24小时内,在症状发作的前6小时内,或在症状发作的3小时内开始。初始施用可使用本文所述的任何制剂通过任何实用途径来进行,诸如通过本文所述的任何途径。
化合物可在检测到或怀疑疾病或病况发作之后一旦可行即加以施用,并且持续为治疗该疾病所必需的时长,诸如像从约1个月至约3个月。在一些实施方案中,可施用化合物的时长可为约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约5周、约6周、约7周、约8周、约2个月、约9周、约10周、约11周、约12周、约3个月、约13周、约14周、约15周、约16周、约4个月、约17周、约18周、约19周、约20周、约5个月、约21周、约22周、约23周、约24周、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约1年、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月、约2年、约2.5年、约3年、约3.5年、约4年、约4.5年、约5年、约6年、约7年、约8年、约9年或约10年。治疗的时长可针对每个对象有所变化。
本文所述的药物组合物可呈适于单次施用精确剂量的单位剂型。在单位剂型中,制剂被分成含有适量的一种或多种化合物的单位剂量。单位剂量可呈含有分立的制剂量的包装的形式。非限制性实例是包装可注射剂、小瓶剂或安瓿剂。水性悬浮液组合物可包装在单次剂量非可再闭合容器中。可使用多次剂量可再闭合容器,例如与或不与防腐剂组合使用。注射用制剂可以例如在安瓿中或在具有防腐剂的多剂量容器中的单位剂型提供。
本文提供的药物组合物可与其他疗法联合施用,该其他疗法例如是化学疗法、放射、手术、消炎剂和所选的维生素。其他剂可在药物组合物之前、之后或与药物组合物相伴施用。
视预定施用模式而定,药物组合物可呈固体、半固体或液体剂型的形式,诸如像片剂、栓剂、丸剂、胶囊、粉剂、液体、混悬剂、洗剂、乳膏剂或凝胶剂,例如呈适于单次施用精确剂量的单位剂型。
对于固体组合物,无毒固体载体包括例如药品级甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖和碳酸镁。
适于与本公开的组合物组合的药物活性剂的非限制性实例包括抗感染剂,即氨基糖苷、抗病毒剂、抗微生物剂、抗胆碱能剂/解痉药、抗糖尿病剂、抗高血压剂、抗赘生剂、心血管剂、中枢神经系统剂、凝血调节剂、激素、免疫剂、免疫抑制剂和眼用制剂。
化合物可通过脂质体技术递送。使用脂质体作为药物载体可增加化合物的治疗指数。脂质体由天然磷脂组成,并且可含有具有表面活性剂性质的混合脂质链(例如卵磷脂酰乙醇胺)。脂质体设计可采用用于附接至不健康组织的表面配体。脂质体的非限制性实例包括多层囊泡(MLV)、小单层囊泡(SUV)和大单层囊泡(LUV)。可调节脂质体物理化学性质以优化通过生物屏障的穿透和在施用部位处的滞留,并且降低显现过早降解和对非靶标组织的毒性的可能性。最优的脂质体性质取决于施用途径:大尺寸脂质体在局部注射后显示良好滞留,小尺寸脂质体更加适合于实现被动靶向。聚乙二醇化降低由肝和脾对脂质体的摄取,并且增加循环时间,从而由于增强的渗透性和滞留(EPR)效应而导致在发炎部位处的定位增加。另外,可修饰脂质体表面以实现所包封的药物选择性递送至特定靶标细胞。靶向性配体的非限制性实例包括对集中在与疾病相关的细胞的表面上的受体具有特异性的单克隆抗体、维生素、肽和多糖。
适用于本公开中的剂型的非限制性实例包括液体、酏剂、纳米混悬剂、水性或油性混悬剂、滴剂、糖浆以及它们的任何组合。适用于本公开中的药学上可接受的赋形剂的非限制性实例包括粒化剂、粘合剂、润滑剂、崩解剂、甜味剂、助流剂、抗粘附剂、抗静电剂、表面活性剂、抗氧化剂、树胶、包衣剂、着色剂、调味剂、包衣剂、增塑剂、防腐剂、助悬剂、乳化剂、植物纤维素材料和球化剂以及它们的任何组合。
本发明的组合物可以试剂盒形式包装。在一些实施方案中,试剂盒包括关于组合物的施用/使用的书面说明书。书面材料可为例如标签。书面材料可建议施用的条件和方法。说明书对对象和主管医师提供关于从疗法的施用中获得最优临床结局的最佳指导。书面材料可为标签。在一些实施方案中,标签可由监管机构例如美国食品与药物管理局(Foodand Drug Administration,FDA)、欧洲药品管理局(European Medicines Agency,EMA)或其他监管机构核准。
给药。
本文所述的药物组合物可呈适于单次施用精确剂量的单位剂型。在单位剂型中,制剂被分成含有适量的一种或多种化合物的单位剂量。单位剂量可呈含有分立的制剂量的包装的形式。非限制性实例是在小瓶或安瓿中的液体。水性悬浮液组合物可包装在单次剂量非可再闭合容器中。可使用多次剂量可再闭合容器,例如与防腐剂组合使用。胃肠外注射用制剂可以例如在安瓿中或在具有防腐剂的多剂量容器中的单位剂型提供。
本文所述的化合物可以约1mg至约2000mg;约100mg至约2000mg;约10mg至约2000mg;约5mg至约1000mg、约10mg至约500mg、约50mg至约250mg、约100mg至约200mg、约1mg至约50mg、约50mg至约100mg、约100mg至约150mg、约150mg至约200mg、约200mg至约250mg、约250mg至约300mg、约300mg至约350mg、约350mg至约400mg、约400mg至约450mg、约450mg至约500mg、约500mg至约550mg、约550mg至约600mg、约600mg至约650mg、约650mg至约700mg、约700mg至约750mg、约750mg至约800mg、约800mg至约850mg、约850mg至约900mg、约900mg至约950mg或约950mg至约1000mg的范围存在于组合物中。
本文所述的化合物可以约1mg、约2mg、约3mg、约4mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg或约2000mg的量存在于组合物中。
在一些实施方案中,剂量可以药物的量除以对象的质量表示,例如每千克对象体重的药物毫克数。在一些实施方案中,以在约5mg/kg至约50mg/kg、250mg/kg至约2000mg/kg、约10mg/kg至约800mg/kg、约50mg/kg至约400mg/kg、约100mg/kg至约300mg/kg或约150mg/kg至约200mg/kg的范围内的量施用化合物。
组合治疗
采用本公开的化合物和至少一种额外治疗剂例如本文所述的任何额外治疗剂的组合疗法可用于治疗病况。在一些实施方案中,相比于当以治疗剂量单独施用时通过每种单独的成分实现的累加作用,组合疗法可产生显著更好的治疗结果。在一些实施方案中,相较于采用每种剂的单药疗法,在组合疗法中,化合物或额外治疗剂例如本文所述的任何额外治疗剂的剂量可降低,同时仍然实现总体治疗作用。在一些实施方案中,化合物和额外治疗剂例如本文所述的任何额外治疗剂可展现协同作用。在一些实施方案中,化合物和额外治疗剂例如本文所述的任何额外治疗剂的协同作用可用于降低施用至对象的药物的总量,此会减少由所述对象经受的副作用。
本公开的化合物可与至少一种额外药物活性剂例如本文所述的任何额外治疗剂组合使用。在一些实施方案中,至少一种额外药物活性剂例如本文所述的任何额外治疗剂可调节与本公开的化合物相同或不同的靶标。在一些实施方案中,至少一种额外药物活性剂例如本文所述的任何额外治疗剂可调节与本公开的化合物相同的靶标,或同一通路的其他组分,或重叠的靶标酶集合。在一些实施方案中,至少一种额外药物活性剂例如本文所述的任何额外治疗剂可调节与本公开的化合物不同的靶标。
因此,在一个方面,本公开提供了一种用于治疗癌症的方法,该方法包括向有需要的对象施用(a)有效量的本公开的化合物和(b)有效量的至少一种额外药物活性剂例如本文所述的任何额外治疗剂,以提供组合疗法。在一些实施方案中,相较于各自单独施用的化合物和至少一种额外药物活性剂的作用,组合疗法可具有增强的治疗作用。根据某些示例性实施方案,组合疗法具有协同治疗作用。根据这个实施方案,相比于当以治疗剂量单独施用时通过每种单独的成分实现的累加作用,组合疗法产生显著更好的治疗结果(例如抗癌、细胞生长阻滞、凋亡、诱导分化、细胞死亡等)。
组合疗法包括但不限于本公开的化合物与化学治疗剂、治疗性抗体或放射治疗的组合,以提供协同治疗作用。在一些实施方案中,本公开的化合物与一种或多种抗癌(抗赘生或细胞毒性)化学治疗药物组合使用。适用于本公开的组合中的化学治疗剂包括但不限于烷基化剂、抗生剂、抗代谢剂、激素剂、植物源性剂、抗血管生成剂、分化诱导剂、细胞生长阻滞诱导剂、凋亡诱导剂、细胞毒性剂、影响细胞生物能学的剂、生物剂例如单克隆抗体、激酶抑制剂以及生长因子和它们的受体的抑制剂、基因治疗剂、细胞疗法或它们的任何组合。
a.与雌激素受体拮抗剂的组合治疗
在一些实施方案中,本公开的化合物与雌激素受体拮抗剂组合使用。在一些实施方案中,本公开的化合物与托瑞米芬(toremifene)
氟维司群是一种选择性雌激素受体降解剂(SERD),并且被指示用于治疗在抗雌激素疗法之后疾病进展的绝经后女性的激素受体阳性转移性乳腺癌。氟维司群是一种具有少许乃至不具有激动剂作用的完全雌激素受体拮抗剂,并且加速雌激素受体的蛋白酶体降解。氟维司群具有不良口服生物利用度,并且通过肌肉内注射施用。氟维司群诱导的ErbB3和ErbB4受体表达使雌激素受体阳性乳腺癌细胞对调蛋白β1(heregulin beta1)敏感。在一些实施方案中,本公开的化合物与氟维司群组合使用。
b.与芳香酶抑制剂的组合治疗
在一些实施方案中,本公开的化合物与芳香酶抑制剂组合使用。芳香酶抑制剂用于治疗绝经后女性的乳腺癌和男性的男子乳腺发育。当使用外部睾酮时,可标签外使用芳香酶抑制剂以降低雌激素转化。芳香酶抑制剂还可在高风险女性中用于化学预防。
在一些实施方案中,本公开的化合物与非选择性芳香酶抑制剂组合使用。在一些实施方案中,本公开的化合物与非选择性芳香酶抑制剂诸如氨鲁米特(aminoglutethimide)或睾内酯(testolactone)
c.与mTOR抑制剂的组合治疗
在一些实施方案中,本公开的化合物与mTOR抑制剂组合使用。mTOR抑制剂是抑制雷帕霉素(rapamycin)机制性靶标(mTOR)的药物,该雷帕霉素机制性靶标是一种属于磷脂酰肌醇-3激酶(PI3K)相关的激酶(PIKK)家族的丝氨酸/苏氨酸特异性蛋白激酶。mTOR通过形成蛋白质复合物mTORC1和mTORC2并且通过该蛋白质复合物进行信号传导来调节细胞代谢、生长和增殖。
在一些实施方案中,本公开的化合物与mTOR抑制剂诸如雷帕霉素、替西罗莫司(temsirolimus)(CCI-779)、依维莫司(everolimus)(RAD001)、地磷莫司(ridaforolimus)(AP-23573)组合使用。在一些实施方案中,本公开的化合物与依维莫司
在一些实施方案中,本公开的化合物与mTOR抑制剂和芳香酶抑制剂组合使用。举例来说,本公开的化合物与依维莫司和依西美坦组合使用。
d.与抗代谢物的组合治疗
抗代谢物是与细胞内的正常物质类似的化学疗法治疗剂。当细胞将抗代谢物并入细胞代谢中时,该细胞不能分裂。抗代谢物是细胞周期特异性的,并且攻击处于细胞周期中的特定阶段的细胞。
在一些实例中,本公开的化合物与一种或多种抗代谢物诸如叶酸拮抗剂、嘧啶拮抗剂、嘌呤拮抗剂或腺苷脱氨酶抑制剂组合使用。在一些实施方案中,本公开的化合物与抗代谢物诸如甲氨蝶呤(methotrexate)、5-氟尿嘧啶(5-fluorouracil)、氟尿苷(foxuridine)、阿糖胞苷(cytarabine)、卡培他滨(capecitabine)、吉西他滨(gemcitabine)、6-巯基嘌呤(6-mercaptopurine)、6-硫鸟嘌呤(6-thioguanine)、克拉屈滨(cladribine)、氟达拉滨(fludarabine)、奈拉滨(nelarabine)或喷司他汀(pentostatin)组合使用。在一些实施方案中,本公开的化合物与卡培他滨
e.与植物生物碱的组合治疗
在一些实施方案中,本公开的化合物与植物生物碱组合使用。在一些实施方案中,本公开的化合物与植物生物碱诸如长春花生物碱(vinca alkaloid)、紫杉烷(taxane)、鬼臼毒素(podophyllotoxin)或喜树碱(camptothecan)类似物组合使用。在一些实施方案中,本公开的化合物与植物生物碱诸如长春新碱(vincristine)、长春花碱(vinblastine)、长春瑞滨(vinorelbine)、太平洋紫杉醇(paclitaxel)、多西他赛(docetaxel)、依托泊苷(etoposide)、替尼泊苷(tenisopide)、伊立替康(irinotecan)或拓扑替康(topotecan)组合使用。
在一些实施方案中,本公开的化合物与紫杉烷诸如太平洋紫杉醇(
f.与治疗性抗体的组合治疗
在一些实施方案中,本公开的化合物与治疗性抗体组合使用。在一些实施方案中,本公开的化合物与裸露的单克隆抗体诸如阿仑珠单抗(alemtuzumab)
在一些实施方案中,本公开的化合物与抗CD20抗体诸如利妥昔单抗(rituximab)
g.与PD-L1和/或PD-1拮抗剂的组合治疗
PD-1通路包含免疫细胞共受体程序性死亡-1(PD-1)和PD-1配体PD-L1和PD-L2。PD-1通路介导肿瘤微环境中的局部免疫抑制。PD-1和PD-L1拮抗剂抑制免疫系统。在一些实施方案中,PD-1或PD-L1拮抗剂是分别特异性结合至、阻断或下调PD-1或PD-L1的单克隆抗体或其抗原结合片段。在一些实施方案中,PD-1或PD-L1拮抗剂是分别特异性结合至、阻断或下调PD-1或PD-L1的化合物或生物分子。
在一些实施方案中,本公开的化合物与PD-1或PD-L1拮抗剂组合使用。在一些实施方案中,本公开的化合物与PD-1/PD-L1拮抗剂例如MK-3475、纳武利尤单抗
h.与抗激素疗法的组合治疗
抗激素疗法使用药剂来抑制所选激素或作用。抗激素疗法通过用激素拮抗剂拮抗激素的功能并且/或者通过阻止激素的产生来实现。在一些实施方案中,对激素的抑制可有益于患有响应于特定激素的存在而生长的某些癌症的对象。在一些实施方案中,本公开的化合物与激素拮抗剂组合使用。
在一些实施方案中,本公开的化合物与抗雄激素剂、抗雌激素剂、芳香酶抑制剂或黄体生成素释放激素(LHRH)激动剂组合使用。在一些实施方案中,本公开的化合物与抗雄激素剂诸如比卡鲁胺(bicalutamide)
i.与低甲基化(脱甲基化)剂的组合治疗
低甲基化(脱甲基化)剂抑制DNA甲基化,该DNA甲基化在不改变根本DNA序列的情况下通过连续世代的细胞影响细胞功能。低甲基化剂可阻断DNA甲基转移酶的活性。在一些实施方案中,本公开的化合物与低甲基化剂诸如阿扎胞苷(azacitidine)
j.与消炎剂的组合治疗
在一些实施方案中,本公开的化合物与非类固醇消炎药物(NSAID)、特异性COX-2抑制剂或皮质类固醇组合使用。在一些实施方案中,本公开的化合物与NSAID诸如阿司匹林(aspirin)、布洛芬(ibuprofen)、萘普生(naproxen)、塞来昔布(celecoxib)、酮咯酸(ketorolac)或双氯芬酸(diclofenac)组合使用。在一些实施方案中,本公开的化合物与特异性COX-2抑制剂诸如塞来昔布
k.与HDAC抑制剂的组合治疗
组蛋白脱乙酰基酶(HDAC)抑制剂是抑制组蛋白脱乙酰基酶的化学化合物。HDAC抑制剂可诱导作为p53活性的调节因素的p21表达。在一些实施方案中,本公开的化合物与HDAC抑制剂组合使用。在一些实施方案中,本公开的化合物与HDAC抑制剂诸如伏立诺他(vorinostat)、罗米地辛(romidepsin)
l.与基于铂的抗赘生药物的组合治疗
基于铂的抗赘生药物是铂的配位络合物。在一些实施方案中,本公开的化合物与基于铂的抗赘生药物诸如顺铂(cisplatin)、奥沙利铂(oxaliplatin)、卡铂(carboplatin)、奈达铂(nedaplatin)、四硝酸三铂(triplatin tetranitrate)、菲铂(phenanthriplatin)、吡铂(picoplatin)或赛特铂(satraplatin)组合使用。在一些实施方案中,本公开的化合物与顺铂或卡铂组合使用。在一些实施方案中,本公开的化合物与顺铂(cisplatinum/platamin/neoplatin/cismaplat/顺式-二胺二氯铂(II)或CDDP;
m.与激酶抑制剂的组合治疗
蛋白质磷酸化的异常激活经常是癌症的直接后果的驱动因素。激酶信号传导通路涉及于肿瘤生物学的表型中,该表型包括增殖、存活、运动性、代谢、血管生成和逃避抗肿瘤免疫应答。
MEK抑制剂:MEK抑制剂是抑制丝裂原激活的蛋白激酶MEK1和/或MEK2的药物。在一些实施方案中,本公开的化合物与MEK1抑制剂组合使用。在一些实施方案中,本公开的化合物与MEK2抑制剂组合使用。在一些实施方案中,本公开的化合物与可抑制MEK1和MEK2的剂组合使用。在一些实施方案中,本公开的化合物与MEK1/MEK2抑制剂诸如曲美替尼(trametinib)
BRAF抑制剂:BRAF抑制剂是抑制丝氨酸/苏氨酸蛋白激酶B-raf(BRAF)蛋白的药物。在一些实施方案中,本公开的化合物与BRAF抑制剂组合使用。在一些实施方案中,本公开的化合物与可抑制野生型BRAF的BRAF抑制剂组合使用。在一些实施方案中,本公开的化合物与可抑制突变BRAF的BRAF抑制剂组合使用。在一些实施方案中,本公开的化合物与可抑制V600E突变BRAF的BRAF抑制剂组合使用。在一些实施方案中,本公开的化合物与BRAF抑制剂诸如威罗菲尼(vemurafenib)
KRAS抑制剂:KRAS是一种在细胞信号传导中充当开启/关闭开关的基因。在一些实施方案中,本公开的化合物与KRAS抑制剂组合使用。在一些实施方案中,本公开的化合物与野生型KRAS抑制剂组合使用。在一些实施方案中,本公开的化合物与突变KRAS抑制剂组合使用。
BTK抑制剂:布鲁顿氏酪氨酸激酶(Bruton’s tyrosine kinase,BTK)是Tec激酶家族的一种涉及于B细胞受体信号传导中的非受体酪氨酸激酶。在一些实施方案中,本公开的化合物与BTK抑制剂组合使用。在一些实施方案中,本公开的化合物与BTK抑制剂诸如依布替尼(ibrutinib)或阿卡替尼(acalabrutinib)组合使用。
CDK抑制剂:CDK4和CDK6是控制细胞周期的G1期与S期之间的转变的周期蛋白依赖性激酶。在癌细胞中,CDK4/CDK6活性失调并且过度活跃。选择性CDK4/CDK6抑制剂可在细胞周期的G1中期阻断细胞周期进展,从而导致阻滞并且阻止癌细胞的增殖。在一些实施方案中,本公开的化合物与CDK4/CDK6抑制剂组合使用。在一些实施方案中,本公开的化合物与CDK4/CDK6抑制剂诸如帕博西尼(palbociclib)
在一些实例中,本公开的化合物与CDK4和/或CDK6的抑制剂,并且与增强CDK4/6抑制剂的细胞抑制活性的剂,并且/或者与将可逆性细胞抑制转化成不可逆性生长阻滞或细胞死亡的剂组合使用。癌症亚型的实例包括NSCLC、黑素瘤、神经母细胞瘤、胶质母细胞瘤、脂肪肉瘤和套细胞淋巴瘤。在一些实例中,本公开的化合物与至少一种缓和CDKN2A(周期蛋白依赖性激酶抑制因子2A)缺失的额外药物活性剂组合使用。在一些实例中,本公开的化合物与至少一种缓和CDK9(周期蛋白依赖性激酶9)异常的额外药物活性剂组合使用。
在一些实施方案中,本公开的化合物与CDK2、CDK7和/或CDK9抑制剂组合使用。在一些实施方案中,本公开的化合物与CDK2、CDK7或CDK9抑制剂诸如塞利西尼、沃鲁西尼或米尔西尼组合使用。在一些实施方案中,本公开的化合物与CDK抑制剂诸如迪那西尼、罗尼西尼
ATM调节剂:本公开的化合物可与一种或多种调节ATM(上调或下调)的药物活性剂组合使用。在一些实施方案中,本文所述的化合物可与一种或多种ATM调节剂协同作用。在一些实施方案中,本文所述的化合物中的一者或多者可与所有ATM调节剂协同作用。
AKT抑制剂:在一些实施方案中,本公开的化合物与一种或多种抑制AKT(蛋白激酶B(PKB))的药物活性剂组合使用。在一些实施方案中,本文所述的化合物可与一种或多种AKT抑制剂协同作用。
n.与其他药物活性剂的组合治疗
在一些实例中,本公开的化合物与至少一种缓和PTEN(磷酸酶和张力蛋白同源物(phosphatase and tensin homolog))缺失的额外药物活性剂组合使用。在一些实例中,本公开的化合物与至少一种缓和Wip-1α过度表达的额外药物活性剂组合使用。在一些实例中,本公开的化合物与至少一种是核苷代谢抑制剂的额外药物活性剂组合使用。核苷代谢抑制剂的实例包括卡培他滨、吉西他滨和阿糖胞苷(Arac)。
下表列出了适于与本文所述的方法一起使用的额外药物活性剂。
/>
/>
/>
/>
/>
组合治疗的施用
本公开的化合物或包含本公开的化合物的药物组合物和至少一种额外药物活性剂或包含至少一种额外药物活性剂的药物组合物可同时地施用(即同时施用)或依序地施用(即依序施用)。
在一些实施方案中,以同一组合物形式或以单独组合物形式同时施用本公开的化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂。当同时施用药物时,化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂可含于同一组合物(例如包含化合物与至少额外药物活性剂两者的组合物)中或单独组合物中(例如化合物含于一种组合物中,并且至少额外药物活性剂含于另一组合物中)。
在一些实施方案中,依序施用化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂,即在施用额外药物活性剂之前或之后施用化合物。在一些实施方案中,在额外药物活性剂例如本文所述的任何额外治疗剂之前施用化合物。在一些实施方案中,在化合物之前施用药物活性剂例如本文所述的任何额外治疗剂。化合物和额外药物活性剂例如本文所述的任何额外治疗剂含于单独组合物中,该单独组合物可含于相同或不同包装中。
在一些实施方案中,化合物和额外药物活性剂例如本文所述的任何额外治疗剂的施用是并行的,即化合物的施用时期和该剂的施用时期彼此重叠。在一些实施方案中,化合物和额外药物活性剂例如本文所述的任何额外治疗剂的施用是非并行的。举例来说,在一些实施方案中,在施用额外药物活性剂例如本文所述的任何额外治疗剂之前终止化合物的施用。在一些实施方案中,在施用化合物之前终止额外药物活性剂例如本文所述的任何额外治疗剂的施用。这两种非并行施用之间的时期可在相隔数天至相隔数周的范围内。
可基于施用医师的判断在治疗的过程期间调整化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂的给药频率。当分开施用时,可以不同给药频率或间隔施用化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂。举例来说,可每周施用化合物,而可以更大或更小频率施用至少一种额外药物活性剂例如本文所述的任何额外治疗剂。或者,可每周两次施用化合物,而可以更大或更小频率施用至少一种额外药物活性剂例如本文所述的任何额外治疗剂。此外,可使用相同施用途径或使用不同施用途径施用化合物和至少一种额外药物活性剂例如本文所述的任何额外治疗剂。
用于疗法中的化合物和/或额外药物活性剂例如本文所述的任何额外治疗剂的治疗有效量可随所治疗的病况的性质、所需治疗时长、患者的年龄和状况而变化,并且可由主治医师确定。
在一些实施方案中,当本公开的化合物与至少一种额外药物活性剂例如本文所述的任何额外治疗剂组合施用时,相比于在单独施用化合物时,可以较低剂量给与化合物的剂量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约5mg/kg至约1000mg/kg;约50mg/kg至约600mg/kg;约150mg/kg至约600mg/kg;或约300mg/kg至约600mg/kg。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约5mg/kg至约25mg/kg;约25mg/kg至约50mg/kg;约50mg/kg至约75mg/kg;约75mg/kg至约100mg/kg;约100mg/kg至约125mg/kg;约125mg/kg至约150mg/kg;约150mg/kg至约200mg/kg;约200mg/kg至约250mg/kg;约250mg/kg至约300mg/kg;约300mg/kg至约350mg/kg;约350mg/kg至约400mg/kg;约400mg/kg至约450mg/kg;约450mg/kg至约500mg/kg;约500mg/kg至约550mg/kg;约550mg/kg至约600mg/kg;约600mg/kg至约700mg/kg;约700mg/kg至约800mg/kg;约800mg/kg至约900mg/kg;或约900mg/kg至约1000mg/kg。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约50mg/kg至约75mg/kg。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约75mg/kg至约150mg/kg。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约150mg/kg至约300mg/kg。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约300mg/kg至约600mg/kg。
在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约5mg/kg;约25mg/kg;约50mg/kg;约75mg/kg;约100mg/kg;约125mg/kg;约150mg/kg;约175mg/kg;约200mg/kg;约250mg/kg;约300mg/kg;约350mg/kg;约400mg/kg;约450mg/kg;约500mg/kg;约550mg/kg;约600mg/kg;约700mg/kg;约800mg/kg;约900mg/kg;或约1000mg/kg的量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约50mg/kg的量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约75mg/kg的量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约150mg/kg的量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约300mg/kg的量。在一些实施方案中,本公开的化合物在组合疗法中的剂量可为约600mg/kg的量。
在一些实施方案中,当本公开的化合物与至少一种额外药物活性剂例如本文所述的任何额外治疗剂组合施用时,相比于在单独施用化合物时,可以较低剂量给与至少一种额外药物活性剂的剂量。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约50μg至约100μg;约100μg至约150μg;约150μg至约200μg;约200μg至约250μg;约250μg至约300μg;约300μg至约350μg;约350μg至约400μg;约400μg至约450μg;约450μg至约500μg;约500μg至约600μg;约600μg至约700μg;约700μg至约800μg;约800μg至约900μg;或约900μg至约1000μg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约100μg至约150μg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约150μg至约200μg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约200μg至约250μg。
在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约50μg;约100μg;约150μg;约200μg;约250μg;约300μg;约350μg;约400μg;约450μg;或约500μg的量。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约200μg的量。
在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约1mg/kg至约5mg/kg;约5mg/kg至约25mg/kg;约25mg/kg至约50mg/kg;约50mg/kg至约75mg/kg;约75mg/kg至约100mg/kg;约100mg/kg至约150mg/kg;约150mg/kg至约200mg/kg;约200mg/kg至约250mg/kg;约250mg/kg至约300mg/kg;约300mg/kg至约350mg/kg;约350mg/kg至约400mg/kg;约400mg/kg至约450mg/kg;约450mg/kg至约500mg/kg;约500mg/kg至约600mg/kg;约600mg/kg至约700mg/kg;约700mg/kg至约800mg/kg;约800mg/kg至约900mg/kg;或约900mg/kg至约1000mg/kg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约1mg/kg至约5mg/kg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约100mg/kg至约150mg/kg。在一些实施方案中,至少一种额外药物活性剂在组合疗法中的剂量可为约200mg/kg至约250mg/kg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约1mg/kg至约500mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约150mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约1mg/kg至约250mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约150mg/kg至约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约1mg/kg至约500mg/kg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约5mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约75mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约5mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约150mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约5mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约300mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约5mg/kg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约5mg/kg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约100μg至约500μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约150mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约100μg至约500μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约150mg/kg至约300mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约100μg至约500μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约300mg/kg至约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量可为约100μg至约500μg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约75mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约150mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约300mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约600mg/kg;并且至少一种额外药物活性剂在组合疗法中的剂量是约200μg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约600mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约50mg/kg至约150mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约150mg/kg至约300mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量可为约300mg/kg至约600mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。
在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约50mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约75mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约150mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约300mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。在一些实施方案中,在组合疗法中施用的本公开的化合物的剂量是约600mg/kg;并且作为额外药物活性剂的抗PD-1剂在组合疗法中的剂量是约200μg。
在一些实施方案中,可一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可一天一次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可一天两次将药学上可接受量的本公开的化合物施用至对象在一些实施方案中,可一天三次将药学上可接受量的本公开的化合物施用至对象。
在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可每3天一次,一天一次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可每3天一次,一天两次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可每7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可每7天一次,一天一次将药学上可接受量的本公开的化合物施用至对象。在一些实施方案中,可每7天一次,一天两次将药学上可接受量的本公开的化合物施用至对象。
在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续1至50次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约5次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约10次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约15次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约20次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约25次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约30次剂量。在一些实施方案中,可每1、2、3、4、5、6或7天一次,一天1、2、3、4或5次将药学上可接受量的本公开的化合物施用至对象,持续约35次剂量。
在一些实施方案中,可每7天,一天一次将药学上可接受量的本公开的化合物施用至对象,持续约5次剂量。在一些实施方案中,可每7天,一天一次将药学上可接受量的本公开的化合物施用至对象,持续约10次剂量。在一些实施方案中,可每7天,一天两次将药学上可接受量的本公开的化合物施用至对象,持续约15次剂量。在一些实施方案中,可每3天,一天一次将药学上可接受量的本公开的化合物施用至对象,持续约20次剂量。在一些实施方案中,可每3天,一天一次将药学上可接受量的本公开的化合物施用至对象,持续约35次剂量。
在一些实施方案中,可每7天,一天两次将药学上可接受量的本公开的化合物施用至对象,持续约5次剂量。在一些实施方案中,可每7天,一天两次将药学上可接受量的本公开的化合物施用至对象,持续约15次剂量。
用于组合治疗的药物组合物
根据某些实施方案,化合物和额外药物活性剂例如本文所述的任何额外治疗剂在单一药物组合物内施用。在一些实施方案中,本公开的化合物和额外药物活性剂例如本文所述的任何额外治疗剂可以单一单位剂型提供以被一起摄取。根据一些实施方案,药物组合物还包含药学上可接受的稀释剂或载体。根据某些实施方案,本公开的化合物和额外药物活性剂例如本文所述的任何额外治疗剂在不同药物组合物内施用。在一些实施方案中,本公开的化合物和额外药物活性剂例如本文所述的任何额外治疗剂可以单独实体(例如在单独容器中)形式以单一单位剂量提供以同时或在某一时间差下施用。
在一些实施方案中,本公开的化合物和额外药物活性剂例如本文所述的任何额外治疗剂可通过相同施用途径施用。在一些实施方案中,本公开的化合物和额外药物活性剂例如本文所述的任何额外治疗剂可通过不同施用途径施用。在一些实施方案中,口服施用本公开的化合物和额外药物活性剂。在一些实施方案中,口服施用本公开的化合物,并且不口服施用额外药学上可接受的剂。在一些实施方案中,不口服施用本公开的化合物,并且口服施用额外药学上可接受的剂。
相较于未接受采用本公开的化合物和额外抗癌剂的组合疗法的对象,通过与该额外抗癌剂组合施用本公开的化合物来治疗病况可增加对象的中值存活时间。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可长于未接受任何癌症疗法的第二患者群体的中值存活时间。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可长于接受采用单独本公开的化合物的疗法的第二患者群体的中值存活时间。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可长于接受采用单独该额外抗癌剂的疗法的第二患者群体的中值存活时间。
在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可比未接受组合疗法的第二患者群体的中值存活时间长至少约50%、约60%、约70%、约80%、约90%、约100%、约110%、约120%、约130%、约140%、约150%、约160%、约170%、约180%、约190%、约200%、约210%、约220%、约230%、约240%、约250%、约260%、约270%、约280%、约290%、约300%、约310%、约320%、约330%、约340%、约350%、约360%、约370%、约380%、约390%、约400%、约410%、约420%、约430%、约440%、约450%、约460%、约470%、约480%、约490%或约500%。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可比未接受组合疗法的第二患者群体的中值存活时间长至少约50%。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可比未接受组合疗法的第二患者群体的中值存活时间长至少约100%。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可比未接受组合疗法的第二患者群体的中值存活时间长至少约150%。在一些实施方案中,接受采用本公开的化合物和额外抗癌剂的组合疗法的第一患者群体的中值存活时间可比未接受组合疗法的第二患者群体的中值存活时间长至少约200%。
治疗方法
本文提供了一种治疗有需要的对象的癌症的方法,该方法包括:(i)向该对象施用治疗有效量的化合物,其中该化合物结合至突变p53蛋白,并且使该突变p53蛋白重新符合p53的展现抗癌活性的构象;以及(ii)向该对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
本文还提供了一种治疗有需要的对象的癌症的方法,该方法包括:(i)向该对象施用治疗有效量的增加该对象中突变p53蛋白的抗癌活性的化合物;以及(ii)向该对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
在一些实施方案中,化合物结合至突变p53蛋白,并且使突变p53蛋白重新符合p53的展现抗癌活性的构象。
本文还提供了一种治疗癌症的方法,该方法包括:(i)向有需要的对象施用治疗有效量的结合至突变p53蛋白,并且使该突变p53蛋白重新符合p53的展现抗癌活性的构象的化合物;以及(ii)向该对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的额外抗癌剂,其中如果在于第一患者群体和第二患者群体中进行的治疗该癌症的对照研究中:(a)确定该第一患者群体的第一中值存活时间,其中该第一患者群体用该治疗有效量的结合至突变p53蛋白,并且使该突变p53蛋白重新符合p53的展现抗癌活性的构象的该化合物治疗;并且(b)确定该第二患者群体的第二中值存活时间,其中该第二患者群体用该治疗有效量的结合至突变p53蛋白,并且使该突变p53蛋白重新符合p53的展现抗癌活性的构象的该化合物以及该治疗有效量的该额外治疗剂治疗;则该第二中值存活时间比该第一中值存活时间长至少约50%。
在一些实施方案中,第二中值存活时间比第一中值存活时间长至少约100%。在一些实施方案中,第二中值存活时间比第一中值存活时间长至少约200%。
在一些实施方案中,化合物增加突变p53蛋白的稳定性。在一些实施方案中,癌症表达突变p53蛋白。在一些实施方案中,突变p53蛋白在氨基酸220处具有突变。在一些实施方案中,突变p53蛋白是p53Y220C。在一些实施方案中,相较于野生型p53,化合物选择性结合突变p53蛋白。在一些实施方案中,癌症是卵巢癌。在一些实施方案中,癌症是乳腺癌。在一些实施方案中,癌症是肺癌。在一些实施方案中,对象是人。
在一些实施方案中,化合物的施用是口服施用。在一些实施方案中,化合物的施用是皮下施用。在一些实施方案中,化合物的施用是局部施用。在一些实施方案中,化合物的治疗有效量是约1mg/kg至约500mg/kg。在一些实施方案中,化合物的治疗有效量是约100mg至约5000mg。在一些实施方案中,化合物的治疗有效量是约500mg至约2000mg。在一些实施方案中,化合物的治疗有效量是约250mg、约500mg、约750mg、约1000mg、约1250mg、约1500mg、约1750mg、约2000mg、约2250mg或约2500mg。在一些实施方案中,化合物的治疗有效量是约150mg。在一些实施方案中,化合物的治疗有效量是约300mg。在一些实施方案中,化合物的治疗有效量是约500mg。在一些实施方案中,化合物的治疗有效量是约600mg。在一些实施方案中,化合物的治疗有效量是约1200mg。在一些实施方案中,化合物的治疗有效量是约1500mg。在一些实施方案中,化合物的治疗有效量是约2000mg。
在一些实施方案中,抗癌剂是小分子。在一些实施方案中,抗癌剂是抗体。在一些实施方案中,抗癌剂是免疫检查点抑制剂。在一些实施方案中,免疫检查点抑制剂是抗PD-1剂。在一些实施方案中,抗PD-1剂是纳武利尤单抗。在一些实施方案中,抗PD-1剂是帕博利珠单抗。在一些实施方案中,抗PD-1剂是西米普利单抗(cemiplimab)。在一些实施方案中,免疫检查点抑制剂是抗PD-L1剂。在一些实施方案中,抗PD-L1剂是阿替利珠单抗(atezolizumab)。在一些实施方案中,抗PD-L1剂是阿维利尤单抗(avelumab)。在一些实施方案中,抗PD-L1剂是度伐利尤单抗(durvalumab)。在一些实施方案中,抗癌剂的施用是口服施用。在一些实施方案中,抗癌剂的施用是皮下施用。在一些实施方案中,抗癌剂的施用是局部施用。在一些实施方案中,抗癌剂的治疗有效量是约5mg/kg至约500mg/kg。在一些实施方案中,抗癌剂的治疗有效量是约10μg至约500μg。在一些实施方案中,抗癌剂的治疗有效量是约200μg。
药物代谢动力学和药物效应动力学数据可通过各种实验技术来获得。描述特定组合物的适当药物代谢动力学和药物效应动力学概况分量可由于人类对象中药物代谢的变化而变化。药物代谢动力学和药物效应动力学概况可基于对一组对象的平均参数的确定。该组对象包括适于确定代表性平均值的任何合理数目的对象,例如5名对象、10名对象、15名对象、20名对象、25名对象、30名对象、35名对象或更多。例如通过计算所测量的每种参数的所有对象的测量结果的平均值来确定平均值。可调节剂量以实现如本文所述的所需药物代谢动力学或药物效应动力学概况,诸如所需或有效血液概况。
药物效应动力学参数可为适于描述本发明的组合物的任何参数。举例来说,可在给药之后例如约零分钟、约1分钟、约2分钟、约3分钟、约4分钟、约5分钟、约6分钟、约7分钟、约8分钟、约9分钟、约10分钟、约11分钟、约12分钟、约13分钟、约14分钟、约15分钟、约16分钟、约17分钟、约18分钟、约19分钟、约20分钟、约21分钟、约22分钟、约23分钟、约24分钟、约25分钟、约26分钟、约27分钟、约28分钟、约29分钟、约30分钟、约31分钟、约32分钟、约33分钟、约34分钟、约35分钟、约36分钟、约37分钟、约38分钟、约39分钟、约40分钟、约41分钟、约42分钟、约43分钟、约44分钟、约45分钟、约46分钟、约47分钟、约48分钟、约49分钟、约50分钟、约51分钟、约52分钟、约53分钟、约54分钟、约55分钟、约56分钟、约57分钟、约58分钟、约59分钟、约60分钟、约零小时、约0.5小时、约1小时、约1.5小时、约2小时、约2.5小时、约3小时、约3.5小时、约4小时、约4.5小时、约5小时、约5.5小时、约6小时、约6.5小时、约7小时、约7.5小时、约8小时、约8.5小时、约9小时、约9.5小时、约10小时、约10.5小时、约11小时、约11.5小时、约12小时、约12.5小时、约13小时、约13.5小时、约14小时、约14.5小时、约15小时、约15.5小时、约16小时、约16.5小时、约17小时、约17.5小时、约18小时、约18.5小时、约19小时、约19.5小时、约20小时、约20.5小时、约21小时、约21.5小时、约22小时、约22.5小时、约23小时、约23.5小时或约24小时的时间时获得药物效应动力学概况。
药物代谢动力学参数可为适于描述化合物的任何参数。C
本文所述的化合物的T
本文所述的化合物的AUC
化合物的AUC
本文所述的化合物的血浆浓度可例如不小于约1ng/mL、不小于约5ng/mL、不小于约10ng/mL、不小于约15ng/mL、不小于约20ng/mL、不小于约25ng/mL、不小于约50ng/mL、不小于约75ng/mL、不小于约100ng/mL、不小于约150ng/mL、不小于约200ng/mL、不小于约300ng/mL、不小于约400ng/mL、不小于约500ng/mL、不小于约600ng/mL、不小于约700ng/mL、不小于约800ng/mL、不小于约900ng/mL、不小于约1000ng/mL、不小于约1200ng/mL,或可为本文所述的化合物的任何其他血浆浓度。血浆浓度可为例如约1ng/mL至约2,000ng/mL;约1ng/mL至约5ng/mL;约5ng/mL至约10ng/mL;约10ng/mL至约25ng/mL;约25ng/mL至约50ng/mL;约50ng/mL至约75ng/mL;约75ng/mL至约100ng/mL;约100ng/mL至约150ng/mL;约150ng/mL至约200ng/mL;约200ng/mL至约250ng/mL;约250ng/mL至约300ng/mL;约300ng/mL至约350ng/mL;约350ng/mL至约400ng/mL;约400ng/mL至约450ng/mL;约450ng/mL至约500ng/mL;约500ng/mL至约600ng/mL;约600ng/mL至约700ng/mL;约700ng/mL至约800ng/mL;约800ng/mL至约900ng/mL;约900ng/mL至约1,000ng/mL;约1,000ng/mL至约1,100ng/mL;约1,100ng/mL至约1,200ng/mL;约1,200ng/mL至约1,300ng/mL;约1,300ng/mL至约1,400ng/mL;约1,400ng/mL至约1,500ng/mL;约1,500ng/mL至约1,600ng/mL;约1,600ng/mL至约1,700ng/mL;约1,700ng/mL至约1,800ng/mL;约1,800ng/mL至约1,900ng/mL;或约1,900ng/mL至约2,000ng/mL。
在一些实施方案中,血浆浓度可为约2,500ng/mL、约3,000ng/mL、约3,500ng/mL、约4,000ng/mL、约4,500ng/mL、约5,000ng/mL、约5,500ng/mL、约6,000ng/mL、约6,500ng/mL、约7,000ng/mL、约7,500ng/mL、约8,000ng/mL、约8,500ng/mL、约9,000ng/mL、约9,500ng/mL或约10,000ng/mL。在一些实施方案中,血浆浓度可为约10,000ng/mL、约15,000ng/mL、约20,000ng/mL、约25,000ng/mL、约30,000ng/mL、约35,000ng/mL、约40,000ng/mL、约45,000ng/mL、约50,000ng/mL、约55,000ng/mL、约60,000ng/mL、约65,000ng/mL、约70,000ng/mL或约75,000ng/mL。
药物效应动力学参数可为适于描述本公开的组合物的任何参数。举例来说,在肿瘤细胞系或异种移植研究中,药物效应动力学概况可展现肿瘤细胞的活力表型降低或肿瘤大小降低,例如约24小时、约48小时、约72小时或1周。
实施例
实施例1:本公开的化合物
制备了具有炔基、芳基和杂芳基接头的吲哚化合物。炔基连接的吲哚化合物显示于表1中。芳基连接的吲哚化合物显示于表2中。杂芳基连接的吲哚化合物显示于表3中。
表1.本公开的炔基吲哚化合物。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
表2.本公开的芳基连接的吲哚化合物。
/>
/>
/>
/>
表3.本公开的杂芳基连接的吲哚化合物。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
实施例2:小鼠肉瘤模型(MT373)中化合物1和抗PD-1剂的组合。
化合物1是在1位处被三氟乙基取代;在2位处被丙炔基氨基-甲氧基-N-甲基苯甲酰胺基团取代;并且在4位处被经杂环取代的氨基取代的吲哚化合物。
以单一剂形式以及与抗PD-1剂组合的形式在小鼠同基因肉瘤模型(MT373)中测试化合物1的功效。将C57Bl/6小鼠用MT373细胞进行植入,并且使肿瘤生长至约80mm
动物:将雌性C57Bl/6小鼠(总计120只)驯化1周,并且在开始研究时,该小鼠是8-10周龄。将动物成群舍饲(N=5)在通风的笼中。以12小时循环(6:30am-6:30pm)提供荧光照明。每日监测和记录温度和湿度,并且分别维持在68-72℉(20-22.2℃)和30-70%湿度之间。不限量提供18%大豆的经照射啮齿动物饲料和经高压灭菌的酸化水。
肿瘤细胞培养:在具有10%胎牛血清的DMEM培养基中培养MT373细胞。将细胞用PBS洗涤,并且以具有92%活力的总计6.59×108个细胞计数。通过离心将细胞旋转,并且以5×10
对小鼠的植入:通过将细胞悬液抽取至配备有25G 5/8”针的1mL结核菌素注射器中来将细胞准备用于注射。手动约束个体小鼠,用70%乙醇拭子将注射部位(右侧腹)消毒,并且皮下注射200μL的细胞悬液。
随机化和研究设置:监测经植入的小鼠的可触知肿瘤。在植入后五天,通过数字卡尺测定具有可触知肿瘤的小鼠的肿瘤大小。根据肿瘤大小选择小鼠,并且随机分入六个治疗组中。平均肿瘤体积(mm
表4A
表4B
/>
肿瘤体积的测量和计算:使用以下方程计算肿瘤体积:(最长直径×最短直径
每周一天,一天两次(BID,相隔8小时),持续四次剂量(2Q7D×4)用媒介物对照(2% HPC、0.5%吐温80,在水中,(w/v/v))对组1动物PO给药。以200μg持续35次剂量(Q3D×35)用抗PD-1剂对组2动物腹膜内(IP)给药。一天两次(BID,相隔8小时),分别以75mg/kg持续6次剂量(2Q7D×6)或150mg/kg持续15次剂量(2Q7D×15)用化合物1对组3和组4动物PO给药。分别用75和150mg/kg持续15次剂量(2Q7D×15)的化合物1与200μg持续15次剂量(Q3D×15)的抗PD-1剂的组合对组5和组6动物给药。表5显示六个功效研究组和给药方案。在第102天停止所有给药,并且监测不具有可触知肿瘤的剩余小鼠的存活。确定每个肿瘤达到2000mm
表5
/>
植入雌性C57Bl/6小鼠中的MT373小鼠同基因肉瘤肿瘤在27天中从平均77.4mm
在第27天时,在用抗PD-1剂、75mg/kg化合物1、150mg/kg化合物1以及75mg/kg+200μg抗PD-1剂组合治疗的动物中分别观察到39.6%、57.1%、95.7%以及91.2%的肿瘤生长抑制(TGI)。在第27天时,在用150mg/kg化合物1+抗PD-1剂治疗的小鼠中观察到92.3%的肿瘤消退。图1显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,小鼠同基因肉瘤模型(MT373)中的肿瘤体积(mm
图2显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,小鼠同基因肉瘤模型(MT373)中的肿瘤体积(mm
表6和表7分别显示在研究的27天和研究的185天中的平均肿瘤生长抑制百分比(%)。表8显示6个小鼠组的以天计的中值存活时间以及相对于媒介物组的存活期增加。
表6
表7(除非指示,否则n=10)
/>
/>
/>
表8
/>
图3显示在接受用媒介物;200μg抗PD-1剂;75mg/kg化合物1;150mg/kg化合物1;75mg/kg化合物1+抗PD-1剂;或150mg/kg化合物1+抗PD-1剂进行的治疗后,用MT373小鼠同基因肉瘤肿瘤植入的个体C57B1/6小鼠中肿瘤体积(mm
图4显示在接受用媒介物;抗PD-1剂;75mg/kg化合物1;150mg/kg化合物1;75mg/kg化合物1+抗PD-1剂;或150mg/kg化合物1+抗PD-1剂进行的治疗后,小鼠的存活百分比的变化。表9概述六个治疗组的中值存活时间(MST)。表10和表11分别显示第0-66研究日和第70-185研究日的个体肿瘤体积。
表9
表10
/>
/>
/>
/>
/>
表11
/>
/>
/>
体重:在研究的过程期间,平均小鼠体重得到良好维持。到研究结束时(第27天),用媒介物对照给药的小鼠平均是22.9g,变化百分比在研究早期的1.36%至+27.74%之间变化。被施用抗PD-1剂的小鼠在研究早期减轻1.38%体重,但得到恢复并且截至第27天平均增加18.15%。一只小鼠(6)在第6天减轻16.6%,但截至第13天得到恢复,体重减轻1.1%。被施用化合物1的小鼠(组3-6)也在整个研究中良好维持体重,并且没有个体小鼠减轻超过5%体重。截至第27天,组3增加12.96%,组4增加10.02%,组5增加11.65%,并且组6增加9.60%。
表11显示在研究中小鼠体重的平均变化百分比(除非另外指示,否则n=10;n/a=组中没有小鼠)。表12显示在研究中第0-66天的个体小鼠体重。表13显示在研究中第70-185天的个体小鼠体重。图5显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×35);75mg/kg化合物1(2Q7D×6);150mg/kg化合物1(2Q7D×15);75mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35);或150mg/kg化合物1(2Q7D×15)+抗PD-1剂(Q3D×35)进行的治疗后,用MT373小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠的体重变化百分比的变化。
表11
/>
/>
/>
/>
表12
/>
/>
/>
/>
/>
/>
表13
/>
/>
/>
临床观察结果:化合物1在整个研究中被良好耐受,没有获得对小鼠的临床观察结果。被施用200μg Q3D抗PD-1剂的组2中的一只小鼠(7)显示坏死的肿瘤,被施用75mg/kg2Q7D化合物1+200μg Q3D抗PD-1剂的组5中的一只小鼠(8)也是这样。表14显示治疗组中个体小鼠的死亡日期和相关临床观察结果。
表14
/>
/>
/>
/>
在小鼠同基因肉瘤模型(MT373)中测试化合物1与抗PD-1剂的组合的剂量响应性抗肿瘤作用。经媒介物对照治疗的动物具有20.94天的中值存活时间。抗PD-1剂以200μg/小鼠IP给药,并且导致39.6% TGI和27.14天的中值存活期。化合物1以75mg/kg或150mg/kg口服给药,导致截至第27天分别有57.1%和95.7% TGI,以及分别为32和42.9天的中值存活时间。截至研究的第27天,用组合疗法75mg/kg化合物1+200μg抗PD-1剂和150mg/kg化合物1+200μg抗PD-1剂给药的小鼠分别产生91.2% TGI和92.3%消退。相对于单药疗法,组合疗法类似地改善中值存活时间,其中低剂量组合导致43.78天的中值存活期(相较于媒介物对照,存活期延长22.84天)。高剂量组合治疗延迟中值存活时间至>185天,并且相较于媒介物对照,存活期延长>164天。在第102天停止给药之后,连续监测小鼠直至第185天。抗PD-1剂组具有一个处于停滞的残余肿瘤和10%治愈率;150mg/kg化合物1 2Q7D×15组具有10%治愈率;75mg/kg 2Q7D×15化合物1+Q3D×35抗PD-1剂组具有30%治愈率,其中1只小鼠具有重新生长的肿瘤,并且必须在第111天时被安乐死;并且高剂量组合组150mg/kg 2Q7D×15化合物1+抗PD-1剂(Q3D×35)具有40%治愈率和1只具有处于停滞的残余肿瘤的小鼠。
每周一天施用化合物1导致剂量响应性抗肿瘤作用,达成肿瘤生长延迟。与抗PD-1剂的组合疗法显著改善抗肿瘤作用,在最高剂量水平下显示消退、治愈和中值存活时间显著增加。
实施例3:小鼠肉瘤模型(MT245)中化合物1和抗PD-1剂的组合。
以单一剂形式以及与抗PD-1剂组合在小鼠同基因肉瘤模型(MT245)中测试化合物1的功效。将C57Bl/6小鼠用MT245细胞进行植入,使肿瘤生长至约77mm
动物:将雌性C57Bl/6小鼠(总计90只)驯化1周,并且在开始研究时,该小鼠是8-10周龄。将动物成群舍饲(N=5)在通风的笼中。以12小时循环(6:30am-6:30pm)提供荧光照明。每日监测和记录温度和湿度,并且分别维持在68-72℉(20-22.2℃)和30-70%湿度之间。不限量提供18%大豆经照射啮齿动物饲料和经高压灭菌的酸化水(pH 2.5-3)。
肿瘤细胞培养:根据具有10%胎牛血清的DMEM培养基培养MT245细胞。将细胞用PBS洗涤,并且以具有85%活力的总计2.33×108个细胞计数。将细胞离心,并且以1×10
对小鼠的植入:通过将细胞悬液抽取至配备有25G 5/8”针的1mL结核菌素注射器中来将细胞准备用于注射。手动约束个体小鼠,用70%乙醇拭子将注射部位(右侧腹)消毒,并且皮下注射100μL的细胞悬液。
随机化和研究设置:监测经植入的小鼠的可触知肿瘤。在植入后六天,通过数字卡尺测定具有可触知肿瘤的小鼠的肿瘤大小。根据肿瘤大小选择小鼠,并且随机分入六个治疗组中。平均肿瘤体积(mm
表15
表15A
表15B
每周一次,持续三次剂量(Q7D×3)用媒介物对照(2% HPC、0.5%吐温80,在水中,(w/v/v))对组1动物PO给药。每三天一次,持续19次剂量(Q3D×19),以200μg用抗PD-1剂对组2动物IP给药。分别采用以下方式一周一次对组3、4和5动物PO给药:150mg/kg化合物1,持续5次剂量(Q7D×5);300mg/kg,持续9次剂量(Q7D×9);和600mg/kg化合物1,持续9次剂量(Q7D×9)。分别用150和300mg/kg持续9次剂量(Q7D×9)的化合物1与200μg持续19次剂量(Q3D×19)的抗PD-1剂的组合对组6和7动物给药。在第55天终止所有给药,并且监测剩余小鼠的存活。当个体肿瘤达到约2000mm
表16显示七个功效研究组和研究组的给药方案。表17显示研究组的以天计的中值存活时间以及相对于媒介物对照组中的小鼠的存活时间增加。表18显示每个研究组的小鼠的临床观察结果和死亡日期。
表16
表17
表18
/>
/>
/>
/>
肿瘤体积的测量和计算:使用以下方程计算肿瘤体积:(最长直径×最短直径
在第20天时,在用200μg抗PD-1剂Q3D×7;150mg/kg Q7D×3化合物1;300mg/kgQ7D×3化合物1;以及150mg/kg Q7D×3化合物1+200μg抗PD-1剂Q3D×7治疗的动物中分别观察到55.19%、42.62%、95.58%以及97.34%的肿瘤生长抑制(TGI)。在第20天时,在用600mg/kg Q7D×3化合物1;和300mg/kg Q7D×3化合物1+200μg抗PD-1剂Q3D×7治疗的小鼠中分别观察到100%和99.93%的肿瘤消退。当相较于媒介物对照(19.3天)时,在接受高剂量的化合物1以及化合物1和抗PD-1剂的两种剂量水平组合的小鼠中,定义为肿瘤达到2000mm
植入雌性C57Bl/6小鼠中的MT245小鼠同基因肉瘤肿瘤在20天中从平均77mm
图6显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠中的肿瘤体积(mm
表19
表20
/>
/>
/>
用媒介物对照(2% HPC、0.5%吐温80)治疗的MT245肿瘤显示一致生长,动物截至第20天达到约2000mm
图7显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的雌性C57B1/6小鼠中的肿瘤体积(mm
表21
/>
/>
/>
/>
/>
表22.研究中的个体肿瘤体积(第73-157天)
/>
/>
/>
体重:在研究的过程期间,小鼠体重得到良好维持(5)。到研究结束时(第20天),用媒介物对照给药的小鼠平均是20.33g,变化百分比在研究早期的-0.28%至+11.69%之间变化。被施用抗PD-1剂的小鼠在整个研究中体重始终增加,并且截至第34天增加16.65%。一只(7)在第14天时开始体重减轻,并且截至第17天具有-9.5%的重量变化并在第20天由于肿瘤负荷而被安乐死。接受150mg/kg化合物1的两只小鼠(1和9)在第20天时具有-5.9%和-7.5%的体重变化,此时该小鼠由于肿瘤负荷而被安乐死,这个组中的所有其他小鼠的体重减轻至多是5%。截至第123天,组4增加26.82%,组5增加23.01%,组6增加24.82%,并且组7增加25.66%。在组5中,一只小鼠(5)在早期体重减轻>5%,但截至第17天得到恢复,并且组6中的一只小鼠(10)大约第31天体重减轻>5%,但也得到恢复。
图10显示在接受用媒介物(Q7D×3);200μg抗PD-1剂(Q3D×19);150mg/kg化合物1(Q7D×5);300mg/kg化合物1(Q7D×9);600mg/kg化合物1(Q7D×9);150mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19);或300mg/kg化合物1(Q7D×9)+200μg抗PD-1剂(Q3D×19)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的C57B1/6小鼠的体重百分比的变化。表23显示在研究中小鼠的体重的平均变化百分比(除非指示,否则n=10)。表24显示在研究中第0-67天的个体小鼠体重。表25显示在研究中第73-157天的个体小鼠体重。
表23
/>
/>
/>
/>
表24
/>
/>
/>
/>
/>
/>
/>
/>
/>
表25
/>
/>
/>
/>
在小鼠同基因肉瘤模型(MT245)中测试呈单一剂形式以及与抗PD-1剂组合的化合物1的剂量响应性抗肿瘤作用。经媒介物对照治疗的动物具有19.30天的中值存活时间。抗PD-1剂以200μg/小鼠IP给药,并且导致在第20天时55.19% TGI和24.89天的中值存活期。化合物1以150mg/kg Q7D×5、300mg/kg Q7D×9和600mg/kg Q7D×9以单一剂形式PO给药,分别导致截至研究的第20天42.62% TGI、95.58% TGI和100%消退。相较于媒介物,单药疗法组中的中值存活期分别增加至25.04、41.21和>157天。用150mg/kg Q7D×9化合物1+200μg抗PD-1剂Q7D×19和600mg/kg Q7D×9化合物1+200μg抗PD-1剂Q7D×19给药的小鼠截至研究的第20天分别产生97.34% TGI和99.93%消退,并且展现中值存活期增加至>157天。
在第55天停止给药之后,连续监测小鼠直至第157天。肿瘤不可触知或被治愈的小鼠在157天期间不显示肿瘤再生长的迹象。抗PD-1剂Q3D×9组具有一例治愈,300mg/kg化合物1组Q7D×9具有4例治愈,600mg/kg化合物1组Q7D×9具有9例治愈,150mg/kg Q7D×9化合物1+抗PD-1剂Q3D×19组具有5例治愈,并且300mg/kg Q7D×9化合物1+抗PD-1剂Q3D×19组具有10例治愈。
化合物1在整个给药时期中被良好耐受,并且仅在研究早期(至多第25天)报告了各组中若干小鼠的最小重量减轻(<10%)。当肿瘤达到约2000mm
表26
每周一次施用化合物1导致剂量响应性抗肿瘤作用,在较低剂量下达成肿瘤生长延迟,并且在较高剂量下达成完全消退,并且导致中值存活时间的剂量响应性增加。与抗PD-1剂的组合疗法显著改善在较低剂量的化合物1下的抗肿瘤作用,显示消退、治愈和中值存活时间显著增加。图11显示在接受用媒介物;150mg/kg化合物1(Q7D×2);300mg/kg化合物1(Q7D×2);或600mg/kg化合物1(Q7D×2)进行的治疗后,用MT245小鼠同基因肉瘤肿瘤植入的C57B1/6小鼠的肿瘤体积(mm
实施例4:小鼠肉瘤(MT373)模型中化合物2与抗PD-1剂的组合
化合物2是在1位处被三氟乙基取代;在2位处被丙炔基氨基-甲氧基-甲基磺酰基苯基取代;并且在4位处被经杂环取代的氨基取代的吲哚化合物。
在各种剂量水平和方案下以及与一种剂量方案的抗PD-1剂组合的化合物2在皮下小鼠同基因肉瘤模型(MT373)中的功效。将有免疫能力的小鼠(C57Bl/6)用MT373细胞进行皮下植入,并且在植入后第6天随机分入研究组中,此时肿瘤是约75mm
动物:将雌性C57Bl/6小鼠(总计120只)驯化1周,并且在开始研究时,该小鼠是8-10周龄。将动物成群舍饲(N=5)在通风的笼中。以12小时循环(6:30am-6:30pm)提供荧光照明。每日监测和记录温度和湿度,并且分别维持在68-72℉(20-22.2℃)和30-70%湿度之间。不限量提供18%大豆经照射啮齿动物饲料和经高压灭菌的酸化水(pH 2.5-3)。
肿瘤细胞培养:在具有10%胎牛血清的DMEM培养基中培养MT373细胞。将细胞用PBS洗涤,并且以具有93.5%活力的总计5.67×10
对小鼠的植入:通过将细胞悬液抽取至配备有25G 5/8”针的1mL结核菌素注射器中来将细胞准备用于注射。手动约束个体小鼠,用70%乙醇拭子将注射部位(右侧腹)消毒,并且皮下注射200μL的细胞悬液。
随机化和研究设置:监测经植入的小鼠的可触知肿瘤。在植入后五天,通过数字卡尺测定具有可触知肿瘤的小鼠的肿瘤大小。根据肿瘤大小选择小鼠,并且随机分入六个治疗组中。平均肿瘤体积(mm
表27A
表27B
肿瘤体积的测量和计算:使用以下方程计算肿瘤体积:(最长直径×最短直径
继续研究直至所有活跃生长的肿瘤达到2000mm
接受媒介物对照的小鼠存活17.3天,而用抗PD-1剂给药的小鼠存活24天。每日以50或100mg/kg用化合物2以单一剂形式给药的小鼠分别存活28和>182天;而150和300mg/kg的每周一日、一日两次方案导致30.8和47.8天中值存活期。对于每日100mg/kg组,71%的小鼠存活直至研究终止,而在300mg/kg 2Q7D组中,20%存活。当将次有效剂量的化合物250mg/kg QD和150mg/kg 2Q7D与抗PD-1剂组合时测量到中值存活期显著增加,导致两个组的中值存活期均>182。对于50mg/kg QD化合物2+抗PD-1剂组,在182天时,89%的小鼠存活。在150mg/kg 2Q7D+抗PD-1剂组中,78%的小鼠存活。
截至研究的第20天,被施用单独化合物2的小鼠展现74% TGI(50mg/kg QD×44)、40%消退(100mg/kg QD×71)、92% TGI(150mg/kg2Q7D×10)和99% TGI(300mg/kg 2Q7D×11)的剂量响应性单一剂活性。截至研究的第20天,单独抗PD-1剂导致72% TGI。相较于媒介物对照,在第20天时,抗PD-1剂与以50mg/kg QD×71或150mg/kg 2Q7D×11施用的化合物2的组合分别导致39%和24%的消退。
表28显示用不同剂量的媒介物、抗PD-1剂、化合物2以及化合物2与抗PD-1剂的组合治疗的9个研究组。表29显示在终点(182天)时小鼠的存活时间。
表28
表29
植入雌性C57Bl/6小鼠中的MT373小鼠肉瘤肿瘤在20天中从平均75.9mm
图12显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的肿瘤体积(mm
表30
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
表31
/>
/>
表32
/>
表33
/>
/>
/>
在媒介物对照小鼠被压垮并且由于肿瘤负荷(2000mm
计算单一剂给药组的中值存活期,其中媒介物对照组具有17.3天的中值存活期。对于根据每日给药方案以50mg/kg QD×44和100mg/kg QD×71施用化合物2的小鼠,中值存活期分别是28天和>182.0天。截至研究终止,100mg/kg QD×71组具有71%小鼠(2例肿瘤停滞和3例治愈,即皮肤下没有可触知肿瘤)存活。相较于媒介物对照,以100mg/kg QD×71施用化合物2也显示>164天存活期延长。对于根据每日两次一周一次给药方案以150mg/kg2Q7D×10和300mg/kg 2Q7D×11施用化合物2的小鼠,中值存活期分别是30.8天和47.8天。截至研究终止,300mg/kg 2Q7D×11组具有20%小鼠存活(1例肿瘤停滞和1例治愈)。
还计算相较于单一剂,两个组合组的中值存活期。组2中的小鼠被施用单独抗PD-1剂,并且相较于媒介物对照组中的17.3天,中值存活时间仅略微增加至24天。对于两个组合组,相较于任一单一剂,共同施用化合物2和抗PD-1剂均展现存活期增加。相较于单一剂分别28天和24天,被施用50mg/kg QD×71化合物2和200μg抗PD-1剂Q3D×24的组7中的小鼠显示>182天的中值存活期。相较于单一剂分别30.8和24天,被施用150mg/kg 2Q7D×11化合物2和200μg抗PD-1剂Q3D×24的组8中的小鼠显示>182天的中值存活期。观察到相较于媒介物对照,在两个组合组中,存活期延长均>164天。在研究终止时,接受50mg/kg QD×71化合物2和200μg抗PD-1剂Q3D×24的组具有89%的小鼠(2例肿瘤停滞和6例治愈)存活。在研究结束时,接受150mg/kg 2Q7D×11化合物2和200μg抗PD-1剂Q3D×24的组具有78%存活(2例肿瘤停滞和5例治愈)小鼠。
图15显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的存活百分比的变化。表34显示每个研究组的小鼠的临床观察结果和死亡日期。表35显示动物的MST。
表34
/>
/>
/>
/>
/>
/>
表35
体重:在研究的过程期间,平均小鼠体重得到良好维持。到研究结束时(第20-23天),用媒介物对照给药的小鼠平均是21.9-22.4g,变化百分比在研究早期的0.33%至到研究结束时的+18.13-22.4%之间变化。一只小鼠(#10)在第2天减轻>10%,但截至第16天得到恢复。截至第20天,被施用抗PD-1剂的小鼠平均增加11.8%。组4、5和8中的小鼠未经历任何超过10%的体重减轻,并且在第20天时分别平均增加4.6%、3.9%和5.6%。然而在组3中,一只小鼠(#10)在第2天减轻>10%体重,但在第13天得到恢复,在组6中,一只小鼠(#1)在第2天减轻>10%体重,并且截至第6天得到恢复,并且在组7中,一只小鼠(#9)在第6天减轻>10%体重,并且截至第23天得到恢复。截至第23天,平均来说,组3增加9.7%,组6增加7.5%,并且组7增加5.5%。
图16显示在接受用媒介物;抗PD-1剂;50mg/kg化合物2(QD);100mg/kg化合物2(QD);或50mg/kg化合物2(QD)+抗PD-1剂进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的存活百分比的变化。图17显示在接受用媒介物(2Q7D×4);200μg抗PD-1剂(Q3D×7);50mg/kg化合物2(QD×44);100mg/kg化合物2(QD×71);150mg/kg化合物2(2Q7D×10);300mg/kg化合物2(2Q7D×11);50mg/kg化合物2(QD×71)+200μg抗PD-1剂(Q3D×24);或150mg/kg化合物2(2Q7D×11)+200μg抗PD-1剂(Q3D×24)进行的治疗后,用MT373小鼠肉瘤肿瘤植入的C57B1/6小鼠的体重百分比的变化。表36显示在研究中第0-69天的个体小鼠体重。表37显示在研究中第72-182天的个体小鼠体重。仅显示组4和6-8中留在研究中的小鼠。表38显示研究中体重的平均变化百分比(除非指示,否则n=10)。
表36
/>
/>
/>
/>
/>
/>
/>
表37
/>
/>
表38
/>
/>
/>
/>
/>
/>
临床观察结果:总的来说,化合物2在整个研究中被良好耐受。一些实验室意外和濒死小鼠记录在表38中。这些包括被施用50mg/kg QD×44化合物2的组3中的一只小鼠(#4),被施用100mg/kg QD×71化合物2的组4中的3只小鼠(#2、#9、#10),被施用150mg/kg2Q7D×10化合物2的组5中的一只小鼠(#7),被施用50mg/kg QD×71化合物2+200μg Q3D×24抗PD-1剂的组7中的一只小鼠(#6),以及被施用150mg/kg2Q7D×11化合物2+200μg Q3D×24抗PD-1剂的组8中的一只小鼠(#5)。
这个研究被设计来在小鼠同基因肉瘤模型(MT373)中测试单独以及与抗PD-1剂组合的化合物2的剂量响应性抗肿瘤作用。以两种给药方案即每周一日、一日一次和一日两次评估单一剂活性。化合物2每日以50mg/kg或100mg/kg PO给药,并且截至第20天分别展现74% TGI和39.9%消退。化合物2还每周一日、一日两次以150mg/kg或300mg/kg PO给药,并且分别展现92%和99.2% TGI。为评估抗PD-1剂和化合物2的组合,抗PD-1剂以单一剂形式以200μg/小鼠IP给药,并且在第20天时展现72.3% TGI。用化合物2和抗PD-1剂的组合给药的小鼠分别展现在50mg/kg每日剂量的化合物2+抗PD-1剂下38.6%消退和在150mg/kg每周一日、一日两次剂量的化合物2+抗PD-1剂下23.5%消退。单独以及与抗PD-1剂组合的化合物2在整个给药时期中被良好耐受。
在第182天时终止研究,计算所有组的中值存活期作为肿瘤达到2000mm
在第70天停止给药之后,连续监测小鼠的肿瘤生长直至第182天。两个单一剂组具有一些残余肿瘤或治愈。在研究终止时,100mg/kg化合物2组具有71%的小鼠存活,并且300mg/kg化合物2组具有20%的小鼠存活。然而,观察到相较于单一剂,两个组合组中处于停滞的肿瘤或治愈的数目增加。在研究终止时,50mg/kg化合物2+抗PD-1剂组具有89%的小鼠存活,并且150mg/kg化合物2+抗PD-1剂组具有78%的小鼠存活。
总之,每周一日、一日一次或一日两次施用化合物2导致剂量响应性抗肿瘤作用,在较高剂量下达成肿瘤生长延迟和肿瘤消退。将次有效剂量水平的化合物2与抗PD-1剂组合显著改善抗肿瘤作用,显示消退、治愈和中值存活时间显著增加。
实施方案
以下非限制性实施方案提供了本发明的说明性实例,但不限制本发明的范围。
实施方案1.一种治疗有需要的对象的癌症的方法,所述方法包括:(i)向所述对象施用治疗有效量的化合物,其中所述化合物结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
实施方案2.如实施方案1所述的方法,其中所述化合物增加所述突变p53蛋白的稳定性。
实施方案3.如实施方案1或2所述的方法,其中所述癌症表达所述突变p53蛋白。
实施方案4.如实施方案1-3中的任一者所述的方法,其中所述突变p53蛋白在氨基酸220处具有突变。
实施方案5.如实施方案1-4中的任一者所述的方法,其中所述突变p53蛋白是p53Y220C。
实施方案6.如实施方案1-5中的任一者所述的方法,其中相较于野生型p53,所述化合物选择性结合所述突变p53蛋白。
实施方案7.如实施方案1-6中的任一者所述的方法,其中所述癌症是卵巢癌。
实施方案8.如实施方案1-6中的任一者所述的方法,其中所述癌症是乳腺癌。
实施方案9.如实施方案1-6中的任一者所述的方法,其中所述癌症是肺癌。
实施方案10.如实施方案1-9中的任一者所述的方法,其中所述化合物的所述施用是口服施用。
实施方案11.如实施方案1-9中的任一者所述的方法,其中所述化合物的所述施用是皮下施用。
实施方案12.如实施方案1-9中的任一者所述的方法,其中所述化合物的所述施用是局部施用。
实施方案13.如实施方案1-12中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg至约1200mg。
实施方案14.如实施方案1-13中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg。
实施方案15.如实施方案1-13中的任一者所述的方法,其中所述化合物的所述治疗有效量是约1200mg。
实施方案16.如实施方案1-13中的任一者所述的方法,其中所述化合物的所述治疗有效量是约2000mg/kg。
实施方案17.如实施方案1-16中的任一者所述的方法,其中所述对象是人。
实施方案18.如实施方案1-17中的任一者所述的方法,其中所述抗癌剂是小分子。
实施方案19.如实施方案1-17中的任一者所述的方法,其中所述抗癌剂是抗体。
实施方案20.如实施方案1-17中的任一者所述的方法,其中所述抗癌剂是免疫检查点抑制剂。
实施方案21.如实施方案1-17或20中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-1剂。
实施方案22.如实施方案1-17、20或21中的任一者所述的方法,其中所述抗PD-1剂是纳武利尤单抗。
实施方案23.如实施方案1-17、20或21中的任一者所述的方法,其中所述抗PD-1剂是帕博利珠单抗。
实施方案24.如实施方案1-17、20或21中的任一者所述的方法,其中所述抗PD-1剂是西米普利单抗。
实施方案25.如实施方案1-17或20中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-L1剂。
实施方案26.如实施方案1-17、20或25中的任一者所述的方法,其中所述抗PD-L1剂是阿替利珠单抗。
实施方案27.如实施方案1-17、20或25中的任一者所述的方法,其中所述抗PD-L1剂是阿维利尤单抗。
实施方案28.如实施方案1-17、20或25中的任一者所述的方法,其中所述抗PD-L1剂是度伐利尤单抗。
实施方案29.如实施方案1-28中的任一者所述的方法,其中所述抗癌剂的所述施用是口服施用。
实施方案30.如实施方案1-28中的任一者所述的方法,其中所述抗癌剂的所述施用是皮下施用。
实施方案31.如实施方案1-28中的任一者所述的方法,其中所述抗癌剂的所述施用是局部施用。
实施方案32.如实施方案1-31中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约5mg/kg至约500mg/kg。
实施方案33.如实施方案1-31中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约10μg至约500μg。
实施方案34.如实施方案1-31或33中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约200μg。
实施方案35.如实施方案1-34中的任一者所述的方法,其中所述化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-A是连接基团;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
实施方案36.如实施方案35所述的方法,其中A是亚烷基、亚烯基或亚炔基,其各自是被取代的或未被取代的。
实施方案37.如实施方案35所述的方法,其中A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案38.如实施方案35或36所述的方法,其中所述化合物具有下式:
实施方案39.如实施方案35-38中的任一者所述的方法,其中Q
实施方案40.如实施方案35-38中的任一者所述的方法,其中Q
实施方案41.如实施方案35-40中的任一者所述的方法,其中m是1。
实施方案42.如实施方案35-40中的任一者所述的方法,其中m是2。
实施方案43.如实施方案35-42中的任一者所述的方法,其中Y是N。
实施方案44.如实施方案35-42中的任一者所述的方法,其中Y是O。
实施方案45.如实施方案35-44中的任一者所述的方法,其中每个R
实施方案46.如实施方案35-45中的任一者所述的方法,其中R
实施方案47.如实施方案35-45中的任一者所述的方法,其中R
实施方案48.如实施方案35-47中的任一者所述的方法,其中R
实施方案49.如实施方案35、36、38、40、41、43、45-48中的任一者所述的方法,其中所述化合物具有下式:
其中环A是被取代的或未被取代的环状基团。
实施方案50.如实施方案35-49中的任一者所述的方法,其中R
实施方案51.如实施方案35-50中的任一者所述的方法,其中R
实施方案52.如实施方案35-51中的任一者所述的方法,其中R
实施方案53.如实施方案35-52中的任一者所述的方法,其中R
实施方案54.如实施方案35、36、38、40、41、43或45-53中的任一者所述的方法,其中所述化合物具有下式:
实施方案55.如实施方案35、36、38、40、41、43或45-54中的任一者所述的方法,其中环A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案56.如实施方案35、36、38、40、41、43或45-55中的任一者所述的方法,其中环A是被取代的芳基。
实施方案57.如实施方案35、36、38、40、41、43或45-55中的任一者所述的方法,其中环A是被取代的杂芳基。
实施方案58.如实施方案35、36、38、40、41、43或45-55中的任一者所述的方法,其中环A是被取代的杂环基。
实施方案59.如实施方案35-58中的任一者所述的方法,其中R
实施方案60.如实施方案35-59中的任一者所述的方法,其中R
实施方案61.如实施方案35-60中的任一者所述的方法,其中R
实施方案62.如实施方案35、36、38、40、41、43或45-61中的任一者所述的方法,其中所述化合物具有下式:
实施方案63.如实施方案35-62中的任一者所述的方法,其中每个R
实施方案64.如实施方案35-63中的任一者所述的方法,其中R
实施方案65.如实施方案35-64中的任一者所述的方法,其中R
实施方案66.如实施方案35-65中的任一者所述的方法,其中R
实施方案67.如实施方案35-66中的任一者所述的方法,其中R
实施方案68.如实施方案35-67中的任一者所述的方法,其中R
实施方案69.如实施方案35-68中的任一者所述的方法,其中R
实施方案70.如实施方案35-69中的任一者所述的方法,其中R
实施方案71.如实施方案35-70中的任一者所述的方法,其中R
实施方案72.如实施方案35-71中的任一者所述的方法,其中R
实施方案73.如实施方案35所述的方法,其中所述化合物是4-[(3-{4-[(1,5-二羟基戊烷-3-基)氨基]-1-(2,2,2-三氟乙基)-1H-吲哚-2-基}丙-2-炔-1-基)氨基]-3-甲氧基苯-1-磺酰胺。
实施方案74.如实施方案35中的任一者所述的方法,其中所述化合物是2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-N-((1r,4r)-4-吗啉代环己基)-1-(环氧乙烷-2-基甲基)-1H-吲哚-4-胺。
实施方案75.如实施方案35中的任一者所述的方法,其中所述化合物是3-甲氧基-4-({3-[4-({2-氧杂螺[3.3]庚烷-6-基}氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基]丙-2-炔-1-基}氨基)苯-1-磺酰胺。
实施方案76.如实施方案35中的任一者所述的方法,其中所述化合物是4-((3-(4-(((3S,4R)-3-氟-1-甲基哌啶-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基-N-甲基苯甲酰胺。
实施方案77.如实施方案35中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-{[3-(4-{[(3S,4R)-3-氟-1-甲基哌啶-4-基]氨基}-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基]氨基}-3-甲氧基苯甲酰胺。
实施方案78.如实施方案35中的任一者所述的方法,其中所述化合物是3-甲氧基-N-(2-甲氧基乙基)-N-甲基-4-((3-(4-((四氢-2H-吡喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯磺酰胺。
实施方案79.如实施方案35中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-((3-(4-((1,1-二氧代四氢-2H-噻喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基苯磺酰胺。
实施方案80.如实施方案35中的任一者所述的方法,其中所述化合物是3-甲氧基-4-((3-(4-(3-(1-甲基哌啶-4-基)脲基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯甲酰胺。
实施方案81.如实施方案35中的任一者所述的方法,其中所述化合物是N-((3S,4R)-3-氟哌啶-4-基)-2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-1-(2,2,2-三氟乙基)-1H-吲哚-4-胺。
实施方案82.一种治疗有需要的对象的癌症的方法,所述方法包括:(i)向所述对象施用治疗有效量的增加所述对象中突变p53蛋白的抗癌活性的化合物;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的抗癌剂。
实施方案83.如实施方案82所述的方法,其中所述化合物结合至所述突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象。
实施方案84.如实施方案82或83所述的方法,其中所述化合物增加所述突变p53蛋白的稳定性。
实施方案85.如实施方案82-84中的任一者所述的方法,其中所述癌症表达所述突变p53蛋白。
实施方案86.如实施方案82-85中的任一者所述的方法,其中所述突变p53蛋白在氨基酸220处具有突变。
实施方案87.如实施方案82-86中的任一者所述的方法,其中所述突变p53蛋白是p53 Y220C。
实施方案88.如实施方案82-87中的任一者所述的方法,其中相较于野生型p53,所述化合物选择性结合所述突变p53蛋白。
实施方案89.如实施方案82-88中的任一者所述的方法,其中所述癌症是卵巢癌。
实施方案90.如实施方案82-88中的任一者所述的方法,其中所述癌症是乳腺癌。
实施方案91.如实施方案82-88中的任一者所述的方法,其中所述癌症是肺癌。
实施方案92.如实施方案82-91中的任一者所述的方法,其中所述化合物的所述施用是口服施用。
实施方案93.如实施方案82-91中的任一者所述的方法,其中所述化合物的所述施用是皮下施用。
实施方案94.如实施方案82-93中的任一者所述的方法,其中所述化合物的所述施用是局部施用。
实施方案95.如实施方案82-94中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg至约2000mg。
实施方案96.如实施方案82-95中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg。
实施方案97.如实施方案82-95中的任一者所述的方法,其中所述化合物的所述治疗有效量是约1200mg。
实施方案98.如实施方案82-95中的任一者所述的方法,其中所述化合物的所述治疗有效量是约2000mg。
实施方案99.如实施方案82-98中的任一者所述的方法,其中所述对象是人。
实施方案100.如实施方案82-99中的任一者所述的方法,其中所述抗癌剂是小分子。
实施方案101.如实施方案82-99中的任一者所述的方法,其中所述抗癌剂是抗体。
实施方案102.如实施方案82-99中的任一者所述的方法,其中所述抗癌剂是免疫检查点抑制剂。
实施方案103.如实施方案82-99或102中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-1剂。
实施方案104.如实施方案82-99、102或103中的任一者所述的方法,其中所述抗PD-1剂是纳武利尤单抗。
实施方案105.如实施方案82-99、102或103中的任一者所述的方法,其中所述抗PD-1剂是帕博利珠单抗。
实施方案106.如实施方案82-99、102或103中的任一者所述的方法,其中所述抗PD-1剂是西米普利单抗。
实施方案107.如实施方案82-99或102中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-L1剂。
实施方案108.如实施方案82-99、102或107中的任一者所述的方法,其中所述抗PD-L1剂是阿替利珠单抗。
实施方案109.如实施方案82-99、102或107中的任一者所述的方法,其中所述抗PD-L1剂是阿维利尤单抗。
实施方案110.如实施方案82-99、102或107中的任一者所述的方法,其中所述抗PD-L1剂是度伐利尤单抗。
实施方案111.如实施方案82-110中的任一者所述的方法,其中所述抗癌剂的所述施用是口服施用。
实施方案112.如实施方案82-110中的任一者所述的方法,其中所述抗癌剂的所述施用是皮下施用。
实施方案113.如实施方案82-110中的任一者所述的方法,其中所述抗癌剂的所述施用是局部施用。
实施方案114.如实施方案82-113中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约5mg/kg至约500mg/kg。
实施方案115.如实施方案82-114中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约10μg至约500μg。
实施方案116.如实施方案82-115中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约200μg。
实施方案117.如实施方案82-116中的任一者所述的方法,其中所述化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-A是连接基团;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
实施方案118.如实施方案117所述的方法,其中A是亚烷基、亚烯基或亚炔基,其各自是被取代的或未被取代的。
实施方案119.如实施方案117所述的方法,其中A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案120.如实施方案117或118所述的方法,其中所述化合物具有下式:
实施方案121.如实施方案117-120中的任一者所述的方法,其中Q
实施方案122.如实施方案117-120中的任一者所述的方法,其中Q
实施方案123.如实施方案117-122中的任一者所述的方法,其中m是1。
实施方案124.如实施方案117-122中的任一者所述的方法,其中m是2。
实施方案125.如实施方案117-124中的任一者所述的方法,其中Y是N。
实施方案126.如实施方案117-124中的任一者所述的方法,其中Y是O。
实施方案127.如实施方案117-126中的任一者所述的方法,其中每个R
实施方案128.如实施方案117-127中的任一者所述的方法,其中R
实施方案129.如实施方案117-128中的任一者所述的方法,其中R
实施方案130.如实施方案117-129中的任一者所述的方法,其中R
实施方案131.如实施方案117、118、122、125或127-130中的任一者所述的方法,其中所述化合物具有下式:
其中环A是被取代的或未被取代的环状基团。
实施方案132.如实施方案117-131中的任一者所述的方法,其中R
实施方案133.如实施方案117-132中的任一者所述的方法,其中R
实施方案134.如实施方案117-133中的任一者所述的方法,其中R
实施方案135.如实施方案117-134中的任一者所述的方法,其中R
实施方案136.如实施方案117、118、122、125或127-135中的任一者所述的方法,其中所述化合物具有下式:
实施方案137.如实施方案117、118、122、125或127-136中的任一者所述的方法,其中环A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案138.如实施方案117、118、122、125或127-137中的任一者所述的方法,其中环A是被取代的芳基。
实施方案139.如实施方案117、118、122、125或127-137中的任一者所述的方法,其中环A是被取代的杂芳基。
实施方案140.如实施方案117、118、122、125或127-137中的任一者所述的方法,其中环A是被取代的杂环基。
实施方案141.如实施方案117-140中的任一者所述的方法,其中R
实施方案142.如实施方案117-141中的任一者所述的方法,其中R
实施方案143.如实施方案117-142中的任一者所述的方法,其中R
实施方案144.如实施方案117、118、122、125或127-143中的任一者所述的方法,其中所述化合物具有下式:
实施方案145.如实施方案117、118、122、125或127-144中的任一者所述的方法,其中每个R
实施方案146.如实施方案117、118、122、125或127-145中的任一者所述的方法,其中R
实施方案147.如实施方案117、118、122、125或127-146中的任一者所述的方法,其中R
实施方案148.如实施方案117、118、122、125或127-147中的任一者所述的方法,其中R
实施方案149.如实施方案117、118、122、125或127-148中的任一者所述的方法,其中R
实施方案150.如实施方案117、118、122、125或127-149中的任一者所述的方法,其中R
实施方案151.如实施方案117、118、122、125或127-150中的任一者所述的方法,其中R
实施方案152.如实施方案117、118、122、125或127-151中的任一者所述的方法,其中R
实施方案153.如实施方案117、118、122、125或127-152中的任一者所述的方法,其中R
实施方案154.如实施方案117、118、122、125或127-153中的任一者所述的方法,其中R
实施方案155.如实施方案117中的任一者所述的方法,其中所述化合物是4-[(3-{4-[(1,5-二羟基戊烷-3-基)氨基]-1-(2,2,2-三氟乙基)-1H-吲哚-2-基}丙-2-炔-1-基)氨基]-3-甲氧基苯-1-磺酰胺。
实施方案156.如实施方案117中的任一者所述的方法,其中所述化合物是2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-N-((1r,4r)-4-吗啉代环己基)-1-(环氧乙烷-2-基甲基)-1H-吲哚-4-胺。
实施方案157.如实施方案117中的任一者所述的方法,其中所述化合物是3-甲氧基-4-({3-[4-({2-氧杂螺[3.3]庚烷-6-基}氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基]丙-2-炔-1-基}氨基)苯-1-磺酰胺。
实施方案158.如实施方案117中的任一者所述的方法,其中所述化合物是4-((3-(4-(((3S,4R)-3-氟-1-甲基哌啶-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基-N-甲基苯甲酰胺。
实施方案159.如实施方案117中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-{[3-(4-{[(3S,4R)-3-氟-1-甲基哌啶-4-基]氨基}-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基]氨基}-3-甲氧基苯甲酰胺。
实施方案160.如实施方案117中的任一者所述的方法,其中所述化合物是3-甲氧基-N-(2-甲氧基乙基)-N-甲基-4-((3-(4-((四氢-2H-吡喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯磺酰胺。
实施方案161.如实施方案117中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-((3-(4-((1,1-二氧代四氢-2H-噻喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基苯磺酰胺。
实施方案162.如实施方案117中的任一者所述的方法,其中所述化合物是3-甲氧基-4-((3-(4-(3-(1-甲基哌啶-4-基)脲基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯甲酰胺。
实施方案163.如实施方案117中的任一者所述的方法,其中所述化合物是N-((3S,4R)-3-氟哌啶-4-基)-2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-1-(2,2,2-三氟乙基)-1H-吲哚-4-胺。
实施方案164.一种治疗癌症的方法,所述方法包括:(i)向有需要的对象施用治疗有效量的结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的化合物;以及(ii)向所述对象施用治疗有效量的通过除p53诱导的凋亡以外的途径起作用的额外抗癌剂,其中如果在于第一患者群体和第二患者群体中进行的治疗所述癌症的对照研究中:(a)确定所述第一患者群体的第一中值存活时间,其中所述第一患者群体用所述治疗有效量的结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的所述化合物治疗;并且(b)确定所述第二患者群体的第二中值存活时间,其中所述第二患者群体用所述治疗有效量的结合至突变p53蛋白,并且使所述突变p53蛋白重新符合p53的展现抗癌活性的构象的所述化合物以及所述治疗有效量的所述额外治疗剂治疗;则所述第二中值存活时间比所述第一中值存活时间长至少约50%。
实施方案165.如实施方案164所述的方法,其中所述第二中值存活时间比所述第一中值存活时间长至少约100%。
实施方案166.如实施方案164或165所述的方法,其中所述第二中值存活时间比所述第一中值存活时间长至少约200%。
实施方案167.如实施方案164-166中的任一者所述的方法,其中所述化合物增加所述突变p53蛋白的稳定性。
实施方案168.如实施方案164-167中的任一者所述的方法,其中所述癌症表达所述突变p53蛋白。
实施方案169.如实施方案164-168中的任一者所述的方法,其中所述突变p53蛋白在氨基酸220处具有突变。
实施方案170.如实施方案164-169中的任一者所述的方法,其中所述突变p53蛋白是p53 Y220C。
实施方案171.如实施方案164-170中的任一者所述的方法,其中相较于野生型p53,所述化合物选择性结合所述突变p53蛋白。
实施方案172.如实施方案164-171中的任一者所述的方法,其中所述癌症是卵巢癌。
实施方案173.如实施方案164-171中的任一者所述的方法,其中所述癌症是乳腺癌。
实施方案174.如实施方案164-171中的任一者所述的方法,其中所述癌症是肺癌。
实施方案175.如实施方案164-174中的任一者所述的方法,其中所述化合物的所述施用是口服施用。
实施方案176.如实施方案164-174中的任一者所述的方法,其中所述化合物的所述施用是皮下施用。
实施方案177.如实施方案164-174中的任一者所述的方法,其中所述化合物的所述施用是局部施用。
实施方案178.如实施方案164-177中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg至约2000mg。
实施方案179.如实施方案164-178中的任一者所述的方法,其中所述化合物的所述治疗有效量是约500mg。
实施方案180.如实施方案164-178中的任一者所述的方法,其中所述化合物的所述治疗有效量是约1200mg。
实施方案181.如实施方案164-178中的任一者所述的方法,其中所述化合物的所述治疗有效量是约2000mg。
实施方案182.如实施方案164-181中的任一者所述的方法,其中所述对象是人。
实施方案183.如实施方案164-182中的任一者所述的方法,其中所述抗癌剂是小分子。
实施方案184.如实施方案164-182中的任一者所述的方法,其中所述抗癌剂是抗体。
实施方案185.如实施方案164-182中的任一者所述的方法,其中所述抗癌剂是免疫检查点抑制剂。
实施方案186.如实施方案164-182或185中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-1剂。
实施方案187.如实施方案164-182、185或186中的任一者所述的方法,其中所述抗PD-1剂是纳武利尤单抗。
实施方案188.如实施方案164-182、185或186中的任一者所述的方法,其中所述抗PD-1剂是帕博利珠单抗。
实施方案189.如实施方案164-182、185或186中的任一者所述的方法,其中所述抗PD-1剂是西米普利单抗。
实施方案190.如实施方案164-182或185中的任一者所述的方法,其中所述免疫检查点抑制剂是抗PD-L1剂。
实施方案191.如实施方案164-182、185或190中的任一者所述的方法,其中所述抗PD-L1剂是阿替利珠单抗。
实施方案192.如实施方案164-182、185或190中的任一者所述的方法,其中所述抗PD-L1剂是阿维利尤单抗。
实施方案193.如实施方案164-182、185或190中的任一者所述的方法,其中所述抗PD-L1剂是度伐利尤单抗。
实施方案194.如实施方案164-193中的任一者所述的方法,其中所述抗癌剂的所述施用是口服施用。
实施方案195.如实施方案164-193中的任一者所述的方法,其中所述抗癌剂的所述施用是皮下施用。
实施方案196.如实施方案164-193中的任一者所述的方法,其中所述抗癌剂的所述施用是局部施用。
实施方案197.如实施方案164-196中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约5mg/kg至约500mg/kg。
实施方案198.如实施方案164-197中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约10μg至约500μg。
实施方案199.如实施方案164-198中的任一者所述的方法,其中所述抗癌剂的所述治疗有效量是约200μg。
实施方案200.如实施方案164-199中的任一者所述的方法,其中所述化合物具有下式:
其中:
-每个
-X
-X
-X
-X
-X
其中X
-A是连接基团;
-Q
-m是1、2、3或4;
-Y是N、O或不存在;
-R
-每个R
-每个R
-每个R
-每个R
-每个R
实施方案201.如实施方案200所述的方法,其中A是亚烷基、亚烯基或亚炔基,其各自是被取代的或未被取代的。
实施方案202.如实施方案200所述的方法,其中A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案203.如实施方案200或201所述的方法,其中所述化合物具有下式:
实施方案204.如实施方案200-203中的任一者所述的方法,其中Q
实施方案205.如实施方案200-203中的任一者所述的方法,其中Q
实施方案206.如实施方案200-205中的任一者所述的方法,其中m是1。
实施方案207.如实施方案200-205中的任一者所述的方法,其中m是2。
实施方案208.如实施方案200-207中的任一者所述的方法,其中Y是N。
实施方案209.如实施方案200-207中的任一者所述的方法,其中Y是O。
实施方案210.如实施方案200-209中的任一者所述的方法,其中每个R
实施方案211.如实施方案200-210中的任一者所述的方法,其中R
实施方案212.如实施方案200-211中的任一者所述的方法,其中R
实施方案213.如实施方案200-212中的任一者所述的方法,其中R
实施方案214.如实施方案200、201、203、205、206、208或210-213中的任一者所述的方法,其中所述化合物具有下式:
其中环A是被取代的或未被取代的环状基团。
实施方案215.如实施方案200、201、203、205、206、208或210-214中的任一者所述的方法,其中R
实施方案216.如实施方案200、201、203、205、206、208或210-215中的任一者所述的方法,其中R
实施方案217.如实施方案200、201、203、205、206、208或210-216中的任一者所述的方法,其中R
实施方案218.如实施方案200、201、203、205、206、208或210-217中的任一者所述的方法,其中R
实施方案219.如实施方案200、201、203、205、206、208或210-218中的任一者所述的方法,其中所述化合物具有下式:
实施方案220.如实施方案200、201、203、205、206、208或210-219中的任一者所述的方法,其中环A是芳基、杂芳基或杂环基,其各自是被取代的或未被取代的。
实施方案221.如实施方案200、201、203、205、206、208或210-220中的任一者所述的方法,其中环A是被取代的芳基。
实施方案222.如实施方案200、201、203、205、206、208或210-220中的任一者所述的方法,其中环A是被取代的杂芳基。
实施方案223.如实施方案200、201、203、205、206、208或210-220中的任一者所述的方法,其中环A是被取代的杂环基。
实施方案224.如实施方案200-223中的任一者所述的方法,其中R
实施方案225.如实施方案200-224中的任一者所述的方法,其中R
实施方案226.如实施方案200-225中的任一者所述的方法,其中R
实施方案227.如实施方案200、201、203、205、206、208或210-226中的任一者所述的方法,其中所述化合物具有下式:
实施方案228.如实施方案200、201、203、205、206、208或210-227中的任一者所述的方法,其中每个R
实施方案229.如实施方案200、201、203、205、206、208或210-228中的任一者所述的方法,其中R
实施方案230.如实施方案200、201、203、205、206、208或210-229中的任一者所述的方法,其中R
实施方案231.如实施方案200、201、203、205、206、208或210-230中的任一者所述的方法,其中R
实施方案232.如实施方案200、201、203、205、206、208或210-231中的任一者所述的方法,其中R
实施方案233.如实施方案200、201、203、205、206、208或210-232中的任一者所述的方法,其中R
实施方案234.如实施方案200、201、203、205、206、208或210-233中的任一者所述的方法,其中R
实施方案235.如实施方案200、201、203、205、206、208或210-234中的任一者所述的方法,其中R
实施方案236.如实施方案200、201、203、205、206、208或210-235中的任一者所述的方法,其中R
实施方案237.如实施方案200、201、203、205、206、208或210-236中的任一者所述的方法,其中R
实施方案238.如实施方案200所述的方法,其中所述化合物是4-[(3-{4-[(1,5-二羟基戊烷-3-基)氨基]-1-(2,2,2-三氟乙基)-1H-吲哚-2-基}丙-2-炔-1-基)氨基]-3-甲氧基苯-1-磺酰胺。
实施方案239.如实施方案200中的任一者所述的方法,其中所述化合物是2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-N-((1r,4r)-4-吗啉代环己基)-1-(环氧乙烷-2-基甲基)-1H-吲哚-4-胺。
实施方案240.如实施方案200中的任一者所述的方法,其中所述化合物是3-甲氧基-4-({3-[4-({2-氧杂螺[3.3]庚烷-6-基}氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基]丙-2-炔-1-基}氨基)苯-1-磺酰胺。
实施方案241.如实施方案200中的任一者所述的方法,其中所述化合物是4-((3-(4-(((3S,4R)-3-氟-1-甲基哌啶-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基-N-甲基苯甲酰胺。
实施方案242.如实施方案200中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-{[3-(4-{[(3S,4R)-3-氟-1-甲基哌啶-4-基]氨基}-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基]氨基}-3-甲氧基苯甲酰胺。
实施方案243.如实施方案200中的任一者所述的方法,其中所述化合物是3-甲氧基-N-(2-甲氧基乙基)-N-甲基-4-((3-(4-((四氢-2H-吡喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯磺酰胺。
实施方案244.如实施方案200中的任一者所述的方法,其中所述化合物是N-(2,3-二羟基丙基)-4-((3-(4-((1,1-二氧代四氢-2H-噻喃-4-基)氨基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)-3-甲氧基苯磺酰胺。
实施方案245.如实施方案200中的任一者所述的方法,其中所述化合物是3-甲氧基-4-((3-(4-(3-(1-甲基哌啶-4-基)脲基)-1-(2,2,2-三氟乙基)-1H-吲哚-2-基)丙-2-炔-1-基)氨基)苯甲酰胺。
实施方案246.如实施方案200中的任一者所述的方法,其中所述化合物是N-((3S,4R)-3-氟哌啶-4-基)-2-(3-((2-甲氧基-4-(甲基磺酰基)苯基)氨基)丙-1-炔-1-基)-1-(2,2,2-三氟乙基)-1H-吲哚-4-胺。
- 用于标定车辆传感器的标定装置、方法及车辆
- 一种热流传感器的标定装置和标定方法
- 一种六维力/力矩传感器标定装置及标定方法
- 裸FBG应变传感器的标定用装置、标定系统及标定方法
- 一种用于气敏传感器标定的标定气体生成方法及装置
- 用于柔性力敏传感器阵列的液压型标定装置及标定方法
