一种基于二氢化茚-1,3-二酮衍生物的有机染料的制备方法、应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及光固化技术领域,具体而言,涉及一种基于二氢化茚-1,3-二酮衍生物的有机染料的制备方法及其应用。
背景技术
光致高分子聚合作为一种新型光固化技术,在增材制造、紫外固化涂料、光刻胶等领域有着重要的应用前景。目前,世界各国也都在加速光固化的产业布局和升级。在光致高分子聚合技术中,光源的选择至关重要,这是因为它会直接影响着高分子单体的聚合效率。相较于已经达到商业化使用的绿光和红光光源而言,基于蓝光、深蓝光光源的光致高分子聚合的光引发效率仍未满足于商业化应用。因此,可商业化应用的基于蓝光、深蓝光光源的光致高分子聚合技术开发一直是学界和相关产业界关注的重要研究领域。现阶段的科学研究中,相关405nm波长的发光二极管(LED)的研究最为广泛。
在光致高分子聚合中,如何选择适当波长的光源同高效的光引发剂相适配是当前研究最大的瓶颈。在光引发剂的设计研究中,合成新型有机光引发系统是实现高效率光固化最重要的研究策略。但是对于大多数有机染料分子而言,由于较弱的吸光性质和光聚合过程中三线态的形成及光漂白的发生,他们很难同时实现树脂的高转化率、高荧光活性以及具有良好色彩的产品。此外,相应的引发助剂也需要掺杂到合适的有机染料分子中,即光引发剂中,组成高效的光引发系统。就当前而言,光引发系统的商业化也有待进一步发展。使用推-拉式有机染料分子(push-pull dyes)是一种可以实现高效率光致高分子聚合的可靠策略。此外,其适度的荧光性质,相对传统有机染料分子而言,在实现蓝光吸收和色纯度上也具有很大的优势。此外,其适中的光引发能力使其可以有效应用于立体固化成型(Stereo lithography,SLA),数字光处理(Digital Light Processing,DLP)3D打印中,而表现出很好的聚合稳定性及可操作性。因此开发出一类具有高荧光性的推-拉式有机染料分子具有十分重要的现实意义。
发明内容
基于此,为了解决有机染料分子难以同时实现树脂的高转化率、高荧光活性以及具有良好色彩的问题,本发明提供了一种基于二氢化茚-1,3-二酮衍生物的有机染料、应用,具体技术方案如下:
一种有机染料的制备方法,包括以下步骤:
S1.得到二氢化茚-1,3-二酮及其衍生物EA,且所述EA包括EA1、EA2以及EA3;
S2.增加二氢化茚-1,3-二酮及其衍生物EA的光化学活性,将D1、D2、D3、D4、D5、D6分别与S1中获得的EA进行反应,得到有机染料或将ED与S1中获得的EA2进行反应,得到有机染料。
优选地,得到EA的方法为:通过克莱森缩合及钠盐中间体的脱二氧化碳的两步反应得到EA1;或于二氢化茚-1,3-二酮上加入丙二腈基团,通过Knoevenagel缩合于EA1上选择性添加氰基,得到EA2以及EA3。
优选地,所述得到EA的方法的反应式如下:
优选地,所述D1、D2、D3、D4、D5、D6分别对应以下的结构:
优选地,D1、D2、D3、D4、D5、D6分别与EA反应式如下:
优选地,所述所述ED包括ED1以及ED2,且所述ED1的结构式为:
优选地,ED与EA2的反应式如下:
本发明还提供一种有机染料的应用,所述应用为有机染料在光固化的三组分光引发系统中的应用。
另外,还提供一种有机染料的应用,所述应用为有机染料在与碘盐,铵盐的三组分光引发系统在3D打印中应用。
上述方案中的有机染料本发明化合物具有高吸光度,高氧化还原性等光化学性质,能够发射不同颜色荧光,是纯有机荧光小分子,能够达到高光引发效率同时部分有机染料分子具有不常见的光漂白现象。此类染料分子与碘盐,铵盐结合在光固化中直接用作三组分光引发系统,在405nm LED的光照下,树脂单体三羟甲基丙烷三丙烯酸脂TMPTA(或使用己二醇二丙烯酸脂HDDA等单体)便可聚合得到表面光滑平整、具有高色纯度,高荧光性的光聚合产品,在增材制造和紫外光固化涂料制备,光刻胶技术领域中具有重要的应用前景。尤其在增材制造中的应用。
附图说明
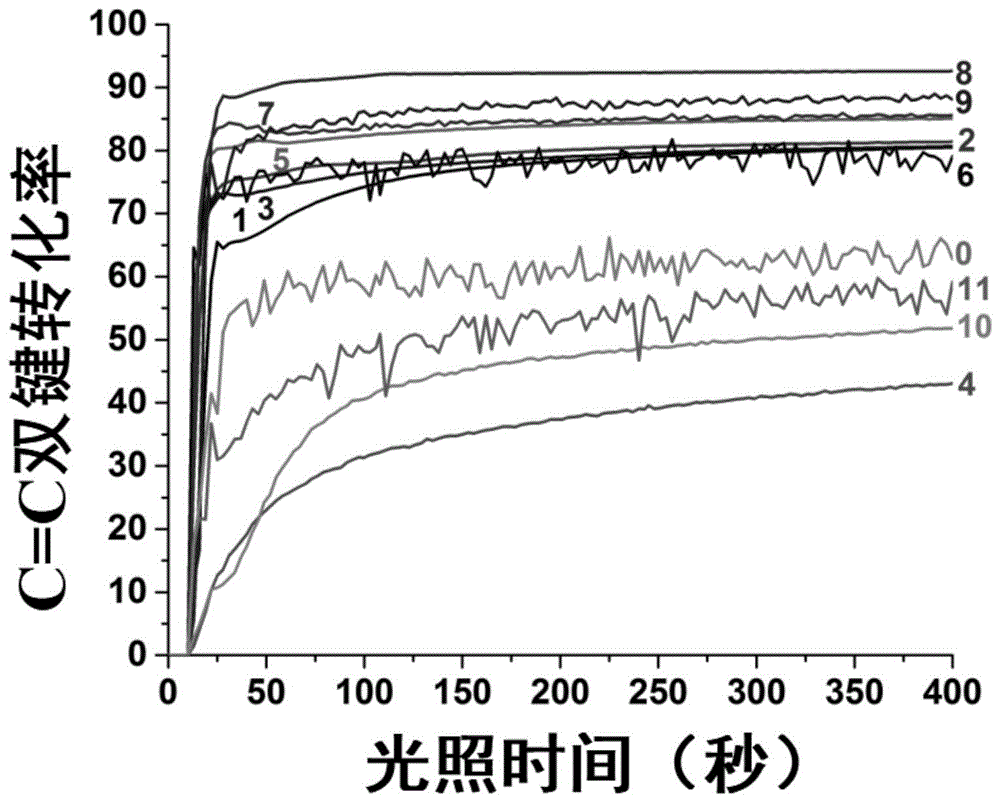
图1为以基于染料1-11,碘盐,铵盐的三组分光引发系统于405nm发光二极管照射下树脂单体(TMPTA)中的双键转化率和时间的关系曲线;
图2为染料1-11的紫外吸光度光谱;
图3为以基于实施例染料8,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的平面俯视图;
图4为以基于实施例染料8,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的3D侧视图;
图5为以基于实施例染料9,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的平面俯视图;
图6为以基于实施例染料9,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的3D侧视图;
图7为以基于实施例染料9,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)加入硅填料经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的平面俯视图;
图8为以基于实施例染料9,碘盐,铵盐的三组分光引发系统引发下,树脂单体(TMPTA)加入硅填料经立体固化成型3D打印后,将所得产品进行数字光学显微镜观测所得到的3D侧视图。
具体实施方式
为了使得本发明的目的、技术方案及优点更加清楚明白,以下结合其实施例,对本发明进行进一步详细说明。应当理解的是,此处所描述的具体实施方式仅用以解释本发明,并不限定本发明的保护范围。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本发明一实施例中的一种有机染料的制备方法,包括以下步骤:
S1.得到二氢化茚-1,3-二酮及其衍生物EA,且所述EA包括EA1、EA2以及EA3;
S2.增加二氢化茚-1,3-二酮及其衍生物EA的光化学活性,将D1、D2、D3、D4、D5、D6分别与S1中获得的EA进行反应,得到有机染料或将ED与S1中获得的EA2进行反应,得到有机染料。
在其中一个实施例中,得到EA的方法为:通过克莱森缩合及钠盐中间体的脱二氧化碳的两步反应得到EA1;或于二氢化茚-1,3-二酮上加入丙二腈基团,通过Knoevenagel缩合于EA1上选择性添加氰基,得到EA2以及EA3。
在其中一个实施例中,所述得到EA的方法的反应式如下:
在其中一个实施例中,所述D1、D2、D3、D4、D5、D6分别对应以下的结构:
在其中一个实施例中,D1、D2、D3、D4、D5、D6分别与EA反应式如下:
在其中一个实施例中,所述所述ED包括ED1以及ED2,且所述ED1的结构式为:
在其中一个实施例中,ED与EA2的反应式如下:
/>
本发明还提供一种有机染料的应用,所述应用为有机染料在光固化的三组分光引发系统中的应用。
另外,还提供一种有机染料的应用,所述应用为有机染料在与碘盐,铵盐的三组分光引发系统在3D打印中应用。
上述方案中的有机染料本发明化合物具有高吸光度,高氧化还原性等光化学性质,能够发射不同颜色荧光,是纯有机荧光小分子,能够达到高光引发效率同时有效避免有机染料分子常见的光漂白现象。此类染料分子与碘盐,铵盐结合在光固化中直接用作三组分光引发系统,在405nm LED的光照下,树脂单体三羟甲基丙烷三丙烯酸脂TMPTA(或使用己二醇二丙烯酸脂HDDA等单体)便可聚合得到表面光滑平整、具有高色纯度,高荧光性的光聚合产品,在增材制造和紫外光固化涂料制备,光刻胶技术领域中具有重要的应用前景。尤其在增材制造中的应用。
下面将结合具体实施例对本发明的实施方案进行详细描述。
本申请中获得的11种1H-环戊[b]萘-1,3(2H)-二酮衍生物的结构式如下:
上述11种结构式代表11种本申请制备的有机染料,标记为染料1、染料2、染料3、染料4、料染5、染料6、料染7、染料8、染料9、染料10、染料11。
实施例1:
染料1的结构式如下:
/>
染料1的制备方法包括以下步骤:
在100mL的圆底烧瓶中,依次加入2-丁氧基-4-(二乙基胺)安息香醛(0.456g,1.8mmol,M=249.35g/mol)、2-(3-氧代-2,3-二氢-1H-环戊[b]萘-1-亚甲基)丙二腈(0.445g,1.8mmol,M=244.25g/mol),并加入40mL无水乙醇(ethanol)作为溶剂,充分混合后加入对N,N-二异丙基乙胺(DIPEA)若干滴。然后将混合均匀后的溶液加热至90℃并回流30min直至混合物的颜色转为深红色;15min后将溶液冷却至室温直至沉淀析出;
将不溶性深红色固体滤出,以乙醇或戊烷清洗数次,真空干燥后即得到深棕色固体0.744g,即得到本申请实施例1所述的染料1。且实施例1的产率为87%。
将实施例1得到的染料1进行质谱分析,质谱理论值MW:476.2333实测m/z:476.2336([M+H+]);1H NMR(400MHz,CDCl3)δ:9.08(d,J=13.0Hz,2H),8.84(s,1H),8.24(s,1H),8.10–7.93(m,2H),7.68–7.57(m,2H),6.44(dd,J=9.5,2.2Hz,1H),6.00(d,J=2.2Hz,1H),4.07(t,J=6.4Hz,2H),3.54(q,J=7.1Hz,4H),1.99–1.86(m,2H),1.56(d,J=13.1Hz,4H),1.30(t,J=7.1Hz,6H),1.02(t,J=7.4Hz,3H);13C NMR(101MHz,CDCl3)δ:164.57,164.15,156.25,142.62,139.01,135.97,135.19,134.11,130.40,129.84,128.90,128.67,125.40,123.35,122.53,116.85,114.08,105.74,92.62,77.32,77.00,76.69,68.63,45.46,30.89,19.35,13.83,12.88。
实施例2:
染料2的结构式如下:
染料2的制备方法包括以下步骤:
在100mL的圆底烧瓶中,依次加入4-(二乙基胺)安息香醛(0.272g,1.8mmol,M=149.19g/mol)、2-(3-氧代-2,3-二氢-1H-环戊[b]萘-1-亚甲基)丙二腈(0.445g,1.8mmol,M=244.25g/mol),并加入无水乙醇(ethanol)40mL作为溶剂,充分混合后加入对N,N-二异丙基乙胺(DIPEA)若干滴;然后将混合均匀后的溶液加热至90℃并回流30min直至混合物的颜色转为深红色,15min后将溶液冷却至室温直至沉淀析出。
将不溶性深红色固体滤出,以乙醇或戊烷清洗数次,真空干燥后即得到深棕色固体0.459g,即得到本申请实施例2的染料2。且实施例2的产率为68%。
将实施例2的染料2进行质谱分析,质谱理论值MW:376.1444实测m/z:375.1372([M+H+]);1H NMR(300MHz,CDCl3)δ:9.14(s,1H),8.65–8.28(m,4H),8.06(s,2H),7.66(s,2H),6.79(s,2H),3.23(s,6H);元素分析理论值:C25H17N3O:C 80.0,H11.2,O 4.3;实测:C79.8,H 11.3,O 4.5。
实施例3:
染料8的结构式如下:
染料8的制备方法包括以下步骤:
在100mL的圆底烧瓶中,依次加入4-(二甲基胺)安息香醛(0.272g,1.8mmol,M=149.19g/mol)、2-(3-氧代-2,3-二氢-1H-环戊[b]萘-1-亚甲基)丙二腈(0.445g,1.8mmol,M=244.25g/mol),并加入无水乙醇(ethanol)40mL作为溶剂,充分混合后加入对氧氮己环(morpholine)若干滴。
然后将混合均匀后的溶液加热至90℃并回流30min直至混合物的颜色转为深红色,15min后将溶液冷却至室温直至沉淀析出。
将不溶性深红色固体滤出,以乙醇或乙醚清洗数次,真空干燥后即得到红色固体0.658g,即得到染料8,且实施例3的产率为79%。
将染料8进行质谱分析,质谱理论值MW:463.2129实测m/z:463.2126([M+H+]);1HNMR(400MHz,CDCl3)δ:2.92(s,6H),3.47–3.52(m,4H),3.72–3.77(m,4H),5.42(brs,1H),5.63(d,1H,J=3.9Hz),6.68(d,2H,J=8.5Hz),7.25(d,2H,J=8.5Hz),7.44–7.52(m,2H),7.74(s,1H),7.79(d,1H,J=7.8Hz),7.84(d,1H,J=7.8Hz),8.16(s,1H);1H NMR(400MHz,DMSO-d6)δ:2.85(s,6H),3.44–3.54(m,2H),3.69–3.78(m,6H),5.49(s,1H),6.68(d,2H,J=8.9Hz),7.12(d,2H,J=8.9Hz),7.50–7.58(m,2H),7.78(s,1H),7.89(d,1H,J=8.6Hz),7.98(d,1H,J=8.6Hz),8.04(s,1H),8.97(s,1H);13C NMR(100MHz,DMSO-d6)δ:48.0,49.1,51.5,59.3,65.9,112.4,117.5,119.0,119.8,120.2,127.2,128.0,129.0,129.8,129.9,131.9,133.3,133.6,134.4,135.3,149.9,153.3,160.2,185.9。
实施例4:
染料9的结构式如下:
在100mL的圆底烧瓶中,依次加入4-(二甲基胺)安息香醛(0.77g,5.15mmol,M=149.19g/mol)、2-(3-氧代-2,3-二氢-1H-环戊[b]萘-1-亚甲基)丙二腈(1.25g,5.15mmol,M=244.25g/mol),并加入无水乙醇(ethanol)40mL作为溶剂,充分混合后加入对氧氮己环(morpholine)若干滴。
将混合均匀后的溶液加热至90℃并回流30min直至混合物的颜色转为深红色,15min后将溶液冷却至室温直至沉淀析出。
将不溶性深红色固体滤出,以乙醇或乙醚清洗数次,真空干燥后即得到红色固体0.452g,即得到染料9,且本实施例的产率为14%。
将染料9进行质谱分析,质谱理论值MW:461.2336实测m/z:461.2333([M+H+]);1HNMR(400MHz,丙酮-d6)δ:1.68–1.80(m,6H),2.90(s,6H),3.58–3.87(m,4H),5.59(d,2H,J=4.8Hz),6.71(d,2H,J=8.8Hz),7.23(d,2H,J=8.8Hz),7.48–7.61(m,2H),7.74(s,1H),7.93(dd,2H,J=13.7Hz,J=7.5Hz),8.20(s,1H);1H NMR(400MHz,CDCl3)δ:1.72–1.75(m,6H),2.90(s,6H),3.50–3.57(m,2H),3.62–3.68(m,2H),5.57–5.60(m,2H),6.67(d,2H,J=8.5Hz),7.25(d,2H,J=8.5Hz),7.40–7.48(m,2H),7.71(s,1H),7.77(d,1H,J=7.6Hz),7.82(d,1H,J=7.6Hz),8.18(s,1H);13C NMR(100MHz,CDCl3)δ:25.4,40.2,40.4,49.8,54.2,80.2,110.9,112.4,120.5,120.9,123.5,124.1,127.2,127.9,128.4,129.5,130.1,131.9,133.3,133.7,134.8,136.2,153.6,157.3,160.1,160.2,187.2。
另外,本申请要提供以下的应用例。
应用例:
三组分光引发系统制备,光致高分子聚合的实施及表征:
称量任意质量的树脂单体,然后按照占树脂单体(TMPTA)的质量比,分别称量0.1%的染料,2%的碘盐和2%的铵盐,将称量后的三组分先后倒入称量好的树脂单体中,充分搅拌后,得到光致高分子聚合体系。
碘盐的结构式为:
树脂单体结构为:/>
用滴管从得到的光致高分子聚合体系取出若干滴,并滴于一片聚丙烯薄膜上,并用另一片聚丙烯薄膜于上方盖好,使得光致高分子聚合体系能够均匀分散。
室温下使用405nm的发光二极管(光强:110mW·cm-2)照射所制备得到的光致高分子聚合体系,同时使用实时傅里叶变换红外吸收光谱仪实时监测红外吸收光谱中的~1630cm-1波段的峰位变化,即为树脂单体TMPTA中C=C双键变化。
高分子树脂单体在某时刻的双键转化率根据下式计算:
转化率(%)=(初始峰值-当前峰值)/初始峰值×100
基于11种本发明相关有机染料荧光小分子的三组分系统引发下的高分子树脂单体(TMPTA)转化率-光照时间关系曲线如图1。
相关有机染料荧光小分子的紫外光吸收性质(即吸光度)由紫外可见光度计表征及计算后得到(见图2)。
实施例1~4中相关四个有机染料荧光小分子的最大紫外吸收波长,最大吸光度,405nm处吸光度,树脂单体转化率如表1:
表1染料的光化学参数及相应光致高分子聚合过程中的树脂单体最终转化率。
表1:
应用例2:
3D打印的实施及表征
将实施例三中所得到的基于染料8(或9)的三组分光引发系统的光致高分子聚合体系,滴入到到手工制作的2mm厚玻璃容器中,然后置于具有405nm激光二极管作为激发光源的立体固化成型(SLA)3D打印机中进行3D打印。打印图样为英文字符“KES”。打印产品经过光学数字显微镜(Numerical Optical Microscope)观测后,表明其具有表明平整,光滑,字符清晰,高分辨率等特征。基于染料8体系的打印产品的观测结果如图3(平面),4(三维)。基于染料9体系的打印产品的观测结果如图5(平面),6(三维)。
基于染料9的三组分光引发系统的光致高分子聚合体系,加入质量比为20%的硅填料,充分搅拌后经过上述立体固化成型3D打印过程可得具有更高强度,及表面光滑平整的光化学复合材料。通过数字光学显微镜的观测结果如图7(平面)和图8(三维)。
由上述实施例的3D打印产品可看出,基于此类有机染料荧光小分子的三组分光引发系统的光致高分子聚合体系可直接作3D打印材料使用,可得到表面光滑平整同时具有颜色及荧光性的3D打印产品。同时3D打印过程具有易操控,速度快等优点。基于上述优势,此类光致高分子聚合体系,若将其应用于紫外光固化涂料及光刻胶制备中,其技术优势将基于先进水平。
以上各实施例仅用以举例说明本发明的技术方案,而非对其限制。尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:在没有脱离本发明权利要求所限定的精神和实质的范围内,可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换仍然在本发明权利要求所限定的范围内。
- 一种1,3-二(2-吡啶基)苯受体单元和引达省并二吡啶二酮有机半导体材料及应用
- 一种5-氯-2,3-二氢-1-茚酮的制备方法
- 一种四苯乙烯-二苯甲酮-咔唑衍生物、晶体及其制备方法与应用
- 一种1,3-丁二炔衍生物的绿色制备方法
- 1,2-二氢化茚-1,3-二酮衍生物以及含有这种衍生物作为活性成分的除草剂
- 1,2-二氢化茚-1,3-二酮衍生物以及含有这种衍生物作为活性成分的除草剂
