包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物。
背景技术
在存在·NO或·NO衍生代谢物的情况下,体内活性氧水平过高会导致如过氧化氮等硝酸盐类物质的形成。因此,当蛋白质中所包含的氨基酸中的酪氨酸发生硝化时,蛋白质的结构和功能可能会发生变化。因此,酪氨酸的硝化可能是多种疾病的诱因。
例如,谷氨酰胺合成酶(glutamine synthetase,GS)是一种在体内利用谷氨酸和氨合成谷氨酰胺的酶,在身体的各个器官中产生,并在器官和全身的氮平衡中发挥作用。当谷氨酰胺合成酶因慢性应激等原因暴露于活性氮时,酪氨酸被硝化,谷氨酰胺合成酶活性也降低,从而可引起多种疾病。
最近,基于骨骼肌中谷氨酰胺合成酶过度表达的基因疗法被提出用于治疗急性高氨血症,该疗法的基本原理是旨在通过替代或增强通常在肝病患者的肌肉中缺乏的谷氨酰胺合酶来增加谷氨酰胺合酶从肌肉中去除氨。
另一方面,韩国公开专利第2020-0018488号公开了谷氨酰胺合成酶在治疗高氨血症中的用途,韩国公开专利第2020-0038481号公开了一种用于治疗应激相关疾病的组合物,但本发明的包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物尚未公开。
发明内容
技术问题
本发明鉴于如上所述的需求而提出,本发明提供一种包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物。经确认,本发明的作为有效成分的酪氨酸具有不仅降低由应激产生的谷氨酰胺合成酶中的N-tyr含量,还能增强活性降低的谷氨酰胺合成酶的活性,并使大脑中的谷氨酰胺、谷氨酸的含量及氨量恢复到正常状态的效果,并且确认为了2型糖尿病模型中的胰岛素敏感性增强效果、癫痫发作模型中的兴奋性毒性和氧化应激抑制效果、中风模型中的脑梗塞减少及GS活性增强效果、使用人重组MnSOD的酪氨酸的脱硝效果、急性肾功能衰竭中的效果以及对高氨血症的效果,从而完成本发明。
解决问题的方案
为了实现上述目的,本发明提供一种包含酪氨酸或其食品学上可接受的盐作为有效成分的用于预防或改善由蛋白质中酪氨酸硝化(nitration)引起的疾病的保健功能食品组合物。
并且,本发明提供一种包含酪氨酸或其药学上可接受的盐作为有效成分的用于预防或治疗由蛋白质中酪氨酸硝化(nitration)引起的疾病的药物组合物。
并且,本发明提供一种对包含硝化(nitration)酪氨酸的蛋白质处理酪氨酸来从硝化酪氨酸中去除硝基的方法。
发明的效果
本发明涉及一种包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物。经确认,谷氨酰胺合成酶的表达量没有因应激而改变,但GS中的N-tyr含量在统计学上显著增加,从而降低了GS的活性,并且在基于细胞的实验中,不仅可以增强游离酪氨酸降低的GS活性,而且具有使大脑中的谷氨酰胺、谷氨酸的含量(比例)及氨量恢复到正常状态的效果,并且具有2型糖尿病模型中的胰岛素敏感性增强效果、癫痫发作模型中的兴奋性毒性和氧化应激抑制效果、中风模型中的脑梗塞减少及GS活性增强效果、使用人重组MnSOD的酪氨酸的脱硝效果、急性肾功能衰竭中的效果以及对高氨血症的效果。
附图说明
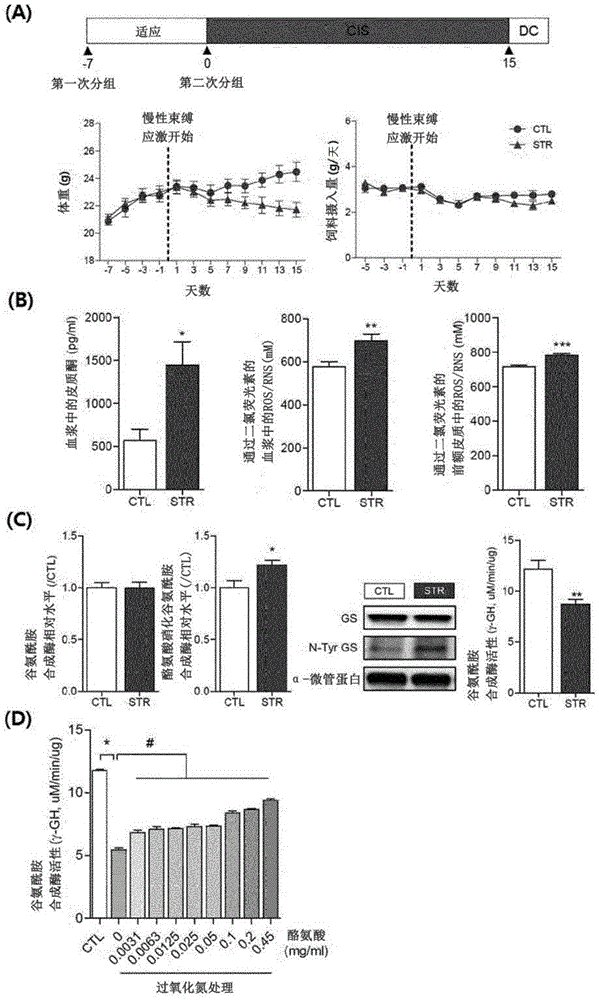
图1为确认由慢性束缚应激(CIS)产生的效果的图,(A)部分为确认实验期间体重及食物摄入量的变化的结果,(B)部分为确认血浆中的皮质酮含量变化和血浆及PFC(前额皮质)中的ROS/RNS含量变化的结果,(C)部分示出GS含量没有变化,但应激组的N-Tyr含量在统计学上显著增加,GS活性在统计学上显著减少,(D)部分为用过氧化氮及酪氨处理PFC组织裂解物后确认体外(in vitro)GS活性的结果。*、**、***表示与CTL相比在统计学上具有显著性差异,*为p<0.05,**为p<0.01,***为p<0.001。#表示与未用酪氨酸处理的组相比,用酪氨酸处理的组的GS活性在统计学上显著增加,p<0.05。
图2为确认酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的体重及饲料摄入量的结果。A部分为一般饮食组(ND)和酪氨酸饮食组(TD)的计划表,B部分为确认体重变化的结果,C部分为确认饲料摄入量的结果。
图3为确认酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的抑郁行为的图,A部分为旷场试验(Open field test)结果,B部分为悬尾试验(tail suspension test)结果,C部分为蔗糖偏好试验(sucrose preference test)结果。
图4为将酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的血浆中的皮质酮(corticosterone)含量(A)和血浆及PFC中的ROS/RNS变化量通过二氯荧光素(dichlorofluorescin,DCF)确认应激激素和氧化应激被TD降低的结果(B、C)。
图5为在酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的PFC中确认GS的活性(A)、GS的表达量(B)及GS中所包含的酪氨酸的硝化(nitration)水平(C)的结果。
图6为确认在PFC中酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的谷氨酸盐、谷氨酰胺、酪氨酸及GABA含量的结果。
图7为确认在PFC中酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的氨含量的结果。
图8为用ONOO
图9为确认本发明的肽的硝化抑制效果的图,A部分为针对PFC(前额皮质)组织中硝基酪氨酸蛋白的蛋白质印迹结果,B部分为针对肝组织中硝基酪氨酸蛋白的蛋白质印迹结果,C部分为针对PFC(前额皮质)组织中谷氨酰胺合成酶蛋白的蛋白质印迹结果,D部分为针对肝组织中谷氨酰胺合成酶、胰岛素受体β及磷酸化胰岛素受体β蛋白的蛋白质印迹结果。
图10为按时期确认由高脂肪饮食诱导的2型糖尿病模型小鼠中由L-酪氨酸饮食引起的体重变化(A)、血糖(B)及饲料摄入量(C)的结果。***表示与一般饮食组(ND)相比,高脂肪饮食组(HFD)的血糖含量在统计学上显著增加,p<0.001,#、##表示与高脂肪饮食组(HFD)相比,含L-酪氨酸饮食组(HFD+L-Tyr)的血糖含量在统计学上显著减少,#为p<0.05,##为p<0.01。
图11为确认由高脂肪饮食诱导的2型糖尿病模型小鼠中由L-酪氨酸饮食引起的小鼠的葡萄糖耐量的结果。(A)部分示出随时间变化的血糖含量,(B)部分示出(A)部分中的曲线下面积(AUC)。**、***表示与一般饮食组(ND)相比,高脂肪饮食组(HFD)的血糖含量在统计学上显著增加,**为p<0.01,***为p<0.001,#表示与高脂肪饮食组(HFD)相比,含L-酪氨酸饮食组(HFD+L-Tyr)的血糖含量在统计学上显著减少,p<0.05。
图12为确认由高脂肪饮食诱导的2型糖尿病模型小鼠中由L-酪氨酸饮食引起的胰岛素抵抗的结果。(A)部分示出随时间变化的血糖含量,(B)部分示出(A)部分中的曲线下面积(AUC)。*、**、***表示与一般饮食组(ND)相比,高脂肪饮食组(HFD)的血糖含量在统计学上显著增加,*为p<0.05,**为p<0.01,***为p<0.001。#表示与高脂肪饮食组(HFD)相比,含L-酪氨酸饮食组(HFD+L-Tyr)的血糖含量在统计学上显著减少,p<0.05。
图13为确认组织中脂肪堆积变化(A)及血浆中ROS/RNS含量变化(B)的结果。***表示与ND相比,HFD或HFD+Tyr的组织重量及血浆中ROS/RNS含量在统计学上显著增加,p<0.001,#、##表示与HFD相比,HFD+Tyr的组织重量及血浆中ROS/RNS含量在统计学上显著减少,#为p<0.05,##为p<0.01。
图14为确认由酪氨酸饮食引起的发作程度变化(A)、体重变化(C)及存活率(D)的结果。(B)部分示出(A)部分中的曲线下面积(AUC)。**、***表示与ND相比,5x L-Tyr的发作水平在统计学上显著减少,**为p<0.01,***为p<0.001。#表示与CTL的发作前相比,发作后体重增加,p<0.05。
图15为确认注射红藻氨酸后存活的小鼠的海马体组织中ROS/RNS量变(A)及GS活性的结果。(A)部分中的**、***表示与CTL相比,ROS/RNS的含量增加,**为p<0.01,***为p<0.001。##、###表示与注射KA并采取一般饮食的ND组相比,酪氨酸饮食组的ROS/RNS的含量在统计学上显著减少,##为p<0.01,###为p<0.001。(B)部分中的*表示与注射KA并采取一般饮食的ND组相比,酪氨酸饮食组的GS活性在统计学上显著增加,p<0.05。
图16为通过红藻氨酸分析海马体区(CA1(A)、CA3(B))的神经细胞数及同一区域的小胶质细胞(microglia)活性的免疫组织化学染色结果。*表示与CTL相比,神经细胞数减少或诱导炎症的小胶质细胞的活性增加,p<0.05,#表示小胶质细胞活性在酪氨酸饮食组中显著减少,p<0.05。
图17为确认慢性束缚应激模型小鼠中D-酪氨酸的认知障碍预防效果的结果。
图18确认使用内皮素-1(Endothelin-1)的中风(stroke)模型小鼠中L-酪氨酸的脑梗塞(brain infarct)减少及GS活性增强效果的结果。
图19为确认使用人重组MnSOD的酪氨酸的脱硝(denitration)效果的结果。***表示与过氧化氮(2.1mM PN)组相比,酪氨酸给药组(L-Tyr,D-Tyr)的MnSOD活性增加,p<0.001。
图20为确认酪氨酸对急性肾功能衰竭的效果的结果,(A)部分示出抗氧化作用因子NQO-1的基因表达量,(B)部分示出CuZnSOD活性,(C)部分示出MnSOD活性,(D)部分示出ROS/RNS含量,(E)部分示出肾缺血及再灌注24小时后肾组织中硝基酪氨酸(nitrotyrosine)蛋白的表达量。
图21为测定作为肾损伤评价指标的血浆肌酐的结果。*、**表示与Sham组相比,肌酸(creatine)(A)、IL-1β(B)及IL-6(C)的表达量在统计学上显著增加,*为p<0.05,**为p<0.01。#、##表示与CMC+IR组相比,肌酸(creatine)、IL-1β及IL-6的表达量减少,#为p<0.05,##为p<0.01。
图22为确认对肝性脑病(高氨血症)的酪氨酸的效果的结果。(A)部分示出血液中氨含量,(B)部分示出血浆中的ALT,(C)部分为确认硝化的蛋白含量的蛋白质印迹结果。
具体实施方式
本发明涉及一种包含酪氨酸或其食品学上可接受的盐作为有效成分的用于预防或改善由蛋白质中酪氨酸硝化(nitration)引起的疾病的保健功能食品组合物。
优选地,上述蛋白质中酪氨酸硝化为选自酪氨酸羟化酶(tyrosinehydroxylase)、锰超氧化物歧化酶(Mn Superoxide dismutase)、铜/锌超氧化物歧化酶(MnSuperoxide dismutase)、胰岛素受体β亚单位(insulin receptorβsubunit)、膜联蛋白IV(annexin IV)、谷氨酸脱氢酶(glutamate dehydrogenase)、3-α羟基类固醇脱氢酶(3-α-OHsteroid dehydrogenase)、谷胱甘肽S-转移酶(glutathione S-transferase)、3-酮脂酰辅酶A硫解酶(3-ketoacyl CoA thiolase)、过氧化氢酶(catalase)、Tau蛋白、线粒体复合物1(mitochondria complex 1)、α-突触核蛋白(α-synuclein)、载脂蛋白-A1(apolipoprotein-A1)、β-淀粉样蛋白(amyloid-β)及NMDA受体(NMDA receptor)中的任一种蛋白质中酪氨酸硝化,但并不限定于此。
优选地,上述由蛋白质中酪氨酸硝化(nitration)引起的疾病为选自抑郁症(depressive disorder)、焦虑症(anxiety disorder)、中风(stroke)、癫痫(epilepsy)、青光眼(glaucoma)、糖尿病(diabets)、糖尿病视网膜病变(diabetic retinopathy)、惊厥(seizure)、肝性脑病(hepaticencephalopathy)、认知障碍(cognitive impairment)、大脑发育障碍(brain development impairment)、癌症(cancer)、阿尔茨海默病(Alzheimerdisease)、急性肾损伤(Acute kidney injury)及高氨血症(Hyperammonemia)中的任一种,但并不限定于此。
上述蛋白质中酪氨酸硝化(nitration)可发生在大脑、肝脏、肌肉、脂肪组织、肾脏组织、胰腺或肺部,但并不限定于此。
优选地,本发明的作为有效成分的酪氨酸以如下表1所示的剂量给药,但并不限定于此。
表1
每种疾病的剂量及饮食时期
上述保健功能食品组合物可由选自丸剂、片剂(tablet)、胶囊(capsule)、散剂、粉末、颗粒剂、糖果、糖浆及饮料中的任一种制备,或者可作为食品成分添加来制备,可根据常规方法适当制备。
可以添加本发明的有效成分的食品的一例可以为选自肉类、香肠、面包、巧克力、糖果类、点心类、饼干类、披萨、拉面、其他面条类、口香糖类、包括冰淇淋类在内的乳制品、各种汤、饮料、茶、补液、酒精饮料及维生素复合物中的任一种形式,包括所有通常意义上的保健功能食品。
上述保健功能食品可包含各种营养素、维生素、矿物质(电解质)、合成和天然风味剂、着色剂及增强剂(奶酪、巧克力等)、果胶酸及其盐类、海藻酸及其盐类、有机酸、保护胶体增稠剂、pH调节剂、稳定剂、防腐剂、甘油、酒精、碳酸饮料用碳酸化剂等。此外,还可以包含用于生产天然果汁和蔬菜饮料的果肉。这些成分可以单独或组合使用。
本发明的保健功能食品组合物可以包含各种香味剂或天然碳水化合物等作为附加成分。上述碳水化合物为如葡萄糖、果糖等单糖,麦芽糖、蔗糖等双糖,以及如糊精、环糊精等多糖,如木糖醇、山梨糖醇、赤藓糖醇等糖醇。可以使用索马甜、甜叶菊提取物等天然甜味剂,或者糖精、阿斯巴甜等合成甜味剂等作为甜味剂。
并且,本发明涉及一种包含酪氨酸或其药学上可接受的盐作为有效成分的用于预防或治疗由蛋白质中酪氨酸硝化(nitration)引起的疾病的药物组合物。
除了上述酪氨酸之外,还可以包含药学上可接受的载体、赋形剂或稀释剂。本发明的药物组合物可以口服或肠胃外给药,在肠胃外给药的情况下,优选选择皮肤外用或腹腔内、直肠、静脉、肌肉或皮下注射方式,但并不限定于此。
本发明的药物组合物可以使用如填充剂、增量剂、粘合剂、润湿剂、崩解剂、表面活性剂等稀释剂或赋形剂来制备。用于口服给药的固体制剂包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,这些固体制剂由一种以上化合物与如淀粉、碳酸钙、蔗糖(sucrose)或乳糖(lactose)、明胶等至少一种赋形剂混合来配制。并且,除了简单的赋形剂外,还使用如硬脂酸镁、滑石粉等润滑剂。用于口服给药的液体制剂包括助悬剂、内用液剂、乳剂、糖浆剂等,除作为常用的简单稀释剂的水和液体石蜡外,还可以包括如润湿剂、甜味剂、芳香剂、保存剂等各种赋形剂。用于肠胃外给药的制剂包括灭菌水溶液、非水溶剂、助悬剂、乳剂、冻干制剂、栓剂。作为非水溶剂和助悬剂,可使用丙二醇(propylene glycol)、聚乙二醇、如橄榄油等植物油、如油酸乙酯等可注射酯等。作为栓剂的基质,可以使用witepsol、聚乙二醇、吐温61、可可脂、月桂脂、甘油、明胶等。
本发明的组合物以药物有效量给药。在本发明中,“药物有效量”是指足以在适用于医学治疗的合理收益/风险比下治疗疾病的量,有效剂量水平可取决于包括患者的疾病类型、严重程度、药物活性、药物敏感性、给药时间、给药途径及排泄率、治疗持续时间、同时使用的药物在内的因素以及医学领域众所周知的其他因素。本发明的组合物可以作为单独的治疗剂给药或者与其他治疗剂联合给药,可以与常规治疗剂依次或同时给药,并且可以单次或多次给药。考虑到所有上述因素,重要的是以能够以最小的量获得最大的效果而没有副作用的量给药,这是本领域技术人员可以容易地确定的。
根据患者的体重、年龄、性别、健康状况、饮食、给药时间、给药方法、排泄率及疾病的严重程度,本发明的组合物的剂量可以在多种范围内使用。
并且,本发明涉及一种对包含硝化(nitration)酪氨酸的蛋白质处理酪氨酸来从硝化酪氨酸中去除硝基的方法。
以下,通过实施例更加详细地说明本发明。对于本领域技术人员而言显而易见的是,这些实施例仅用于更加具体地说明本发明,而本发明的范围并限于这些实施例。
1.动物模型
在本发明中,将28只7周龄的C57BL/6雄性小鼠(韩国KOATECH)在标准条件(温度22~24℃,湿度50~70%,早上6点开灯,12小时明暗循环)下饲养,此时,使动物能够自由摄入食物和水。根据国立卫生研究院(NIH,Bechesda,MD,USA)的指南,根据庆尚大学动物护理和使用委员会(GNU IACUC)批准的方案(GNU-161128-M0068)对本发明中使用的动物进行实验。
2.准备血浆及前额皮质(prefrontal cortex;PFC)试样
脑血和PFC试样均取自用CO
3.确认皮质酮(corticosterone)及ROS/RNS(reactive oxygen species/reactive nitrogen species)
将10μg的裂解物混合在50ml的GS分析缓冲液(50mM的咪唑-HCl、pH6.8、50mM的L-谷氨酰胺、25mM的羟胺、25mM的砷酸钠(sodium arsenate)、2mM的MnCl
混合后,添加50μl的终止缓冲液(90mM的FeCl
分别使用蛋白质印迹及免疫沉淀(IP)-WB测量GS及酪氨酸硝化GS的水平,使用抗3硝基酪氨酸(ab61392,Abcam,Cambridge,UK)及蛋白A/G+琼脂糖(Santa Cruz,Dallas,TX,USA)并根据制造商的方案进行酪氨酸硝化GS的免疫沉淀分析,使用抗GS(1:5000,Abcam)进行GS的蛋白质印迹。
实施例1.根据慢性束缚应激(Chronic immobilization stress;CIS)分析行为、确认谷氨酰胺合成酶(GS)活性变化及GS中的硝化酪氨酸的含量
动物模型分为两组(正常组、应激组),应激组每天在束缚器中单独强制活动2小时(下午2~4点)并给予慢性束缚应激15天,每隔一天测量体重变化和饲料摄入量。
之后,处死动物以确认血浆中皮质酮(corticosterone)含量变化,并确认血浆及PFC中的ROS/RNS。使用ELISA试剂盒(Cayman)并根据制造商的方法进行皮质酮的含量,使用ROS/RNS分析试剂盒(Cell Biolabs,San Diego,CA,USA)并根据制造商的方法分析ROS/RNS。
其结果如图1所示,与未施加应激的对照组(CTL)相比,施加慢性应激的应激组(STR)的体重在7到15天之间趋于下降,但饲料摄入量几乎没有差异,皮质酮含量和ROS/RNS也在统计学上显著增加。
另一方面,经确认,与对照组相比,应激组的谷氨酰胺合成酶(GS)的表达量没有降低,GS中的酪氨酸被硝化的水平在统计学上显著增加,而且GS活性在统计学上显著减少。
并且,向10μg的PFC(prefrontal cortex)组织裂解物中添加0.0031~0.45mg/ml的酪氨酸并混合,在冰上培养10分钟,混合过氧化氮(PN),以使体积达到上述组织裂解物的10倍,然后培养10分钟,之后在体外(in vitro)确认GS活性,结果确认GS活性随着酪氨酸浓度的增加而增加。
实施例2.确认酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的体重及饲料摄入量变化
动物模型分为两组(正常组、应激组),应激组每天在束缚器中单独强制活动2小时(下午2~4点)并给予慢性束缚应激15天,每隔一天测量体重变化和饲料摄入量。
将上述正常组及应激组分为营养均衡的一般饮食组和补充(181.2mg/kg)本发明酪氨酸(tyrosin)的饮食组进行喂养。
其结果如图2所示,确认了酪氨酸饮食与否在体重的变化或饲料摄入量上没有差异。
之后,进行包括OFT(open field test)、TST(tail suspension test)及SPT(sucrose preference test)在内的行为分析。
OFT(旷场试验)在一个方形盒子(60×60×20cm)中进行,将小鼠放置在盒子的中心区域(30×30cm)并跟踪其动作5分钟以测量总移动距离、在中心区域的持续时间以及尝试进入中心区域的频率。
在TST(悬尾试验)中,将小鼠单独悬挂在带有水平杆的盒子中,跟踪其运动6分钟以测量不动的持续时间。
在SPT(蔗糖偏好试验)中,提供0.1M的蔗糖(sucrose)和水48小时养成习惯,然后24小时不提供0.1M的蔗糖(sucrose)和水,之后,提供0.1M的蔗糖(sucrose)和水6小时,再将0.1M的蔗糖(sucrose)和水换位提供3小时。
之后,测量蔗糖和水的消耗量,计算提供的蔗糖占蔗糖偏好总消耗量的比率。
其结果如图3所示,经确认,在旷场试验中,与正常组(CTL)相比,应激组(STR)的在中心区域停留的时间、移动距离、移动到中心的次数减少,在应激组中,与一般饮食组(ND)相比,酪氨酸饮食组(TD)的在中心区域停留的时间、移动距离、移动到中心的次数增加。
并且,在悬尾试验(TST)中,与正常组(CTL)相比,应激组的一般饮食组(ND)的不动时间在统计学上显著增加(p<0.05),与此相比,酪氨酸饮食组的不动时间在统计学上显著减少(p<0.05)。
并且,同样在蔗糖偏好试验中,与正常组相比,应激组的蔗糖偏好在统计学上显著减少(p<0.001),与应激组的一般饮食组相比,本发明的酪氨酸饮食组的蔗糖偏好在统计学上显著增加(p<0.01)。
之后,处死动物后确认血浆中的皮质酮含量,结果如图4所示,应激使皮质酮含量增加,但与应激组的一般饮食组相比,酪氨酸饮食组中的皮质酮的含量在统计学上显著减少(#、p<0.05),确认血浆和PFC组织中的ROS/RNS的结果,与应激组的一般饮食组相比,酪氨酸饮食组中的ROS/RNS在统计学上显著减少(**:p<0.01、*:p<0.05)。
另一方面,与对照组相比,应激组的一般饮食组(ND)及酪氨酸饮食组(TD)的谷氨酰胺合成酶(GS)的表达量均相似,但应激使GS活性降低,但在应激组中,与一般饮食组相比,酪氨酸饮食组的GS活性在统计学上显著增加,GS中的N-Tyr(硝化酪氨酸)的含量被应激在统计学上显著增加,但与一般饮食应激组相比,酪氨酸饮食组的N-Tyr的含量在统计学上显著减少(图5)。
实施例3.确认在PFC中酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的谷氨酸盐、谷氨酰胺、酪氨酸及GABA含量
通过液相色谱-质谱法(LC-MS/MS)定量PFC中的氨基酸(谷氨酸盐、谷氨酰胺、酪氨酸)及GABA的含量。
首先,裂解PFC组织,用内标物质(L-Glu-d5)和流动相稀释组织的上清液。将稀释的试样分为5个并注入LC-MS/MS系统(Agilent 6460)。使用的色谱柱为SeQuant
通过多反应监测检测法检测氨基酸(Glu的m/z 148→84、Gln的m/z 147→84、GABA的m/z 104→87及内标物质的m/z 153→88)
其结果如图6所示,经确认,与正常组相比,应激组的一般饮食组的PFC中的谷氨酸盐、谷氨酰胺、酪氨酸及GABA的含量减少,与此相比,酪氨酸饮食组的谷氨酸盐、谷氨酰胺、酪氨酸及GABA的含量增加到正常组的水平以上。
实施例4.在PFC中酪氨酸饮食(TD)慢性束缚应激(CIS)诱导组(STR)的氨含量变化
在-20℃以下的温度下测量PFC组织的重量以防止组织融化,然后将每10mg组织重量100μl的RIPA(proteinase inhibitor cocktail,包括PIC)和适量玻璃珠放入1.5ml试管中,使用Bullet搅拌机(bullet blender)将组织裂解2次,每次30秒。将组织裂解物离心(spin down),转移到新的1.5ml试管中,并使用超声波粉碎组织1分钟。以12000rpm离心15分钟后,将上清液转移至新的1.5ml试管中,保存在-80℃直至使用。在上述过程中,除PFC组织重量测量外,所有程序均在4℃的温度下进行。将氨分析试剂盒(Ammonia assay kit:Sigma-Aldrich,Cat Num.AA0100)中提供的氨标准溶液(10μg/ml=588μM提供)用水稀释,制成0(空白对照组(blank control))、0.2、0.4、0.6、0.8、1.0μg/ml,PFC组织裂解物用PBS缓冲液稀释2倍。
向上述氨分析试剂盒中提供的100μl的氨分析试剂中添加10μl的用PBS缓冲液稀释2倍的试样(对应5μg的组织)并在常温下培养5分钟。同时向100μl的氨分析试剂中添加10μl的标准溶液,在常温下培养5分钟。用PBS缓冲液稀释2倍的RIPA+PIC作为缓冲液空白对照组,以补偿PFC组织裂解缓冲液(RIPA+PIC)的干扰作用。5分钟后,使用酶标仪在340nm处测量吸光度(A
添加10μl的L-谷氨酸脱氢酶(glutamate dehydrogenase),在常温下培养5分钟后,在340nm处测量吸光度(A
求得DA340nm(A
使用标准的结果值求得指线性回归(linear regression),并使用其计算试样的氨浓度。
其结果如图7所示,经确认,与正常组相比,应激组的一般饮食组的氨含量增加,与此相比,本发明的酪氨酸饮食组的氨含量减少到与正常组相似的水平。
实施例5.体外(in vitro)硝化(nitration)抑制效果分析
用ONOO
并且,使用小鼠的大脑和肝组织裂解物(lysate)分析本发明的酪氨酸的硝化抑制效果。从用CO
其结果确认,PFC及肝组织中酪氨酸硝化被PN增加的蛋白质增加,并通过多个条带的蛋白质印迹结果确认了除谷氨酰胺合成酶(GS)和胰岛素受体β亚单位(IRb)外的多种蛋白的硝化增加。经确认,酪氨酸硝化被PN增加的蛋白质的硝化因用末端带有酪氨酸(Y)的肽处理而减少(图9的A部分、图9的B部分)。通过GS和IRb的表达确认了PFC和肝组织中的各处理组的蛋白质的量没有差异。然而,通过磷酸化-IRb(IRb-p)的蛋白质印迹确认了IRb被PN硝化而被磷酸化的形式减少(图9的C部分,图9的D部分)。
实施例6.确认高脂肪饮食2型糖尿病模型小鼠中L-酪氨酸的胰岛素敏感性增强效果
(1)构建高脂肪饮食2型糖尿病模型
将27只3周龄的C57BL/6雄性小鼠适应饲养环境1周后,分为3组后分别提供正常饮食(ND,normal diet;10kcal%fat,热量3.85kcal/g)、高脂肪饮食(HFD,high fat diet;60kcal%fat,热量5.24kcal/g)、添加L-酪氨酸(L-Tyr)的高脂肪饮食(HFD+L-Tyr;包含181mg的L-酪氨酸/kg),使动物能够自由摄入水和饲料。每2天测量一次体重和食物摄入量,持续3个月,每1周测量一次血糖。
其结果如图10所示,经确认,体重逐渐增加,并且在同一天,HFD及HFD+L-Tyr组的体重高于ND,并且HFD及HFD+L-Tyr组的体重变化表现出相似的水平。各组之间的饲料摄入量几乎没有差异,并且没有出现不同时期的差异。与正常饮食组(ND)相比,HFD组的血糖在统计学上显著增加,与HFD组相比,HFD+L-Tyr组的血糖在统计学上显著减少。
(2)葡萄糖耐量检查
通过将D-葡萄糖溶解在1×PBS中准备40%D-葡萄糖溶液。对禁食16小时的小鼠测量血糖后,按式(1)腹腔注射葡萄糖溶液,每1kg体重腹腔注射2g的葡萄糖。
式(1):
葡萄糖注射量(μl)=体重(g)×5
作为一例,给体重为45g的小鼠注射225μl的40%葡萄糖溶液。腹腔注射葡萄糖溶液后,分别于30、60、90及120分钟测量血糖。
其结果如图11所示,与正常饮食组(ND)相比,高脂肪饮食组(HFD)的血糖含量在统计学上显著增加,与此相比,本发明的添加L-酪氨酸(L-Tyr)的高脂肪饮食组(HFD+L-Tyr)的血糖含量减少。
(3)胰岛素抵抗试验
通过将胰岛素稀释在生理盐水中来准备0.15U/ml的溶液。对禁食6小时的小鼠测量血糖后,腹腔注射胰岛素(0.75U/体重(kg))。腹腔注射胰岛素后,分别于15、30、60及90分钟测量血糖。
式(2):
胰岛素注射量(μl)=体重(g)×5
其结果如图12所示,与正常饮食组(ND)相比,高脂肪饮食组(HFD)的血糖含量在统计学上显著增加,与此相比,本发明的添加L-酪氨酸(L-Tyr)的高脂肪饮食组(HFD+L-Tyr)的血糖含量减少。
(4)确认组织中脂肪堆积变化及血浆中ROS/RNS含量变化用阿佛丁(Avertin)麻醉小鼠后,通过心脏采血,在真空采血管(vacutainer)中与EDTA反应,然后在1500×g、4℃的条件下离心15分钟以分离血浆。PBS和4%多聚甲醛(paraformaldehyde;PFA)通过心脏灌注以固定组织,每个组织被切除并保存在PFA中。
在PBS中稀释血浆3倍后,使用Oxiselect ROS/RNS分析试剂盒(Cell Biolabs)并根据推荐的实验方法测量血浆中活性氧/氮(ROS/RNS)浓度。
其结果确认,在HFD动物模型中,酪氨酸减少了肝脏脂肪的总堆积量,并将肾脏周围的脂肪组织量以在统计学上具有差异的水平个减少,与正常饮食组(ND)相比,高脂肪饮食组(HFD)的血浆中ROS/RNS水平在统计学上显著增加,与此相比,本发明的添加L-酪氨酸(L-Tyr)的高脂肪饮食组(HFD+L-Tyr)的血浆中ROS/RNS水平在统计学上显著减少(图13)。
实施例7.确认由红藻氨酸(Kainic acid)诱导发作的癫痫发作模型小鼠中L-酪氨酸的兴奋性毒性和氧化应激抑制效果
使用由红藻氨酸(KA)诱导发作的癫痫发作动物模型确认酪氨酸对谷氨酸的兴奋性毒性抑制效果。给小鼠腹腔注射等量的红藻氨酸,给喂食不同量酪氨酸的动物连续7天,确认发作的程度。
(1)癫痫发作
给4周龄的ICR雄性小鼠提供正常饮食或含L-酪氨酸饮食,使动物能够自由摄入水和饲料。
正常饮食(ND):AIN-93G
1×L-Tyr:包含181mg/kg的L-Tyr的AIN-93G
3×L-Tyr:包含543mg/kg的L-Tyr的AIN-93G
5×L-Tyr:包含905mg/kg的L-Tyr的AIN-93G
将红藻氨酸(Kainic acid:KA,Abcam)在水浴中加热的同时溶于生理盐水中来准备9mg/ml的红藻氨酸溶液,腹腔注射红藻氨酸溶液(30mg/kg),测定发作水平和症状2小时并记录。根据下表2中的标准应用发作水平判断,并且在注射红藻氨酸之前和之后24小时测量体重并进行比较。
并且,在注射红藻氨酸24小时后,从存活的小鼠中取出活脑组织或在用PFA灌注组织固定后取出脑。
表2
按发作水平分类的代表性症状
其结果确认,发作程度随着酪氨酸含量而有差异地减弱,并且实验组之间的体重没有变化(图14)。并且,经确认,在不摄入酪氨酸的动物的情况下,发生了因红藻氨酸引起的强烈发作现象而在120分钟内死亡的个体,但小鼠的死亡现象随着酪氨酸的摄入量而有所改善,并且,摄入包含900mg/kg(饮食重量)的酪氨酸的饲料的小鼠均存活。
(2)ROS/RNS测量
将脑组织中的海马体放入每10mg组织质量100μl的RIPA(包含蛋白酶/磷酸酶抑制剂(proteinase/phosphatase inhibitor))缓冲液中,使用使用玻璃珠及Bullet搅拌机粉碎1分钟。在12000×g、4℃的条件下离心15分钟来分离上清液并在PBS中稀释10倍用于ROS/RNS测量。使用OxiSelect ROS/RNS分析试剂盒(Cell Biolabs)并根据推荐的实验方法测量ROS/RNS浓度。
注射红藻氨酸后分析存活的小鼠的海马体组织的ROS/RNS量变和GS活性的结果,ROS/RNS的量随着红藻氨酸而增加,但摄入酪氨酸的小鼠中减少到对照组水平(图15)。
(3)谷氨酰胺合成酶(GS)活性测定
在96孔板中放入2μl的海马体裂解物,另外添加50mM的咪唑-HCl缓冲液(pH6.8)调节至50μl。添加50μl的GS活性分析缓冲液(50mM的咪唑(imidazole)-HCl、pH6.8、25mM的L-谷氨酰胺、12.5mM的羟胺、12.5mM的砷酸钠(sodium arsenate)、1mM的MnCl
反应结束后,在空孔中放入作为标准物质的γ-谷氨酰基异羟肟酸(γ-glutamylhydroxamate),直至浓度达到0.391~25.0mM。向试样和标准物质中添加100μl的反应终止溶液(90mM的FeCl
通过与标准曲线比较获得每个样品的GS活性。GS活性以作为终产物的γ-谷氨酰基异羟肟酸的生成量表示,单位为μM/分钟/μg(μM/min/μg)蛋白。
其结果如图15所示,红藻氨酸降低了GS活性,但摄入酪氨酸小鼠增加到对照组水平以上。
(4)免疫组织化学(Immunohistochemistry,IHC)
通过心脏灌注PBS和PFA,取出脑并在PFA中固定15小时以上。用PBS洗涤3次,持续10分钟,通过振动切片机(vibratome)获得厚度为40μm的脑组织切片。
在室温下,将获得的上述脑切片在溶解有3%牛血清白蛋白(bovine serumalbumin)的IHC缓冲液(含0.3%Triton X-100的PBS)中封闭1小时后,在4℃的温度下与一抗(anti-NeuN(Millipore,MAB377,1:500)、anti-Iba1(Wako,019-19741,1:200))反应15小时以上(包含3%BSA的IHC缓冲液)。用IHC缓冲液洗涤3次,每次10分钟,并在室温下,与荧光标记的二抗(anti-Mouse IgG Alexa Fluor 488(Invitrogen,1:1000),anti-Rabbit IgGAlexaFluor594(Invitrogen,1:000))反应2小时(包含3%BSA的IHC缓冲液)。用IHC缓冲液清洗3次,每次10分钟,将切片固定到硅烷(silane)包被的载玻片上。将含有DAPI的防褪色(anti-fade)溶液置于切片上并盖上盖玻片晾干。使用Image J分析程序分析用荧光显微镜拍摄的图像的信号密度。
检查由红藻氨酸诱导的发作模型的脑组织,结果确认,红藻氨酸使海马体区(CA1、CA3)的神经细胞数减少,同一区域的小胶质细胞(microglia)活性增加,并且确认到当摄入酪氨酸后,神经细胞数得以维持并且小胶质细胞的活性由于炎症反应而降低(图16)。
实施例8.确认慢性束缚应激模型小鼠中D-酪氨酸的认知障碍预防效果
(1)准备慢性束缚应激模型
将28只C57BL/6雄性小鼠(7周龄)分为两组后,提供正常饮食(AIN-93G)或含D-酪氨酸(D-Tyr)饮食(181mg D-Tyr/kg AIN-93G)1周。使动物能够自由摄入水和饲料,每周两次测量体重和食物摄入量。
从8周龄开始,在200lux照明条件下每天施加慢性束缚应激(chronicimmobilization stress,CIS)2小时,持续2周。分为对照组(CTL)、D-Tyr摄入对照组(CTL+D-Tyr)、慢性应激组(STR)、D-Tyr摄入慢性应激组(STR+D-Tyr),每组由7只动物组成。
(2)认知功能试验
CIS结束2周后,进行认知功能试验。为了比较含D-Tyr摄入组和一般饲料摄入组在包括适应期在内的整个试验期间的认知功能,进行物体识别测试(object recognitiontest,ORT)和物体位置识别测试(object location recognition test,OLT)以测试长期记忆能力。
ORT由适应(habituation)、熟悉(familiarization)、测试(test)这三个阶段构成。在两天内每天适应测试箱10分钟,第三天,使动物在熟悉阶段探索两个相同的物体10分钟。将小鼠放入测试箱时,将其面向没有物体的墙壁放置。在第四天的测试阶段,将两个物体中的一个换成新的物体,使动物探索10分钟,前5分钟的记录作为数据。物体认知功能指数(DI)通过以下式(3)计算。
式(3):
DI(Descrimination Index)=[新的物体探索时间-熟悉的物体探索时间]/[新的物体探索时间+熟悉的物体探索时间]
OLT:ORT进行24小时后,使动物改变熟悉的物体的位置并探索5分钟。与上述物体认知功能指数(DI)一样,通过计算探索移动物体所花费的时间占总物体探索时间的比率来计算物体位置认知功能指数。
为了使用慢性应激轻度认知障碍动物模型确认酪氨酸的认知功能保护效果,给小鼠提供添加酪氨酸的饲料的同时施加慢性应激(14天),结果确认,酪氨酸的包含有否在体重及饲料摄入量上没有差异,在ORT中无法确认统计学上的显著性差异,在OLT中被应激下降的认知功能因酪氨酸的摄入而维持对照组水平(图17)。
实施例9.确认使用内皮素-1(Endothelin-1)的中风(stroke)模型小鼠中L-酪氨酸的脑梗塞(brain infarct)和氧化应激减少效果
(1)准备中风模型小鼠
给8周龄的C57BL/6雄性小鼠提供正常饮食或含L-酪氨酸饮食1周以上,并使动物能够自由摄入水和饲料。
正常饮食(ND):AIN-93G
L-Tyr:包含905mg/kg L-Tyr的AIN-93G
(2)内皮素-1(Endothelin-1)的准备及立体定向手术(stereotaxic surgery)
将内皮素-1(Endothelin-1)加入三级蒸馏水(2μg/μl)中,剧烈涡旋(vortex)后,在4℃的温度下利用超声波完全溶解约10分钟。
腹腔注射麻醉剂阿佛丁(avertin:每25g小鼠重量0.5ml)麻醉小鼠后,通过立体定向手术在大脑的运动皮质区(以前囟(bregma)为中心,AP 1.5mm、ML-1.5mm、DV 1.8mm)注入2μg的内皮素-1(Endothelin-1)。以每分钟0.3μl的速度注入,注入完成后静置针头约5分钟,使内皮素-1(Endothelin-1)充分吸收到组织中。缝合皮肤后将其在原来的笼子中恢复。
(3)组织染色
通过心脏灌注PBS和PFA,取出脑并在PFA中固定15小时以上。用PBS洗涤3次,持续10分钟,通过振动切片机(vibratome)切成厚度为40μm的脑组织切片,在注入内皮素-1(Endothelin-1)的位置,每次将四个切片固定在涂有硅烷(silane)的载玻片上。将干燥后的切片浸入0.1%甲酚紫(cresyl violet)溶液中5分钟,然后浸入三级蒸馏水中2次,洗去染色液。在100%乙醇中浸泡2~3秒钟脱水后,用二甲苯洗涤两次5秒钟。涂上封固液(Mount)后,盖上盖玻片晾干。在光学显微镜下观察染色的切片试样,并使用Image J程序对存储的图像计算脑梗塞部位的面积。
(4)谷氨酰胺合成酶(GS)活性测定
在96孔板中放入2μl的大脑运动质裂解物(lysate),另外添加50mM的咪唑-HCl缓冲液(pH6.8)调节至50μl。添加50μl的GS活性分析缓冲液(50mM的咪唑(imidazole)-HCl、pH6.8、25mM的L-谷氨酰胺(L-glutamine)、12.5mM的羟胺(hydroxylamine)、12.5mM的砷酸钠(sodium arsenate)、1mM的MnCl
反应结束后,在空孔中放入作为标准物质的γ-谷氨酰基异羟肟酸(γ-glutamylhydroxamate)(0.391~25.0mM)。向试样和标准物质中添加100μl的反应终止溶液(90mM的FeCl
通过将内皮素-1(Endothelin-1)注入小鼠大脑的运动皮质(motor cortex)来诱导血管性中风的实验结果,与给药生理盐水(saline)的对照组相比,给药内皮素(endothelin)的实验组的梗塞体积(infarct volume)剧增,以900mg/kg(饲料重量)剂量摄入酪氨酸的实验组的梗塞体积(infarct volume)减少。并且可以确认,与对照组相比,组织的GS活性因内皮素-1(Endothelin-1)而降低,但tyr饮食维持GS的活性(图18)。
实施例10.确认使用人重组MnSOD的酪氨酸的脱硝(denitration)效果
1)过氧化氮(Peroxynitrite)定量
将过氧化氮(Peroxynitrite)在0.3M的NaOH中稀释40倍并在302nm处测量吸光度,使用过氧化氮(Peroxynitrite)的摩尔吸光系数(ε
2)SOD活性测定
使用Thermofisher公司的SOD比色反应活性试剂盒测定SOD活性。向标准SOD中混合范围内的人重组MnSOD、肽及过氧化氮后在冰上反应10分钟。将标准SOD或10μl的反应的混合物和50μl的从试剂盒中提供的基质溶液加入96孔板中,并在450nm处测量吸光度。加入25μl的从试剂盒中提供的黄嘌呤氧化酶,在常温下反应20分钟后,并在450nm处测量吸光度。使用通过从第二次测量的吸光度减去第一次测量的吸光度获得的数据测量SOD活性。
其结果,SOD活性被活体中的活性氮降低。经确认,尽管过氧化氮(peroxynitrite)降低了MnSOD的活性,但在添加的Tyr(L-、D-form)中SOD活性得以维持(图19)
实施例11.确认Tyr对急性肾功能衰竭的效果
(1)动物实验
使23~25g的雄性C57BL/6小鼠(KOATECH)在恒温恒湿的无菌饲养室内自由摄入水和饲料,并分为1)对照组(Sham)、2)配制溶剂处理肾缺血及再关注诱导组(CMC+IR)、3)L-酪氨酸(L-tyrosine)处理肾缺血及再关注诱导组(L-Tyr+IR)等三个实验组。
将L-酪氨酸(100mg/kg)悬浮在0.5%羧甲基纤维素(carboxymethyl cellulose,CMC)中。将L-酪氨酸或配制溶剂CMC每天口服给药一次,持续4天,第4天口服给药30分钟后诱导肾缺血。通过切开腹部并使用Muller无创伤血管夹(Muller atraumatic vascularclamp)夹住双肾蒂(renal pedicle)来诱导肾缺血。在缺血25分钟后,移除夹子(clamp)并进行再灌注。在对照组(Sham)中,除了通过钳子诱导缺血外,所有外科手术均以相同的方式进行。再灌注24小时后,处死实验动物,从心脏采集血液,并取出组织。
(2)血浆肌酐
采集的血液以3000rpm离心15分钟分离血浆,用Jaffe法测量血肌酐。在Jaffe法中,通过将血浆试样与苦味酸在510nm波长下反应测得的吸光度与用60%乙酸终止反应后测得的吸光度之间的差值计算肌酐的量,以mg/dl单位表示。
(3)实时定量聚合酶链反应
通过Trizol法从肾组织中提取总RNA(total RNA),并使用Revert Aid逆转录系统(Thermofisher)合成cDNA。使用iQ SYBR Green Super mix(Bio-Rad)在CFX ConnectReal-Time PCR系统(Bio-Rad)上进行定量PCR。GAPDH用作管家基因。实验中使用的引物如表3所示。
表3
(4)蛋白质印迹
将肾组织在RIPA缓冲液中均质化并在16000×g、4℃的条件下离心15分钟,收集上清液并通过BCA法定量蛋白质。通过SDS-PAGE电泳后转移至PVDF膜上,用5%脱脂奶粉封闭。之后,将硝基酪氨酸和β-肌动蛋白(β-actin)一抗及相应的二抗反应后,通过ECL法在ChemiDoc XRS
由ROS(Reactive oxygen species)或RNS(reactive nitrogen species)引起的氧化应激是肾缺血及再关注损伤导致急性肾功能衰竭的主要机制,抗氧化因子的增加对抑制肾缺血及再关注损伤具有重要意义。在肾缺血及再关注24小时后测定肾组织中抗氧化作用因子NQO-1的基因表达的结果,与配制溶剂给药组相比,L-酪氨酸的给药显著增加了NQO-1基因表达(#、p<0.01)。确认到线粒体中ROS/RNS的含量也被IR增加了约6倍以上,但被Tyr抑制。确认到MnSOD和Cu/Zn SOD的活性被IR降低,但被Tyr恢复。在肾缺血及再关注24小时后,与sham组相比,肾组织中的硝基酪氨酸(nitrotyrosine)蛋白增加,并且这种增加被L-酪氨酸(L-tyrosine)的给药显著降低(图20)。
并且,如21所示,作为肾损伤评价指标的血浆肌酐的测定结果,在肾缺血及再关注24小时后,与sham相比,血浆肌酐增加了约5.9倍,L-酪氨酸(L-tyrosine)的给药在统计学上显著抑制了该增加,为了确认炎症反应是肾缺血及再关注损伤后急性肾功能衰竭的主要发病机制,测定肾组织中炎性细胞因子(IL-1b及IL-6)的基因表达,结果显示,在肾缺血及再关注24小时后,与sham组相比,IL-1b及IL-6基因表达增加,L-酪氨酸(L-tyrosine)的给药在统计学上显著抑制了该增加。
实施例12.使用偶氮甲烷(Azoxymethane)的对肝性脑病(高氨血症)的Tyr的功效实验
(1)动物实验
将13周龄的C57BL/6雄性小鼠(KOATECH)在恒温恒湿的无菌饲养室内自由摄入水和饲料,并分为(1)对照组(Control)、(2)羧甲基纤维素(Carboxymethyl cellulose)+偶氮甲烷(azoxymethane)处理组(CMC+AOM)、(3)L-酪氨酸+AOM处理组(L-Tyr+AOM)等三个实验组。将L-酪氨酸(100mg/kg)悬浮在0.5%羧甲基纤维素(carboxymethyl cellulose,CMC)中。将L-酪氨酸或配制溶剂CMC每天口服给药一次,持续4天,第4天口服给药2小时后腹腔注射AOM(100mg/kg,100ml)。AOM给药12小时后,腹腔注射200ml的含0.5%葡萄糖的生理盐水以预防脱水,4小时后处死实验动物,从心脏采集血液,并取出肝组织。
(2)血氨分析
使用用于单波长反射测量法分析的测量仪PocketChem BA PA-4140(Arkray,Japan)测量血液中氨的量。取20μl的血液置于试纸条上,在室温下反应3分钟,插入测量仪,在635nm(LED)波长下测量吸光度,结果以μg/dl单位表示。
(3)血浆ALT分析
谷氨酸氨基转移酶(alanine aminotransferase,ALT)是肝细胞损伤的血液指标,通过将采集的血液以3000rpm离心15分钟以分离血浆并使用ChemiLab GPT分析试剂盒(IVD-LAB,Korea)来测量。按照试剂盒(Kit)标准测量方法在分光光度计中于340nm波长处测量吸光度,结果以U/L单位表示。
(4)蛋白质印迹(Western blot)
将肝组织在RIPA缓冲液中均质化并在16000×g、4℃的条件下离心15分钟,收集上清液并通过BCA法定量蛋白质的量。通过SDS-PAGE电泳后转移至PVDF膜上,用5%脱脂奶粉封闭。之后,将硝基酪氨酸和β-肌动蛋白(β-actin)一抗及相应的二抗反应后,通过ECL法在ChemiDoc XRS
氨是氨基酸和核酸的主要代谢产物,将氨转化为尿素的尿素循环的主要酶只存在于肝细胞中,降低氨浓度的GS和SOD以及去除活性氧的过氧化氢酶(catalase)等在肝组织中也很丰富,因此,通过肝脏并上行至大脑的血管中血氨浓度的变化是肝性脑病的重要指标。在由AOM诱导的急性肝性脑病模型中测量血氨的结果,与正常对照组相比,CMC+AOM处理组的血氨浓度增加了6.7倍,L-酪氨酸(L-tyrosine)的给药在统计学上显著抑制了由AOM引起的血氨增加。肝实质细胞的损伤导致存在于细胞质中的ALT游离到血液中,导致其浓度增加,因此,测定这种酶的活性是可以知道肝损伤程度的直接指标。作为在由AOM诱导的急性肝性脑病模型中测量血浆中ALT的结果,与对照组相比,CMC+AOM处理组的血浆ALT增加了约65倍,并且L-酪氨酸(L-tyrosine)的给药在统计学上显著抑制了由AOM诱导的血浆ALT的增加。AOM给药16小时后,与对照组相比,肝组织中的硝基酪氨酸(nitrotyrosine)蛋白增加,L-酪氨酸(L-tyrosine)的给药显著降低了这种增加,该结果证明Tyr抑制存在于肝脏中的蛋白质的硝化(nitration)以去除流入肝脏的氨(图22)。
统计处理
本发明的所有数据均以平均值±SEM表示,并通过使用Dunnetts多重比较检验(Dunnetts Multiple Comparison Test)的单向方差分析(ANOVA)或使用GraphPad Prism5(GraphPad Software)的学生t检验(p<0.05)进行统计分析。
<110> 庆尚国立大学校 产学协力团
<120> 包含酪氨酸作为有效成分的用于预防、改善或治疗由蛋白质中酪氨酸硝化引起的疾病的组合物
<130> KHP222112116.8
<150> KR 2020-0080308
<151> 2020-06-30
<160> 8
<170> KoPatentIn 3.0
<210> 1
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> IL-1β f
<400> 1
tcgcagcagc acatcaacaa gag 23
<210> 2
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> IL-1β r
<400> 2
ggtgctcatg tcctcatcct gga 23
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> IL-6f
<400> 3
ccaattcatc ttgaaatcac 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> IL-6r
<400> 4
ggaatgtcca caaactgata 20
<210> 5
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> NQO-1f
<400> 5
atgacatcac aggtgagctg aagg 24
<210> 6
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> NQO-1r
<400> 6
ctcaaaccag cctttcagaa tggc 24
<210> 7
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> GAPDHf
<400> 7
gtggcaaagt ggagattgtt g 21
<210> 8
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> GAPDHr
<400> 8
ttgactgtgc cgttgaattt g 21
- 包含紫罗兰酮或其盐作为有效成分的具有改善皮肤保湿、去除皮肤角质、增强皮肤弹性、抑制红斑、改善皮肤皱纹或改善皮肤光老化效果的组合物
- 包含丝氨基酸和酪氨酸的用于预防及改善脑疾病的组合物
- 含有芦根提取物作为有效成分的用于预防、改善或治疗由抗癌剂的副作用引起的疾病的组合物
