一类新型曲霉属色素
文献发布时间:2023-06-19 11:55:48
技术领域
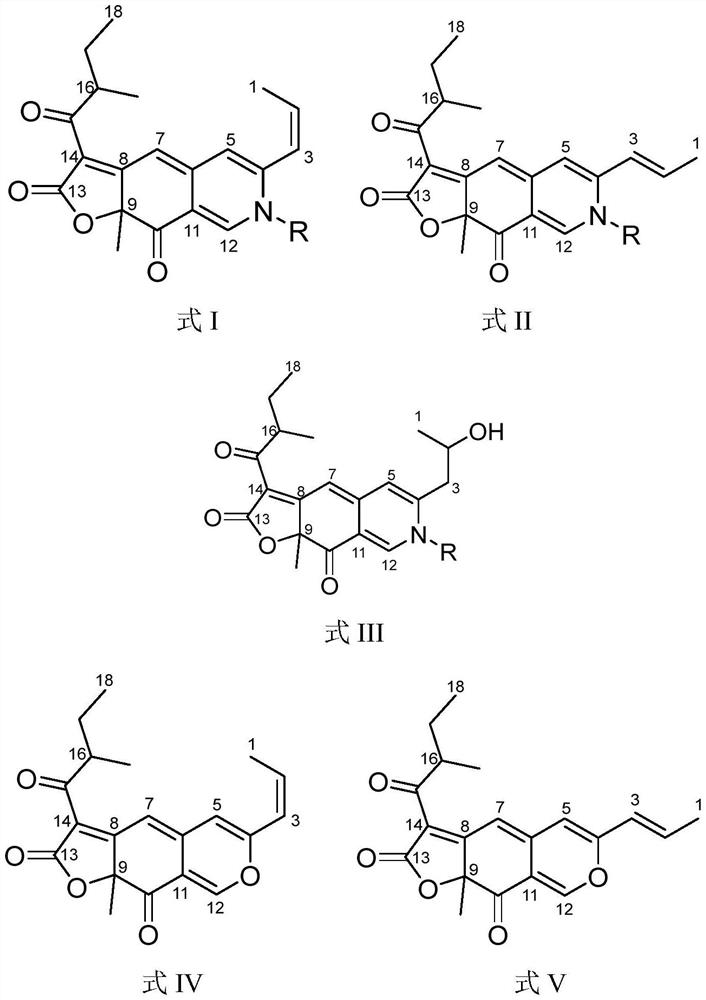
本发明提供了一类新型的天然红色azaphilone色素:卡维胺(cavernamine)及其羟基衍生物,以及它们各自的橙色/黄色前体卡维宁(cavernine)。另外,提供了通过使用Aspergillus cavernicola发酵生产它们的方法,以及进一步地提供了该新型色素和包含该色素的试剂盒用作为食品和/或非食品和化妆品的着色剂的用途。
背景技术
由于消费者对合成着色剂的潜在有害作用的认识不断提高,天然食品着色剂越来越受到追捧
红曲霉(Monascus)是产生色素的真菌属,长期以来在亚洲国家一直用于制造传统食品
使用红曲霉菌种生产红曲霉色素会产生多种不同红曲霉色素的混合物
发明内容
根据第一方面,本发明提供了具有式I或式II结构的卡维胺色素:
其中R是氢,或N-R选自氨基酸、肽、氨基糖和伯胺。
优选地,式I的N-R是选自下组的氨基酸:L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酰胺、L-谷氨酸、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸和L-鸟氨酸。
根据第二方面,本发明提供了具有式III结构的羟基-卡维胺:
其中R是氢,或N-R选自氨基酸、肽、氨基糖和伯胺;其中所述羟基-卡维胺是本发明第一方面的卡维胺的羟基衍生物。
优选地,式III的N-R是选自下组的氨基酸:L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酰胺、L-谷氨酸、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸和L-鸟氨酸。
根据第三方面,本发明提供一种具有式IV或式V的结构的卡维宁色素:
其中,所述卡维宁色素是本发明第一方面的卡维胺色素的前体和/或本发明第二方面的羟基-卡维胺的前体。
根据第四方面,本发明提供了一种通过发酵生产卡维胺色素和/或所述卡维胺色素的羟基衍生物的方法,其包括以下步骤:
a.提供Aspergillus cavernicola菌株的孢子或菌丝体,
b.在包含氮源的液体生长培养基中培养所述孢子或菌丝体,
c.回收在步骤(b)的培养过程中产生的卡维宁色素和/或其羟基衍生物,和
d.可选地分离所述卡维胺色素和/或其羟基衍生物。
优选地,步骤(b)中的唯一氮源是选自单种氨基酸、肽、氨基糖和伯胺的化合物。
本发明进一步提供了一种通过发酵生产卡维胺色素和/或所述卡维胺的羟基衍生物的方法,该方法包括以下附加步骤:
a')在初级(preliminary)液体生长培养基中培养步骤(a)的孢子或菌丝体,其中所述初级液体生长培养基的唯一氮源是无机氮源;并且
在所述步骤(a')之后进行步骤(b)。
本发明还涉及式I或式II的卡维胺色素、式III的羟基-卡维胺和/或式IV或式V的卡维宁用作为着色剂用于食品、非食品和化妆品中的任何一种的用途。
另外,本发明涉及用于使组合物着色的部件的试剂盒,其中所述试剂盒包含(i)至少一种式I或式II的卡维胺色素、至少一种式III的羟基-卡维胺和/或至少一种式IV或式V的卡维宁,和(ii)稳定剂,其中色素装在容器中,其中所述组合物选自食品、非食品和化妆品。
附图说明
图1:(A)卡维胺色素(式I和式II)的结构;(B)卡维胺的羟基衍生物(式III)的结构;和(C)卡维宁色素(式IV和式V)的结构。
图2:从最初筛选生长在察氏酵母提取物琼脂(Czapek Dox yeast extract agar)(CYA)平板或(如实施例1.7所定义的)一步法液体发酵液中的A.cavernicola提取的化合物的基峰色谱图(BPC)和紫外色谱图(EWC,在520nm下测量)。(A)A.Cavernicola IBT32660:1)CYA板提取物的BPC。2)CYA板提取物的EWC(520nm)。3)察氏肉汤培养基提取物的BPC,和4)察氏肉汤培养基提取物的EWC(520nm)。(B)A.Cavernicola IBT23158:1)CYA板提取物的BPC,2)CYA板提取物的EWC(520nm),3)察氏肉汤培养基提取物的BPC,和4)察氏肉汤培养基提取物的EWC(520nm)。(A)和(B)中的垂直虚线表示黄色/橙色前体卡维宁。
图3:显示从来源于的(A)A.Cavernicola菌株IBT32660或(B)A.Cavernicola菌株IBT23158的培养培养基中提取的化合物的EWC色谱图,其中(A)A.Cavernicola菌株IBT32660或(B)A.Cavernicola菌株IBT23158在补充有氨基酸:亮氨酸、组氨酸、缬氨酸、精氨酸或色氨酸的察氏培养基上生长。星号*表示预期的卡维胺氨基酸衍生物;十字形号线
图4:(A)卡维宁和(B)顺式-卡维胺-L的吸收光谱的图形表示。
图5:在不同pH条件下培养的A.cavernicola IBT32660的色素产量(吸光度520nm,深灰色条形柱)和生物量形成(g/l,浅灰色条形柱)。
图6:(A)显示反式-卡维胺的
图7:(A)显示顺式-卡维胺的
图8:(A)显示顺式-卡维胺-L的
图9:(A)显示反式-卡维宁的
图10:(A)显示羟基-卡维胺-H的
图11:从左至右:作为对照的脱脂奶0.1%,具有28ppm的卡维胺-L的脱脂奶0.1%,具有140ppm的卡维胺-L的脱脂奶0.1%,以及具有280ppm的卡维胺-L的脱脂奶0.1%。
图12:左:脱脂酸牛奶(Skyr)对照,右:具有46ppm的卡维胺-L的脱脂酸牛奶。
图13:从左至右:环氧树脂对照,具有30ppm的卡维胺-L的环氧树脂,以及具有600ppm的卡维胺-L的环氧树脂。
图14:左:口香糖(Gummi)对照,右:具有180ppm的卡维胺-L的口香糖。
具体实施方式
缩略语和术语:
卡维胺:是化学式为C
卡维胺氨基酸衍生物是化学式为C
卡维胺的羟基衍生物与羟基-卡维胺可互换使用;卡维胺的羟基衍生物且具有化学式C
卡维宁是化学式为C
基本上不含可用无机氮的生长培养基是一种生长培养基,由于缺乏可用的氮,其会限制指数增长并导致微生物(真菌)的生长进入迟滞或细胞死亡阶段。当生长培养基中含有少于5mM的氮源(例如<5mM KNO
本发明提供了新型的azaphilone色素:卡维胺和卡维胺衍生物,以及它们的前体:卡维宁。这些红色和橙色/黄色色素具有潜在的用途,例如食品着色剂。此外,提供了一种通过使用属于Aspergillus cavernicola菌种的真菌菌株发酵来生产各种形式的azaphilone色素的方法。最初将Aspergillus cavernicola菌株选为潜在的生产生物体,因为与红曲霉属物种相同,发现它们在固体培养基上培养时会分泌出鲜红色。
根据第一方面,本发明提供了一种新型的卡维胺色素。
在一个实施方案中,本发明提供了新型的具有式I或式II的卡维胺色素:
其中R是氢,或N-R选自氨基酸、肽、氨基糖(例如葡糖胺或半乳糖胺)和伯胺(例如邻氨基苯甲酸、苯胺、乙醇胺或对苯二胺)。
在另一个实施方案中,卡维胺色素具有式I或式II,其中R是氢。
在一个优选的实施方案中,卡维胺色素具有式I,其中N-R是氨基酸。举例来说,卡维胺色素具有式I,其中N-R是选自下组的氨基酸:L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酰胺、L-谷氨酸、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸和L-鸟氨酸。
具有如上所定义的式I或式II的新型卡维胺是由Aspergillus cavernicola天然产生的红色azaphilone色素。
与已知的红曲霉色素相比,具有式I或式II的新型卡维胺的一个重要性质是其在水相中出乎意料增加的溶解度(参见实施例4)。这可能主要是由于卡维胺的主链“尾部”结构的链长较短。
根据第二方面,本发明提供了一种新型的羟基-卡维胺色素。
在一个实施方案中,本发明提供了具有式III的新型羟基-卡维胺色素:
其中R是氢,或N-R选自氨基酸、肽、氨基糖(例如葡糖胺或半乳糖胺)和伯胺(例如邻氨基苯甲酸、苯胺、乙醇胺或对苯二胺)。
在一个实施方案中,羟基-卡维胺色素具有式III,其中R是氢。
在一个优选的实施方案中,羟基-卡维胺色素具有式III,其中N-R是氨基酸。举例来说,羟基-卡维胺色素具有式III,其中N-R是选自下组的氨基酸:L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酰胺、L-谷氨酸、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸和L-鸟氨酸。
具有如上定义的式III的新型羟基-卡维胺是由Aspergillus cavernicola天然产生的红色azaphilone色素。
羟基-卡维胺是上述第一方面中所述的本发明的卡维胺色素的羟基衍生物。因此,母核结构(core structure)是相同的(参见图1,其中仅碳1-3的排列不同,而母核结构的碳4-18是相同的),这赋予了所观察到的改进的技术性质。
与已知的红曲霉色素相比,具有式III的新型羟基-卡维胺的一个重要性质是其在水相中的溶解度增加(参见实施例4)。这主要是由于羟基-卡维胺的主链“尾部”结构的链长较短以及C2中的羟基。
根据第三方面,本发明提供了一种新型的卡维宁色素。
在一个实施方案中,本发明提供了具有式IV或式V的新型卡维宁色素:
具有如上所定义的式IV或式V的新型卡维宁是由Aspergillus cavernicola天然产生的黄色azaphilone色素。
卡维宁是在上述第一和第二方面中所述的本发明的卡维胺色素的前体。与卡维胺相比,卡维宁具有氧原子而不是N-R基团。因此,母核结构是相同的(参见图1),这赋予了所观察到的改进的技术性质。
与已知的红曲霉色素相比,具有式IV或式V的新型卡维宁的一个重要性质是其增加的水溶性(参见实施例4)。这主要是由于卡维胺的主链“尾部”结构的链长较短。
提取和检测根据本发明的第一、第二和第三方面的式I或式II的卡维胺、式III的羟基-卡维胺或者式IV或式V的卡维宁的方法在实施例1.4、1.5和1.6中进行了说明。根据本发明的第一、第二和第三方面的式I或式II的卡维胺、式III的羟基-卡维胺或者式IV或式V的卡维宁的化学结构可以通过与二极管阵列检测、高分辨率质谱和核磁共振(NMR)光谱相结合的超高效液相色谱法来确定,如实施例1.5和3.1中所述。
根据本发明的第一、第二和第三方面的式I或式II的卡维胺、式III的羟基-卡维胺和/或式IV或式V的卡维宁可用作食品、非食品和化妆品中的着色剂(例如在实施例5中所述)。食品可以选自以下食品:烘焙食品,烘焙混合物,饮料和饮料基料(beverage base),早餐谷物,奶酪,调味品和调味剂,蜜饯和糖霜,脂肪和油,冷冻乳制甜点和混合物,明胶,布丁和馅料,肉汁和酱汁,奶制品,植物蛋白制品,加工的水果和果汁,以及休闲食品。
非食品可以选自以下非食品:纺织品,棉花,羊毛,丝绸,皮革,纸张,油漆,聚合物,塑料和油墨。
化妆品可以是游离的、可倾倒的或压实的粉末,液体无水油腻产品,用于身体和/或面部的油,用于身体和/或面部的洗剂(lotion)或护发产品的形式。
本发明进一步提供了用于使组合物着色的部件的试剂盒,其中试剂盒至少包含(i)一种具有式I或式II的卡维胺色素,至少一种式III的羟基-卡维胺和/或至少一种式IV或式V的卡维宁,和(ii)稳定剂,其中组合物选自食品、非食品和化妆品。稳定剂可以是阿拉伯树胶或类似的食品工业稳定剂。部件的试剂盒可进一步包含麦芽糖糊精或其他具有与麦芽糖糊精相似性质的食品添加剂。在实施例6中提供了这种组合物的一个实例。优选将色素装在容器中(可选地与分配剂(例如胶体)或增稠剂组合)。
根据第四方面,本发明提供了一种制备卡维胺色素和/或其羟基衍生物的方法。
根据一个实施方案,本发明提供了通过发酵生产卡维胺色素和/或所述卡维胺色素的羟基衍生物的(一步)方法,该方法包括以下步骤:
a)提供Aspergillus cavernicola菌株的孢子或菌丝体,
b)在包含氮源的液体生长培养基中培养所述孢子或菌丝体,
c)回收在步骤(b)的培养过程中产生的卡维胺色素和/或所述卡维胺色素的羟基衍生物,和
d)可选地分离一种或多种所述的卡维胺色素和/或所述卡维胺色素的羟基衍生物,其中所述卡维胺色素具有式I或式II的结构:
且其中所述卡维胺色素的所述羟基衍生物具有式III的结构:
在一个实施方案中,液体生长培养基的氮源选自复合源,例如酵母提取物或玉米浆。在另一个实施方案中,氮源可以是尿素。在又一个实施方案中,氮源选自无机氮源,例如KNO
在一个优选的实施方案中,步骤(b)中液体生长培养基中的氮源仅由选自氨基酸、肽、氨基糖和任何其他伯胺的化合物组成。
合适的唯一氮源包括氨基糖,例如葡糖胺或半乳糖胺;并且包括伯胺,例如邻氨基苯甲酸,苯胺,乙醇胺或对苯二胺。
甚至更优选地,唯一的氮源是单种氨基酸,选自:L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酰胺、L-谷氨酸、L-甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸和L-鸟氨酸。
包含氮源的液体生长培养基优选是包含盐、痕量金属和碳源的合成培养基。合适的碳源包括葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甜菜或甘蔗糖蜜、麦芽及其至少两种的任何组合。
生长培养基优选进一步包含以下盐和痕量金属或由以下盐和痕量金属组成:KH
在生长培养基中提供氮源的化合物的浓度可以为0.01M至1M,例如至少0.01、0.025、0.05、0.075、0.10、0.125、0.15、0.175、0.2、0.3、0.4、0.5、0.6、0.7和0.8M。
在步骤(b)期间提供和保持的生长培养基的pH优选为3至8,更优选为4.0至6.5,甚至更优选为4.0至6.0;其中pH可以通过添加NaOH或HCl水溶液进行调节。
步骤(b)中的培养可以通过将Aspergillus cavernicola的孢子或菌丝体悬浮在液体生长培养基中来进行。
步骤(a)中的孢子可以包含Aspergillus cavernicola的孢子的水悬浮液。
在一个实施方案中,根据本发明的一步法生产的卡维胺色素和/或其羟基衍生物具有式I或式III的结构,其中N-R选自氨基酸、肽、氨基糖和伯胺。
根据第二实施方案,本发明提供了使用上述的一步发酵方法的变型来生产式I的卡维胺色素和/或式III的羟基-卡维胺的(两步)方法。根据该变型,在步骤(a)之后进行附加步骤(a')。在步骤(a')中,将步骤(a)中提供的孢子或菌丝体在初级液体生长培养基中进行培养,其中唯一的氮源是尿素或无机氮源。无机氮源可以选自:KNO
优选地,初级生长培养基中氮源的浓度小于50mM,例如不大于45、40、35、30、25、20、17.5、15、12.5或10mM。
步骤(a')中的初级液体生长培养基包括无机氮作为唯一的氮源,是包括盐、痕量金属和碳源的合成培养基。合适的碳源包括葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甜菜或甘蔗糖蜜、麦芽及其至少两种的任何组合。该合成培养基的关于盐和痕量金属的组成优选包含以下或由以下组成:KH
根据两步发酵法,在步骤(a')中产生的曲霉培养物的培养接着在液体生长培养基中继续进行进一步的培养步骤(b)。步骤(b)中的液体生长培养基优选是在盐和痕量金属方面具有与初级液体生长培养基相同组成的合成培养基。但是,步骤(b)中的液体生长培养基还包含有机氮源。合适的有机氮源选自:氨基酸、肽、氨基糖和任何其他伯胺;并对应于一步发酵法中液体生长培养基使用的合适来源。有机氮化合物优选选自氨基酸、肽、氨基糖和伯胺中的一种作为有机氮的唯一来源。
尽管在步骤(a')中无机氮源是初级液体生长培养基的成分;但是在步骤(b)中,液体生长培养基中不包含其他无机氮源,而是将无机氮替换为给定的有机氮源。
根据第二实施方案,两步发酵可以如下进行:在步骤(a')中在初级液体生长培养基中培养孢子或菌丝体,然后在步骤(b)中将唯一的有机氮源添加到由步骤(a')产生的培养物中。在步骤(a')中的真菌孢子或菌丝体的培养过程中,初级液体生长培养基的无机氮含量被耗尽,使得在步骤(a')结束时,生长培养基中基本上没有可用的无机氮。可以调整初级液体生长培养基中的无机氮含量,以确保在步骤(a')结束之前完全耗尽;例如,通过提供不超过50mM,45mM,40mM,35mM,30mM,25mM,20mM,17.5mM,15mM,12.5mM,10mM的NO
或者,在进一步的培养步骤(b)开始时,将步骤(a')中的初级液体生长培养基替换为包含上述确定的有机氮化合物作为唯一氮源的液体生长培养基。
步骤(a')中提供的初级生长培养基的pH可以与步骤(b)中的生长培养基的pH相同或不同。
在步骤(a')期间提供和保持的初级生长培养基的pH优选为3至8,例如3至5,例如4至7,更优选4.0至6.5,甚至更优选4.0至6.0;其中pH可以通过添加NaOH或HCl水溶液进行调节。
在步骤(b)期间提供和保持的生长培养基的pH优选为3至8,更优选为4.0至6.5,甚至更优选为4.0至6.0;其中pH可以通过添加NaOH或HCl水溶液进行调节。
根据本发明的两步法生产的卡维胺色素和/或其衍生物具有式I或式III的结构,其中N-R选自氨基酸、肽、氨基糖和伯胺。
一步发酵和两步发酵过程中的培养条件支持曲霉培养物中的有氧代谢。有氧代谢依赖于足够的通气,这可以通过摇动液体培养物或提供空气源(例如氧气)来实现。
一步发酵和两步发酵法可以在生物反应器中进行。可以将在一步发酵和两步发酵法中使用的液体生长培养基(如上所述)提供给生物反应器,以促进真菌培养物的分批培养、补料分批培养或连续培养。
对两步发酵法中的培养步骤(a')和(b)的持续时间进行选择,以优化曲霉培养物的生长(通过生物量测量)和曲霉培养物产生的色素的产量。培养步骤(a')优选为至少28小时;例如30小时至40小时。培养步骤(a')的持续时间可以是大约32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70和72小时。在步骤(a')之后的培养步骤(b)的持续时间优选为至少48小时,至少72小时,至少96小时或甚至至少120小时。培养步骤(b)可以例如在48小时至168小时之间。培养步骤(b)的持续时间可以为约48、54、60、66、72、78、84、90、96、104、110、116、120、144小时,或甚至168小时。
通过培养Aspergillus cavernicola而产生的卡维胺和羟基-卡维胺色素是细胞外的,因此可以从液体培养基中回收。
出乎意料的是,通过本发明的两步法生产的红色色素基本上是单一种类的卡维胺和羟基-卡维胺色素,而不是色素的混合物(参见实施例1)。当在两步发酵法的步骤(a')期间提供少量无机氮源时,这会选择性地促进在步骤(a')期间合成少量的分别为式IV和式V的黄色/橙色卡维宁色素的顺式和反式形式。在随后的步骤(b)中,有机氮源中存在的氨基掺入卡维宁母核异构体结构(顺式和反式)中,以形成基本上纯的特定的式I的顺式-卡维胺衍生物。因此,可以提取和回收通过该方法生产的单一种类的卡维胺色素,而无需多个且可能复杂的纯化步骤。此外,使用该方法的发酵产物不含任何霉菌毒素(参见实施例2),因此对于人类使用是安全的。
根据第五方面,本发明提供了一种生产卡维宁色素的方法。
根据一个实施方案,本发明提供了一种通过发酵生产卡维宁色素的方法,该方法包括以下步骤:
a)提供Aspergillus cavernicola菌株的孢子或菌丝体,
b)在液体生长培养基中培养所述孢子或菌丝体,
c)回收在步骤(b)的培养过程中产生的卡维宁色素,和
d)可选地分离所述卡维宁色素,
其中所述卡维宁色素具有式IV或式V的结构:
为了生产卡维宁,将步骤(a)中提供的孢子或菌丝体在步骤(b)中在液体生长培养基中培养,其中氮源可以是尿素或复合氮源,例如酵母提取物或玉米浆,或氮源可以是无机氮源,例如选自:KNO
优选地,用于生产卡维宁的生长培养基中氮源的浓度小于50mM,例如不大于45、40、35、30、25、20、17.5、15、12.5或10mM。
液体生长培养基可以是包含盐、痕量金属和碳源的合成培养基。合适的碳源包括葡萄糖,蔗糖,麦芽糖,可溶性淀粉,甜菜或甘蔗糖蜜,麦芽及其至少两种的任何组合。该合成培养基关于盐和痕量金属的组成优选包含以下或由以下组成:KH
根据第五实施方案,用于生产卡维宁的发酵可以在生物反应器中进行,例如以分批、补料分批或连续模式进行。步骤(b)中的液体生长培养基中的氮含量可以在发酵过程中耗尽,使得在步骤(b)结束时生长培养基中基本上没有可用的氮;或在步骤(b)期间可以提供氮源(可能与其他培养基成分/营养素混合),以提供最小的氮浓度来维持细胞。步骤(b)中液体生长培养基的氮含量可以在最初、全程或以一定间隔调整为50mM、45mM、40mM、35mM、30mM、25mM、20mM、17.5mM、15mM、12.5mM或10mM的氮源,例如50mM、45mM、40mM、35mM、30mM、25mM、20mM、17.5mM、15mM、12.5mM或10mM的NO
优选应调节步骤(b)中的培养时间,以避免潜在的卡维胺产生。这种调节可能涉及在16小时、20小时、24小时、28小时或32小时后(例如20小时至46小时)终止培养。培养步骤(b)的持续时间可以为约32、34、36、38、40、42、44、46、48、50、52和54小时。
在步骤(b)期间提供和保持的生长培养基的pH优选为3至8,例如3至5,例如4至7,更优选4.0至6.5,甚至更优选4.0至6.0;其中pH可以通过添加NaOH或HCl水溶液进行调节。
通过培养Aspergillus cavernicola而产生的卡维宁色素是细胞外的,因此可以从液体培养基中回收。
实施例
实施例1:通过发酵生产卡维胺
1.1菌株保持(maintenance)和孢子生产:真菌菌株Aspergillus cavernicolaIBT 32660和IBT 23158(丹麦IBT科技大学菌种采集中心)被用于生产卡维宁和卡维胺。将A.cavernicola的孢子在CYA琼脂(Sigma-Aldrich提供的察氏酵母提取物琼脂)的平板上繁殖,并在25℃下孵育7天。用0.9%氯化钠(NaCl)溶液和0.01%吐温20收获孢子;将悬浮液通过神奇滤布(mira-cloth)过滤以将孢子与菌丝体分离。将孢子溶液在4℃以10,000rpm离心10分钟。除去上清液,并将孢子沉淀重新悬浮在0.9%NaCl溶液中。通过使用Burker-Turk计数室确定孢子浓度。将所有培养物接种在指定的培养基中,以使初始孢子浓度为10
1.2取样
在摇瓶培养结束时或在生物反应器中的整个培养过程中定期采集样品用于干重(DW)、HPLC、吸光度和LC-MS分析。打算用于HPLC、吸光度和LC-MS的样品通过孔径为0.45μm的无菌过滤器过滤,以从滤液中分离出生物质。
1.3干重分析:通过发酵获得的A.cavernicola生物质的分析
在过滤器上评估干重(DW),该过滤器在微波中预干燥20分钟,在干燥器中保持最少10分钟并称重。为了进行DW分析,将过滤器置于真空过滤泵中,并加入10ml培养液。随后,将具有生物质的过滤器在微波中干燥20分钟,并在干燥器中保持最少10分钟,然后重新称重。将生物质的重量确定为样品施加之前和之后过滤器重量的差。
1.4提取与纯化
首先通过过滤分离生物质和培养基,从A.cavernicola的深层培养提取色素。接下来,使用乙酸乙酯萃取培养基,并将乙酸乙酯相干燥。在配备二醇柱的Isolera One(Biotage)快速系统中,使用正庚烷,正庚烷:二氯甲烷(1:1),二氯甲烷,二氯甲烷:乙酸乙酯(1:1),乙酸乙酯,乙酸乙酯:甲醇(1:1)和甲醇分离干燥的提取物。包含色素的级分进一步经过在连接至Waters 966PDA检测器的Waters 600控制器上的半制备型HPLC。使用的色谱柱为Phenomenex Luna II C18,并使用具有50ppm三氟乙酸的MQ水和乙腈的梯度溶液洗脱化合物。
1.5超高效液相色谱-高分辨率质谱(UHPLC-HRMS)
在配备有二极管阵列检测器的Agilent Infinity 1290UHPLC系统(AgilentTechnologies,Santa Clara,CA,美国)上进行UHPLC-HRMS。在Agilent Poroshell 120苯基己基色谱柱(2.1×250mm,2.7μm)上进行分离,使用线性梯度(由以20mM甲酸缓冲的水(A)和乙腈(B)组成),起始于10%的B,在15分钟内增加至100%并保持2分钟,在0.1分钟内恢复至10%并保持3分钟(0.35mL/min,60℃)。使用1μL的进样量。在具有60mm流通池的Agilent1290DAD检测器上进行UV-VIS检测。MS检测在配备有Agilent Dual Jet Stream电喷雾离子源的Agilent 6545QTOF MS上以正检测模式进行,干燥气体温度为250℃,气流速为8L/min,鞘气温度为300℃,鞘气流速为12L/min。毛细管电压设置为4000V,喷嘴电压设置为500V。质谱图分别以10、20和40eV记录为质心数据,在MS模式下为m/z 85-1700,在MS/MS模式下为m/z 30-1700,采集速率为10个光谱/秒。使用额外的LC泵以15μL/min的流速使用1:100分流器在第二台喷雾器中注入70:30的甲醇:水的锁定质量溶液。该溶液包含1μM三丁胺(Sigma-Aldrich)和10μM六(2,2,3,3-四氟丙氧基)磷腈(Apollo Scientific Ltd.,Cheshire,英国)作为锁定质量。两种化合物均使用[M+H]
1.6吸光度分析:发酵产生的卡维胺的定量分析
通过吸光度测量对色素进行定量分析。使用Synergy 2光谱(BioTek,德国)和96孔微量滴定板测定各个色素溶液的吸光度值。在200-700nm的范围内扫描每种氨基酸色素溶液的150μL样品肉汤,并测定最大吸光度值。在500nm处的吸光度表明存在红色色素。使用橙色和红色色素的标准曲线来计算培养基中的浓度。对于没有标准曲线的氨基酸,吸光度以AU/150μL给出。
1.7初步筛选:一步发酵法生产卡维胺
在(i)察氏酵母提取琼脂(CYA)平板上以及在(ii)液态察氏肉汤中进行两种菌株的初步筛选。
(i)将A.cavernicola孢子在CYA平板上繁殖,在25℃下温育7天。通过在整个菌落上取3-5个直径为6mm的栓(plug)进行菌栓提取。将栓转移到Eppendorf管中,并用800μL的乙酸乙酯和异丙醇的3:1混合物与1%(v/v)甲酸(FA)提取,超声处理一小时。超声处理后,将提取液倾倒至新的Eppendorf管中,并在30℃的温和氮气流下蒸发溶剂。将干燥的提取物在超声处理下重新溶解在400μL甲醇(MeOH)中,并在13500rpm下离心3分钟,以避免样品中出现任何孢子或其他颗粒。如实施例1.5中所述地制备由A.cavernicola分泌的细胞外化合物的色谱图。
(ii)将A.cavernicola孢子接种在察氏肉汤(pH 6)中并培养7天。察氏肉汤由以下成分组成:蔗糖(30g/L),NaNO
肉眼观察到在培养A.cavernicola的过程中,平板和液体培养基都变红了。图2中显示了A.cavernicola分泌的细胞外化合物的色谱图,显示了产生的多种色素。来自CYA板和察氏肉汤的代谢谱具有相似的峰。由此证明,它们可以同等地用于随后测试由A.cavernicola生产的卡维胺。
1.8初步筛选:两步发酵法生产卡维胺
将A.cavernicola孢子接种在察氏肉汤(pH 6)中,该肉汤由蔗糖(30g/L),NaNO
与未诱导的样品(图2)相比,氨基酸诱导的培养物的色谱图显示出明显更精简(leaner)的谱图(图3)。发现卡维胺氨基酸衍生物是氨基酸诱导的样品的肉汤的主要成分。
图4显示了卡维宁和卡维胺(示例性卡维胺-L)的吸收光谱。
1.9卡维胺生产的pH筛选
在补充有酵母提取物(5g/L)和1ml/L的痕量金属溶液的液态察氏肉汤(35g/L)中培养Aspergillus cavernicola IBT 32660,该痕量金属溶液由CuSO
pH筛选结果如图5所示,表明在3至8的pH范围内可产生卡维胺,但是,更优选pH=5。在pH=3时,真菌的生长受到抑制并且非常缓慢,这很可能解释了产生的色素含量低的原因。
实施例2:A.cavernicola的产物不含霉菌毒素橘霉素(mycotoxin citrinin)
对来源于在CYA(5g/l酵母提取物,35g/l察氏肉汤,20g/l琼脂,1ml/l痕量金属)、MEA(20g/l麦芽提取物,1g/l蛋白胨,20g/l葡萄糖,20g/l琼脂,1ml/l痕量金属)、OAT(30g/l燕麦粉,15g/l琼脂,1ml/l痕量金属),PDA(39g/l马铃薯葡萄糖琼脂,1ml/l痕量金属)和YES(20g/l酵母提取物,150g/l蔗糖,0.5g/l MgSO
实施例3:通过发酵A.cavernicola产生的新型卡维胺、卡维宁和羟基-卡维胺色素的结构
从A.cavernicola的培养物中,总共鉴定出四种不同的新型azaphilone化合物:卡维宁、卡维胺、卡维胺的氨基酸衍生物和卡维胺的羟基衍生物。
使用1D和2D NMR实验确定了卡维宁、卡维胺、卡维胺的氨基酸衍生物和羟基-卡维胺的结构。如实施例1.4和1.5中所述地提取、分离和分析A.avecnicola色素;然后使用NMR进行如下分析:
3.1核磁共振(NMR)光谱
在位于丹麦科技大学化学系的Bruker Avance 800MHz上记录NMR光谱(1H,DQF-COSY,edHSQC,HMBC和NOESY)。使用标准脉冲序列获得NMR光谱。所使用的溶剂是DMSO-d6(也可作为δH=2.50ppm和δC=39.5ppm的信号的参照物)或CD
3.2卡维胺的结构解析
基于HR-MS,卡维胺的两个异构体的分子式确定为C
从1H光谱中,鉴定出21个质子,以及基于HSQC和HMBC的19个碳,如图6A所示。一个碳信号的明显缺失与先前从其他azaphilone化合物获得的结果一致,因为当在甲醇中采集光谱时,碳8(图6B)通常具有低的信号强度。
DQF-COSY光谱显示C-1,C-2和C-3的质子之间以及H-16,H-16-CH
基于观察到的相关性,建立了与内酯连接的中央杂芳族双环结构(C-4至C-12)。可以将由四个碳原子(C-16,C-16-CH
除了卡维胺的反式版本,还分离出了顺式版本(图7B)。化学位移与反式版本高度可比,差异主要在H-2和H-3处,其偶合常数对应于顺式构型(图7A)。
3.3卡维胺氨基酸衍生物的结构解析
从实施例1.8中描述的摇瓶培养物中获得的卡维胺的氨基酸衍生物被分离并在结构上被解析。每种衍生物均根据结合的氨基酸进行命名。例如,图8A列出了亮氨酸衍生物顺式-卡维胺-L的质子和碳位移(图8B)。
3.4卡维宁的结构解析
除了含氮的卡维胺外,还在添加氨基酸之前从摇瓶培养物中分离出了不含氮的橙色/黄色色素(图9B)。HR-MS分析确定该分子式为C
3.5羟基-卡维胺的结构解析
还从实施例1.8中描述的摇瓶培养物中鉴定出一系列含还原性较低的氨基酸的卡维胺,其在C-2处含有羟基而不是在C-2和C-3之间的双键(图10B)。例如,图10A中显示了组氨酸衍生物羟基-卡维胺-H的NMR数据。
实施例4:卡维胺色素的物理性质
根据计算结果(http://www.swissadme.ch/index.php),发现卡维胺和卡维宁与已知的红曲霉色素相比,具有更大的水溶性。给出了所选色素的logP值(表1)。凭借其羟基,羟基-卡维胺显示出比其他色素更低的logP。
表1:所选的A.cavernicola色素和相应的红曲霉色素的LogP值。
实施例5:使用顺式卡维胺-L对不同产品进行着色
如实施例1.8中所述制备卡维胺-L,并按实施例1.4中所述纯化。
根据CIEL*a*b*进行比色分析。CIEL*a*b*是International Commission ofIllumination(CIE)指定的颜色空间的名称,它包括所有可感知的颜色。坐标L*表示颜色的亮度(L*=0,产生黑色,L*=100表示漫射白色);a*和b*表示颜色相反的维度:红色和绿色(a*)(负表示绿色,而正表示红色)和黄色和蓝色(b*)(负表示蓝色,正表示黄色)。
该系统基于以下事实:从任何彩色表面反射的光都可以通过三种原色(红色,绿色和蓝色)的相加混色在视觉上进行匹配。L*a*b*模型是三维模型,只能在三维空间中正确表示。
CIELAB值是通过柯尼卡美能达公司(Konica Minolta)的Chroma Meter CR-200测量的。根据手册进行测量。通过取两种颜色之间的L*a*b*之间的欧几里德距离ΔE*来计算感知色差。
5.1牛奶的着色
使用来自Arla的1%脱脂奶来测试顺式-卡维胺-L的着色。将不同浓度的卡维胺-L粉末加入至1%的脱脂奶。将牛奶和有色粉末混合5分钟,然后根据CIEL*a*b*对溶液进行比色分析。
在图11中显示了着色,在表2中报告比色分析的结果。
表2:用不同浓度的顺式-卡维胺-L着色的牛奶的CIEL*a*b*颜色系统测量结果。
5.2脱脂酸牛奶(Skyr)的着色
来自Arla的香草味脱脂酸牛奶(Vanilla Skyr)用于测试顺式-卡维胺-L的着色。
将卡维胺-L粉末添加到来自Arla的香草味脱脂酸牛奶中。将脱脂酸牛奶和有色粉末混合5分钟,然后根据CIEL*a*b*对溶液进行比色分析。图12中显示了着色,在表3报告了比色分析的结果。
表3:用不同浓度的顺式-卡维胺-L着色的脱脂酸牛奶的CIEL*a*b*颜色系统测量结果。
5.3环氧树脂的着色
从Pébéo购买了由树脂和固化剂组成的双组分环氧树脂体系(PEBEO GEDEO 300mlCystal Resin)。
将卡维胺-L粉末加入到固化剂中并充分混合。按照使用说明将着色剂和固化剂按1:2的比例混合,并使其固化24小时。固化后,根据CIEL*a*b*对环氧树脂进行比色分析。
在图13中显示了着色,在表4中报告了比色分析的结果。
表4:用不同浓度的顺式-卡维胺-L着色的环氧树脂的CIEL*a*b*颜色系统测量结果。
5.4自制口香糖(Gummi)的着色
香糖通常是有色的糖果。在本实施例中,测试了卡维胺-L使自制的口香糖着色的能力。
香糖成分配方:14g去矿物质水,7g琼脂,20g糖,25g葡萄糖浆,1g柠檬酸。将配料混合并加热至65℃持续30分钟。将卡维胺-L粉末加到混合物中,并在65℃下搅拌5分钟。将口香糖混合物倒入模具中并冷藏24小时,直到它们变硬。根据CIEL*a*b*对口香糖进行比色分析。
在图14中显示了着色,比色分析的结果报告在表5中。
表5:用不同浓度的顺式-卡维胺-L着色的口香糖的CIEL*a*b*颜色系统测量结果。
实施例6.包含顺式-卡维胺-L的组合物
如实施例1.8中所述地制备卡维胺-L,并按实施例1.4中所述纯化。
用麦芽糖糊精和柠檬酸配制卡维胺-L。纯的卡维胺-L的颜色太强烈,无法实际使用,因为只需要向应用中添加极少量,这会使工作流程更加困难。因此,理想的是将颜色稀释并配制成较弱强度的颜色,如下所示。
如表6所示制备稀释混合物。
表6:稀释混合物
用2M的氢氧化钠将稀释混合物的pH调节至5。将卡维胺-L粉末以0.5g/L的浓度添加到稀释混合物中并混合5分钟。然后将着色溶液在冻干之前冷冻。回收稀释的红色粉末,检测到配制的卡维胺-L的颜色强度的E1%为2.2(在492nm处),而原始的纯卡维胺-L粉末的E1%为220(在492nm处)。
- 一类新型曲霉属色素
- 曲霉属菌发酵产物、食品组合物、化妆料组合物、曲霉属菌发酵产物原料、曲霉属菌发酵产物的制造方法及酶产生促进剂
