双功能肽聚糖/几丁质水解酶的抗致病活性
文献发布时间:2023-06-19 11:57:35
发明领域
本发明涉及双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体(例如酵母或细菌)中的菌丝形成的用途。
本发明还涉及双功能肽聚糖/几丁质水解酶,用于人类或兽医医学,具体地是用于治疗和/或防止致病性感染,特别是酵母或细菌感染。
真菌和细菌病原体比通常所知的更普遍地与发病和死亡相关。人类中最常见的真菌病原体之一是白色念珠菌(Candida albicans(C.albicans)),引起浅表粘膜念珠菌病和危及生命的侵袭性感染。在正常情况下,白色念珠菌作为共生菌生活在人类粘膜表面上,但在真菌粘附和过度生长后,可转变为致病性生命型式,随后发生组织侵袭和粘膜感染。类似地,植物和作物的真菌感染,如葡萄孢属(Botrytis)、核盘菌属(Sclerotinia)和镰刀霉属(Fusarium)在农业上造成严重损失。
真菌致病过程中的一个重要因素是丝状菌丝的形成,丝状菌丝有助于宿主细胞的粘附和侵袭。这种菌丝形态发生过程意味着单细胞酵母细胞和丝状菌丝生长形式之间的可逆转换。与未菌丝化(unhyphenised)的酵母细胞的细胞壁相比,由于几丁质的更高水平,菌丝细胞壁更坚硬,并被其他(糖)蛋白质修饰。病原体的菌丝形式对于穿透组织表面和在内化后逃离宿主细胞可能是重要的。已表明菌丝产生机械力,有助于穿透宿主表皮。为了使机械力作用于宿主细胞组织表面,与宿主组织的紧密锚定可能是一个先决条件。
此外,菌丝形成是真菌病原体形成生物膜的第一步。生物膜的形成涉及浮游细胞的粘附(粘附期)、细胞生长和聚集(初始定殖期)、细胞外物质的产生以及最终形成成熟的生物膜基质(成熟期)。生物膜形成是真菌病原体(如念珠菌属(Candida)物种)的一个重要毒力属性,因为生物膜细胞与其浮游生物或悬浮对应物相比,显示出对抗真菌剂和宿主防御的更强抗性。这部分地是由限制抗真菌药物通过生物膜渗透的外聚合基质的产生以及顽固菌细胞形成的增加引起的(Lewis,2008)。
真菌感染,如例如念珠菌属感染,传统上用抗真菌化合物如唑类进行治疗,但对唑类的抗性正在上升并令人担忧。近年来,靶向毒力因子而不是病原体活力的概念越来越流行。白色念珠菌向菌丝生长的转变是靶向这样的毒力过程的一个主要的实例。此外,这种转变与人类微生物群的紊乱和共生微生物群控制念珠菌属感染的能力下降有关。由于共生微生物群的这一关键作用,益生菌如乳杆菌改造微生物群的潜力得到越来越多的探索,应用于阴道、老年人的口腔以及早产儿和儿童的胃肠道。一些临床试验已显示乳杆菌属(Lactobacillus)复合体的成员具有有潜力的保护作用,但其他临床研究的结果没有定论。由于缺乏乳杆菌对白色念珠菌的抑制效应的作用分子机理的理解,阻碍了对临床研究之间差异的解释。
在本发明中,令人惊讶地发现例如由干酪乳杆菌(Lactobacillus casei)群的菌株产生的双功能肽聚糖/几丁质水解酶能够减少和/或防止诸如白色念珠菌的病原体中菌丝形成,从而可以作为抗致病剂使用。
本发明基于双功能肽聚糖/几丁质水解酶的鉴定,该双功能肽聚糖/几丁质水解酶具有减少和/或防止病原体中菌丝形成的能力。因此,在第一实施方案中,本发明提供了双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体中菌丝形成的用途。在另一个实施方案中,公开了所述双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体中菌丝形成的用途,其中双功能肽聚糖/几丁质水解酶存在于组合物中。
在一个进一步的实施方案中,根据本发明所有不同实施方案的双功能肽聚糖/几丁质水解酶的用途是在pH低于7的环境中提供的。在另一个实施方案中,所述用途在pH低于7的微环境中提供。在另一个实施方案中,并且当在组合物中提供双功能肽聚糖/几丁质水解酶的用途时,所述组合物具有低于7的pH值。在另一个实施方案中,所述组合物进一步包含酸;特别是乳酸。
在另一方面,本公开内容提供了双功能肽聚糖/几丁质水解酶或包含所述水解酶的组合物用于减少和/或防止菌丝形成的用途,作为非医学应用中的抗致病剂;特别是作为非医学应用中的抗真菌剂。例如,提供了双功能肽聚糖/几丁质水解酶的用途,作为个人卫生行业、食品行业、清洁行业、制药行业、植物保护或生物控制行业中的抗致病剂。在另一个实施方案中,提供了双功能肽聚糖/几丁质水解酶在个人卫生行业、食品行业、清洁行业、制药行业、或生物控制行业中作为抗真菌剂的用途。在又一个实施方案中,本发明提供了根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶作为生物控制剂的用途。
在所有所述实施方案中,双功能肽聚糖/几丁质水解酶也可存在于组合物中。在一个进一步的实施方案中,所述组合物包含双功能肽聚糖/几丁质水解酶和乳杆菌属菌株;具体地选自包括发酵乳杆菌(Lactobacillus fermentum)、鼠李糖乳杆菌(Lactobacillusrhamnosus)、干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillusparacasei)的组的乳杆菌属菌株。
在另一个实施方案中,本公开内容提供了根据本发明所有不同实施方案的双功能肽聚糖/几丁质水解酶的用途,用于减少和/或防止病原体中菌丝形成,从而减少和/或防止病原体(例如酵母)形成生物膜。因此,在一个进一步的实施方案中,本公开内容提供了双功能肽聚糖/几丁质水解酶或包含所述肽聚糖水解酶的组合物的用途,用于减少和/或防止病原体(例如酵母)形成生物膜。
本发明的另一方面涉及用于人类和兽医医学的双功能肽聚糖/几丁质水解酶;特别是用于治疗和/或防止致病性感染。此外,公开了所述双功能肽聚糖/几丁质水解酶还可以存在于组合物中,其中所述组合物中的所述双功能肽聚糖/几丁质水解酶用于人类和兽医医学;特别是用于治疗和/或防止致病性感染。
在另一个实施方案中,用于治疗和/或防止致病性感染的所述双功能肽聚糖/几丁质水解酶或其中存在所述双功能肽聚糖/几丁质水解酶的组合物具有低于7的pH值。
在又一个实施方案中,用于治疗和/或防止致病性感染的其中存在所述双功能肽聚糖/几丁质水解酶的所述组合物进一步包含酸;特别是乳酸。
对于本发明而言典型的,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶的特征在于其具有几丁质酶活性。换句话说,本发明所有不同实施方案中的双功能肽聚糖/几丁质水解酶也可描述为具有几丁质酶活性的肽聚糖水解酶。在所述上下文中,几丁质酶活性类似于几丁质水解酶活性。
在又一个实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶是主要分泌蛋白1(Msp1)。在再一个实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶为Msp1并且具有几丁质酶(或几丁质水解酶)活性。
在另一方面中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶包含与SEQ ID NO:1(WP_005687638.1)至少70%、具体地至少85%、甚至更具体地至少90%、95%或99%的序列同源性。在另一个实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶由包含核苷酸序列的核酸编码,所述核苷酸序列与SEQ ID No:2(8422039)具有至少70%、具体地至少85%、甚至更具体地至少90%、95%或99%的同源性。
在另一方面,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶包含与SEQID NO:3至少70%、具体地至少85%、甚至更具体地至少90%、95%或99%的序列同源性。在另一个实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶由包含核苷酸序列的核酸编码,所述核苷酸序列与SEQ ID No:4具有至少70%、具体地至少85%、甚至更具体地至少90%、95%或99%的同源性。
在又另一方面中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶从乳杆菌属菌株获得。在另一方面中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶从选自包括鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌或发酵乳杆菌的组的乳杆菌属菌株获得。
如上文已提到的,本发明提供了双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体中菌丝形成的用途。在一个进一步的实施方案中,所述病原体选自酵母或细菌;优选地选自酵母。在一个更优选的实施方案中,病原体选自念珠菌属(Candida)、曲霉属(Aspergillus)或镰刀霉属(Fusarium)。在一个甚至更优选的实施方案中,病原体选自白色念珠菌(Candida albicans)、热带念珠菌(Candida tropicalis)或都柏林念珠菌(Candidadubliniensis)。
如上文也提到的,本发明的一个方面涉及根据本文所公开的所有不同实施方案的双功能肽聚糖/几丁质水解酶,用于人类和兽医医学,具体地用于治疗和/或防止致病性感染。在一个进一步的实施方案中,所述致病性感染选自酵母感染或细菌感染,优选地选自酵母感染。在仍又一个实施方案中,致病性感染选自念珠菌属感染、曲霉属感染或镰刀霉属感染。甚至更具体地,致病性感染选自由白色念珠菌、热带念珠菌或都柏林念珠菌引起的感染。在另一方面,致病性感染选自阴道感染、泌尿生殖器感染、口腔感染、胃肠感染、上呼吸道感染、肺部感染和皮肤感染。在仍又一个实施方案中,本发明涉及根据本文所公开的所有不同实施方案的双功能肽聚糖/几丁质水解酶,用于治疗和/或防止由病原体引起的阴道感染、泌尿生殖器感染、口腔感染、胃肠感染、上呼吸道感染,肺部感染或皮肤感染;具体地是由酵母或细菌引起的;甚至更具体地是由念珠菌属、曲霉属或镰刀霉属引起的;甚至更具体地是由白色念珠菌、热带念珠菌或都柏林念珠菌引起的。
现在具体参考附图,需要强调的是,所示的细节仅作为示例,并且仅用于例示性讨论本发明的不同实施方案。为了提供被认为是对本发明的原理和概念方面最有用和最容易描述的内容而呈现它们。在这方面,没有试图比基本理解本发明所需的更详细地展示本发明的结构细节。使用附图进行的描述使本领域技术人员清楚地知道如何在实践中体现本发明的几种形式。
图1:特定乳杆菌属菌株的抗菌丝活性和乳酸产生。(A)与活乳杆菌属细胞(10
图2.鼠李糖乳杆菌GG及其组分对白色念珠菌、热带念珠菌和都柏林念珠菌菌丝的抑制。与以下(A)、(B)和(C)共孵育期间,对白色念珠菌(10
图3.在酸存在下,鼠李糖乳杆菌GG及其组分对白色念珠菌菌丝形成的抑制。与以下(A)和(B)共孵育期间,对白色念珠菌(10
图4.突变分析证实了Msp1在抗菌丝活性中的关键作用。(A)与鼠李糖乳杆菌GG突变株共孵育期间,对白色念珠菌(10
图5.Msp1的酶活性。(A)与白色念珠菌菌丝孵育后,鼠李糖乳杆菌GG(左)和植物乳杆菌(L.plantarum)WCFS1(右)的显微图像。箭头表示乳杆菌的极点似乎与菌丝相互作用的部位。显示了代表性图像。(B)Msp1的化学去糖基化不影响其抗菌丝活性。(C)Msp1能分解几丁质衍生物—几丁质天青(chitin-azure)。作为对照,使用乙酸钠缓冲剂。(D)几丁质酶抑制剂Bisdionine C能部分地阻止菌丝抑制。星号表示与单独白色念珠菌相比,p值低于0.05,双星号表示p值低于0.01。
本申请基于以下发现,双功能肽聚糖/几丁质水解酶(例如由干酪乳杆菌组或发酵乳杆菌组的乳杆菌属菌株产生的)具有减少和/或防止病原体(如酵母或细菌)中菌丝形成的能力。
病原体中的菌丝形成定义为单细胞和丝状菌丝生长形态之间的可逆转换。与未菌丝化细胞的细胞壁相比,由于几丁质水平更较高,菌丝细胞壁更坚硬,并被其他(糖)蛋白质修饰。
本申请的发明人现在已经发现,特定的双功能肽聚糖/几丁质水解酶能够抑制或减少菌丝形态发生。如上文所详述,本发明因此提供了这种双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体中菌丝形成的用途。在一个进一步的实施方案中,所述双功能肽聚糖/几丁质水解酶可存在于组合物中。在又一个进一步的实施方案中,所述组合物包含双功能肽聚糖/几丁质水解酶和乳杆菌属菌株;特别是选自包括鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌或发酵乳杆菌的乳杆菌属菌株。
在本发明的另一个实施方案中,从乳杆菌属菌株获得减少和/或防止病原体中菌丝形成的双功能肽聚糖/几丁质水解酶。具有肽聚糖水解酶活性的乳杆菌属菌株例如来自发酵乳杆菌、鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌的组。
真菌细胞壁由几丁质(乙酰葡萄糖胺聚合物)、葡聚糖、多糖和粘多糖、蜡和色素组成。几丁质是真菌细胞壁的位于最接近质膜的重要结构成分,有助于细胞壁的机械强度,包括菌丝的形成。如果没有几丁质的合成,生长的菌丝倾向于裂解。
肽聚糖水解酶是负责切割肽聚糖链和侧链支链中的键的酶,并因此负责总体细胞壁肽聚糖的周转。三类主要的细菌肽聚糖水解酶是切割聚糖主链的糖苷酶、切割侧链肽的酰胺酶和在肽侧链内切割的肽酶,它们根据其切割位置进一步划分。
本发明人在此已经发现肽聚糖水解酶,尤其是肽聚糖水解酶主要分泌蛋白1(Msp1),显示出针对诸如真菌等病原体的菌丝细胞壁的额外的且出乎意料的水解活性。尤其是,所述肽聚糖水解酶(例如Msp1)作为双功能肽聚糖水解酶发挥作用,从而切割酵母细胞壁的几丁质中的乙酰葡萄糖胺连接,除了其先前公布的对肽聚糖的内肽酶活性(Claes等人,2012)之外。结果,肽聚糖水解酶能够减少和/或防止病原体(例如酵母)中菌丝的形成。在本申请中,所述肽聚糖水解酶因此被称为双功能肽聚糖/几丁质水解酶,或具有几丁质酶活性的肽聚糖水解酶。
本发明人进一步鉴定了本发明的双功能肽聚糖/几丁质水解酶因此显示几丁质酶活性。因此,在本发明的另一方面中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶具有几丁质酶活性。这种几丁质酶活性有助于肽聚糖水解酶减少和/或防止病原体中菌丝形成的能力。在另一个实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶显示葡糖酰胺酶活性。
几丁质酶(EC 3.2.1.14)是一种糖基水解酶,其大小在20kDA到约90kDA的范围内。它们存在于广泛生物中,例如细菌、真菌、酵母、植物、放线菌、节肢动物和人类。几丁质酶具有将几丁质直接降解为低分子量几丁寡聚体的能力,具有广泛的工业、农业和医学功能,如诱导子作用和抗肿瘤活性。
几丁质酶可具体分为两大类:内几丁质酶(EC 3.2.1.202)和外几丁质酶(EC3.2.1.200和EC 3.2.1.201)。内几丁质酶在内部位点随机分裂几丁质,从而形成二聚体联十六烷基几丁二糖和N-乙酰葡萄糖胺的可溶性低分子量多聚体如几丁三糖,和几丁四糖。外几丁质酶又分为2个亚类:几丁二糖苷酶(EC3.2.1.29),参与催化从几丁质微丝的非还原端开始的二乙酰几丁二糖的渐进释放,以及1-4-β氨基葡萄糖苷酶(EC 3.2.1.30),切割内几丁质酶和几丁二糖酶的寡聚体产物,从而生成N-乙酰葡萄糖胺的单体。
几丁质是自然界中继纤维素之后第二丰富的多糖,并且例如存在于几种真菌的细胞壁中。几丁质是β-1,4-N-乙酰葡萄糖胺(其为2-乙酰氨基-2-脱氧-D-葡萄糖)的线性稳定聚合物。
在本发明中,本发明人已发现肽聚糖水解酶对病原体(例如真菌)中菌丝形成的作用可通过其水解酶活性与其几丁质酶活性的组合来解释。
本发明不同实施方案中使用的双功能肽聚糖/几丁质水解酶可从乳杆菌属菌株获得。乳杆菌属菌株可选自包括鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌和发酵乳杆菌的组。在优选实施方案中,根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶由鼠李糖乳杆菌GG产生。
如上文已提到的,菌丝的形成对于某些病原体是典型的,包括酵母菌或细菌(
在本发明的另一方面中,本发明人已发现双功能肽聚糖/几丁质水解酶对菌丝形成的作用在酸性环境中得到加强。这种酸性环境可以通过病原体(例如乳杆菌属菌株)产生乳酸来创建,或者通过添加酸(例如乳酸或L-乳酸)来创建酸性环境。乳酸的存在(由同样产生肽聚糖水解酶的乳杆菌属菌株产生,或者另外添加的乳酸)导致双功能肽聚糖/几丁质水解酶在减少和/或防止病原体中菌丝形成方面的协同效应。
此外,本申请涉及包含双功能肽聚糖/几丁质水解酶的组合物用于减少和/或防止病原体中菌丝形成的用途。在一个进一步的实施方案中,所述组合物具有低于7的pH值。在又一个实施方案中,所述组合物进一步包含酸;优选地乳酸,例如L-乳酸。
本申请还涉及双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体中菌丝形成的用途,其中所述双功能肽聚糖/几丁质水解酶存在于组合物中。在一个进一步的方面,所述组合物具有低于7的pH值。在又一方面中,所述组合物进一步包含酸;优选地乳酸,例如L-乳酸。
在另一个实施方案中,根据本发明的组合物还可以包含其它益生菌制剂。
在另一个实施方案中,本发明提供了在所有公开的实施方案中双功能肽聚糖/几丁质水解酶的用途,用于减少和/或防止病原体中菌丝形成,从而减少和/或防止病原体的生物膜形成。因此,在一个进一步的实施方案中,本发明提供了双功能肽聚糖/几丁质水解酶用于减少和/或防止病原体的生物膜形成的用途。在所有所述实施方案中,双功能肽聚糖/几丁质水解酶从乳杆菌属菌株获得;具体地从选自包括鼠李糖乳杆菌、干酪乳杆菌、副干酪乳杆菌或发酵乳杆菌的组的乳杆菌属菌株获得。
在另一方面,本发明提供了根据其所有实施方案的双功能肽聚糖/几丁质水解酶用于防止和/或抑制病原体的生物膜形成的用途。
生物膜是微生物的受保护的生态位,在这里它们不受抗生素或抗真菌处理的影响,并且可以造成持续感染的来源。生物膜是自然界细菌和真菌生长的最常见方式并且在临床感染中也很重要。在本发明中,发明人显示了双功能肽聚糖/几丁质水解酶能够抑制生物膜形成,特别是白色念珠菌的生物膜形成。
在本发明的另一方面中,提供了根据其所有可能实施方案的双功能肽聚糖/几丁质水解酶作为抗致病剂在非医学应用中的用途。在一个进一步的方面,所述非医学应用选自个人卫生行业、食品行业、生物控制行业、作物保护、清洁行业、制药行业。
因此,在一个实施方案中,公开了根据其所有实施方案的双功能肽聚糖/几丁质水解酶用于在个人卫生行业中减少和/或防止病原体中菌丝形成的用途。个人卫生行业包括纸巾、防护面罩/口罩或喷雾剂的生产。甚至更具体地,所述纸巾、防护面罩/口罩或喷雾剂涉及治疗和/或防止致病性感染。例如,本发明的双功能肽聚糖/几丁质水解酶可在个人卫生工业的所有应用中在纸巾、保护面罩/口罩或喷雾剂生产过程中并入所述纸巾、保护面罩/口罩或喷雾剂中。
在本发明的另一个实施方案中,提供了根据其所有可能实施方案的双功能肽聚糖/几丁质水解酶用于在食品行业中减少和/或防止病原体中菌丝形成的用途。所述食品行业可包括发酵食品(乳制品、沃斯(worth)、大豆、蔬菜)或食品行业中使用的生物反应器和加工环境。例如,本发明的双功能肽聚糖/几丁质水解酶可并入所述发酵食品产品中,或并入食品行业中使用的生物反应器和加工环境中。此外,还描述了在清洁行业或制药行业中的用途。在此,本发明的双功能肽聚糖/几丁质水解酶可用于减少和/或防止病原体中菌丝形成,从而确保清洁和无菌的环境。例如,本发明的双功能肽聚糖/几丁质水解酶可添加到清洁产品中。
在另一个实施方案中,提供了本发明的双功能肽聚糖/几丁质水解酶用于生物控制行业。具体地,生物控制行业的定义是为了作物保护而生产和/或应用生物控制剂。因此,在更进一步的实施方案中,本发明提供了根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶作为生物控制剂的用途。在另一个实施方案中,提供了根据本发明不同实施方案的双功能肽聚糖/几丁质水解酶作为作物保护剂的用途。
在本发明的最后方面中,提供了在其所有不同实施方案中的双功能肽聚糖/几丁质水解酶用于治疗和/或防止致病性感染;特别是由酵母或细菌引起的感染。
在又一个实施方案中,致病性感染选自念珠菌属感染、曲霉属感染或镰刀霉属感染。甚至更具体地,致病性感染选自由白色念珠菌、热带念珠菌或都柏林念珠菌引起的感染。在另一方面,致病性感染选自阴道感染、泌尿生殖器感染、口腔感染、胃肠感染、上呼吸道感染、肺部感染和皮肤感染。
泌尿生殖器感染可以包括膀胱感染。口腔感染和上呼吸道感染可包括口鼻咽腔的感染、中耳炎、咽炎、慢性窦炎、急性窦炎、鼻炎、粘膜炎、龋齿、牙龈炎或口臭等。胃肠感染可包括结肠炎、胃感染、炎症性肠病、肠易激综合征等。肺部感染可能包括支气管炎和肺炎。皮肤感染包括寻常痤疮、牛皮癣、烧伤、蜂窝组织炎、脓疱、香港脚(脚癣)、真菌性指甲感染或疣等。
在又一个实施方案中,本发明涉及根据本发明的双功能肽聚糖/几丁质水解酶,用于治疗和/或防止阴道感染、泌尿生殖器感染、口腔感染、胃肠感染、上呼吸道感染、肺部感染或皮肤感染,这些感染是由病原体引起的;特别是由酵母或细菌引起的;更特别地是由念珠菌属、曲霉属或镰刀霉属引起的;甚至更特别地是由白色念珠菌、热带念珠菌或都柏林念珠菌引起的。
实施例
材料和方法
微生物菌株和培养条件。乳杆菌属菌株(表1)生长在37℃无搅拌在deMan、Rogosa和Sharpe(MRS)肉汤(Difco,Erembodegem,比利时)中。白色念珠菌SC5314、热带念珠菌DSM4238和都柏林念珠菌DSM13268生长在37℃并不断地摇动的酵母提取物蛋白胨葡萄糖(YPD)肉汤(Carl Roth,Karlsruhe,德国)中。
表1.本研究中使用的细菌菌株
在37℃孵育24小时后,将本申请中收集的乳杆菌属菌株分离到MRS琼脂平板上。通过对16S核糖体RNA基因测序,对分离物进行分类学表征至物种水平。简而言之,用通用的27F和1492R引物扩增完整的16S rRNA基因(1.5kb)并进行测序。在国家生物技术信息中心(NCBI)网站(
该研究已得到Tienen(比利时)地方医院伦理委员会审查和批准,所有患者均在取样前明确表示同意。
抑制白色念珠菌中菌丝形成。
通过将10
抑制白色念珠菌生物膜的形成。评估了对白色念珠菌生物膜的抑制作用。简而言之,白色念珠菌在YPD培养基中生长过夜,并悬浮至10
乳杆菌属的UV灭活和热杀灭。经过两个洗涤步骤后,通过15分钟UV照射的三次重复将乳杆菌属进行UV灭活,和通过在80℃孵育20分钟进行杀灭。通过在MRS琼脂上铺板确认灭活。
制备无细胞上清液。使乳杆菌属的过夜培养物在37℃在MRS培养基中无搅拌生长。通过在4℃将培养物以2000x g离心10分钟并然后通过0.2μm过滤器(VWR,Haasrode,比利时)过滤来制备无细胞上清液。通过随后用旋转过滤器(>100kDa,>10kDa,>1kDa)进行尺寸分离和用PBS另外洗涤来获得粗级分。
D-乳酸和L-乳酸生产。过夜孵育后,通过离心(10分钟,2000x g,4℃)和通过0.2μm过滤器的过滤灭菌来获得无细胞的上清液。用来自R-Biopharm(Darmstadt,德国)的商购获得的试剂盒测量D-乳酸和L-乳酸的浓度。
从鼠李糖乳杆菌GG中分离Llp1和Llp2。如先前所述(Petrova等人,2016)分离来自鼠李糖乳杆菌GG中的Llp1和Llp2蛋白。简而言之,在表达凝集素的重组大肠杆菌BL21细胞(CMPG10708和CMPG10709)中,用1mM异丙基β-D-硫代半乳糖吡喃糖苷(IPTG)诱导重组蛋白的产生。孵育(25℃,摇动)后,将沉淀物悬浮在非变性裂解缓冲液(50mM NaH
从鼠李糖乳杆菌GG中分离Msp1。如先前所述(Lebeer等人,2012)通过阳离子交换层析纯化Msp1。简而言之,为了从鼠李糖乳杆菌GG的CFS中纯化Msp1,将培养物在4℃以2000×g离心10分钟,然后通过0.2μm过滤器过滤。通过随后用旋转过滤器(>100kDa和>10kDa)的尺寸分离以及用PBS的额外洗涤来获得粗级分。如前所述(Lebeer等人,2012),通过阳离子交换层析从CFS(10至100kDa的级分)进一步纯化Msp1。简而言之,将培养上清液加载到用60mM乳酸盐缓冲液(pH 4.0)平衡的SP Sepharose High Performance(GE Healthcare)上。含有增加的NaCl浓度(100–1000mM)的乳酸盐缓冲液用于洗脱结合的蛋白质。使用SDS-PAGE鉴定含有Msp1的级分,并使用Vivaspin过滤器(MW截留值10,000)(SartoriusStedimbiotech GmbH,37070Goettingen,德国)进行浓缩。
Msp1的去糖基化。Msp1通过三氟甲磺酸(TFMS)方法(-20℃,30分钟)进行化学去糖基化处理(Lebeer等人,2012)。处理后,将蛋白质进行大量透析,并通过SDS-PAGE分析。
Msp1的几丁质酶活性。首先,如前所述,基于几丁质天青(Sigma)的分解研究了Msp1的几丁质酶活性。如前所述,进一步的确认基于2.5mM Bisdionine C(Sigma)对几丁质酶活性的抑制。
使用光学显微术的间接免疫荧光。将抗Msp1兔抗血清用于野生型和dltD突变细胞。与Alexa Fluor 488偶联的抗兔IgG抗体用于使细胞上的Msp1定位可视化。通过配备AxioCam MRm Rev.3单色数码相机的Zeiss Axio Imager Z1对样品进行可视化。使用“Plan-Neofluar”100x/1.3Oil Ph3物镜对样品进行成像。使用提供的AxioVision Rel.4.6软件对图像进行分析,制作相位差和荧光图像的覆盖图。
ELISA。鼠李糖乳杆菌GG和CMPG5540的无细胞上清液中的蛋白质浓度使用二辛可宁酸(BCA)蛋白质测定法进行测定。将96孔ELISA板(Greiner,Bio-one)的孔用冻干并溶于PBS后的上清液(0.5μg/mL)或Msp1(不同浓度,标准曲线)在37℃包被过夜。然后,将孔用PBS/T(含0.05%Tween 20的PBS)洗涤3次,在板中加入250μL含25%脱脂乳溶液的PBS/T,在37℃孵育1小时以阻断非特异结合。接下来,将孔用PBS/T洗涤3次,然后在每个孔中填充100μL在PBS/T中以1:2000稀释的Msp1抗血清,并孵育(37℃,90分钟)。将碱性磷酸酯缀合的山羊抗兔免疫球蛋白G(IgG,Sigma)在PBS/T中按1:3000稀释,并添加到每个孔(100μL)中,然后孵育(37℃,1h)。将结合的抗体与每孔150μL对硝基苯基磷酸盐(在1M Tris-HCl中1mg/mL,pH 9.8)(Sigma)孵育(30min,37℃)后,用Synergy MX微量滴定板读取器(BiotekInstruments)读取每个孔的吸光度(405nm)。
统计数据。Shapiro-Wilk正态性检验(GraphPad Prism 7.02,CA,USA)用于确定数据是否呈正态分布。条件间的统计显著性是通过单因素ANOVA和Tukey的多重比较检验估算得出的。
结果
选择的乳杆菌属菌株显示出强的菌丝抑制活性。
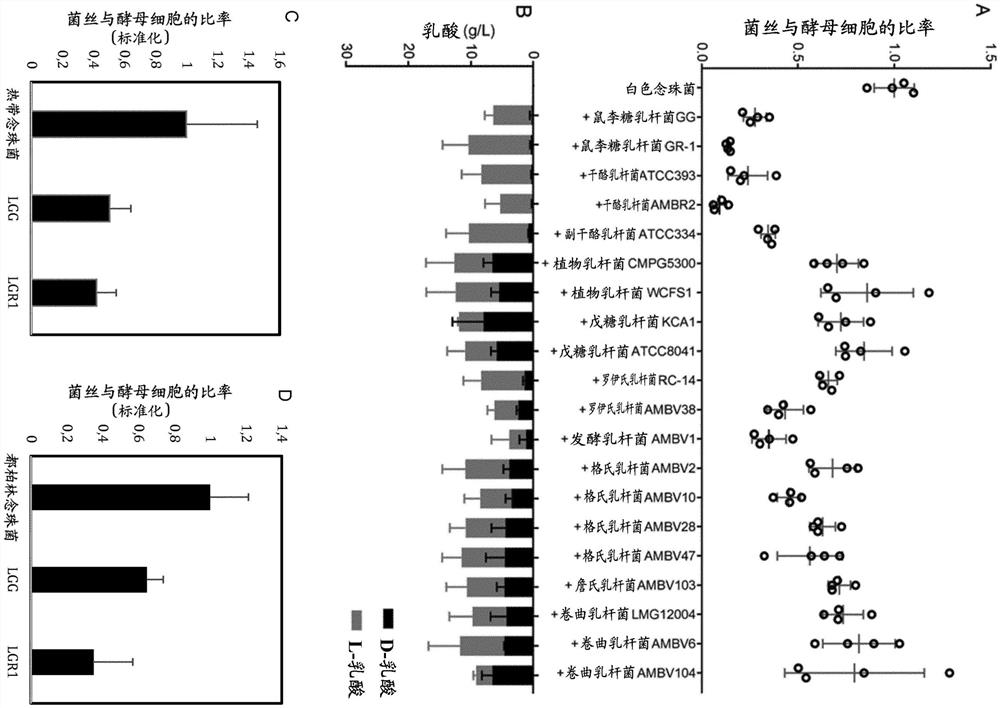
首先,我们旨在比较不同乳杆菌属分类单元之间的抗念珠菌活性。由于菌丝形态发生是白色念珠菌、热带念珠菌和都柏林念珠菌的最重要毒力因子,因此我们集中研究了乳杆菌对所述念珠菌中血清诱导的菌丝形态发生的影响。我们选择了可在内部或在比利时的微生物保藏中心(Belgian Coordinated Collections of Micro-organisms)获得的菌株,这些菌株代表了最近被描述为主要是适应游牧或脊椎动物的不同分类单元/系统发生组。因此,菌株选自干酪乳杆菌组、植物乳杆菌组、罗伊氏乳杆菌(L.reuteri)、发酵乳杆菌、格氏乳杆菌(L.gasseri)、詹氏乳杆菌(L.jensenii)和卷曲乳杆菌(L.crispatus)。在白色念珠菌中,对菌丝形成的抑制率在测试菌株之间显示出较大的差异,范围从91%(干酪乳杆菌AMBR2)到14%(植物乳杆菌WCFS1)(图1A)。
乳酸已被描述为乳杆菌属的关键生物活性代谢物,也据报道会影响白色念珠菌,因此,我们接下来测量了在生长到静止期后,这些菌株的上清液中D-乳酸和L-乳酸的浓度。尽管D-乳酸和L-乳酸的比率不同,但所有菌株都能从葡萄糖中产生乳酸(图1B)。但是,乳酸的总量与所测试的乳杆菌的菌丝抑制活性水平未显示出关系,其任一种异构体的量也没有显示出关系。
在我们的测试中,表现最好的五个菌株均属于干酪乳杆菌组(鼠李糖乳杆菌、干酪乳杆菌和副干酪乳杆菌)。
最后,我们在这里还显示,菌丝形态发生在热带念珠菌和都柏林念珠菌中也受到抑制。尤其是,鼠李糖乳杆菌GG和鼠李糖乳杆菌GR-1均抑制了热带念珠菌和都柏林念珠菌中FCS诱导的菌丝形成(图1C-D)。
鼠李糖乳杆菌GG的主要肽聚糖水解酶和乳酸共同介导了白色念珠菌菌丝抑制。
为了进一步阐明乳杆菌如何影响菌丝形态发生,我们首先探讨了造成这一点的(副)干酪乳杆菌/鼠李糖乳杆菌的因子是否是表面结合的、分泌的或两者兼有。选择鼠李糖乳杆菌GG作为模型,因为该菌株在遗传和分子水平上得到很好的表征。我们首先比较了活的鼠李糖乳杆菌GG细胞与其仅含有分泌分子的无细胞培养上清液以及UV灭活和热杀灭的鼠李糖乳杆菌GG细胞对血清诱导的菌丝形成的作用。两种方式处理的细胞都不应再分泌分子,但是与热杀灭的细胞相反,UV灭活的细胞的表面蛋白不应变性。该比较表明,来自鼠李糖乳杆菌GG的上清液几乎完全抑制了菌丝形成(-97%),而UV灭活的鼠李糖乳杆菌GG细胞对白色念珠菌的菌丝形成的抑制程度与活细胞相同(分别为-57%和-51%)(图2A)。另一方面,被热杀灭的细胞不再能够抑制白色念珠菌菌丝形成。因此,这些结果表明,主要核心鼠李糖乳杆菌特异性效应分子是热敏感和分泌的,但也可以是表面结合的或被细胞结合的效应子所补充。
接下来,我们探索了主要文献记载的鼠李糖乳杆菌GG表面分子的活性,这些表面分子由于凝集素与糖的相互作用而被合理地认为具有假定的菌丝结合特性,包括凝集素样蛋白1(Llp1)和2(Llp2),富含半乳糖的胞外多糖(EPS)及其被甘露糖基化的主要分泌蛋白1(Msp1)。
通过琼脂糖结合和聚糖阵列筛选已显示Llp1和Llp2与D-甘露糖(Petrova等人,2016)和复合糖甘露聚糖结合,两者均存在于白色念珠菌细胞壁的外层。因此,我们旨在探讨这种糖结合能力是否还会导致干扰菌丝形态发生。但是,在先前记录的50μg/ml活性浓度,用Llp1和Llp2处理并没有显示出念珠菌菌丝形成的减少(图2B)。相反,在菌丝表面也可以发现具有凝集素样特性的蛋白质,从而使乳杆菌表面的糖缀合物也成为潜在的相互作用伙伴。与先前的结果一致,从鼠李糖乳杆菌GG分离的EPS能够抑制菌丝形态发生,但仅在200μg/mL的较高浓度下才起作用(图2B)。相反,通过偶然发现,本文测试的来自鼠李糖乳杆菌GG的肽聚糖水解酶Msp1表现出非常强的抑制活性(图2C),在低至5μg/mL的浓度将菌丝形态发生降低了超过50%。此外,Msp1对热带念珠菌和都柏林念珠菌中FCS诱导的菌丝形成具有浓度依赖性作用(图2D-E)。
即使乳杆菌属产生的乳酸不能解释在不同乳杆菌属菌株之间抗菌丝活性中观察到的所有变化(图1),我们在此筛选中也外源添加了乳酸,以定量其对鼠李糖乳杆菌GG的抗菌丝活性的贡献。这样的乳酸(0.5-2%,D-乳酸和L-乳酸以1:1的比率组合)也减少了菌丝形态发生,在相当于上清液的浓度(1%乳酸)约为50%(图3A)。接下来,我们研究了Msp1是否与乳酸协同作用。比上清液中甚至更低浓度的乳酸(0.5%)和Msp1(2μg/ml)的组合显示减少超过94%的菌丝形成,其抑制水平与无细胞上清液相当,表明该组合包含赋予鼠李糖乳杆菌GG以抗菌丝活性的主要效应子(图3B)。丁酸对白色念珠菌的菌丝形成具有可比的作用。同样,盐酸也显著地抑制了菌丝形成,并且与乳酸的差异不显著(图3C)。
白色念珠菌的生物膜调节
菌丝形态发生与白色念珠菌的生物膜调节紧密相关,因此,我们接下来研究了鼠李糖乳杆菌GG是否也能抑制白色念珠菌生物膜形成。该实验设置揭示了鼠李糖乳杆菌GG的上清液能够减少白色念珠菌的生物膜形成。上清液的两个主要成分,乳酸和Msp1,也分别显示出抗生物膜活性(图3D)。
鼠李糖乳杆菌GG的突变体分析证实了Msp1的关键作用。
乳杆菌表面上个体分子之间的相互作用可能会增强或减弱个体纯化的分子的抗菌丝活性,因此,我们用可以从我们先前的研究中获得的特定鼠李糖乳杆菌GG同基因突变体进行了另外的实验。这种补充的方法还使我们能够研究无法纯化到足够水平的分子。
突变体分析证实,EPS层和凝集素的存在与否在鼠李糖乳杆菌GG细胞的抗菌丝活性中没有关键作用,如图4A所示。我们还包括了鼠李糖乳杆菌GG的spaCBA突变体。复杂的、杂聚的SpaCBA菌毛本身难以纯化,但是先前对该同基因突变体的研究表明,菌毛及其岩藻糖和甘露糖残基在鼠李糖乳杆菌GG与宿主细胞和糖缀合物(例如肠粘液,其结构同源物可能存在于菌丝表面)相互作用中的重要性。突变体分析显示,这些SpaCBA菌毛的存在或不存在似乎在鼠李糖乳杆菌GG的抗菌丝活性中不发挥重要作用(图4A)。
不幸的是,由于Msp1在细菌生长和细胞分离中的核心作用,鼠李糖乳杆菌GG中没有获得通过双重同源重组产生的敲除突变体。
但是,dltD突变体是鼠李糖乳杆菌GG的一个有趣的通用表面突变体,因为脂磷壁酸不再被D-丙氨酰化,导致表面电荷以及与表面蛋白和其他分子的缔合中的剧烈转变。值得注意的是,鼠李糖乳杆菌GG dltD突变体细胞几乎完全消除了白色念珠菌的菌丝形态发生。为了探索这是否也可以由Msp1的活性来解释,我们检查了Msp1在该高活性dltD突变体的上清液中和在表面上的存在。使用荧光标记的抗Msp1抗体显示,Msp1与dltD突变体细胞的表面关联性比与野生型表面更高(图4B),因此在上清液中的分泌变少(图4C)。
最后,我们还测试了名为CMPG10200的插入性msp1突变体(此处称为msp1突变体)的活性,该突变体不表达Msp1蛋白的第二半/C末端肽聚糖NLPc/p60结构域,因此缺少内肽酶肽聚糖水解酶结构域(Claes等人,2012)。与具有完整msp1基因的野生型相比,鼠李糖乳杆菌GG的抗菌丝活性受msp1基因诱变的影响不大,而鼠李糖乳杆菌GG dltD突变体细胞几乎可以完全消除白色念珠菌菌丝(图4D)。此外,在仍表达Msp2的msp1突变体CMPG10200中活性没有增加的事实表明,鼠李糖乳杆菌GG的其他肽聚糖水解酶不是活性的肽聚糖水解酶。
此外,评估了与鼠李糖乳杆菌GG突变菌株共孵育期间白色念珠菌的菌丝诱导,这些菌株在其表面上缺乏长的富含半乳糖的EPS、Llp1、Llp2、SpaCBA菌毛或脂磷壁酸(LTA)的D-丙氨酰化(图4D)。
因此,使用突变体或分离的分子的方法组合进一步证明了Msp1的双功能活性在鼠李糖乳杆菌GG的抗菌丝活性中的关键作用。这一发现与以下事实相吻合:来自干酪乳杆菌组的其他测试菌株显示强活性(图1A),因为Msp1被证明在干酪乳杆菌组中(至少一部分)是保守的,而其他所研究的分子对鼠李糖乳杆菌GG菌株是较为具有特异性的。
Msp1显示几丁质酶活性,独立于其糖基化状态。
我们随后旨在更详细地探索Msp1水解酶和念珠菌细胞之间的这种相互作用。首先,我们比较了鼠李糖乳杆菌GG(作为强抗菌丝菌株)与植物乳杆菌WCFS1(以前测试过的效力最低菌株之一)之间与菌丝细胞的结合(图1A)。这些菌株属于数量有限的其主要肽聚糖水解酶已得到充分表征的乳杆菌属菌株。它们两者的主要肽聚糖水解酶均已显示位于乳杆菌细胞的极点(pole),但它们的水解活性和糖基化状态不同:Msp1已证明有γ-D-谷氨酰-L-赖氨酰-内肽酶活性,并似乎被甘露糖残基糖基化,而来自植物乳杆菌WCFS1的Acm2被鉴定为内-β-乙酰氨基葡糖苷酶,并且似乎被N-乙酰葡糖胺残基糖基化。我们首先探讨了这些差异是否在乳杆菌属菌株与菌丝的不同相互作用中得到反映。在鼠李糖乳杆菌GG存在下诱导后,对白色念珠菌菌丝的显微镜检查表明,这些乳杆菌似乎主要在菌丝细胞的极性部位与菌丝细胞接触(图5A)。与鼠李糖乳杆菌GG相反,植物乳杆菌WCFS1细胞似乎不与菌丝紧密相互作用(图5A),表明鼠李糖乳杆菌GG与菌丝的特异性结合对于其抗菌丝活性很重要。
为了探究Msp1和白色念珠菌菌丝之间的结合是否确实是由于它们的糖-凝集素相互作用所致,如上所述,我们接下来研究了非糖基化Msp1的活性。化学去糖基化后,菌丝抑制水平显示与天然(糖基化)Msp1相似(图5B),表明另一种意外机制可能是Msp1的抗菌丝活性的基础。
尽管起源不同,来自白色念珠菌的几丁质和来自鼠李糖乳杆菌GG的肽聚糖显示出一些结构相似性,这是由于在两者的主链中都存在N-乙酰基-葡萄糖胺残基。因此,并且由于乳杆菌极点和菌丝之间的紧密接触,我们假设Msp1可能能够使用几丁质(菌丝细胞壁的主要聚合物)作为底物。基于几丁质天青测定,我们发现Msp1确实能够分解几丁质,其程度与可以商购的来自灰链霉菌(Streptomyces griseus)的几丁质酶相同(图5C)。接下来,我们确定几丁质酶抑制剂是否能够挽救白色念珠菌菌丝形态发生。Bisdionine C(一种已知的几丁质酶抑制剂)部分地逆转了Msp1对菌丝形态发生的抑制作用(图5D),进一步证实了Msp1的几丁质酶活性确实是其抗菌丝能力的基础。
生物信息学分析指向干酪乳杆菌组的Msp1的保守性质
在核苷酸水平和蛋白质水平上都进行了Blast分析。在核苷酸水平上,在鼠李糖乳杆菌、副干酪乳杆菌、干酪乳杆菌三个物种中发现了具有足够同源性的蛋白质。仅鼠李糖乳杆菌分类单元的菌株显示具有完整基因(100%查询覆盖),而副干酪乳杆菌和干酪乳杆菌显示41-44%查询覆盖和最小77-80%的百分比同一性。在蛋白质水平上,blastP显示大多数同源蛋白质来自乳杆菌属复合体。
鼠李糖乳杆菌含有完整蛋白,百分比同一性范围为93-100%。副干酪乳杆菌和干酪乳杆菌的一些菌株也含有完整蛋白,但是百分比同一性较低或查询覆盖较低。C-末端结构域属于NlpC/P60家族,指的是内肽酶,并且在所有研究的乳杆菌属中大多数都是保守的。上面显示该结构域不足以提供全部的几丁质酶活性,因为缺少该结构域的msp1突变体仍然能够部分地抑制菌丝。因此,N-末端结构域也应存在,与鼠李糖乳杆菌GG的Msp1具有最小74.65百分比同一性。
除了突变体信息和TFMS分析外,生物信息学分析还指向潜在的几丁质酶结构域
由于Msp1的生化表征显示了几丁质酶活性,因此我们调查了我们是否可以在msp1基因(LGG_00031)编码的蛋白质中检测到几丁质酶样结构域。不幸的是,通过BLAST分析未能鉴定出已知的几丁质酶样结构域。但是,当我们从Msp1蛋白第一个结构域(178个氨基酸残基)的BLASTp搜索中排除乳杆菌属序列时,命中之一是来自瘤胃球菌属(Ruminococcus)物种的1型锚定蛋白(dockerin)(同一性得分为34%)。在内切葡聚糖酶中发现1型锚定蛋白结构域,这可能与几丁质酶有相似之处,因为几丁质是葡萄糖衍生物的聚合物。
接下来,我们探索了Msp1与其他几丁质酶之间的其他潜在结构相似之处。我们发现在(酸性)哺乳动物几丁质酶活性位点的六个高度保守的氨基酸残基也存在于Msp1序列的第一部分(Olland等人,2009)。更具体地说,发现了在来自鼠李糖乳杆菌GG的Msp1中,八个保守残基中有六个彼此距离相似(Asp-136、Arg-145)或相等(Glu-140、Asp-213、His-269、Trp-360)。
对来自粘质沙雷氏菌(Serratia marcescens)的几丁质酶晶体结构的阐明表明其催化结构域为α/β桶形结构域(Perrakis等人,1994)。这些桶形结构由相互连接的链和环组成(Tian和Bernstein,2010年)。预测Msp1的第一部分具有相似的结构,因为通过在线工具PredictProtein 2013(Yachdav等人,2014)发现该部分似乎存在的几乎完全是链和环。
这使我们相信Msp1蛋白编码另一个尚未描述的酶结构域,该酶结构域负责几丁质酶活性。我们关于存在另一个结构域和伴随活性的假设得到了许多观察的支持。首先,NlpC/p60结构域仅覆盖计数为498个氨基酸的蛋白的C-末端113个氨基酸(SEQ ID NO:3),而该基因的第一部分可用于其他结构域。在第一部分中,我们确实发现了与已知几丁质酶的一些结构相似性。要考虑的另一个相似之处是Msp1可以刺激Akt信号传导(Yan和Polk,2002),这在其他几丁质结合蛋白(例如几丁质酶-3-样-1蛋白)也有所描述(Chen等人,2011)。这也意味着Msp1是一种双功能酶。
在这里发现的这些观察结果也为其他一些研究提供了更多的启示。在Ettinger及其同事的研究中,他们发现鼠李糖乳杆菌GR-1(其表达与鼠李糖乳杆菌GG相同的Msp1/p75蛋白)可以减弱对心肌细胞中肥大的诱导。他们基于已知的抗凋亡特性假设这是由于Msp1的分泌所致(Ettinger等人,2017),但无法证实这一点。然而,由于他们仅使用鼠李糖乳杆菌GR-1的插入性突变体(也缺少已知的酶促内肽酶结构域)且没有用纯化的Msp1,因此可以认为Msp1仍然是所观察到的活性的关键效应子。在我们先前关于鼠结肠炎模型中鼠李糖乳杆菌GG及其LTA突变体的研究中(Claes等人,2011),因为Msp1和Msp2抗炎性质,提出Msp1和Msp2作为鼠李糖乳杆菌GG的抗结肠炎分子。最近,表明人几丁质酶-3-样-1蛋白可以下调凋亡前蛋白S100A8和S100A9(Low等人,2015)。这些蛋白质通常在结肠炎期间被上调并且对于疾病发展至关重要。可能的是,Msp1的几丁质酶结构域还可以与人几丁质酶-3-样-1蛋白识别相同的位点,并对凋亡前蛋白S100A89的表达发挥相同的活性。
Chen C.C.等人Carbohydrate-binding motif in chitinase 3-like 1(CHI3L1/YKL-40)specifically activates Akt signaling pathway in colonic epithelialcells.Clin.Immunol.;140(3):268-75(2011).
Claes,I.J.等人Lessons from probiotic-host interaction studies inmurine models of experimental colits.Mol.Nutr.Food Res.,55(10):1441-53(2011).
Claes,I.J.等人Genetic and biochemical characterization of the cellwall hydrolase activity of major secreted protein of Lactobacillus rhamnosusGG;Plos One 7(2):e31588(2012).
Ettinger G.,等人Lactobacillus rhamnosus GR-1attenuates induction ofhypertrophy in cardiomyocytes but not through secreted protein Msp-1(p75).Plos one;12(1):e0168622(2017).
Lebeer,S.等人The major secreted protein Msp1/p75 is O-glycosylated inLactibacillus rhamnosus GG.Microb.Cell Fact.11,15(2012).
Lewis,K.Multidrug tolerance of biofilms and persister cells;Curr.Top.Microbiol.Immunol.,322:107-311(2008).
Low,D.等人Chitinase 3-like 1induces survival and proliferation ofintestinal epithelial cells during chronic inflammation and colitis-associated cancer by regulating S100A9.Oncotarget,6(34):36535-50(2015).
Olland,A.M.等人Triad of polar residues implicated in pH specificityof acidic mammalian chitinase.Protein Sci.,18(3):569-78(2009).
Perrakis,A.,等人Crystal structure of a bacterial chitinase at 2.3Aresolution.Structure;2(12):1169-80(1994).
Petrova,M.I.等人Lectin-like molecules of Lactobacillus rhamnosus GGinhibit pathogenic Escherichia coli and Salmonella biofilm formation;Plos One11,e0161337(2016).
Tian,P.和Bernstein,H.D.Moleculra baisis for the structural stabilityof an enclosed beta-barrel loop.J.Mol.Biol;402(2):475-89(2010).
Yachdav,G.等人PredictProtein–an open resource for online predictionof protein structural and functional features.Nucleic Acids Res.;42:W337-43(2014).
Yan,F.和Polk,D.B.Probiotic bacterium prevents cytokine-inducedapoptosis in intestinal epithelial cells.J.Biol.Chem.,277(52):50959-65(2002).
序列表
<110> Universiteit Antwerpen
<120> 双功能肽聚糖/几丁质水解酶的抗致病活性
<130> UNA-032
<150> EP18201637.8
<151> 0025-04-09
<160> 4
<170> BiSSAP 1.3.6
<210> 1
<211> 498
<212> PRT
<213> 人工序列
<220>
<223> Msp1蛋白
<400> 1
Met Val Asp Ser Lys Lys Val Leu Ser Val Thr Ala Gly Phe Val Gly
1 5 10 15
Ala Ala Gly Leu Ala Ala Leu Ala Thr Gly Ala Asn Thr Val Ser Ala
20 25 30
Ser Thr Gly Thr Val Ser Tyr Lys Ser Gly Ala Thr Thr Val Trp Asn
35 40 45
Ser Pro Ser Trp His Gln Val Lys Arg Tyr Val Thr Phe Gly Asp Thr
50 55 60
Val Gln Leu Leu Gly Lys Thr Val Asp Gln Asn Gly Ala Thr Trp Tyr
65 70 75 80
Lys Val Gly Asp Asn Gln Trp Ile Pro Glu Leu Tyr Leu Asn Val Ala
85 90 95
Gly Lys Thr Ala Thr Val Glu Thr Pro Ser Ser Ala Ala Ser Gln Thr
100 105 110
Ala Val Ser Gln Ala Pro Ala Ser Gln Ala Pro Thr Ser Gln Ala Pro
115 120 125
Ala Thr Gln Thr Pro Ala Ala Pro Gln Thr Asp Thr Gln Thr Ala Asn
130 135 140
Thr Gln Leu Tyr Val Lys Asn Ile Gly Ser Ala Val Thr Val Trp Thr
145 150 155 160
Thr Pro Ala Tyr Thr His Ala Thr Gly Gln Tyr Leu Glu Gly Ser Gln
165 170 175
Thr Leu Thr Ala Val Ala Gln Gln Gln Ala Asn Gly Glu Thr Trp Tyr
180 185 190
Arg Leu Ala Asn Gly Gly Tyr Val Pro Ala Arg Phe Val Ser Thr Thr
195 200 205
Pro Val Ala Val Thr Pro Gln Pro Ala Ala Pro Gln Ser Asn Glu Ala
210 215 220
Ser Val Ala Ser Thr Asn Thr Asn Ala Ala Asn Asp Ser Ala Ala Ala
225 230 235 240
Ser Ser Ala Ala Ala Ser Gln Ala Ala Ala Ser Ser Ala Ala Ala Ser
245 250 255
Thr Ala Ala Ala Asn Ala Ala Val Ala Ser Ala Asn Ala Thr Ala Ser
260 265 270
Gln Ala Ala Ala Ser Glu Ala Ala Ala Ser Gln Ala Ala Ala Ser Gln
275 280 285
Ala Ala Ala Ser Gln Ala Ala Ala Ser Gln Ala Ala Ala Ser Gln Ala
290 295 300
Ala Ala Ser Gln Ala Ala Ala Ser Gln Ala Ala Ala Ser Gln Ala Ala
305 310 315 320
Ala Ser Gln Ala Ala Ala Ser Gln Ala Ala Ala Asn Ala Ala Gln Gln
325 330 335
Ala Pro Ala Asn Gln Ala Asn Val Thr Thr Thr Gln Val Asn Ala Asn
340 345 350
Gln Ala Gln Gln Gln Thr Ala Thr Ala Thr Pro Ala Val Asn Thr Ser
355 360 365
Asn Gln Thr Ala Ala Val Ser Ala Ser Arg Gln Ala Lys Ile Gln Ala
370 375 380
Val Ile Ala Ile Ala Glu Gln Gln Val Gly Lys Pro Tyr Val Trp Gly
385 390 395 400
Gly Lys Gly Pro Asn Ser Phe Asp Cys Ser Gly Leu Met Tyr Tyr Ala
405 410 415
Phe Leu Asn Gly Ala Gly Val Asn Ile Gly Gly Trp Thr Val Pro Gln
420 425 430
Glu Ser Ser Gly Thr Gln Val Ser Leu Ser Ala Leu Gln Pro Gly Asp
435 440 445
Leu Leu Phe Trp Gly Ser His Gly Ser Thr Tyr His Val Ala Leu Tyr
450 455 460
Ile Gly Gly Gly Thr Met Ile Gln Ala Pro Gln Pro Gly Glu Asn Val
465 470 475 480
Lys Tyr Thr Ala Leu Ala Tyr Phe Met Pro Asp Phe Ala Val Arg Pro
485 490 495
Ser Leu
<210> 2
<211> 1498
<212> DNA
<213> 人工序列
<220>
<223> Msp1基因
<400> 2
atggtagatt ctaagaaagt attgtcagta acggcaggct tcgttggtgc tgccggtctg 60
gcggctttag caaccggagc caataccgtt tctgcatcga cagggacggt cagttacaaa 120
tccggtgcga ccaccgtatg gaatagtcca tcatggcacc aagtcaaacg ctacgtgact 180
tttggggaca cggtgcagct attgggtaaa accgttgacc aaaatggtgc tacttggtat 240
aaagttggcg acaatcagtg gattccggaa ttgtatttga atgttgcggg taaaactgcc 300
acggttgaaa caccgagttc ggcagcaagt caaactgctg tcagccaagc accggctagt 360
caggcgccta caagccaagc accagcaacc caaacacctg cdagcaccac aaaccgatac 420
ccaaacagct aatacacagc tttatgtcaa gaatatcggt tcagcagtta ccgtatggac 480
aaccccggcg tatactcatg cgacaggtca atatctagaa ggcagccaga cactgacggc 540
tgttgcccag cagcaagcaa atggtgaaac atggtatcgg cttgccaacg gcggttatgt 600
tcctgcacgg tttgttagca caacaccagt ggctgtaaca ccacaacctg cagcgccaca 660
gtcaaatgag gccagtgttg cgtcaacgaa caccaatgca gctaatgatt ctgccgctgc 720
ttctagtgca gccgcatcgc aagccgcagc ttccagtgct gccgcttcta cagcagcagc 780
taatgcagca gtagcatctg caaatgccac tgcatcacaa gcagcggctt ctgaagctgc 840
tgcatctcag gcggctgcat cacaagccgc agcgtctcag gctgccgcat cgcaagccgc 900
agcatcacaa gctgcagcgt ctcaggcggc tgcatcacaa gccgccgctt cacaagctgc 960
agcgtcccag gctgccgcat cacaagcagc tgcaaatgct gcccagcagg cgccggctaa 1020
ccaggcaaat gttacaacaa cacaggttaa tgccaatcaa gctcaacagc aaaccgctac 1080
ggctacacca gcagttaaca cgtctaatca gacggcggcc gtaagtgctt caagacaggc 1140
caagattcaa gcagtgattg ccattgccga acaacaagtt ggtaagccat acgtttgggg 1200
cggtaagggg cctaacagct ttgattgctc cggtttgatg tattacgctt tcctgaatgg 1260
cgctggcgtc aacattggtg gctggacagt tcctcaagaa tcttcaggga cacaagtttc 1320
actgagtgct ctgcaacccg gtgacttact cttctggggt agtcacggtt caacctatca 1380
cgttgccctg tacatcggtg gcggcacgat gattcaggcg ccacagccag gtgaaaatgt 1440
taaatatacc gcgctggcat acttcatgcc tgactttgcg gttcgcccgt cactataa 1498
<210> 3
<211> 217
<212> PRT
<213> 人工序列
<220>
<223> Msp1蛋白 - 几丁质酶结构域
<400> 3
Met Val Asp Ser Lys Lys Val Leu Ser Val Thr Ala Gly Phe Val Gly
1 5 10 15
Ala Ala Gly Leu Ala Ala Leu Ala Thr Gly Ala Asn Thr Val Ser Ala
20 25 30
Ser Thr Gly Thr Val Ser Tyr Lys Ser Gly Ala Thr Thr Val Trp Asn
35 40 45
Ser Pro Ser Trp His Gln Val Lys Arg Tyr Val Thr Phe Gly Asp Thr
50 55 60
Val Gln Leu Leu Gly Lys Thr Val Asp Gln Asn Gly Ala Thr Trp Tyr
65 70 75 80
Lys Val Gly Asp Asn Gln Trp Ile Pro Glu Leu Tyr Leu Asn Val Ala
85 90 95
Gly Lys Thr Ala Thr Val Glu Thr Pro Ser Ser Ala Ala Ser Gln Thr
100 105 110
Ala Val Ser Gln Ala Pro Ala Ser Gln Ala Pro Thr Ser Gln Ala Pro
115 120 125
Ala Thr Gln Thr Pro Ala Ala Pro Gln Thr Asp Thr Gln Thr Ala Asn
130 135 140
Thr Gln Leu Tyr Val Lys Asn Ile Gly Ser Ala Val Thr Val Trp Thr
145 150 155 160
Thr Pro Ala Tyr Thr His Ala Thr Gly Gln Tyr Leu Glu Gly Ser Gln
165 170 175
Thr Leu Thr Ala Val Ala Gln Gln Gln Ala Asn Gly Glu Thr Trp Tyr
180 185 190
Arg Leu Ala Asn Gly Gly Tyr Val Pro Ala Arg Phe Val Ser Thr Thr
195 200 205
Pro Val Ala Val Thr Pro Gln Pro Ala
210 215
<210> 4
<211> 651
<212> PRT
<213> 人工序列
<220>
<223> Msp1基因 - 几丁质酶结构域
<400> 4
Ala Thr Gly Gly Thr Ala Gly Ala Thr Thr Cys Thr Ala Ala Gly Ala
1 5 10 15
Ala Ala Gly Thr Ala Thr Thr Gly Thr Cys Ala Gly Thr Ala Ala Cys
20 25 30
Gly Gly Cys Ala Gly Gly Cys Thr Thr Cys Gly Thr Thr Gly Gly Thr
35 40 45
Gly Cys Thr Gly Cys Cys Gly Gly Thr Cys Thr Gly Gly Cys Gly Gly
50 55 60
Cys Thr Thr Thr Ala Gly Cys Ala Ala Cys Cys Gly Gly Ala Gly Cys
65 70 75 80
Cys Ala Ala Thr Ala Cys Cys Gly Thr Thr Thr Cys Thr Gly Cys Ala
85 90 95
Thr Cys Gly Ala Cys Ala Gly Gly Gly Ala Cys Gly Gly Thr Cys Ala
100 105 110
Gly Thr Thr Ala Cys Ala Ala Ala Thr Cys Cys Gly Gly Thr Gly Cys
115 120 125
Gly Ala Cys Cys Ala Cys Cys Gly Thr Ala Thr Gly Gly Ala Ala Thr
130 135 140
Ala Gly Thr Cys Cys Ala Thr Cys Ala Thr Gly Gly Cys Ala Cys Cys
145 150 155 160
Ala Ala Gly Thr Cys Ala Ala Ala Cys Gly Cys Thr Ala Cys Gly Thr
165 170 175
Gly Ala Cys Thr Thr Thr Thr Gly Gly Gly Gly Ala Cys Ala Cys Gly
180 185 190
Gly Thr Gly Cys Ala Gly Cys Thr Ala Thr Thr Gly Gly Gly Thr Ala
195 200 205
Ala Ala Ala Cys Cys Gly Thr Thr Gly Ala Cys Cys Ala Ala Ala Ala
210 215 220
Thr Gly Gly Thr Gly Cys Thr Ala Cys Thr Thr Gly Gly Thr Ala Thr
225 230 235 240
Ala Ala Ala Gly Thr Thr Gly Gly Cys Gly Ala Cys Ala Ala Thr Cys
245 250 255
Ala Gly Thr Gly Gly Ala Thr Thr Cys Cys Gly Gly Ala Ala Thr Thr
260 265 270
Gly Thr Ala Thr Thr Thr Gly Ala Ala Thr Gly Thr Thr Gly Cys Gly
275 280 285
Gly Gly Thr Ala Ala Ala Ala Cys Thr Gly Cys Cys Ala Cys Gly Gly
290 295 300
Thr Thr Gly Ala Ala Ala Cys Ala Cys Cys Gly Ala Gly Thr Thr Cys
305 310 315 320
Gly Gly Cys Ala Gly Cys Ala Ala Gly Thr Cys Ala Ala Ala Cys Thr
325 330 335
Gly Cys Thr Gly Thr Cys Ala Gly Cys Cys Ala Ala Gly Cys Ala Cys
340 345 350
Cys Gly Gly Cys Thr Ala Gly Thr Cys Ala Gly Gly Cys Gly Cys Cys
355 360 365
Thr Ala Cys Ala Ala Gly Cys Cys Ala Ala Gly Cys Ala Cys Cys Ala
370 375 380
Gly Cys Ala Ala Cys Cys Cys Ala Ala Ala Cys Ala Cys Cys Thr Gly
385 390 395 400
Cys Ala Gly Cys Ala Cys Cys Ala Cys Ala Ala Ala Cys Cys Gly Ala
405 410 415
Thr Ala Cys Cys Cys Ala Ala Ala Cys Ala Gly Cys Thr Ala Ala Thr
420 425 430
Ala Cys Ala Cys Ala Gly Cys Thr Thr Thr Ala Thr Gly Thr Cys Ala
435 440 445
Ala Gly Ala Ala Thr Ala Thr Cys Gly Gly Thr Thr Cys Ala Gly Cys
450 455 460
Ala Gly Thr Thr Ala Cys Cys Gly Thr Ala Thr Gly Gly Ala Cys Ala
465 470 475 480
Ala Cys Cys Cys Cys Gly Gly Cys Gly Thr Ala Thr Ala Cys Thr Cys
485 490 495
Ala Thr Gly Cys Gly Ala Cys Ala Gly Gly Thr Cys Ala Ala Thr Ala
500 505 510
Thr Cys Thr Ala Gly Ala Ala Gly Gly Cys Ala Gly Cys Cys Ala Gly
515 520 525
Ala Cys Ala Cys Thr Gly Ala Cys Gly Gly Cys Thr Gly Thr Thr Gly
530 535 540
Cys Cys Cys Ala Gly Cys Ala Gly Cys Ala Ala Gly Cys Ala Ala Ala
545 550 555 560
Thr Gly Gly Thr Gly Ala Ala Ala Cys Ala Thr Gly Gly Thr Ala Thr
565 570 575
Cys Gly Gly Cys Thr Thr Gly Cys Cys Ala Ala Cys Gly Gly Cys Gly
580 585 590
Gly Thr Thr Ala Thr Gly Thr Thr Cys Cys Thr Gly Cys Ala Cys Gly
595 600 605
Gly Thr Thr Thr Gly Thr Thr Ala Gly Cys Ala Cys Ala Ala Cys Ala
610 615 620
Cys Cys Ala Gly Thr Gly Gly Cys Thr Gly Thr Ala Ala Cys Ala Cys
625 630 635 640
Cys Ala Cys Ala Ala Cys Cys Thr Gly Cys Ala
645 650
- 双功能肽聚糖/几丁质水解酶的抗致病活性
- 基于拮抗酵母细胞壁几丁质诱抗活性的果实病害控制方法
