一种丝蛋白微针及其制备方法
文献发布时间:2023-06-19 18:32:25
技术领域
本发明属于医疗、医美或药物制剂技术领域,具体涉及一种丝蛋白微针及其制备方法。
背景技术
微针作为一种新型的物理促透技术,是由多个尺寸在微米级的细小针尖点阵以阵列的方式连接在基座上组成,在使用时能定向刺穿渗透性极差的皮肤表层(角质层),产生生物大分子得以通过的微米尺寸机械通道,将药物直接置于表皮或上部真皮层,不同透过角质层即可参与微循环。微针作为一种新型的经皮药物递送系统,具有可自主给药、透皮吸收速率稳定、疼痛感低和使用便捷的优点,是皮下注射的理想替代品。
因此微针作为一种新型的给药体系广受关注。如何制造好微针至关重要,包括微针材料的选择、微针结构的设计、微针给药效率以及微针在加工及使用过程中的便捷性都是需要考量的。
在微针制备材料的选择时,传统的制造过程中往往选用金属、玻璃、硅质等高强度材料,以达到良好的刺入效果,改善皮肤通透性。但基于金属的微针系统往往限制其功能的发挥,例如,如果应用不当,存在破裂的风险而如果细小金属结构残留在皮肤内,则存在炎性响应或感染的可能。同时这类微针装载药物的涂覆方法一般只将药物涂覆于微针表面仅提供了小的体积来包容治疗物质,其载药量较小,药物控制性差。尽管这类材料能通过电镀、光刻蚀、微通道浇注技术等方式是制备成空心载药结构,但成本较高,且所用材料对皮肤亲和性不好,仍存在一定的改善空间。所以选择对皮肤亲和性的微针材料将会是首先要解决的问题。有研究人员用生物相容性好且可溶解的物质聚乙烯吡咯烷酮(PVP)和碳水化合物制造出了大容量负载型微针,可给予相对较大的药物剂量。但其聚合物在室温下靠紫外光固化的过程可影响载入药物的活性。同时,此类微针系统给药时会迅速溶解,容易产生瞬间的爆发递送现象,从而药物释放动力学难以可控。因此,对于具有生物相容性的、力学性能俱佳的且有效可控的药物递送微针以及制造此类微针的改进方法仍存在着强烈需求。
近年来,丝蛋白(即桑蚕丝脱去丝胶后剩余的部分,又称丝素蛋白,SILK FIBROIN)因其具有良好的生物相容性和生物降解性能被公认为合适的生物医学材料。多种临床实验表明,丝蛋白在组织修复,延缓衰老,皮肤美白等方面都具有良好的效果。因此适用于人工皮肤、组织工程支架、人工眼角膜等人工替代产品的制造。再生后的丝蛋白固体材料,还具有较好的机械性能,能够满足微针使用的强度需求。同时丝蛋白的亲水性使其与水溶性药物亲和性良好,利于水溶性药物稳定包埋于丝蛋白内部。因此,相比其他生物亲和材料而言,丝蛋白在微针制造领域具有更加广阔的前景。
目前,几乎都是通过在微针成型前将药物和丝蛋白水溶液以共混的方式来制备聚合物微针,显著提高了微针载药率,拓宽了微针技术应用领域。中国发明专利CN103800998B公开了一种丝蛋白凝胶微针系统及其制备方法,以聚二甲基硅氧烷制备针孔模具阵列,将经处理后的丝蛋白溶液浇注在模具内,经过20-60小时烘干才能够脱模后得到丝蛋白凝胶微针系统。一是由于他们使用的透析脱盐的方法制备的丝蛋白溶液,制备的蛋白溶液浓度较低,导致干燥时间长;另一方面,丝蛋白溶液剪切敏感,在生产过程中容易产生絮状沉淀,影响产品均一性;而且注入磨具的过程中会产生气泡,需要用真空设备脱除气泡,所以这种微针制备工艺繁琐耗时长、效率低、工艺稳定性不好。因此,通过改进其制备方法来解决上述缺点的优化工艺仍然十分迫切需要。
同时,由于聚合物微针内聚合物大分子排列的致密结构,不利于微针内部包裹的模型药物快速经皮释放,因而很大程度上限制了微针的应用。中国发明专利CN10258032A公开了一种丝蛋白微针系统及丝纳米颗粒的制备方法,可以达到药物释放目的。但是此法本质上还是利用模型药物与丝蛋白共混的方法,药物加载量过多会导致微针结构缺陷,强度过低,并且药物释放后被局部组织吸收,难以实现定向输送和缓释的作用。中国发明专利CN103260693A公开了另一种基于丝蛋白微针及其制备方法,通过措施控制丝蛋白β-sheet结构的含量,从而使微针不溶干水,进一步控制药物释放的速率。但其制备过程可能会使药物的活性降低,同时β-sheet的丝蛋白结构稳定,分子排列紧密,造成药物释放缓慢,不利于某些需要快速见效以及较大血药浓度症状的治疗。中国发明专利CN106362223A发明了一种多孔丝蛋白微针给药装置,利用丝蛋白做基底和给药体材质,多孔结构进行给药。利用给药体和微针复合,然后用酸性溶液除去水不溶性碳酸盐以形成多孔,便于药物释放。虽提高了给药效率,但是在其处理过程中可能导到药物活性降低,同时若无机盐阳离子处理不干净,有可能造成对人体的伤害。
简言之,看似简单的微针透皮给药系统仍面临着一系列技术瓶颈。用于透皮给药的微针须采用微加工技术制备,价格昂贵、工艺复杂,不适合工业化生产,而且以金属和硅材料制备的微针在皮肤上保留较长的时间可能会导致皮肤刺激,微针断裂残留的碎块残留在皮肤内,则可能造成无机颗粒的积淀。为了改善上述问题,以聚合物、多糖为材料的实心微针相继问世,但仍存三个问题:①针刺后需涂抹药物的给药方式比较繁琐,②脂溶性聚合物与蛋白不兼容的问题,③只能在针头上载药限制其给药量等问题。而理想的微针点阵透皮贴膜应具备对皮肤和蛋白均生物兼容、保持持续的扩散通道、允许较大剂量给药、可根据需要进行可控缓释等性能,且制备方法简便经济绿色可放大。为此,发明一种对人体无毒无害、简单易得、经济绿色、且易于产业化放大生产的微针制备工艺和制备一种便于使用,可控缓释给药,确保给药效率的新型多孔结构微针迫在眉睫。
发明内容
本发明要解决的问题是针对现有技术在丝蛋白微针制备工艺中存在的多种不足,提供一种对人体无毒无害、简单易得、经济绿色、且易于产业化放大生产的微针制备工艺和一种便于使用,可控缓释给药,确保给药效率的新型多孔结构微针的制备方式。
本发明提供了一种由压制法结合纳米微球载药技术制备一体化成型多孔结构丝蛋白微针的方法。
本发明提供了一种丝蛋白微针制备方法,包括以下步骤:
S1:丝蛋白溶液的制备:桑蚕丝经过脱胶、溶解、纯化步骤制备得到丝蛋白水溶液;
S2:丝蛋白载药微球的制备:具体包括:取步骤S1中的溶液,加入无水乙醇混合均匀,并进行冷冻和浓缩,制备得到浓度较高的分散在水溶液中的丝蛋白载药微球;
S3:丝蛋白载药微球母粒和丝蛋白母粒的制备:a)取步骤S1制备的丝蛋白水溶液与步骤S2中制备的丝蛋白载药微球混合均匀,将混合溶液通过喷雾干燥制备得到丝蛋白载药微球母粒;b)将步骤S1中得到的丝蛋白水溶液溶过喷雾干燥制备得到丝蛋白母粒;
S4:丝蛋白载药微球母粒的打发:将步骤S3中制备的所述丝蛋白载药微球母粒在机械搅拌下加入去离子水打发,得到丝蛋白载药微球糊状物;
S5:微针阵列模具的制备:用高精度3D打印机打印树脂材料,得到微针阵列模具;
S6:丝蛋白微针的制备:先将步骤S4中制备的丝蛋白载药微球糊状物涂覆在模具里,干燥1-10分钟,然后将步骤S3中制备的丝蛋白母粒和柔性材料分层铺在模具里,总体压制处理成型,得到功能性多孔结构的丝蛋白微针。
优选的,所述步骤S1中的制备丝蛋白水溶液的方法为:a)脱胶:将桑蚕蚕丝放入碳酸钠、碳酸氢钠的水溶液或者碳酸钠和碳酸氢钠的混合溶液中,加热煮沸,取出后用纯化水清洗,脱去丝胶蛋白,留下丝蛋白,将丝蛋白烘干,获得干燥后的丝蛋白,备用;b)溶解:将上述干燥后的丝蛋白以溶于溴化锂水溶液中,获得含丝蛋白和少量不溶性颗粒组成的混合液;c)纯化:将混合液加入纯净水稀释后,通入超滤系统脱盐,将最终溶液的丝蛋白浓度浓缩至5-40wt%。
优选的,所述步骤S2中丝蛋白载药微球的具体制备方法为:向步骤S1制备的丝蛋白溶液中加入无水乙醇混合均匀,丝蛋白溶液与乙醇的体积比为10:1至3:1,混合后溶液中丝蛋白的固含量为1-10wt%;然后将混合溶液置于-20至-40℃环境中放置12-48小时后解冻;解冻后将丝蛋白载药微球溶液浓缩至固含量为10-50wt%。
进一步的,所述步骤S2中,丝蛋白载药微球的直径为30-800nm。
进一步的,所述步骤S2中的丝蛋白载药微球用于包埋不同药物,丝蛋白载药微球释放进体内后,可以持续缓释药物。
进一步的,所述步骤S2中的丝蛋白载药微球所包埋的药物选自下列试剂:蛋白质、免疫原、酶、核酸、小分子、细胞、激素、治疗剂、诊断剂,以及上述试剂的任意组合。
进一步的,所述步骤S2中的丝蛋白载药微球,其表面能够修饰不同的靶向基团,在进入体内后定向作用于靶向组织和器官;所修饰的靶向基团为与肿瘤细胞有特异性结合的靶向分子,包括多肽、单糖、多糖、叶酸、抗体和抗体片段,可促进纳米药物在肿瘤组织处的滞留,增强纳米药物的内吞效率和肿瘤细胞内的富集。
优选的,所述步骤S3中丝蛋白载药微球母粒制备的具体方法为:在步骤S1中制备的丝蛋白水溶液中加入步骤S2中制备的丝蛋白载药微球,充分搅拌混合均匀后通入喷雾干燥系统中进行喷雾干燥,喷雾干燥成粉状状态,此时系统中的粉末粒径较小;同时向喷雾干燥系统中喷入粉末粘结剂,使得较小的粉末在飞舞的过程中逐渐结合成较大颗粒。
优选的,所述步骤S3中丝蛋白母粒制备的具体方法为:将步骤S1制备的丝蛋白溶液通入喷雾干燥系统中进行喷雾干燥,喷雾干燥成粉状状态,此时系统中的粉末粒径较小;同时向喷雾干燥系统中喷入粉末粘结剂,使得较小的粉末在飞舞的过程中逐渐结合成较大颗粒。
进一步的,所述步骤S3中,所述粉末粘结剂包括去离子水或再生丝蛋白溶液,当选择再生丝蛋白溶液作为粉末粘结剂时,其浓度为1-10wt%。
进一步的,在所述步骤S3中的丝蛋白母粒的制备中,喷雾干燥过程的给料速度为10-500mL/min,喷雾干燥进风温度为90-150℃,喷头压力为0.1-1MPa;优选的,给料速度为50-200mL/min,喷雾干燥进风温度为100-130℃,喷头压力为0.2-0.7MPa。
进一步的,所述步骤S3中制备得到的丝蛋白载药微球母粒和丝蛋白母粒的粒径为10-100μm,更优选为10-50μm。
优选的,在所述步骤S4中,打发操作中的搅拌速率与糊状物的黏度匹配,否则无法使材料均匀,搅拌装置打发的转速为100rpm-2000rpm,优选200rpm-1200rpm;对于丝蛋白粉末质量分数为40%的糊状物,优选转速为300rpm-500rpm;对于丝蛋白粉末质量分数为30%的糊状物,优选转速为500rpm-700rpm;对于丝蛋白粉末质量分数为20%的糊状物,优选转速为700rpm-1200rpm。
优选的,所述步骤S5微针阵列模具的制备方法为:a)首先利用CAD软件设计模具的CAD模型;b)对CAD模型进行切片离散和扫描路径规划;c)然后将处理好的三维数据模型导入3D打印设备中;d)计算机逐层调入切片信息,通过多个打印头将光敏树脂材料喷出来,在材料喷出来同时紫外光完成固化;模具的加工通过一层一层完成,直到模具加工完全。
进一步的,所述步骤S5微针阵列模具的制备选用高精度3D打印机,打印原料选用光敏树脂,3D打印加工具有可设计度高、一次成型,可节省大量时间等特点。
进一步的,所述步骤S5微针阵列模具的制备材料可选用多种光敏树脂材料,包括丙烯酸酯化环氧树脂、不饱和聚酯、聚氨酯、多硫醇或多烯光固化树脂体等。
优选的,所述步骤S6中的丝蛋白微针成型的方法为:将步骤S4制备的打发后的丝蛋白载药微球糊状物涂覆在模具里,干燥1-10分钟,然后将步骤S3中制备的丝蛋白母粒和柔性材料分层铺在模具里,将油压机加压至20-400MPa并在此压力下持续5分钟;将模具从油压机中取出后脱模,即可制备得到具有功能性微针阵列结构的丝蛋白膜。优选的,所述步骤S6中的柔性材料,需具有足够的柔性,以便在接触组织或器官表面时适合所述表面,并允许所述微针穿透组织或器官至期望的深度。
可选择的,将步骤S6中的柔性材料替换为刚性材料,应用在施加微针的接触面为平面的应用场景中。
本发明的有益效果:
1.丝蛋白微针的制造方法。丝蛋白压制法是一种快速成型的制造工艺,通过将丝蛋白溶液干燥制粒,再经过压力作用下压制成型,可得到一种强度较好,形态稳定的丝蛋白基底材料。
2.在制备丝蛋白微针时,采用3D打印的高精度材料作为压制成型模具,通过压制工艺制备的丝蛋白微针阵列,干燥后其结构具有稳定,均一的优良性质。通过这种工艺可以实现丝蛋白微针的快速制备,在工业化批量生产过程中具有重大的意义。
3.采用丝蛋白载药微球母粒打发的工艺,便能得到一种多孔状结构的微针,大大提高了药物释放速率。
4.纳米微球技术在体内药物输送过程中表现出优异的性能。在制作微针时,可以先将药物包埋于微球中,再与丝蛋白共混制备出载药的丝蛋白微针,可以实现对药物释放动力学精准可控,并且可在微球表面修饰后可以精准靶向到作用位点,实现药物的定向输送。
5.丝蛋白微针在制备完成后,在面向用户前还需要进行包装处理。而对于压制法制备的丝蛋白微针,具有基底一体化成型的优点。在成型过程中,可在基底面添加丝蛋白粉末或柔性聚合材料等功能材料,便于在使用时承担固定,保护的作用。在压制处理成型时,只需在基底上修饰生物相容性的柔性材料,便可制备出一体化的丝蛋白微针,并可直接使用。
6.将丝蛋白造粒然后进行压制处理的方式,可以明显提高丝蛋白固化效率。如果用丝蛋白溶液浇注模具的方式,烘干时间在24小时以上,本发明采用的压制法在几分钟内就可以成型,大大提高了制备效率,可大规模生产。
附图说明
图1为本发明制备丝蛋白微针的工艺示意图;
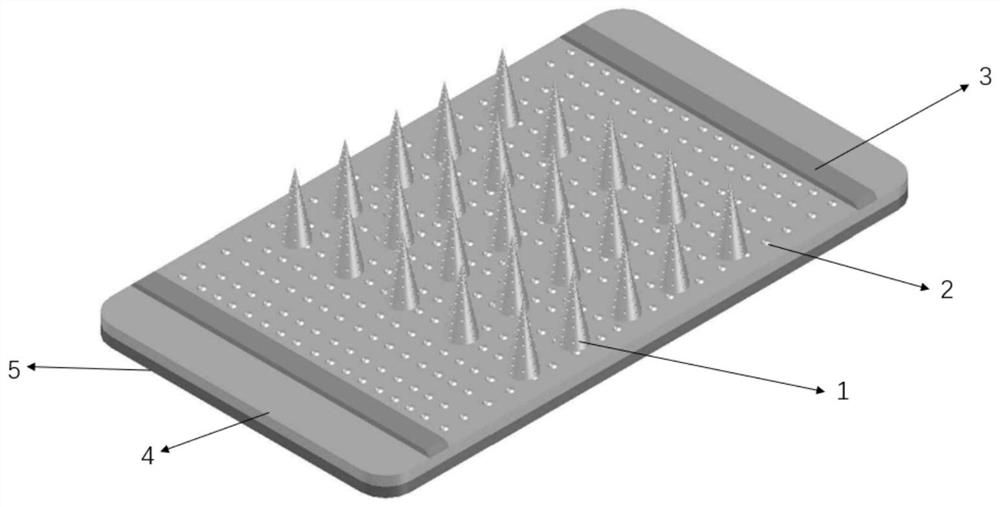
图2为本发明制备的丝蛋白微针的示意图;
图3为本发明制备的丝蛋白微针的实物图和针尖的扫描电镜图;
图4为本发明制备的丝蛋白载药微球的扫描电镜图;
图5为本发明实施例1制备的丝蛋白微针的药物缓释图;
图6为本发明实施例1制备的丝蛋白微针的断面扫描电镜图;
图7为本发明实施例2制备的丝蛋白载药微球上接枝叶酸前后的红外图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,实施例仅用于说明本发明而不用于限制本发明的保护范围。此外,应理解,在阅读了本发明所公开的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本发明所限定的保护范围之内。
实施例1
本实施例提出了一种可一体化快速成型的精准缓释微针的制备方法,包括以下步骤:
S1:丝蛋白溶液的制备:将桑蚕蚕丝经过脱胶、溶解、纯化得到丝蛋白水溶液,该水溶液浓度为10%。
S2:丝蛋白载药微球的制备:将注射用盐酸博来霉素溶液加入步骤S1制备的丝蛋白溶液中,搅拌均匀,盐酸博来霉素占丝蛋白固含量的1-20%;然后加入无水乙醇混合均匀,丝蛋白溶液与乙醇的体积比为4:1,混合后溶液中丝蛋白的固含量为5wt%;将混合溶液置于-20℃环境中放置24小时后,解冻;解冻后将丝蛋白载药微球溶液浓缩至固含量为30wt%,制备的丝蛋白载药微球直径为100nm。
S3:丝蛋白载药微球母粒和丝蛋白母粒的制备:将步骤S1和S2中制备的溶液混合,搅拌均匀,然后用制粒机进行喷雾干燥制粒,得到丝蛋白载药微球母粒;单独取S1中的丝蛋白溶液搅拌均匀,然后用制粒机进行喷雾干燥制粒,得到丝蛋白母粒;在上述两个喷雾干燥制粒过程中,进料速率为75ml/min,进风温度为110℃,制备的粉末粒径为10-100μm。被雾化的液滴在进口温度下被瞬间干燥为粉末,此过程热作用时间短,对于物料的功能性质影响小。同时,向喷雾干燥系统中喷入雾化水作为粉末粘结剂,使得较小的粉末在飞舞的过程中逐渐结合成较大颗粒。制备的母粒直径为10-50μm。将产品含水率按干燥法测定(GB/T5009.3-2003),最终产品含水率为21%。
S4:丝蛋白载药微球母粒打发:向步骤S3中制备的丝蛋白载药微球母粒中加入去离子水,母粒与水的质量之比为1:2,机械搅拌打发,搅拌装置打发的转速为800rpm,得到丝蛋白载药微球糊状物;
S5:微针阵列模具的制备:模具材料选择丙烯酸酯化环氧树脂,在型号为ProJet3500HDMax的3D打印机打印成型微针阵列模具,其操作步骤为:
a)首先利用CAD软件设计模具的CAD模型;
b)对CAD模型进行切片离散和扫描路径规划;
c)然后将处理好的三维数据模型导入3D打印设备中;
d)计算机逐层调入切片信息,通过多个打印头将光敏树脂材料喷出来,在材料喷出来同时紫外光完成固化;模具的加工通过一层一层完成,直到模具加工完全。加工完成的模具上均匀分布有10*10的微针型腔阵列,型腔的深度为350微米。
S6:丝蛋白微针的压制成型:如图1所示,取一定质量步骤S4中制备的丝蛋白载药微球糊状物涂覆于模具中,再取一定量的丝蛋白母粒和柔性聚氨酯材料分层置于模具中,然后将模具放入油压机的两个压板之间。将油压机加压至50MPa并在此压力下持续5分钟。将模具从油压机中取出后脱模,即制备得到功能性多孔结构的丝蛋白微针。如图2所示。
图2所示的微针(1)从端部到根部可选择性地制备为多孔结构,通过调节步骤S6中涂覆于模具内的丝蛋白载药微球糊状物的量来调节多孔的结构的比例。所述微针的基底与皮肤接触的内层(2)可选择地使用多孔材料,从而保持透气性;所述微针的基底的外层(5)可根据应用场景选择柔性或刚性材料。所述微针(1)的基底的内层还设有胶粘带(3),所述胶粘带(3)表面设有粘性材料,便于微针和皮肤的贴合。
图3示出了所制备的丝蛋白微针的实物图和针尖的扫描电镜图,可以看出微针具有多孔结构。
图4为上述步骤S2制备的丝蛋白载药微球的扫描电镜图,可以看出丝蛋白载药微球尺寸均一,分散性良好。
图5为实施例1制备的丝蛋白微针的药物缓释图。将步骤S6制备的负载了盐酸博来霉素的微针置于ph7.4磷酸缓冲溶液中进行体外缓释实验模拟,用紫外分光光度计在294nm处测定药物含量。从图5中可以看出,载药微针表现出一定的缓释行为。并且在pH为5的磷酸缓冲溶液中的缓释量明显大于Ph为7的缓冲液,也对应于癌症部位呈现弱酸性环境。
实施例2
本实施例提出了一种具有靶向和药物缓释功能的微针制备方法,包括以下步骤:
S1:丝蛋白溶液的制备:将桑蚕蚕丝经过脱胶、溶解、纯化得到丝蛋白水溶液,该水溶液浓度为10%。
S2:丝蛋白载药微球的制备:将注射用盐酸博来霉素溶液加入步骤S1制备的丝蛋白溶液中,搅拌均匀,盐酸博来霉素占丝蛋白固含量的1-20%;然后加入无水乙醇混合均匀,丝蛋白溶液与乙醇的体积比为4:1,混合后溶液中丝蛋白的固含量为5wt%;将混合溶液置于-20℃环境中放置24小时后,解冻;解冻后将丝蛋白载药微球溶液浓缩至固含量为30wt%,制备的丝蛋白载药微球直径为100nm。
将叶酸分子接枝到丝蛋白载药微球上:叶酸在药物载体的靶向治疗方面的意义重大,为验证叶酸成功接枝,对叶酸(FA)、丝蛋白载药微球(RSFS-BLE)、丝蛋白靶向载药微球(FA-RSFS-BLE)进行傅里叶红外光谱表征,结果如图7所示:载药丝素颗粒接枝叶酸基团后,在1628cm
S3:丝蛋白载药微球母粒和丝蛋白母粒的制备:制备方法同实施例1的步骤S3。
S4:丝蛋白载药微球母粒的打发:向步骤S3中制备的丝蛋白载药微球母粒中加入去离子水,母粒与水的质量之比为1:2,机械搅拌打发,搅拌装置打发的转速为800rpm,得到丝蛋白载药微球糊状物;
S5:微针阵列模具的制备:模具材料选择丙烯酸酯化环氧树脂,在型号为ProJet3500HDMax的3D打印机打印成型微针阵列模具,其操作步骤同实施例1的步骤S5。
S6:丝蛋白微针的压制成型:取一定质量步骤S4中制备的丝蛋白载药微球糊状物涂覆于模具中,再取一定量的丝蛋白母粒和柔性材料分层置于模具中,然后将模具放入油压机的两个压板之间。将油压机加压至50MPa并在此压力下持续5分钟。将模具从油压机中取出后脱模,即制备得到功能性多孔结构的丝蛋白微针。
实施例3
本实施例提出了一种压制在丝绸布表面的微针制备方法,包括以下步骤:
S1:丝蛋白溶液的制备:将桑蚕蚕丝经过脱胶、溶解、纯化得到丝蛋白水溶液,该水溶液浓度为10%。
S2:丝蛋白载药微球的制备:将胰岛素加入步骤S1制备的丝蛋白溶液中,搅拌均匀,胰岛素占丝蛋白固含量的1-20%;然后加入无水乙醇混合均匀,丝蛋白溶液与乙醇的体积比为4:1,混合后溶液中丝蛋白的固含量为5wt%;将混合溶液置于-20℃环境中放置24小时后,解冻;解冻后将丝蛋白载药微球溶液浓缩至固含量为30wt%,制备的丝蛋白载药微球直径为100nm。
S3:丝蛋白载药微球母粒和丝蛋白母粒的制备:制备方法同实施例1的步骤S3。
S4:丝蛋白载药微球母粒打发:向步骤S3中制备的丝蛋白载药微球母粒中加入去离子水,母粒与水的质量之比为1:2,机械搅拌打发,搅拌装置打发的转速为800rpm,得到丝蛋白载药微球糊状物;
S5:微针阵列模具的制备:模具材料选择丙烯酸酯化环氧树脂,在型号为ProJet3500HDMax的3D打印机打印成型微针阵列模具,其操作步骤同实施例1的步骤S5。
S6:丝蛋白微针的压制成型:取一定质量步骤S4中制备的丝蛋白载药微球糊状物涂覆于模具中,再取一定量的丝蛋白母粒和丝绸布分层置于模具中,然后将模具放入油压机的两个压板之间。将油压机加压至50MPa并在此压力下持续5分钟。将模具从油压机中取出后脱模,即制备一种压制在丝绸布表面的功能性多孔结构的丝蛋白微针。
图6所示,上述制备微针的基底断面图,可以看出丝绸布和丝蛋白母粒结合的很牢固。
针对平面的微针应用场景,例如平展的皮肤表面,作为另一种实施方式,可以将本实施例中的丝绸布替换为刚性材料,具体制备方法与本实施例子中的方法基本相同,区别仅在于:在步骤S6中,先取一定质量步骤S4中制备的丝蛋白载药微球糊状物涂覆于模具中,再取一定量的丝蛋白母粒和刚性材料分层置于模具中,然后经过同样的压制方式,得到一种压制在刚性材料表面的功能性多孔结构的丝蛋白微针。
实施例4
本实施例提出了一种具有抗菌性的微针制备方法,包括以下步骤:
S1:丝蛋白溶液的制备:将桑蚕蚕丝经过脱胶、溶解、纯化得到丝蛋白水溶液,该水溶液浓度为10%。
S2:丝蛋白载药微球的制备:将胰岛素加入步骤S1制备的丝蛋白溶液中,搅拌均匀,胰岛素占丝蛋白固含量的1-20%;然后加入无水乙醇混合均匀,丝蛋白溶液与乙醇的体积比为4:1,混合后溶液中丝蛋白的固含量为5wt%;将混合溶液置于-20℃环境中放置24小时后,解冻;解冻后将丝蛋白载药微球溶液浓缩至固含量为30wt%,制备的丝蛋白载药微球直径为100nm。
S3:丝蛋白母粒制备:制备方法同实施例1的步骤S3。
S4:丝蛋白载药微球母粒打发:向步骤S3中制备的丝蛋白母粒-1中加入去离子水,母粒与水的质量之比为1:2,机械搅拌打发,搅拌装置打发的转速为800rpm,得到丝蛋白糊状物;
S5:微针阵列模具的制备:模具材料选择丙烯酸酯化环氧树脂,在型号为HD3500Max的3D打印机打印成型微针阵列模具,其操作步骤同实施例1S5。
S6:丝蛋白微针的压制成型:取一定质量步骤S4中制备的模压料涂覆于模具中,再取一定量的母粒-2和纳米银膜分层置于模具中,然后将模具放入油压机的两个压板之间。将油压机加压至50MPa并在此压力下持续5min。将模具从油压机中取出后脱模,即制备一种具有抗菌性的多孔结构的丝蛋白微针。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种双修饰微针电极及其制备方法和血糖微针电化学传感器电极
- 一种大腹园蛛梨状腺丝蛋白的基因及其制备方法
- 一种蛋白多肽类药物双重微球及其制备方法和胰岛素双重微球
- 一种治疗类风湿性关节炎的微针透皮给药贴片及其制备方法
- 一种海绵微针调和精华液及其制备方法
- 一种快速分离生长激素的丝蛋白缓释微针的制备方法
- 重组蛋白类药物可溶性微针配方及应用、微针及制备方法
