一种检测TGF-β1的试剂盒、检测方法及应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及体外诊断技术领域,具体而言,涉及一种检测TGF-β1的试剂盒、检测方法及应用。
背景技术
转化生长因子是一类由多种细胞分泌的具有多重生物学效应的多肽类细胞因子,转化生长因子-β1(transforming growth factorβ1,TGF-β1)属于TGF-β超家族,TGF-β1分子量为25KD,同时含量最高,具有代表性:它是由分子量为12.5KD的两个单体分子通过二硫键连接成的二聚体,可调节细胞的增殖、分化;还在血管生成、损伤修复、免疫抑制、细胞外基质形成、纤维化和肿瘤的发生起重要作用。
目前临床检测人体TGF-β1的含量,在诊断癌症病人中起着关键和双重的作用。在肿瘤早期发展阶段,TGF-β1引发的是抑制行为,体现在TGF-β1信号通路的核心部件的缺失和突变,同时支持肿瘤的生长、传播和免疫,表现为TGF-β1受体改变及癌基因突变。人卵巢颗粒细胞、卵泡膜细胞以及各阶段的卵母细胞都能合成并分泌TGF-β1,而且这些细胞表面均高表达TGF-β1受体,调节卵泡发育成熟及排卵。
据相关资料报道,胃癌中TGF-β1的阳性率约为65%,TGF-β1的高表达与癌症的发生、发展及转移过程中起到重要作用,胃癌细胞分化程度变低,临床分期的进展以及淋巴结转移的出现,TGF-β1的表达也越来越强,可作为反映胃癌生物学行为的指标。随着生物技术和药物的研究,可以通过阻止TGF-β1及其受体的表达,研究新的抗肿瘤药物,有望成为新的胃癌的治疗方法。
TGF-β1是参与血管重构发病机制的主要调节因子,也参与严重哮喘患者肺纤维化的发展及哮喘气道重塑,促进成纤维细胞向肌成纤维细胞分化,可能导致上皮下纤维化和哮喘气道平滑肌的增值。
目前市场上定量检测人体血样TGF-β1的试剂盒大多应用酶联免疫吸附法、胶乳比浊法和免疫荧光层析法,使用化学发光方法的较少。酶联免疫吸附法的缺点在于灵敏度不够高,检测时间长,线性范围不够宽。胶乳比浊法和免疫荧光层析法可以快速检测,但准确度偏低。微孔板酶促发光法虽然灵敏度高,检测时间短,准确度高,但是也容易受体内一些物质的干扰,试剂的稳定性相对偏低。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种检测TGF-β1的试剂盒及其使用方法和应用,以提高人血样本中TGF-β1的灵敏度和特异性。
本发明是这样实现的:
第一方面,本发明提供了一种检测TGF-β1的试剂盒,其包括:
第一试剂:包括有抗异硫氰酸荧光素抗体联结的磁微粒;
第二试剂:包括有异硫氰酸荧光素标记的TGF-β1抗体;以及
第三试剂:包括有吖啶类发光物标记的TGF-β1抗体。
第二方面,本发明提供了一种TGF-β1的检测方法,采用上述检测TGF-β1的试剂盒,其包括以下步骤:
取待测样本和校准品加入反应管中,然后依次加入第二试剂、第三试剂,孵育后加入第一试剂,再次孵育并清洗,然后加入预激发液A和激发液B,检测其发光值
第三方面,本发明提供了上述检测TGF-β1的试剂盒在检测TGF-β1含量中的应用。
本发明具有以下有益效果:
本发明使用FITC与抗-FITC系统,并具有磁分离和化学发光的双重优势,可以较好地避免内源性生物素在检测人体血样时的干扰,具有较高的检测灵敏度和特异性,线性范围较其它有明显的优势,检测通量大,成本低,在发光仪上可实现全自动操作。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
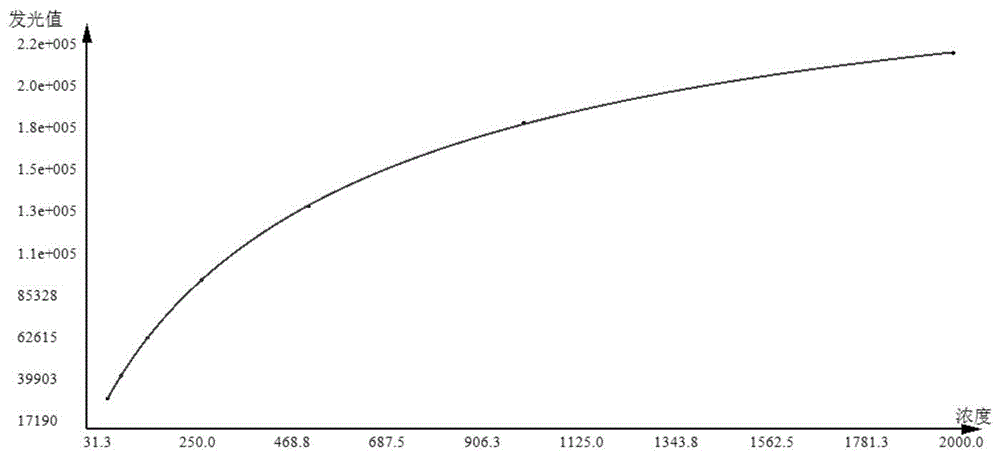
图1为实施例2的校准曲线图。
图2为对比例1的校准曲线图。
图3为实验例4中两种试剂的散点图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
为了提高人血样本中TGF-β1的灵敏度和特异性,本发明提出的TGF-β1的检测试剂盒,应用FITC与抗-FITC系统,将能够识别抗原上不同表位的TGF-β1单克隆抗体1和TGF-β1单克隆抗体2分别与FITC和吖啶酯联结,通过抗原抗体特异免疫反应后,在发光底物存在的条件下实现高灵敏度和特异性检测。
本发明提出的TGF-β1检测试剂盒,包括:第一试剂:包括有抗异硫氰酸荧光素抗体联结的磁微粒;第二试剂:包括有异硫氰酸荧光素标记的TGF-β1抗体;以及第三试剂:包括有吖啶类发光物标记的TGF-β1抗体。
在本发明中,第二试剂中的TGF-β1抗体和第三试剂中的TGF-β1抗体是能够识别抗原上不同表位的两种不同的TGF-β1抗体。上述抗体可以是单克隆抗体、多克隆抗体或抗体功能性片段,优选地,本发明中采用的TGF-β1抗体为TGF-β1单克隆抗体。
在一些实施例中,磁微粒的表面修饰有羧基、氨基和甲苯磺酰基中的其中一种基团。
在一些实施例中,磁微粒的直径为0.5-5μm。
在一些实施例中,第一试剂中还包括磁微粒稀释液。
在一些实施例中,磁微粒稀释液的成分包括:1.0-2.0wt%的牛血清,0.15mol/L的NaCl,0.20-0.80wt%的酪蛋白,0.40wt%的Proclin-300,0.10mol/L、pH7.6的磷酸盐缓冲液。
在一些实施例中,第一试剂的制备方法包括:将清洗后的磁微粒与抗FITC抗体混合,然后在混合溶液中加入EDC溶液,偶联反应后进行磁分离,弃上清,洗涤后再用磁微粒稀释液稀释至所需浓度,平衡后用超声将其完全分散。
在一些实施例中,磁微粒与抗FITC抗体的添加质量比为100-200:15。
在一些实施例中,磁微粒与抗FITC抗体偶联反应的时间为25-30min。
在一些实施例中,平衡的条件为:在2-8℃下平衡22-24h。
在一些实施例中,第一试剂中磁微粒的浓度为0.5-1.0mg/mL。
在一些实施例中,第二试剂的制备方法包括:将透析后的TGF-β1单克隆抗体加入FITC溶液中,混合均匀,在2-8℃下避光反应10-12h后,再加入5mmol/L的NH
在一些实施例中,TGF-β1单克隆抗体与FITC的添加质量比为1:50-100。
在一些实施例中,第二试剂中TGF-β1抗体的浓度为0.5-2mg/mL。
在一些实施例中,第二试剂中还包括抗体稀释液。
在一些实施例中,抗体稀释液的成分包括1.0-2.0wt%的BSA,0.4wt%的Proclin-300,100mmol/L的NaCl,3-10g/L的黄原胶,1mg/mL的阻断剂HBR,0.2g/L的EDTA,0.5wt%的蛋白保护剂,0.10mol/L、pH7.6的磷酸盐缓冲液。
在一些实施例中,第三试剂中还包括上述抗体稀释液;同时第三试剂中的吖啶类发光标记物包括吖啶酯和/或吖啶磺酰胺。
在一些实施例中,第三试剂的制备方法包括:在溶于二甲基亚砜的吖啶酯溶液和/或吖啶磺酰胺溶液中加入TGF-β1单克隆抗体溶液,避光反应后加入甘氨酸缓冲液,纯化后,再用抗体稀释液稀释至所需浓度,获得第三试剂。
在一些实施例中,TGF-β1单克隆抗体与吖啶酯和/或吖啶磺酰胺的添加质量比为10-50:1。
在一些实施例中,试剂盒还包括校准品、质控品、浓缩清洗液、预激发液A和激发液B;
在一些实施例中,校准品和/或质控品中包括TGF-β1和基质液。
在一些实施例中,基质液的成分包括2wt%的BSA,0.10mol/LNaCl,0.2wt%的Proclin-300,10g/L的甘氨酸,0.10mol/L、pH7.4的磷酸盐缓冲液。
在一些实施例中,浓缩清洗液的成分包括10mmol/L的二硫苏糖醇,2wt%的SDS,2wt%的Tween-20,62.5mmol/L、pH6.7的Tris缓冲液。
在一些实施例中,预激发液A的成分包括0.1mol/L盐酸和1.0wt%的过氧化脲,激发液B的成分包括1.6wt%的氢氧化钠和2.0wt%的八烷基三甲基氯化铵。
本发明还提供了一种TGF-β1的检测方法,采用上述检测TGF-β1的试剂盒,其包括以下步骤:
取待测样本和校准品加入反应管中,然后依次加入第二试剂、第三试剂,孵育后加入第一试剂,再次孵育并清洗,然后加入所述预激发液A和激发液B,检测其发光值。
本发明采用的上述检测方法是一种较新型的磁微粒化学发光法,具有磁分离和化学发光的双重优势,而且采用FITC与抗-FITC系统可以较好地避免内源性生物素在检测人血样时的干扰,具有较高的检测灵敏度和特异性,线性范围较其它有明显的优势。
本发明还提供了上述检测TGF-β1的试剂盒在检测TGF-β1含量中的应用,通过本发明的检测试剂盒,可以检测样本中TGF-β1含量,为相关疾病的诊断提供参考。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了一种检测TGF-β1的试剂盒,其包括:第一试剂、第二试剂和第三试剂、校准品、质控品、浓缩清洗液、预激发液A和激发液B,以上组分的制备方法如下:
1.第一试剂的制备
取磁微粒2mg,磁分离,弃上清,加0.5M的MES溶液清洗,重复三次,将清洗完的磁微粒与抗FITC的按照100:15的比例在0.5M的MES溶液中混合均匀,加入EDC溶液120μL,反应25-30分钟,磁分离,弃上清,然后用磁微粒保护液重悬后稀释至1mg/mL,2-8℃平衡22-24小时。再室温混旋3小时,进行超声分散,超声功率10%,超声时间10s。间隔时间10s,取样,用显微镜在40倍物镜下观察,确保磁微粒完全分散,然后保存于2~8℃,备用。
其中磁微粒保护液的成分包括:1wt%的牛血清,0.15mol/L的NaCl,0.20wt%的酪蛋白,0.40wt%的Proclin-300,0.10mol/L、pH7.6的磷酸盐缓冲液。
2.第二试剂的制备
取1mgTGF-β1单克隆抗体1,在0.05PBS缓冲液透析过夜,调整浓度为0.5mg/mL,将透析后的TGF-β1单克隆抗体1与FITC按照1:50比例混合均匀,避光,2~8℃反应12小时,然后加入5mmol/L的NH4Cl溶液,终止反应1.5小时,将反应物在PBS缓冲液中透析3次,然后用抗体稀释液稀释至所需浓度,于2~8℃避光保存备用。
其中,抗体稀释液的成分包括:1wt%的BSA,0.4wt%的Proclin-300,100mmol/L的Nacl,3g/L的黄原胶,1mg/mL的阻断剂HBR,0.2g/L的EDTA,0.5wt%的蛋白保护剂,0.10mol/L、pH7.6的磷酸盐缓冲液。
3.第三试剂的制备
取1mgTGF-β1单克隆抗体2溶于1mL的CB缓冲液中。另取20μg吖啶酯溶解于1mL二甲基亚砜中混合均匀,取混合后的吖啶酯-二甲基亚砜溶液溶解于2mg/mL的抗体溶液中,25℃恒温避光反应1小时后,加入1M甘氨酸缓冲液继续反应1小时,用超滤管进行纯化,收集标记好的抗体,用抗体稀释液稀释至所需工作浓度,保存于2~8℃备用。
4.校准品的制备
将已知浓度的TGF-β1纯品加入到基质液中配制成下列浓度的校准品:0pg/mL,31.25pg/mL,62.5pg/mL,125pg/mL,250pg/mL,500pg/mL,1000pg/mL,2000pg/mL。
其中,基质液的成分包括:2wt%的BSA,0.10mol/LNaCl,0.2wt%的Proclin-300,10g/L的甘氨酸,0.10mol/L、pH7.4的磷酸盐缓冲液。
5.质控品的制备
将已知浓度的TGF-β1纯品加入到基质液中配制成下列浓度的质控品:80pg/mL,300pg/mL,质控品基质液同校准品基质液。
6.发光液的制备
预激发液A含有0.1mol/L盐酸和1.0wt%的过氧化脲,激发液B含有1.6wt%的氢氧化钠和2.0wt%的八烷基三甲基氯化铵。
7.浓缩清洗液的制备
浓缩清洗液的成分为:10mmol/L的二硫苏糖醇,2wt%的SDS,2wt%的Tween-20,62.5mmol/L、pH6.7的Tris缓冲液;使用时用纯化水稀释10倍。
实施例2
本实施例提供了一种TGF-β1的检测方法,其包括以下步骤:
(1)吸取50μL待测样本和校准品加入反应管中,加入50μL第二试剂,再加入50μL第三试剂,在37℃的条件下温育60min;
(2)加入50μL第一试剂,在37℃的条件下温育30min,进行磁分离,然后用清洗液清洗3次;
(3)在反应管中加入100μL预激发液A,混匀后加入100μL激发液B,同时检测其发光值。
以校准品的浓度为横坐标,校准品测定的发光值为纵坐标,得到四参数拟合方程:
Y=(340212.9375+2288.0022)/(1+(X/894.1611)^-0.8375)-2288.0022;
相关系数r=0.9963,大于0.95,具体见表1和图1。
表1校准曲线数值表
对比例1
本对比例1与实施例1的区别在于,将吖啶酯标记TGF-β1单克隆抗体替换为碱性磷酸酶(ALP)标记TGF-β1单克隆抗体,其它组分相同。
ALP标记TGF-β1单克隆抗体的过程如下:将(N-马来酰亚胺甲基)环已烷-1羧酸琥珀酰亚胺酯(SMCC)用二甲基酰胺(DMF)溶解至6mg/mL,将8mg/mL的ALP溶液和SMCC溶液在室温下反应1h,活化ALP,将透析24h的TGF-β1单克隆抗体2与活化的ALP按1:1混合联接,反应12h,加入100mmol/L的马来酰亚胺中止反应,接着用100mmol/L的乙醇胺封闭未结合的ALP标记抗体,最后用8g/L的NaCl,0.10mol/L、PH7.8的磷酸盐缓冲液透析过夜,备用。
用对比例1的试剂按实施例2的检测方法,以校准品的浓度为横坐标,校准品测定的发光值为纵坐标做校准曲线数值表2和图2。
表2校准曲线数值表
实验例1
对实施例1提供的试剂盒进行灵敏度检测,检测方法为:
用零浓度校准品作为样本进行检测,重复测试20次,得出20次测量结果的相对发光强度(RLU),计算其平均值(M)和标准差(SD),得出M+2SD,根据零浓度校准品和相邻校准品之间的浓度-RLU进行两点回归拟合一次方程,将M+2SD的RLU值带入一次方程中,得出试剂盒的最低检测限为15.23pg/mL。
实验例2
对实施例1提供的试剂盒进行精密性检测,检测方法为:
用实施例1的试剂盒分别检测低、中、高值样本,样本各重复检测10次,结果见表2。
表2样本的精密度
由表2可知,本发明试剂盒在低、中、高值样本检测中的CV都小于8%,结果表明该试剂盒重复性良好。
实验例3
对实施例1提供的试剂盒进行准确度检测,检测方法为:
将已知浓度为5ng/mL的TGF-β1纯品加入到低值血样中,血清和血浆均已灭活,其中血浆用肝素锂抗凝剂,取100μLTGF-β1加入到900μL低值血清和血浆中,分别稀释3组,每组重复测定三次,结果见表3。
表3回收率实验
从表3可以得出,实施例1的试剂盒回收率在88%-106%之间,表明本发明的试剂盒不论是对血清还是血浆中的TGF-β1均有较好的回收率。
实验例4
转化生长因子-β1目前没有公认的国际参考品,现选用一种欧洲品牌的化学发光试剂盒进行临床验证,其中样本选用35例低浓度样本,20例中浓度样本,5例高浓度样本,进行临床验证,结果见表4和图3。
表4相关性实验结果单位(pg/mL)
/>
根据表4和图3的结果来看,两种试剂的相关性为R
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
