昆布产品HPLC特征图谱的构建方法及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于药物分析技术领域,具体涉及一种昆布产品HPLC特征图谱的构建方法及其应用。
背景技术
昆布为海带科植物海带Laminaria japonicaAresch.或翅藻科植物昆布Eckloniakurome Okam.的干燥叶状体,其性寒,味咸,具有消痰软坚散结、利水消肿的功效,用于治疗瘿瘤、瘰疬、睾丸肿痛、痰饮水肿。
作为一味应用历史悠久的药食两用中药,前人对昆布的化学组成、药理作用和临床应用开展了许多研究。2020年版中国药典一部收载的昆布质量标准中仅测定了碘和多糖的含量,不能实现对昆布产品整体质量进行准确描述和评价。李蓉首次建立的海带HPLC参考指纹图谱可用于海带药材的真伪鉴别(参见李蓉,唐旭利,张敏,李国强,王长云,管华诗.海洋药用生物系列HPLC化学指纹图谱研究Ⅰ.海带药材的HPLC化学指纹图谱[J].中国海洋大学学报(自然科学版),2009,39(S1):37-41.)。后黄华花利用UPLC指纹图谱结合化学模式识别技术对昆布进行质量评价(参见黄华花,张怡评,吕诗诗.昆布UPLC指纹图谱及化学模式识别研究[J].中药材,2020,43(07):1651-1655.)。现有方法有效分离的成分较少,构建的特征图谱的特征峰数量较少,不能全面监控昆布产品的质量。现有方法不能对昆布及其制剂中极性较大的成分进行特征图谱检测,如昆布标准汤剂是由昆布药材经炮制后按固定的制备工艺水煎煮而成的冻干粉,故标汤中大多为水提取出的极性较大的成分,无法用该特征图谱方法进行检测。
针对现有的检测昆布特征图谱方法只适用于检测海带饮片真伪,而海带标准汤剂是由昆布药材经炮制后按固定的制备工艺水煎煮而成的冻干粉,所含成分极性较大,现有方法无法对其进行检测。且现有特征图谱方法供试品制备方法时间过久、操作繁琐、指认特征峰无归属,无法对昆布及其制剂的真实性和质量的一致性以及稳定性均可有效地加以检测和控制。因此,有必要建立一种昆布产品的质量控制方法,为有效控制和较全面评价昆布及其制剂的质量提供依据。
发明内容
为了解决上述技术问题,本发明提供了一种昆布产品HPLC特征图谱的构建方法及其应用,可以有效控制和较全面的评价昆布产品的质量。
为了实现上述目的,本发明采用以下技术方案:
昆布产品HPLC特征图谱的构建方法,包括以下步骤;
S1、昆布供试品溶液的制备;
S2、参照物溶液的制备;
S3、对照品溶液的制备;
S4、高效液相色谱测定:吸取步骤S1制备的昆布供试品溶液、步骤S2制备的参照溶液和步骤S3制备的对照品溶液注入高效液相色谱,得到HPLC特征图谱。
本发明中的昆布供试品包括昆布药材、昆布饮片、昆布标准汤剂、昆布干膏粉或昆布配方颗粒。
本发明中所述昆布供试品溶液的制备为:称取昆布供试品,精密加入体积百分数10%的甲醇制备成昆布供试品溶液。具体地,所述制备方法为:精密称取昆布供试品,精密加入体积百分数10%甲醇,超声处理,取出,放冷,再称定重量,用体积百分数10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
优选地,所述昆布供试品溶液的制备为:精密称取昆布供试品,精密加入10%甲醇20-50mL,超声处理30-90分钟,超声处理的功率为250W-800W,取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
最优选地,所述昆布供试品溶液的制备为:精密称取昆布供试品,精密加入10%甲醇50mL,超声处理30分钟,超声处理的功率为250W,取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
本发明中参照物为昆布对照药材,所述参照物溶液的制备为:取昆布对照药材,加体积百分数10%的甲醇制备成参照物溶液。具体地,所述制备方法为:取昆布对照药材,置具塞锥形瓶中,加10%甲醇,超声处理,取出,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
优选地,所述参照物溶液的制备为:取昆布对照药材1g,置具塞锥形瓶中,加10%甲醇30mL,超声处理30分钟,超声功率250W,取出,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
本发明中的对照品为尿苷、腺苷、尿嘧啶和鸟苷,所述对照品溶液的制备为:取尿苷、腺苷、尿嘧啶及鸟苷对照品适量,加体积百分数10%的甲醇制备成混合溶液,作为对照品溶液。具体地,所述制备方法为:取尿苷、腺苷、尿嘧啶及鸟苷对照品适量,加10%甲醇制成每1mL各含10μg的混合溶液,作为对照品溶液。
优选地,步骤S4中所述高效液相色谱的色谱柱以十八烷基硅烷键合硅胶为填充剂,以体积比3:2的乙腈和甲醇混合液为流动相A,体积百分数0.1%的磷酸溶液为流动相B进行梯度洗脱。
进一步优选地,所述梯度洗脱的条件如下:
/>
优选地,步骤S4中所述高效液相色谱的色谱条件为:流速为每分钟0.7-0.9mL/min;柱温为23-27℃;检测波长为230-320nm。
进一步优选地,步骤S4中所述高效液相色谱的色谱条件为:以十八烷基硅烷键合硅胶为填充剂,色谱柱的柱长为250mm,内径为4.6mm,粒径为5μm;以体积比3:2的乙腈和甲醇混合液为流动相A,0.1%磷酸溶液为流动相B进行梯度洗脱;流速为每分钟0.7-0.9mL/min;柱温为23-27℃;检测波长为230-320nm;理论板数按腺苷峰计算应不低于5000。
最优选地,步骤S4中所述高效液相色谱的色谱条件为:以十八烷基硅烷键合硅胶为填充剂,色谱柱的柱长为250mm,内径为4.6mm,粒径为5μm;以体积比3:2的乙腈和甲醇混合液为流动相A,0.1%磷酸溶液为流动相B进行梯度洗脱;流速为每分钟0.8mL/min,柱温为25℃;检测波长为260nm,理论板数按腺苷峰计算应不低于5000。
优选地,步骤S4采用中药色谱指纹图谱相似度评价软件生成由6个特征峰构成的对照特征图谱,其中,2号峰为尿嘧啶峰,4号峰为尿苷峰,5号峰为腺苷峰,6号峰为鸟苷峰,1号峰和3号峰为共有峰。
进一步优选地,以腺苷峰为S峰,各特征峰与S峰的相对保留时间的比值为:0.37-峰1、0.39-峰2、0.52-峰3、0.87-峰4、1.32-峰6。
本发明还提供了上述的构建方法在昆布产品质量控制中的应用。
优选地,本发明中的昆布产品为昆布药材、昆布饮片、昆布标准汤剂、昆布干膏粉或昆布配方颗粒。
优选地,所述应用可同时针对尿苷、鸟苷、尿嘧啶和腺苷的含量对昆布产品的质量进行定量控制。
本发明的有益效果为:
(1)本发明提供的昆布产品HPLC特征图谱的构建方法,同时实现了尿苷、鸟苷、尿嘧啶和腺苷各评价指标成分的共同控制,同时构建得到的对照特征图谱中含有6个共有特征峰,显著提升了特征峰的数量,能够有效提升昆布产品特征图谱的精确度,达到昆布产品整体质量控制的目的。
(2)本发明提供的昆布产品HPLC特征图谱的构建方法,对供试品溶液制备过程进行优化,采用在供试品中加入10%甲醇提取完全,检测成分含量相对较高,各特征峰分离效果相对较好,峰形佳。
(3)本发明提供的昆布产品HPLC特征图谱的构建方法,进一步优化获得特征图谱的色谱条件,包括流动相的优化,以及梯度洗脱程序的优化,最终选用乙腈-甲醇(3:2)-0.1%磷酸溶液为流动相进行梯度洗脱,以尿嘧啶、尿苷、腺苷、鸟苷为参照物,能够有效改善峰形,提高色谱峰分离度,精密度高、稳定性好、重复性好、准确度高、分析速率快,能够全面、清楚、有效地对昆布产品的质量进行控制。
(4)本发明还提供了上述的构建方法在昆布产品质量控制中的应用,所述应用可同时针对尿苷、鸟苷、尿嘧啶和腺苷的含量进行定量控制。并且,通过本发明还能有效实现物质传递过程的质量控制,具体为:可以有效实现配方颗粒制备过程中中间品的质量控制,有效使最终制备得到的昆布配方颗粒的成分能够与昆布药材、饮片、标准汤剂、提取液、浸膏、干膏粉中基本一致。
附图说明
图1为实施例1的对照特征图谱;
图2为实施例2.1提取溶剂考察HPLC特征图谱;
图3为实施例2.2提取方法、实施例2.3提取时间和超声功率考察HPLC特征图谱;
图4为实施例2.4提取溶剂量考察HPLC特征图谱;
图5为实施例3.1的腺苷紫外吸收光谱图;
图6为实施例3.1的尿苷紫外吸收光谱图;
图7为实施例3.1的鸟苷紫外吸收光谱图;
图8为实施例3.1的尿嘧啶紫外吸收光谱图;
图9为实施例3.1的昆布(海带)标准汤剂不同波长的HPLC特征图谱;
图10为实施例3.2的昆布(海带)标准汤剂柱温考察的HPLC特征图谱;
图11为实施例3.3的昆布(海带)标准汤剂流速考察的HPLC特征图谱;
图12为实施例3.4的昆布(海带)标准汤剂进样量考察的HPLC特征图谱;
图13为实施例3.5的色谱条件1的HPLC特征图谱;
图14为实施例3.5的色谱条件2的HPLC特征图谱;
图15为实施例3.5的色谱条件3的HPLC特征图谱;
图16为实施例3.5的色谱条件4的HPLC特征图谱;
图17为实施例3.5的色谱条件5的HPLC特征图谱;
图18为实施例4.1色谱峰指认图;
图19为实施例4.5的色谱柱耐用性考察结果图;
图20为实施例6的15批昆布(海带)标准汤剂的HPLC特征图谱;
其中,R为对照特征图谱;S2到S16批号依次为:20220725-1、20220725-2、20220725-3、20220725-4、20220725-5、20220725-6、20220725-7、20220725-8、20220726-1、20220726-2、20220726-3、20220726-4、20220726-5、20220726-6、20220726-7;
图21为实施例6的对照特征图谱;
图22为实施例7的15批昆布(海带)药材的HPLC特征图谱;
其中,R为对照特征图谱;S2到S16批号依次为:W20220501、W20220502、W20220503、W20220504、W20220505、S20220501、S20220502、S20220503、S20220504、S20220505、P20220501、P20220502、P20220503、P20220504、P20220505;
图23为实施例7的对照特征图谱;
图24为实施例8的15批昆布(海带)饮片的HPLC特征图谱;
其中,R为对照特征图谱;S2到S16批号依次为:220501、220502、220503、220504、220505、220506、220507、220508、220509、220510、220511、220512、220513、220514、220515;
图25为实施例8的对照特征图谱。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。除非另外定义,本文中的质量比或百分数如无特殊说明均为体积比或体积百分数。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
仪器与试药
高效液相色谱仪:安捷伦1260型高效液相色谱仪、Waters e2695型高效液相色谱仪、Waters ACQUITY ARC-2489UV型高效液相色谱仪;
电子天平:赛多利斯BSA2235、赛多利斯SECURA225D-1CN、赛多利斯MSA3.6P-OCE.DM、上海天美天平仪器有限公司FA2204C;
超纯水机:HHitech Master Touch-DUVT型(上海和泰仪器有限公司);
超声波清洗机:DTC-33型(500W,40KHz;鼎泰(湖北)生化科技设备制造有限公司);
色谱柱:Shim-pack GIST C18-AQ 250×4.6mm,5μm、Waters X Select HSST3,250×4.6mm,5μm。
乙腈、甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
腺苷(中国食品药品检定研究院,批号:110879-201703,含量以99.7%计)。
鸟苷(中国食品药品检定研究院,批号:111977-201501,含量以93.6%计)。
尿嘧啶(中国食品药品检定研究院,批号:100469-201302,含量以99.6%计)。
尿苷(中国食品药品检定研究院,批号:110887-202104,含量以99.6%计)。
昆布(海带)对照药材(天地恒一制药股份有限公司,批号W20220504)。
昆布(海带)标准汤剂冻干粉(天地恒一制药股份有限公司制备,批号:20220725-1、20220725-2、20220725-3、20220725-4、20220725-5、20220725-6、20220725-7、20220725-8、20220726-1、20220726-2、20220726-3、20220726-4、20220726-5、20220726-6、20220726-7)。
昆布(海带)药材(天地恒一制药股份有限公司制备,批号:W20220501、W20220502、W20220503、W20220504、W20220505、S20220501、S20220502、S20220503、S20220504、S20220505、P20220501、P20220502、P20220503、P20220504、P20220505)。
昆布(海带)饮片(天地恒一制药股份有限公司制备,批号:220501、220502、220503、220504、220505、220506、220507、220508、220509、220510、220511、220512、220513、220514、220515)。
实施例1
(一)供试品溶液的制备:
(1)药材、饮片供试品溶液的制备:取药材、饮片供试品粉末(过三号筛)约1.5g,精密称定,置具塞锥形瓶中,精密加入10%甲醇50mL,密塞,称定重量,超声处理(功率250w,频率40kHz)30分钟(每隔5分钟振摇一次),取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
(2)标准汤剂供试品溶液的制备:取标准汤剂供试品适量,研细,取约1.5g,精密称定,置具塞锥形瓶中,精密加入10%甲醇50mL,密塞,称定重量,超声处理(功率250w,频率40kHz)30分钟,取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
(二)参照物溶液的制备:取昆布(海带)对照药材1g,置具塞锥形瓶中,加10%甲醇30mL,超声处理(功率250W,频率40kHz)30分钟,取出,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
(三)对照品溶液的制备:分别取尿苷、腺苷、尿嘧啶及鸟苷对照品适量,加10%甲醇制成每1mL各含10μg的混合溶液,作为对照品溶液。
(四)高效液相色谱测定:
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒径为5μm);以3:2(v/v)的乙腈-甲醇为流动相A,以体积百分数0.1%的磷酸溶液为流动相B;按表1中的梯度进行洗脱;流速为每分钟0.8mL;柱温为25℃;检测波长为260nm。理论板数按腺苷峰计算应不低于5000。
表1实施例1梯度洗脱表
测定法:分别精密吸取供试品溶液、参照物溶液和对照品溶液各10μL,注入液相色谱仪,测定,得到HPLC特征图谱。
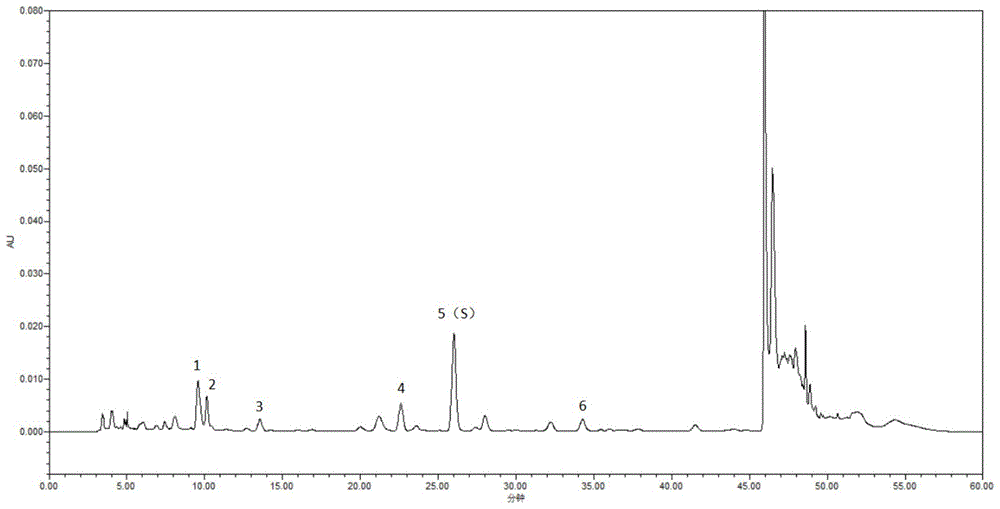
根据获得的HPLC特征图谱,使用《中药色谱指纹图谱相似度评价系统》(2012.1版本),得出对照特征图谱(如图1所示),并进行共有峰的标识,共标识6个共有峰,其中4个峰应分别与相应对照品峰的保留时间相对应,2号峰为尿嘧啶峰,4号峰为尿苷峰,5号峰为腺苷峰,6号峰为鸟苷峰,1号峰和3号峰为共有峰。以腺苷峰为S峰,各特征峰与S峰的相对保留时间的比值为:0.37(峰1)、峰2(0.39)、0.52(峰3)、峰4(0.87)、峰6(1.32)。
实施例2提取方式考察
2.1提取溶剂考察
取昆布(海带)饮片(批号220515)约1.0g,精密称定,置具塞锥形瓶中,分别加入20mL的水、10%甲醇、30%甲醇、50%甲醇、100%甲醇进行提取,超声处理(功率250W,频率40kHz)30分钟,放冷,再称定重量,用溶剂补足减失的重量,摇匀,滤过,取续滤液得各供试品溶液。按照实验例1的色谱条件测定,结果如图2所示。
不同提取溶剂考察的结果表明,以10%甲醇制样时,其检测成分含量相对较高,各特征峰分离效果相对较好,峰形佳,故以10%甲醇作为昆布(海带)原药材及其制剂特征图谱的最佳提取溶剂。
2.2提取方法考察
取昆布(海带)饮片(批号:220515)约1.0g,精密称定,置具塞锥形瓶中,精密加入10%甲醇20mL,分别对供试品提取方法为回流、超声进行考察,提取时间30min,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,得各供试品溶液。按照实验例1的色谱条件测定,结果如图3所示。
不同提取方法考察的结果表明,对供试品分别进行超声提取与回流提取时效果一致。但从操作方便以及节约时间成本角度考虑,超声提取操作更为简便,故供试品提取方法确定为超声提取。
2.3提取时间和超声功率考察
取昆布(海带)饮片(批号:220515)约1.0g,精密称定,置具塞锥形瓶中,加入10%甲醇20mL,超声处理(分别对供试品超声功率为250W、500W、800W时进行考察),分别对供试品提取时间为30分钟、60分钟、90分钟时进行考察,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液得各供试品溶液。按照实验例1的色谱条件测定,结果如图3所示。
不同提取时间考察的结果表明,30、60和90分钟均可将样品提取完全,结合节约时间成本角度考虑,结合特征图谱检测结果无明显差异,因此选择30min作为最佳提取时间。
不同超声功率考察的结果表明,在超声功率250W时,即可充分提取。故供试品超声功率确定为250W。
2.4提取溶剂量考察
取昆布(海带)饮片(批号:220515)约1.0g,精密称定,置具塞锥形瓶中,分别加入10%甲醇20mL、30mL、50mL,密塞,称定重量,超声处理(功率250W,频率40kHz)30min,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液得各供试品溶液。按照实验例1的色谱条件测定,结果如图4所示。
不同提取溶剂量考察的结果表明,提取溶剂量为50mL时溶剂量多,含量相对高于其他组,结合特征图谱检测结果无明显差异,因此选择以50mL作为最佳提取溶剂量。
实施例3色谱条件考察
3.1波长考察
在实施例1拟定的实验条件基础上,利用二极管阵列检测器对腺苷、尿嘧啶、尿苷、鸟苷、昆布(海带)标准汤剂供试品溶液进行全波段扫描,并分别提取昆布(海带)标准汤剂供试品溶液在230nm、240nm、250nm、260nm、270nm、280nm、290nm、300nm、320nm波长下的色谱图,腺苷、尿嘧啶、尿苷、鸟苷紫外吸收光谱图如图5-8所示,昆布(海带)标准汤剂供试品溶液在不同波长下的色谱图如图9所示。
结果表明,在检测波长为260nm时色谱峰信息量较大,色谱图基线更平稳,故检测波长确定为260nm。
3.2柱温考察
在实施例1拟定的实验条件基础上,对柱温分别为23℃、25℃、27℃进行考察,结果如图10所示。供试品批号:20220822批。
柱温考察结果表明,当柱温为25℃时,色谱图峰形对称,分离度较好,故最终确定柱温选择25℃。
3.3流速考察
在实施例1拟定的实验条件基础上,对流速分别为0.7mL/min、0.8mL/min、0.9mL/min进行了考察,结果如图11所示。供试品批号:20220822批。
流速考察结果表明,在流速为0.8mL/min时,色谱图峰形较好,分离度适中。故流速确定为0.8mL/min。
3.4进样量考察
在实施例1拟定的实验条件基础上,对进样量分别为10μL、20μL进行了考察,结果如图12所示。供试品批号:20220822批。
进样量考察结果表明,在进样量为10μL时,色谱图峰形较好,分离度适中。故进样量确定为10μL。
3.5色谱条件优化
色谱条件1
供试品溶液的制备:取昆布(海带)饮片粉末约1.5g,精密称定,置具塞锥形瓶中,精密加入10%甲醇50mL,密塞,称定重量,超声处理(功率250w,频率40kHz)30分钟,取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法:精密吸取供试品溶液10μL,注入液相色谱仪,测定,即得。
以十八烷基硅烷键合硅胶为填充剂(柱长为100mm,内径为2.1mm,粒径为1.7μm);以乙腈为流动相A,以0.1%磷酸为流动相B,按表2中的规定进行梯度洗脱;柱温为30℃;检测波长为217nm;流速0.3mL/min。
表2色谱条件1梯度洗脱表
色谱条件2
供试品溶液的制备:取昆布(海带)饮片粉末约0.2g,精密称定,置于具塞水解管中,精密加入9mol/L盐酸溶液10mL,称定重量,150℃水解3小时,取出,放冷,再称定重量,用9mol/L盐酸溶液补足减失重量,混匀,滤过,精密量取5mL滤液移蒸发皿中,蒸干,残渣加0.1mol/L盐酸溶液溶解,转移至25mL量瓶中,加0.1mol/L盐酸溶液至刻度,摇匀,即得。
测定法:精密量取供试品溶液5mL,置25mL量瓶中,加0.1mol/L异硫氰酸苯酯(PITC)的乙腈溶液、1mol/L三乙胺的乙腈溶液2.5mL,摇匀,室温放置1小时后,加50%乙腈至刻度,摇匀。取上述溶液10mL,加正己烷10mL,振摇,放置10分钟,取下层溶液,滤过,取续滤液各5μL,注入液相色谱仪,测定,即得。
以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒径为5μm);以0.1mol/L乙酸钠(乙酸调pH=6.5):乙腈=93:7为流动相A,以乙腈:水=4:1为流动相B,按表3中的规定进行梯度洗脱;柱温为30℃;检测波长为254nm;流速0.5mL/min;进样体积:5μL。
表3色谱条件2梯度洗脱表
色谱条件3
供试品溶液的制备同色谱条件1。
以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒径为5μm);以乙腈为流动相A,以0.1%磷酸为流动相B,按表4中的规定进行梯度洗脱;柱温为30℃;检测波长为260nm;流速0.8mL/min。
测定法:精密吸取供试品溶液10μL,注入液相色谱仪,测定,即得。
表4色谱条件3梯度洗脱表
色谱条件4
供试品溶液的制备同色谱条件1。
以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒径为5μm);以甲醇为流动相A,以0.1%磷酸为流动相B,按表5中的规定进行梯度洗脱;柱温为30℃;检测波长为260nm;流速0.8mL/min。
测定法:精密吸取供试品溶液10μL,注入液相色谱仪,测定,即得。
表5色谱条件4梯度洗脱表
色谱条件5
供试品溶液的制备同色谱条件1。
以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒径为5μm);以乙腈:甲醇=3:2(v/v)为流动相A,以0.1%磷酸为流动相B,按表6中的规定进行梯度洗脱;柱温为25℃;检测波长为260nm;流速0.8mL/min。
测定法:精密吸取供试品溶液10μL,注入液相色谱仪,测定,即得。
表6色谱条件5梯度洗脱表
5种色谱条件检测结果如图13-17所示,色谱条件1的HPLC图谱中的昆布(海带)色谱峰均较小,且分离度较差,有包峰。色谱条件2的HPLC图谱中的昆布(海带)色谱峰均较少,且基线上抬严重。色谱条件3的HPLC图谱中的昆布(海带)色谱峰基线上抬严重。色谱条件4的HPLC图谱中的的昆布(海带)色谱峰基线上抬严重。色谱条件5的HPLC图谱中的昆布(海带)色谱峰基线平稳,色谱峰较多,分离度良好。且当有机相单纯采用的是甲醇或乙腈,色谱图基线上抬严重,当甲醇与乙腈一定比例时,色谱峰峰型好、基线稳,因此有机相采用乙腈:甲醇=3:2(v/v)。
实施例4方法学考察
4.1色谱峰指认
昆布(海带)标准汤剂(批号:20220822)供试品溶液的制备:取昆布(海带)标准汤剂适量,研细,取约1.5g,精密称定,置具塞锥形瓶中,精密加入10%甲醇50mL,密塞,称定重量,超声处理(功率250w,频率40kHz)30分钟,取出,放冷,再称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
参照物溶液的制备:取昆布(海带)对照药材1g,置具塞锥形瓶中,加10%甲醇30mL,超声处理(功率250W,频率40kHz)30分钟,取出,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
对照品溶液的制备:分别取尿苷、腺苷、尿嘧啶及鸟苷对照品适量,加10%甲醇制成每1mL各含10μg的混合溶液,作为对照品溶液。
阴性对照溶液的制备:按以上拟定的实验条件,制备缺昆布(海带)标准汤剂阴性对照溶液。
对昆布(海带)标准汤剂特征图谱峰进行定位,结果如图18所示。
4.2精密度考察
取对照品参照物溶液,按实施例1实验方法连续进样6次,每次10μL,计算各对照品峰的相对保留时间及相对峰面积,结果如表7、8所示。
表7精密度考察-保留时间
表8精密度考察-峰面积
/>
精密度考察结果表明,各对照品峰保留时间RSD为0.03%,峰面积RSD为0.08%-0.09%,该仪器精密度良好。
4.3重复性考察
精密称取昆布(海带)标准汤剂(批号:20220822)6份,按实施例1实验方法进行制备及测定,计算各特征峰的保留时间及峰面积,结果如表9、10所示。
表9重复性考察-相对保留时间
表10重复性考察-相对峰面积
重复性考察结果表明,重复性各特征峰相对保留时间RSD为0.03%-0.07%,相对峰面积RSD为0.13%-6.90%,该方法重复性良好。
4.4中间精密度考察
在实施例1拟定的实验条件基础上,分别精密称取昆布(海带)标准汤剂6份,制备供试品溶液,分别在安捷伦1260、Waters e2695型高效液相色谱仪上进行测定,结果如表11、12所示。
表11中间精密度-相对保留时间
表12中间精密度-相对峰面积
中间精密度结果表明,由不同的人员在不同的时间对同一个样品进行测定,方法稳定性较好。各特征峰相对保留时间RSD为0.60%-1.43%,相对峰面积RSD为0.58%-4.74%,该方法稳定性良好。
4.5色谱柱耐用性考察
在实施例1拟定的实验条件基础上,分别对色谱柱为Waters Xselect HSST3 C18
250×4.6mm、Shim pack GIST C18 250×4.6mm(SN:21E24971),Shim pack GISTC18
250×4.6mm(SN:21G27585)进行考察,结果如图19所示,计算各特征峰的相对保留时间及相对峰面积,结果如表13、14所示。
表13色谱柱耐用性考察-相对保留时间
表14色谱柱耐用性考察-相对峰面积
色谱柱耐用性考察实验结果显示,在不同型号十八烷基硅烷键合硅胶为填充剂色谱柱条件下,色谱图分离度、峰形均较好,相对保留时间稳定。
4.6稳定性考察
在以上拟定的实验条件基础上,取同一供试品溶液,分别于0h、23h、37h、57h、89h测定,各特征峰的保留时间及峰面积结果如表15、16所示。
表15稳定性考察-保留时间
表16稳定性考察-峰面积
稳定性考察结果表明,其相对应的特征峰保留时间的RSD在0.12%-0.49%,峰面积RSD为0.38%-31.79%,各特征峰的保留时间稳定,各特征峰除峰3的峰面积变化较大,有稳定增长的趋势,其余特征峰相对较稳定,稳定性试验结果显示,样品溶液在89h内,不影响特征峰的识别及含量测定。
实施例5特征峰的确定及对照图谱的建立
5.1相对保留时间规定值限度的制定:方法学各考察项目及验证结果汇总如表17所示。
表17方法学各项目结果RSD%汇总标准—保留时间-相对保留时间
在色谱柱耐用性考察项中,峰1至峰6的RSD范围为0.03%-1.53%,故将各峰的相对保留时间规定值暂定为±10%。
最终规定:推荐使用Shim-pack GIST C18-AQ色谱柱进行分析,供试品特征图谱中应呈现6个特征峰,其中与腺苷参照物相应的峰为S峰。
实施例6 15批昆布(海带)标准汤剂验证
采用实施例1方法,对15批昆布(海带)标准汤剂样品进行特征图谱分析,采用中药色谱指纹图谱相似度评价系统(2012版)对15批昆布(海带)标准汤剂进行合成,结果如图20所示,对照特征图谱如图21所示,计算相对保留时间和相对峰面积比值,结果如表18、19所示。
表18 15批昆布(海带)标准汤剂相对保留时间
表19 15批昆布(海带)标准汤剂相对峰面积
/>
根据相对保留时间稳定及各批次样品均能检出且峰相对较高的原则,共选择了6个重复性较好的峰作为特征峰。计算各特征峰与S峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,规定值为0.37(峰1)、峰2(0.39)、0.52(峰3)、峰4(0.87)、峰6(1.32)。
同时,对15批昆布(海带)标准汤剂特征图谱进行相似度计算,15批昆布(海带)标准汤剂特征图谱与标准特征图谱相似性大于0.9。详细结果如表20所示。
表20 15批昆布(海带)标准汤剂相似度结果
实施例7 15批昆布(海带)药材验证
采用实施例1方法,对15批昆布(海带)药材样品进行特征图谱分析,采用中药色谱指纹图谱相似度评价系统(2012版)对15批昆布(海带)药材进行合成,结果如图22所示,对照特征图谱如图23所示,计算相对保留时间和相对峰面积比值,结果如表21、22所示。
表21昆布(海带)药材特征图谱相对保留时间
表22昆布(海带)药材特征图谱相对峰面积
根据相对保留时间稳定及各批次样品均能检出且峰相对较高的原则,共选择了6个重复性较好的峰作为特征峰。最终规定:供试品色谱中应呈现6个特征峰,并应与对照药材参照物色谱中的6个特征峰的保留时间相对应,其中4个峰应分别与相应对照品参照物峰的保留时间相对应;与腺苷对照品参照物峰相对应的峰为S峰,计算峰1、峰3与S峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,规定值为:0.37(峰1)、峰2(0.39)、0.52(峰3)、峰4(0.87)、峰6(1.32)。
同时,对15批昆布(海带)药材特征图谱进行相似度计算,昆布(海带)药材特征图谱与标准特征图谱相似性大于0.9。详细结果如表23所示。
表23 15批昆布(海带)药材相似度结果
实施例8 15批昆布(海带)饮片验证
采用实施例1方法,在15批昆布(海带)饮片样品进行特征图谱分析,结果如图24所示,对照特征图谱如图25所示,计算相对保留时间和相对峰面积比值,结果如表24、25所示。
表24昆布(海带)饮片特征图谱相对保留时间
表25昆布(海带)饮片特征图谱相对峰面积
/>
根据相对保留时间稳定及各批次样品均能检出且峰相对较高的原则,共选择了6个重复性较好的峰作为特征峰。最终规定:供试品色谱中应呈现6个特征峰,并应与对照药材参照物色谱中的6个特征峰的保留时间相对应,其中4个峰应分别与相应对照品参照物峰的保留时间相对应;与腺苷对照品参照物峰相对应的峰为S峰,计算峰1、峰3与S峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,规定值为:0.37(峰1)、峰2(0.39)、0.52(峰3)、峰4(0.87)、峰6(1.32)。
同时,对15批昆布(海带)饮片特征图谱进行相似度计算,昆布(海带)饮片特征图谱与标准特征图谱相似性大于0.9。详细结果如表26所示。
表26 15批昆布(海带)饮片相似度结果
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种复方罗汉果清肺制剂的HPLC特征图谱及其构建方法
- 异功散HPLC特征图谱的构建方法及其HPLC标准指纹图谱和应用
- 黄连的HPLC特征图谱及其构建方法和应用、黄连制剂的质量检测方法
