新型的诊断肿瘤的标志物及其应用
文献发布时间:2024-04-18 19:58:53
本专利申请是申请号为CN 201911407889.4的发明专利申请的分案申请。
技术领域
本发明属于疾病诊断标志物领域,更具体地,本发明涉及新型的诊断肿瘤的标志物及其应用。
背景技术
表观遗传学(Epigenomics)是研究基因在不发生DNA序列改变的情况下,基因功能的可遗传的变化,并最终导致表型变化的一门学科。表观遗传学主要包括DNA甲基化(DNAmethylation),组蛋白修饰(histone modification),microRNA水平变化等生化过程。DNA甲基化是研究较为深入的表观遗传学机制,在包括诊断和治疗在内的肿瘤临床实践中有着应用前景。DNA甲基化是指生物体内在DNA甲基转移酶(DNA methyltransferase,DMT)的催化下,以S-腺苷甲硫氨酸(SAM)为甲基供体,将甲基转移到特定的碱基上的过程。DNA甲基化可以发生在腺嘌呤的N-6位、胞嘧啶的N-4位、鸟嘌呤的N-7位或胞嘧啶的C-5位等。在哺乳动物中DNA甲基化主要发生在5’-CpG-3’的C上,生成5-甲基胞嘧啶(5mC)。
在基因组中98%以上的CpG二核苷酸散在的分布位于具有转录依赖性的转座潜能的重复序列中。在正常细胞中,这些CpG处于高度甲基化/转录沉默的状态,而在肿瘤细胞中这些CpG发生了广泛的去甲基化,导致重复序列的转录、转座子的活化,基因组的高度不稳定性和原癌基因转录增强。余下的占总量2%左右的CpG密集地分布于较小的区域(CpG岛)。约40-50%的基因启动子区域或其附近存在CpG岛,暗示DNA甲基化可能参与该类基因转录调控机制。
在肿瘤细胞中,一些原本在正常细胞中处于低甲基化状态的CpG岛会发生高甲基化而导致基因的转录失活。受影响的基因包括DNA修复基因,细胞周期控制基因和抗凋亡基因等抑癌基因。基因组DNA经亚硫酸氢盐处理后,进行PCR(甲基化特异PCR,MSP)检测可有效地确定受试DNA片段的特定位点的甲基化状态。
人类基因组全序列尽管已经被人们所掌握,但是基因组序列纷繁复杂,哪些基因或哪些区段与疾病密切相关,仍然是目前本领域研究的重要课题。因此,有必要结合表观遗传学技术筛选有用于疾病诊断的新标志物。在本发明人的前期研究中,找到了一部分基于甲基化修饰的肿瘤标记物。但是,仍然有必要找到更多的新型肿瘤标志物,从而为肿瘤的诊断提供更多的途径。将来的肿瘤诊断必然需要多种标志物的联合运用,以提高诊断的准确性。
发明内容
本发明的目的在于提供新型的诊断肿瘤的标志物及其应用。
在本发明的第一方面,提供分离的人核酸或其转变而来的核酸在制备肿瘤筛查、诊断、检测或预后评估的试剂或试剂盒中的用途;其中,所述的人核酸包括(1)SEQ ID NO:1~16任一所示核苷酸序列的核酸或核酸组合,或含有所述序列中至少1个,如包括2~80个(可以是2~80的正整数的任一数)或3~77个(可以是3~77的正整数的任一数)修饰的CpG位点的核酸修饰的CpG位点的核酸或核酸组合;或(2)与(1)的核酸在序列上互补的核酸或核酸组合;其中,所述由人核酸转变而来的核酸为对应于(1)或(2)的核酸,其非修饰的胞嘧啶转变为T或U,而其修饰的CpG位点的胞嘧啶C不变。
在另一优选例中,与SEQ ID NO:1~16任一所示核苷酸序列的核酸互补的核酸分别是SEQ ID NO:17、23、29、35、41、47、53、59、65、71、77、83、89、95、101、107所示核苷酸序列的核酸。
在另一优选例中,所述肿瘤的样本包括:组织样本、石蜡包埋样本、血液样本、胸腔积液样本以及肺泡灌洗液样本、腹水及灌洗液样本、胆汁样本、粪便样本、尿液样本、唾液样本、痰液样本、脑脊液样本、细胞涂片样本、宫颈刮片或刷片样本、组织及细胞活检样本。
在本发明的另一方面,提供一种分离的人核酸或核酸组合,包括:(1)SEQ ID NO:1~16任一所示核苷酸序列的核酸,或含有所述序列中至少1个修饰的CpG位点的核酸;或(2)与(1)的核酸在序列上互补的核酸。较佳地,所述“含有所述序列中至少1个修饰的CpG位点的核酸”具有约20~1392bp的长度,如长度30、40、50、60、70、80、100、150、200、300、500、1000bp。
在一个优选例中,所述修饰的CpG位点包括发生5-醛甲基化修饰、5-羟甲基化修饰、5-甲基化修饰或5-羧甲基化修饰的CpG位点。
在另一个优选例中,所述分离的人核酸包括选自下组的核酸:SEQ ID NO:1~16任一所示核苷酸序列的核酸;SEQ ID NO:1中第122~175位核苷酸序列或其互补的序列的核酸;SEQ ID NO:2中第35~65位核苷酸序列或其互补的序列的核酸;SEQ ID NO:3中第52~65位核苷酸序列或其互补的序列的核酸;SEQ ID NO:4中第33~70位核苷酸序列或其互补的序列的核酸;SEQ ID NO:5中第273~291位核苷酸序列或其互补的序列的核酸;SEQ IDNO:6中第2~43位核苷酸序列或其互补的序列的核酸;SEQ ID NO:7中第112~167位核苷酸序列或其互补的序列的核酸;SEQ ID NO:8中第16~46位核苷酸序列或其互补的序列的核酸;SEQ ID NO:9中第1~28位核苷酸序列或其互补的序列的核酸;SEQ ID NO:10中第27~40位核苷酸序列或其互补的序列的核酸;SEQ ID NO:11中第63~91位核苷酸序列或其互补的序列的核酸;SEQ ID NO:13中第1~39位核苷酸序列或其互补的序列的核酸;SEQ ID NO:14中第21~32位核苷酸序列或其互补的序列的核酸;SEQ ID NO:15中第497~536位核苷酸序列或其互补的序列的核酸;或SEQ ID NO:16中第44~76位核苷酸序列或其互补的序列的核酸。
在本发明的另一方面,提供一种由前述所述分离的核酸或核酸组合转变而来的核酸或核酸组合,对应于前述分离的核酸,其非修饰的胞嘧啶转变为T或U,而其修饰的CpG位点的胞嘧啶C不变。
在另一优选例中,所述经转变而来的核酸或核酸组合由对应于前述分离的如SEQIDNO:1~16的核酸或核酸组合,经过亚硫酸氢盐或重亚硫酸氢盐处理转变而来。较佳地,包括:如SEQ ID NO:18、24、30、36、42、48、54、60、66、72、78、84、90、96、102、108所示核苷酸序列的核酸或核酸片段,或如SEQ ID NO:19、25、31、37、43、49、55、61、67、73、79、85、91、97、103、109所示核苷酸序列的核酸或核酸片段;所述核酸片段包括至少1个(如包括2~80个,可以是2~80的正整数的任一数)修饰的CpG位点。较佳地,所述核酸片段具有约20~1392bp的长度,如长度30、40、50、60、70、80、100、150、200、300、500、1000bp。
在另一优选例中,所述的核酸的片段中包括:SEQ ID NO:18中第122~175位核苷酸序列或其互补的序列的核酸;SEQ ID NO:24中第35~65位核苷酸序列或其互补的序列的核酸;SEQ ID NO:30中第52~65位核苷酸序列或其互补的序列的核酸;SEQ ID NO:36中第33~70位核苷酸序列或其互补的序列的核酸;SEQ ID NO:42中第273~291位核苷酸序列或其互补的序列的核酸;SEQ ID NO:48中第2~43位核苷酸序列或其互补的序列的核酸;SEQID NO:54中第112~167位核苷酸序列或其互补的序列的核酸;SEQ ID NO:60中第16~46位核苷酸序列或其互补的序列的核酸;SEQ ID NO:66中第1~28位核苷酸序列或其互补的序列的核酸;SEQ ID NO:72中第27~40位核苷酸序列或其互补的序列的核酸;SEQ ID NO:78中第63~91位核苷酸序列或其互补的序列的核酸;SEQ ID NO:90中第1~39位核苷酸序列或其互补的序列的核酸;SEQ ID NO:96中第21~32位核苷酸序列或其互补的序列的核酸;SEQ ID NO:102中第497~536位核苷酸序列或其互补的序列的核酸;或SEQ ID NO:108中第44~76位核苷酸序列或其互补的序列的核酸。
在本发明的另一方面,提供一种试剂或试剂组合,其特异性检测靶序列的CpG位点修饰情况,所述的靶序列是权利要求3~8任一所述的核酸的全长或片段,其中包括至少1个(如包括2~80个,可以是2~80的正整数的任一数)修饰的CpG位点;较佳地,所述的试剂或试剂组合针对包含所述靶序列的基因序列,较佳地所述的基因序列包括基因Panel或基因群组;较佳地,所述的试剂或试剂组合包括特异性检测SEQ ID NO:1~16中2~16条(如3、4、5、6、7、8、9、10、11、12、13、14、15条)序列的试剂。
在另一优选例中,所述的试剂或试剂组合针对包含所述靶序列的基因序列(基于所述基因序列而设计),较佳地所述的基因序列包括基因Panel或基因群组。
在本发明的另一方面,提供一种制备试剂的方法,所述试剂用于肿瘤诊断、筛查、检测、分型或预后评估,所述方法包括:提供前面任一所述的分离的人核酸,以所述核酸全长或片段作为靶序列,设计特异性检测该靶序列的CpG位点修饰情况的检测试剂;其中,所述的靶序列中包括至少1个(如包括2~80个,可以是2~80的正整数的任一数)修饰的CpG位点;较佳地,所述的检测试剂包括但不限于:引物,探针,芯片或试纸。
在另一优选例中,,所述的检测试剂包括特异性检测SEQ ID NO:1~16中2~16条(如3、4、5、6、7、8、9、10、11、12、13、14、15、16条)序列的试剂;较佳地,多种(如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16条)所述的检测试剂被整合于芯片上。
在本发明的另一方面,提供一种用于进行肿瘤检测、筛查、分型、诊断或预后评估的试剂盒,该试剂盒中包括前面所述的试剂或试剂组合。
在另一优选例中,所述的试剂或试剂组合包括引物。
在另一优选例中,所述的引物包括:所述的引物包括选自下组的引物:SEQ ID NO:20和SEQ ID NO:21,或还包括SEQ ID NO:22;SEQ ID NO:26和SEQ ID NO:27,或还包括SEQID NO:28;SEQ ID NO:32和SEQ ID NO:33,或还包括SEQ ID NO:34;SEQ ID NO:38和SEQ IDNO:39,或还包括SEQ ID NO:40;SEQ ID NO:44和SEQ ID NO:45,或还包括SEQ ID NO:46;SEQ ID NO:50和SEQ ID NO:51,或还包括SEQ ID NO:52;SEQ ID NO:56和SEQ ID NO:57,或还包括SEQ ID NO:58;SEQ ID NO:62和SEQ ID NO:63,或还包括SEQ ID NO:64;SEQ ID NO:68和SEQ ID NO:69,或还包括SEQ ID NO:70;SEQ ID NO:74和SEQ ID NO:75,或还包括SEQID NO:76;SEQ ID NO:80和SEQ ID NO:81,或还包括SEQ ID NO:82;SEQ ID NO:86和SEQ IDNO:87,或还包括SEQ ID NO:88;SEQ ID NO:92和SEQ ID NO:93,或还包括SEQ ID NO:94;SEQ ID NO:98和SEQ ID NO:99,或还包括SEQ ID NO:100;SEQ ID NO:104和SEQ ID NO:105,或还包括SEQ ID NO:106;和/或SEQ ID NO:110和SEQ ID NO:111,或还包括SEQ IDNO:112。
在一个优选例中,所述的试剂盒中还可包括但不限于:DNA纯化试剂,DNA提取试剂,亚硫酸氢盐或重亚硫酸氢盐,PCR扩增试剂。
在其它优选例中,所述的试剂盒中还包括:用于标明检测操作步骤和结果判定标准的说明书。
在本发明的另一方面,提供所述的试剂或试剂组合的用途,用于制备肿瘤诊断、筛查、检测分型或预后评估的试剂盒。
在本发明的另一方面,提供检测待测样品的甲基化水平的方法,包括:提取待测样品的核酸;以及检测所提取的核酸中靶序列的CpG位点修饰情况,所述的靶序列是前述任一所述的经转变而来的核酸。
在另一优选例中,检测所提取的核酸中靶序列的CpG位点修饰情况的方法包括:焦磷酸测序法、重亚硫酸盐转化测序法、甲基化芯片法、qPCR法、数字PCR法、二代测序法、三代测序法、全基因组甲基化测序法、DNA富集检测法、简化亚硫酸氢盐测序技术、HPLC法、MassArray、甲基化特异PCR、或它们的组合;或SEQ ID NO:1所示序列中部分或全部甲基化位点的组合基因群组体外检测方法及体内示踪检测方法。
在另一优选例中,所述检测所提取的核酸中靶序列的CpG位点修饰情况的方法包括:(i)对所提取的核酸进行处理,使其中未发生修饰的胞嘧啶转化为尿嘧啶;较佳地,所述修饰包括5-甲基化修饰、5-羟甲基化修饰、5-醛甲基化修饰或5-羧甲基化修饰;较佳地,利用亚硫酸氢盐或重亚硫酸氢盐处理步骤(i)所述的核酸;(ii)分析经(i)处理的核酸中所述的靶序列的修饰情况。
在另一优选例中,步骤(ii)中,分析的方法包括:焦磷酸测序法、重亚硫酸盐转化测序法、甲基化芯片法、qPCR法、数字PCR法、二代测序法、三代测序法、全基因组甲基化测序法、DNA富集检测法、简化亚硫酸氢盐测序技术、HPLC法、MassArray、甲基化特异PCR(MSP)、或它们的组合以及SEQ ID NO:1所示序列中部分或全部甲基化位点的组合基因群组体外检测方法及体内示踪检测方法。并且,其它其他甲基化检测方法及未来新开发的甲基化检测方法也可被应用于本发明中。
在另一优选例中,所述的甲基化谱式的方法不是诊断性的方法,也即其不以直接获得疾病的诊断结果为目的。
在另一优选例中,所述检测样品的甲基化谱式的方法为体外方法。
在另一优选例中,步骤(ii)包括:(1)对(i)的产物进行处理,使其中未发生修饰的胞嘧啶转化为尿嘧啶;较佳地,所述修饰包括5-甲基化修饰、5-羟甲基化修饰、5-醛甲基化修饰或5-羧甲基化修饰;较佳地,利用亚硫酸氢盐或重亚硫酸氢盐处理步骤(i)所述的核酸;(2)分析经(1)处理的核酸中所述的靶序列的修饰情况。
在另一优选例中,所述的甲基化谱式异常是指该核酸CpG中的C发生高度甲基化。
根据前面任一方面,所述肿瘤包括:血液系统肿瘤,消化系统肿瘤,妇科及生殖系统肿瘤,神经系统肿瘤,泌尿系统肿瘤,其他系统肿瘤;较佳地,所述血液系统肿瘤如白血病,淋巴瘤,多发性骨髓瘤;消化系统肿瘤如食道癌,胃癌,结直肠癌,肝癌,胰腺癌,胆管及胆囊癌;妇科及生殖系统肿瘤如乳腺癌,卵巢癌,宫颈癌,外阴癌,睾丸癌,前列腺癌,阴茎癌;神经系统肿瘤如胶质瘤,神经母细胞瘤,脑膜瘤;头颈部肿瘤如口腔癌,舌癌,喉癌,鼻咽癌;泌尿系统肿瘤如肾癌,膀胱癌,皮肤癌;其他系统肿瘤如皮肤癌、黑色素瘤、骨肉瘤,脂肪肉瘤,甲状腺癌;呼吸系统肿瘤如肺癌,胸膜瘤。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
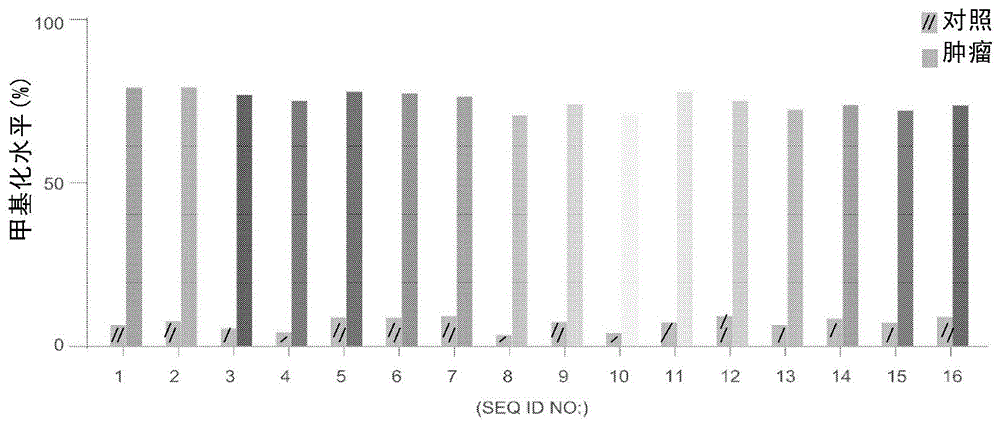
图1、基于公共数据库信息,分析靶基因中相应位点在肿瘤组织或正常组织中的甲基化水平的结果图。
图2、十种肿瘤细胞系以及三例白细胞对照样本中,靶基因位点的甲基化水平的结果图。
图3、白血病临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图4、乳腺癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图5、直肠癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图6、食管癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图7、胃部临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图8、头颈部肿瘤临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图9、肝癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图10、肺癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
图11、胰腺癌临床样本中,SEQ ID NO:1~16所示序列中的位点在实验组和对照组中甲基化值比较。
具体实施方式
本发明人经过深入的研究和分析,分离获得了一类DNA表观修饰相关的疾病标志物,所述标志物在患有肿瘤的患者中表现出显著性的甲基化状态的差异,这种差异统计学意义显著,且在实体瘤以及非实体瘤等诸多肿瘤中均能表现出这种差异,所述的非实体瘤如血液肿瘤,所述的实体瘤如肝癌、肺癌等。因此,本发明的肿瘤标志物可作为临床肿瘤的诊断、筛查、分型、检测、预后的标志物,也可作为肿瘤临床辅助诊断或预后的新型分子,或可用于设计诊断试剂及试剂盒。
本发明中,术语“样品”或“样本”包括从任何个体(较佳地为人)或分离的组织、细胞或体液(如血浆)中获得的、适合于DNA甲基化状态检测的物质。例如,所示的样本可以包括但不限于:血液样本、组织样本、石蜡包埋样本、胸腔积液样本以及肺泡灌洗液样本、腹水及灌洗液样本、胆汁样本、粪便样本、尿液样本、唾液样本、脑脊液样本、细胞涂片样本、宫颈刮片或刷片样本、组织及细胞活检样本。
本发明中,术语“高(度)甲基化”是指在一个基因序列中CpG存在高度甲基化、羟甲基化、醛甲基化或羧甲基化修饰。例如,以甲基化特异PCR(MSP)分析手段而言,以甲基化特异性引物所进行的PCR反应可获得阳性的PCR结果即可认为该受试的DNA(基因)区处于高甲基化状态。例如,以实时定量甲基化特异性PCR而言,高甲基化状态的判定可根据其对照样品的甲基化状态的相对值分析统计学差异。
本发明中,SEQ ID NO:1~16任一所示基因序列或其部分区域的甲基化状态在肿瘤组织和非肿瘤组织之间存在显著的差异,只要检测到所述基因序列区域存在异常高甲基化状态,即可判定该受检者罹患肿瘤或属于肿瘤高危人群。并且,SEQ ID NO:1~16任一所示基因序列或其部分区域呈现的这种在肿瘤组织和非肿瘤组织之间存的显著差异广谱地存在于不同种类的肿瘤中,包括实体瘤如肠癌、肺癌等,同时也包括非实体瘤。实体瘤以及非实体瘤的研究结果在临床研究中得以证实,详细的内容可见实施例中的具体记载。
根据上述,本发明提供了来源于人基因组特定区域的核酸,其具有SEQ ID NO:1~16任一所示基因序列或其部分区域,同时还包括其反义链。在肿瘤细胞内,该核酸序列中多处5’-CpG-3’的碱基C位置上生成5-甲基胞嘧啶(5mC)。
针对本发明提供的一个或多个CpG进行检测均是可以的,因此本发明也包含所述核苷酸序列的核酸的片段,且其中包括至少1个甲基化CpG位点。所述的至少一个可以包括2~80个,可以是2~80的正整数的任一数,更具体如3,5,8,10,12,15,18,20,30,40,50,60,70个。
根据本发明所提供的人基因组中该特定片段的信息后,本领域技术人员可以方便地获得所述CpG位点,加以应用。本发明的实施例中提供了一系列的含有CpG位点的序列片段,这些片段可以作为较佳实施方式的一些例子,但是应理解,根据本发明提供的信息,人们可以作出变化,选择其它的片段。
本发明也包括SEQ ID NO:1~16任一所示核苷酸序列或序列片段或其互补序列的基因Panel或基因群组。针对所述的基因Panel或基因群组,也可以通过DNA甲基化状态检测获取正常细胞和肿瘤细胞的特征。
应理解,多种多样的可用于分析甲基化状态的技术均可被应用于本发明中,本发明对此类检测技术没有特别的限制。本发明提供的核酸可以作为基因组中分析甲基化状态的关键区域,可通过各种本领域已知的技术来分析它们的甲基化状态,进而分析肿瘤的发生或发展情况。
本发明的SEQ ID NO:1~16任一所述的核酸或其片段或与其互补的序列,可在经过亚硫酸氢盐或重亚硫酸氢盐处理后,其中未发生甲基化的胞嘧啶转化为尿嘧啶,而发生甲基化的胞嘧啶保持不变。因此,本发明还提供了上述核酸(包括其互补链(反义链))经过亚硫酸氢盐或重亚硫酸氢盐处理后获得的核酸,包括:SEQ ID NO:18、24、30、36、42、48、54、60、66、72、78、84、90、96、102、108所示核苷酸序列的核酸或核酸片段,或如SEQ ID NO:19、25、31、37、43、49、55、61、67、73、79、85、91、97、103、109所示核苷酸序列的核酸或核酸片段。这些核酸可作为设计检测试剂或检测试剂盒的更为直接的靶点。
本发明也包含上述核酸或其反义链经过亚硫酸氢盐或重亚硫酸氢盐处理后获得的核酸的片段,且其中包括至少1个甲基化CpG位点。所述的至少一个可以包括2~80个,可以是2~80的正整数的任一数,更具体如3,5,8,10,12,15,18,20,30,40,50,60,70个。本领域人员可以理解的是,在本发明提供了基于一条DNA链的CpG编号后,与之互补的DNA链中各个CpG位点相应于正义链的编号是根据本发明所提供的内容易于获得的。
本发明的SEQ ID NO:1~16任一所示核苷酸序列的核酸和/或其互补核酸可被整合于一个或若干个整体中,如一个或若干个核酸集中,供本领域技术人员运用,如从该核酸集中选择一条或多条核酸或核酸的片段,设计靶向分析试剂。所设计的靶向分析试剂,也可被整合于一个或若干个整体中,如一个或若干个试剂盒中。这种整合有利于实现高通量的分析。
本发明的由SEQ ID NO:1~16任一所示核苷酸序列的核酸和/或其互补核酸转变而来的核酸,也可被整合于一个或若干个整体中,如一个或若干个核酸集中,供本领域技术人员运用,如从该核酸集中选择一条或多条核酸或核酸的片段,设计靶向分析试剂。所设计的靶向分析试剂,也可被整合于一个或若干个整体中,如一个或若干个试剂盒中,或一片或若干片芯片中。这种整合有利于实现高通量的分析。
在本发明的提供了靶基因的基础上,本领域公知的这些技术以及即将发展的一些技术,均可被应用于本发明中,来实施甲基化水平的检测。测定核酸的甲基化谱式可通过已有的技术(如甲基化特异性PCR(MSP)或实时定量甲基化特异性PCR,Methylight)来进行,或其它仍在发展中和将被开发出来的技术来进行。例如,检测甲基化水平时可使用定量甲基化特异性PCR(QMSP)的方法,其基于一种荧光PCR的持续性的光学监控,其较MSP方法更为敏感。其通量高并避免了用电泳方法对其结果进行分析。此外,其他可用的技术还有:qPCR法、二代测序法、焦磷酸测序法、重亚硫酸盐转化测序法、全基因组甲基化测序法、DNA富集检测法、简化亚硫酸氢盐测序技术或HPLC法以及组合基因群组检测法等该领域常规方法。尽管本发明的实施例中提供了一些优选的方式,但本发明的总体方案并不限于此。
作为本发明的优选方式,还提供了一种体外检测样品中核酸的甲基化谱式的方法。所述的方法基于的原理是:亚硫酸氢盐或重亚硫酸氢盐可以将未甲基化的胞嘧啶转化为尿嘧啶,在后续的PCR扩增过程中转变为胸腺嘧啶,而甲基化的胞嘧啶保持不变;因而,经过亚硫酸氢盐或重亚硫酸氢盐处理核酸后,甲基化的位点产生类似于一个C/T的核酸多态性(SNP)。基于上述原理来鉴定检测样品中核酸的甲基化谱式,可以有效区分出甲基化与非甲基化的胞嘧啶。
本发明所述的方法包括:包括:首先提供样品、提取基因组DNA;其次,利用亚硫酸氢盐或重亚硫酸氢盐处理步骤(a)所述的基因组DNA,从而基因组DNA中未甲基化的胞嘧啶转化为尿嘧啶;再次,分析经步骤(b)处理的基因组DNA中是否存在甲基化谱式异常。
本发明的方法可用于:对受试者样品进行检测,评估受试者是否患有肿瘤;或用于区分肿瘤高危人群。所述的方法可以是不以获得直接的疾病诊断结果为目的的情形,例如不以判断疾病最终结果为目的的情形、人群地域性分析研究、科学研究、人口普查等。
在本发明的优选实施例中,通过PCR扩增及焦磷酸测序法检测DNA甲基化,实际应用中并不限于该方法,本领域已知的或正在改进的其它DNA甲基化检测方法亦可。在进行PCR扩增中,所应用的引物并不限于是实施例中所提供的,还可以获得与本发明实施例所提供的引物在序列上存在不同,但仍然针对于本发明所指示的核酸或相应CpG位点的引物。
围绕本发明所提供的标记物核酸,其它本领域技术人员已知的确定基因组的序列、其变异及甲基化状态的检测方法和试剂均可包括在本发明中。
本发明提供了一种制备肿瘤检测试剂的方法,包括:提供所述的核酸,以所述核酸的全长或片段作为靶序列,设计特异性检测该靶序列的检测试剂;其中,所述的靶序列中包括至少1个甲基化CpG位点。所述的检测试剂可以包括但不限于:芯片,引物,探针,等等;在获得了所述的标记物后,检测试剂的选择是本领域技术人员可以做到的。
在得知了核酸的序列后,设计引物是本领域技术人员已知的,两个引物在将被扩增的目标基因特定序列的两侧(包含CpG序列在内,与其中CpG互补为针对原为甲基化的基因区,而与其中TpG互补为针对原为去甲基化的基因区)。在本发明优选的实施例中,所述的试剂是引物,所述的引物优选地为被列于表2~表17中的那些。除了引物,其它的诊断或检测试剂也是可以制备的,包括但不限于探针、芯片等。
所述的试剂也可以是试剂组合,例如引物组合。例如,所述的组合包括多于一组的引物,从而可分别扩增上述的多条核酸。
本发明还提供了体外检测样品中核酸的甲基化谱式的试剂盒,该试剂盒包括:容器,以及位于容器中的上述引物对。
所述的试剂盒中还可包括用于提取DNA、DNA纯化、PCR扩增等所需的各种试剂以及其它试剂,例如样本处理试剂。此外,所述的试剂盒中还可包括使用说明书,其中标明检测操作步骤和结果判定标准,以便于本领域技术人员应用。
本发明的方法及试剂用于诊断临床肿瘤时,准确性非常高,这在本发明实施例中针对多种肿瘤临床样本的检测中得以体现。本发明可应用于肿瘤前期筛查、疗效判定、辅助诊断、预后监测等等领域,或如前所述的不以获得直接的疾病诊断结果为目的的情形。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、与肿瘤相关的标志物的筛选及获得
人类疾病的发生或发展与基因存在密切的相关性。而人基因组存在庞大而复杂的基因信息,其中隐藏着疾病发生发展密切相关的基因,同时也可能存在一些能够区分疾病和非疾病的基因或片段。本发明人致力于肿瘤诊断研究,为了获得与肿瘤密切相关的基因,本发明人对人基因组进行了大量的分析,从中探寻在肿瘤以及非肿瘤中甲基化存在显著差异的分子,在大量分析以及试验论证的基础上,本发明人确定了一系列可以作为肿瘤标志的基因区段,包括选自SEQ ID NO:1~SEQ ID NO:16的基因区段,具体的序列列于表1中。
SEQ ID NO:1~SEQ ID NO:16的经重亚硫酸盐处理后序列分别是SEQ ID NO:18、24、30、36、42、48、54、60、66、72、78、84、90、96、102、108。
同时,本发明人还获得了SEQ ID NO:1~SEQ ID NO:16的反向互补序列,它们分别是SEQ ID NO:17、23、29、35、41、47、53、59、65、71、77、83、89、95、101、107。针对于所述反向互补序列的经重亚硫酸盐处理后序列分别是SEQ ID NO:19、25、31、37、43、49、55、61、67、73、79、85、91、97、103、109。
本发明人根据每一靶基因区段进行分组,每一靶区段、其反向序列以及它们的经重亚硫酸盐处理后序列归为一组,分为16组,如表1。
表1*
/>
/>
/>
/>
/>
/>
/>
/>
/>
*表中,以“.”标示的碱基为甲基化CpG位点或其经过重亚硫酸盐处理后相应位点,所述位点(下方)对应的数字为CpG编号;下划线的位置为后续部分实施例中的检测靶位置区域。
实施例2、基于公共数据库信息来分析相应靶基因的甲基化水平
本发明人汇总了公共数据库(所述公共数据库包括TCGA,Roadmap,ENCODE)中肿瘤组织样本的DNA甲基化数据集。肿瘤组织样本共包括以下17种:膀胱癌,乳腺癌,宫颈癌,胆囊癌,结肠癌,直肠癌,头颈部肿瘤,食管癌,肾癌,肝癌,肺癌,胰腺癌,前列腺癌,黑色素瘤,胃癌,甲状腺癌,子宫内膜癌);正常组织样本包括以下17种:膀胱组织,乳腺组织,宫颈组织,胆囊组织,结肠组织,头颈部组织,食管组织,肾组织,肝组织,肺组织,胰腺组织,前列腺组织,皮肤组织,胃组织,甲状腺组织,子宫内膜组织。获取各样本的DNA甲基化数据集后,计算SEQ ID NO:1~16所示序列在所有肿瘤以及对照样本中的平均甲基化水平。
结果如图1,可见肿瘤样本中SEQ ID NO:1~16所示序列的甲基化水平普遍在70%以上,而对照正常组织样本中则普遍低于10%。因此,肿瘤样本中SEQ ID NO:1~16所示序列的甲基化水平显著高于对照样本。
实施例3、诊断试剂的制备以及肿瘤细胞甲基化水平检测
一、诊断试剂的设计
1、组1
针对组1的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为对应于SEQ IDNO:1中013~022号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表2。
表2
2、组2
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:2中05~11号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表3。
表3
3、组3
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:3中03~06号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表4。
表4
4、组4
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:4中04~12号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表5。
表5
5、组5
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:5中13~17号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表6。
表6
6、组6
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:6中01~04号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表7。
表7
7、组7
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:7中08~18号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表8。
表8
8、组8
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:8中02~07号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表9。
表9
9、组9
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:9中01~05号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表10。
表10
10、组10
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:10中05~09号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表11。
表11
11、组11
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:11中04~07号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表12。
表12
12、组12
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:12中01~05号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表13。
表13
13、组13
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:13中01~07号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表14。
表14
14、组14
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:14中02~05号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表15。
表15
15、组15
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:15中26~31号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表16。
表16
16、组16
针对组的靶基因位置进行引物设计。其中,焦磷酸检测CpG位点为相应于SEQ IDNO:16中07~12号的CpG位点(即表1中下划线部分序列相应位置所含CpG)。引物序列具体如表17。
表17
二、针对肿瘤细胞的甲基化检测
本发明人收集了十种肿瘤细胞,获得其基因组,检测其中SEQ ID NO:1~16所示序列的甲基化水平。所述肿瘤细胞为A549(肺癌),HCT116(结直肠癌),K562(慢性髓细胞白血病),97L(肝癌),Hela(宫颈癌),HUCCT1(胆管上皮癌),SW1990(胰腺癌),GBC-SD(胆囊癌),MCF7(乳腺癌),746T(胃癌)。同时,本发明人收集了三例白细胞(WBC1~3)作为对照样本。
检测时采用焦磷酸测序法(pyrosequencing),主要步骤如下:
利用焦磷酸测序法来检测肿瘤样本与非肿瘤样本的甲基化差异,具体步骤包括:
(1)获取样本:选择肿瘤细胞系-白细胞对照,或者从临床获取癌旁/非癌-癌组织样本,白细胞、癌旁/非癌样本作为对照组,肿瘤细胞系,癌组织样本作为肿瘤检测实验组;
(2)DNA提取:分别提取实验组和对照组DNA;本实验用酚氯仿抽提法;
(3)重亚硫酸盐处理:以重亚硫酸盐处理提取的DNA样本,按照步骤操作;本实验中用ZYMO Research公司的EZ DNA Methylation-Gold Kit,货号D5006;
(4)引物设计:根据靶基因序列,设计PCR扩增引物与焦磷酸测序引物,如后续相应列表中所示;
(5)PCR扩增及琼脂糖凝胶电泳:以重亚硫酸盐处理后的样本作为PCR的模板,进行PCR扩增,扩增后的产物通过琼脂糖凝胶电泳鉴定PCR扩增的特异性;
(6)焦磷酸测序:通过QIAGEN公司的Pyro Mark Q96 ID焦磷酸测序仪进行检测,按照其说明书步骤进行操作;
(7)甲基化值计算:焦磷酸测序可以独立检测出目标区域内单个CpG位点的甲基化情况,计算所有CpG位点甲基化平均值作为该样本中的甲基化值;
(8)结果分析:比较对照组与实验组中靶基因序列的甲基化值。
结果如图2(每组柱体由左向右对应于标注自上而下的顺序,箭头处为对照),在十种肿瘤细胞系以及三例白细胞对照样本中检测,SEQ ID NO:1~16所示序列的甲基化水平(约50~99%)均显著高于白细胞对照样本(约20%以下)。
实施例4、白血病临床检测
本发明人从临床获取12例非白血病骨髓涂片样本作为对照组,同时获取12例白血病骨髓涂片样本作为实验组,按照实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ IDNO:1~16所示序列的甲基化水平。
结果如图3,显示在白血病临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组,甲基化水平的增加幅度普遍约在2~8倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于白血病临床诊断。
实施例5、乳腺癌临床检测
本发明人从临床获取5例乳腺癌癌旁组织样本作为对照组,同时获取5例乳腺癌组织样本作为实验组,按照实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图4,显示在乳腺癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~8倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于乳腺癌临床诊断。
实施例6、直肠癌临床检测
本发明人从临床获取7例结直肠癌癌旁组织样本作为对照组,同时获取7例结直肠癌组织样本作为实验组,按照实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图5,显示在结直肠癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~8倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于直肠癌临床诊断。
实施例7、食管癌临床检测
本发明人从临床获取10例食管癌癌旁组织样本作为对照组,同时获取10例食管癌组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ IDNO:1~16所示序列的甲基化水平。
结果如图6,显示在食管癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~7倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于食管癌临床诊断。
实施例8、胃癌临床检测
本发明人从临床获取5例胃部炎症患者组织样本作为对照组,同时获取5例胃癌组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图7所示,显示在胃癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~4倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于胃癌临床诊断。
实施例9、头颈部肿瘤临床检测
本发明人从临床获取10例头颈部肿瘤癌旁组织样本作为对照组,获取10例头颈部肿瘤组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQID NO:1~16所示序列的甲基化水平。
结果如图8所示,显示在头颈部肿瘤临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~4倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于头颈部肿瘤临床诊断。
实施例10、肝癌临床检测
本发明人从临床获取9例肝癌癌旁组织样本作为对照组,获取9例肝癌组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图9所示,显示在肝癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~4倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于肝癌临床诊断。
实施例11、肺癌临床检测
本发明人从临床获取8例肺癌癌旁组织样本作为对照组,获取8例肺癌组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图10所示,显示在肺癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~5倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于肺癌临床诊断。
实施例12、胰腺癌临床检测
本发明人从临床获取6例胰腺癌癌旁组织样本作为对照组,获取6例胰腺癌组织样本作为实验组,按照以上实施例3的焦磷酸检验步骤,比较对照组与实验组SEQ ID NO:1~16所示序列的甲基化水平。
结果如图11所示,显示在胰腺癌临床样本中,SEQ ID NO:1~16所示序列在实验组中甲基化值显著高于对照组(箭头所指的柱体),甲基化水平的增加幅度普遍约在2~6倍。
因此,对SEQ ID NO:1~16任一所示序列进行甲基化水平检测,可以用于胰腺癌临床诊断。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 新型的诊断肿瘤的标志物及其应用
- 新型的诊断肿瘤的标志物及其应用
