一种试剂盒
文献发布时间:2023-06-19 13:46:35
技术领域
本发明涉及生化检测领域,具体涉及一种试剂盒。
背景技术
血清淀粉样蛋白A(serumamyloidAprotein,SAA),是一种急性相蛋白并与血浆高密度脂蛋白(HDL)结合,与心脑血管疾病、肿瘤、肾脏疾病、淀粉样变性病、呼吸系统疾病的相关性以及它在相关疾病的应用介绍:1、在肿瘤方面的应用:SAA在肿瘤的发生发展、侵袭转移过程发挥重要的作用,SAA在肿瘤的转移病人体内有高浓度表达,因此SAA在肿瘤患者的疗效观察和预后评估方面具有重要的应用价值;2、心血管疾病方面:可以作为发生心血管疾病的风险评估指标3、肾脏疾病方面的应用:尤其在肾移植患者的检测方面,发生肾移植排斥患者SAA会异常升高,且该指标比如尿酸、肌酐、CRP等指标更灵敏;4、其他的一些疾病,例如淀粉样变性病、呼吸系统疾病、类风湿关节炎也有一定的应用价值。
血清淀粉样蛋白A是急性期蛋白,在炎症、感染性和非感染性疾病期间,它在血液中的浓度能在数小时内急剧升高,可升高到最初浓度的1000倍;SAA与HDL有关,它能在炎症期间调节HDL的代谢,SAA一个特别重要的特性是其降解产物能以淀粉样蛋白A原纤维的方式沉积在不同的器官中,在慢性炎症疾病中这是一种严重的并发症;血清淀粉样蛋白A升高还见于动脉粥样硬化、糖尿病肾病、急性心肌梗死、冠心病、慢性肾脏疾病。在评价炎症、监控其活动及治疗中,SAA与CRP有相似的作用。SAA检测在诊断发生病毒感染、肾移植排斥反应的患者(特别是进行免疫抑制治疗的患者)以及肾上腺皮质激素治疗的囊性纤维化患者方面,比C反应蛋白检测更确凿。研究发现,在患关节炎的案例中,血清淀粉样蛋白A与疾病活动性的关系最密切。同时检测C反应蛋白和血清淀粉样蛋白A能提高对感染的诊断灵敏度。
铁蛋白为机体内一种贮存铁的可溶组织蛋白,主要存在于肝脏、脾脏和大脑的锥体外侧束的细胞核中,构成铁蛋白的两个亚型:一个是L亚型,相对分子质量19000,另一个是H亚型,相对分子质量21000,具有调节铁代谢平衡、抗氧化胁迫、消除部分重金属和有毒分子的毒害等功能。慢性肾病长期依赖透析维持治疗者中,有一半人血清铁蛋白水平可高达500ng/mb血清铁蛋白大于800ng/ml的透析患者,有更高的CRP水平及更糟糕的营养状态及感染可能。
在临床上,冠状动脉疾病是导致发达国家心血管疾病患者死亡的主要原因之一,而铁过量增加了心血管疾病发生的危险性。血清铁蛋白是急性心肌梗死的一种新的危险因素。另外原发性高血压和脑梗死患者与血清铁蛋白水平有着密切的关系。铁蛋白作为组织铁的可靠指标,参与了急性脑梗死的发生、发展过程;缺铁性贫血,在发达国家与发展中国家都很常见。尽管骨髓穿刺是诊断缺铁性贫血的金标准,但因是损伤性操作,多数患者难以接受,而且受到取材好坏的限制,所以仍需积极寻找简便可行、灵敏度高的缺铁性贫血指标。而血清铁蛋白能够反映身体贮铁状况,是贫血的常规检查项目。血清铁蛋白降低对于缺铁性贫血具有高度特异性,其检测较金标准骨髓穿刺铁染色损伤性小,参考范围为男性:30-300ng/ml女性:10-200ng/ml;目前大量临床和流行病学研究发现,体内铁蛋白储存量增高可能与罹患肝癌、肺癌、结肠癌、食管癌、胃肠道肿瘤和胰腺癌、乳腺癌有关,特别是当肝癌AFP测定值较低时,可用测定铁蛋白值作为补充,以提高诊断率。
髓过氧化物酶(myeloperoxidase,MPO),是一种血红素蛋白,富含于中性粒细胞中,由粒细胞进入循环之前在骨髓内合成并存储于噬天青颗粒内。外界刺激可导致中性粒细胞聚集,从而释放髓过氧化物酶。MPO的相对分子量为150kDa,是由两个亚单位通过共价结合形成的四聚体,每个亚单位又有一条重链α(相对分子量60kDa)和一条轻链β链(相对分子量为15kDa)构成。MPO可以通过催化氧化氯离子产生次氯酸在吞噬细胞内杀灭微生物,破坏多种靶物质,对机体产生和调节炎症反应等多方面发挥作用。更重要的是,其氧化修饰低密度脂蛋白(LDL)可引起动脉粥样硬化,因此MPO被认为与心血管疾病的发生有关。目前,MPO被认为是最有前景的心血管标志物,体内MPO含量升高预示着有动脉硬化以及冠心病的风险,是心肌梗死的早期预警,比其他指标如肌钙蛋白T、CK-MB以及CRP更灵敏,更早地诊断和危险评估。在胸痛发生2h内MPO水平即可明显升高,所以,对于胸痛患者而言,MPO对于诊断急性冠脉综合征(ACS)将有更重要的临床意义。
脂蛋白相关磷脂酶A2(lipoprorein-assoeiated phosPhohPaseA2,Lp-PLA2)又称血小板活化因子乙酞水解酶(PAF-AH),是一种炎性细胞分泌的能促使氧化磷脂水解的磷脂酶,是磷脂酶A2(PLA2)超家族中的一员,相对分子质量为45.4kD(441个氨基酸)。Lp-PLA2是磷脂酶超家族中的亚型之一,也被称为是血小板活化因子乙酰水解酶,由血管内膜中的巨噬细胞、T细胞和肥大细胞分泌。动脉粥样硬化斑块中Lp-PLA2表达上调,并且在易损斑块纤维帽的巨噬细胞中强表达。Lp-PLA2可水解氧化低密度脂蛋白ox-LDL中的氧化磷脂,生成脂类促炎物质,如溶血卵磷脂和氧化游离脂肪酸,进而产生多种致动脉粥样硬化作用,包括内皮细胞死亡和内皮功能异常,刺激粘附因子和细胞因子的产生。这些物质可通过趋化炎症细胞进一步产生自我强化的循环,生成更多促炎物质。释放到血液循环中的Lp-PLA2主要与富含载脂蛋白(Apo)B的脂蛋白结合,低密度脂蛋白(LDL)占80%,其余与高密度脂蛋白(HDL)、脂蛋白和极低密度脂蛋白(VLDL)结合。在动脉粥样硬化性疾病患者中,Lp-PLA2水平与LDL亚组分水平呈正相关。
脂蛋白相关磷脂酶A2(LP-PLA2)是具有血管特异性的炎症标志物,LP-PLA2为动脉粥样硬化性心血管疾病,冠心病和缺血性卒中的独立危险因素标志物。LP-PLA2的检测能直接准确的反映血管内炎症的程度,并且它反映的是动态的变化,作为一个动态指标。Lp-PLA2是心脑血管恶性事件高特异性预测指标;反映粥样斑块的炎症程度,有效鉴别良性与恶性斑块;独立预测动脉粥样硬化引起的心脑血管栓塞性疾病;动态变化反应治疗效果,对心脑血管栓塞性疾病患者的临床疗法与疗效起辅助性指导。
半胱氨酸蛋白酶抑制剂(cysteine proteinase inhibitor,CPI)后被命名为胱抑素C。被称为γ-微量蛋白及γ-后球蛋白,广泛存在于各种组织的有核细胞和体液中,是一种低分子量、碱性非糖化蛋白质,分子量为13.3KD,由122个氨基酸残基组成,可由机体所有有核细胞产生,产生率恒定。循环中的胱抑素c仅经肾小球滤过而被清除,是一种反映肾小球滤过率变化的内源性标志物,并在近曲小管重吸收,但重吸收后被完全代谢分解,不返回血液,因此,其血中浓度由肾小球滤过率决定,而不依赖任何外来因素,如性别、年龄、饮食的影响,是一种反映肾小球滤过率变化的理想内源性标志物。胱抑素C用于肾脏疾病的早期诊断和病情监测,反应GFR的最理想内源标志物。胱抑素C(Cys-C)是迄今基本满足理想内源性肾小球滤过率(GFR)标志物要求的内源性物质,是新近发展起来的一种评估肾功能敏感性好、特异性高的指标。
D-二聚体(D-Dimer):最简单的纤维蛋白降解产物,其质量浓度的增加反映体内高凝状态和继发性纤溶亢进,主要应用在静脉血栓栓塞(VTE)、深静脉血栓形成(DVT)和肺栓塞(PE)的诊断。
肿瘤患者中高凝血状态是和组织因子依赖的外源性途径和非组织因子相关的肿瘤促凝作用有关,据大量文献表示D-二聚体浓度,并且可以作为肿瘤分期、预后等判断标准。
在肝脏疾病中,血浆D-二聚体的含量明显增高,且与肝病的严重程度呈正相关,原因是抗纤溶酶及AT—Ⅲ等由肝脏合成,肝病时其合成减少,造成纤溶亢进,在纤溶酶激活下纤维蛋白和纤维蛋白原降解,其降解产物D-二聚体等明显升高,D-二聚体的浓度可以作为一个判断肝脏受损程度的标志。
脓毒症是指由感染引起的全身炎症反应和免疫功能紊乱综合征,从本质上讲脓毒症是机体对感染性因素的一系列的病理生理反应,其中凝血系统异常是表现之一,在脓毒症患者中,炎症细胞激活,通过各种途径激活机体内凝血系统,随后人体产生抗凝物质启动纤溶系统,不同感染类型脓毒症患者血液D-二聚体的水平不相同,D-二聚体水平可以用来评价患者病情严重程度和预后,并对治疗效果的评价也可能存在作用。
但目前所使用的关于血清淀粉样蛋白A测定试剂盒无法同时具备检测限度低、操作简单和动态监测的功能。
目前,铁蛋白常用的检测方式有免疫法,比浊法,化学发光法,但是以上方法无法同时具备检测限度低、操作简单和动态监测的功能。
目前,髓过氧化物酶的常用检测方法有连续监测法、酶联免疫吸附法(ELISA)和流式细胞仪测定法,但是以上方法无法同时具备检测限度低、操作简单和动态监测的功能。
目前,Lp-PLA2的检测有活性法和浓度法两种。活性法主要采用高效液相色谱法、放射活度测定法和酶水解底物法等。高效液相色谱法灵敏度低,易受到血液中各种成分的干扰。放射活度测定法存在试剂的放射性污染、准确度低、重复性差等问题;酶水解底物法主要依靠进口试剂,存在成本高等问题。在临床上主要采用检测浓度的方法为ELISA法。但是上述方法无法同时具备检测限度低、操作简单和动态监测的功能。
目前,胱抑素C常用的检测方式有单向免疫扩散法(RID)、放射免疫法(RIA)、时间分辨荧光免疫法(TRFIA)、酶免疫测定法(EIA)、颗粒增强透射免疫比浊法(PETIA)、颗粒增强散射免疫比浊法(PENIA),但是现有技术无法同时具备检测限度低、操作简单和动态监测的功能。
目前,D-二聚体常用的检测方法有干式免疫散射色谱法、免疫比浊法和定量分析,但是上述方法无法同时具备检测限度低、操作简单和动态监测的功能。
发明内容
本发明为了解决现有技术中的缺陷,提供一种试剂盒,所述试剂盒包括:10ml顶层试剂、10ml底层试剂、10mlBSA溶液和10mLEDTA抗凝剂;
所述顶层试剂包括:金核银壳纳米棒底物、半胱胺修饰分子、戊二醛修饰分子、血清淀粉样蛋白A单克隆抗体和1×PBS缓冲液;
所述底层试剂包括:金核银壳纳米棒底物、4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑拉曼检测分子、戊二醛功能修饰分子;
所述BSA溶液的浓度为1%。
进一步地,所述试剂盒的制备方法包括:
(1)制备顶层试剂
(1.1)将拉曼检测分子乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动并离心,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入功能化修饰物溶液,温和摇动并离心,得到混合物二;
(1.3)将混合物二分散到血清淀粉样蛋白A检测抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后进行离心,去上清液,将沉淀分散到1×PBS缓冲液中,得到顶层试剂,在4℃的条件下保存;
(2)制备底层试剂
(2.1)使用半胱胺溶液对金核银壳纳米棒溶液进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)加入功能化修饰物溶液进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.1中得到的产物加入到血清淀粉样蛋白A捕获抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
进一步地,步骤(1.1)中所述拉曼检测分子为4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑拉曼检测分子,所述拉曼检测分子乙醇溶液的摩尔浓度为5mmol/L,用量为2μL;
所述金核银壳纳米棒溶液的用量为1mL;
所述温和摇动的时间为2h,所述离心的条件为7000rpm,10min。
进一步地,步骤(1.2)中所述去离子水的用量为1.0mL;
所述功能化修饰物溶液为戊二醛溶液,浓度为25%wt,用量为2μL;
所述温和摇动的时间为1.5h,所述离心的条件为6000rpm,10min。
进一步地,步骤(1.3)中所述血清淀粉样蛋白A检测抗体溶液为抗血清淀粉样蛋白A多克隆抗体溶液,浓度为9μg/mL in 1×PBS buffer,用量为1.0mL;
所述离心的条件为6000rpm,10min;
所述1×PBS缓冲液的用量为1.0mL。
进一步地,步骤(2.1)中所述半胱胺溶液的浓度为25mmol/L,用量为2μL。
进一步地,步骤(2.2)中所述功能化修饰物溶液为戊二醛溶液,浓度为25%wt,用量为2μL。
进一步地,步骤(2.3)中所述血清淀粉样蛋白A关脂质运载蛋白捕获抗体溶液为血清淀粉样蛋白A单克隆抗体溶液,浓度为20μg/mL in 1×PBS buffer,用量为2mL。
本发明的另一个方面在于提供一种利用试剂盒检测血清淀粉样蛋白A的方法,所述方法包括:
(a)阻断非特异性结合
首先,将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定血清淀粉样蛋白A
向步骤(a)处理后的底层试剂中滴加入200μL检测样本,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
进一步地,所述检测样品为全血、血浆或血清中的一种;
所述检测样品为全血时,检测前需要加入EDTA抗凝剂进行抗凝。
与现有技术相比较,本发明具有以下有益之处:
本发明提供了一种试剂盒采用顶层溶液-检测样品-衬底溶液的夹心结构,通过拉曼射线的照射,顶层溶液中拉曼检测分子形成强烈的光信号,弥补了现有技术中试剂盒的缺陷,可以同时实现操作简单,成本低廉,测定灵敏度高检测快速的目标。
附图说明
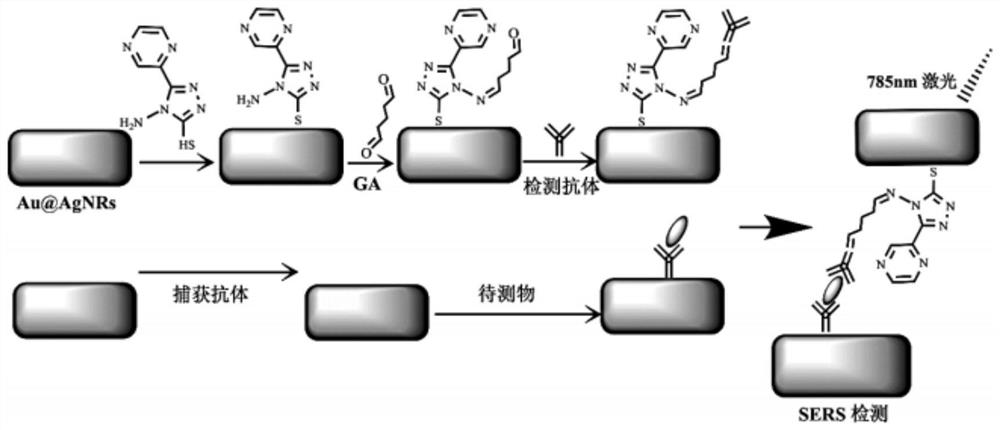
图1为本发明夹心免疫试剂盒结构形成的过程图。
图2为本发明第一个实施例中血清淀粉样蛋白的拉曼光谱。
图3为本发明第一个实施例中不同浓度水平血清淀粉样蛋白的拉曼光谱。
图4为本发明第二个实施例中铁蛋白的拉曼光谱。
图5为本发明第二个实施例中不同浓度水平铁蛋白的拉曼光谱。
图6为本发明第三个实施例中髓过氧化物酶的拉曼光谱。
图7为本发明第三个实施例中不同浓度水平髓过氧化物酶的拉曼光谱。
图8为本发明第四个实施例中人脂蛋白相关磷脂酶A2的拉曼光谱。
图9为本发明第四个实施例中不同浓度水平人脂蛋白相关磷脂酶A2的拉曼光谱。
图10为本发明第五个实施例中胱抑素C的拉曼光谱。
图11为本发明第五个实施例中不同浓度水平胱抑素C的拉曼光谱。
图12为本发明第六个实施例中D-二聚体的拉曼光谱。
图13为本发明第五个实施例中不同浓度水平D-二聚体的拉曼光谱。
具体实施方式
通过参考示范性实施例,本发明的目的和功能以及用于实现这些目的和功能的方法将得以阐明。然而,本发明并不受限于以下所公开的示范性实施例;可以通过不同形式来对其加以实现。说明书的实质仅仅是帮助相关领域技术人员综合理解本发明的具体细节。
在下文中,将参考附图描述本发明的实施例,在附图中,相同的附图标记代表相同或类似的部件,或者相同或类似的步骤。
实施例一。
如图1所示本发明夹心免疫试剂盒结构形成的过程图。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、血清淀粉样蛋白A夹心免疫检测试剂盒的制备
(1)制备顶层试剂
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的血清淀粉样蛋白A多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到顶层试剂,在4℃的条件下保存;
(2)制备底层试剂
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的血清淀粉样蛋白A单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到血清淀粉样蛋白A夹心免疫检测试剂盒的顶层试剂10mL和底层试剂10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图2所示本发明第一个实施例中血清淀粉样蛋白的拉曼光谱。使用实施例中血清淀粉样蛋白A夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的血清淀粉样蛋白A夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定血清淀粉样蛋白A
向步骤(a)处理后的2份底层试剂中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm
得到的拉曼光谱如图2所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图3所示本发明第一个实施例中不同浓度水平血清淀粉样蛋白的拉曼光谱。使用实施例中血清淀粉样蛋白A夹心免疫检测试剂盒对不同浓度血清淀粉样蛋白A进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的血清淀粉样蛋白A,得到1-6号样品。
然后,取6份实施例中的血清淀粉样蛋白A夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定血清淀粉样蛋白A
向步骤(a)处理后的6份底层试剂中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm范围内,曝光10s。
得到的拉曼光谱如图2所示,结果表明,拉曼强度随血清淀粉样蛋白A浓度的增强呈单调上升趋势,因此,本发明实施例中制备的血清淀粉样蛋白A夹心免疫检测试剂盒可以检测人血清淀粉样蛋白A的存在,且检测限度在fg级别。
实施例二。
本实施例利用夹心免疫试剂盒检测铁蛋白。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH4溶液现用现配,对混合溶液进行磁力搅拌,速度为1200rpm,搅拌2min,最后获得的种子溶液在30℃静置30min待用;
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl4溶液,在700rpm速度下搅拌90min,改变第二次磁力搅拌速度为400rpm,一边搅拌一边加入2.1ml 37wt%的HCl溶液,搅拌15min,最后加入1.25ml 0.064M的抗坏血酸溶液,进行第三次搅拌,搅拌速度为1200rpm,搅拌30s,得到生长液;
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、铁蛋白夹心免疫检测试剂盒的制备
(1)制备检测试剂
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的铁蛋白多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到检测试剂,在4℃的条件下保存;
(2)制备捕获试剂
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的铁蛋白单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到铁蛋白夹心免疫检测试剂盒的检测试剂10mL和捕获试剂10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图4所示本发明第二个实施例中铁蛋白的拉曼光谱。使用实施例中铁蛋白夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的铁蛋白夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将捕获试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定铁蛋白
向步骤(a)处理后的2份捕获试剂中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入检测试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图4所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图5所示本发明第二个实施例中不同浓度水平铁蛋白的拉曼光谱。使用实施例中铁蛋白夹心免疫检测试剂盒对不同浓度铁蛋白进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的铁蛋白,得到1-6号样品。
然后,取6份实施例中的铁蛋白夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将捕获试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定铁蛋白
向步骤(a)处理后的6份捕获试剂中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入检测试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图4所示,结果表明,拉曼强度随铁蛋白浓度的增强呈单调上升趋势,因此,本发明实施例中制备的铁蛋白夹心免疫检测试剂盒可以检测人铁蛋白的存在,且检测限度在fg级别。
实施例三。
本实施例利用一种夹心免疫试剂盒检测髓过氧化物酶(MPO)。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH4溶液现用现配,对混合溶液进行磁力搅拌,速度为1200rpm,搅拌2min,最后获得的种子溶液在30℃静置30min待用;
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl4溶液,在700rpm速度下搅拌90min,改变第二次磁力搅拌速度为400rpm,一边搅拌一边加入2.1ml 37wt%的HCl溶液,搅拌15min,最后加入1.25ml 0.064M的抗坏血酸溶液,进行第三次搅拌,搅拌速度为1200rpm,搅拌30s,得到生长液;
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、髓过氧化物酶(MPO)夹心免疫检测试剂盒的制备
(1)制备试剂一
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的髓过氧化物酶(MPO)多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到试剂一,在4℃的条件下保存;
(2)制备试剂二
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的髓过氧化物酶(MPO)单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到髓过氧化物酶(MPO)夹心免疫检测试剂盒的试剂一10mL和试剂二10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图6所示本发明第三个实施例中髓过氧化物酶的拉曼光谱。使用实施例中髓过氧化物酶(MPO)夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的髓过氧化物酶(MPO)夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将试剂二浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定髓过氧化物酶(MPO)
向步骤(a)处理后的2份试剂二中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入试剂一,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图6所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图7所示本发明第三个实施例中不同浓度水平髓过氧化物酶的拉曼光谱。使用实施例中髓过氧化物酶(MPO)夹心免疫检测试剂盒对不同浓度髓过氧化物酶(MPO)进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的髓过氧化物酶(MPO),得到1-6号样品。
然后,取6份实施例中的髓过氧化物酶(MPO)夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将试剂二浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定髓过氧化物酶(MPO)
向步骤(a)处理后的6份试剂二中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入试剂一,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图6所示,结果表明,拉曼强度随髓过氧化物酶(MPO)浓度的增强呈单调上升趋势,因此,本发明实施例中制备的髓过氧化物酶(MPO)夹心免疫检测试剂盒可以检测人髓过氧化物酶(MPO)的存在,且检测限度在fg级别。
实施例四
本实施例利用一种夹心免疫试剂盒检测人脂蛋白相关磷脂酶A2(LP-PLA2)。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH4溶液现用现配,对混合溶液进行磁力搅拌,速度为1200rpm,搅拌2min,最后获得的种子溶液在30℃静置30min待用;
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl4溶液,在700rpm速度下搅拌90min,改变第二次磁力搅拌速度为400rpm,一边搅拌一边加入2.1ml 37wt%的HCl溶液,搅拌15min,最后加入1.25ml 0.064M的抗坏血酸溶液,进行第三次搅拌,搅拌速度为1200rpm,搅拌30s,得到生长液;
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒的制备
(1)制备顶层试剂
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的人脂蛋白相关磷脂酶A2(LP-PLA2)多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到顶层试剂,在4℃的条件下保存;
(2)制备底层试剂
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的人脂蛋白相关磷脂酶A2(LP-PLA2)单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒的顶层试剂10mL和底层试剂10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图8所示本发明第四个实施例中人脂蛋白相关磷脂酶A2的拉曼光谱。使用实施例中人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定人脂蛋白相关磷脂酶A2(LP-PLA2)
向步骤(a)处理后的2份底层试剂中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图8所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图9所示本发明第四个实施例中不同浓度水平人脂蛋白相关磷脂酶A2的拉曼光谱。使用实施例中人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒对不同浓度人脂蛋白相关磷脂酶A2(LP-PLA2)进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的人脂蛋白相关磷脂酶A2(LP-PLA2),得到1-6号样品。
然后,取6份实施例中的人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定人脂蛋白相关磷脂酶A2(LP-PLA2)
向步骤(a)处理后的6份底层试剂中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以785nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图8所示,结果表明,拉曼强度随人脂蛋白相关磷脂酶A2(LP-PLA2)浓度的增强呈单调上升趋势,因此,本发明实施例中制备的人脂蛋白相关磷脂酶A2(LP-PLA2)夹心免疫检测试剂盒可以检测人人脂蛋白相关磷脂酶A2(LP-PLA2)的存在,且检测限度在fg级别。
实施例五。
本实施例利用一种夹心免疫试剂盒检测胱抑素C(Cys-C)。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH4溶液现用现配,对混合溶液进行磁力搅拌,速度为1200rpm,搅拌2min,最后获得的种子溶液在30℃静置30min待用;
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl4溶液,在700rpm速度下搅拌90min,改变第二次磁力搅拌速度为400rpm,一边搅拌一边加入2.1ml 37wt%的HCl溶液,搅拌15min,最后加入1.25ml 0.064M的抗坏血酸溶液,进行第三次搅拌,搅拌速度为1200rpm,搅拌30s,得到生长液;
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、胱抑素C(Cys-C)夹心免疫检测试剂盒的制备
(1)制备顶层试剂
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的胱抑素C(Cys-C)多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到顶层试剂,在4℃的条件下保存;
(2)制备底层试剂
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的胱抑素C(Cys-C)单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到胱抑素C(Cys-C)夹心免疫检测试剂盒的顶层试剂10mL和底层试剂10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图10所示本发明第五个实施例中胱抑素C的拉曼光谱。使用实施例中胱抑素C(Cys-C)夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的胱抑素C(Cys-C)夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定胱抑素C(Cys-C)
向步骤(a)处理后的2份底层试剂中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以570nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图10所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图11所示本发明第五个实施例中不同浓度水平胱抑素C的拉曼光谱。使用实施例中胱抑素C(Cys-C)夹心免疫检测试剂盒对不同浓度胱抑素C(Cys-C)进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的胱抑素C(Cys-C),得到1-6号样品。
然后,取6份实施例中的胱抑素C(Cys-C)夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定胱抑素C(Cys-C)
向步骤(a)处理后的6份底层试剂中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以570nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图10所示,结果表明,拉曼强度随胱抑素C(Cys-C)浓度的增强呈单调上升趋势,因此,本发明实施例中制备的胱抑素C(Cys-C)夹心免疫检测试剂盒可以检测人胱抑素C(Cys-C)的存在,且检测限度在fg级别。
实施例六。
本实施例利用一种夹心免疫试剂盒检测D-二聚体。本实施例提供一种夹心免疫检测试剂盒的制备方法,该方法包括以下步骤:
一、金核银壳纳米棒的制备
1、金纳米棒的制备
1)在20mL的玻璃瓶中将0.1mL浓度为25mM HAuCl4溶液用去离子水稀释至5mL,向稀释液中加入5mL 0.2M的CTAB溶液,得到溶液一;
2)将0.6mL0.01 M的NaBH4溶液快速注入溶液一中,NaBH4溶液现用现配,对混合溶液进行磁力搅拌,速度为1200rpm,搅拌2min,最后获得的种子溶液在30℃静置30min待用;
3)将7.0g CTAB和1.234g油酸钠溶解于水中250mL 50℃水中,自然冷却到30℃,然后加入18ml,4.0mM的硝酸银溶液,保温1min,得到溶液二;
4)一边磁力搅拌一边向溶液二中注射250ml 1.0mM的HAuCl4溶液,在700rpm速度下搅拌90min,改变第二次磁力搅拌速度为400rpm,一边搅拌一边加入2.1ml 37wt%的HCl溶液,搅拌15min,最后加入1.25ml 0.064M的抗坏血酸溶液,进行第三次搅拌,搅拌速度为1200rpm,搅拌30s,得到生长液;
5)将0.4mL种子溶液注入生长液中1500rpm速度下搅拌30s,最后,将混合液在30℃条件下静置10h,将静置后的混合液在8000r/min的速度速度下离心10min,收集沉淀物,将沉淀物分散于80mM的CTAC溶液中;
6)将步骤5)重复三次,将所述得沉淀物储存在CTAC溶液中,得到金纳米棒溶液
2、金核银壳纳米棒的制备
将0.5mL金纳米棒溶液用水稀释至4ml,向稀释液中加入2.5ml 10mM的硝酸银溶液,在1000Hz频率下超声波处理2min,后加入2.5ml 0.1M的抗坏血酸溶液,经65℃水浴保存4h、8000r/min离心10min,收集沉淀物分散到1ml去离子水中,得到金核银壳纳米棒悬浮液。
二、D-二聚体夹心免疫检测试剂盒的制备
(1)制备顶层试剂
(1.1)将2μL浓度为5mmol/L的4-氨基-3-巯基-5-吡嗪-4(H)-1,2,4-三唑乙醇溶液加入到金核银壳纳米棒溶液中,温和摇动2h,在7000rpm条件下离心10min,去上清液,得到混合物一;
(1.2)将混合物一分散到去离子水中,加入2μL浓度为25%wt的戊二醛溶液,温和摇动1.5h,在6000rpm条件下离心10min,得到混合物二;
(1.3)将混合物二分散到1.0mL浓度为9.0μg/mL in 1×PBS buffer的D-二聚体多克隆抗体溶液中得到混合溶液,将混合溶液在4℃条件下保存12h,然后在6000rpm条件下离心10min,去上清液,将沉淀分散到1mL1×PBS缓冲液中,得到顶层试剂,在4℃的条件下保存;
(2)制备底层试剂
(2.1)将2μL浓度为25mmol/L的半胱胺溶液加入到1.0mL金核银壳纳米棒溶液中,对其进行氨基功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.2)再加入2μL浓度为25mmol/L的戊二醛溶液对其进行功能化处理,处理后用纯净水冲洗,氮气干燥;
(2.3)将步骤2.2中得到的产物加入到2mL浓度为20μg/mL in 1×PBS buffer的D-二聚体单克隆抗体溶液中,在4℃下培育12小时,然后用纯净水冲洗,氮气干燥。
通过以上方法制备得到D-二聚体夹心免疫检测试剂盒的顶层试剂10mL和底层试剂10mL,此外,试剂盒中还提供10mL浓度为1%的BSA溶液。
如图12所示本发明第六个实施例中D-二聚体的拉曼光谱。使用实施例中D-二聚体夹心免疫检测试剂盒对患者血清进行检测。
首先,获取10mL患者血清作为测试样品,然后以10mL小牛血清作为空白样品,然后,取2份实施例中的D-二聚体夹心免疫检测试剂盒按照以下步骤操作:
a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定D-二聚体
向步骤(a)处理后的2份底层试剂中分别滴加入200μL测试样品和空白样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)光谱采集
以570nm激光为激发光源,使用20倍物镜在徕卡显微镜上对上述2份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图12所示,结果表明,在测试样品的拉曼光谱曲线中1013cm
如图13所示本发明第五个实施例中不同浓度水平D-二聚体的拉曼光谱。使用实施例中D-二聚体夹心免疫检测试剂盒对不同浓度D-二聚体进行检测。
首先,制备6份样品,在6份小牛血清中分别加入浓度为1ng/mL、10pg/mL、100fg/mL、1fg/mL、0.1fg/mL和0fg/mL的D-二聚体,得到1-6号样品。
然后,取6份实施例中的D-二聚体夹心免疫检测试剂盒按照以下步骤操作:
(a)阻断非特异性结合
将底层试剂浸入BSA溶液中1h,阻断非特异性结合活性位点,然后用纯净水冲洗,氮气干燥;
(b)固定D-二聚体
向步骤(a)处理后的6份底层试剂中分别滴加入200μL1-6号样品,在温室中培育1h,然后用纯净水冲洗,氮气干燥;
(c)形成夹心结构
步骤(b)氮气干燥后,加入顶层试剂,在温室中20min,培育完成后用纯净水冲洗,再用氮气干燥,得到夹心结构。
(d)表面增强拉曼光谱采集
以570nm激光为激发光源进行表面增强拉曼光谱检测,使用20倍物镜在徕卡显微镜上对上述6份样品进行拉曼光谱采集,光谱在800-1800cm-1范围内,曝光10s。
得到的拉曼光谱如图12所示,结果表明,拉曼强度随D-二聚体浓度的增强呈单调上升趋势,因此,可以根据试验例1和试验例2的结果得出,本发明实施例中制备的D-二聚体夹心免疫检测试剂盒可以检测人D-二聚体的存在,且检测限度在fg级别。
结合这里披露的本发明的说明和实践,本发明的其他实施例对于本领域技术人员都是易于想到和理解的。说明和实施例仅被认为是示例性的,本发明的真正范围和主旨均由权利要求所限定。
- 一种ELISA试剂盒包被板用稳定剂及其制备方法、试剂盒包被板、试剂盒
- 一种试剂盒、试剂盒的制备方法及利用该试剂盒实现的外周血甘氨胆酸的检测方法
