超高剂量率辐射和治疗剂的使用方法
文献发布时间:2023-06-19 10:06:57
本申请要求于于2019年7月19日提交的题为“Methods of Use of Ultra-HighDose Rate Radiation and Therapeutic Agents”的美国临时申请No.62/700,783的优先权,其全部内容出于所有目的通过引用并入本文。
背景技术
辐射疗法是针对癌症患者的关键治疗方式。辐射可以以亚毫米的精度递送到肿瘤,同时大部分不影响正常组织,最终导致肿瘤细胞被杀死。然而,肿瘤细胞逃避辐射的细胞杀伤效果和/或发展抗性机制的能力可以抵消放射疗法的肿瘤细胞杀伤作用,潜在地限制了辐射疗法治疗癌症的治疗效果。此外,针对正常组织毒性的潜力可能影响辐射疗法作为治疗模式的治疗窗口。
辐射诱导的肿瘤细胞死亡导致从裂解细胞释放肿瘤抗原,增加了抗原呈递细胞上的MHC-1表达,并且增加了肿瘤内T细胞群体的多样性。这些因素和其他因素是启动人体自身免疫系统的激活以消除癌细胞的关键。正在探索免疫调节剂来激活人体自身的免疫系统,但是已知其具有单一疗法的局限性(例如,患者的反应率)。在用作单一疗法时免疫调节剂的反应率在靶标患者群体的20%至30%的范围内。由于全身正常组织毒性,诸如使用两种免疫调节剂或具有靶向抗癌药的免疫调节剂的组合方法具有局限性。
发明内容
与常规RT相比,用超高剂量率辐射(例如,FLASH RT)治疗肿瘤可以通过在维持肿瘤毒性的同时降低正常组织副作用来改善治疗窗口。可以通过增加剂量率或通过限制正常组织暴露于辐射的时间,来减少正常组织的副作用。可以通过多个离散场或电离辐射的连续旋转递送来强制增加的治疗窗口。对正常组织的副作用的减少还可以允许肿瘤中的剂量增加,从而导致增强的肿瘤杀死和控制。
常规辐射诱导可以抵消辐射的肿瘤细胞杀伤作用的基质、免疫和血管变化。出乎意料地发现,FLASH辐照对微环境的影响不同,最终导致具有更多或提高的免疫能力的肿瘤环境。结果,FLASH辐照与治疗剂相结合可以增加肿瘤细胞的杀伤,同时使正常组织毒性最小化。在一些实施例中,治疗剂是免疫调节剂、抗衰老剂、辐射敏化剂和/或纳米颗粒。
采用了多种机制来促进肿瘤微环境中的免疫抑制,包括但不限于调节性T细胞(Tregs)、肿瘤相关巨噬细胞(TAMs)和骨髓来源的抑制性细胞(MDSCs)的募集。另外,诸如转化(或肿瘤)生长因子β(TGF-beta)和IL-10等抗炎成分抑制细胞毒性T细胞(CTL)的溶细胞活性。TAM和MDSC通过产生消耗掉L-精氨酸(一种T细胞功能必需的营养物质)的精氨酸酶和一氧化氮来修改肿瘤微环境的代谢环境。此外,异常的肿瘤血管生成导致缺氧,这发起免疫抑制性骨髓细胞的募集。抑制性骨髓细胞生成活性氧和氮物质,其修改淋巴器官和肿瘤本身中细胞毒性淋巴细胞(CTL)的受体,从而影响CTL归巢于肿瘤并且杀死肿瘤细胞的能力。
当利用FLASH RT治疗患者时,免疫抑制性微环境没有机会充分发育。在严重限制免疫抑制性肿瘤微环境的情况下,对垂死的肿瘤细胞的免疫反应将增强,这最终将改善肿瘤细胞杀伤。
在免疫抑制性微环境中起作用的其他因素包括可以形成M1-M2表型转化的肿瘤浸润巨噬细胞,M1-M2表型转化可以影响肿瘤细胞的杀死。这些效果在FLASH RT的情况下看不到。FLASH RT的另一益处是,它使循环免疫细胞免于辐射诱导的毒性,从而提高了免疫相关的肿瘤细胞杀伤作用。
当将治疗剂与FLASH辐射相结合来治疗癌症患者时,本文中描述的方法提供了抗肿瘤功效和正常组织保护的双重益处。本文中描述的方法可以用于通过FLASH辐射疗法治疗局部和转移性癌症,以向肿瘤递送高适形剂量、和免疫调节剂。这种联合疗法具有改善局部和全身辐射疗法的功效以及免疫调节剂的功效,同时最小化对正常组织的毒性。
质子在其路径的尽头最密集地沉积能量,这种机制已经被利用来在癌症辐射疗法中具有优势(Jones等人的2006年的British Journal of Radiotherapy、2009年的JakelRadiat Protection Dosimetry)。吸收的剂量根据渗透深度而变化的特性图在粒子停止之前的位置处具有最大值,从而支持在特定深度对肿瘤进行治疗性定向。与之相比,用于电子/光子束放射疗法的剂量沉积在组织(例如,皮肤)的入口表面附近最大,随后随组织深度呈指数减小。由于这些物理特性,质子疗法允许在深部肿瘤中的高剂量沉积。
发明人令人惊讶地确定,质子能量沉积的出乎意料的优点不仅取决于递送到靶标的绝对剂量,还取决于用于递送剂量的剂量率(速度)。出乎意料的是,观察到依赖于质子剂量率的生物学,例如当质子以不同的剂量率被递送时,不同的生物通路被激活。质子沉积的剂量率依赖特性对包括剂量率依赖性联合疗法在内的癌症疗法和新型治疗选项的发展具有重要意义。
因此,在一个方面,本文中提供了一种用于治疗患有癌症的受试者的肿瘤的方法,该方法包括向肿瘤施用有效量的超高剂量率(FLASH)辐射和治疗剂。在一些实施例中,与向肿瘤施用常规辐射(例如,0.5Gy/秒的剂量)相比,该方法减少了对正常组织的损害。在一些实施例中,与施用常规辐射相比,皮炎、肺纤维化或淋巴细胞凋亡减少。
在一些实施例中,以等于或大于40Gy/sec的剂量率来施用FLASH辐射,或者以1秒或更短的时间施用剂量。在一些实施例中,以单个脉冲或多个脉冲来施用FLASH辐射。在一些实施例中,FLASH辐射包括质子或由质子组成。在一些实施例中,FLASH辐射不包括电子。
在一些实施例中,治疗剂是免疫调节剂、辐射敏化剂、或纳米颗粒。
在一些实施例中,治疗剂是有丝分裂纺锤体抑制剂、DNA损伤修复和反应抑制剂、MAPK通路抑制剂、上皮到间质(EMT)抑制剂、T辅助1型(TH1)淋巴细胞的激活剂、PTEN通路的激活剂和TGF-β通路的抑制剂、1型干扰素信号通路的激活剂、树突状细胞成熟的激活剂、CD47/SIRP-α的抑制剂、或芳烃受体(ahR)的抑制剂。
在一些实施例中,有丝分裂纺锤体抑制剂选自CDK4/6抑制剂、AURKA抑制剂、TPX2-AURKA复合抑制剂、或紫杉烷。
在一些实施例中,DNA损伤修复和反应抑制剂选自:PARP抑制剂,RAD51抑制剂,或选自CHCK1、ATM或ATR的DNA损伤反应激酶的抑制剂。
在一些实施例中,MAPK通路抑制剂是EGFR、MEK、BRAF或ERK的抑制剂。
在一些实施例中,EMT抑制剂是选自结合TGF-β的化合物、小分子、抗体或其片段的TGFβ通路抑制剂。
在一些实施例中,T辅助1型(TH1)淋巴细胞的激活剂是细胞因子、toll样受体激动剂、STAT3调节剂、衍生自灭活细菌/或寄生虫(包括但不限于单核细胞增生性李斯特菌、大利什曼原虫和弓形虫、结核分枝杆菌)或其触发干扰素γ或IL-12产生的化合物的衍生物、肠葡萄球菌肠毒素B、和在体内激活Th1反应的未甲基化的CpG核苷酸、或基因治疗系统,基因治疗系统包括当在肿瘤部位处被注射时导致IL2、IL-12和IFN-γ的产生的基于细菌或病毒的基因表达系统。
在一些实施例中,PTEN通路的激活剂选自mTOR抑制剂,该mTOR抑制剂选自雷帕霉素、坦西罗莫司、依维莫司、西罗莫司或AP-2357、乌布利昔单抗、利妥昔单抗、舒尼替尼(诱导PTEN)、曲妥珠单抗和帕妥珠单抗(通过Src抑制来增加PTEN)、抵抗素(p38MAPK调节剂,增加PTEN)、辛伐他汀(NF0-kB抑制剂)、洛伐他汀和罗格列酮(PPAR-γ调节剂)、NVP-AEW541(增加PTEN的IGF-1R调节剂)和PP1除草霉素(Src抑制剂)(参见,例如Boosani等人的ExpertOpm Ther Pat.2013年5月,23(5),569-580)。
在一些实施例中,TGF-β通路的抑制剂选自结合TGF-β的化合物、小分子、抗体或其片段。
在一些实施例中,1型干扰素信号通路的激活剂是STING激动剂、Toll样受体(TLR)激动剂、或MAVS激动剂。
在一些实施例中,树突状细胞成熟的激活剂是合成肽疫苗。在一些实施例中,CD47/SIRP-α的抑制剂选自抗体或其片段、或抑制CD47/DSIRP-α相互作用的小分子化合物。
在一些实施例中,纳米颗粒具有高有效原子序数,或者包含金或钆。
在一些实施例中,ahR抑制剂是SR1、CH-223191、UM729或高良姜素。
在一些方面,本文中提供了一种用于治疗患有癌症的受试者的肿瘤的方法,该方法包括向肿瘤施用电离FLASH辐射和免疫调节剂,其中免疫调节剂选自由以下项组成的组:对抑制性检查点分子的抑制剂、刺激性检查点分子的激活剂、趋化因子抑制剂、巨噬细胞迁移抑制性因子(MIF)的抑制剂、生长因子、细胞因子、白介素、干扰素、与免疫系统细胞结合的抗体、细胞免疫调节剂、疫苗、溶瘤病毒及其任何组合。意外发现,当与FLASH辐射组合时免疫调节剂的施用增加了抗肿瘤反应。
在一些实施例中,对抑制性检查点分子的抑制剂是小分子药物或者抗体或其片段,其与抑制性检查点分子特异性结合并且抑制其活性,其中抑制性检查点分子选自由以下项组成的组:PD-1、PD-L1、PD-L2、CTLA-4、BTLA、A2aR、B7-H2、B7-H3、B7-H4、B7-H6、CD47、CD48、CD160、CD244(2B4)、CHK1、CHK2、CGEN-15049、ILT-2、ILT-4、LAG-3、VISTA、gp49B、PIR-B、TIGIT、TIM1、TIM2、TIM3、TIM4和KIR及其配体。在一些实施例中,刺激性检查点分子的激活剂是小分子药物、基于多肽的激活剂、或基于多核苷酸的激活剂,其与刺激性检查点分子特异性结合并且增加其活性,其中刺激性检查点分子选自由以下项组成的组:B7-1(CD80)、B7-2(CD86)、4-1BB(CD137)、OX-40(CD134)、HVEM、可诱导共刺激分子(ICOS)、糖皮质激素诱导的肿瘤坏死因子受体(GITR)、CD27、CD28、CD40及其配体。在某些情况下,趋化因子抑制剂是小分子药物或者抗体或其片段,其与趋化因子(或其受体)特异性结合并且抑制趋化因子活性。在一些实施例中,趋化因子选自由以下项组成的组:CCL2、CCL3、CCL4、CCL5、CCL7、CCL8、CCL11、CCL12、CCL13、CCL14、CCL15、CCL16、CCL17、CCL18、CCL19、CCL20、CCL21、CCL22、CCL23、CCL24、CCL5、CCL26、CCL27、CCL28、CXCL1、CXCL2、CXCL3、CXCL4、CXCL5、CXCL6、CXCL7、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CXCL13、CXCL14、CXCL5和CXCL16。在一些实施例中,趋化因子抑制剂与选自由以下项组成的组的趋化因子受体相结合:CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CCR10、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6和CXCR7。在一些情况下,MIF的抑制剂是与MIF特异性结合并且抑制MIF活性的小分子药物或抗体或其片段。
在一些方面,本文中提供了一种用于治疗患有癌症的受试者的肿瘤的方法,该方法包括对肿瘤施用FLASH辐射和免疫调节剂。在一些实施例中,免疫调节剂可以是以CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8、CD68、TGFβ、TGFβ通路相关生物标志物或其任何组合为靶标(targeting)的抗体或抗体片段。
本文中还提供了用于治疗肿瘤的改良方法,方法包括向患有癌症的受试者施用免疫调节剂和FLASH辐射。与免疫调节剂单一疗法或常规辐射单一疗法相比,这种联合疗法可以引起增加的抗癌反应。
与FLASH相结合的免疫调节剂包括但不限于检查点抑制剂、共刺激剂、调节腺苷通路或STING(刺激干扰素基因)通路的广泛免疫调节剂、以免疫细胞抗原和癌症抗原两者为靶标的双特异性抗体、和细胞治疗方法(例如,嵌合抗原受体(CAR)治疗)。
在一些实施例中,通过作为伴随的佐剂或新佐剂过程将FLASH RT与免疫治疗剂的递送相结合来增强FLASH RT的积极作用。因此,当与免疫调节剂相结合使用时,本文中描述的FLASH RT的免疫调节性质可以得到增强并且为需要治疗的患者或受试者提供进一步的益处。FLASH RT和免疫疗法的结合可以并入辐射治疗计划以及治疗本身中。
本文中描述的FLASH RT和免疫调节剂的结合也可以与个性化药物治疗方案相结合。因此,在一些实施例中,该方法包括检测一种或多种生物标志物在受试者中的表达。在一些实施例中,一种或多种生物标志物选自CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8、CD68、ΤGFβ、TGFβ通路相关生物标志物或其任何组合。在一些实施例中,方法包括放射组学信息,诸如肿瘤表型。在一些实施例中,方法包括功能成像信息,包括但不限于PET、SPECT和fMRI。
在一些方面,本文中提供了一种用于治疗患有癌症的受试者内的肿瘤的方法,该方法包括向肿瘤施用电离FLASH辐射和免疫调节剂。该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;(b)将一种或多种生物标志物的表达水平与正常组织样本中的一种或多种生物标志物的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比肿瘤样本中的一种或多种生物标志物的表达水平被修改,则向受试者内的肿瘤施用包括电离FLASH辐射和免疫调节剂的治疗。生物标志物可以是CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8、CD68、TGFβ、TGFβ通路相关生物标志物、或其任何组合。
在某些方面,本文中提供了一种将患有癌症的受试者标识为用于包括电离FLASH辐射和免疫调节剂的治疗的候选方的方法,例如体外方法。该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物、(多个)成像标志物及其任何组合;(b)将一种或多种生物标志物的表达水平与正常组织样本中的一种或多种生物标志物的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比肿瘤样本中的一种或多种生物标志物的表达水平被修改,则将受试者分类为用于包括电离FLASH辐射和免疫调节剂的治疗的候选方。生物标志物可以是CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8、CD68、ΤGFβ、TGFβ通路相关生物标志物、或其任何组合。
在其他方面,本文中提供了一种针对患有癌症的受试者选择治疗的方法,例如体外方法。该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;(b)将一种或多种生物标志物的表达水平与正常组织样本中一种或多种生物标志物的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比肿瘤样本中的一种或多种生物标志物的表达水平被修改,则选择包括电离FLASH辐射和免疫调节剂的治疗。生物标志物可以是CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8、CD68、TGFβ、TGFβ通路相关生物标志物、或其任何组合。
在一些实施例中,如果相对于正常或对照样本中的表达水平,CD44的表达水平升高和/或MFG-E8的表达水平降低,则向受试者施用电离FLASH辐射和/或包括电离FLASH辐射和免疫调节剂的联合疗法。在一些实施例中,如果相对于正常或对照样本中的表达水平,CD44的表达水平升高和/或MFG-E8的表达水平降低,则向受试者施用的电离FLASH辐射的量和/或免疫调节剂的量增加。另一方面,如果相对于正常或对照组织样本中的表达水平,CD44的表达水平降低和/或MFG-E8的表达水平升高,则向受试者施用的电离FLASH辐射的量和/或免疫调节剂的量可以减少。
在一些实施例中,(a)如果相对于正常或对照样本中的表达水平,CD44的表达水平升高和/或MFG-E8的表达水平降低,则包括电离FLASH辐射和免疫调节剂的治疗被选择;(b)如果相对于正常或对照样本中的表达水平,CD44的表达水平升高和/或MFG-E8的表达水平降低,则增加所选择的电离FLASH辐射的量和/或免疫调节剂的量;并且(c)如果相对于正常或对照组织样本中的表达水平,CD44的表达水平降低和/或MFG-E8的表达水平升高,则减少所选择的电离FLASH辐射的量和/或免疫调节剂的量。
在一些实施例中,如果相对于正常或对照组织样本中的表达水平,CD68的表达水平增加,则向受试者施用电离FLASH辐射和/或包括电离FLASH辐射和免疫调节剂的联合疗法。在一些实施例中,如果相对于正常或对照组织样本中的表达水平,CD68的表达水平增加,则向受试者施用的电离FLASH辐射的量和/或免疫调节剂的量增加。另一方面,如果相对于正常或对照组织样本中的表达水平,CD68的表达水平降低,则可以减少向受试者施用的电离FLASH辐射的量和/或免疫调节剂的量。
在一些实施例中,(a)如果相对于正常或对照组织样本中的表达水平,CD68的表达水平升高,则包括电离FLASH辐射和免疫调节剂的治疗被选择;(b)如果相对于正常或对照组织样本中的表达水平,CD68的表达水平升高,则增加所选择的电离FLASH辐射的量和/或免疫调节剂的量;(c)如果相对于正常或对照组织样本中的表达水平,CD68的表达水平升高,则可以减少所选择的电离FLASH辐射的量和/或免疫调节剂的量。
在一些方面,本文中提供了将FLASH辐射和治疗剂用于治疗受试者内的肿瘤的用途。在一些实施例中,用途包括电离FLASH辐射和治疗剂的组合,治疗剂选自本文中描述的免疫调节剂、抗衰老剂和/或本文中描述的辐射敏化剂。
在另一方面,本公开提供了一种用于在治疗患有癌症的受试者内的肿瘤的方法中使用的治疗剂,其特征在于,该方法包括向肿瘤施用FLASH辐射和治疗剂。在一些实施例中,提供了一种用于在治疗癌症或肿瘤中使用的与超高剂量率(FLASH)辐射相结合的治疗剂。
在另一方面,本公开提供了一种用于在治疗患有癌症的受试者内的肿瘤的方法中使用的治疗剂,其特征在于,该治疗剂与FLASH辐射相结合施用。
在另一方面,本公开提供了一种用于在治疗患有癌症的受试者内的肿瘤的方法中使用的治疗剂,其中该治疗剂被施用到由上述FLASH辐射引起的提高的免疫能力的肿瘤环境。
在另一方面,本公开提供了一种用于在治疗患有癌症的受试者内的肿瘤的方法中使用的刺猬拮抗剂,其特征在于该刺猬拮抗剂与FLASH辐射相结合施用。
在另一方面,本文中提供了一种用于在治疗患有癌症的受试者内的肿瘤的方法中使用的治疗剂,其特征在于,该方法包括:
(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;
(b)将一种或多种生物标志物的表达水平与正常组织样本中的一种或多种生物标志物的表达水平进行比较;以及
(c)如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物的表达水平被修改,则向受试者内的肿瘤施用包括电离FLASH辐射和治疗剂的治疗。
在另一方面,描述了一种用于治疗受试者内的肿瘤的方法,该方法包括:
i)在肿瘤微环境或来自受试者的肿瘤样本中检测本文中描述的生物标志物的表达,以及
ii)向受试者施用有效量的FLASH辐射和治疗剂,从而治疗肿瘤。
在一些实施例中,将本文中描述的(多个)生物标志物的表达水平与在受试者内的正常或对照(例如,非肿瘤)组织中检测到的表达水平进行比较。
在另一方面,描述了一种用于治疗受试者内的肿瘤的方法,该方法包括:
i)使来自受试者的肿瘤样本与本文中描述的结合生物标志物的抗体相接触;
ii)检测肿瘤样本中的生物标志物的修改后的表达,以及
iii)向受试者施用有效量的FLASH辐射和治疗剂,从而治疗肿瘤。
在一些实施例中,修改后的生物标志物表达包括生物标志物的增加和/或降低的表达水平。在一些实施例中,生物标志物选自由以下项组成的组:CD44、MMP9、ALDH1A1、波形蛋白、透明质酸、β连环蛋白、MFG-E8和CD68。在一些实施例中,生物标志物CD68的表达水平在肿瘤环境或肿瘤样本中增加。在一些实施例中,生物标志物CD44的表达水平在肿瘤环境或肿瘤样本中增加。在一些实施例中,在肿瘤环境中或肿瘤样本中,生物标志物CD44的表达水平增加,而MFG-E8的表达水平降低。
在一些实施例中,该方法还包括在正常组织样本中检测本文中描述的生物标志物的表达水平。在一些实施例中,利用与(多个)生物标志物结合的抗体来检测生物标志物的表达水平。
在另一方面,提供了一种辐射治疗系统。在一些实施例中,辐射治疗系统为需要其的受试者或患者提供辐射治疗。在一些实施例中,辐射治疗系统还包括利用与辐射治疗协同的治疗剂来治疗患者的免疫疗法系统。在一些实施例中,辐射治疗是FLASH RT。
在另一方面,描述了一种辐射治疗计划系统,该辐射治疗计划系统可操作用于生成辐射治疗计划,该辐射治疗计划还包括与辐射治疗协同被执行的免疫疗法。在一些实施例中,辐射治疗是FLASH RT。
在另一方面,描述了一种非瞬态计算机可读存储介质,该非瞬态计算机可读存储介质具有计算机可执行指令,该计算机可执行指令用于使得计算系统执行用于与所描述的治疗剂相结合来治疗肿瘤的超高剂量率(FLASH)辐射治疗计划的方法。在一些实施例中,上述方法包括使用与利用治疗剂对肿瘤的治疗有关的信息来调整射束参数。
在一些实施例中,提供了一种非瞬态计算机可读存储介质,该非瞬态计算机可读存储介质具有计算机可执行指令,计算机可执行指令用于使得计算系统执行用于与治疗剂相结合来治疗肿瘤的超高剂量率(FLASH)辐射治疗计划的方法。该方法包括:
从计算系统的存储器中访问参数的值,其中参数包括要被引导到靶标中的子体积中的射束的方向和射束的射束能量;
访问指定辐射治疗计划的限制的信息,其中该限制基于剂量阈值并且包括对靶标外部的每个子体积的照射时间的限制:
其中指定限制的信息包括关于利用治疗剂治疗肿瘤的信息;以及
调整影响将要由射束递送的剂量的所计算的量的参数的值,直到子体积的相应总值之间的差满足阈值。
在一些实施例中,处于靶标中的射束的每个部分被表示为纵向射束区域的相应集合,并且其中该方法还包括:
针对射束区域中的每个射束区域,计算要由射束区域递送的剂量的量,并且向射束区域分配与该量相对应的值;以及
针对子体积中的每个子体积,通过将到达子体积的每个射束的每个射束区域的值相加来计算针对该子体积的总值;其中上述调整还包括调整影响要由射束区域递送的剂量的所计算的量的参数,直到子体积的相应总值之间的差满足阈值。
在一些实施例中,上述调整还包括:
确定射束是否在靶标外部与任何其他射束重叠;以及
根据有多少其他射束在靶标外部与该射束重叠,来对射束的射束段的射束强度进行加权。
在一些实施例中,该方法还包括执行针对靶标外部子体积的剂量计算,其中上述执行剂量计算包括:
访问用于靶标外部子体积的剂量计算因子的值,其中根据有多少射束到达靶标外部子体积来确定剂量计算因子的值;
计算靶标外部子体积的剂量;以及
将剂量计算因子的值应用于针对靶标外部子体积而计算的剂量。
在一些实施例中,如果仅一个射束到达外部靶标子体积,则剂量计算因子减小针对靶标外部子体积而计算的剂量。
在一些实施例中,限制选自由以下项组成的组:对靶标中的每个子体积的照射时间的限制;对靶标中的每个子体积的剂量率的限制;以及对靶标外部的每个子体积的剂量率的限制。
在一些实施例中,剂量阈值还取决于组织类型。
在一些实施例中,射束包括选自由以下项组成的组的射束类型:质子;电子;光子;原子核和离子。
在另一方面,描述了一种辐射治疗计划的计算机实现的方法,该辐射治疗计划用于与治疗剂相结合来治疗肿瘤。在一些实施例中,该方法包括确定用于超高剂量率(FLASH)辐射的射束参数,该方法使用基于肿瘤对治疗剂的反应的指定剂量。
在一些实施例中,辐射治疗计划的计算机实现的方法包括:
确定要被递送到肿瘤靶标中和要跨肿瘤靶标被递送的超高剂量率(FLASH)辐射的指定剂量,其中指定剂量是基于肿瘤对治疗剂的反应来确定的;
访问参数的值,参数包括要被引导到靶标中的子体积中的多个射束中的射束的数目、多个射束的方向、以及多个射束的射束能量,其中每个射束包括多个射束段;
标识多个射束中具有在靶标外部重叠的相应射束路径的任何重叠射束;
针对多个射束中的每个射束,确定该射束的最大射束能量,并且将该射束的射束段的射束能量确定为该射束的最大射束能量的百分比;以及
针对在靶标外部重叠的重叠射束中的每个重叠射束,将该重叠射束的射束段的射束强度减小剂量计算因子,其中多个射束的射束段的射束强度被确定以使得递送到靶标的累积剂量满足指定剂量。
在一些实施例中,该方法包括:
将射束中处于靶标中的每个射束表示为纵向射束区域的相应集合,其中该集合中的每个射束区域具有与要由射束区域递送的剂量的所计算的量相对应的值;
针对靶标中的每个子体积,将到达该子体积的每个射束的每个射束区域的值相加以确定该子体积的总值,以产生靶标中的子体积的相应总值;以及
调整影响要由射束区域递送的剂量的所计算的量的参数的值,直到子体积的总值之间的差满足阈值。
在一些实施例中,该方法包括:
访问靶标外部子体积的剂量计算因子的值,其中剂量计算因子的值根据有多少射束到达靶标外部子体积被确定;
计算靶标外部子体积的剂量;以及
将剂量计算因子的值应用到针对靶标外部子体积而计算的剂量,其中如果只有一个射束到达靶标外部子体积,则剂量计算因子减少针对靶标外部子体积而计算的剂量。
在一些实施例中,该方法包括使用剂量阈值来指定用于辐射治疗计划的限制,其中该限制选自由以下项组成的组:对靶标中的每个子体积的照射时间的限制;对靶标外部的每个子体积的照射时间的限制;对靶标中的每个子体积的剂量率的限制;以及对靶标外部的每个子体积的剂量率的限制。
在一些实施例中,剂量阈值取决于多种生物学因素,包括但不限于组织类型和/或免疫学简档。
在一些实施例中,射束包括选自由以下项组成的组的射束类型:质子;电子;光子;原子核和离子。
在另一方面,提供了一种超高剂量率(FLASH)辐射与治疗剂相结合来治疗需要其的受试者内的癌症或肿瘤的用途。
在另一方面,提供了一种用于在治疗癌症或肿瘤中与治疗剂相结合的超高剂量率(FLASH)辐射。
在本文中所描述的方面和实施例中的任何一个中,治疗剂可以是免疫调节剂、抗衰老剂、辐射敏化剂和/或纳米颗粒。
在另一方面,提供了一种用于降低受试者内的刺猬信号通路的激活的方法。在一些实施例中,该方法包括向受试者施用治疗有效量的超高剂量率(FLASH)辐射,其中与向受试者施用常规质子辐射疗法相比,刺猬信号通路的激活被降低。在一些实施例中,受试者患有癌症或肿瘤。在一些实施例中,该方法包括向受试者内的肿瘤施用治疗有效量的超高剂量率(FLASH)辐射。在一些实施例中,将FLASH辐射作为质子疗法施用,或者FLASH辐射包括质子或由质子组成。
在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,由刺猬信号通路激活的基因的表达被降低。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,从CELSR1、TLE3、OPHN1、GPR56、PTCH1、TLE1、MYH9、RASA1、HEY1、ETS2、HEY2、LDB1、UNC5C、NF1、CDK6、VLDLR、NRP2、DPYSL2和NRP1中选择的一个或多个基因的表达被降低。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,由从以下项中所选择的基因编码的一种或多种蛋白质的表达被降低:CELSR1、TLE3、OPHN1、GPR56、PTCH1、TLE1、MYH9、RASA1、HEY1、ETS2、HEY2、LDB1、UNC5C、NF1、CDK6、VLDLR、NRP2、DPYSL2和NRP1。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,对具有从SEQ ID Nos:15-70中选择的氨基酸序列的蛋白质编码的一个或多个基因的表达被降低。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,具有从SEQ ID Nos:15-70中选择的氨基酸序列的一种或多种蛋白质的表达被降低。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,对表7中的蛋白质编码的一个或多个基因的表达被降低。在一些实施例中,与施用常规质子辐射疗法相比,当向受试者施用FLASH辐射时,表7中的一种或多种蛋白质的表达降低。
在一些实施例中,该方法还包括向受试者施用治疗有效量的刺猬拮抗剂。在一些实施例中,刺猬拮抗剂从Smo拮抗剂、PTCH1抑制剂、环巴胺、维莫德吉(Vismodegib)、LDE225、saridegib、BMS 833923、LEQ 506、PF-04449913、PF-5274857、GANT61、SANT-1、格拉吉布(Glasdegib)(PF-04449913)、Taladegib(LY2940680)或TAK-441中选择。在一些实施例中,受试者患有癌症或肿瘤。在一些实施例中,该方法包括向受试者内的肿瘤施用治疗有效量的超高剂量率(FLASH)辐射和治疗有效量的刺猬拮抗剂。
附图说明
图1示出了本文中描述的一个实施例中的样本射束几何形状的截面图。
图2示出了代表性剂量表面曲线图,作为在本文中描述的一个实施例中用于确定剂量阈值的变量的示例。
图3是可以在其上实现本文中描述的实施例的计算系统的示例的框图。
图4是示出本文中描述的一个实施例中的自动辐射治疗计划系统的示例的框图。
图5示出了在对照老鼠(经假治疗)以及用常规、FLASH和split-Flash(分裂-Flash)辐射治疗的老鼠中用于正常组织毒性研究的实验设计。
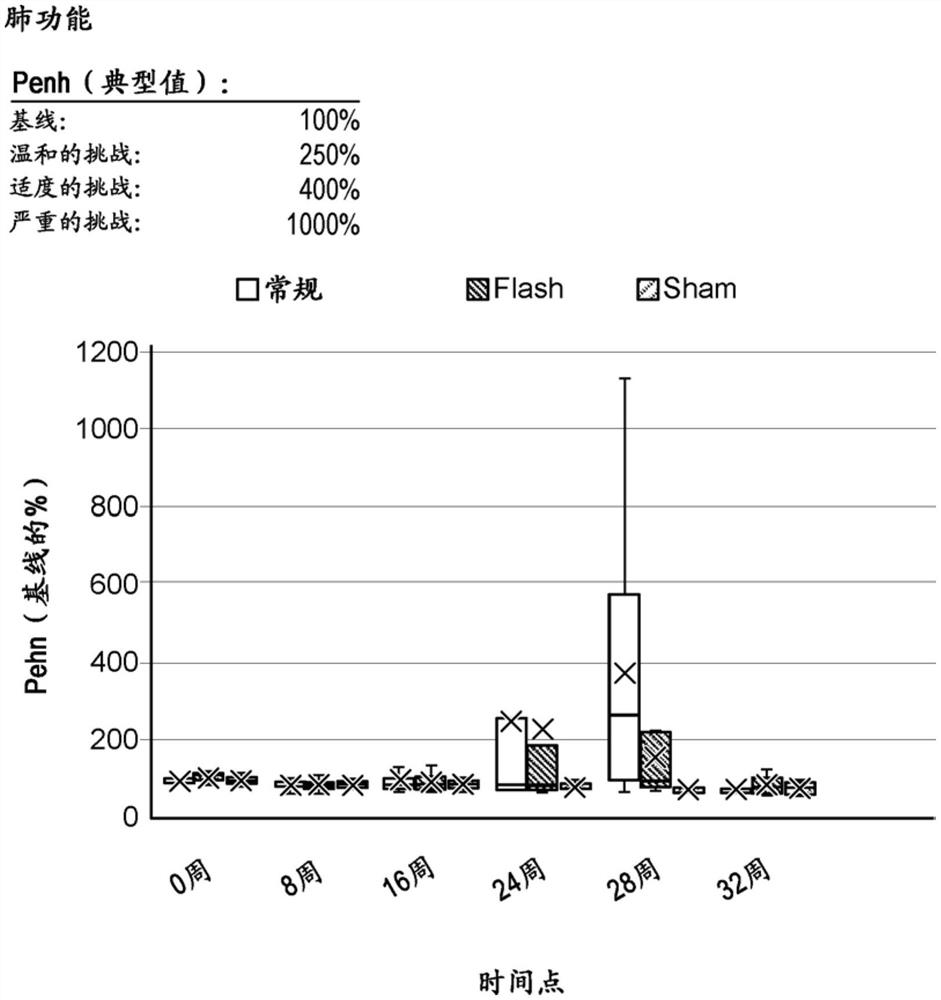
图6示出了与常规辐射治疗相比FLASH的肺功能得到改善。
图7示出了与常规辐射治疗组相比FLASH的中位存活率得到提高:20.0Gy:增加14%;17.5Gy:增加18%。
图8示出了与常规辐射治疗组相比FLASH的中位存活率得到提高,以及取决于剂量率的治疗窗口的可能性:17.5Gy FLASH>17.5Gy CON;17.5Gy FLASH=20,0Gy CON。
图9示出了与常规辐射相比FLASH的平均皮炎得到减少:FLASH:减少34%;Split-FLASH:减少52%。
图10示出了在17.5Gy与常规组相比FLASH的平均肺纤维化减少23%。
图11示出了与FLASH治疗相比常规的肺平均重量增加——0.46g与0.40g(M);0.37g与0.32g(F)。
图12A-图12D示出了在每个时间点的差异表达基因的维恩图。A)24小时处、B)8周处、C)16周处、D)24周处的DE基因,其中调整后的p值小于或大于0.05。
图13A-图13D示出了三个治疗组之间的GSEA标志通路的重叠。A)24小时处、B)8周处、C)16周处、D)24周处的GSEA,其中FDR-q值<0.25,并且调整后的p值<0.05。相对于Sham处理样本,带下划线的文字表示下调,而斜体文字表示上调通路。
图14A-图14D示出了用于Split Flash-Sham和Flash-Sham GSEA分析的标志性有丝分裂纺锤体富集图和核心富集基因。用于Split-Flash和FLASH的核心富集基因的A)Split-Flash和B)FLASH处理组基因表达热图的标志性有丝分裂纺锤体的富集图。C)SplitFLASH和FLASH处理组之间的重叠。D)来自图14C的基因列表,BOLD基因是有丝分裂纺锤体装配中的关键参与者。
图15A和图15B示出了Flash特异性DNA修复签名和核心富集基因:A)(左上):DNA修复签名的富集图(左下):DNA修复签名的富集统计。B)标志性DNA修复签名中的核心富集基因的基因表达热图。
图16A-图16C示出了Flash特异性KRAS信号上升8周至24周:(上部):对于Flash处理的老鼠的A)8周、B)16周、和C)24周的KRAS信号上升签名和富集统计的富集图。
图17A-图17C示出了EMT签名和核心富集基因分析:24周的EMT富集图和统计:A)常规B)Flash处理的细胞。C)常规与Flash之间的核心富集基因的重叠,突出显示了TGF Beta基因。有关核心富集基因和重叠的完整列表,请参见表5。
图18示出了饼状图,其表示在24小时通过不同辐射方案调节的各种经典通路。对p值<0.05样本的基因的过滤列表进行分析。此处呈现并在表6中列出的通路的p值<0.05,FDR<0.1并且Z得分>1.5。相对于Sham处理的样本,带下划线的文字表示下调,而斜体文字表示上调通路。
图19示出了由IPA分析的通过Flash和常规辐射处理两者调节的主要典型通路的比较性分析的热图。P值0.05,Z得分>1.5。发现这些治疗方案之间差异调节的通路主要涉及炎症和免疫调节。
图20示出了表示在16周处发现由不同辐射方案调节的各种典型通路的饼图。对p值<0.05样本的基因的过滤列表进行分析。此处呈现并在表4中列出的且呈现的通路的p值<0.05,FDR<0.1并且Z得分>1.5。相对于Sham处理的样本,
图21示出了如由IPA分析的在16周处通过Flash和常规辐射治疗两者调节的主要经典通路的比较分析的热图。P值0.05,并且Z得分>1.5。发现这些治疗方案之间差异调节的通路主要涉及炎症和免疫调节。
图22示出了应用于DAPI图像的QuPath细胞检测的结果。
图23A和图23B示出了(A)原始FITC图像,和(B)分段的TUNEL阳性细胞。ImageJ的斐济分布用于量化每个视场中的TUNEL阳性细胞的数目。首先将高斯模糊应用于图像,然后使用阈值来分割对象。
图24是示出TUNEL结果的图。该图示出了针对每组大约20个动物(雄性和雌性合并)的每个动物的平均计数。
图25示出了辐射后24小时,FLAS样本与常规样本的差异基因表达和通路分析。图25A示出了最高差异表达的基因的火山图。红点表示FDR值小于5%的基因,为清楚起见,所标记的基因表示具有大于1.3对数差异倍数的表达的基因。图25B示出了在FLASH辐射和常规辐射之间富集的最高GSEA标志的表。图25C示出了针对GSEA的标志性炎症反应的富集图和最高的50个前沿(leading edge)基因。图25D显示了在经FLASH辐射和常规辐射处理的样本之间的微阵列数据集中的最高富集通路的IPA结果。
术语“治疗”是指对肿瘤或诊断出患有肿瘤的受试者施用治疗。可以以足够或有效地杀死肿瘤细胞(即,在治疗上有效的量)、减慢肿瘤的生长、减小肿瘤的大小或从受试者完全消除肿瘤的量或治疗剂量来施用治疗。治疗的示例包括:电离辐射,诸如FLASH辐射疗法,治疗剂,免疫调节剂,抗衰老剂,辐射敏化剂,纳米颗粒或其组合。该术语还包括选择治疗或治疗计划、以及向医疗护理提供方或受试者提供治疗选择。
术语“治疗剂”是指可以用于治疗肿瘤的试剂,诸如小分子药物或生物药物,并且可以包括免疫调节剂、抗衰老剂、辐射敏化剂、或纳米颗粒。治疗剂可以是由监管机构批准的用于治疗肿瘤或癌症、在监管部门批准之前正在进行临床试验、或者正在接受治疗肿瘤或癌症的研究的试剂。治疗剂可以与辐射疗法(诸如常规或FLASH辐射疗法)相结合来治疗肿瘤。在一些实施例中,治疗剂与FLASH辐射疗法相结合来治疗肿瘤。
术语“电离辐射”是指包括具有足够动能以从原子或分子释放电子从而产生离子的粒子的辐射。该术语既包括直接电离辐射,诸如由原子粒子(诸如α粒子(氦核)、β粒子(电子)和质子)引起的辐射;也包括间接电离辐射,诸如光子(包括伽马射线和x射线)引起的辐射。辐射疗法中使用的电离辐射的示例包括高能x射线、电子束、离子束和质子束。
术语“FLASH”、“FLASH辐射”或“FLASH辐射疗法(FLASH RT)”是指作为疗法被施用于受试者或患者的超高剂量率辐射。在一些实施例中,可以以超高剂量率以一个到很多个短脉冲对需要治疗的受试者或患者施用剂量。在一些实施例中,在不超过一秒的总“射束接通”时间内递送整个辐射剂量。
FLASH是指以一定剂量率施用电离辐射的模式,该剂量率确保所有正常组织辐射在1秒或更短时间内发生以递送整个剂量处方。例如,20戈瑞(Gy)的剂量处方,对于单个照射方向,将需要每秒至少20Gy的剂量率;对于两个照射方向,将需要每秒至少10Gy;对于四个照射方向,将需要每秒5Gy,等等。场的数目可以降低剂量率以满足FLASH照射条件,只要这些场不重叠或在1秒或更短的时间内递送重叠的场。
脉冲式FLASH是以一定剂量率施用电离辐射的模式,该剂量率导致在1秒或更短时间内对于指定剂量的电离辐射向正常组织的总主动递送时间,并且允许在单个治疗会话或片段内重复照射同一正常组织体积。例如,将在1秒或更短的有效照射时间内递送20Gy处方,但是可以将其分为5个4Gy的脉冲,每个脉冲间隔1秒,每个脉冲以0.2秒递送,或者每个脉冲每秒20Gy。另一示例是10个2Gy的脉冲,持续时间为0.1秒,间隔开2秒,或每个脉冲每秒20Gy。脉冲式FLASH允许自由选择用于递送的占空比,只要对单个治疗会话实施1秒或更短的总有效递送时间。脉冲间隔可以从小于一秒的脉冲间隔到几分钟不等。
分割式FLASH是在更长的时间间隔内递送FLASH或脉冲式FLASH电离辐射。在确定的分割辐射治疗临床方案之后,该时间间隔可能为数小时至数天,而实际的治疗递送为FLASH或脉冲式FLASH。
术语组织的“常规辐射疗法”或“常规照射”是指每秒0.5Gy的剂量,例如40秒内20Gy、35秒内17.5Gy或30秒内15Gy(0.5Gy/sec)。
术语“肿瘤环境”或“肿瘤微环境”是指生物体或生物体的一部分的直接小规模环境,特别是作为更大环境的不同部分,例如,肿瘤的直接小尺度环境。该术语不仅包括肿瘤细胞本身,还包括与肿瘤相关联或围绕肿瘤的相关血管(包括内皮细胞和平滑肌细胞)、免疫系统细胞和分泌的细胞因子、上皮细胞、成纤维细胞、结缔组织、和/或细胞外基质。该术语还指代肿瘤所在的细胞和细胞外环境。
辐射疗法中的术语“护理标准”或“标准辐射治疗方案”通常是指基于肿瘤类型、大小、组织位置和其他各种生物学参数,在医学领域中普遍接受作为给定肿瘤的适当治疗的电离辐射剂量和给药间隔。护理标准或标准治疗方案各不相同,并且取决于几个因素。例如,对于肺癌的辐射疗法,护理标准包括向肿瘤施用的生物活性剂量(例如,对于周围肿瘤以3个部分的54GY,对于中心肿瘤以4-8个部分的48-60Gy)的多个部分(例如,低剂量辐射治疗约30例,或6周内约60Gy)或较少数目的部分(例如,1-5部分)。
术语“电离辐射的类似剂量”是指与向另一受体内的肿瘤施用或向正在接受现有治疗的同一受试者内的肿瘤施用的有效剂量相同、几乎相同或基本相同的电离辐射的剂量。该术语涵盖由向受试者内的肿瘤施用电离辐射领域的医学技术人员递送的电离辐射剂量的正常和预期变化。例如,该术语涵盖向肿瘤施用的有效剂量的变化小于10%,小于5%或小于1%。受试者可以是人类或非人类动物,诸如伴侣动物(例如,猫、狗)或农场动物(例如,牛、马等)。
术语“表达水平”是指本文中描述的生物标志物的量或水平和/或存在或不存在。
术语“小分子药物”是指分子量小于约50kDa、小于约10kDa、小于约1kDa、小于约900道尔顿或小于约500道尔顿的有机化合物。该术语包括具有期望药理学性质的药物,并且包括可以口服或通过注射来施用的化合物。
术语“辐射敏化剂”是指使肿瘤细胞更容易通过辐射疗法而杀死的任何物质。示例性的辐射敏化剂包括:低氧辐射敏化剂,诸如米索硝唑、甲硝唑和克罗汀丁酸钠;以及DNA损伤反应抑制剂,诸如聚(ADP)核糖聚合酶(PARP)抑制剂。
术语“减少的组织损伤”或“减少对正常组织的损伤”是指与向受试者施用常规辐射相比在施用FLASH辐射时组织损伤的减少。减少的组织损伤可以通过测量或量化细胞或组织对辐射的反应来确定,诸如但不限于皮炎、纤维化、细胞死亡或呼吸道紊乱。在一些实施例中,减少的组织损伤是指与向受试者施用常规辐射相比在施用FLASH时细胞或组织对辐射的反应中的组织损伤的至少约10%、15%、20%、25%、30%、35%、40%、45%、50%或更多的减少。
术语“样本”、“生物样本”和“肿瘤样本”是指体液,诸如但不限于血液、血清、血浆或尿液、和/或从受试者或患者获得的细胞或组织。在一些实施例中,样本是福尔马林固定且石蜡包埋的组织或肿瘤样本。在一些实施例中,样本是冷冻组织或肿瘤样本。在一些实施例中,肿瘤样本可以是包括来自肿瘤的肿瘤细胞的活检。在一些实施例中,受试者或患者是动物或哺乳动物。在一些实施例中,受试者或患者是人。
术语“约”是指本领域普通技术人员通常遇到的本文中描述的任何值或本文中描述的施用剂量的测量值的变化。因此,术语“约”包括本文中描述的任何值的正或负0.1、0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0或10.0百分率的变化。无论是否使用术语“约”,本文中描述的任何值均被认为由术语“约”修饰。本文中描述的任何数值范围包括端点以及端点之间的所有值。例如,约1至10的范围包括约1.0、约1.1、约1.2、……、约9.8、约9.9或约10.0。
具体实施方式
当将治疗剂(诸如免疫调节剂、抗衰老剂、辐射敏化剂、或纳米颗粒)与FLASH辐射相结合来治疗癌症患者时,本文中描述的方法提供了抗肿瘤功效和正常组织保护的优点。本文中描述的方法提供了出乎意料的结果,即,与单独的FLASH辐射疗法或治疗剂疗法(单一疗法)相比,FLASH辐射与治疗剂(例如,免疫调节剂疗法)相结合可以增加抗肿瘤反应。抗肿瘤反应的增加可以增强或增加由任一单独疗法提供的对肿瘤生长的抑制。本文中描述的方法可以用于通过施用FLASH辐射疗法以向肿瘤递送高适形剂量以及治疗剂来治疗局部和转移性癌症。本文中描述的联合疗法可以改善(局部和全身)FLASH辐射疗法的功效和治疗剂疗法的功效两者。在一些实施例中,与单独施用治疗剂或FLASH辐射单一疗法相比,在与FLASH辐射相结合施用时,治疗剂或免疫调节剂还增强了抗癌反应。与单独利用常规辐射疗法或治疗剂疗法(单一疗法)的治疗相比,本文中描述的方法还可以增加抗肿瘤反应。
在一个方面,提供了一种用于治疗患有癌症的受试者内的肿瘤的方法,其包括向肿瘤施用FLASH RT和免疫调节剂。免疫调节剂可以选自由以下项组成的组:对抑制性检查点分子的抑制剂、刺激性检查点分子的激活剂、趋化因子抑制剂、巨噬细胞迁移抑制因子(MIF)的抑制剂、生长因子、细胞因子、白介素、干扰素、与免疫系统细胞结合的抗体(诸如与T细胞和肿瘤抗原结合的双特异性抗体)、细胞免疫调节剂(诸如CAR-T细胞)、疫苗、溶瘤病毒及其任何组合。在一些实施例中,对抑制性检查点分子的抑制剂是与抑制性检查点分子特异性结合并且抑制其活性的小分子药物或者抗体或其片段,其中抑制性检查点分子选自由以下项组成的组:PD-1、PD-L1、PD-L2、CTLA-4、BTLA、A2aR、B7-H2、B7-H3、B7-H4、B7-H6、CD47、CD48、CD160、CD244(2B4)、CHK1、CHK2、CGEN-15049、ILT-2、ILT-4、LAG-3、VISTA、gp49B、PIR-B、TIGIT、TIM1、TIM2、TIM3、TIM4和KIR及其配体。在其他的一些实施例中,刺激性检查点分子的激活剂是小分子药物、基于多肽的激活剂、或基于多核苷酸的激活剂,其与刺激性检查点分子特异性结合并且增加其活性,其中刺激性检查点分子选自由以下项组成的组:B7-1(CD80)、B7-2(CD86)、4-1BB(CD137)、OX-40(CD134)、HVEM、可诱导共刺激分子(ICOS)、糖皮质激素诱导的肿瘤坏死因子受体(GITR)、CD27、CD28、CD40及其配体。在某些实施例中,趋化因子抑制剂是与趋化因子(或其受体)特异性结合并且抑制趋化因子活性的小分子药物或者抗体或其片段。在一些实施例中,趋化因子选自由以下项组成的组:CCL2、CCL3、CCL4、CCL5、CCL7、CCL8、CCL11、CCL12、CCL13、CCL14、CCL15、CCL16、CCL17、CCL18、CCL19、CCL20、CCL21、CCL22、CCL23、CCL24、CCL5、CCL26、CCL27、CCL28、CXCL1、CXCL2、CXCL3、CXCL4、CXCL5、CXCL6、CXCL7、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CXCL13、CXCL14、CXCL5和CXCL16。在一些实施例中,趋化因子抑制剂与选自由以下项组成的组的趋化因子受体相结合:CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CCR10、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6和CXCR7。MIF的抑制剂可以是与MIF特异性结合并且抑制MIF活性的小分子药物或者抗体或其片段。也可以使用巨噬细胞迁移的其他抑制剂。在一些实施例中,免疫调节剂是吲哚胺2,3-双加氧酶(IDO)的抑制剂。
该方法还可以包括;(a)检测来自受试者的肿瘤样本中的一种或多种生物标志物的表达水平,其中一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;(b)将一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平与正常组织样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比,一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则利用FLASH RT和免疫调节剂来治疗肿瘤。在一些情况下,如果与正常组织样本中的表达水平相比,至少一种生物标志物的表达水平降低,或者至少一种生物标志物的表达水平增加,或者至少一种生物标志物的表达水平增加并且至少一种生物标志物的表达水平降低,则一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改。可以对一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行排名或加权。
在一些实施例中,(多个)免疫细胞生物标志物或(多个)肿瘤细胞生物标志物或(多个)循环生物标志物为多核苷酸或蛋白质。检测步骤可以通过使用选自由以下项组成的组的分析来执行:免疫组织化学、ELISA、Western分析、HPLC、蛋白质组学、PCR、RT-PCR、Northern分析和微阵列。
肿瘤样本可以是包括肿瘤细胞的活检。正常组织样本可以包括来自与肿瘤相同组织类型的非肿瘤细胞。
在另一方面,本文中提供了一种治疗患有癌症的受试者内的肿瘤的方法,该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平,其中一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;(b)将一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平与正常组织样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则向受试者内的肿瘤施用包括FLASH RT和治疗剂的治疗。
在一些情况下,施用FLASH RT的步骤包括使肿瘤与辐射敏化剂相接触。如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则与标准治疗方案相比,可以以更高的剂量施用FLASH RT。如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则可以施用FLASH RT作为大分割辐射治疗。在其他情况下,如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则施用FLASHRT作为超分割辐射治疗。
在又一方面,本文中提供了一种将患有癌症的受试者标识为针对包括FLASH RT和治疗剂的治疗的候选方的方法。该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物、(多个)成像标志物及其任何组合:(b)将一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平与正常组织样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则将受试者分类为针对包括FLASH RT和治疗剂的治疗的候选方。在一些情况下,如果与正常组织样本中的表达水平相比,至少一种生物标志物的表达水平增加,或者至少一种生物标志物的表达水平降低,或者至少一种生物标志物的表达水平增加并且至少一种生物标志物的表达水平降低,则一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改。在某些情况下,对一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行排名或加权。在某些情况下,该方法还包括执行肿瘤的功能成像。
在另一方面,本文中提供了一种针对患有癌症的受试者选择治疗的方法,该方法包括:(a)确定来自受试者的肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平,其中一种或多种生物标志物选自由以下项组成的组:(多个)免疫细胞标志物、(多个)肿瘤细胞标志物、(多个)循环标志物及其任何组合;(b)将一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平与正常组织样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行比较;以及(c)如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则选择包括FLASH RT和治疗剂的治疗方法。在一些实施例中,该方法包括执行肿瘤的功能成像;以及基于肿瘤的功能成像来选择包括FLASH RT和治疗剂的治疗。在一些情况下,FLASH RT包括使肿瘤与辐射敏化剂相接触。
在任何上述方面和实施例中,如果与正常组织样本中的表达水平相比,至少一种生物标志物的表达水平增加,或者至少一种生物标志物的表达水平降低,或者至少一种生物标志物的表达水平增加并且至少一种生物标志物的表达水平降低,则一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改。可以对一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平进行排名或加权。
在以上方面和实施例中的任何一个中,如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则与标准治疗方案相比以更高的剂量施用FLASH RT。在某些情况下,如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则施用FLASH RT作为大分割辐射治疗。在其他情况下,如果与正常组织样本中的表达水平相比,肿瘤样本中的一种或多种生物标志物(例如,1、2、3、4、5或更多种生物标志物)的表达水平被修改,则施用FLASH RT作为超分割辐射治疗。
在以上方面和实施例中的任何一个中,治疗剂是免疫调节剂,免疫调节剂选自由以下项组成的组:对抑制性检查点分子的抑制剂、刺激性检查点分子的激活剂、趋化因子抑制剂、巨噬细胞迁移抑制因子(MIF)的抑制剂、生长因子、细胞因子、白介素、干扰素、与免疫系统细胞结合的抗体、细胞免疫调节剂、疫苗、溶瘤病毒及其任何组合。
在以上方面和实施例中的任何一个中,本文中描述的方法还可以包括在施用FLASH RT和/或治疗剂之前执行肿瘤的功能成像。
电离辐射(例如,FLASH RT)和治疗剂可以同时施用。备选地,FLASH RT和治疗剂可以顺序地施用。
在另一方面,提供了一种试剂盒(kit)。试剂盒包括能够检测本文中描述的生物标志物的表达的试剂。在一些实施例中,试剂盒包括能够检测生物标志物的核酸(例如,RNA)表达的试剂。例如,试剂盒可以包括能够扩增由本文中描述的生物标志物基因表达的核酸的寡核苷酸引物。在一些实施例中,试剂盒还包括与生物标志物核酸或扩增的生物标志物核酸或其补体杂交的寡核苷酸探针。扩增和检测核酸的方法是本领域公知的,并且可以包括PGR、RT-PCR实时PCR和定量实时PCR、Northern分析、表达的核酸的测序、以及表达和/或扩增的核酸与微阵列的杂交。在一些实施例中,试剂盒包括能够通过本文中描述的生物标志物检测蛋白质表达的试剂。在一些实施例中,试剂是与生物标志物蛋白特异性结合的抗体。检测蛋白质表达的方法是本领域公知的,并且包括免疫测定、ELISA、Western分析和蛋白质组学技术。
在以上方面和实施例中的任何一个的一些实施例中,肿瘤样本中的每种生物标志物的表达水平与正常组织中的表达水平相比的差异增加或减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施例中,肿瘤样本中的每种生物标志物的表达水平相对于正常组织中的表达水平,增加或降低至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多倍。
在一些实施例中,肿瘤样本中的所有生物标志物的平均和/或排名表达水平相对于正常组织中的表达水平增加或减少。因此,在一些实施例中,肿瘤样本中的所有生物标志物的平均和/或排名表达水平与正常组织中的表达水平相比,增加或减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施例中,正常组织中的表达水平被标准化为对照或基线水平。应当理解,在治疗、治疗过程或治疗计划之前、之后或期间,也可以将表达水平与肿瘤样本中的表达水平进行比较。因此,在一些实施例中,肿瘤样本中的每种生物标志物的表达水平与治疗之前、治疗期间或治疗之后的肿瘤样本中的表达水平相比,增加或减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。
此外,关于以上方面和实施例中的任何一个,一个或多种生物标志物可以包括生物标志物的任何组合或由生物标志物的任何组合组成,例如,本文中描述的任何生物标志物、两种或更多种生物标志物的任何组合、三种或更多种生物标志物的任何组合、四种或更多种生物标志物的任何组合、五种或更多种生物标志物的任何组合、六种或更多种生物标志物的任何组合、以及七种或更多种生物标志物的任何组合。
在另一方面,确定本文中描述的生物标志物中的至少一种、两种、三种、四种或更多种的表达水平。两种或更多种生物标志物(例如,2、3、4、5、6或更多种生物标志物)的表达水平的组合可以指示患有癌症的受试者与对照受试者相比对辐射更敏感。与标准剂量相比,可以向该受试者施用减小或减少的剂量的辐射。在其他情况下,如果两种或更多种生物标志物(例如,2、3、4、5、6或多种生物标志物)的表达水平的组合可以指示患有癌症的受试者与对照受试者相比对辐射更不敏感。对辐射更不敏感的受试者可以被施用增加剂量、大分割剂量或超分割剂量的辐射。可选地,辐射疗法可以与免疫调节剂相结合施用,免疫调节剂诸如但不限于抗TIM4抗体、抗MFG-E8抗体、抗M199抗体及其任何组合。
在一些实施例中,生物标志物是CD44、MFG-E8、CD68、ΤGFβ或其任何组合。在某些实施例中,如果相对于对照样本,在获自患有癌症的受试者的样本中的第一生物标志物具有高表达水平并且第二生物标志物具有低表达水平,则可以预测辐射治疗单一疗法可以导致局部肿瘤控制失败。这样,该生物标志物谱(profile)可以指示应当与免疫调节剂相结合地向受试者施用辐射治疗。备选地,该生物标志物谱可以指示辐射剂量应增加(即,超过标准方案剂量)。例如,如果与对照样本相比,受试者的肿瘤样本中的CD44的水平较高而MFG-E8的水平较低,则可以预测单独的辐射治疗将不会导致临床反应。换言之,具有高水平的CD44和低水平的MFG-E8的肿瘤样本可能对电离辐射或FLASH辐射疗法不敏感或敏感性低。在某些情况下,本文中描述的生物标志物谱指示受试者应当接受增加剂量的辐射和/或包括FLASH RT和免疫调节剂的联合治疗,免疫调节剂诸如抗TIM4抗体、抗MFG-E8抗体、抗M199抗体及其任何组合。
在其他实施例中,如果CD44的水平与正常样本相比较低和/或MFG-E8的水平与正常样本相比较高,则受试者可能对电离辐射或FLASH单一疗法具有临床反应。在某些情况下,预测的是CD44水平低和/或MFG-E8水平高的受试者可能对电离辐射或FLASH辐射疗法敏感。
在一些实施例中,如果受试者的肿瘤与对照样本相比具有高水平的CD68,则预测受试者在辐射单一疗法之后具有降低的存活性。这样,可以向该受试者施用包括FLASH RT和免疫调节剂的联合疗法。在其他情况下,如果受试者的肿瘤与对照样本相比具有较低水平的CD68,则该受试者可能对辐射单一疗法具有临床反应。预测的是该受试者对辐射敏感。在某些情况下,可以指示与标准方案剂量相比,应向对象施用低剂量或降低剂量的辐射。
FLASH辐射
可以以单个脉冲或任何脉冲序列向组织(例如,肿瘤细胞)施用FLASH辐射,其中脉冲之间的间隔小于一秒到几分钟。FLASH辐射的剂量范围可以从约40Gy/sec到大于500Gy/sec。在实施例中,FLASH辐射允许以FLASH速率在活组织中高达200厘米的剂量沉积。在一些实施例中,FLASH辐射的剂量足以杀死位于人或动物组织中高达200厘米深的肿瘤细胞,例如从1Gy到大于500Gy,其中总的射束接通递送时间不超过1秒。FLASH序列内的每个脉冲可以是连续的,也可以是较短的微脉冲的序列。在一些实施例中,每个脉冲的剂量是至少0.1Gy,并且每个脉冲的剂量率是至少40Gy/sec(即,2.5ms内0.1Gy,10ms内4Gy,0.5秒内20Gy,等等)并且高达本文中指定的1e7Gy/sec。脉冲占空比(即,时间间隔)可以具有从1到1e-9的任何值。
在一些实施例中,使用诸如x射线、伽马射线、电子束或质子的高能粒子或波来递送FLASH辐射。在一些实施例中,将FLASH辐射作为质子疗法递送。在一些实施例中,不使用电子来递送FLASH辐射。在一些实施例中,根据以下安排来递送质子疗法:FLASH:
1.在0.5秒内20Gy(40Gy/秒)
2.在0.4375秒内17.5Gy(40Gy/秒)
3.在0.375秒内15Gy(40Gy/秒)
脉冲式FLASH
1.在10秒内10个1.5Gy脉冲,其中占空比为0.1或10%
2.在10秒内10个1.75Gy脉冲,其中占空比为0.1或10%
3.在10秒内10个2Gy脉冲,其中占空比为0.1或10%
相比之下,常规的质子辐射治疗可以按照以下安排递送:
1.在40秒内20Gy(0.5Gy/秒)
2.在35秒内17.5Gy(0.5Gy/秒)
3.在30秒内15Gy(0.5Gy/秒)
使用由线性电子加速器递送的电子进行的FLASH照射例如在Sci.Transl.Med.6,245ra93(2014)的V.Favaudon、L.Caplier、V.Monceau、F.Pouzoulet、M.Sayarath、C.Fouillade、M.-F.Poupon、I.Brito、P.Hupe、J.Bourhis、J.Hall、J.-J.Fontaine、M.-C.Vozenin的“Ultrahigh dose-rate FLASH irradiation increases the differentialresponse between normal and tumor tissue in mice”中有描述。用于产生FLASH辐射的系统在美国专利申请No.15/089,330(2016年4月1日提交)中有描述,该专利申请为了所有目的通过引用整体并入本文。因此,在一些实施例中,辐射治疗或治疗系统是可以用于FLASH RT的质子笔射束扫描系统。更具体地,该系统可以包括加速器和射束传输系统以及可以朝向对象对准的喷嘴。喷嘴包括被配置为通过以下方式来调整射束的射束能量调整器:例如在射束的路径中放置不同厚度的材料以影响射束中的粒子的能量。喷嘴能够快速调整射束中的粒子以创建在靶标体积中递送整个相对较高的治疗性辐射剂量的扫描射束(与散射射束相反)。例如,可以在不到一秒钟内沿着指定射束方向(例如,给定射线)递送四戈瑞或更多的剂量。
每个射线是扫描图案的一部分,并且沿着穿过靶标体积的不同线段(“靶标线段”)照射组织。可以在短时间内沿着靶标线段递送的高剂量可以称为“射击”。在一个实施例中,可以在能量(强度)或范围上调整射击,并且以展开布拉格峰(SOBP)向靶标体积递送射击,SOBP为整个靶标线段提供均匀且经过适当修改的剂量。
可以用于FLASH RT的其他类型的辐射治疗系统在于2016年12月14日提交的题为“Dynamic Three-Dimensional Compensator”的共同未决临时申请序列号62/434,053中有描述,其全部内容通过引用并入本文。
在一些实施例中,辐射疗法或治疗系统包括加速器、射束传输系统和射束成形系统。在一个实施例中,加速器可以是基于射频(RF)(线性加速器、回旋加速器或同步加速器)或基于激光的加速器。加速器可以以脉冲、连续或准连续方式递送剂量。射束传输可以包括磁性元件(偶极、四极、多极)、静电元件、以及狭缝或准直器。射束成形可以通过磁性、静电和机械元件的组合来执行,目的是最大化剂量对肿瘤的适形性。实施例包括能够在单个场中或作为多个子束的组合向肿瘤递送3D适形剂量的系统。
FLASH RT剂量可以作为单个剂量(单个部分)被递送,或者总剂量可以分为随时间推移而递送的多个部分。在一个实施例中,医学技术人员可以使用例如x射线或磁共振成像(MRI)对肿瘤进行连续监测,以帮助确定当靶标在限定的靶标场中时何时接通射束,以进一步确保最佳的剂量适形性。
FLASH RT可以使用非常高能的带电粒子(VHECP),包括但不限于电子、质子和重离子、高能光子(x射线、γ射线)或任何高能中性粒子,诸如中子。高能被定义为允许以FLASH速率在活组织中多达200厘米的剂量沉积的任何能量。强度调制(IM)的FLASH RT和调制电弧(MA)的FLASH RT提供了用于实现最佳剂量适形性的方法。
辐射治疗计划系统
在诸如强度调制粒子疗法(IMPT)的强度调制辐射疗法(IMRT)中,射束强度跨患者内的每个治疗区域(靶标)而变化。代替用相对较大且均匀的场进行治疗,而是用多个较小射束(例如,射束段或子束)治疗患者,多个较小射束中的每个较小射束可以具有自己的能量和/或强度值,并且多个较小射束中的每个射束可以从不同的方向或角度(可以称为射束几何形状)递送。由于存在很多可能的射束几何形状、射束数目、以及跨射束和每个射束内的射束能量或强度的范围,因此实际上存在无限数目(或至少非常大数目)的潜在治疗方案,并且因此,始终如一地有效地生成和评估高质量的治疗计划超出了人类的能力并且依赖于计算机系统的使用,特别是考虑到与使用辐射疗法治疗癌症等疾病相关的时间限制,尤其是考虑到在任何给定时间段内正在接受或需要接受辐射治疗的大量患者。
图1示出了针对肿瘤(靶标710)和周围的肿瘤微环境720的可能的射束几何形状的截面图。在图1中,确定了要递送到靶标中和跨靶标而递送的指定剂量。靶标的每个部分可以由至少一个3D元素(称为体素)表示;一部分可以包括多于一个的体素。体素或靶标的一部分在本文中也可以称为子体积;子体积可以包括一个或多个部分或一个或多个体素。如下面将详细描述的,每个部分或体素可以接收来自从不同方向递送的一个或多个射束的辐射。指定剂量例如针对靶标的每个部分或体素定义剂量值或最小剂量值和最大剂量值。在一个实施例中,对于靶标的所有部分(子体积或体素),指定剂量是相同的,使得针对整个靶标指定均匀剂量。
在图1中,确定用于将射束705-707递送到靶标710中的方向(例如,相对于患者或靶标的机架角度、或相对于患者或靶标的喷嘴方向)。射束可以是质子束、电子束、光子束、离子束或原子核束。确定射束方向的操作可以包括确定射束的数目(要从其递送射束的方向的数目)。射束的路径在靶标内可以重叠或不重叠,并且在靶标外部可以重叠或不重叠。通常,当生成辐射治疗计划时,一个目标是确定使靶标外部组织的每个子体积或体素的照射剂量最小化的射束路径。在某些情况下,辐射肿瘤学家认为重要的器官可能需要比附近的其他器官接受更少的剂量。因此,常规治疗计划由对肿瘤和周围器官的所计算的积分剂量的指定阈值驱动。
本公开提供了用于确定靶标710外部的器官剂量阈值的附加标准。图2包含剂量与时间和另一变量的3维表面曲线图。递送到肿瘤的剂量将取决于更多的变量,但是出于描述实施例而不增加复杂性的目的,选择了两个变量。通常,剂量表面可以取决于任何数目的变量,并且通常将是n维的,其中n大于或等于1。在肿瘤微环境720的情况下,其他参数可以是免疫敏感性、肿瘤对免疫调节剂的反应性、或某种其他生物学参数。虽然通常该表面的形状可以变化,但是图2示出了随着照射时间的减少而增加的剂量阈值、以及随着“免疫生物学指示剂”的增加而略微增加的剂量阈值。
在一个实施例中,时间约束可以通过射束配置的几何构造来满足。在理想情况下,靶标外部的每个子体积或体素最多仅与单个射束相交。如果允许在射束路径之间存在某些重叠,则理想情况下,靶标外部的每个子体积或体素与不超过两个的射束相交,而大多数仅与单个射束相交。在一个实施例中,作为实现上述目标的一种手段,确定射束方向以使得在靶标外部的射束路径之间的重叠总量被最小化。在一个这样的实施例中,方向被确定为使得射束路径在靶标内重叠并且使得在靶标外部的射束路径的重叠总量小于在靶标内的射束路径的重叠总量。在另一这样的实施例中,确定方向以使得射束路径在靶标外部完全不重叠。射束路径可以位于同一平面内,也可以位于不同的平面内。
射束(705-707)被示出为穿过患者,但是本公开不限于此。射束也可以像离子束和质子束一样,在靶标内终止。在这种情况下,射束能量确定靶标内的终点,计算引擎和优化器需要考虑该终点。否则,所有其他优化参数都相同。
虽然图1中的操作被示出为以一定顺序且串联发生,但是本公开不限于此。这些操作可以以不同的顺序和/或并行地执行,并且它们还可以以迭代的方式执行,因为射束的数目(以及相应的方向的数目)、射束方向、以及用于递送指定剂量的射束能量或强度(和/或射束段能量或强度)是相互关联的。如上所述,由于需要考虑的不同的参数、那些参数的值的范围、那些参数的相互关系、使对患者的风险最小化但有效的治疗计划的需求、以及迅速生成高质量治疗计划的需求,在计算系统106(图3)上一致地执行的优化器模型150用于如本文中公开的辐射治疗计划的使用是重要的。
尽管在图1中示出了多个射束,但是这并不表示所有射束都必须同时或以重叠的时间段递送,尽管它们可以这样递送。在任一时间递送的射束的数目取决于辐射治疗系统中的机架或喷嘴的数目以及治疗计划。
在操作中,在一个实施例中,射束段被顺序地递送。例如,射束段705被递送给靶标(接通)并且然后关断,然后射束段706被接通并且然后关断,然后射束段707被接通并且然后关断,以此类推。每个射束段可以仅接通一秒钟的时间(以毫秒为单位)。在一个实施例中,所有射束705-707可以同时被接通。
如图1所示,子体积可以被多于两个的射束横穿,在这种情况下,通过相加到达子体积的每个射束的适当值来表示该子体积的累积剂量。这样的子体积被称为重叠区域730。也就是说,通过将到达子体积的每个射束的每个射束区域的值相加在一起来针对靶标710中的每个子体积确定总值。重叠区域中的剂量也可以通过由图2中的表面限定的约束来优化。
优化器模型可以调整影响被递送给靶标710的所计算的剂量的参数,以跨靶标710实现令人满意的均匀的累积剂量。当靶标710中每个子体积的所有总值相同或者当每个子体积的总值之间的差异满足阈值时,指示令人满意的均匀的累积剂量。
阈值可以是例如指定允许的差异范围或指定最大允许差异的值。
剂量限制可以包括但不限于:对靶标中的每个子体积(体素)的照射时间的限制(例如,对于靶标组织的每个体素,治疗时间<0.5秒);对靶标外部的每个子体积(体素)的照射时间的限制(例如,对于正常组织的每个体素,治疗时间<0.5秒);对靶标中的每个子体积(体素)的剂量率的限制(例如,对于靶标组织的每个体素,剂量率>40Gy/sec);以及对靶标外部的每个子体积(体素)的剂量率的限制(例如,对于正常组织的每个体素,剂量率>40Gy/sec);对肿瘤微环境中的剂量和剂量率的限制。通常,这些限制旨在最小化照射正常组织的时间量并且最大化免疫反应。
总之,本文中描述的实施例通过以下方式改善了辐射治疗计划和治疗本身:将FLASH RT扩展到更广泛的治疗平台和靶标位点以及优化FLASH RT的递送以增强免疫反应。与常规技术相比(甚至对非FLASH剂量率),本文中描述的生成的治疗计划通过设计减少(如果没有使之最小化)对正常组织(靶标外部)的剂量的幅度(以及在某些情况下为积分)来更有效地保护正常组织免于辐射。在与FLASH剂量率一起使用时,简化了患者运动的管理。虽然仍然是在竞争参数与相关参数之间寻找平衡的一项复杂任务,但是治疗计划相对于常规计划得到简化。本文中描述的技术可以用于立体定向辐射外科以及具有单个或多个转移的立体定向身体辐射疗法。
在一些实施例中,本文中描述的方法可以与其他类型的外部射束放射疗法一起使用,诸如但不限于IMPT、调强辐射疗法(IMRT)、图像引导辐射疗法(IGRT)、RapidArc
图3示出了可以用于辐射治疗计划的计算系统100的示例的框图。在其最基本的配置中,系统100包括至少一个处理单元102和存储器104。这种最基本的配置在图3中由虚线106示出。系统100还可以具有附加的特征和/或功能。例如,系统100还可以包括附加存储装置(可移除和/或不可移除),包括但不限于磁盘、光盘或磁带。这样的附加存储装置在图3中由可移除存储装置108和不可移除存储装置120示出。系统100还可以包含允许设备例如在联网环境中使用到一个或多个远程计算机的逻辑连接与其他设备通信的(多个)通信连接122。
系统100还包括诸如键盘、鼠标、笔、语音输入设备、触摸输入设备等(多个)输入设备124。还包括诸如显示设备、扬声器、打印机等(多个)输出设备126。
在图3的示例中,存储器104包括与治疗计划系统150相关联的计算机可读指令、数据结构、程序模块等。然而,治疗计划系统150可以替代地驻留在由系统100使用的任何一种计算机存储介质中,或者可以分布在计算机存储介质的某种组合上,或者可以分布在联网计算机的某种组合上。
治疗计划系统150可以用于通过接收患者特定信息(例如,几何信息)来为特定患者制定辐射治疗计划,患者特定信息输入到治疗计划系统并且由治疗计划系统处理。输入的患者特定信息可以包含实际上可以影响辐射治疗计划的参数的任何组合。例如,患者特定信息可以被组织为矢量或数据结构,包括以下各项的特征元素:靶标体积的大小和形状;靶标体积的位置;有风险的器官的大小和形状;有风险的器官的类型;与器官重叠的靶标体积的一部分;以及与靶标体积重叠的器官的一部分。
治疗计划系统150可以用于预测针对与特定患者相对应的治疗计划的剂量参数。剂量治疗计划系统150可以包括剂量体积直方图(DVH)估计模型,其中预测数量是剂量体积直方图。在其他实施例中,治疗计划系统150还基于到靶标距离直方图(DTH)生成预测,该DTH表示从关注区域(ROI)到辐射靶标的距离。通常,治疗计划系统150被实现为适合于预测针对辐射治疗计划的剂量(作为剂量直方图或空间3D剂量分布)的任何模型。
如上所述,辐射治疗计划系统150可以考虑空间域和时间域两者。例如,具有VHECP的IM或MA FLASH RT的治疗计划中可以包括时间相关组成。
在一些实施例中,治疗计划系统150考虑FLASH RT和免疫疗法的结合。治疗计划系统150将免疫疗法并入治疗计划中,包括免疫疗法如何影响剂量方案以及免疫疗法对辐射递送和剂量率的影响。通常,治疗计划系统150确定集成了FLASH RT和免疫疗法的最终辐射治疗计划。例如,治疗计划系统150可以迭代地评估辐射治疗的FLASH方面和辐射治疗的免疫疗法/生物学方面,以生成能够优化这两个方面的组合的最终辐射治疗计划。
例如,计划器定义一组质量度量。为了进行计划,定义度量使得较小的值比较大的值更优选。计划器还为每个质量度量定义相对优先级或权重(wi)。然后,将制定最佳计划的任务表述为二次成本函数C:C=sum(wi(Qi-qi)2),其中qi是可以针对特定治疗计划实现的质量度量的值。最佳计划通过最小化成本函数C来确定。
协助计划器的另一种方法是使用多标准优化(MCO)方法进行治疗计划。帕累托表面导航是一种MCO技术,其促进探索临床目标之间的权衡。对于给定的一组临床目标,如果治疗计划满足目标并且没有任何度量在不恶化至少一个其他度量的情况下得以改善,则认为该治疗计划是帕累托最优的。一组帕累托最优计划定义了与一组临床目标相关的帕累托表面。沿着帕累托表面的运动导致临床目标之间的权衡;一些度量将以恶化一个或多个其他度量为代价而得到改善。计划器可以沿着帕累托表面导航,并且根据计划器所应用的标准来选择似乎最佳的最终(优化)辐射治疗计划,或者可以基于治疗计划与帕累托表面的接近程度自动选择治疗计划。
与FLASH RT和免疫疗法的组合相关联的度量包括例如与靶标均一性、关键器官保留、指定剂量、剂量递送率、正常和肿瘤组织毒性等相关联的度量。
图4是示出自动辐射疗法治疗计划系统150的实施例的框图。系统150包括用于接收患者特定信息(数据)201的输入接口210和输出接口230。系统150整体上或部分地可以在计算系统100(图3)上/使用计算系统100而实现为软件程序、硬件逻辑或其组合。
辐射疗法治疗计划系统150还接收或访问FLASH RT参数和度量、以及免疫疗法参数和度量。度量的示例在本文中描述。FLASH RT参数可以包括例如射束类型、射束能量、射束相对于患者/靶标体积的角度、射束形状、剂量递送安排、用于肿瘤外部的任何给定正常组织体积的总剂量和照射时间、以及在肿瘤微环境内的可以优化免疫反应的剂量和照射时间。免疫疗法参数可以包括例如向受试者施用的药物或免疫调节剂的类型、所施用的肿瘤抗原、新抗原或抗体、剂量、以及递送安排(例如,在FLASH RT之前、之后和/或期间)。
治疗计划系统150产生预测结果,例如可达到的剂量分布预测。然后可以基于预测结果生成治疗计划。在一个实施例中,预测结果伴随有指示预测质量的参数,诸如结果的可靠性、预测的计划的复杂性、和结果的概率。
在一些实施例中,本文中描述的辐射治疗计划系统将产生如下的预测:可以基于受试者对免疫疗法的反应而向受试者施用较低有效剂量的辐射,例如FLASH辐射。例如,在一些实施例中,(多个)辐射治疗计划系统将预测到如果受试者的肿瘤对免疫疗法产生有利的反应,例如在免疫治疗之后肿瘤缩小,则可以向受试者施用较低有效剂量的辐射,例如FLASH辐射。
在一些实施例中,本文中描述的辐射治疗计划系统将产生如下的预测:基于增强免疫反应(例如,增加免疫调节剂的递送或活性)的参数来改变辐射(例如,FLASH辐射)的有效剂量,以更有效地治疗受试者的肿瘤。
用于放射疗法选择的生物标志物
本文中描述的生物标志物可以用于对患者进行分层以与免疫调节剂相结合来接受个性化的定制的放射疗法(例如,FLASH RT)。生物标志物还可以用于监测免疫调节剂疗法对癌症患者的疗效。生物标志物包括但不限于一种或多种免疫细胞生物标志物、一种或多种肿瘤细胞生物标志物、一种或多种循环生物标志物、一种或多种成像生物标志物及其任何组合。例如,免疫细胞生物标志物可以提供关于特定细胞群(诸如T细胞群)的位置和/或活性的信息。免疫细胞生物标志物或肿瘤细胞生物标志物可以是遗传生物标志物、多核苷酸生物标志物、或蛋白质生物标志物。在一些实施例中,免疫细胞生物标志物是与非免疫细胞或不同类型的免疫细胞相比,由特定免疫细胞以更高水平表达的特定多核苷酸(例如,RNA和微小RNA)或蛋白质。类似地,肿瘤细胞生物标志物可以是与非肿瘤细胞相比由肿瘤细胞以更高水平表达的特定多核苷酸(例如,RNA和微小RNA)或蛋白质。例如,肿瘤细胞生物标志物可以是与肿瘤细胞的增殖和/或转移相关联的蛋白质或编码上述蛋白质的多核苷酸。在某些情况下,蛋白质可能参与血管新生或由肿瘤细胞激活的其他过程。肿瘤生物标志物可以是癌基因或肿瘤抑制物。在一些情况下,肿瘤细胞生物标志物是存在于肿瘤细胞中而非存在于非肿瘤细胞中的基因变异、基因突变、拷贝数变异(CNV)、单核苷酸多态性(SNP)等。在一些实施例中,循环生物标志物是外来体(即,可以在体液中发现的细胞来源的囊泡)。有用的生物标志物的示例包括美国专利申请出版No.20160024594中描述的示例,其公开内容出于所有目的通过引用并入本文。
生物标志物集合可以包括但不限于CD44、乳脂球EGF因子8(MFG-E8)、CD68和TGFβ。CD44是一种细胞表面糖蛋白,其在各种细胞类型(包括淋巴细胞和癌细胞)的细胞增殖、细胞间相互作用、细胞粘附和细胞迁移中起作用。人CD44多肽序列记载于例如GenBank登录No.NP_000601中。人CD44 mRNA(编码)序列记载于例如GenBank登录No.NM_000610中。乳脂球-EGF因子8蛋白(MFG-E8)是巨噬细胞产生的蛋白质,其促进肿瘤细胞凋亡和吞噬。人MFG-E8多肽序记载于例如GenBank登录No.NP_005919中。人MFG-E8 mRNA(编码)序列记载于例如GenBank登录No.NM_005928中。CD68是110-kD跨膜糖蛋白,其由人单核细胞和组织巨噬细胞高度表达。该蛋白主要定位于溶酶体和内体,其中较小的部分循环到细胞表面。它是具有高度糖基化的胞外域的I型整合膜蛋白,并且与组织和器官特定的凝集素或选择素结合。CD68也是清道夫受体家族的成员。人CD68多肽序列记载于例如GenBank登录No.NP_001242中。人CD68mRNA(编码)序列记载于例如GenBank登录No.NM_001251中。TGFβ是参与细胞生长、细胞增殖、细胞分化、细胞凋亡、体内平衡和很多其他细胞过程的细胞因子。人TGFβ多肽序列记载于例如GenBank登录No.NP_000651中。人TGFβmRNA(编码)序列记载于例如GenBank登录No.NM_000660中。
应当理解,相对于正常或对照组织样本中肿瘤生物标志物的表达水平,患者样本中本文中描述的每种生物标志物的表达水平可以增加或降低。例如,与正常组织中的表达水平相比,肿瘤样本中的一种肿瘤生物标志物的表达水平可以增加,而与正常组织中的表达水平相比,在肿瘤样本中的第二种生物标志物的表达水平可以降低。表达水平也可以基于患者样本中的所有肿瘤生物标志物表达水平的平均、组合或总和。例如,可以对患者样本中的每种生物标志物的表达水平进行排名或加权,以产生高于或低于正常组织值的排名值(该值可以是标准化值,例如,设置为1)。
在一些实施例中,确定来自患有肿瘤的受试者的生物样本中的生物标志物表达。在一些实施例中,生物学样本是肿瘤样本。肿瘤样本可以是包括来自肿瘤的肿瘤细胞的活检。在一些实施例中,生物样本包含来自受试者的体液,诸如但不限于血液、血清、血浆或尿、和/或细胞或组织。在一些实施例中,生物学样本是福尔马林固定且石蜡包埋的组织或肿瘤样本。在一些实施例中,生物学样本是冷冻组织或肿瘤样本。因此,在一些实施例中,本文中描述的方法的一个或多个步骤在体外进行。例如,在一些实施例中,在体外确定生物标志物表达。
在一些实施例中,正常组织样本包含来自与肿瘤相同组织类型的非肿瘤细胞。在一些实施例中,正常组织样本获自被诊断患有肿瘤的同一受试者。正常组织样本也可以是来自不同受试者的相同组织类型的对照样本。正常组织样本的表达水平也可以是从正常组织样本的群体中获得的平均或均值。
本文中描述的生物标志物的表达水平可以使用本领域已知的任何方法来确定。例如,表达水平可以通过检测核酸(例如,RNA、mRNA或微小RNA)或由该核酸编码的蛋白质的表达来确定。
用于检测核酸的表达水平的示例性方法包括但不限于Northern分析、聚合酶链反应(PCR)、逆转录PGR(RT-PCR)、实时PCR、定量实时PCR和DNA微阵列。
用于检测蛋白质(例如,多肽)的表达水平的示例性方法包括但不限于免疫组织化学、ELISA、Western分析、HPLC和蛋白质组学测定。在一些实施例中,使用Allred方法通过免疫组织化学来确定蛋白质表达水平,以分配得分(参见例如“Allred,D.C,Connection9:4-5,2005”,其通过引用并入本文)。例如,使福尔马林固定的、石蜡包埋的组织与特异性结合本文中描述的生物标志物的抗体接触。利用可检测的标记或与可检测的标记耦合的第二抗体(诸如比色标记(例如,由HRP或AP产生的酶促底物))检测结合的抗体。通过估计阳性肿瘤细胞的比例及其平均染色强度,对抗体阳性信号进行评分。比例和强度得分两者组合为用于对这两个因素加权的总得分。
在一些实施例中,蛋白质表达水平通过数字病理学来确定。数字病理学方法包括扫描固体支持物(诸如载玻片)上的组织的图像。使用扫描设备将载玻片扫描成完整的幻灯片图像。扫描的图像通常存储在信息管理系统中以进行存档和取回。图像分析工具可以用于从数字幻灯片获得客观的定量测量结果。例如,可以使用适当的图像分析工具来分析免疫组织化学染色的面积和强度。数字病理系统可以包括扫描仪、分析(可视化软件、信息管理系统和图像分析平台)、存储和通信(共享服务、软件)。数字病理系统可从众多商业供应商处获取,例如Aperio Technologies,Inc.(莱卡显微系统有限公司的子公司)和VentanaMedical Systems,Inc.(现为Roche的一部分)。表达水平可以通过商业服务提供商进行量化,包括Flagship Biosciences(CO)、Pathology,Inc.(CA)、Quest Diagnostics(NJ)和Premier Laboratory LLC(CO)。
在一些实施例中,肿瘤的成像(诸如功能性成像)也用于标识或选择应当接受本文中描述的联合疗法的癌症患者。功能成像的非限制性示例包括单光子发射计算机断层扫描、光学成像、超声检查、正电子发射断层扫描(PET)、计算机断层扫描(CT)、灌注计算机断层摄影、磁共振成像(MRI)、功能磁共振成像、磁磁共振波谱成像、动态对比增强成像、弥散加权成像、血氧水平依赖性成像、磁共振波谱、磁共振淋巴照相、及其任何组合。可以执行诸如多模态成像等任何类型的功能成像,以表征肿瘤,以确定肿瘤的谱、肿瘤的范围、肿瘤的体积,和/或以评估肿瘤的微环境(例如,肿瘤周围的环境)。功能成像可以辅助选择最佳治疗方案和/或监测对治疗的反应。
用于选择治疗过程的方法
生物标志物的表达水平可以用于确定或选择诊断为患有肿瘤的受试者的治疗过程。例如,在一些实施例中,治疗包括对受试者内的肿瘤施用电离辐射,诸如FLASH RT。电离辐射也可以施用于整个受试者或其一部分,特别是在肿瘤是分散的或活动的情况下。在一些实施例中,治疗还包括使肿瘤与辐射敏化剂接触。在一些实施例中,治疗还包括向受试者施用抑制免疫检查点通路的化合物或生物药物,诸如抗体。在一些实施例中,治疗包括施用与免疫调节剂相结合的FLASH辐射治疗方案。
治疗过程可以基于生物标志物的表达水平来选择。例如,表达水平可以用于确定辐射疗法是否适合于受试者(即,用于对辐射疗法做出通过/不通过的决策)。此外,如果生物标志物的表达水平相对于正常值或对照值增加,则可以增加对肿瘤的有效辐射剂量,和/或相应地修改分割安排。在一些实施例中,增加对肿瘤的FLASH RT的有效剂量。还可以增加对供养肿瘤的血管的辐射剂量。在某些情况下,施用大分割辐射治疗。备选地,施用超分割辐射治疗。在一些实施例中,与免疫调节剂治疗相结合地提供FLASH辐射治疗。
在一些实施例中,如果生物标志物的表达水平相对于正常值或对照值增加,则治疗可以包括向肿瘤施用电离辐射,诸如FLASH RT。在一些实施例中,如果生物标志物的表达水平相对于正常值或对照值降低,则治疗可以包括减少向肿瘤施用的电离辐射或FLASH RT的量。
治疗还可以包括修改现有的治疗过程。例如,在一些实施例中,修改现有的治疗过程以增加向肿瘤施用的电离辐射(诸如FLASH辐射)的有效剂量。在一些实施例中,通过增加向肿瘤施用的电离辐射的量和/或使肿瘤与辐射敏化剂接触,增加诸如FLASH辐射的电离辐射的有效剂量。在一些实施例中,修改现有的治疗过程以降低向肿瘤施用的电离辐射的有效剂量。在一些实施例中,治疗包括与施用免疫调节剂相结合来修改标准辐射治疗方案。
在一些实施例中,如果本文中描述的一种或多种生物标志物的水平在肿瘤环境中升高,则增加向肿瘤施用的电离辐射(诸如FLASH辐射)的有效剂量。例如,与在肿瘤环境中(多个)生物标志物水平没有升高的受试者的治疗标准相比,增加电离辐射的有效剂量。这适用于当前未经受辐射治疗的受试者,以及针对经受辐射治疗的受试者修改现有治疗方案的方法。因此,如果受试者已经经受针对肿瘤的辐射治疗,则可以从当前有效剂量增加电离辐射的有效剂量。可以修改辐射疗法以减少对邻近健康组织的约束。例如,如果肿瘤环境中的生物标志物水平指示需要更积极的辐射治疗,则可以修改治疗计划,以减少对健康组织和肿瘤组织之间的边界的约束。这将导致在损害一些健康组织以杀死更多肿瘤组织之间的权衡。
在一些实施例中,治疗包括辐射疗法和免疫调节剂(包括辐射敏化剂)的组合。在一些实施例中,治疗包括FLASH辐射治疗和免疫调节剂(包括辐射敏化剂)的组合。在一些实施例中,当向受试者施用免疫调节剂时,向肿瘤施用的电离辐射的有效剂量不改变(例如,相对于护理标准或相对于现有的治疗过程)。例如,在一些实施例中,向受试者施用与对本文中描述的一种或多种生物标志物在肿瘤环境中没有升高水平的受试者施用的相同或相似的有效剂量的电离辐射,并且进一步向受试者施用免疫调节剂。在一些实施例中,向肿瘤施用的电离辐射的有效剂量基于在肿瘤环境中没有升高的(多个)生物标志物水平的受试者的护理标准,并且进一步向受试者施用免疫调节剂代理。在涉及现有的治疗过程的一些实施例中,电离辐射的有效剂量被维持在当前有效剂量,并且如果本文中描述的一种或多种生物标志物的水平在肿瘤环境中升高,则与电离辐射相结合来向受试者施用抗癌剂。
在一些实施例中,基于本文中描述的生物标志物的表达水平来制定和/或修改治疗计划。
还可以通过使用分析或者确定肿瘤样本中的生物标志物相对于正常样本中的水平的表达水平的算法(例如计算机实现的算法),选择治疗过程。该算法可以是线性回归算法,其包括生物标志物表达水平和用于组合表达水平的系数(即,权重)。在一些实施例中,该算法包括用于计算系数的最小二乘拟合。如果算法确定肿瘤样本中的生物标志物的表达水平相对于正常样本升高或降低,则可以分配适当的治疗过程。在一些实施例中,该算法是非参数回归树。在一些实施例中,取决于算法确定肿瘤样本中的生物标志物的表达水平相对于正常样本升高或降低,包括FLASH辐射和免疫调节剂的治疗被选择。在一些实施例中,使用标准统计方法来分析数据,以确定哪些生物标志物最能预测临床存活或局部肿瘤控制失败。
在一些实施例中,本文中描述的方法是计算机实现的方法。在一些实施例中,计算机实现的方法包括线性回归模型,该线性回归模型向本文中描述的生物标志物的表达水平分配排名或加权值。在一些实施例中,本公开提供了一种计算机可读介质,该介质提供用于使得计算机执行本文中描述的方法的指令。例如,介质可以提供用于使得计算机向本文中描述的生物标志物的表达水平分配排名或加权值的指令。
辐射治疗
本文中描述的肿瘤生物标志物的表达水平可以用于优化利用辐射疗法(诸如FLASH RT)对患者的治疗。例如,可以基于生物标志物的表达水平,调整向肿瘤或受试者施用的辐射的治疗剂量。电离辐射的有效剂量随肿瘤类型和需要治疗的癌症阶段而变化。有效剂量还可以基于向患者施用的其他治疗模式(例如,化学疗法和外科治疗)以及是否在手术前或手术后进行辐射治疗而变化。通常,针对实体上皮肿瘤的常规有疗效的治疗剂量为约60至80戈瑞(Gy),而针对淋巴瘤的有疗效剂量为约20至40Gy。通常,预防剂量可以是45-60Gy。对于FLASH照射,针对实体上皮肿瘤的有疗效的治疗剂量可以在约20至200戈瑞(Gy)的范围内,而针对淋巴瘤的有疗效的剂量可以在约10至200Gy的范围内,而预防剂量为5-500Gy。
治疗剂量可以分割式递送。分割是指随着时间(例如,几天、几周或几个月)散布总辐射剂量。每个分割中递送的剂量可以是每天约1.5-2Gy。取决于每个患者的治疗需求,治疗计划可以包括每天、隔日、每周等一次或多次的分割治疗。例如,大分割安排包括将总剂量分成几个相对较大的剂量,并且至少隔一天施用剂量。示例性大分割剂量为每个部分3Gy至20Gy。可以用于治疗肺癌的示例性分割安排是连续超分割加速辐射治疗(CHART),其每天由三小部分组成。
在一些实施例中,FLASH RT包括使受试者内的肿瘤与辐射敏化剂接触。示例性的辐射敏化剂包括低氧辐射敏化剂,诸如米索硝唑、甲硝唑和克罗西汀反式钠,其是有助于增加氧向低氧肿瘤组织中的扩散的化合物。辐射敏化剂也可以是DNA损伤反应抑制剂,其干扰碱基切除修复(BER)、核苷酸切除修复(NER)、错配修复(MMR)、包括同源重组(HR)和非同源末端连接(NHEJ)的重组修复、以及直接修复机制。SSB修复机制包括BER、NER或MMR通路,而DSB修复机制包括HR和NHEJ通路。辐射导致如果不及时修复将致命的DNA断裂。使用完整的DNA链作为模板,通过BER、NER和MMR机制的组合,修复单链断裂。SSB修复的主导通路是利用被称为聚(ADP核糖)聚合酶(PARP)的一系列相关酶的BER。因此,辐射敏化剂可以包括DNA损伤反应抑制剂,诸如聚(ADP)核糖聚合酶(PARP)抑制剂。
本文中描述的生物标志物可以用于开发和修改被诊断为患有肿瘤或癌症的患者的治疗计划。该治疗计划可以包括可视化或测量需要被照射的肿瘤体积、向肿瘤施用的辐射的最佳或有效剂量、以及防止对附近健康组织或有风险的器官造成损害的最大剂量。算法可以用于治疗计划,并且包括基于所采用的特定放射疗法技术参数(例如,机架角度、MLC叶位置等)的剂量计算算法、以及使用各种技术在剂量计算之间调整系统参数以优化治疗效果的搜索算法。示例性剂量计算算法包括各种蒙特卡罗(“MC”)技术和笔形射束卷积(“PBC”)。示例性搜索算法包括各种模拟退火(“SA”)技术、代数逆处理计划(“AITP”)和同时迭代逆处理计划(“SIITP”)。这样的技术和其他技术被包括在本公开的范围内。
治疗计划算法可以被实现为提供附加特征和能力的集成式治疗计划软件包的一部分。例如,可以使用剂量计算算法和搜索算法来优化每个机架角度处的一组通量图,其中使用单独的叶定序器来计算递送叶片所需要的叶运动。备选地,可以使用剂量计算算法和搜索算法来直接优化叶运动和其他机器参数。本申请的受让人提供的Eclipse
在一些实施例中,本文中描述的生物标志物可以用于监测在FLASH辐射疗法之后肿瘤控制的进展。例如,可以比较电离FLASH辐射疗法之前和之后的生物标志物的表达水平。在一些实施例中,如果在放射疗法之后生物标志物的表达水平增加,则这暗示肿瘤的大小持续增长。因此,可以基于使用本文中描述的生物标志物监测肿瘤生长,修改辐射治疗。
本文中描述的生物标志物可以与本领域已知的任何辐射疗法技术一起使用。辐射治疗技术包括外束放射疗法(“EBRT”)和强度调制放射疗法(“IMRT”),其可以通过配备有多叶准直器(“MLC”)的放射疗法系统(诸如线性加速器)来施用。多叶准直器和IMRT的使用允许从多个角度对患者进行治疗,同时改变辐射射束的形状和剂量,从而避免对附近健康组织的过度照射。其他示例性辐射疗法技术包括立体定向放射疗法(SBRT)、体积调制电弧疗法、三维共形放射疗法(“3D适形”或“3DCRT”)、图像引导放射疗法(IGRT)。辐射疗法技术还可以包括自适应放射治疗(ART),这是一种形式的IGRT,其可以在辐射疗法过程期间修改治疗方法,以便根据患者的解剖结构变化以及器官和肿瘤的形状来优化剂量分布。另一种辐射疗法技术是近距离辐射治疗。在近距离辐射治疗中,将辐射源植入受试者体内,使得辐射源靠近肿瘤。如本文中使用的,术语放射疗法应当被广义地理解,并且意图包括用于照射患者的各种技术,包括使用光子(诸如高能x射线和γ射线)、粒子(诸如电子束和质子束)、FLASH RT和辐射外科技术。此外,将适形辐射提供给靶标体积的任何方法都意图在本公开的范围内。
治疗剂
本文中描述的FLASH辐射疗法可以与一种或多种治疗剂相结合施用。治疗剂的示例包括免疫调节剂、抗衰老剂、辐射敏化剂和纳米颗粒。
在一些实施例中,治疗剂是有丝分裂纺锤体抑制剂。在一些实施例中,将辐射疗法与有丝分裂纺锤体抑制剂相结合,有丝分裂纺锤体抑制剂诸如细胞周期素抑制剂,例如CDK4/6抑制剂(例如,Pablociclib)、AURKA抑制剂(诸如小分子Alisertib和Tozasertib),阻断TPX2-AURKA的复合物,诸如复合破坏剂(GSK1070916)(Asteriti等人,2015;Janecek等人,2016)和紫杉烷(诸如多西紫杉醇、紫杉醇)。
在一些实施例中,治疗剂是DNA修复和反应通路抑制剂。在一些实施例中,将FLASH辐射疗法与以下相结合使用:PARP抑制剂(例如,Talazoparib、Rucaparib、Olapabrib)(Lord和Ashworth,2016;Murai等人,2012)、RAD51抑制剂(RI-1)、或DNA损伤反应激酶的抑制剂(诸如CHCK1(AZD7762)、ATM(KU-55933、KU-60019、NU7026、VE-821)和ATR(NU7026)。
在一些实施例中,治疗剂是KRAS和/或MAPK通路的抑制剂。在一些实施例中,将FLASH辐射疗法与KRAS上游和/或下游的抑制剂相结合。上游抑制剂可以以EGFR(埃洛替尼、吉非替尼、拉帕替尼、阿法替尼)和/或SHP2(RMC-4550)为靶标。下游抑制剂包括MEK(曲美替尼、塞鲁米替尼、PD0325901)、BRAF(达布拉非尼、韦拉非尼、PLX-4720)或ERK(SCH772984、LY3214996、GDC-0994)的抑制剂。
在一些实施例中,治疗剂是上皮向间质(EMT)转化的抑制剂。TGF-β是EMT的已知驱动。因此,在一些实施例中,将FLASH辐射疗法与EMT转化的抑制剂相结合,EMT转化的抑制剂诸如小分子抑制剂(例如,SD-208、LY2109761、LY21157299)或其结合TGF-β的抗体或其片段。
在一些实施例中,治疗剂诱导或为TH1通路的激活剂。T辅助1型(Th1)细胞是CD4
在一些实施例中,治疗剂是磷酸酶和肌腱蛋白同源蛋白(PTEN)通路的激活剂,其对癌变是保护性的。PTEN通路在经Flash照射的组织中被激活,并且因此与常规辐射相比,Flash辐射预计对组织具有保护效果。发明人还观察到与常规照射的老鼠相比,Flash中的肺纤维化减少,并且因此Flash照射可以通过PTEN通路的激活来减少肺纤维化。因此,在一些实施例中,FLASH辐射疗法与PTEN通路的激活剂相结合。PTEN通路的激活剂/激动剂在US2011/0189169 A1中描述,并且包括mTOR抑制剂,诸如雷帕霉素(
在一些实施例中,治疗剂是TGF-β通路的抑制剂。TGF-β是已知参与多种正常组织毒性作用(包括肺纤维化)的蛋白质。骨形态发生蛋白(BMP)是TGF-β超家族的成员,并且在Flash治疗之后BMP通路被下调。与用常规辐射治疗的老鼠相比,经Flash治疗的老鼠还表现出减少的肺纤维化。因此,在一些实施例中,Flash辐射疗法与TGF-β通路的抑制剂相结合,TGF-β通路的抑制剂诸如小分子抑制剂(例如,SD-208、LY2109761、LY21157299)或结合TGF-β的抗体或其片段。
在一些实施例中,治疗剂是1型干扰素(IFN)的激活剂或诱导剂,其影响先天性和适应性免疫反应的发展。与常规辐射治疗相比,在经FLASH治疗的动物中IFN信号通路被下调。1型干扰素以平衡方式调节先天免疫反应,该平衡方式促进抗原呈递和自然杀伤细胞功能,同时抑制促炎通路和细胞因子产生。1型干扰素还激活适应性免疫系统,从而促进高亲和力抗原特异性T和B细胞反应和免疫记忆的发展。微环境中的1型干扰素促进DC的成熟和抗原呈递,并且增强内源性NK或CD8+T-细胞介导的抗肿瘤免疫反应。因此,在一些实施例中,将FLASH辐射疗法与1型干扰素的激活剂或诱导剂相结合,这预期将创建包括T细胞的免疫细胞可以在其中清除肿瘤细胞的环境。
在一些实施例中,1型干扰素的激活剂或诱导剂是STING/cGAS通路的激活剂。STING/cGAS通路的激活剂包括合成CDN STING激动剂、小分子STING激动剂、小分子STING通路激动剂、病毒编码的STING通路激动剂、细菌编码的STING通路激动剂、或STING激动剂包裹的纳米颗粒和脂质体。在一些实施例中,干扰素激活剂包括结合并且激活Toll样受体(TLR)(诸如TLR4和TLR9)的化合物、以及激活MAVS通路的化合物。
在一些实施例中,治疗剂是树突细胞(DC)成熟的激活剂。如本文中描述的,在FLASH处理后,DC成熟被下调。树突状细胞中吞噬功能的调节、以及由此通过先天信号进行的抗原加工和呈递表示适应性和先天免疫系统整合的关键水平。因此,在一些实施例中,FLASH辐射疗法与DC成熟的激活剂(诸如合成肽疫苗)相结合。
此外,CD47/SIRP-α的抑制剂可以用于由增强树突状细胞进行的抗原交叉呈递和增加的T细胞引发。因此,在一些实施例中,将FLASH辐射疗法与CD47/SIRP-α的抑制剂组合,CD47/SIRP-α的抑制剂诸如抗体、抗体衍生物或其片段、以及抑制CD47/SIRP-α相互作用的化合物或小分子。
在一些实施例中,治疗剂是芳烃受体(ahR)抑制剂。在一些实施例中,FLASH疗法与ahR抑制剂相结合,ahR抑制剂如SR1、CH-223191、UM729或高良姜素。
免疫调节剂
本文中描述的FLASH辐射疗法可以与一个或多个免疫调节剂相结合施用。与任一治疗作为单一疗法的施用相比,联合疗法可以提供更高的抗肿瘤反应(阳性临床反应)。在某些情况下,免疫调节剂可以选自由以下项组成的组:对抑制性检查点分子的抑制剂、刺激性检查点分子的激活剂、趋化因子抑制剂、巨噬细胞迁移抑制因子(MIF)的抑制剂、生长因子、细胞因子、白介素、干扰素、与免疫系统细胞结合的抗体(诸如与T细胞和肿瘤抗原结合的双特异性抗体)、细胞免疫调节剂(诸如CAR-T细胞)、疫苗、溶瘤病毒及其任何组合。
免疫调节剂可以包括与在免疫系统细胞的表面上表达的分子结合的小分子和生物疗法(例如,抗体、其片段和其衍生物),免疫系统细胞诸如抗原呈递细胞和T细胞。生物疗法还可以包括与抗原呈递肿瘤细胞和T细胞结合的双特异性抗体、其片段和其衍生物。免疫调节剂还可以包括抑制或刺激免疫系统的小分子。在一些情况下,免疫调节剂刺激CD27+免疫细胞,或抑制一个或多个抑制性检查点分子,包括PD-1、PD-L1、PD-L2、CTLA-4、BTLA、A2aR、B7-H2、B7-H3、B7-H4、B7-H6、CD47、CD48、CD160、CD244(2B4)、CHK1、CHK2、CGEN-15049、ILT-2、ILT-4、LAG-3、VISTA、gp49B、PIR-B、TIGIT、TIM1、TIM2、TIM3、TIM4、KIR及其配体等。免疫检查点通路和信号分子在例如Pardoll的“Nature Rev Cancer,2012,12:252-264”和Mellman等人的“Nature,2011,480:480-489”中描述。
抑制性检查点分子的抑制剂可以是特异性结合或识别以下各项的抗体或其片段:PD-1、PD-L1、PD-L2、CTLA-4、BTLA、A2aR、B7-H2、B7-H3、B7-H4、B7-H6、CD47、CD48、CD160、CD244(2B4)、CHK1、CHK2、CGEN-15049、ILT-2、ILT-4、LAG-3、VISTA、gp49B、PIR-B、TIGIT、TLM1、TIΜ2、TIΜ3、T1M4、KIR及其配体。在一些实施例中,CTLA-4抑制剂选自由伊匹木单抗、曲美木单抗等组成的组。小分子免疫调节剂的一个非限制性示例是酶吲哚胺2,3-双加氧酶(IDO)的抑制剂。在一些实施例中,免疫调节剂是PD-1、PD-L1、PD-L2或CTLA-4的抑制剂。
在一些实施例中,PD-1抑制剂选自由以下项组成的组:派姆单抗、尼武仑单抗、兰博珠单抗、匹地珠单抗、AMP-244、MEDI-4736、MPDL328OA、MIH1、IBI-308、mDX-400、BGB-108、MEDI-0680、SHR-1210、PF-06801591、PDR-001、GB-226、STI-1110、其生物仿制药、其生物增强药、及其生物等效物。在一些实施例中,PD-L1抑制剂选自由以下项组成的组:durvalumab、atezolizumab、avelumab、BMS-936559、ALN-PDL、TSR-042、KD-033、CA-170、STI-1014、KY-1003、生物仿制药、生物增强药、及其生物等效物。
在一些实施例中,刺激性检查点分子的激活剂是小分子、抗体或其片段、基于多肽的激活剂、基于多核苷酸的激活剂(即,适体)、激动剂、激动剂抗体或其片段等。刺激性检查点分子可以是B7-1(CD80)、B7-2(CD86)、4-1BB(CD137)、OX40(CD134)、HVEM、可诱导共刺激分子(ICOS)、糖皮质激素诱导的肿瘤坏死因子受体(GITR)、CD27、CD28、CD40或其配体,
在一些实施例中,作为免疫调节剂来施用趋化因子抑制剂。趋化因子抑制剂可以是与趋化因子(或其受体)特异性结合并且抑制其活性的小分子或抗体或其片段。在一些实施例中,趋化因子选自由以下项组成的组:CCL2、CCL3、CCL4、CCL5、CCL7、CCL8、CCL11、CCL12、CCL13、CCL14、CCL15、CCL16、CCL17、CCL18、CCL19、CCL20、CCL21、CCL22、CCL23、CCL24、CCL5、CCL26、CCL27、CCL28、CXCL1、CXCI.2、CXCL3、CXCL4、CXCL5、CXCL6、CXCL7、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CXCL13、CXCL14、CXCL5和CXCL16、或与癌症相关联的其他趋化因子,诸如将白细胞运至肿瘤微环境(例如,控制白细胞向肿瘤的浸润)。在一些实施例中,趋化因子抑制剂与选自由以下项组成的组的趋化因子受体结合:CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CCR10、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6和CXCR7。
免疫调节剂的附加示例包括但不限于抗TIM4抗体、抗MFG-E8抗体、抗M199抗体、其任何组合等。在一些实施例中,免疫调节剂包括与引发和激活免疫系统有关的试剂(抗体或小分子),并且包括以CTLA4、B7(B7-lor B7-2)、PD-L1/PD-L2或PD-1为靶标的试剂、或者以CTLA4与B7-1/B7-2之间或PD-1与PD-L1/PD-L2之间的结合相互作用为靶标的试剂。以CTLA4、B7(B7或B7-2)、PD-L1/PD-L2和PD-1为靶标的试剂包括特异性结合这些分子的抗体,诸如单克隆抗体。在一些实施例中,试剂是与LAG 3、TIM1、TIM3、MFG-E8、IL-10或磷脂酰丝氨酸特异性结合的抗体。
本文中描述的免疫调节剂可以以治疗有效剂量被施用。治疗有效剂量可以由本领域普通技术人员基于所施用的免疫调节剂的类型来确定。可以使用本领域描述的剂量、施用路线和施用方案。代表性剂量在“Merck Manual Professional Edition”(参见互联网merckmanuals.com/professional)中可获取。
此外,可以基于体表面积(BSA)(以mg/m2表示)归一化方法将向动物施用的免疫调节剂的剂量转换为针对人类的等效剂量(参见例如FASEB J.22的659-661(2007)的Reagan-Shaw、S.等人的“Dose translation from animal to human studies revisited”以及美国卫生与公共服务部、食品药物管理局、药物评估与研究中心(CDER)2005年7月的药理学和毒理学的“Guidance for Industry-Estimating the Maximum Safe Starting Dose inInitial Clinical Trials for Therapeutics in Adult Healthy Volunteers”;其通过引用并入本文)。例如,可以通过下式I计算基于BSA的人类等效剂量(HED):
I.HED=以mg/kg计的动物剂量×(以kg计的动物重量/以kg计的人类重量)0.33
备选地,可以通过下式II确定HED:
II.HED(mg/kg)=动物剂量(mg/kg)×(动物Km/人类Km)
基于下表确定Km系数(参见“Guidance for Industry,Id.”):
表X:基于体表面面积将动物剂量转换为人类等效剂量
假定60kg的人。
因此,在老鼠中5mg/kg的剂量等效于60kg的人中的0.4mg/kg的剂量。在60kg的人中的0.4mg/ml的剂量等于14.8mg/m2的剂量。
在一些实施例中,以治疗有效的量来施用本文中描述的免疫调节剂达有效治疗癌症或肿瘤的时间段。本文中描述的免疫调节剂的有效量可以由本领域普通技术人员确定,并且包括为免疫调节剂的体重的如下百分比的针对哺乳动物的计量的量:约0.5至约200mg/kg、约0.5至约150mg/kg、约0.5至约100mg/kg、约0.5至约75mg/kg、约0.5至约50mg/kg、约0.01至约50mg/kg、约0.05至约25mg/kg、约0.1至约25mg/kg、约0.5至约25mg/kg、约1至约20mg/kg、约1至约10mg/kg、约20mg/kg、约10mg/kg、约5mg/kg、约2.5mg/kg、约1.0mg/kg或约0.5mg/kg、或其中可得出的任何范围。在一些实施例中,免疫调节剂的剂量的量为体重的从约0.01mg/kg至约10mg/kg。在一些实施例中,免疫调节剂的剂量为体重的从约0.01mg/kg至约5mg/kg或从约0.01mg/kg至约2.5mg/kg。本文中描述的组合物可以以单个剂量或以单独的分剂量的形式被施用,诸如每天1至4次,或者每2天、3天、4天、5天、6天、每周、或每月一次。本文中描述的组合物也可以被施用各种治疗周期,诸如2、3、4、5、6、7、8、9、10个治疗周期。取决于待治疗的癌症,治疗周期可以是不同的时间长度,例如1、2、3、4、5、6、7、8、9或10个周的治疗周期。另外,本文中描述的免疫调节剂的有效量可以在临床前试验和临床试验期间通过医师和临床医生已知的方法确定。
示例
提供以下示例以说明而非限制所要求保护的实施例。
示例1:
该示例提供了对利用常规和FLASH照射来治疗的老鼠中的基因表达谱和组织损伤进行比较的研究的结果。
微阵列方法:
样本:以常规质子剂量率(1Gy/s)、Flash剂量率(40Gy/s)、Split Flash(将总剂量分成10等份,每个部分间隔1秒的时间段,递送时的瞬时剂量为40Gy/s,整体剂量率为4Gy/s)照射C57BL/6老鼠。392只年龄和性别匹配的老鼠分6个队列进行治疗,并且在肺照射之后的l小时-36周死亡。每个队列4组:Sham(假):无辐射;常规:1Gy/s;FLASH:40Gy/s射束接通;Split-FLASH:4Gy/0.1sec,脉冲递送(参见图5)。在辐射和收集肺脏之后的24小时、8周、16周或24周对动物实施安乐死。为了进行基因表达分析,总共采集了96个肺样本(24个样本/时间点),分别来自四个不同治疗组的三只雄性和三只雌性,四个不同治疗组即Sham、常规15Gy、Flash15Gy和Split Flash 15Gy。
RNA分离和质量控制:使用Qiagen RNasy组织微阵列试剂盒(Qiagen cat 74104)来分离总的RNA。简而言之,将来自老鼠(20-30mg)的冷冻中左肺在液氮中匀浆,并且使用制造商方案分离RNA。使用2100生物分析仪(Agilent技术)评估所分离的RNA的完整性,并且仅考虑RNA完整性数至少为7或28/18S比率为1.3或更高的样本进行进一步处理。
样本扩增和标记:荧光Cy3标记使用基于单色微阵列的基因表达分析低输入快速扩增标记按安捷伦科技公司的建议来进行。每个样本的100ng RNA被扩增,并且利用基于单色微阵列的基因表达分析低输入量快速扩增标记试剂盒进行标记,并且在每个贴片上使用600ng的Cy3标记的cRNA来进行杂交。使用Nanodrop测量Cy3的扩增和整合,并且仅进一步使用比活度大于8的样本。
基因表达谱使用安捷伦科技公司(美国加利福尼亚州,帕洛阿尔托)生产的SurePrint G3老鼠基因表达v2微阵列8×60K而生成。标记和杂交遵循制造商的规程执行。每个样本一式三份加载到安捷伦阵列上以用于总共72个槽。然后,使用安捷伦的High-RPM基因表达Hyb试剂盒在8×60K阵列上杂交600ng的Cy3标记的cRNA。在旋转的hyb烘箱中以10rpm在65℃执行杂交20小时。在清洗后,使用Innopsys 710Innoscan扫描阵列。使用Innopsys Feature Extraction软件Mapix处理所得到的TIFF图像。
表达谱预处理和标准化:在使用Mapix软件进行图像提取之后,进行技术副本之间的相关性分析以标识与同级副本不相关的任何技术副本。通过计算每个技术副本的平均强度的中位和中位背景,将通过QC的任意阵列合并到一个文件中。使用R包Limma(Ritchie等人,2015)来分析数据文件。在上传数据之后,将中位荧光强度阵列进行分位数归一化,以允许跨不同的比较(Bolstad等人,2003)。为了处理标记的斑点,值小于-50的所有标记的权重被分配为0。这确保了在数据的线性拟合期间不考虑这些点进行线性拟合。
基因集富集分析(GSEA):在标准化之后,将数据用于GSEA分析以标识每个治疗组中的富集通路(Subramanian等人,2005)。使用HALLMARKS(标志性)基因集运行经典的GSEA分析,使用治疗组与sham之间的探针水平数据。对于下游分析,考虑将FDR-q值小于25%并且校正后的p值小于或等于0.05的通路用于报告和下游目的。
差异表达基因分析:为了标识治疗组之间的差异表达基因,使用Limma包,其实现数据的线性模型拟合,然后使用温和T检验对比较组之间的探针进行比较。为了校正多个假定,使用Bonferroni-Hochberg方法的测试p值被调整,并且考虑将调整后的p值小于或等于0.05的基因用于下游分析(Benjamini和Hochberg,1995)。
独创性通路分析(IPA):通过生成大多数受调控基因的列表对微阵列数据进行常规分析不足以了解受调控基因的功能及其在生物过程中的作用。因此,还使用IPA执行分子通路分析,来预测哪些典型通路、上游调节剂和生物功能发生了变化,以标识分子事件并且进一步揭示通过将辐射剂量率从1Gy/s改变为40Gy/s而被调控的分子机制。IPA在基因列表中进行搜索,并且确定与有据可查的典型信号转导或代谢通路有关的基因。
IPA首先向Ingenuity Pathways知识库查询聚焦的基因之间的相互作用,然后是存储在知识库中的所有其他基因对象。对于我们的数据,查询符合参数P值为0.05的基因以进行IPA核心分析,随后标识被调制的主要的典型通路。基于两个参数确定数据集与典型通路之间的关联的显著性:(1)数据集中映射到通路的基因的数目除以映射到典型通路的基因的总数目的比率;以及(2)使用Fischer精确检验随后是Benjamini Hotchberg校正(FDR截止值≤0.1)所计算的P值,Benjamini Hotchberg校正确定数据集中的基因与典型通路之间的关联仅是由于偶然性造成的概率;3)Z得分1.5或更高的绝对值截止,以预测特定通路的富集和激活状态。符合所有这些标准的通路被预测为显著调节的。
TUNEL方法:
TUNEL荧光染色:使用原位细胞死亡检测试剂盒荧光素(Sigma-AldrichCorporation,Saint Louis,MO)通过末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)荧光染色确定凋亡。将速冻的肺组织切成5μm厚,然后根据制造商的指导进行固定、透化和染色。还利用DAPI(NucBlue
分析:在尼康ECLIPSE Ni-E显微镜(日本千代田,日本尼康公司)上以100X放大率,在DAPI和FITC荧光通道(分别为核和TUNEL)中油浸的情况下针对每个样本对多个视场成像。这些图像被导入QuPath(
肺功能:使用全身体积描记仪评估肺和penh(Jackson等人Health Physics2014)。进行penh的基线测量,并且每2周监测动物的肺功能。结果在图6中示出。
肺纤维化:老鼠被未治疗或被常规的、FLASH的或split flash辐射治疗。在第16、24和36周的各种时间点对老鼠实施安乐死,将肺组织固定在福尔马林中并且包埋在封口膜中。肺切片用马松三重染色法和H&E染色进行染色,由受过训练的病理学家进行显微镜评估,该病理学家使用MFSS评分方案从0-8对纤维化进行评分(Ashcroft Journal ofClinical Pathology 1988and Hubner et al Biotechniques 2008),其中0表示没有纤维化,并且8对应于严重纤维化完全消除了肺部结构,并且完全丧失了空位(闭塞性纤维化)。结果在图10中示出。
通过使用道格拉斯和福勒量表对老鼠的皮炎进行评分。得分在0与3.5之间进行,其中0是正常,并且3.5在大部分受照射区域以及坏死中的潮湿脱皮(Ryan等人的Journalof investigative Dermatology2012)。结果在图9中示出。
存活:用15、17.5和20Gy的常规或Flash辐射剂量治疗老鼠。每个辐射剂量组由20只年龄匹配的动物构成(50%的雄性和50%的雌性)。每周三次监测动物,如果体重减轻超过20%(两天之内没有恢复)或由兽医评分为严重的皮炎,则对动物实施安乐死。结果在图7和图8中示出。
结果:
使用FLASH辐射改善了肺功能并且减少了纤维化
图6示出了与常规辐射治疗相比,FLASH的肺功能得到改善。这种差异证实了辐射毒性的剂量率依赖性的存在。图10示出了在17.5Gy处针对FLASH的平均肺纤维化严重程度与常规组相比降低23%。这种差异证实了辐射毒性的剂量率依赖性的存在。图11示出了与FLASH治疗相比常规的平均肺重量增加——0.46g与0.40g(M);0.37g与0.32g(F)。该研究指示,FLASH使正常组织保留。
与常规辐射相比在利用FLASH照射之后老鼠的存活率得到提高
图7示出了与常规辐射治疗组相比FLASH的中位存活率得到提高:20.0Gy:增加14%;17.5Gy:增加18%。图8示出了与常规辐射治疗组相比FLASH的中位存活率得到提高,以及取决于剂量率的治疗窗口的可能性:17.5Gy FLASH>17.5Gy CON;17.5Gy FLASH=20.0Gy CON。
与常规辐射相比FLASH减少了皮炎
图9示出了与常规辐射相比FLASH的平均皮炎减少:FLASH:减少34%;Split-FLASH:减少52%。这种差异证实了与皮炎有关的辐射毒性的剂量率依赖性的存在。
微阵列:
Flash放射疗法(FLASH RT)方式与有丝分裂纺锤体抑制剂协同作用
图12示出了在每个时间点处的差异表达基因的维恩图。在24小时的GSEA指示G2M检查点和E2F靶标被所有放射疗法方式所抑制(图13A)。这些特征指示细胞在治疗后停滞在G1和G2M。E2F靶标包括各种基因;然而,细胞周期素是该通路的主要靶标{cite}。因此,将Flash RT与CDK4/6抑制剂(Pablociclib)相结合使用可以维持放射疗法引起的细胞周期停滞。
在Flash组和split-Flash组中,有丝分裂纺锤体均被特异性下调(图14A、图14B)。对每个组的核心富集基因的重叠分析指示,有丝分裂纺锤体基因的关键调节子被下调,诸如AURKA、Kinesin-like蛋白家族基因(KIF11、KIF23、KIF23、KIF4A)和TPX2(图14C、图14D)。有证据表明AURKA和TPX2在几种靶向疗法的背景下在驱动获取性耐药中起主要作用(Donnella等人,2018;Panicker等人,2017)。在这些模型中,AURKA表达增加以驱动耐药性,因此阻断了AURKA表达,对于Flash和Split Flash疗法的疗效可能很重要。利用小分子抑制剂(Alisertib、Tozasertib)特异性靶向AURKA。TPX2是AURKA的驱动子,并且指示了使用复合干扰物(GSK1070916)阻断TPX2-AURKA复合物(Asteriti等人,2015;Janecek等人,2016)。最后,可以通过使用紫杉烷(多西紫杉醇、紫杉醇)来以有丝分裂纺锤体整体作为靶标。在24周结束时,FLASH RT上调有丝分裂纺锤体基因(图13D),以支持适应性基因表达变化可能对放射疗法的疗效起关键作用。
Flash RT方式与DNA损伤修复和反应抑制剂相结合
Flash RT特异性抑制DNA修复通路基因。在通路水平,Flash RT下调了HallmarkDNA修复通路(图13A和图15A)。核心富集分析揭示了关键的同源性定向修复(HR)基因的下调,诸如LIG1、RAD51和BRCA2(完整列表见图15B)。这些被下调的基因的直接含义指示,FLASH疗法诱导BRCAness表型,因此可以指示PARP抑制剂(Talazoparib,Rucaparib,Olapaparib)与FLASH RT相结合来以肿瘤作为靶标(Lord和Ashworth,2016;Murai等人,2012)。
另外,在抑制的DNA修复(即,BRCA1突变或BRCAness)的情况下,DNA损伤反应通过阻断该通路的关键调节剂而被阻断。例如,修复双链断裂需要RAD 51,因此FLASH RT和RAD51抑制剂(RI-1)的组合可以协同作用。此外,以其他DNA损伤反应激酶作为靶标在FlashRT诱导的BRCAness的情况中也是有效的,其他DNA损伤反应激酶诸如CHCK1(AZD7762)、ATM(KU-55933、KU-60019、NU7026、VE-821)、ATR(NU7026)(Ashworth和Lord,2018年;Lord和Ashworth,2016年)。
Flash RT与MAPK通路抑制剂相结合
在24小时之后,在所有治疗组中,很多通路的表达增加(图13B-图13D),特别是KRAS信号在所有治疗组中随时间上调,特别是在8-24周之间在常规和FLASH组中富集了“KRAS信号”(图16A-图16C)。KRAS信号是癌症的主要驱动,并且通过MAPK通路驱动很多生物学程序,包括增殖、细胞周期进程和促存活信号(Sun等人,2015)。有证据指示,常规辐射疗法取决于阻断EGF/EGFR信号(Wang等人,2011)。虽然RAS的直接抑制剂仍处于早期阶段,但目的是使用FLASH RT和KRAS上游和下游的抑制剂的结合来阻断上下游RAS信号(Downward,2003)。作为示例,可以与FLASH RT相结合使用上游抑制剂,诸如EGFR(厄洛替尼、吉非替尼、拉帕替尼、阿法替尼)和SHP2(RMC-4550)。作为另一示例,下游抑制剂可以与FLASH疗法相结合,下游抑制剂诸如MEK(曲美替尼、塞鲁米替尼、PD0325901)、BRAF(达布拉非尼、韦拉非尼、PLX-4720)或ERK(SCH772984、LY3214996、GDC-0994)。
放射治疗引发的EMT
在8-10周的时间过程中,上皮到间质(EMT)转化在8-16周之间在Flash中是上调通路(图13B-图13C);然而,在24周结束时,常规治疗和Flash治疗中的EMT均被上调(图17A-图17B)。已知EMT驱动对靶向治疗和非靶向治疗的耐药性,并且因此可能会对放射疗法的功效构成挑战(Kitai和Ebi,2016年;Liang等人,2015年)。EMT是基因表达变化的结果,其将细胞从一种状态驱动到另一种状态,因此靶向EMT可能构成挑战。在24周对常规和Flash的EMT签名进行的重叠分析揭示了,共有56个基因重叠(图17C,表5)。在重叠的TGFB1和TGFBI中,在常规和经flash处理的老鼠内两者均被上调。TGFB是EMT的已知驱动,并且因此TGFB抑制剂(SD-208,LY2109761,LY21157299)可以阻止EMT发生并且引起辐射抵抗性肿瘤(Foroutan等人,2017)
差异基因表达分析:
为了获取对Flash相对于常规治疗的早期反应的评估,对在照射后24小时安乐死的被照射老鼠执行微阵列评估。初步的聚类分析揭示,对于较早的时间点,Flash和sham样本聚类在一起,而常规处理的老鼠与Split Flash组聚类在一起。这遵循了最初在存活和皮炎中观察到的模式,即Flash起初比常规治疗好得多,但后来更接近常规治疗。基于基因表达分析,常规照射(1Gy/s)在24小时处最显著地调控2131个基因(p值为0.05),而Flash在24小时时间点处仅调控257个基因,这其中的175个常见基因均受这两个辐射类型的调控(图5)。
IPA分析:
IPA分析揭示,这些不同的辐射治疗方案改变了很多经典通路。在24小时的初始时间点观察到主要变化,其中发生了大部分的RNA水平的调节,这种调节被全基因组微阵列捕获。常规辐射中大多数显著上调的通路(p值≤I0.05,Z得分≥1.5并且FDR为0.1)都参与了炎症反应,如干扰素信号、IL-8信号、STAT3信号、GP6信号通路和磷脂酶C信号。一些癌症相关通路也被上调,如胰腺腺癌信号和大肠癌转移信号。预测在常规照射之后细胞周期素和细胞周期调控通路被抑制。(图18和表6A-C)。在Flash辐射的24小时处,大多数的通路均被下调,其中包括polo样激酶的有丝分裂作用、雌激素介导的S期进入、Ary1烃受体信号、细胞周期素和细胞周期调控、TH1辅助T细胞通路、树突状细胞成熟、和钙诱导的T淋巴细胞凋亡。在split-Flash中,所调控的通路主要涉及如下的细胞周期,其中细胞周期的不同阶段与p53通路一起被不同地调节。由所有治疗类型调节的共同通路是细胞周期素和细胞周期调节,已知其在辐射治疗后被破坏。
当执行常规辐射和Flash辐射之间的比较时(重叠的p值>0.05,Z得分为1.5),在这些治疗之间几乎没有被差异调节的通路(图18)。示出了树突状细胞成熟、淋巴细胞中的PKC信号、TH1通路和钙诱导的T淋巴细胞凋亡在常规辐射之后升高,而在Flash治疗之后降低。尽管很多通路在常规辐射后显著上调,而在Flash辐射后不受影响,例如IL-8、巨噬细胞中ROS和MO的产生、干扰素信号、Rho家族GTPases、GP6信号、大肠癌转移信号、鞘氨醇-1-磷酸信号等。
TH1通路:T辅助1型(Th1)细胞是CD4
钙介导的T细胞凋亡:T细胞经历凋亡的一个重要通路是通过钙通道,该通道涉及抗原呈递细胞上的MHC II类复合物与T细胞上的TCR-CD3复合物的结合,这导致PLC-gammal的激活,继而激活PKC和钙在细胞质中的积累。游离钙通过与钙调神经磷酸酶、CABIN和NFAT的相互作用而触发凋亡通路。在Flash之后,该通路被下调,并且被常规照射激活。因此,Flash辐射可以凭借其避免照射更多血液的较快治疗方式(较高的剂量率)以及通过该通路的下调来保留(spare)T淋巴细胞,从而导致T淋巴细胞的分子保留。淋巴细胞被认为是辐射疗法期间的高风险器官,并且很多血液流量高的器官(如肺和脑)必须限制剂量以减少淋巴细胞杀伤[5]。因此,Flash辐射与治疗计划算法相结合可以用于治疗淋巴细胞计数高的器官部位。淋巴细胞保留也将对提供与辐射的有效免疫治疗组合产生影响。
对于16周的分析,发现在Flash组中两个经典通路被显著调节。细胞周期素和细胞周期调控通路被激活,而心脏肥大中的NFAT通路被下调(p值≤I0.05,Z得分≥1.5并且FDR0.1)。在使用Fischer精确统计分析进行的常规15Gy和Flash 15Gy辐射之间的比较分析(p值≤I0.05并且Z得分≥1.5)中,发现两种治疗调控了很多通路。发现干扰素信号在两个组中均被上调,但发现在常规组中被激活更多(图18)。发现Flash与常规相比,BMP信号通路被下调。
PTEN:在Flash中激活了对癌变具有保护作用的磷酸酶和张力蛋白同源物(PTEN)通路,因此预测与常规相比,Flash可能对组织具有保护作用。老鼠成纤维细胞中的PTEN表达的损失示出导致肺纤维化(Parapuram等人,Matrix Biol 2015)。用博来霉素(辐射模拟药物)治疗的PTEN基因敲除老鼠示出肺纤维化增加。因为与常规辐射治疗相比,Flash中观察到肺纤维化减少(图10),所以Flash导致肺纤维化减少的机制之一可能是通过PTEN通路的激活。PTEN通路的激活剂/激动剂在US 2011/0189169A1中描述,并且包括mTOR抑制剂,诸如:雷帕霉素(
BMP通路:骨形态发生蛋白(BMP)是TGF-β超家族的成员。TGF-β是已知参与多种正常组织毒性作用(包括肺纤维化)的蛋白质。Flash治疗组中在16周的时间点处,BMP通路被下调。经Flash处理的样本在16和24周时间点处也展现出减少的肺纤维化。因此,抑制TGF-β通路可以降低正常组织的毒性。
干扰素信号:
1型干扰素(IFN)影响先天性和适应性免疫反应的发展。与常规(CONV)相比,最异常调节的经典通路之一的IFN信号通路在FLASH中被下调。1型干扰素以平衡的方式调节先天免疫反应,该平衡的方式促进抗原呈递和自然杀伤细胞功能,同时抑制促炎通路和细胞因子产生。1型干扰素还激活适应性免疫系统,从而促进高亲和力抗原特异性T和B细胞反应和免疫记忆的发展。微环境中的Type1干扰素促进DC的成熟和抗原呈递,并且增强内源性NK或CD8+T细胞介导的抗肿瘤免疫反应。因此,可以将1型干扰素激活剂与FLASH递送结合使用,以创建包括T细胞在内的免疫细胞可以在其中茁壮生长以根除肿瘤细胞的环境。
涉及1型干扰素产生的一个关键通路是STING/cGAS通路。干扰素基因的刺激物(STING)是一种感测环状二核苷酸(CDN)的细胞内信号分子。CDN外源性地衍生自感染原,或由哺乳动物dsDNA传感器cGAS(环状鸟苷单磷酸腺苷单磷酸;环状GMP-AMP合酶)产生。STING/cGAS感测机制诱导先天免疫反应,包括1型干扰素的产生和释放。因此,STING/cGAS通路的激活剂可以与FLASH递送相结合使用,以创建免疫细胞能够在其中茁壮成长以根除肿瘤细胞的环境。这些激活剂尤其包括合成的CDN STING激动剂、小分子STING激动剂、小分子STING通路激动剂、病毒编码的STING通路激动剂、细菌编码的STING通路激动剂、或STING激动剂包裹的纳米颗粒和脂质体。其他1型干扰素激活剂包括结合并且激活Toll样受体(TLR)(诸如TLR4和TLR9)的化合物、以及激活MAVS通路的化合物。
树突状细胞成熟:
树突状细胞成熟在FLASH中被下调。树突状细胞中吞噬功能的调控、以及由此通过先天信号进行的抗原加工和呈递,表示适应性和先天免疫系统整合的关键水平。FLASH和合成肽疫苗的组合可能有益于诱导持久的免疫反应。
此外,可以使用CD47/SIRP-α的抑制剂来增强由树突状细胞进行的抗原交叉呈递和增加的T细胞启动。这些尤其包括抑制CD47/SIRP-α相互作用的抗体、抗体衍生物、和小分子。
纳米颗粒:
纳米颗粒是尺寸在1nm至100nm之间的小颗粒。它们可以具有不同的形状,诸如球形、杆形或星形。它们可以通过增强的渗透性和保留作用而被动地靶向到肿瘤,也可以主动地靶向,诸如通过将抗体或肽与纳米颗粒缀合。此外,它们可以包封在囊泡中或插入凝胶基质中以增加肿瘤靶向性。
先前已经示出,具有高有效原子序数的纳米颗粒(例如,金或钆)当通过提供剂量增强在辐射治疗之前被施用时,可以具有协同作用(Hainfeld等人,2004)。这是因为当被光子撞击时,在纳米颗粒中发生光电效应,从而发射电子和附加的x射线。此外,纳米颗粒的辐射还可以在肿瘤中引起热疗,从而增加治疗效果。还已经示出,当将纳米颗粒与质子治疗结合使用时,可以实现剂量增强(Lin等人,2014)。最后,辐射还可以用于通过改变肿瘤微环境(例如,通过降低肿瘤间质压力)来调节和增强纳米颗粒向肿瘤的递送(Stapleton等人,2017)。
Flash RT可以与纳米颗粒相结合使用
将纳米颗粒与辐射疗法结合使用的主要障碍之一是纳米颗粒在体内的半衰期短。在常规的分割安排中在几个处理中的每一种之前递送纳米颗粒也是具有挑战性和不切实际的。此外,某些纳米颗粒在足够高的浓度下仍可能有毒,尤其是当无法迅速从体内清除时。通过将纳米颗粒与Flash辐射疗法结合使用,可以克服这些挑战。通过仅在单个部分中治疗一个或多个肿瘤,即使纳米颗粒具有相对短的半衰期,在整个治疗过程中,一个或多个肿瘤中的纳米颗粒浓度仍可以保持足够高。此外,由于具有短半衰期的纳米颗粒仍然有效,因此,由于纳米颗粒将迅速从体内清除,可能的毒性将降低。Flash辐射疗法与纳米颗粒结合的工作流的一个示例是纳米颗粒的施用,随后是成像,诸如通过CT或MRI。考虑到纳米颗粒的分布,这些成像数据用于创建Flash辐射疗法治疗计划。然后,在治疗之前,重新注入纳米颗粒,并且递送所计划的Flash治疗。
芳烃受体通路:
在经Flash处理的肺中,芳基烃受体(ahR)信号通路被下调。该通路的一般功能是检测芳烃(芳基)并且激活一组异种代谢基因,特别是细胞色素P450酶。这对药物组合策略具有重要意义,因为该通路的下调可以改变患者体内其他药物的清除。另外,该通路的激活还可以促进对小分子的泛药抗性或细胞由于放射疗法而处理有毒物质的能力。AhR通路激活也与癌症免疫疗法相关联,AhR调控先天和适应性免疫两者,它激活抗炎Treg细胞和M2巨噬细胞。因此,辐射疗法与ahR抑制剂(诸如SR1、CH-223191、UM729、高良姜素)的组合可以抑制肿瘤清除毒性物质和激活免疫细胞的能力。
肺组织中的细胞凋亡
图24是示出TUNEL结果的图。该图示出了针对每组大约20个动物(雄性和雌性合并)的每个动物的计数的平均数目。量化TUNEL细胞构成计数问题,其中TUNEL阳性细胞的数目针对每组动物样本被计数,并且因此应当遵循泊松统计。图表上的竖线指示使用Ulm等人提出的精确估算方法所计算的95%置信区间。(Ulm,K.,“A simple method to calculatethe confidence interval of a standardized mortality ratio(SMR)”,Am JEpidemiol,1990,131(2):373-5)。95%的置信区间的重叠指示,SplitFlash(脉冲式FLASH)和FLASH与常规的相比与Sham更相似,从而指示对于这些新颖的治疗技术,凋亡的发生率更低。
表2:24小时最富集的通路
表2A常规与Sham:
表2B Flash与Sham:
表2C Split Flash与Sham
NES=归一化的富集得分,Nom p值=归一化的值,FDR q值=错误发现率值
表3:8周最富集的通路
表3A常规与Sham:
表3B Flash与Sham:
NES=归一化的富集得分,Nom p值=归一化的值,FDR q值=错误发现率值
表4:16周最富集的通路
表4A常规与Sham:
表4B Flash与Sham:
表4C Flash与Sham:
NES=归一化的富集得分,Nom p值=归一化的值,FDR q值=错误发现率值
表5:24周最富集的通路
表5A常规与Sham:
表5B Flash与Sham:
NES=归一化的富集得分,Nom p值=归一化的值,FDR q值=错误发现率值。
表6:由IPA的24小时最典型通路
表6A常规与Sham:
表6B Flash与Sham:
表6C Split Flash与Sham
示例2
该示例演示Flash辐射导致刺猬(Hh)信号的改变的激活。
Hh信号通路近来已被认为是癌症中的重要信号通路和治疗靶标。在成年人中,该通路的突变或失调在增殖和分化中都起关键作用,从而在多种组织中导致肿瘤发生或肿瘤生长加速。Hh信号通路的不适当激活已牵涉到若干其他癌症的发展,包括肺癌、前列腺癌、乳腺癌和胰腺癌。另外,一些近来的发现表明,Hh也可能通过以旁分泌方式从肿瘤传递至周围基质或者癌症干细胞(CSC)中,而促进肿瘤发生。如图25和表7所示,与常规质子辐射比较,flash辐射导致刺猬信号通路的减少的激活。累积的富集得分指示基因的下调。涉及向GLI转录因子的信号传递的Hh/GLI信号通路的组成部分包括刺猬配体(Sonic Hh(SHh)、Indian Hh(IHh)以及Desert Hh(DHh]))、修补受体(Ptchl,Ptch2)、平滑受体(Smo)、融合同源物(Sufu)的抑制因子、驱动蛋白Kif7、蛋白激酶A(PKA)以及环腺苷酸(cAMP)。GLI的激活剂形式到达细胞核并通过与靶标基因的启动子结合而刺激靶基因的转录。Hh信号通路的主要靶标基因是PTCH1、PTCH2和GLI族锌指1(GLI1)。
几种刺猬拮抗剂包括但不限于刺猬拮抗剂Smo拮抗剂、PTCH1抑制剂(如RU-SKI43)、环巴胺、维莫德吉、LDE 225、saridegib、BMS 833923、LEQ 506、PF-04449913、PF-5274857,GANT61、SANT-1、格拉吉布(PF-04449913)、Taladegib(LY2940680)和TAK-441可以与Flash疗法相结合工作。
表7.与常规辐射相比由Flash辐射下调的刺猬通路基因
参考文献:
Ashworth,A.,and Lord,C.J,(2018).Synthetic iethal therapies forcancer:what's next after PARP inhibitors?Nat.Rev.Clin.Oncol.1.
Asteriti,I.A.,De Mattia,F.,and Guarguaglini,G.(2015).Cross-Talkbetween AURKA and Plk1 in Mitotic Entry and Spindle Assembly.Front.Oncol.5.
Benjamini,Y.,and Hochberg,Y,(1995).Controlling the False DiscoveryRate:A Practical and Powerful Approach to Multiple Testing.J.R.Stat.Soc.Ser.BMethodol.57,289-300.
Bolstad,B.M.,Irizarry,R.A.,Astrand,M.,and Speed,T.P.(2003).Acomparison of normalization methods for high density oligonucleotide arraydata based on variance and bias.Bioinformatics 19,185-193.
Donnella,H.J.,Webber,J.T.,Levin,R.S.,Camarda,R.,Momcilovic,O.,Bayani,N.,Shah,K.N.,Korkola,J.E.,Shokat,K.M.,Goga,A.,et al.(2018).Kinome rewiringreveals AURKA limits PI3K-pathway inhibitor efficacy in breastcancer.Nat.Chem.Biol.
Downward,J.(2003).Targeting RAS signalling pathways in cancertherapy.Nat.Rev.Cancer 3,11-22.
Foroutan,M.,Cursons,J.,Hediyeh-Zadeh,5.,Thompson,E.W.,and Davis,M.J.(2017).A Transcriptional Program for Detecting TGFβ-lnduced EMT in Cancer,Mol.Cancer Res.MCR 15,619-631.
Hainfeld,JF et al.(2004).The use of gold nanoparticles to enhanceradiotherapy in mice.Phys Med Biol.
Kitai,H.,and Ebi,H.(2016).Key roles of EMT for adaptive resistance toMEK inhibitor in KRAS mutant lung cancer.Small GTPases 0,00-00.
Liang,S.-Q.,Marti,T.M.,Dorn,P.,Froment,L.,Hall,S.R.R.,Berezowska,S.,Kocher,G.,Schmid,R.A.,and Peng,R.-W.(2015).Blocking the epithelial-to-mesenchymal transition pathway abrogates resistance to anti-folatechemotherapy in lung cancer.Cell Death Dis.6,el824.
Lin,Y et al.(2014).Comparing gold nano-particle enhanced radiotherapywith protons,megavoltage photons and kilovoltage photons:a Monte Carlosimulation.Phys Med Biol.
Lord,C.J.,and Ashworth,A.(2016).BRCAness revisited.Nat.Rev.Cancer 16,110-120.
Murai,J.,Huang,S.N.,Das,B.B.,Renaud,A.,Zhang,Y.,Doroshow,J.H.,Ji,J.,Takeda,S.,and Pommier,Y.(2012).Trapping of PARP1 and PARP2 by Clinical PARPInhibitors.Cancer Res.72,5588-5599.
Panicker,R.C.,Coyne,A.G.,and Srinivasan,R.(2017).Allosteric Targetingof Aurora A Kinase Using Small Molecules:A Step Forward Towards NextGeneration Medicines?Curr.Med.Chem.
Ritchie,M.E.,Phipson,B.,Wu,D.,Hu,Y.,Law,C.W.,Shi,W.,and Smyth,G.K.(2015).limma powers differential expression analyses for RNA-sequencing andmicroarray studies.Nucleic Acids Res.43,e47,
Stapleton,S et al.(2017).Radiation effects on the tumormicroenvironment:Implications for nanomedicine delivery.Adv Drug Deliv Rev.
Subramanian,A.,Tarmayo,P.,Mootha,V.K.,Mukherjee,S.,Ebert,B.L.,Gillette,M.A.,Paulovich,A.,Pomeroy,S.L.,Golub,T.R.,Lander,E.S.,et al.(2005).Gene set enrichment analysis:A knowledge-based approach for interpretinggenome-wide expression profiles.Proc.Natl.Acad.Sci.U.S.A.102,15545-15550.
Sun,Y.,Liu,W.-Z.,Liu,T.,Feng,X.,Yang,N.,and Zhou,H.-F.(2015).Signaling pathway of MAPK/ERK in cell proliferation,differentiation,migration,senescence and apoptosis.J.Recept.Signal Transduct.Res.35,600-604.
Wang,M.,Morsbach,F.,Sander,D.,Gheorghiu,L,Nanda,A.,Benes,C.,Kriegs,M.,Krause,M.,Dikomey,E.,Baumann,M.,et al.(2011).EGF Receptor InhibitionRadiosensitizes NSCLC Cells By Inducing Senescence In Cells Sustaining DNADouble-Strand Breaks,Cancer Res.71,6261-6269.
[1]T.Nishimura,K.Iwakabe,M.Sekimoto,Y.Ohmi,T.Yahata,M.Nakui,T.Sato,S.Habu,H,Tashiro,M.Sato,A.Ohta,Distinct role of antigen-specific T helpertype 1(Th1)and Th2 cells in tumor eradication in vivo,J Exp Med,190(1999)617-627.
[2]H.M.Xu,Th1 cytokine-based Immunotherapy for cancer,HepatobiliaryPancreat Dis Int,13(2014)482-494.
[3]G.E,Kaiko,J.C.Horvat,K.W.Beagley,P.M.Hansbro,Immunologicaldecision-making:how does the immune system decide to mount a helper T-cellresponse?,immunology,123(2008)326-338.
[4]G.Hasko,C.Szabo,IL-12 as a therapeutic target for pharmacologicalmodulation in immune-mediated and inflammatory diseases:regulation of Thelper 1/T helper 2 responses,Br J Pharmacol,127(1999)1295-1304.
[5]C.Tang.Z.Liao,D.Gomez,L.Levy,Y.Zhuang,R.A.Gebremichael,D.S.Hong,R.Komaki,J.W.Welsh,Lymphopenia association with gross tumor volume and lungV5 and its effects on non-small cell lung cancer patient outcomes,Int JRadiat Oncol Biol Phys,89(2014)1084-1091.
应当理解,本文中描述的示例和实施例仅用于说明目的,并且鉴于其的各种修改或改变将被建议给本领域技术人员,并且将被包括在本申请的精神和范围以及所附权利要求的范围之内。本文中引用的所有出版物、专利、专利申请、序列登录号以及UniProt编号出于所有目的通过引用整体并入本文。
形式序列列表
SEQ ID NO:1:音速刺猬蛋白(SHH)(HHG-1)(SHH未处理的N端信号和C端自动处理域)(ShhNC)[分割成:音速刺猬蛋白N-产物(ShhN)(SHH N端处理信号域)(ShhNp)](UniProtID Q 15465)>sp|Q154651|SHH_HUMAN音速刺猬蛋白OS=智人 OX=9606 GN=SHH PE=lSV=l
SEQ ID NO:2:印度刺猬蛋白(IHH)(HHG-2)[分割成:印度刺猬蛋白N-产物;印度刺猬蛋白C-产物](UniProt ID Q14623)>sp|Q14623|IHH_HUMAN印度刺猬蛋白OS=智人 OX=9606 GN=IHH PE=1 SV=4
SEQ ID NO:3:沙漠刺猬蛋白(DHH)(HHG-3)[分割成:沙漠刺猬蛋白N-产物;沙漠刺猬蛋白C-产物](UniProt ID 043323)>sp|043323|DHH_HUMAN沙漠刺猬蛋白OS=智人 OX=9606 GN=DHH PE=1 SV=1
SEQ ID NO:4:蛋白修补同源物(PTC)1(PTC1)。UniProt ID Q13635.同种型L(UniProt Q13635-1)>sp|Q13635|PTC1_HUMAN蛋白修补同源物1 OS=智人 OX=9606 GN=PTCH1 PE=1 SV=2
SEQ ID NO:5:同种型L’。UniProt ID Q13635-2.>sp|Q13635-2|PTCl_HUMAN蛋白修补同源物1的同种型L’OS=智人 OX=9606 GN=PTCH1
SEQ ID NO:6:同种型M。UniProt ID Q13635-3.>sp|Q13635-3|PTCl_HUMAN蛋白修补同源物1的同种型M OS=智人 OX=9606 GN=PTCH1
SEQ ID NO:7:同种型S。UniProt ID Q13635-4.>sp|Q13635-4|PTCl_HUMAN蛋白修补同源物1的同种型S OS=智人 OX=9606 GN=PTCH1
SEQ ID NO:8:蛋白修补同源物2(PTC2)。UniProt ID Q9Y6C5.同种型1(Q9Y6C5-1).>sp|Q9Y6C5|PTC2_HUMAN蛋白修补同源物2 OS=智人 OX=9606 GN=PTCH2 PE=l SV=2
SEQ ID NO:9:蛋白修补同源物2(PTC2)。UniProt ID Q9Y6C5.同种型2(Q9Y6C5-2).>sp|Q9Y6C5-2|PTC2_HUMAN蛋白修补同源物2的同种型2 OS=智人 OX=9606 GN=PTCH2
SEQ ID NO:10:平滑后的同源物(SMO)(蛋白质Gx)。UniProt ID Q99835.>sp|Q99835|SMO_HUMAN平滑后的同源物OS=智人OX=9606 GN=SMO PE=1 SV=1
SEQ ID NO:11:融合同源物(SUFUH)的抑制剂。UniProt ID Q9UMX1.同种型1.>sp|Q9UMXl|SUFU_HUMAN融合同源物的抑制剂OS=智人 OX=9606 GN=SUFU PE=1 SV=2
SEQ ID NO:12:融合同源物(SUFUH)的抑制剂。UniProt ID Q9UMX1-2.同种型2.>sp|Q9UMXl-2|SUFU_HUMAN融合同源物的抑制剂的同种型2 OS=智人 OX=9606 GN=SUFU
SEQ ID NO:13:融合同源物(SUFUH)的抑制剂。UniProt ID Q9UMX1-3.同种型3。>sp|Q9UMXl-3|SUFU HUMAN融合同源物的抑制剂的同种型3 OS=智人 OX=9606 GN=SUFU
SEQ ID NO:14:驱动蛋白样蛋白KIF7。UniProt ID Q2M1P5.>sp|Q2MlP5|KIF7_HUMAN驱动蛋白样蛋白KIF7 OS=智人OX=9606 GN=KIF7 PE=l SV=2
SEQ ID NO:15:钙粘附蛋白EGF LAG七次G型受体1 CELR1。UniProt ID Q9NYQ6.同种型1.>sp|Q9NYQ6|CELRl_HUMAN钙粘附蛋白EGF LAG七次G型受体1 OS=智人 OX=9606GN=CELSR1 PE=l SV=l
SEQ ID NO:16:钙粘附蛋白EGF LAG七次G型受体1 CELR1。UniProt ID Q9NYQ6-2.同种型2.>sp|Q9NYQ6-2|CELRl_HUMAN钙粘附蛋白EGF LAG七次G型受体1的同种型2 OS=智人 OX=9606 GN=CELSR1
SEQ ID NO:17:转导蛋白样增强蛋白3TLE3。UniProt ID Q04726.同种型1.>sp|Q04726|TLE3_HUMAN转导蛋白样增强蛋白3 OS=智人 OX=9606 GN=TLE3 PE=1 SV=2
SEQ ID NO:18:转导蛋白样增强蛋白3 TLE3。UniProt ID Q04726-2.同种型2.>sp|Q04726-2|TLE3_HUMAN转导蛋白样增强蛋白3的同种型2 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:19:转导蛋白样增强蛋白3 TLE3。UniProt ID Q04726-3.同种型3.>sp|Q04726-3|TLE3_HUMAN转导蛋白样增强蛋白3的同种型3 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:20:转导蛋白样增强蛋白3 TLE3。UniProt ID Q04726-4.同种型4.>sp|Q04726-4|TLE3_HUMAN转导蛋白样增强蛋白3的同种型4 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:21:转导蛋白样增强蛋白3TLE3。UniProt ID Q04726-5.同种型5.>sp|Q04726-5|TLE3_HUMAN转导蛋白样增强蛋白3的同种型5 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:22:转导蛋白样增强蛋白3TLE3。UniProt ID Q04726-6.同种型6.>sp|Q04726-6|TLE3_HUMAN转导蛋白样增强蛋白3的同种型6 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:23:转导蛋白样增强蛋白3 TLE3。UniProt ID Q04726-7.同种型7.>sp|Q04726-7|TLE3_HUMAN转导蛋白样增强蛋白3的同种型7 OS=智人 OX=9606 GN=TLE3
SEQ ID NO:24:卵磷脂-1 OPHN1。UniProt ID O60890.同种型1>sp|O60890|OPHNl_HUMAN卵磷脂-l OS=智人 OX=9606 GN=OPHN1 PE=1 SV=1
SEQ ID NO:25:卵磷脂-1 OPHN1。UniProt ID O60890-2.同种型2>sp|O60890-2|OPHNl_HUMAN卵磷脂-1的同种型2 OS=智人 OX=9606 GN=OPHN1
SEQ ID NO:26:粘附G-蛋白偶联受体G1 AGRG1。UniProt ID Q9Y653.同种型1.>sp|Q9Y653|AGRGl_HUMAN粘附G-蛋白偶联受体G1 OS=智人 OX=9606 GN=ADGRG1 PE=1 SV=2
SEQ ID NO:27:粘附G-蛋白偶联受体G1 AGRG1。UniProt ID Q9Y653-2.同种型2.>sp|Q9Y653-2|AGRGl_HUMAN粘附G-蛋白偶联受体G1的同种型2 OS=智人 OX=9606 GN=ADGRG1
SEQ ID NO:28:粘附G-蛋白偶联受体G1 AGRG1。UniProt ID Q9Y653-3.同种型3.>sp|Q9Y653-3|AGRGl_HUMAN粘附G-蛋白偶联受体G1的同种型3 OS=智人 OX=9606 GN=ADGRG1
SEQ ID NO:29:粘附G-蛋白偶联受体G1 AGRG1。UniProt ID Q9Y653-4.同种型4.>sp|Q9Y653-4|AGRGl_HUMAN粘附G-蛋白偶联受体G1的同种型4 OS=智人 OX=9606 GN=ADGRG1
SEQ ID NO:30:粘附G-蛋白偶联受体G1 AGRG1。UniProt ID Q9Y653-5.同种型5.>sp|Q9Y653-5|AGRGl_HUMAN粘附G-蛋白偶联受体G1的同种型5 OS=智人 OX=9606 GN=ADGRG1
SEQ ID NO:31:蛋白修补同源物1PTC1。UniProt ID Q13635.同种型L.>sp|Q13635|PTCl_HUMAN蛋白修补同源物1 OS=智人OX=9606 GN=PTCHl PE=l SV=2
SEQ ID NO:32:蛋白修补同源物1PTC1。UniProt ID Q13635-2.同种型L’.>sp|Q13635-2|PTCl_HUMAN蛋白修补同源物1的同种型L’OS=智人 OX=9606 GN=PTCH1
SEQ ID NO:33:蛋白修补同源物1PTC1。UniProt ID Q13635-3.同种型M.>sp|Q13635-3|PTCl_HUMAN蛋白修补同源物1的同种型M OS=智人 OX=9606 GN=PTCH1
SEQ ID NO:34:蛋白修补同源物1PTC1。UniProt ID Q13635-4.同种型S.>sp|Q13635-4|PTCl_HUMAN蛋白修补同源物1的同种型S OS=智人 OX=9606 GN=PTCHl
SEQ ID NO:35:转导蛋白样增强蛋白1TLE1。UniProt ID Q04724.>sp|Q04724|TLEl_HUMAN转导蛋白样增强蛋白1 OS=智人OX=9606 GN=TLEl PE=l SV=2
SEQ ID NO:36:肌球蛋白-9MYH9。UniProt ID P35579.同种型1.>sp|P355791|MYH9_HUMAN肌球蛋白-9 OS=智人 OX=9606 GN=MYH9 PE=1 SV=4
SEQ ID NO:37:肌球蛋白-9MYH9。UniProt ID P35579-2.同种型2.>sp|P35579-2|MYH9_HUMAN肌球蛋白-9的同种型3 OS=智人OX=9606 GN=MYH9
SEQ ID NO:38:拉斯GTP酶激活蛋白1RASA1。UniProt ID P20936.同种型1.>sp|P20936|RASAl_HUMAN拉斯GTP酶激活蛋白1 OS=智人 OX=9606 GN=RASA1 PE=l SV=l
SEQ ID NO:39:拉斯GTP酶激活蛋白1RASA1。UniProt ID P20936-2.同种型2.>sp|P20936-2|RASAl_HUMAN拉斯GTP酶激活蛋白1的同种型2 OS=智人 OX=9606 GN=RASA1
SEQ ID NO:40:拉斯GTP酶激活蛋白1RASA1。UniProt ID P20936-3.同种型3.>sp|P20936-3|RASAl_HUMAN拉斯GTP酶激活蛋白1的同种型3 OS=智人 OX=9606 GN=RASAl
SEQ ID NO:41:拉斯GTP酶激活蛋白1RASA1。UniProt ID P20936-4.同种型4.>sp|P20936-4|RASAl_HUMAN拉斯GTP酶激活蛋白1的同种型4 OS=智人 OX=9606 GN=RASAl
SEQ ID NO:42:与YRPW基序蛋白有关的有毛/分裂增强体1 HEY1。UniProt IDQ9Y5J3.同种型1.>sp|Q9Y5J3|HEY1_HUMAN与YRPW基序蛋白有关的有毛/分裂增强体1 OS=智人 OX=9606 GN=HEY1 PE=1 SV=1
SEQ ID NO:43:与YRPW基序蛋白有关的有毛/分裂增强体1 HEY1。UniProt IDQ9Y5J3-2.同种型2.>sp|Q9Y5J3-2|HEYl_HUMAN与YRPW基序蛋白有关的有毛/分裂增强体1的同种型2 OS=智人OX=9606 GN=HEY1
SEQ ID NO:44:蛋白C-ets-2ETS2。UniProt ID P15036.>sp|P15036|ETS2_HUMAN蛋白C-ets-2 OS=智人 OX=9606 GN=ETS2 PE=1 SV=1
SEQ ID NO:45:与YRPW基序蛋白有关的有毛/分裂增强体2 HEY2。UniProt IDQ9UBP5.>sp|Q9UBP5|HEY2_HUMAN与YRPW基序蛋白有关的有毛/分裂增强体2 OS=智人 OX=9606 GN=HEY2 PE=1 SV=1
SEQ ID NO:46:LIM域结合蛋白1LDB1。UniProt ID Q86U70.同种型1.>sp|Q86U70|LDBl_HUMAN LIM域结合蛋白1 LDB1 OS=智人OX=9606 GN=LDB1 PE=1 SV=2
SEQ ID NO:47:LIM域结合蛋白1LDB1。UniProt ID Q86U70-3.同种型2.>sp|Q86U70-3|LDBl_HUMAN LIM域结合蛋白1的同种型2 OS=智人 OX=9606 GN=LDB1
SEQ ID NO:48:LIM域结合蛋白1 LDB1。UniProt ID Q86U70-2.同种型3.>sp|Q86U70-2|LDBl_HUMAN LIM域结合蛋白1的同种型3 OS=智人 OX=9606 GN=LDB1
SEQ ID NO:49:纺锤蛋白受体UNC5C。UniProt ID O95185.同种型1.>sp|O95185|UNC5C_HUMAN纺锤蛋白受体UNC5C的同种型2 OS=智人 OX=9606 GN=UNC5C
SEQ ID NO:50:纺锤蛋白受体UNC5C。UniProt ID O95185-2.同种型2.>sp|O95185-2|UNC5C_HUMAN纺锤蛋白受体UNC5C的同种型2 OS=智人 OX=9606 GN=UNC5C
SEQ ID NO:51:神经纤维蛋白NF1。UniProt ID P21359.同种型2.>sp|P21359|NFl_HUMAN神经纤维蛋白OS=智人 OX=9606 GN=NF1 PE=1 SV=2
SEQ ID NO:52:神经纤维蛋白NF1。UniProt ID P21359-2.同种型1.>sp|P21359-2|NF1_HUMAN神经纤维蛋白的同种型1 OS=智人OX=9606 GN=NF1
SEQ ID NO:53:神经纤维蛋白NF1。UniProt ID P21359-3.同种型3.>sp|P21359-3|NFl_HUMAN神经纤维蛋白的同种型3 OS=智人OX=9606 GN=NF1
SEQ ID NO:54:神经纤维蛋白NF1。UniProt ID P21359-4.同种型4.>sp|P21359-4|NFl_HUMAN神经纤维蛋白的同种型4 OS=智人OX=9606 GN=NF1
SEQ ID NO:55:神经纤维蛋白NF1。UniProt ID P21359-5.同种型5.>sp|P21359-5|NFl_HUMAN神经纤维蛋白的同种型5 OS=智人OX=9606 GN=NF1
SEQ ID NO:56:神经纤维蛋白NF1。UniProt ID P21359-6.同种型6.>sp|P21359-6|NFl_HUMAN神经纤维蛋白的同种型6 OS=智人OX=9606 GN=NF1
SEQ ID NO:57:细胞周期蛋白依赖性激酶6CDK6。UniProt ID Q00534.>sp|Q00534|CDK6_HUMAN细胞周期蛋白依赖性激酶6 OS=智人 OX=9606 GN=CDK6 PE=l SV=1
SEQ ID NO:58:细胞周期蛋白超低密度脂蛋白受体VLDLR。UniProt ID P98155.长同种型.>sp|P981551 VLDLR HUMAN超低密度脂蛋白受体。OS=智人 OX=9606 GN=VLDLRPE=1 SV=1
SEQ ID NO:59:细胞周期蛋白超低密度脂蛋白受体VLDLR。UniProt ID P98155-2.短同种型.>sp|P98155-2|VLDLR_HUMAN超低密度脂蛋白受体的的短同种型OS=智人 OX=9606 GN=VLDLR
SEQ ID NO:60:神经菌毛蛋白-2NRP2。UniProt ID O60462.同种型A22.>sp|O60462|NRP2_HUMAN神经菌毛蛋白-2 OS=智人OX=9606 GN=NRP2 PE=1 SV=3
SEQ ID NO:61:神经菌毛蛋白-2NRP2。UniProt ID O60462-2.同种型A0.>sp|O60462-2|NRP2_HUMAN神经菌毛蛋白-2的同种型A0 OS=智人 OX=9606 GN=NRP2
SEQ ID NO:62:神经菌毛蛋白-2NRP2。UniProt ID O60462-3.同种型A17.>sp|O60462-3|NRP2_HUMAN神经菌毛蛋白-2的同种型A17 OS=智人 OX=9606 GN=NRP2
SEQ ID NO:63:神经菌毛蛋白-2 NRP2。UniProt ID O60462-4.同种型B0.>sp|O60462-4|NRP2_HUMAN神经菌毛蛋白-2的同种型B0 OS=智人 OX=9606 GN=NRP2
SEQ ID NO:64:神经菌毛蛋白-2 NRP2。UniProt ID O60462-5.同种型B5.>sp|O60462-5|NRP2_HUMAN神经菌毛蛋白-2的同种型B5 OS=智人 OX=9606 GN=NRP2
SEQ ID NO:65:神经菌毛蛋白-2 NRP2。UniProt ID O60462-6.同种型s9.>sp|O60462-6|NRP2_HUMAN神经菌毛蛋白-2的同种型s9 OS=智人 OX=9606 GN=NRP2
SEQ ID NO:66:二氢嘧啶酶相关蛋白2 DPYL2。UniProt ID Q16555.同种型1.>sp|Q16555|DPYL2_HUMAN二氢嘧啶酶相关蛋白2 OS=智人 OX=9606 GN=DPYSL2 PE=1 SV=1
SEQ ID NO:67:二氢嘧啶酶相关蛋白2 DPYL2。UniProt ID Q16555-2.同种型2.>sp|Q16555-2|DPYL2_HUMAN二氢嘧啶酶相关蛋白2的同种型2 OS=智人 OX=9606 GN=DPYSL2
SEQ ID NO:68:神经菌毛蛋白-1NRP1。UniProt ID O14786.同种型1.>sp|O14786|NRPl_HUMAN神经菌毛蛋白-1 OS=智人 OX=9606 GN=NRP1 PE=l SV=3
SEQ ID NO:69:神经菌毛蛋白-1NRP1。UniProt ID O14786-2.同种型2.>sp|O14786-2|NRPl_HUMAN神经菌毛蛋白-1的同种型2 OS=智人 OX=9606 GN=NRP1
SEQ ID NO:70:神经菌毛蛋白-1 NRP1。UniProt ID O14786-3.同种型3.>sp|Ol4786-3|NRPl_HUMAN神经菌毛蛋白-1的同种型3 OS=智人 OX=9606 GN=NRPl
- 超高剂量率辐射和治疗剂的使用方法
- 超高剂量率辐射和治疗剂的使用方法
