一种FOLFOX药物方案有效性检测方法及试剂盒
文献发布时间:2023-06-19 09:30:39
技术领域
本发明属于生物技术领域,具体涉及一种肿瘤治疗过程中FOLFOX药物方案有效性检测方法及试剂盒。
背景技术
肿瘤治疗中化疗用FOLFOX药物方案是抗嘧啶类代谢药,是胃肠道肿瘤的一线化疗药物,主要作用于细胞周期的S期,在体内转化成氟尿嘧啶核苷酸,抑制DNA,RNA的合成,口服吸收不完全,静脉注半小时可进入血脑屏障,主要经肝脏代谢。常用于消化系统肿瘤,如胃癌,结直肠癌,原发性肝癌,胰腺癌,食管癌均较常用。对乳腺癌,卵巢癌,子宫颈癌,癌性胸腹腔积液也有一定疗效。
化疗是广谱性细胞毒药物,参与化疗FOLFOX方案代谢的各种细胞因子、酶等非常复杂,因而每个患者个体对药物的响应均有所不同,个体差异很大。参与FOLFOX药物方案代谢的各种因子均离不开基因的调控,因此不同的基因型可以影响正常组织对药物的敏感性,因此在基因水平上研究化疗用FOLFOX药物方案的药效可以更本质的解决FOLFOX方案药敏预测的问题。
DNA分子标记是以个体间遗传物质内核苷酸序列变异为基础的遗传标记,是直接在DNA分子上检测生物间的差异,是DNA水平变异的直接反应,DNA分子标记不受环境基因表达与否的限制,数量极多,遍及整个基因组,多态性高,遗传稳定,但是由于DNA分子标记数量过大,很难筛选出与研究目的相关的DNA分子标记。
因此,一种筛选与化疗FOLFOX方案药效相关的DNA分子标记方法,使化疗FOLFOX方案药效的程度与基因水平的表现相关联,是目前有待解决的问题。
发明内容
本发明解决的技术问题:针对上述不足,克服现有技术的缺陷,本发明的目的是提供肿瘤治疗过程中FOLFOX药物方案有效性检测方法及试剂盒。
本发明的技术方案:
一种FOLFOX药物方案有效性检测方法,步骤如下:
步骤1:准备FOLFOX药物方案的药效样品;
步骤2:对步骤1的药效样品进行DNA分子标记,记录分子标记位点的信息;
步骤3:将DNA分子标记位点信息作为自变量,将FOLFOX药物方案的药效信息作为因变量,建立多元线性回归数学模型;
步骤4:根据多元线性回归数学模型,计算FOLFOX药物方案药效的有效变量的相关系数;
步骤5:步骤4获得有效变量的相关系数即为FOLFOX药物方案药效相关的DNA分子标记的权重系数,根据权重系数确定FOLFOX药物方案有效性。
本发明的一个具体实施方式,将样本在筛选出的27个位点的基因型与人类参考基因组版本37号(GRCh37)做比对,当该位点比对的结果为两个拷贝都一致时,该位点的原始赋值为0;当该位点比对的结果为一个拷贝一致时,该位点的原始赋值为1;当该位点比对的结果为两个拷贝均变异型时,该位点的原始赋值为2。然后将每个位点的原始赋值与该位点的权重系数相乘,所得数值为该位点的计算分值。将一个样本的27个位点的计算分值相加,得到的总和即为该样本对应的有效性评判数值。当总和数值大于0.5时,判定为该患者使用化疗FOLFOX方案后会有效。
其中,步骤2中标记物及位点信息如下:
其中,上述物理坐标以人类参考基因组版本37号为参照。
其中,DNA分子标记的位点信息可采用基因测序法、核酸杂交分型法或聚合酶链式反应法(PCR)等方法;
本发明所述的DNA分子标记例如可以为但不限于为SNP、简单序列重复(SimpleSequence Repeat,简称SSR)、内部简单序列重复(Inter Simple Sequence Repeat,简称ISSR)、限制性内切酶位点、特征性扩增的序列区间(Sequence Characterized AmplifiedRegion,简称SCAR)等DNA分子标记。需要说明的是,本发明不限制DNA分子标记的种类,只要能体现个体间遗传物质内核苷酸序列的多态性即可。
本发明的一个具体实施方案,所述步骤2中,DNA分子标记为SNP标记,即单核苷酸多态性(Single Nucleotide Polymorphisms)标记。
优选地,候选SNP标记的个数为1×10
更优地,个数为5×10
更优地,个数为6.3×10
所述步骤2中,候选SNP标记的个数为1×10
本发明的一个具体实施方式,所述步骤3中,多元线性回归数学模型为Lasso和弹性网络正则化的广义线性模型。该方式融合了岭回归和Lasso回归两种正则化的方法,在一个优选的实施方式中,所述基于Lasso和弹性网络正则化的广义线性模型的算法使用GLMNETR程序包实现。
其中,所述FOLFOX药物方案的药效样品的数量至少为50个,优选为50-200个,更优选为100-150个;使用FOLFOX药物方案的样品需要有药效,其中无效的样品的数量至少为样本总数量的20%,有效的样品的数量至少为样本总数量的20%。
在一些可选的实施方式中,FOLFOX药物方案有效例如可以为但不限于为CR、PR和SD,本发明不限制化疗FOLFOX方案药效的患病种类,可以理解的是,只要将使用化疗FOLFOX方案症状有改善,以便计算时作为因变量赋值即可。
本发明的一个具体实施方式,所述步骤5中DNA分子标记的权重系数获得方式如下:
(a)将已知FOLFOX药物药效样品定义为N
(b)将药效样品中候选的DNA分子标记定义为P
(c)为N
(d)根据FOLFOX药物方案的药效信息建立1×N阶矩阵,以定义为Y:
(e)以X作为自变量,以Y作为因变量,用基于Lasso和弹性网络正则化的广义线性模型的算法,计算出有效变量和有效变量的相关系数;有效变量的相关系数即为FOLFOX药物方案相关的DNA分子标记的权重系数。
一种基于权利要求1所述的FOLFOX药物方案有效性检测方法的试剂盒,所述试剂盒包括用于FOLFOX药物方案药效检测的相关的DNA分子标记的成套引物。
本发明的一个具体实施方案,该试剂盒还包括捕获探针或基因芯片,以及相关试剂
更优地,所述试剂盒还包括记载有DNA分子标记的权重系数的载体。
有益效果:本发明提供的FOLFOX药物方案有效性检测方法及试剂盒,通过DNA分子标记的方式,从基因层面上研究化疗用FOLFOX药物方案的药效,使化药物方案的药效程度与基因的表现相关联,从而可以更好的判决FOLFOX药物方案药效的有效性,以及预测或辅助预测化疗FOLFOX方案药效的风险。
附图说明:
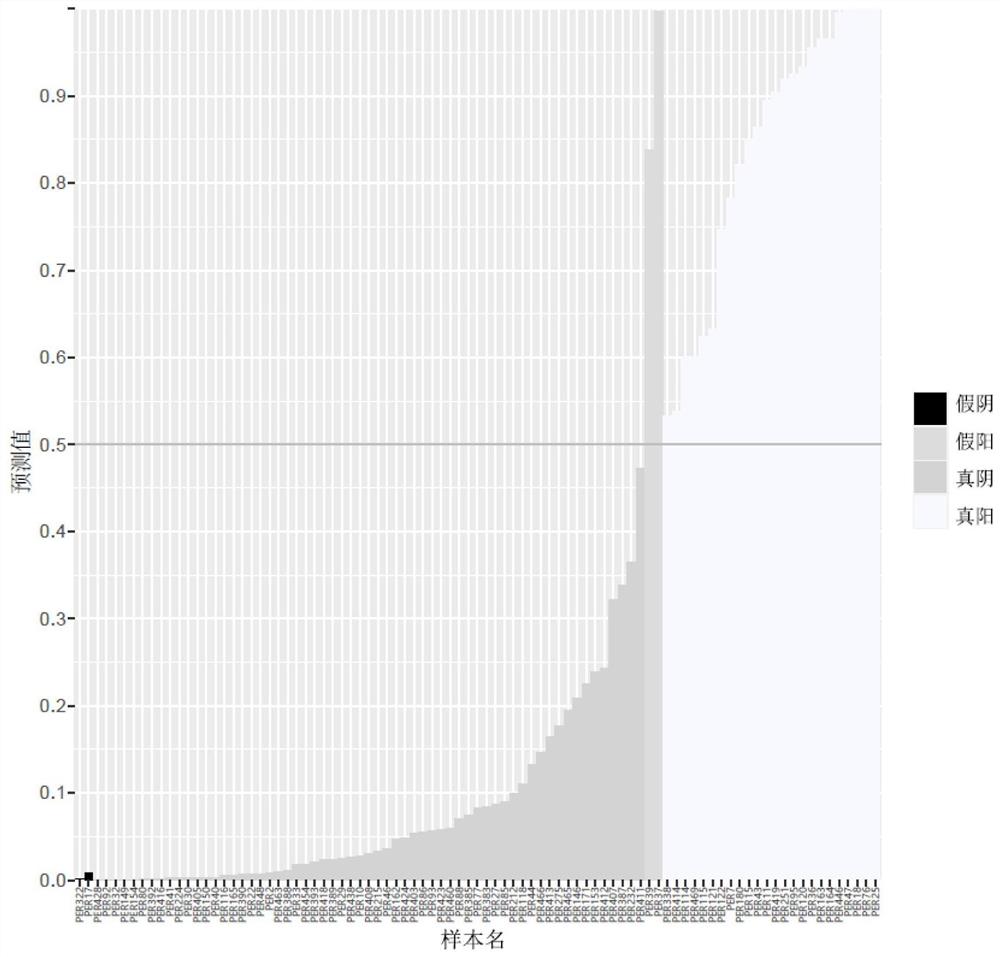
图1根据本发明FOLFOX药物方案有效性检测方法预测的124例化疗用FOLFOX药物方案药效图。
具体实施方式
为使本发明实施例的目的和技术方案更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
以下结合实施例对本发明作进一步的说明。
一种FOLFOX药物方案有效性检测方法,步骤如下:
步骤1:准备FOLFOX药物方案的药效样品;
本实施例中,药效样本共100例,其中无效50例,有效50例,药效样品均为临床患者的血液DNA样品。
步骤2:对步骤1的药效样品进行DNA分子标记,记录分子标记位点的信息;
DNA分子标记为SNP标记,侯选SNP位点的标准是能够覆盖到人类基因组的全部区间,所有SNP中,常见的SNP位点数量在所有SNP的数量中占比大于90%,常见的定义为该SNP位点的发生频率大于5%。样本检测SNP的方法为使用美国Agilent公司的SureSelectHuman All Exon V6(建库试剂)建库,使用美国Illumina公司的NovaSeq 6000(测序仪)测序,检测方法和步骤完全按照厂家的标准操作执行。
其中,步骤2中标记物及位点信息如下:
表1 DNA分子标记位点信息
其中,上述物理坐标以人类参考基因组版本37号为参照。
步骤3:将DNA分子标记位点信息作为自变量,将FOLFOX药物方案的药效信息作为因变量,建立多元线性回归数学模型;
首先,为了便于数据的处理,本实施例中对SNP位点信息进行赋值,以区分野生纯合型、野生杂合型和变异纯合型,需要明确的是该赋值具有任意性,该数值不代表任何生物学意义。
本实施例中,使用人类标准参考基因组(版本37)作为参考基因,表型为纯合型赋值0,表型为杂合型赋值1,表型为变异纯合型赋值2,这样赋值计算较为简便。
理论上讲,SNP既可能是二等位多态性,也可能是3个或4个等位多态性,但实际上,后两者非常少见,几乎可以忽略。因此,通常所说的SNP都是二等位多态性的。因此当SNP位点与参考基因比对时,通常其变异型也只有一个常见类型。因此在本实施例中,只对常见的变异性进行赋值,例如一个SNP位点参考基因是A,其常见的变异性是G,因此当一个样本该位点是AA时赋值为0,AG时赋值为1,GG时赋值为2,如若出现AC基因型的SNP则也赋值为0,以减少小概率的突变对计算结果的干扰;
如果响因变量和预测变量自变量之间有比较明显的线性关系,最小二乘回归会有很小的偏倚,特别是如果观测数量因变量远大于预测变量自变量时,最小二乘回归也会有较小的方差。但是如果自变量和因变量比较接近,则容易产生过拟合;如果因变量小于因变量,最小二乘回归得不到有意义的结果。另外,多元线性回归模型里的很多变量可能是和响应变量(因变量)无关的;也有可能产生多重共线性的现象:即多个预测变量(自变量)之间明显相关。
针对上面的问题,本发明应用Lasso和弹性网络正则化的广义线性模型。该方式融合了岭回归和Lasso回归两种正则化的方法,该模型为现有技术,本实施例中采用GLMNETR程序包实现。
步骤4:根据多元线性回归数学模型,计算FOLFOX药物方案药效的有效变量和有效变量的相关系数;
步骤5:步骤4获得有效变量的相关系数即为FOLFOX药物方案药效相关的DNA分子标记的权重系数,根据权重系数确定FOLFOX药物方案有效性。
其中,权重系数的具体计算方式如下:
(a)将已知FOLFOX药物药效样品定义为N
(b)将药效样品中候选的DNA分子标记定义为P
(c)为N
(d)根据FOLFOX药物方案的药效信息建立1×N阶矩阵,以定义为Y:
(e)以X作为自变量,以Y作为因变量,用基于Lasso和弹性网络正则化的广义线性模型的算法,计算出有效变量和有效变量的相关系数;有效变量的相关系数即为FOLFOX药物方案相关的DNA分子标记的权重系数。
其中,本实施例提供一种赋值方式,示例如下:
1)下载人类人类参考基因组版本37号,并按照如下格式建立数据库,并命名位ref_data:
SITE CHR coordinate ref
RP2-01 12 10366515 C
RP2-02 12 1038854 C
RP2-03 13 32912299 T
…………
共4列(TAB键分开),其中:第1例为位点编号;第2列为染色体号;第3列为染色体位置;第4列为参考碱基;
2)然后将前述约700000个位点的基因型数据按照如下格式建立输入文件并命名为input_data:
SITE BASE
RP2-01[C/A]
RP2-02[C/T]
RP2-03[T/C]
……
共2列(TAB键分开),其中第1例为位点编号;第2列为可变基因型,中括号“[]”内,“/”分隔。
3)在计算机上运行以下perl脚本(需要perl运行环境):
输出文件名为:“treated_result”,
SITE VALUE
RP2-01 1
RP2-02 1
RP2-03 2
……
共2列,第1例为位点编号;第2列为该位点的原始赋值。
该原始赋值也可以通过其它不同的计算机语言实现,只需要最终效果同示例一致即可。
将所有样本都进行上述操作,最终得到一个P×N阶的矩阵,其中P为每个样本所统计的多态性位点的总体数量,N为总体的样本数量。该矩阵将作为一个输入文件X。将所有样本的药效信息建立第二个矩阵文件,该矩阵为1×N阶,其中N为总体的样本数量。将上述两个矩阵文件分别作为自变量和因变量带入到GLMNET R程序包中进行运算,运算的结果为共得到12个与化疗FOLFOX方案相关的SNP标记,其SNP信息与权重系数如下表所示:
表2 FOLFOX药物方案相关的DNA分子标记的权重系数
效果例
临床血液样本来源于南京某医院,以上样本均获得本人的知情同意,获取的70例样本均来自使用化疗FOLFOX药物方案患者。血液采集按照临床常规操作,收集1ml的静脉血,血液冷藏保存于常规的EDTA抗凝管中,保存时间不超过一周。将采集的血液样本用DNA提取试剂盒提取基因组DNA。采用基因测序法对70例样本提取的70份基因组DNA进行测序,得到实施例筛选出的12个SNP位点的基因型。
将样本在实施例中筛选出的12个位点的基因型与人类参考基因组版本37号(GRCh37)做比对,当该位点比对的结果为两个拷贝都一致时,该位点的原始赋值为0;当该位点比对的结果为一个拷贝一致时,该位点的原始赋值为1;当该位点比对的结果为两个拷贝均变异型时,该位点的原始赋值为2。然后将每个位点的原始赋值与该位点的权重系数相乘,所得数值为该位点的计算分值。将一个样本的12个位点的计算分值相加,得到的总和即为该样本对应的风险值。当总和数值大于0.5时,判定为该患者使用化疗FOLFOX方案后会有效。
对70个样本对化疗FOLFOX方案药效的检测分值进行统计,结果如图1所示,(检测)预判出共有32例患者在使用化疗FOLFOX方案后有效果。后续对这70例患者做了术后实际随访,患者对化疗FOLFOX方案的药效,结果如下表所示:
表3样品FOLFOX药物方案药效等级表
(注:表格中0代表无效,1代表有效)
从上述表格中可以看出70例患者中36例得了在使用化疗FOLFOX方案后有效,并且患者的样本编号与本发明检测的结果也高度一致(见附图),说明本发明提供的检测方法可以作为预测或辅助预测化疗FOLFOX方案药效有效性检测方式之一。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
