金属化石墨烯纤维的制造方法和生物电子应用
文献发布时间:2023-06-19 12:25:57
相关申请的交叉引用
本申请要求2018年11月21日提交的题为“金属化石墨烯纤维的制造方法和生物电子应用”的美国临时申请62/770,540的优先权和权益,其全部内容通过引用合并于此。
技术领域
本公开涉及包括金属化石墨烯纤维的微电极阵列的制造生物传感器和生物电子应用。
背景技术
可以长期植入的微电极可以使人造设备与神经系统之间进行通信。基于电刺激或动作电位记录的神经假体和疗法涉及与中枢和周围神经系统接口的电极。需要功能性微电极与单个神经元通信以记录生物信号,同时传递足够数量的电荷以使神经组织去极化并启动反应。现有的微电极技术已经遇到了巨大的挑战和局限性。
例如,虽然机器和神经系统之间的有效的双向通信需要到达具有相当于单个神经元的尖端大小的低阻抗软微电极(D<50μm,几何表面积<2000μm
因此,在用于神经刺激和记录的界面处电极的材料的选择影响神经接口的功效、可靠性和寿命。此外,在刺激和记录期间,电极必须传递并记录足够量的电荷,但不超过触发周围介质电解的阈值。常规的基于金属的电极的低表面积本质上限制了其传递高电荷密度的能力,并且不利地影响了单个神经元信号记录的灵敏度。
这些局限性促使评估诸如纳米结构碳、纳米结构纤维、金属氧化物、金属氮化物和有机导体之类的其他材料,以提供具有生物相容性的增强的电化学特性。但是,这类材料带来了额外的挑战。例如,通过氮化钛(TiN)涂层通过电容机制将Pt电极的电荷注入容量从0.05-0.26mC/cm
另外,常规的低阻抗微电极的刚度不足以穿透软神经组织,但是具有柔韧性或可拉伸性以最小化与组织的机械失配并且一旦植入就适应微运动。
包括石墨烯在内的纳米结构碳质材料可提供出色的电化学特性,同时实现柔韧性和强度。纳米管和石墨烯微纤维具有出色的电化学性能、高表面积、机械强度、高柔韧性和生物相容性,因此非常适合电极制造。实际上,与金属电极和常规碳纤维相比,碳纳米管纤维在植入时表现出显著的电化学活性、灵敏度和抗生物结垢性。然而,尽管基于纯碳纳米管的纤维微电极是稳定的并且能够在相对较长的时间段内记录神经活动,但是用于制造纳米管的纺丝工艺却具有挑战性。此外,生产超对准碳纳米管阵列(干法纺丝)的高成本以及其制造所需的极其严格的条件(包括高温(>1000℃))和使用腐蚀性溶剂(如发烟硫酸和氯磺酸)极大地限制了基于碳纳米管的微纤维的生产。
此外,常规的自立式碳纳米管和石墨烯微纤维的另一个主要缺点在于与金属同类材料相比的高电阻率。当微电极长于几毫米时,电阻率显著增加,这对低噪声记录提出了巨大挑战。
发明内容
本公开涉及包括金属化石墨烯纤维的微电极阵列的制造生物传感器和生物电子应用。在一些实施方案中,具有薄铂涂层的柔性且自支撑的基于石墨烯纤维的微电极阵列作为集电器的制造导致具有低阻抗、高表面积和优异的电化学性质的结构。可以使用氧化石墨烯(LCGO)的液晶分散体来制造石墨烯纤维。石墨烯纤维除了具有天然的生物相容性外,还具有独特的机械和电化学性能。与常规石墨烯或Pt电极相比,所得的微电极阵列可提供更好的性能。特别地,在一些实施方案中,石墨烯纤维的低阻抗和多孔结构导致无与伦比的电荷注入容量以及改善的记录和检测神经元活动的能力,而薄的Pt层有效地沿微电极转移收集的电子。此外,与常规的微电极阵列相比,所得的微电极阵列还可以以改善的信噪比检测神经元活动。
在一些实施方案中,可植入电极包括多层石墨烯-纤维芯、围绕多层石墨烯-纤维芯的绝缘涂层以及设置在多层石墨烯-纤维芯和绝缘涂层之间的金属层。在一些实施方案中,多层石墨烯-纤维芯不包括粘合剂材料。任选地,绝缘涂层可以是基于聚合物的涂层,例如Parylene-C或硅树脂。在一些实施方案中,绝缘涂层具有约2μm的厚度。在一些实施方案中,金属层可以与多层石墨烯-纤维芯相邻,并且金属层完全或部分地覆盖石墨烯-纤维芯的表面部分,其中多层石墨烯-纤维芯被全部或部分包封。在一些实施方案中,金属层覆盖多层石墨烯-纤维芯的大约一半表面。在一些实施方案中,金属层与多层石墨烯-纤维芯相邻,并且金属层覆盖石墨烯-纤维芯的表面部分,其中多层石墨烯-纤维芯被全部包封。在一些实施方案中,金属层包括铂、铱、氧化铱、铂-铱和氮化钛中的至少一种。在一些实施方案中,金属层的厚度在约10nm至约500nm之间的范围内。在一些实施方案中,多层石墨烯-纤维芯的直径在约10μm至约200μm之间的范围内。
在一些实施方案中,一种用于制造可植入电极的方法包括以下步骤:通过在液晶中原位还原完全有序的氧化石墨烯片来形成多层石墨烯-纤维芯,用金属层涂覆多层石墨烯-纤维芯的至少一部分,并用绝缘涂层涂覆多层石墨烯纤维芯和金属层。通过进行原位还原形成多层石墨烯-纤维芯可以包括使用包含酸的凝结浴湿纺氧化石墨烯的液晶分散体。任选地,酸包括次磷酸。任选地,金属层包括铂、铱、氧化铱、铂-铱和氮化钛中的至少一种。任选地,金属层的厚度在约10nm至约500nm之间的范围内。任选地,绝缘涂层包括Parylene-C。
在一些实施方案中,一种记录和刺激周围神经的方法包括通过接合周围神经来植入可植入电极,其中该可植入电极还包括多层石墨烯-纤维芯、围绕多层石墨烯-纤维芯的绝缘涂层以及设置在多层石墨烯-纤维芯和绝缘涂层之间的金属层,以及记录和刺激所述周围神经中的至少一项。任选地,接合周围神经可以包括将可植入电极植入在周围神经内、穿过周围神经缝合或在周围神经上方缝合。任选地,周围神经可以支配一个或多个器官,包括心脏、肺、胃、肝、胰、肾、以及在盆腔和会阴区域的那些器官,等等。在一些实施方案中,系统可以用于记录和/或刺激植物神经节或皮肤感觉神经节,包括但不限于结节、肠系膜和颈动脉。另外,在一些实施方案中,根据本公开构建的系统和方法可用于记录和/或刺激神经血管丛,其中神经分支在动脉和静脉复合体(例如,脾神经或肾神经等中的那些)之间行进。
在一些实施方案中,一种记录和刺激周围神经的方法可以包括:从周围组织暴露和隔离目标神经;通过使可植入电极绕着暴露的目标神经经过和与可植入电极形成结中的至少一项将可植入电极接合至目标神经,并将可植入电极穿过暴露的目标神经的神经外膜插入,其中该可植入电极还包括多层石墨烯-纤维芯、围绕多层石墨烯-纤维芯的绝缘涂层以及设置在多层石墨烯-纤维芯和绝缘涂层之间的金属层,以及记录和刺激所述周围神经中的至少一项。任选地,接合周围神经可以包括将可植入电极植入在周围神经内、穿过周围神经缝合或在周围神经上方缝合。任选地,周围神经可以在心脏、肺、胃、肝、脾、胰腺和骨盆器官中的至少之一周围。
附图说明
相信通过结合附图进行的以下描述,将更加充分地理解本公开。为了更清楚地示出其他元件,可以通过省略所选元件来简化一些附图。在某些附图中元素的这类省略并不一定表示在任一示例性实施方案中存在或不存在特定元素,除非可以在相应的书面描述中明确描述。所有附图均未必按比例绘制。
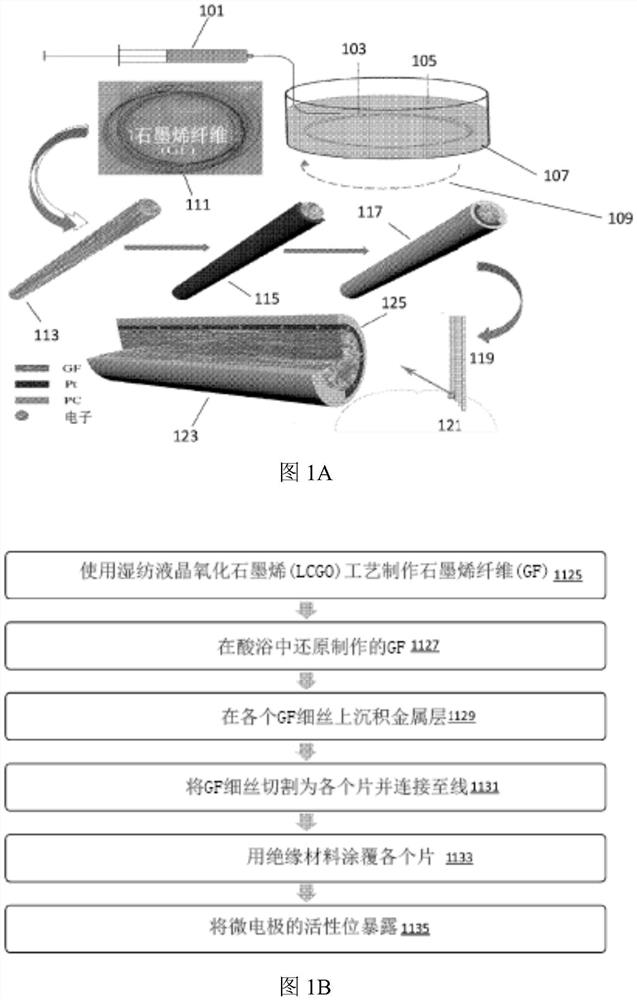
图1A提供了根据本公开的一些实施方案的用于制造和施加金属化的石墨烯纤维的示意图。
图1B提供了根据本公开的一些实施方案的用于制造金属化石墨烯纤维的过程的流程图。
图2提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的扫描电极表征。
图3提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的电化学表征。
图4提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的机械的和加速老化特性。
图5提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极从大鼠大脑记录的神经活动。
图6提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图7提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图8提供了根据本公开的一些实施方案构建的石墨烯纤维电极上的金属化厚度涂层的特征。
图9提供了根据本公开的一些实施方案的用于制造和施加金属化的石墨烯纤维的示意图。
图10提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图11提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图12提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图13提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图14提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图15提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图16提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性。
图17提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图18提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图19提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图20提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图21提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图22提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图23提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性。
图24提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图25提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图26提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图27提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性。
图28提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图29提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图30提供了通过根据本公开的一些实施方案构建的金属化石墨烯纤维电极记录的神经活动。
图31提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图32提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的表征。
图33提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性。
图34提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性和神经记录。
图35提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性和神经记录。
图36提供了根据本公开的一些实施方案构建的金属化石墨烯纤维电极的植入特性。
具体实施方式
本公开涉及金属化石墨烯纤维的制造和生物电子应用。在一些实施方案中,石墨烯纤维可以涂覆有铂,并用于记录和刺激一个或多个组织和器官。在一些实施方案中,具有薄金属(例如铂)涂层的柔性且自支撑的基于石墨烯纤维的微电极阵列作为集电荷器的制造导致具有低阻抗、高表面积和优异的电化学性质的结构。与常规石墨烯电极或铂(Pt)电极相比,本文讨论的杂化镀铂石墨烯纤维可以是稳健的,并提供了更好的性能。特别地,根据本文的公开内容构建的微电极阵列的实施方案可以包括低阻抗和石墨烯纤维的多孔结构,其上具有薄的铂层。石墨烯纤维可提供无与伦比的电荷注入容量以及记录和检测神经元活动的能力,而薄的Pt层有效地沿微电极转移收集的电子。因此,微电极可能够以高信噪比检测神经元活动。
常规的自立式碳纳米管和石墨烯微纤维的主要缺点在于与金属同类材料相比的高电阻率。当微电极长于几毫米时,电阻率显著增加,这对低噪声记录提出了巨大挑战。相比之下,根据本公开内容构建的系统可以通过在湿纺石墨烯微纤维上施加薄金属涂层(例如200nm范围内的铂)作为集电器来克服该局限性。该改性将石墨烯的电化学特性和金属的电子特性集成到微电极中,而不会限制其机械柔韧性和高表面积。石墨烯纤维的低阻抗和多孔结构导致了无与伦比的电荷注入容量,具有记录和检测神经元活动的能力,而薄金属层则有效地沿微电极转移了记录的电子。
图1A提供了用于制造金属化石墨烯纤维微电极并将该微电极植入脑中的过程的示意图。特别地,在101处,使用液晶氧化石墨烯(LCGO)工艺生成沉积在酸浴105内的氧化石墨烯纤维103。浴可以旋转109,并导致产生石墨烯纤维(GF)111。可以将GF切成较小的片113,并用金属涂覆以形成金属涂覆的石墨烯纤维115。然后可以用绝缘材料覆盖金属涂覆的石墨烯纤维117。然后可以切割绝缘材料,使得露出一个导电表面和/或尖锐的尖端以用于记录和/或刺激。可以组装119一个或多个绝缘的金属涂覆的石墨烯纤维,并将其植入脑121中。截面图123示出了电子125穿过绝缘的金属涂覆的石墨烯纤维的金属层的运动。
图1B提供了示出用于制造金属化石墨烯纤维微电极的方法的流程图。在第一步骤1125中,使用湿纺液晶氧化石墨烯(LCGO)工艺制造石墨烯纤维(GF)。在Esrafilzadeh,D.、Jalili,R.、Stewart,E.M.、Aboutalebi,S.H.、Razal,J.M.、Moulton,S.E.&Wallace,G.G.(2016).High-performance multifunctional graphene-PLGA fibers:towardbiomimetic and conducting 3D scaffolds.Advanced Functional Materials,26(18),3105-3117中描述了使用LCGO制造GF以及进一步固态剥落石墨的方法的描述。高性能多功能石墨烯-PLGA纤维:用于仿生和导电3D支架,其全部内容通过引用合并于此。在第二步骤1127中,在酸浴中还原制造的GF。在第三步骤1129中,在至少一部分单独的GF丝上沉积金属层。在第四步骤1131中,将GF细丝(具有沉积的金属层)切成单片并附接到导线上。在第五步骤1133中,将单片涂覆绝缘材料。在第六步骤1135中,暴露出1135包括GF细丝的微电极的活性位点。
在一些实施方案中,GF纤维不包括粘合剂材料。在一些实施方案中,GF芯可具有在约10μm至约200μm之间的范围内的直径。GF纤维不包含粘合剂的实施方案可以以较低的成本制造并提供更好的性能,因为常规的粘合剂可能不利于结构的电子和电化学性质,因为它们有助于机械支撑结构的加工。
在一些实施方案中,绝缘涂层可以是基于聚合物的涂层,例如Parylene-C。绝缘涂层可以具有约2μm的厚度。
在一些实施方案中,金属层可以被溅射到石墨烯纤维芯的表面上。在这样的实施方案中,金属层可以覆盖石墨烯纤维芯的全部或一部分。在一些实施方案中,金属层可以覆盖石墨烯-纤维芯的表面积的一半。金属层可以包括铂、铱、氧化铱、铂-铱和氮化钛中的一种或多种。在一些实施方案中,金属层的厚度在约10nm至约500nm之间的范围内。在一些实施方案中,金属层可以覆盖石墨烯纤维芯的表面积的大约50%至75%。可以调节金属层覆盖的表面积的百分比以用于制造过程。
进一步地,如图1B所示,可以通过在液晶中进行高度有序的氧化石墨烯片的原位还原来形成多层石墨烯纤维芯。任选地,这可以包括使用包含酸的凝结浴湿纺氧化石墨烯的液晶分散体。在一些实施方案中,酸可以是次磷酸和/或氯化钙。
在一些实施方案中,可以通过生产单片的包括2微米的具有优异柔韧性的氧化石墨烯来产生石墨烯纤维。然后可以使用导电性较低的金属(例如铂)来使石墨烯纤维金属化。但是,金属层可用于通过收集电荷来改善整体导电性。
在一些实施方案中,根据本文描述的系统和方法构建的石墨烯纤维可以形成多种形状,包括但不限于网状结构、阵列、线、纱线、尖针等。可选地,可以将石墨烯结构生物印刷成任何合适的形状以用于记录和/或刺激。
在下面的实施例中提供了根据以上公开内容构建的金属化石墨烯纤维的制备、表征和生物电子应用。
前述实例证明了根据上述公开内容的,由涂覆有Pt的石墨烯纤维制成的柔性和自支撑的微电极的制造、表征和急性体内性能,其用于神经刺激和记录应用。利用GO的高机械强度和高弯曲柔韧性的独特组合,制造了坚固、柔软的纤维和高导电性的电极。所得石墨烯纤维-铂涂层(GF-Pt)微电极具有优异的电化学性能,并具有明显更低的阻抗和更高的电荷存储容量的特征。电压瞬态分析证实这些微电极具有超过10mC/cm
电极制作
根据上述方法和技术,氧化石墨烯片的高机械强度和超柔韧性允许直接加工三维(3D)结构,而无需任何粘合剂来辅助加工。为了实现具有减少的石墨烯片的自组装、多层、无粘合剂、对准的超细纤维,使用包含次磷酸的凝聚浴对氧化石墨烯的液晶分散体(LCGO)进行湿纺。该凝聚浴在纺丝过程中降低了GO,而不影响柔韧性和机械强度。与传统的金属电极相比,微纤维的柔韧性是制造可植入微电极的重要特征,因为它最大程度地减少了异物反应并最大程度地提高了近端神经元的存活率。
更具体地说,GF是通过湿法纺丝工艺由自制的LCGO制成的。用次磷酸溶液(50%水溶液,Sigma-Aldrich)在80℃下还原制造的湿LCGO纤维24小时。通过使用溅射涂布机将干燥的单个GF丝(直径40μm)沉积在200nm Pt层上以制备GF-Pt。将制备的GF-Pt切成8-12mm的小片,并使用导电银漆(SPI用品,Z05002-AB)将其连接到银线上。然后,使用Parylene沉积系统涂布机(Specialty Coating System,PDS 2010 Labcoater)用Parylene C涂布GF-Pt和银线。将组装好的GF-Pt-PC浸入液氮中约10min,并用锋利的剪刀将其尖端切开,露出微电极的活性位。在测试之前将银线尾部的Parlyene C除去,使其导电。纤维的电导率是使用自制的四点探针电导率装置测量的,该装置的探针间隔为240um,其使用恒电流源(Princeton Applied Research 363)和数字万用表(Agilent 34401A)。通过扫描电子显微镜(JEOL JSM-7500FA)和视频显微镜(Leica M2056A)直接检查制备的纤维和电极。
图2说明了这些石墨烯微纤维的柔韧性。如图2的小图A所示,石墨烯微纤维具有足够的柔韧性,可以打单结201。图2的小图B和C分别显示了直径为20±3μm至40±5μm的石墨烯微纤维的扫描电子显微镜(SEM)图像,其分别使用19-23号喷嘴。这些纤维的横截面之间的比较表明,直径较大的那些纤维在干燥后趋于形成更不规则的形状,具有片间空隙(如图2的小图B中箭头所示的典型的直径较大纤维中的空隙表示)。这可能表明干燥过程中出现了严重的收缩,这进而可以解释20±3μm纤维的较高电导率(205±16S/cm),比较而言40±5μm纤维的电导率为52±0.3S/cm。
图2的小图D示出了图2的小图C的放大的SEM横截面,并且示出了石墨烯微纤维的对齐且高度组织的特征。在凝聚浴期间,数百个单独的石墨烯片会一起塌缩,在石墨烯纤维组件中形成多层芯。图2的小图D中显示的典型纤维截面的高倍放大SEM图像显示了石墨烯片层的特别对齐的特征。在此,原位还原处于液晶状态的完全有序的多层GO片通过防止弛豫相而抑制了形态的随机化。实际上,保持了固有的LC顺序,允许高度组织地组装GO微纤维。此外,原位还原限制了片的任何不受控制的重新堆叠。因此,获得了完全有序且多孔的体系结构。这种还原的石墨烯纤维可提供高达~2210m
图2的小图E显示了石墨烯微纤维的电阻率随铂涂层和长度的变化。如图所示,电阻随纤维长度的增加而增加。此外,GF-Pt电极显示出比GF电极低的电阻。这些微纤维的电阻受其长度的影响,随着长度从约~0.5cm增加到5cm,电阻从约~2kΩ增加到20kΩ。为了最大程度地减少纤维长度对电阻率的影响并促进记录细神经信号,微纤维的一侧被溅射涂覆了达~200nm厚的Pt层(GF-Pt)。Pt涂层使电导率从205±16S/cm显著增加到460±30.3S/cm。而且,由于Pt用作集电器,所以由于微纤维的长度引起的电阻率的增加的危害性变得显著更小。为了实现降噪、记录的稳定性和有效的电刺激,电阻率的最小化是特别期望的。
通过在液氮浴中尖锐切割尖端之前,用~2μm的绝缘聚合物涂层(Parylene-C,GF-Pt-PC)对每条镀铂微纤维进行绝缘,制造微电极;只留下尖端暴露为电化学活性位点。选择Parylene-C是因为它具有高介电性能、生物相容性、无针孔且均匀的涂层以及其在神经假体中的普遍用途。由裸石墨烯纤维(即无Pt涂层)制成的微电极被制造用于比较。此外,尽管聚合物涂层工艺提高了石墨烯微纤维的坚固性,但如打单结所表明的,柔韧性也得到了改善。
图2的小图F、G和H显示了每个涂层步骤后典型微纤维的SEM图像。特别地,小图F是GF电极的外表面的SEM图像。小图G是涂覆有Pt的GF电极的外表面的SEM图像。小图H是涂覆有Pt并用Parlyene-C绝缘的GF电极的外表面的SEM图像。Pt和Parylene-C涂层均在微纤维周围形成薄层,在尖端保留了多孔结构和高表面积,如高分辨率SEM显微镜图像所证实(参见图2中的小图I、J、K和L)。高表面积导致高记录灵敏度以及在1Hz至10kHz的低阻抗下的大电荷注入容量。特别地,小图I和J示出了GF-Pt电极的横截面SEM图像,小图K和L示出了最终微电极的尖端的SEM图像。
电化学表征
在刺激和记录生物电行为的过程中,电极执行从电解质中的离子流到测量系统中的电流的转换功能。电极与活组织之间的界面的高电阻抗会负面影响信噪比并增加信号失真。由于尺寸减小,这对于微电极尤其重要。图3说明了石墨烯微电极的电化学性能,其通过电化学阻抗谱(EIS)、循环伏安法(CV)以及电荷存储容量和电荷注入极限的计算来评估。
室温下,用CHI 660E电化学工作站(CH Instruments)在磷酸盐缓冲液(PBS,pH7.4,Sigma-Aldrich)中进行电化学阻抗谱(EIS)和循环伏安法(CV)。采用三电极电池系统,将测试样品作为工作电极,将铂片作为对电极,将Ag|AgCl作为参比电极。以10-50000mV/s的扫描速率在-0.2和0.8V的电压之间记录CV。测试每个样品3-5个循环,然后从最后循环中以100mV/s的扫描速率记录的电流随时间的积分来计算阴极电荷存储容量。进行从-1.6到1.6V的扫描以确定GF-Pt-PC电极的水窗口(例如,电解阈值),并在检测到尖锐的电流峰值时确定水的氧化和还原电位。在1-10
图3的小图A示出了微电极的阻抗模量。还制造了由具有类似直径的Pt丝和微纤维制成的电极,并将其作为对照进行测试。EIS分析表明,在测试的频率范围(1Hz至10kHz,小图A)中,石墨烯微电极的阻抗比Pt电极低约2个数量级。特别是,在1kHz时的阻抗比Pt电极低50倍以上(~50kΩvs~300kΩ)。石墨烯微电极阻抗的这种大幅降低是完全有序和分离的石墨烯片的可用表面积增加的结果。此外,Pt改性的微电极的阻抗(在1kHz时)分别比纯石墨烯和Pt微电极的阻抗低约5倍和约300倍。在石墨烯微纤维上(作为集电器)添加一薄层Pt产生了强大的协同效应,从而产生具有较低阻抗的坚固和优异的混合微电极。
图3的小图B示出了微电极的阻抗的相角。在理想的极化电极上,在刺激过程中,通过的电荷将完全归因于电容,而不是任何法拉第反应。如图3的小图B所示,微电极的相位滞后表明,暴露尖端处的电化学相互作用是通过在微电极尖端的双层上的电容性充放电过程(吸附控制过程)来控制的。
图3的小图C显示了在PBS溶液中微电极的CV为10mV/s。CV是一种用于测量电极-溶液界面处的电容和法拉第成分的简单快速的技术。图3的小图C比较了在此实施例中制备的不同电极的循环伏安法(CV)。尽管两个基于石墨烯的微电极均显示出接近矩形的CV曲线,但Pt改性的微电极的电流明显高于其他电极。该改进归因于Pt涂层的高电导率与GO电极的高表面积相结合的整合,这使电解质离子有效扩散,随后通过Pt层实现了便捷的电子转移。此外,由CV计算得出的Pt改性GO微电极的阴极电荷存储容量为946±140mC/cm
图3的小图D示出了微电极的水窗口,图3的小图E示出了微电极的电压瞬变测试。图3的小图F示出了与文献中报道的神经接口电极相比,根据本文所述的方法构建的微电极的电荷注入容量、比阻抗和几何面积的比较。
特别地,电压瞬态测量是在室温下在PBS溶液(pH 7.4,Sigma-Aldrich)中设置的两电极上进行的。由数字刺激器DS800和A365隔离器单元(World Precision Instruments)产生对称的电荷平衡、阴极第一、双相电流脉冲,其宽度为100μs,相间开路电位为20μs,在250Hz时短路为2.78ms。响应于所施加的电流脉冲,跨有源微电极的电压波形用电子记录系统(eDAQ)记录。通过从总电压瞬变中减去初始进入电压(V
电刺激通过使可兴奋细胞的膜去极化来启动功能响应,这是通过电极之间离子流的流动来实现的。进行电压瞬态测量以确定电极-电解质界面上的最大正和负极化值,并估计可以在不超过水电解极限的情况下在刺激脉冲中注入的最大电荷。将电势扫过一个宽的窗口以获得电压范围,在该电压范围内电极、电解质和水既不会被氧化也不会被还原。为了确保在刺激过程中微电极的安全极化,通过在-1.6V至1.6V的电压极限(vs.Ag/AgCl电极)之间扫描电势来记录微电极的CV。在生物系统中,该电势范围主要取决于水的氧化和还原(水窗口)。水窗口受到水的氧化和还原电压的限制,电流的急剧增加表明了这一点。在该实施例中,发现基于GF的微电极的水窗口在-1.0V至0.9V之间(图3的小图D)。图3的小图E的上部显示了典型的输入双相电流脉冲(300μA和20μs延迟)。由于电解质的欧姆电阻,对电流脉冲的电位偏移响应(参见图3的小图E下部)显示出电位的初始快速变化,称为存取电压(Va=-1.35V),之后是极化电压缓慢上升(V
使用双相脉冲的第一相的极化电压确定电荷注入极限,并通过不断增加电流幅度直到极化电压达到1.0V来获得所述极化电压。在水还原电势(图3的小图E)之前,在V
GF-Pt微电极的电荷注入容量显著高于所有报道最好的电极材料;如图3小图F所示,包括但不限于Pt、碳纳米管纤维、导电聚合物涂层、金属氮化物和氧化物。有序石墨烯片与Pt层的低电阻率的协同效应导致了这种显著的电荷注入容量以及显著增强的电化学性能。
耐久性表征
图4示出了根据本文描述的方法构建的电极的耐久性。随着时间的流逝,长期植入的电极会受到材料降解以及绝缘涂层(例如Parylene)分层的不利影响,这会导致器件故障。使用循环伏安法在PBS溶液中测试GF-Pt微电极的寿命。图4的小图A显示了在50mV/s的扫描速率下的1000个电化学循环后的微电极的代表性SEM图像。如图所示,电极头未显示任何明显的石墨烯降解或Parylene分层。Parylene涂层通常会从刚性的下层电极(例如Pt和硅)上剥落。然而,此处,Parylene和石墨烯微纤维之间的强界面粘合力以及下层纤维的柔韧性和柔软性导致了Parylene涂层的显著稳定性。
图4的小图B证实了在延长的稳定性试验中,电化学性能没有明显变化。
此外,针对在PBS溶液中反复弯曲和长时间浸泡,评估了石墨烯微纤维和微电极的稳定性(如图4的小图C、D、E和F所示)。具体而言,图4的小图C表明,石墨烯微纤维在弯曲循环测试中表现出出色的稳定性,因为直的和弯曲的GF-Pt纤维电极之间的电导率均无明显差异(105.2±2.7 vs 104.4±3.7S/cm),弯曲200次后也无明显差异(105.2±2.7 vs102.7±2.5S/cm)。此外,图4的小图D显示即使在PBS中浸泡2周后,也仅观察到~8%的电导率损失。经过非常艰苦的耐久性和疲劳测试后,微电极也可以保持77.6%和52.2%的电荷存储容量,该测试分别涉及连续200次360°折叠(图4的小图E)和在PBS中浸泡2周(图4的小图F)。
包括根据本公开的实施方案构建的微电极的实施例1的神经接口电极的电化学性能可以汇总如下:
手术(体内)植入和神经活动记录
结合实施例1,将根据本公开内容构建的电极通过外科手术植入大鼠中。
所有程序均按照2017年1月6日在德克萨斯大学达拉斯分校的机构动物护理和使用委员会批准的动物使用规程15-19进行。本研究选择了一只Long-Evans大鼠,目标位于运动皮层内与左前爪控制相关的区域。用混合在氧气中的2%异氟烷麻醉动物,然后腹膜内施用由氯胺酮(65mg/kg)、甲苄噻嗪(13.33mg/kg)和乙酰丙嗪(1.5mg/kg)组成的队列。将动物安装在Kopf 900型小型动物立体定位仪(美国加利福尼亚州David Kopf Instruments)中。地塞米松(2mg/kg)在肩部皮下施用以减少炎症反应,然后在头皮切口部位直接皮下施用0.5%利多卡因(0.16cc)。暴露颅骨后,开创一个2.0mm乘2.0mm的颅骨切开术,其中心位于我们的初始植入坐标中距前囟尖端2.5mm和距其外侧2.5mm的位置。该区域的硬脑膜用硬脑膜挑针反射,然后用微型剪刀将皮层表面暴露出来。通过频繁施加7.4pH无菌生理磷酸盐缓冲液,将整个区域保持在液体下。
为该概念验证研究选择了五个植入物。第一个植入物由一束四个直径为40μm的微电极组成,这些电极由涂有铂薄层并用Parylene-C绝缘材料包裹的石墨纤维组成(GF-Pt-PC)。第二个微电极由Parylene-C绝缘体包封的单个直径为40μm的石墨纤维导体组成(GF-PC)。第三个微电极是单个40μm直径的GF-Pt-PC微电极。最后两个微电极包括一个GF-PC和一个GF-Pt-PC,直径为20μm。
将四个微电极的束装入2650型液压微定位器(美国加利福尼亚州David KopfInstruments)的微电极支架中。降低微纤维线束的尖端,直到它们在植入坐标处与皮质表面接触,重置微定位器上的距离计数器,然后将设备以1000μm/s的速度降低至运动皮层。如果线开始弯曲,则立即停止植入并将速度降低至100μm/s。将无菌不锈钢皮下注射针插入大鼠尾巴中,以用作对电极。最佳植入深度为1500μm。
使用OmniPlex D神经数据采集系统(美国德克萨斯州Plexon Inc.)进行每次急性记录至少10分钟。如果没有获得单个神经单元,我们将植入深度增加200μm,并进行另一次记录。我们继续增加植入的深度,直到获得单个单元的成功记录,或者线植入达到最大深度2000μm。记录后,将微纤维丝/束完全从大脑中移出,用异丙醇对微定位器进行消毒,然后将另一根丝装入微操纵器中。将每个其他微纤维微电极分别植入不同的位置,第二个植入位置位于距初始植入位置尖端200um的位置。第三个微电极从第二个位置横向植入200μm,下一个距第三个位置尾部200μm,最后一个距第三个位置100μm。对于所有随后的微电极,遵循相同的记录程序。研究结束后,使用过量的5%异氟烷蒸气对大鼠实施安乐死,直到停止呼吸为止。
使用Plexon的Offline Sorter软件进一步处理了从OmniPlex D获得的宽带记录。宽带信号用截止位于550Hz的4阶Butterworth滤波器滤波并且使用共模式参考进行噪声消除。选择单个单元的阈值从峰高设置为3σ,波形持续时间为1500ps。使用该软件的内置Valley-Seeking算法,可以进一步评估从阈值交叉点分类的波形。通过将阈值设置为原始信号的±3σ并去除阈值交叉之前250ms和之后750ms的波形段,获
为了演示体内概念验证神经记录,首先将单个微电极植入成年大鼠的大脑皮层中。包含完全有序的石墨烯片的细胞尺度微电极(20μm至40μm)为我们提供了足够的机械稳固和清晰度,以便插入并精确定位以记录神经信号共十分钟。图5的小图A显示了植入的微电极的图像。另外,体内测试使用了四个尖端暴露的微电极的阵列,它们在线尖端之间以大约1mm的距离对齐并胶合在一起(如图5的小图B所示)。在体内测试之前,记录每个微电极的CV(如图5的小图C所示),以确认合适的电化学性能。在插入捆绑的微电极时,4个单微电极中只有3个渗透到运动皮层中。第四个微电极弯曲,随后没有进入大脑,因此从记录中消除。在三个穿透的微电极中,两个从皮层表面测得的束深度1500μm处显示出单个单元的活性。图5的小图D显示了从GF-Pt-PC捆绑的两个微电极中获得10秒的550Hx高通滤波电信号,其中两个微电极插入1.5mm到Long Evans的运动皮层中在距前囟尖端2.5mm和侧面2.5mm的位置。图5的小图E显示了在10分钟的记录时间内从GF-Pt-PC植入的微电极之一获得的1543个单个单元信号。波形中心的黑线表示平均单个单元信号,其幅度为-70.2μV,峰-峰值为130.5μV。第二有源电极(未示出)的单元具有相似的形状,其平均幅度稍低,为-54.3μV,峰-峰值为89.7μV。两个微电极的SNR为7.10dB和4.43dB。
如图6所示,从皮质表面植入另一单个GF-Pt微电极至1500μm的深度,并与植入2000μm深度的仅GF的微电极进行了比较。从单个微电极获得的信号产生的单个单元波形与图5所示的捆绑微电极相比在形状和持续时间上都相似。GF-Pt微电极显示两个单个单元,振幅分别为-75.2μV和-69.3μV,峰-峰电压分别为183.4μV和123.6μV,信噪比(SNR)分别为9.2dB和8.4dB。我们所有的GF-Pt微电极信号均已显示出比以前报道的信号更大的记录信号。另一方面,仅GF的微电极表现出更弱的性能。尽管它具有-93.9μV的信号振幅和146.4μV的峰-峰电压,但噪声明显更大,导致SNR降低了3.0dB。
因此,具有极薄的铂涂层的坚固、柔性和自支撑的基于石墨烯纤维的微电极阵列表现出具有低阻抗、高表面积和高电荷注入容量的高性能神经记录微电极。体内研究表明,植入大鼠大脑皮质的微电极可以检测噪比(SNR)非常高的神经元活动。
碳纳米管和石墨烯已被成功证明是用作神经植入设备的其他导电材料(例如铂、铱、氮化钛和氧化铱)的替代平台,可有效捕获神经信号。实例实验已经证明了铂改性的石墨烯微纤维用于具有高信噪比的单个单元记录容量的能力。此外,这些电极捕获的记录的单元与其他小型微电极平台报告的记录的单元并无不同。
图7提供了各种纤维横截面的SEM图像,并说明了直径较大的纤维在试验过程中往往形成较大的空隙,这是因为其比较小的纤维具有更大的收缩率。
图8提供了条形图,显示了具有不同Pt涂层厚度的石墨烯细纤维的电导率。
图9示出了具有Pt涂层(GF-Pt-PC)和不具有Pt涂层(GF-PC)的微电极的制造方法。如图9所示,任选地,石墨烯纤维(GF)901可以涂铂,从而形成带有Pt涂层(GF-Pt)909的微电极。如分别在步骤903和911处所示,可以将GF或GF-Pt附接到银线上。另外,可以分别在步骤905和913处施加Parylene涂层。此外,如步骤907和915所示,暴露每个微电极的尖端,并去除银线尾部上的Parylene C以便连接。
图10提供了GF-Pt的光学显微镜图像。如图所示,GF-Pt非常柔性,可以轻松打结1001和缠绕1003。
图11提供了根据本文的公开内容构建的电极的另外的电化学特性。特别地,图11的小图A提供了GF-Pt-PC的CV测量,以确定在石墨烯双层上的动态行为。此外,图11的小图B显示,在低扫描速率下,峰值电流与扫描速率线性相关,线性回归方程为y=3.2659*10-8+3.0127x(R2=0.980),表明GF-Pt-PC的表面吸附控制的过程。此外,图11的小图C显示,在高扫描速率下峰值电流与扫描速率平方根线性相关,线性回归方程为y=-1.6698*10-8+5.4659x(R2=0.999),表明扩散控制的过程。
图12提供了将单个单元植入成年大鼠的大脑皮层中时记录过程的快照。如图所示,用户可以使用图形用户界面1201来从特定电极1203中选择记录。此外,图形用户界面1201可以允许用户查看波形1205、波形数据1207的簇、电极通道信息1209、时间线1211和波形1213。
图13示出了使用四个阵列电极的体内皮质神经记录。如图所示,可以将电极插入大脑的3-6层。可以记录1303、1305、1307和1309四个波形,每个电极一个。可以确定复合波形1301。
图14示出了通过施用硝普钠(NPS)(一种降低血压的分子)引起的脾神经的内源性活性的记录。如图所示,根据本文所述的公开内容制成的石墨烯纤维电极能够记录来自脾神经的末端分支之一的自发神经活动。如小图1401所示,该测试包括记录2分钟的基线活动。之后,静脉注射硝普钠(NPS),然后施用降低血压的血管扩张药(绿色箭头表示注射时间)。注射后约1分钟,从石墨烯电极(白色垂直迹线)记录高振幅的神经活动。离线分析显示了该诱发活动中的两个特定波形。在1403处示出一个波形,其在NPS之后出现367次,具有在1000秒之前的高入射率并且相对较低的频率,而在1409处示出另一波形,观察到其在更低频率出现52次。还分别示出了功率谱信号14-7和1413以及频率1405和1411。图14展示了使用包裹在这条小尺寸(60-80微米)神经周围的石墨烯纤维电极记录脾脏中生理相关神经信号的能力。
图15示出了使用石墨烯纤维电极在钩电极上以增加的电压诱发的神经活动的记录。特别地,记录是使用商业钩电极(箭头)在施加于迷走神经的增加电压(1.2、1.4、1.6、1.8和2V)1501下通过电刺激诱发的脾神经的复合动作电位。使用石墨烯纤维电极在脾神经中识别出两个不同的波形,一个显示在顶部小图1505中,另一个显示在底部小图1507中;它们响应于较高电压刺激1503而以增加的数量出现。该数据证实了根据本公开内容构建的石墨烯纤维电极记录小神经中的神经信号的能力。
图16示出了通过将石墨烯-Pt纤维电极绑在脾神经丛上使石墨烯-Pt电极接合到脾神经的小末端分支,从而记录或刺激神经活动。1601是大鼠脾脏的照片,其略微抬起1605以可视化小末端分支(插入物1603)。在右侧1603中显示了该分支的更高放大倍数,在底部可见一些脂肪细胞的血管。已知神经网(即神经丛)包裹血管并将神经控制带到脾脏。图16中的照片还示出了石墨烯纤维电极1607(根据本文所述的本发明制造),其包裹在血管/神经丛周围以记录神经活动。
图17示出了根据本公开内容的不同波形,其代表使用石墨烯-Pt电极从终末脾神经丛记录的各种类型的神经活动。示出了用石墨烯纤维电极记录的九种不同的波形。
图18示出了根据本文的描述制成的石墨烯纤维电极的电刺激能力。将两个石墨烯纤维电极插入大鼠的坐骨神经中,一个用作阴极,另一个用作阳极。通过石墨烯纤维电极施加一连串电脉冲,并使用钩形电极从更近端记录其诱发的活动。该图显示,通过增加电脉冲1801(黄色箭头),我们能够募集三种不同类型的神经信号,分别来自不同的神经元群体,如1803、1805所示,对应于三个不同的波形1807。该数据证实本公开的石墨烯纤维电极能够通过电刺激唤起特定的神经活动。
电极制作
根据本文所述的技术,制作了直径为20微米的石墨烯纤维电极、直径为20微米的涂覆有铂的石墨烯纤维电极、直径为40微米的石墨烯纤维电极、以及涂覆有铂且直径为40微米的石墨烯纤维电极。
图19示出了在各种纤维长度下四种类型的石墨烯纤维电极的电阻。如图所示,电阻率随纤维长度的增加而增加。
电化学表征
图20提供了由Pt、石墨烯微纤维和Pt涂覆的石墨烯微纤维(D=20和40μm)制成的各种微电极的电化学特性。图20的小图A提供了微电极的模量阻抗。图20的小图B提供了微电极的阻抗的相角。图20的小图C提供了PBS溶液中10mV s
根据以上关于实施例1讨论的技术进行电化学表征。
耐久性表征
图21示出了改性微电极(GF-Pt-PC-40)的电化学耐久性表征。具体而言,图21的小图A和B显示了典型的改性微电极在以扫描速率50mV s
根据以上关于实施例1讨论的技术进行耐久性表征。
连接神经系统以解码功能活动或电刺激以调节该功能具有许多科学和医学应用。期望用于神经接口设计的材料具有低阻抗和高信噪比(SNR),以允许单个单元活动的灵敏记录,以及高电荷存储容量(CSC),以有效且安全地刺激神经。微电极通常在硅中制造,其具有铂(Pt)、Pt/铱和铱氧化物电极。但是,植入软神经组织的硅树脂轴的微动会加剧异物反应,并导致这些设备的最终故障。由于其生物相容性和高CSC(~372mC/cm
电极制作
图22示出了根据本公开内容构建的石墨烯电极。小图A和B示出了通过在酸性凝结浴中挤出LCGO而获得的20-40微米的石墨烯纤维,随后将其涂覆Parylene C。小图C和D示出了石墨烯纤维的扫描电子显微镜图像。
手术(体内)植入和神经活动记录
如图23所示,将石墨烯电极植入成年雌性大鼠2300的运动皮层或坐骨神经中。特别地,金属化的石墨烯电极多阵列2303被植入运动皮层2301中。另外,将单个金属化的石墨烯电极2307植入坐骨神经2309中。来自石墨烯电极的信号被传输到记录系统2305。
如图24所示,从运动皮层记录了单个单元记录2400。多电极被植入到运动皮层的不同深度,因此从不同的皮质层获得了单个单元记录。
如图25所示,使用光栅图2501、2503绘制了来自运动皮层和坐骨神经的记录,并说明了三个独立轴突的活动(如图25的小图B的PCA图所示)。此外,绘制了尖峰间间隔2507。
图22-25说明了石墨烯微电极可用作中枢神经系统和周围神经系统的高性能接口。此外,在石墨烯纤维上施加金属涂层向该材料赋予了优异的电化学特性。另外,石墨烯纤维的多电极阵列的设计代表了用于记录多个单神经元单元的高灵敏度性能的替代方法。
接口到迷走神经(VN)可使研究人员解码和调节其活动。FDA批准的基于VN刺激的临床疗法包括耐药性癫痫和抑郁症,并且目前正在研究迷走神经的病态肥胖、耳鸣和中风。VN具有异质的解剖结构组成(约80%的传入纤维和约20%的传出纤维),导致复杂的功能电生理学,其以独特的方式对不同的生理刺激做出反应。接口到VN的常规电极是用铂或铂铱制成的,期灵敏度有限且电荷注入容量低(Qinj,~0.05-0.26mC/cm2),而用碳纳米管制成的神经内电极已显示出希望(CSC~372mC/cm2,12.5kΩ)。
在实施例4中,将从具有优异电化学特性的氧化石墨烯的液晶分散体获得的高性能镀铂石墨烯纤维(CSC和Qinj分别地~947和~46mC/cm2)植入VN中,并且用它们记录在以下期间在神经外和神经内构造中的诱发的电生理活动:i)全身性氧张力降低,ii)静脉硝普钠治疗引起的平均动脉压降低,和iii)使用铂钩形电极响应于近端VN刺激的诱发的活动。特定活动波形和活动模式与基线条件下具有高信噪比(SNR~4.3)的治疗相关。数据支持使用镀铂石墨烯纤维作为神经外和神经内电极来接口到VN。
电极制作
图26的小图A示出了电极制作步骤。具体而言,使用LCGO 2601,然后在凝结浴2603中挤出,将石墨烯纤维2605成长,切割2607,涂覆金属(即,铂)2609,涂覆绝缘材料(即,Parylene-C)以形成GF-Pt微电极2611。提供了2613微电极的SEM图像。
电化学表征
与Pt-PC线2619相比,图26的小图B、C和D示出了在20和40μm OD下涂有PC(GF-Pt-PC)的石墨烯纤维的阻抗谱2615、相角2617和循环伏安法。
手术(体内)植入和神经活动记录
图27示出了根据本公开的实施例构建的电极的手术植入。特别地,如图所示,将电极植入成年雌性大鼠2701中。将石墨烯电极神经外2703(参见图27中的小图B)或神经内2705(参见图27中的小图C)植入颈迷走神经(VN)2709中。大鼠2701在手术和神经刺激/神经记录过程中被充氧。使用三种技术激发神经活动:迷走神经刺激(VNS)、硝普钠的应用和氧的减少。记录迷走神经2709的电活动并将其提供给研究人员2711。通过大鼠2701的股静脉给予硝普钠2713。在股动脉处记录2715氧合测量和/或血压测量。
图28汇总了图27中描述的体内测试装置的结果,更具体地说,由于系统硝普钠引起的低血压引起的迷走神经活动。特别是,小图A显示了来自股动脉的基线血压测量值以及来自植入迷走神经的石墨烯电极的神经活动记录。图28的小图B显示了血压测量值和由诱发性低血压引起的在迷走神经中植入的石墨烯电极的神经活动记录。小图C在光栅图中说明了对硝普钠和利多卡因施用的神经活动反应。如小图D所示,确定了两个单独的波形。
图29示出了通过电刺激引起的活动。如图29的顶部图所示,复合动作电位的频率和幅度随强度的增加而增加。如底部图所示,已识别出一种波形及其对应的光栅图。
图30示出了根据本文的公开内容,通过植入颈VN中的神经内石墨烯纤维检测到的神经活动。氧气限制增加了神经电活动的幅度。在所选波形的光栅图中(图30的右下方小图)记录了频率的相应增加,这在速率直方图(图30的右上方小图)中表示。底部迹线提供了从2至0L/min的氧气减少的示意性指示时间。
如图26-30所示的实施例4证明,镀铂石墨烯纤维电极可以用作高性能神经接口,以在神经外或神经内记录颈VN的神经元活动。这些电极的电化学特性(低电阻和高电导率)可以有效识别SNR~4.3的单个和复合神经单元。由电刺激、血压降低和氧气减少引起的电活动的有效检测支持将这些电极用作自主神经接口,以解码与生物电子医学有关的神经电活动。
电极制作
如图31的小图A所示,根据本文所述的系统和方法,制造了涂覆有~200nm层Pt并用2μm Parylene-C绝缘的石墨烯纤维微电极(GF-Pt-PC)。如图31的小图B和图31的小图C所示,将石墨烯纤维微电极连接到银线。石墨烯纤维微电极的SEM图像显示在图31的小图D和E中,显示了比常规微电极更大的柔韧性。根据本公开内容构建的电极可以用作不同纤维的阵列,用作纱线或股多电极阵列。
电化学表征
如图32所示,在石墨烯微纤维上涂上一层薄Pt产生了强的协同效应,导致坚固耐用和优异的混合微电极,其阻抗分别比原始GF微纤维和Pt微电极低约1个和3个数量级。Pt涂层将40μmGF纤维的电导率显著提高到200至460S/cm。而且,由CV计算得出的微电极的阴极电荷存储容量为946mC/cm
手术(体内)植入和神经活动记录
常规周围神经接口(PNI)可以根据其制造、敏感性和侵袭性进行分类。袖带电极是沿圆周植入在周围神经上的PNI,由柔性材料制成,具有螺旋形、螺旋状、分开圆柱或折叠设计,以符合其圆柱形状,并与金、铂或铂/铱等金属接触。由于其柔软性(即,在MPa范围内的杨氏模量)和长期稳定性,通常使用由硅树脂制成的传统袖带电极,尽管它们的制造大多限于模塑和层压技术。不幸的是,这些常规的袖带设备具有产生足够的弯曲力以使其保持闭合所需的相对较厚的壁(例如,280-600μm),这导致明显的异物反应和肾上腺纤维化,从而不利地影响接口的敏感性。此外,涉及心脏、呼吸、消化和泌尿疾病的器官生理调节的新临床应用着重于较小且由较少轴突组成的自主周围神经的神经调节(例如,在60-80μm大鼠颈动脉窦神经中大约600个轴突平均2.5μm)。在这些疾病中,神经靶还具有较薄的神经外膜,其大部分由无髓鞘的轴突形成,因此可能更容易受到神经接口设备的损害。这些靶标的小神经尺寸、其易碎的性质以及受限的植入区域正推动着新型可植入电极的发展,这些电极小、柔韧、并具有足够的电荷注入容量,以有效、安全地刺激神经。
如图33的小图A所示,所公开的GP-Pt纤维可以用作“无袖带”的PNI,因为它们可以简单地绑在3301神经3305周围,并用作单极或多极电极,用于记录和刺激任何尺寸的神经,因为可以使用纤维打结并因此完全闭合。这样就可以将其紧密放置在任何神经、神经束或神经丛和神经血管丛上。电极的灵敏度使其可以将其包裹在小神经周围,以感知其活动。
可选地,如图33的小图B所示,如果尖端被锐化,则它们可以单独地或作为阵列3303来使用,以在血管内记录或刺激。当用作无袖电极时,在将神经周围的节段放置在神经周围之前,将其绝缘。
图34图示了迷走神经3403周围的单极电极3401的位置,并显示了在560uV峰到峰处由轻度缺氧引起的神经活动增加的敏感记录(图34的小图B),与碳纳米管纤维处于同一神经中的报道相比,灵敏度增加了9-18倍。
在其他配置中,Pt-Gph纤维可以连接到一次性针头进行缝合,并用于连接患者的组织部分。传统上,缝合线是由丝绸或合成材料制成的,并且不导电。
如图35所示,在单独的配置中,GF-Pt纤维可用作皮质电极,用于记录或刺激大脑或脊髓组织。可以将GP-Pt纤维插入组织中,或者在脊髓的情况下,可以将GP-Pt纤维绑在背根或腹根周围,以进行感觉和运动接口。刺激背根可用于控制疼痛。小图A示出了插入大鼠大脑皮质的电极的照片。图35的小图B显示了由GF-Pt电极记录的皮质神经元的单个单元记录。
如图36所示,GF-Pt纤维还可用于记录和刺激其他组织,包括肌肉外或肌肉内的骨骼肌。图36的小图A示出了针3601的使用,其中尼龙缝合线3603被绑在GF-Pt上。图36的小图B示出了其中GP-Pt纤维被驱动到肌肉3605中的实施方案。
本文所述的金属化石墨烯纤维可以使用制造。替代地或另外地,金属化的石墨烯纤维也可以通过3D打印、挤出、湿纺等来生产。
本文所述的金属化石墨烯纤维可以与任何合适的肌肉结合使用。例如,它们可以在心脏中用作心脏起搏器或记录心律不齐,也可以用于皮肤上,用于经皮的皮下刺激。其他应用包括面部肌肉,用于治疗上睑下垂或偏头痛。该技术还可直接用于其他器官,包括胃、肝脏、肾脏和脾脏。
在一些配置中,本文描述的金属化石墨烯纤维可以用于细胞培养记录、生化生物感测、分子生物感测等。例如,未改性的或功能化的石墨烯纤维可用于测量许多代谢和生化生物标志物的细胞外浓度。这些包括活性氧种类,例如过氧化氢和氧气,以及许多重要的神经递质,包括5-羟色胺、多巴胺、谷氨酸、γ-氨基丁酸。代谢生物标志物包括葡萄糖、咖啡酸和雌二醇。此外,它们可以用作单个生物传感器或多功能传感器阵列,并用于包括血清、尿液、汗液、唾液等在内的各种样品。
在某些配置中,纤维电极可以连接到电池或无线系统以进行记录或刺激。在其他实施方案中,它可以连接到电、热或射频能量源,并用于电化学检测,包括多巴胺的电化学检测。它们也可以作为其他装置的组成部分并入,包括作为神经支架的一部分,其中将神经支架固定在适当位置的缝合线也具有导电性,并且可以传递电刺激来刺激神经再生。另外的应用可以是这些纤维的经皮放置,用于类似于针刺的应用,其优点是这些纤维可以放置一次并根据需要存取。这些GP-Pt纤维可用于治疗针灸等解决的疾病。
在一些实施方案中,本文所述的镀铂石墨烯纤维可用于记录并刺激多个组织和器官。例如,可以将金属化的石墨烯纤维置于诸如脾脏、肾脏等的其他器官上。在一些实施方式中,根据本公开内容构建的电极可以包裹在血管或神经血管丛周围,以进行生物传感或神经调节。此外,可将电极植入内部器官内部、通过内部器官缝合或内部器官上,所述内部器官包括但不限于心脏、肺、胃、肝脏、脾脏、胰腺和其他盆腔器官。
例如,在一些实施方案中,纤维的柔韧性和敏感性可以允许将这些基于石墨烯纤维的电极放置在脾、肾以及其他胃和盆腔器官以及神经节中的小的神经血管丛上。特别地,在脾末端神经血管分支中,石墨烯纤维可以复合动作电位的形式检测不同类型的自发和诱发的活动。从这些记录和激发它们的活性,例如,可以估计神经纤维类型的特定组对包括A-α、A-β、A-γ、A-δ/B和C纤维的复合动作电位的贡献。此外,脾神经的刺激可用于神经调节脾的生理活性,包括释放炎性细胞因子,这对于作为包括类风湿关节炎和克罗恩氏病等疾病的生物电子医学方法可能是有益的。
此外,公开的实施方案可用于体细胞和自主神经节的神经调节,包括例如结节神经节、颈神经节以及肠系膜和脏肌神经节等。所公开的纤维可以直接插入到具有固有神经网络的经源器官中,例如心脏或肠道,以直接神经调节它们的活性。
镀铂石墨烯纤维可用作长期应用中的神经和神经-肌肉界面的可植入导电缝合线。例如,所描述的镀铂石墨烯纤维可用于记录、刺激和/或阻断神经和神经肌肉接头的电势,从而提供安全且长期的界面,其具有高注入电荷容量、对各种肌肉和神经几何形状的适应性,包括那些血管神经丛复合物、和高电极敏感性。
根据本公开内容构建的实施方案可用于刺激身体中包括神经和肌肉在内的许多组织,以预防与年龄有关的肌肉萎缩,在康复中恢复截瘫患者四肢的运动以及在那些需要进行定时电刺激的治疗中恢复运动,例如胫骨神经刺激和骨盆底刺激,以治疗尿失禁和刺激膝盖肌肉以治疗骨关节炎。此外,根据本公开内容构建的实施方案还可以用作与机器人假体装置、周围神经调节和生物电子医学应用的双向链接。
例如,神经刺激和/或神经记录的方法可以包括以下步骤:将根据本文的公开内容构建的电极植入体内神经上,其控制包括大脑、心脏、脾脏、肝脏、肾脏等在内的内部器官。
在另一实例中,神经刺激和/或神经记录的方法可以包括以下步骤:将根据本文的公开内容构建的电极直接体内植入到包括大脑、心脏肌肉的器官上,表面上或进入器官内均可。
在又一实例中,植入方法可以包括以下步骤:将根据本文的公开内容构建的电极放置在组织上方、组织内部或穿过组织或在组织上缝合。
任选地,根据本文公开内容构建的电极可用于通过向一个或多个可植入电极发送电流来刺激一组包括神经元和肌肉细胞的电响应细胞。另外,通过根据本文公开内容构建的可植入电极,来自包括神经元和肌肉细胞的电源性细胞的活性。
如本文的描述和随后的权利要求书中所使用的,除非上下文另有明确说明,否则“一个”、“一种”和“所述”的含义包括复数指代。与数值相关的术语“约”是指该值向上或向下变化5%。例如,对于大约100的值,表示95到105(或95到105之间的任何值)。
在本文中描述的组合物和方法的上下文中以及本说明书中所使用每条术语在使用时的具体的上下文中,这些术语通常具有其在本领域中的普通含义。上面已经更具体地定义了一些术语,以向从业者提供关于组合物和方法的描述的附加指导。
本文中任何地方提及的所有专利、专利申请和其他科学或技术著作均通过引用全文并入本文。可以在不存在本文未具体公开的任何一个或多个元件、一个或多个限制的情况下适当地实践本文说明性地描述的实施方案。因此,例如,在本文的每种情况下,术语“包含”、“基本上由...组成”和“由...组成”中的任何一个都可以用另外两个术语中的任一个代替,同时保留它们的普通含义。已经采用的术语和表达用作描述性术语,而不是限制性的,并且不意图在使用这样的术语和表达时排除所示出和描述的特征或其部分的任何等同形式,而是应当认识到,在所要求保护的本发明的范围内可以进行各种修改。因此,应当理解,尽管已经通过实施方案具体公开了本发明,但是本领域技术人员可以采用本文所公开的概念的可选特征、修改和变化,并且这种修改和变化被认为在说明书和所附权利要求书所限定的本发明范围之内。
每当在说明书中给出一个范围时,例如温度范围、时间范围、或组成或浓度范围,所有的中间范围和子范围以及包括在给定范围内的所有单个数值都意欲包括在本公开中。将理解,本文的描述中包括的范围或子范围内的任何子范围或单个值可以从本文的方面中排除。将理解,本文描述中包括的任何要素或步骤可以从要求保护的组合物或方法中排除。
另外,在根据马库什组或其他替代组来描述本发明的特征或方面的情况下,本领域技术人员将认识到,由此也根据马库什组或其他组的任何单个成员或成员的子组描述了本发明。
尽管已经相对于本公开的特定实施例描述了本公开,但是对于本领域技术人员而言,许多其他变型和修改以及其他用途将变得显而易见。因此,优选的是,本公开不受本文的具体公开限制,而仅由所附权利要求书限制。
- 金属化石墨烯纤维的制造方法和生物电子应用
- 使用石墨烯的电子器件、该使用石墨烯的电子器件的制造方法以及具备该使用石墨烯的电子器件的电磁波检测器
