基于核酸的条形码
文献发布时间:2023-06-19 12:25:57
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求2018年11月1日递交的第62/754,450号美国临时申请的权益,其内容通过引用整体并入本文中。
政府资助
本申请根据海军研究办公室(Office of Naval Research)授予的第N00014-16-1-2410号合同和国家科学基金会(National Science Foundation)授予的第CCF-1317291号基金,在政府支助下进行。政府享有本发明的某些权益。
技术领域
本公开涉及核酸条形码的组合物和方法。
背景技术
考虑到它们可以保存的惊人信息密度和长期稳定性,人们已经提出将核酸作为长期数据存储的有希望的底物[1]。在本文中,提出了一种快速的、光指导的核酸数据条形码的串接方法。这种光指导的核酸数据写入方法与水性介质(例如水)兼容并可以在其中进行。然后可以在各种形式的水性介质,包括可压缩的水凝胶上打印核酸数据条形码,所述水性介质可以用核酸编码数据模式化以减少信息所占据的物理空间,从而增加材料的信息密度。收缩且经常脱水的水凝胶在重新水化和膨胀以读取其中存储的数据之前,可以保存很长时间。这种用于物理数据压缩的经济高效的方法有可能大大超过传统数据存储解决方案(例如蓝光光碟)的信息密度,并且代表了一种新型的核酸编码数据存储。
以字节/克计,核酸,例如DNA具有一些最高的体积数据密度,理论上最大达到~455艾字节/克[2]。然而,核酸合成的速度和成本均缓慢且昂贵,这在历史上一直禁止将核酸用作可行的数据存储方法。为了减轻这些问题,本文描述了旨在仅使用核酸、光反应性元件和光来合成核酸数据条形码串联体的核酸数据存储方法。这些方法是没有酶的,并且与水性介质兼容,因此可以实现核酸条形码的合成,而无需在常规的核酸化学合成中常用的专用的和有毒的化学物质,也无需使用昂贵的酶。作为通用数字数据存储平台,核酸数据存储将与许多行业相关。特别值得关注的是,这些策略在档案存储中很有用,其中核酸的低维护成本和长期稳定性将是人们所希望的。
发明概述
本公开的一些方面提供了写入数据的方法,包括:将包含两侧为一对杂交结构域的条形码的第一核酸与包含两侧为一对杂交结构域的条形码结构域(例如,DNA数据结构域)的第二核酸光交联;任选地还包括将第一或第二核酸与包含两侧为一对杂交结构域的条形码的至少一种另外的核酸光交联,其中每对的杂交结构域中的一个包含光反应性元件,并且其中每个条形码被分配独立的位值;以及产生条形码的串联体。
在另一个方面,本文提供了包括在具有编码数据的核酸的底物上或其内写入数据的方法。
在另一个方面,本文提供了包括读取编码在底物或可压缩的水凝胶上写入,任选地模式化的数据的核酸的方法。
在另一个方面,本文提供了包括压缩利用编码数据的核酸写入,任选地模式化的底物或可压缩的水凝胶的方法。
在另一个方面,本文提供了包括读取编码在底物上写入,任选地模式化的数据的核酸的方法。
在又一个方面,本文提供了条形码制作方法,包括:
a.将包含条形码和杂交结构域的第一核酸附接至底物上;
b.将第一核酸与包含两侧为一对杂交结构域的条形码结构域的第二核酸光交联;
其中每对的杂交结构域中的一个包含光反应性元件,
其中每个条形码被分配独立的位值;
并且其中所述光交联产生条形码的串联体。
在另一个方面,本文提供了通过本文所述的方法制作的有条形码的底物。
在另一个方面,本文提供了利用编码数据的核酸模式化的底物。
另外的方面提供了利用编码数据的核酸模式化的可压缩的水凝胶。
在另一个方面,本文提供了条形码组合物,其包含:
a.第一核酸,其包含两侧为一对杂交结构域的条形码结构域;
b.第二核酸,其包含两侧为一对杂交结构域的条形码结构域;
c.底物;
d.任选地,试剂,其中所述试剂允许将第一核酸附接至底物上;
e.任选地,至少一种另外的核酸,其包含两侧为一对杂交结构域的条形码结构域;
其中每个条形码结构域被分配独立的位值,
其中每种核酸的杂交结构域中的至少一个包含光反应性元件,
并且其中至少一种核酸在预定的位置处被固定至底物上。
在任何方面的一些实施方案中,条形码是DNA数据条形码。
在任何方面的一些实施方案中,光反应性元件是光反应性核苷酸。
在任何方面的一些实施方案中,光反应性核苷酸是CNVK或CNVD交联碱基。
在任何方面的一些实施方案中,使用350-400nm,任选地365nm的光波长进行光交联。
在任何方面的一些实施方案中,光反应性元件是补骨脂素(psoralen)。
在任何方面的一些实施方案中,第一和/或第二核酸的DNA数据条形码选自具有4的最小汉明距离的条形码文库。
在任何方面的一些实施方案中,在水性溶液中进行光交联。
在任何方面的一些实施方案中,方法是没有酶的。
在任何方面的一些实施方案中,每种核酸通过杂交结构域的单个光反应性元件与至少一种其他的核酸不可逆地共价连接。
在任何方面的一些实施方案中,每个条形码具有至少5个核苷酸,任选地5-10个核苷酸的长度。
在任何方面的一些实施方案中,第一和/或第二核酸被附接至底物上。
在任何方面的一些实施方案中,方法还包括根据本文提供的方法产生条形码的串联体,其中第一核酸与底物上的对接链连接。
在任何方面的一些实施方案中,条形码的串联体编码特定的信息和/或空间信息。在任何方面的一些实施方案中,特定的信息选自:文本、图像、坐标、图形、影像、测序数据、QR码、二进制代码和健康记录。
在任何方面的一些实施方案中,底物选自:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物、环烯烃共聚物、链霉亲和素、树脂和生物材料。在任何方面的一些实施方案中,生物材料选自:组织、细胞、类器官、改造的组织;和细胞外基质。在任何方面的一些实施方案中,底物选自玻璃、透明聚合物、聚苯乙烯和水凝胶。在任何方面的一些实施方案中,底物选自可压缩的水凝胶。
在任何方面的一些实施方案中,底物或可压缩的水凝胶包含水溶性聚合物或天然的聚合物。在任何方面的一些实施方案中,水溶性聚合物选自聚(丙烯酸)、聚(乙烯醇)、聚(乙烯吡咯烷酮)、聚(乙二醇)、聚丙烯酰胺和多糖类。在任何方面的一些实施方案中,天然的聚合物选自明胶、琼脂和胶原。
在任何方面的一些实施方案中,在底物上或其内写入数据包括将对接链连接或嵌入至底物上,任选地其中所述对接链被均匀地或随机地连接或嵌入至底物上,并且任选地其中所述对接链包含使得对接链能够共价连接至底物上的修饰,任选地丙烯酰胺基修饰。
在任何方面的一些实施方案中,方法还包括将底物或水凝胶压缩和任选地脱水。在任何方面的一些实施方案中,可压缩的底物或水凝胶被化学压缩,任选地通过向底物或水凝胶添加非水性溶剂或通过增加底物或水凝胶周围的总离子浓度,或者其中可压缩的底物或水凝胶被物理压缩。在任何方面的一些实施方案中,底物或水凝胶的尺寸被压缩至少一千倍、至少一百倍或至少十倍。在任何方面的一些实施方案中,方法还包括存储底物或水凝胶。
在任何方面的一些实施方案中,底物每立方厘米包含至少1拍字节的数据。在任何方面的一些实施方案中,以0.5-5微米,任选地1微米的分辨率写入数据。在任何方面的一些实施方案中,数据是数据模式,任选地,其中使用数字微镜器件在底物上将编码数据的核酸模式化。
在任何方面的一些实施方案中,第一核酸和/或第二核酸以预定的模式附接至底物上。在任何方面的一些实施方案中,核酸以预定的模式嵌入在底物上或其内。在任何方面的一些实施方案中,预定的模式是几何形状、方形、圆形或三角形。在任何方面的一些实施方案中,预定的模式包含重复元件。在任何方面的一些实施方案中,预定的模式是非对称的或对称的。在任何方面的一些实施方案中,预定的模式包含空间信息和/或特定的信息。在任何方面的一些实施方案中,第一核酸以0.25-100微米,任选地1微米的分辨率附接。
在任何方面的一些实施方案中,任选地在从底物切割核酸后,使用光学显微镜、电子显微镜、原子力显微镜、肉眼或核酸测序技术读取编码的数据。
附图的简要说明
图1A-图1E提供了利用DNA的光指导的数据写入的概览。图1A提供了示例性的条形码文库和核酸设计。显示了数个示例性的条形码序列。图1B显示了CNVK碱基修饰(左边的框)和描绘的胸腺嘧啶碱基(中间的框)之间的光指导的反应以产生交联的核酸(右边的框)。图1C显示了CNVK交联反应的卡通画。包含CNVK修饰(实心圆)的DNA链‘a’可以与互补的寡聚物‘a*’形成链间交联。图1D显示了光指导的串联体化的示意图。图1E显示了串联的DNA条形码的位顺序的数据重建的示意图。
图2A-图2C示出了用于在可压缩的水凝胶上存储核酸编码数据的示例性的方法。图2A显示在典型的情形下,首先在水凝胶底物上写入数据(写入),然后存储(存储)。在需要查看数据时,读取数据(读取)并且取决于模式化方法,可能另外还需要重置(重置)步骤,然后再次存储。图2B示出了在数据(模式)被应用(写入)之前可以如何膨胀小的水凝胶。在写入数据之后,重新压缩凝胶,然后以干燥的状态存储(存储)。图2C说明为了读取数据模式,通常必须将干燥的水凝胶再水化并膨胀,然后才能读取。在读取信息之后,可以再次将水凝胶重新压缩并干燥以进行进一步存储。
图3示出了使用CNVK修饰的链的示例性的光指导的写入、读取和重置操作。在其互补结构域内包含CNVK修饰的(写入)交联链(CNVK)与嵌入水凝胶中的对接链结合。然后,如果并且当复合物暴露至365nm的UV光时,在链之间形成共价的链间交联。这些交联的链足够稳定而幸免于洗涤条件(例如,低盐、高温、甲酰胺),并被认为是打开状态,对应于1的位值。未暴露至UV光的复合物未成为交联的并因而在洗涤步骤中解离。这些对接链被认为是关闭状态,对应于0的位值。打开状态的(读取)交联链可以结合荧光标记的核酸,后者能够与交联的核酸杂交,以允许使用荧光成像仪读取链。可以洗涤打开状态的(重置)交联链已去除杂交的核酸。
图4A-图4G示出了用于在一个区域(即,像素)中编码位的方法。图4A显示可以将对接链均匀地或随机地嵌入水凝胶中,并且如图3所示的写入/读取操作可用于将对接链的状态从关闭(0)改变为打开(1)。像素是定义的可以应用或可以不应用UV的水凝胶区域。图4B显示可以设计多条1和0交联位链,以进一步增加每像素的位含量。示出了每像素n=4位(4种颜色)所需的链的实例。图4C显示使用连续多轮的结合1位链、交联特定的像素、洗涤和结合0位链,可以组装代表多个位的串联体。示出了可以形成的4位像素串联体的3个实例。图4D示出了用于增加每像素位含量的另一策略,即使用多条正交的位链。图4E显示这些正交链可以与嵌入凝胶中的正交的对接链结合,并且通过连续的结合和洗涤步骤,可以特异性地结合每个像素(打开状态1)或不结合(关闭状态0)。在该示意图中,显示了3种可能的4位像素配置。图4F显示了条形码链,其设计为在已致密地嵌入表面中的同一结合结构域(x*)上杂交。图4G显示通过将结合反应动力学(例如,短时间、低条形码链浓度)编程,在交联时少部分的结合位点可被目标条形码链占据,使得可以将同一结合序列重复用于所有条形码序列。
图5A-图5B显示了利用数字微镜器件(DMDs)进行高通量像素模式化。图5A显示UV光源(365nm)可以通过DMD或光刻掩膜以仅照亮其框架内的特定像素,从而仅交联那些特定像素内的链。图5B显示可以以多路复用形式将多个框架模式化,从而产生更大规模的模式。
图6示出了利用条形码串联体的编码策略。通过DMD照亮的每个像素都包含长度多达30-40单位的DNA数据条形码串联体。
图7示出了利用组合的条形码增加数据密度的示意图。在组合的编码方案中,关于条形码序列分布的定量信息可以用于基于序列预期的相对频率将真实的数据串去卷积。
图8示出了用于拷贝和检索条形码信息的示例性的方法。DNA数据条形码集显示在左边,其包含交替的杂交结构域(实线)、条形码序列(虚线)和光反应性元件(实心圆)。在光指导的串联体化期间(右上图),每个DNA数据条形码将重复地杂交而形成长链串联体。可以通过利用缺口填充聚合酶、连接和交联的逆转填充缺口来存取条形码(右下图)。
图9A-图9C示出了固体表面上DNA的DMD模式化的实验性验证。图9A显示了具有包含CNVK修饰(圆形)的序列的链,其在暴露至UV光后能够与杂交的链交联。图9B显示了已经利用BSA-生物素、链霉亲和素和生物素化的序列a*功能化的载玻片的表面。然后荧光团标记的CNVK序列与这些对接序列结合,并使用DMD暴露至405nm光,以提供棋盘状的照明模式。图9C显示了利用Typhoon荧光扫描仪在荧光通道中成像后所得的载玻片上的棋盘状模式。
图10A-图10D示出了可压缩的水凝胶上的DMD模式化的实验验证。图10A显示了具有序列a的链包含CNVK修饰(圆形),其能够在暴露至UV光后与杂交的链交联。图10B显示了包含对接链(序列a*)的可压缩的水凝胶,所述对接链(序列a*)经丙烯酰胺基修饰并聚合在凝胶中。在与交联链结合后,DMD被用于照亮凝胶上的棋盘状模式。图10C显示可以使用一系列条件(例如低盐、乙醇孵育)将水凝胶物理压缩。图10D显示了物理压缩之前和之后的并排水凝胶荧光图像。通过压缩过程维持基于DNA的棋盘状模式。
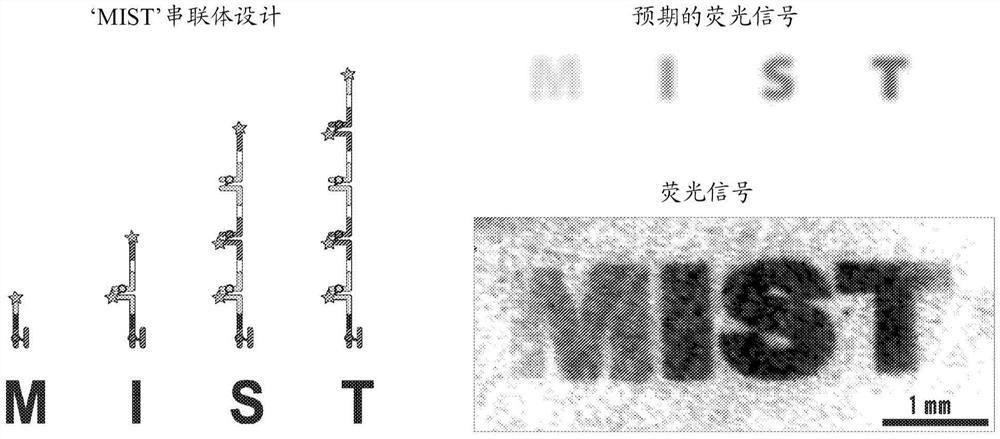
图11示出了使用与DMD相关的串联化的DNA在载玻片上拼写出字母’MIST’的条形码实验。
图12显示了具有显示1微米大小特征的荧光交联链的玻璃表面上的模式化的交联。利用1秒UV脉冲进行交联。然后利用40x物镜在TRITC通道中扫描载玻片。
图13示出了载玻片上光图案化(photopatterning)的像素水平的空间控制。(左图)用于DMD光掩模的位图(600X 680),白色的像素翻转DMD‘打开’中相应的微镜,并且对于黑色的像素反之亦然。(右图)在载玻片上将荧光交联剂链的交联进行1秒。通过10x物镜(~1um特征尺寸)将交联空间模式聚焦到载玻片上,然后利用40x物镜在TRITC通道中进行扫描。
发明详述
通常,本文提供的方法部分是基于允许核酸的高通量串联体化和产生具有空间信息和/或数据的组合序列的方法和组合物的发现。本文所述的方法和组合物可用于许多应用中,如分子编码、数据存储、组织工程、通信和生物传感器。
如本文所用,术语“条形码链”通常是指长度为5-10个核苷酸且编码数据的单链核酸。在一些实施方案中,条形码链长度为5、6、7、8、9或10个核苷酸。在一些实施方案中,条形码链长度可以多于10个核苷酸。在一些实施方案中,条形码链可被分配0或1的位值。在一些实施方案中,可以使用核酸测序技术读取条形码链。在一些实施方案中,可以通过使用利用可检测部分标记的互补序列确定条形码链的序列,如荧光团、量子点、肽标签、珠子(例如,琼脂糖、乳胶、磁电机响应性的(magnetoresponsive)、彩色的)、聚合物点、纳米粒子、另外的对接位点、标签如生物素,或者官能团,使得可以例如通过荧光显微镜、荧光扫描仪、光学扫描仪等检测其存在。
如本文所用,术语“互补”通常是指两组核酸之间发生杂交配对或结合相互作用的可能性。互补核酸能够根据经典的沃森-克里克碱基配对和非沃森-克里克碱基配对(例如,Wobble碱基配对和Hoogsteen碱基配对),通过氢键配对与彼此结合。在一些实施方案中,两组核酸可能与彼此100%互补。在其他实施方案中,两组核酸可以包含1、2、3、4、5、6、7、8、9、10或更多个不互补的核苷酸。在其他实施方案中,两组核酸可以至少50%、至少60%、至少70%、至少80%或至少90%互补。在一些实施方案中,两组核酸互补,只要它们能够形成稳定的或瞬时的复合物。如本文所用,术语“互补链”通常是指长度为200个核苷酸或更少核苷酸的单链核酸。在一些实施方案中,互补链长度可以为5-100、5-75、5-50、5-25、5-15或5-10个核苷酸。在一些实施方案中,互补链长度可以为10-100、10-50、10-25、10-20、15-25或15-25个核苷酸。在一些实施方案中,互补链长度可以为7个核苷酸。在一些实施方案中,互补链包含至少一个可检测的部分。在一些实施方案中,可检测的部分可以是荧光团或纳米粒子。在一些实施方案中,互补链与交联链互补,任选地其中交联链是第一核酸条形码的组件,并且互补链是第二核酸条形码的组件。在一些实施方案中,交联链是DNA或RNA。
如本文所用,术语“可压缩的水凝胶”、“水凝胶”和“核酸编码的水凝胶”可互换使用,并且通常是指能够在其结构内保留相当大部分的水而没有溶解于水性溶液中的任何聚合材料。可压缩的水凝胶可以是通过一种或多种单体的反应产生的任何聚合材料,取决于其周围环境,其能够以压缩状态和膨胀状态存在。此外,可压缩的水凝胶能够用核酸模式进行编码。
如本文所用,术语“交联链”通常是指长度为200个核苷酸或更少核苷酸的单链核酸。在一些实施方案中,交联链长度可以为5-100、5-75、5-50、5-25、5-15或5-10个核苷酸。在一些实施方案中,交联链长度可以为10-100、10-50、10-25、10-20、15-25或15-25个核苷酸。在一些实施方案中,交联链长度可以为7个核苷酸。在一些实施方案中,交联链包含至少一个光反应性核苷酸。在一些实施方案中,交联链包含至少一个CNVK或CNVD核苷酸。在一些实施方案中,交联链与互补链互补,任选地其中交联链是第一核酸条形码的组件,并且互补链是第二核酸条形码的组件。在一些实施方案中,交联链是DNA或RNA。在一些实施方案中,交联链利用诸如荧光团、量子点、生物素、链霉亲和素、功能化学基团和其他标签或纳米粒子的部分进一步功能化。
如本文所用,术语“对接链”通常是指长度为200个核苷酸或更少核苷酸,并与可压缩的水凝胶关联,例如结合的单链核酸。在一些实施方案中,对接链包含官能团,例如丙烯酰胺基修饰,其使得对接链能够共价附接或连接至水凝胶上。对接链可以包含与交联链的互补结构域互补的对接位点。在一些实施方案中,对接链为100个核苷酸或更少核苷酸。在一些实施方案中,对接链为50个核苷酸或更少核苷酸。在一些实施方案中,对接链与成像器链结合。在一些实施方案中,对接链是DNA或RNA。在一些实施方案中,对接链可以附接至表面如玻璃、聚苯乙烯、纸或硅上。在一些实施方案中,对接链包含生物素或链霉亲和素修饰以介导其与表面的结合。在一些实施方案中,对接链可以缀合或以其他方式结合至磁粒子、金纳米粒子、玻璃珠、链霉亲和素珠子、链霉亲和素树脂、抗体、硝化纤维膜、纸、玻璃纤维膜或任何固体支撑柱上。
如本文所用,“附接核酸链”是指任何核酸,其允许本文所述的核酸结合、交联、嵌入或拴系至本文所述的底物上、与本文所述的底物共价或非共价相互作用。在一些实施方案中,附接核酸链包含条形码结构域和杂交结构域,其中杂交结构域任选地包含光反应性元件。在一些实施方案中,附接核酸链与第一核酸的至少一部分基本上互补。
如本文所用,术语“杂交结构域”通常是指交联链或互补结构域。在一些实施方案中,杂交结构域是交联链,如本文中定义的。在一些实施方案中,杂交结构域是互补链,如本文中定义的。在一些实施方案中,两个交替的杂交结构域是指单个交联链和单个互补链。
如本文所用,术语“核酸条形码”通常是指单链核酸,其包含以下中的至少两种:交联链、条形码链和/或互补链。如果核酸条形码包含条形码链,则其包括包含在其相关的条形码链内的数据。在一些实施方案中,可以将一系列核酸条形码,例如至少3个核酸条形码写入在核酸串联体中。在一些实施方案中,可以在底物支撑物,例如可压缩的水凝胶上将核酸条形码或一组核酸条形码模式化。在一些实施方案中,核酸条形码长度可以为至少15、20、25、30、40、50、60、70、80、90或100个核苷酸。在一些实施方案中,核酸条形码长度为20个核苷酸。在一些实施方案中,核酸条形码包含长度为6个核苷酸的条形码链、长度为7个核苷酸的交联链和长度为7个核苷酸的互补链。核酸条形码通常包含以下结构域结构,其在5’-3’方向上为:5’-交联链-至-条形码链-至-互补链。
如本文所用,术语“条形码结构域”或“DNA数据结构域”是指包含代表特定的信息、任意值或代码的核酸序列的条形码链部分。可以通过条形码文库预先确定条形码结构域序列。条形码结构域可以是包含DNA、RNA、合成的核碱基或以上的任意组合的序列。
如本文所用,术语“条形码文库”是存储的具有相关信息的核酸序列的集合。每个序列和相关信息存储在具有诸如序列、模式、结构和标记的信息的数据库中。条形码文库可用于解译或读取每个条形码链中包含的特定信息。条形码文库也可用于预先确定数据存储的串联体模式、写入和读取串联体。
如本文所用,术语“核酸串联体”通常是指包含至少3个核酸条形码的核酸。核酸串联体可包含经由光反应性核苷酸与彼此共价连接的核酸条形码。在一些实施方案中,核酸串联体可包含至少1个、至少2个、至少3个、至少4个、至少5个或至少10个核酸条形码。在一些实施方案中,核酸串联体可包含至少1个、至少2个、至少3个、至少4个、至少5个或至少10个条形码链,其每个包含数据,例如,每个条形码链可被独特地/独立地分配位值。
如本文所用,术语“位值”是指可用于鉴定沿x、y和z坐标的位置的任意值;整数;符号;字符;或字母。在计算中,位编号是用于鉴定位位置的约定。位值可以是与二进制数字系统相关的二进制数字。二进制数字系统使用两个符号:零“0”和一“1”,它们代表位置符号。许多1和0可以串在一起来表示更大的数字。在本文提供的条形码的上下文中,位值被分配至条形码结构域,并可以使用条形码文库鉴定。位值可用于存储数据和特定的信息。例如,参见图4A-4G以及图6和图7。
如本文所用,术语“模式”通常是指任何可辨别地不同的图像、结构或设计。在一些实施方案中,模式是几何形状如方形、圆形或三角形。模式可包含重复元件。模式可包含任意元件。在一些实施方案中,模式是非对称的。在一些实施方案中,模式是对称的。模式可包含空间信息和/或特定的信息(例如,图像、像素、任意值和代码)。
如本文所用,术语“特定的信息”是可以存储于条形码中的任何数据或空间信息。特定信息的非限制性实例包括字母、数字、文本、坐标、图像、图形、影像、测序数据、QR码、二进制代码、密码和健康记录。
如本文所用,术语“空间信息”是生物组织或基质中的任何信息、坐标、标记,其可以存储于条形码中。空间信息可以告知本领域技术人员底物上特定的标记、条形码或模式位于何处。例如,空间信息在利用核酸条形码创建图像或QR码中可能会有用。在存在作为本文提供了标记的揭示试剂的情况下,空间信息在核酸探针的传感功能中也很有用。在本文提供的条形码揭示试剂存在的情况下,空间信息在传感核酸条形码的功能中也可能有用。
如本文所用,术语“试剂”是指合成或生物来源的任何底物、化学组分、化学分子。
如本文所用,术语“多”通常是指大于1的任何数字或值。多个可以是至少2个、至少3个、至少5个、至少10个、至少20个、至少25个、至少30个、至少40个、至少50个、至少100个、至少150个、至少200个、至少250个、至少300个、至少350个、至少400个、至少500个或至少1,000个。多种核酸如多种核酸staple链或多种SSTs可以包括至少2种、至少3种、至少5种、至少10种、至少20种、至少25种、至少30种、至少40种、至少50种、至少100种、至少150种、至少200种、至少250种、至少300种、至少350种、至少400种、至少500种或至少1,000种核酸。在一些实施方案中,多种核酸包括2-1000、5-1000、10-1000、50-1000、100-1000或500-1000种核酸。在一些实施方案中,多种核酸包括2-5000、5-5000、10-5000、50-5000、100-5000或500-5000种核酸。
利用核酸的光指导的数据写入
本文提供了用于条形码(例如,DNA数据条形码)的光指导的串联体化的方法(图1)。每条核酸条形码链长度可以为约5-10个碱基。在一些实施方案中,核酸条形码链长度可以为4、5、6、7、8、9或10个碱基。在一些实施方案中,核酸条形码链长度可以为约10个或约10-15个碱基。单个独特的条形码链可被分配‘0’或‘1’的位值。因此,串联的核酸条形码串可以等于一串0和1(即数字信息)(图1D、图1E)。
条形码链或条形码序列被设计用于强大的数据检索,任选地与不完美的测序装置一起使用。所示的示例性条形码文库具有4的最小汉明距离,这意味着在发生别名混叠之前,在发生条形码混叠之前测序装置一定制造了至少4个取代错误。还可以使用纠错码的其他变型,包括冗余序列、奇偶序列,或等效形式也可以合并到条形码序列(图1A)中。
核酸条形码的基本设计将包含两侧为一组两个交替的杂交结构域的条形码链(例如,约5-10个碱基长度)。这将允许通过重复的杂交、交联和洗涤步骤任意布置任何条形码(图1A)。在一些实施方案中,杂交结构域可以是交联链。在一些实施方案中,杂交结构域可以是互补链。在一些实施方案中,一组两个交替的杂交结构域可包含一条交联链和一条互补链。在一些实施方案中,核酸条形码包含与以下连接的条形码链:(i)交联链,其包含光激活的核苷酸,和(ii)互补链。在一些实施方案中,交替的杂交结构域长度可以为至少5个、至少10个、至少15个或至少20个碱基。在一些实施方案中,交替的杂交结构域包含的碱基足以提供与第二核酸条形码的杂交结构域杂交的能力。在一些实施方案中,一个核酸条形码的交联链将与另一个的互补链杂交。
可以通过光化学交联反应将核酸,例如DNA数据条形码串联和共价固定在一起。交联反应本身是光驱动的,并可以在水性溶液中进行。核酸条形码的交联链至少包含一个光反应性核碱基。在一些实施方案中,光反应性核碱基可以是能够在存在光的情况下与另一个核碱基形成交联的任何修饰的核碱基。在一些实施方案中,光反应性核碱基可以是修饰的嘧啶或嘌呤核碱基。在一些实施方案中,光反应性核碱基可以是3-氰基乙烯基咔唑亚磷酰胺(CNVK)或3-氰基乙烯基咔唑修饰的d-苏氨酸(CNVD)。在一些实施方案中,光反应性核碱基可以包含乙烯基、丙烯酸酯、N-羟基琥珀酰亚胺、胺、羧酸盐或巯基化学基团。在一些实施方案中,光反应性核碱基包含溴脱氧尿苷。利用位置临近互补链上的碱基的胸腺嘧啶(T)碱基,CNVK交联碱基显示最高的交联效率[10],并且可以本身直接并入DNA杂交结构域中作为碱基取代(图1B)。在一些实施方案中,使用365nm的光波长进行交联反应,并且可以在1秒内完成(图1C)。在一些实施方案中,可以使用任何可见光或紫外光波长进行交联反应。在一些实施方案中,可以在0.1、0.25、0.5、1、5或10秒内完成交联反应。在一些实施方案中,可以在0.5、1、5、10、20、30、40、50或60分钟内完成交联反应。在一些实施方案中,交联反应对临近光反应性核碱基的碱基具有可忽略不计的影响。在一些实施方案中,其他光化学核酸交联试剂,包括补骨脂素可与核酸条形码组合使用。
在一些实施方案中,CNVK标记的链可以在使得它们平均仅结合少于1秒、1-10秒或少于1分钟的盐和温度条件下,通过1-10个碱基或通过10-20个碱基与对接链杂交。在其他实施方案中,CNVK标记的链与对接链的结构域可以具有增加的同源性(20-40个碱基、多于40个碱基),可以增加盐或降低温度,从而使它们被认为是稳定结合的,因为它们平均保持结合的时间超过一分钟。通常,可以调整条件,以使CNVK标记的链与对接链具有所需的平均结合时间(t_结合=1/k_关闭)。
核酸条形码的串联体可包含至少2个、至少3个、至少4个、至少5个、至少10个、至少15个、至少20个、至少25个、至少30个或至少50个核酸条形码。
核酸条形码的串联体可以位于本文提供的底物上的任何位置中。例如,串联体可以是线型的,具有两种不同的定向,或不同方向上的多种定向。条形码可以沿x、y和z坐标空间定位。
在一些方面,本文描述了条形码组合物,其包含:
a.第一核酸,其包含两侧为一对杂交结构域的条形码结构域;
b.第二核酸,其包含两侧为一对杂交结构域的条形码结构域;
c.底物;
d.任选地,试剂,其中所述试剂允许第一核酸附接至底物上;
e.任选地,至少一种另外的核酸,其包含两侧为一对杂交结构域的条形码结构域;
其中每个条形码结构域被分配独立的条形码,
其中每种核酸的杂交结构域中的至少一个包含光反应性元件,
并且其中至少一种核酸在预定的位置处被固定至底物上。
在一些实施方案中,光反应性元件是光反应性核苷酸。在一些实施方案中,光反应性核苷酸是CNVK或CNVD交联碱基。在一些实施方案中,光反应性元件是补骨脂素。
在一些实施方案中,第一和/或第二核酸的条形码结构域选自具有4的最小汉明距离的条形码文库。
在一些实施方案中,至少一种核酸包含标记。在一些实施方案中,标记是荧光团。
在一些实施方案中,底物选自:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物、环烯烃共聚物、链霉亲和素、树脂和生物材料。在一些实施方案中,底物是可压缩的水凝胶。在一些实施方案中,生物材料选自:组织、细胞、类器官、改造的组织;和细胞外基质。
在一些实施方案中,条形码组合物还包含含有光反应性元件的核酸的串联体。
在一些实施方案中,核酸的串联体编码特定的信息和/或空间信息。
在一些实施方案中,特定的信息选自:文本、图像、坐标、图形、影像、测序数据、QR码、二进制代码和健康记录。
在一些实施方案中,核酸通过杂交结构域的单个光反应性元件与至少一种其他的核酸共价连接。
在一些实施方案中,每个条形码结构域包含至少5个核苷酸,任选地5-10个核苷酸。
在一些实施方案中,一种或多种核酸以预定的模式附接至底物上。在一些实施方案中,预定的模式是几何形状、方形、圆形或三角形。在一些实施方案中,预定的模式包含重复元件。
在一些实施方案中,预定的模式是非对称的或对称的。在一些实施方案中,预定的模式包含空间信息和/或特定的信息。在一些实施方案中,第一核酸以0.5-5微米,任选地1微米的分辨率附接。在一些实施方案中,第一核酸以0.25-100微米,任选地1微米的分辨率附接。
在一些实施方案中,用于将第一核酸附接至底物上的试剂是附接核酸链;并且其中附接核酸链与第一核酸的至少一部分基本上互补。
在一些实施方案中,用于将第一核酸附接至底物上的试剂是附接核酸链,其包含条形码结构域和杂交结构域,其中杂交结构域任选地包含光反应性元件。
底物
可将核酸条形码或核酸条形码的串联体应用于任何底物表面上,而无需专门的表面处理,如在微阵列芯片中常见的微孔形成。表面仅需要利用核酸链进行功能化,这些核酸链将作为新生链条形码串联体的初始对接链。可选地,核酸可以与底物形成非共价的相互作用。
如本文所用,术语“底物”或“底物表面”互换使用以描述这样的结构,一个或多个本文提供的核酸条形码或核酸条形码的串联体可以在其上显示或接触,以用于接触另外的核酸和/或标记。本文提供的核酸条形码可缀合至底物表面上。
如本文所用,术语“缀合至”包括通过共价结合将核酸与底物表面、相变试剂或亲和力对的成员缔合,包括但不限于经由交联试剂交联,或通过在使用缀合物的条件下保持的强非共价相互作用交联。
如本文所用,术语“杂交”是指单链核酸或其区域与另一单链核酸或其区域(分子间杂交)或与同一核酸的另一单链区域(分子内杂交)形成氢键结合的碱基对相互作用的现象。杂交受相关碱基序列的控制,其中互补核碱基形成氢键,并且任何杂合体的稳定性均由碱基对的性质(例如,G:C碱基对强于A:T碱基对)和连续碱基对的数量决定,其中较长的互补碱基延伸形成更稳定的杂合体。例如,对接链与包含光反应性核碱基,例如CNVK碱基的核酸条形码之间的杂交允许存储在底物表面上的数据的光指导的读取和/或可视化。
本文提供的底物表面可以以下形式存在:生物材料(例如细胞、组织或其片段)、平台、柱子、过滤器或薄片、盘、微流体捕获装置、毛细管、电化学响应平台、支架、管筒、树脂、基质、珠子、相变试剂或本领域已知的另一种底物表面。可以使用多种表面类型。底物表面的非限制性实例包括:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金纳米珠子或粒子、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物或环烯烃共聚物、链霉亲和素、Sepharose
在一些实施方案中,底物可以是玻璃或聚合物表面。在一些实施方案中,底物是可压缩的水凝胶。
在一些实施方案中,生物材料选自:组织、细胞、类器官、改造的组织;以及细胞外基质。
在一些实施方案中,核酸条形码或核酸条形码的串联体可应用于或嵌入可压缩的水凝胶中。在一些实施方案中,核酸条形码或核酸条形码的串联体代表特定的信息,例如数字数据,并可以存储任何信息,包括但不限于:文本、图像、图形、影像、测序数据和/或健康记录。在一些实施方案中,核酸条形码或核酸条形码的串联体代表空间信息。
用核酸链将这些底物表面功能化的方法在本领域中是已知的,并且需要很少的材料要求和最少的制备时间。典型的制剂首先涉及用牛血清白蛋白-生物素(BSA-生物素)钝化表面。BSA与玻璃表面非特异性结合。其次,链霉亲和素蛋白将与BSA蛋白上附接的生物素结合。最后,可以引入生物素标记的核酸以与链霉亲和素蛋白上的其他可用结合位点结合,从而完成玻璃表面的功能化。
利用初始核酸对接链(图3,蓝色链)功能化底物表面将因表面类型而不同。玻璃表面的功能化如上所述。对于底物表面,可以在聚合步骤中将对接链自身直接合并到底物或水凝胶基质中。丙烯酰胺基修饰的核酸链可与底物或水凝胶材料混合,并与底物或水凝胶材料一起聚合。
在一些实施方案中,可以将诸如分子、无细胞反应、细胞、组织切片、类器官和生物体的生物材料固定在本文所述的底物上。可以利用已知的空间条形码配置将有条形码的表面和底物预先模式化。有条形码的表面可以用作生物材料的空间条形码的网格。底物可以用作生物样品中各种靶标,包括基因组靶标和核糖核酸靶标的对接位点。有条形码的底物上的对接位点可以带有官能团,包括化学或蛋白质标签,其可以用于结合生物材料中的蛋白质、代谢物或其他靶标。任选地,可以使用化学、酶促或光化学方法从表面上切下有条形码的底物上的核酸条形码,并通过扩散或电泳、力谱或磁场将其转移到生物材料中,同时保留整个条形码模式。
可压缩的水凝胶
可压缩的水凝胶是三维(3D)聚合物网络,其包含高含水量(高达水凝胶质量的99%)[3]。这给予了水凝胶响应聚合物网络中的水量而显著膨胀和压缩(>10倍体积)的能力,而水量可经由环境刺激如离子强度、pH温度、光、电场和磁场、溶剂组合物和压力进行调节。水凝胶已广泛用于生物医学(例如,在药物输送、隐形眼镜、组织工程、生物传感、光动力疗法中)、微技术(例如,在致动器、超级电容器中)、工业和显微镜[4]。
水凝胶的大小可以基于各种环境条件进行调节,如盐浓度、溶质浓度、温度、pH值和核酸的存在[5]、[6]。已经证明,将特征嵌入水凝胶中允许将目标特征之间的距离从衍射极限以下膨胀到其上,从而可以通过物理膨胀凝胶实现超分辨率成像[7]。可压缩的水凝胶的关键特征在于,水凝胶的压缩和膨胀可以各向同性地获得,从而无论水凝胶的大小如何,特征都可以与彼此保持其相对的空间距离。此外,根据所用水凝胶的应用或可视化读出,水凝胶可以容易地塑膜、模式化或成形为任何形状、大小或形式。本文提供的水凝胶可以是多维的(例如,2D、3D或可膨胀的(4D))水凝胶。参见,例如,McCracken,J.et al.2016.“Programming Mechanical and Physicochemical Properties of 3D HydrogelCellular Microcultures via Direct Ink Writing.”Advanced Healthcare Materials5:1025–1039;Gladman,et al.2016.“Biomimetic 4D Printing.”Nature Materials 15:413-419;Ramon-Azcon et al.Lab on a Chip(2012);第9,410,267B2号美国申请;和第8.999,378B2号美国专利;其通过引用整体并入本文中。
也可以在许多其他材料(例如,聚合物、玻璃或塑料)的表面上固化水凝胶。例如,在本领域中已知水凝胶可用作生物学模式化的支架,如模拟体内微环境的3D类器官和层状组织的发展。预期本文提供的核酸可以嵌入任何类型的水凝胶中,或者可以为任何形式或模式的生物核酸,包括改造的基质和生物组织或细胞排列。本文提供的核酸可用于构建改造的组织或类器官内的细胞-细胞相互作用。
使用本领域已知的方法,水凝胶模式可以是使用本领域已知的方法(例如,纳米成型、微成型、微接触印刷、注射成型、掩膜技术、光刻法、固化、无掩膜的模式化、光敏水凝胶模式化、3D打印、旋转喷射纺丝等)改造的任何预先确定的模式形式。模式可以是各向同性的或各向异性的。模式可以是线、圆形、管、球、纤维、字母、数字、点、多边形、正方形、基质条形码(例如QR码)、二进制代码或本领域已知的任何其他模式的形式。模式可以是允许可视化或读取模式的任何大小、形状或形式。
水凝胶可以具有可能不同的物理性质,例如弹性模量或孔隙率。水凝胶可以是多孔的或无孔的。改变水凝胶的物理性质,例如弹性模量的方法在本领域中是已知的,并且可以根据所使用的溶质的浓度、温度、压力、固化程序、所使用的水性溶液的类型或溶质的混合物,和在水性溶液中的孵育时间而变化。
可压缩的水凝胶,也被称为可膨胀水凝胶,最近已用于显微分析,以通过物理方式扩大嵌入样品的尺寸,以便改善分子污渍的分离,从而获得更高的分辨率[7]。对于这些应用,通过在低盐或无盐溶液的存在下吸收水,证明了丙烯酸酯-丙烯酰胺共聚合物水凝胶的4-5倍线性膨胀。膨胀的水凝胶可以重新嵌入另一可膨胀的凝胶中,并再次膨胀,以实现<20倍的线性膨胀[8]。可选地,与丙烯酸钠(SA)交联的N,N-二甲基丙烯酰胺酸(DMAA)已被用于产生可膨胀的凝胶基质,其可以在单一步骤中经受10倍的线性膨胀[9]。这些凝胶可以类似地通过脱水各向同性地压缩。这可以通过使用具有高盐浓度的溶液或通过用其他液体如乙醇或有机溶剂代替水来实现。
水凝胶可以由几种不同的材料形成,包括水溶性聚合物如聚(丙烯酸)、聚(乙烯醇)、聚(乙烯吡咯烷酮)、聚(乙二醇)、聚丙烯酰胺和多糖类。可选地,可以利用天然的聚合物如明胶、琼脂、右旋糖酐或胶原。可以通过使用聚合引发剂的化学方法或通过辐射或热处理来进行交联。以膨胀形式,水凝胶可以承受较高的水含量(达到~99%的水)。
水凝胶可以是天然存在的、来源于天然来源的,或来源于合成来源的。水凝胶可以是通过一种或多种单体的反应产生的任何水溶胀和交联的聚合材料。水凝胶可以是能够膨胀以在其结构内保留很大一部分水而不会溶解到水性溶液中的聚合材料。水凝胶也可以是任何可收缩的材料,例如热收缩塑料、粘弹性泡沫、记忆泡沫。
水凝胶可以来源于天然的单体分子(例如,糖胺聚糖)、亲水性材料(例如,甲基丙烯酸酯、电解质复合物、醋酸乙烯酯、丙烯酰胺)或天然的聚合材料(例如,肽、糖类)。其他合适的水凝胶组合物如2001年8月7日发布的第6,271,278号美国专利中所述,其标题为“具有快速溶胀、高机械强度和超吸收特性的水凝胶组合物和超多孔水凝胶组合物(Hydrogelcomposites and superporous hydrogel composites having fast swelling,highmechanical strength,and superabsorbent properties)”。水凝胶可以由疏水性和/或亲水性材料组成,其中疏水性材料不物理吸水,并且亲水性材料物理吸水。
在一些实施方案中,水凝胶可以是基于同聚物的水凝胶,其中水凝胶来源于单一单体物质或分子。在一些实施方案中,水凝胶可以是基于共聚物的水凝胶,其中水凝胶来源于两种或更多种不同的单体物质或分子。在一些实施方案中,基于共聚物的水凝胶以随机的、块状的或交替的配置,任选地沿一个单体的骨架排列。在一些实施方案中,水凝胶可以是贯穿基于聚合物的水凝胶的多聚物,其中水凝胶来源于至少两种不同的,任选地交联的聚合物亚单位。在一些实施方案中,贯穿基于聚合物的水凝胶的多聚物包含一种交联的聚合物亚单位和一种为非交联的聚合物亚单位的聚合物。
水凝胶可以是非结晶的、半结晶的或结晶的。水凝胶可以是共价交联的,也可以不是共价交联的。可以使用化学方法(例如化学交联)或物理方法(例如疏水性相互作用)合成水凝胶。水凝胶可以带中性电荷、带正电荷或带负电荷。在一些实施方案中,水凝胶包含带正电的基团和带负电的基团。在一些实施方案中,水凝胶可以是两性或两性离子的。
在一些实施方案中,可以将水凝胶预先浇铸到凝胶、模具或其他嵌入材料中,然后再进行核酸编码。在一些实施方案中,可以在进行核酸编码之后,将水凝胶浇铸到凝胶、模具或其他嵌入材料中。
可以使用外部刺激,如电场、磁场、压力、吸力和毛细作用,促进核酸或其他分子物质的合成、操纵和/或添加至水凝胶。本文提供的水凝胶可被改性以用作生物传感器(例如,监测疾病、利用受控的药物释放机制治疗疾病、隐形眼镜、皮肤或粘膜组织移植或微阵列疾病检测)。用于组织移植和细胞支架的水凝胶的改性是本领域已知的。
在一些实施方案中,微流体可用于合成、操纵或添加核酸或其他分子物质至水凝胶。
在一些实施方案中,水凝胶以压缩状态存在,其中水凝胶是完全压缩的或收缩的,并且水凝胶的水含量降低。在一些实施方案中,水凝胶以膨胀状态存在,其中水凝胶是完全膨胀的、扩大的或溶胀的,并且水凝胶的水含量增加。在一些实施方案中,水凝胶可以完全压缩和完全膨胀之间的中间状态存在。在一些实施方案中,水凝胶响应外部环境条件的变化而压缩或膨胀。在一些实施方案中,外部环境条件可以包括物理和化学条件,其中物理条件包括温度、电势、光、压力和声音,并且其中化学条件包括pH、溶剂组合物(例如水、有机溶剂量的变化)、离子强度和小分子溶质。
底物的数据压缩
本文中,底物或水凝胶的压缩和膨胀特性被用于物理压缩信息(图2A-图1C)。在如图2A中所示的典型的数据存储工作流中,首先在底物或可压缩的水凝胶上将数据写入或模式化(写入),然后存储(STORE)。随后,可以存取(读取)数据,并且可以任选地进行重置(重置)操作,然后可以再次存储数据。
嵌入核酸条形码的可压缩的水凝胶具有经由水凝胶的物理压缩实现高数据密度同时保留核酸条形码的空间信息的优势。在先前发布的核酸数据存储形式中,在核酸中编码的数据通常为数千个非连续的DNA寡聚物链的形式,使得必须在每条DNA链中包含空间条形码数据以重构位顺序,从而降低总的数据存储密度[12]。
通常,首先通过文献中先前描述的任何一种方法将水凝胶进行各向同性膨胀(例如降低盐浓度),使得其可以用核酸编码,即,模式化,如图5A-图5B中所示。在写入和/或模式化后,可以使用与用于膨胀相反的方法(例如加盐)将水凝胶压缩回较小的尺寸。为了获得更稳定的存储,可以在存储之前将凝胶充分干燥。
为了读取写入的和/或模式化的底物或水凝胶上的数据(图2C),必要时通常将凝胶再水化,然后将其膨胀至可以将其解码(读取)的大小,然后必要时进行重置(重置)。此时,凝胶可以随后被重新压缩和干燥以用于进一步存储,如图2B的最后步骤中所示的。
由于制备底物或水凝胶所需的少量单体组件,数据压缩的这些方法是可扩展的,并且在其增加信息存储密度的能力中非常有效。通过物理压缩信息位所占用的空间量,信息密度可以大大降低。例如,如果方形水凝胶的所有面各被压缩10x,那么在2D下进行模式化时,这导致信息密度增加100x,或者在体积上进行模式化时导致信息密度增加1000x。例如,可以以1微米分辨率(特征尺寸)存储单个位,且面压缩为20x的模式化可以导致每50
可以复制、传输或编辑在底物或水凝胶上编码的核酸模式或核酸条形码系列。在一些实施方案中,模式或核酸条形码系列可被复制或转移到另一底物或水凝胶上。在其他实施方案中,模式或核酸条形码系列可被复制或转移到非水凝胶材料上。在一些实施方案中,可以使用化学方法或物理方法来复制、转移或编辑模式或核酸条形码系列,其中化学方法可能涉及酶的使用。
转移方法是本领域已知的,如电转移或扩散转移。参见例如,第4,840,714 A号和第8,173,002 B2号美国专利,其通过引用整体并入本文中。
例如,可以通过使用聚合酶将有条形码的模式转换为其互补条形码或在原处复制。也可以从底物化学、热或酶促释放出条形码或条形码副本。释放的链可以通过扩散或电泳、力谱、离心、毛细管流动或磁场转移到底物材料如水凝胶或生物材料中,同时保留整个模式。如果条形码是在水凝胶中构建的,则可以在压缩之前或之后进行此释放。
在转移过程之前,可以任选地固定有条形码的模式,以经由链通过桥接核酸或交联剂与彼此的共价附接来保护组织。这允许将相同的条形码模式重新用于多次模式传输。
在一些实施方案中,有条形码的模式可用于精密加工或作为用于蚀刻、掩膜和沉积其他材料的底物。
写入核酸编码的底物
可以利用能够在底物或水凝胶处于其膨胀形式同时将核酸空间模式化的任何写入技术来编码底物或可压缩的水凝胶。
示例性的写入技术涉及将对接链引入底物或水凝胶中,以用作设计模式的主要柄。对接链,通常是长度为200个核苷酸或更少核苷酸的单链核酸,可以结合并与交联链的互补结构域形成共价交联。可以通过将它们直接并入底物或水凝胶中而将多条对接链嵌入底物或水凝胶中,然后将底物或水凝胶物质浇铸到凝胶或模具中。可选地,可以编码多条对接链,例如以不同的方式在水凝胶上模式化(图4A)。对接链可以随机地或均匀地分布在整个底物或水凝胶中。在一些实施方案中,对接链可以随机地或均匀地穿过底物或水凝胶的部分或像素。在一些实施方案中,对接链的分布可以产生模式。在其他实施方案中,单独的对接链的分布将不会产生模式。多个对接链可以是多个具有相同序列的相同对接链。可选地,多个对接链可以包含2个、3个、4个、至少5个、至少10个、至少15个或至少20个具有独特序列的不同对接链。
如上文所述的核酸条形码随后可以通过对接链与核酸条形码的交联链的杂交附接至对接链上。随后暴露至光可允许在对接链和核酸条形码之间通过条形码的光反应性核碱基,例如CNVK碱基的反应性而形成链间连接。
也可以将数据写入成模式或形状,例如,嵌入水凝胶中,使得模式或形状可以编码信息。在一些实施方案中,可以写入核酸以便在另一模式或形状内显示模式或形状。
核酸模式可以是使用本文提供的方法改造的任何预定模式的形式。可选地,核酸模式可以是或然的(stochastic)或随机的(anisotropic)。用另一种方式表示,核酸模式可以是各向同性的或各向异性的。模式可以是线、圆形、管、球、纤维、字母、数字、点、多边形、正方形、基质条形码(例如QR码)、二进制代码或本领域已知的任何其他模式。模式可以是允许可视化或读取模式的任何大小、形状或形式。
交联链可设计为稳定结合或瞬时结合对接链。在一些实施方案中,交联链可共价或非共价结合对接链。在一些实施方案中,交联链可以与对接链互补。交联链可以与对接链具有至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的互补性。此外,交联链可与不同核酸条形码的互补结构域结合。在一些实施方案中,交联链可与包含其自己的交联链但不包含条形码链的核酸的互补结构域结合。
底物或水凝胶内的称为“像素”的特定大小的区域可用于写入和读取信息。包含许多相同的对接链的像素可能处于两种状态之一,即打开(位值1)或关闭(位值2)。通过使用多个位链,可以进一步增加单个像素的位含量(图4B)。在这种情况下,链被设计为具有互补的x/x*和y/y*,以便在连续多轮的结合和洗涤期间,它们可以形成串联体链(图4C)。例如,这可以通过以下方式进行:首先在对应于位置(颜色)0的1位链中引入,将它们与合适的像素交联,洗掉过量的1位,在对应于该颜色的0位链中流动,交联,依此类推,直到创建了与对接链交联的具有n位链的串联体。以这种方式,每个像素的位含量已增加到n。增加每个像素的位内含量的另一种方法是将多个正交序列(颜色)嵌入底物或水凝胶中,其中不同的位链与这些颜色中的每一个互补(图4D-图4E)。该过程可以类似于针对图4C所描述的过程,在图4C中,对应于每种颜色的位链被连续地引入,其间具有洗涤步骤,除了不需要0位外。
增加每个像素的位含量的另一种方法是将多个正交序列(颜色)嵌入底物或水凝胶中,其中不同的位链与这些颜色中的每一个互补(图4D-图4E)。相比简单的0相对于1、黑相对于白编码方案,通过为每个像素引入正交序列(即“颜色”)的多种不同的可能组合,可以大大提高每个像素的信息含量。在这种情况下,该程序类似于针对图4C所描述的程序,其中对应于每种颜色的位链连续地流入,其间具有洗涤步骤,除了不需要0位外。最后一种可能性是利用所有条形码链都可以结合于其上的相同的致密包被的序列结构域(x*)(图4F)。以这种方式,只需要嵌入一个序列,但是所有可能的条形码序列都可以杂交。通过控制反应动力学,以便在交联时只有一小部分的位点结合到1位目标条形码链上,留下剩余的位点以用于由其他1位链进行的将来多轮位编码。例如,如果采用4条条形码链,则在第一位交联时,小于或等于1/4的结合位点可能被占据,确保剩余的3/4可用于将来的结合。
可以从底物或水凝胶和/或它们对应的对接链上切下串联体链,以使其与底物或水凝胶一起悬浮在溶液中或与底物或水凝胶一起干燥。这种切割可以通过化学方法,例如使用酶,或通过物理方法进行。在一些实施方案中,串联体链的切割进一步增加了通过这些方法提供的信息密度。在一些实施方案中,可以使用已知的核酸测序方法,例如基于纳米孔的测序对切割的串联体链进行测序。
一种示例性的写入技术是基于使用UV光来指导核酸的交联。图3中描绘了用于写入、读取和重置操作的典型图。在写入操作中,两个结构域的交联链(蓝色-粉色)首先与对接链(蓝色)结合。交联链可在其互补结构域内包含CNVK碱基修饰,利用了序列特异性和光诱导性的核酸交联部分。CNVK已被证明可以高效且快速地交联(>90%,在~1秒内),从而有助于快速写入操作。在碱基配对的复合物暴露至365nm波长的UV光后,包含CNVK修饰(在互补结构域中)的交联链与对接链形成链间共价交联。未暴露至UV光的任何交联链/对接链复合物不形成共价交联。交联链针对严格的洗涤步骤(例如,低盐、高温、甲酰胺)具有鲁棒性,在洗涤后仅留下交联的结构在原处,并且其附接的互补链(粉色)为用户定义的模式。从信息理论角度,洗涤步骤后存在的互补链代表了单个信息位的写入,其中附接至底物或水凝胶上的交联复合物代表了1(打开)位,并且附接至底物或水凝胶上的裸露的对接链代表0(关闭)位。
通过使用数字微镜器件(DMDs),可以大大增加图3中描述的光指导的方法的通量,所述数字微镜器件(DMDs)包含微镜阵列,后者可被设置为不同的角度以允许(打开)或不允许(关闭)光通过。DMDs已用于创建投影仪显示器以及芯片上寡核苷酸的模式合成[13]。使用DMD,可以使框架的特定像素暴露至UV光(图5A),从而实现如同所述的像素特异性的交联。通过调整投影光的焦点,还可以调整像素大小。例如,使光通过具有更高放大倍数的物镜镜头使得能够实现1微米或更小像素特征尺寸(衍射限)。可以移动带有X*Y像素的DMD,或者可以移动样本本身,以使许多框架能够快速地模式化(图5B)。通过使用共焦显微镜中常见的光学切片功能,可以进一步将写入从2D扩展到3D。调整激光的Z焦点可以特异性地靶向,并且只在限定的XYZ对准或体素内使链交联。此外,可以利用旋转盘共聚焦显微镜对这一过程进行多路复用,以允许同时进行多个激光照射底物或水凝胶。
在一些实施方案中,可以使用基于照相和/或光的模式化将底物或水凝胶模式化。在一些实施方案中,可以通过使用光刻掩模、微镜或光刻将底物或水凝胶模式化。
在一些实施方案中,在膨胀状态时利用核酸编码底物或水凝胶。在一些实施方案中,在压缩状态时利用核酸编码底物或水凝胶。
编码策略
对于底物(例如,玻璃表面)上的数据写入和/或模式化,通常将复制并冻干条形码串联体,以使稳定性和存储密度最大化。然而,也将保留每个条形码的空间或位置信息,以允许随后重建数据,例如,成为连续的0和1或任意值串,或者模式化的条形码基质(例如,QR条形码)。为了保留复制后核酸条形码的空间信息,每个有条形码的串联体还将携带编码其原始空间位置的条形码序列(图6)。这不应被解释为限制性的,因为可以预期,在分析物存在的情况下,条形码可以包含感测功能。
在一些实施方案中,包含在单个条形码链内的数据可以由单个碱基编码,例如‘A’=0和‘G’=1。在一些实施方案中,多个碱基可以编码同一位标识符,例如‘A’和‘T’均可以编码0,而‘C’=1和‘G’均可编码1。在一些实施方案中,位可以由碱基的混合物编码,例如,在特定位置处2:1比例的A:T可以编码0,而3:1比例的A:T碱基可以编码1。在一些实施方案中,位可以由多重碱基编码,例如,‘ACTTAC’可以编码位0,且‘GCAGAT’可以编码位1。在一些实施方案中,多重碱基可以是2、3、4、5、6、7、8、9、10或至少15个碱基。这在序列读出的情况下是很有帮助的,因为条形码序列彼此之间有足够的差异,使得即使聚合酶产生的几个错误仍然可以映射回相同的条形码序列。在一些实施方案中,数据编码以位进行(碱基2系统)。在其他实施方案中,数据编码以三进制数位(碱基3系统)进行,其中包含任选地各自包含1-100个碱基的3个独特的条形码序列将编码3个三进制数位标识符中的每个。
在一些实施方案中,可以使用成像仪,例如荧光成像仪读取核酸条形码和/或模式化的核酸。在基于成像的数据读出(参见例如图4A)的情况下,如果存在条形码链编码1且不存在编码0,则大小为n的条形码文库可以编码2^n种可能组合。这允许使用至少1种、至少2种、至少3种、至少4种、至少5种或至少10种不同的序列,在每个像素中编码n位数据(参见图4B-图4G)。在一些实施方案中,编码链的部分(例如,1碱基的部分或百分比)也编码信息。在一些实施方案中,不同水平的成像仪链可被定量,例如,产生定量信号,其对应于不同的状态。例如,如果控制条形码序列A的照明使得在一些情况下其以33%的占有率存在并且在其他情况下其以66%的占有率存在,则条形码A现在有4种不同的状态:0%、33%、66%和100%,而非原来的两种可能的状态(0%或100%)。因此,每个条形码的编码位数翻了一番。可以通过定量显微镜读出状态,该显微镜可以确定信号电平,而不仅仅是信号电平是否存在。对于具有“n”种不同条形码序列的“g”种可能的差分信号电平状态,现在将有n*g种可能的组合,并因此每隔像素可以存储log_2(n*g)位。
在一些实施方案中,可以使用核酸测序技术,例如一代测序、深度测序或基于纳米孔的测序读取核酸条形码和/或模式化的核酸。
如本文所用,术语“核酸测序”是指鉴定给定核酸中的单个核碱基的方法。核酸测序的方法是本领域已知的,如cDNA和RNA测序、基于成像的方法,如NanoString,和使用PCR以及qPCR的多种多样的方法。参见例如,Sanger,F.et.al.,Proc.Natl.Acad.Sci.USA,74:5463-5467 1977;第6,025,136号和第6,018,041号、第7,473,767号美国专利;其通过引用整体并入本文中。
在一些实施方案中,方法还包括扩增核酸序列。如本文所用,术语“扩增”是指将核酸序列置于这样的条件下的步骤,其中如果反应的所有组分均完整,则足以允许扩增多核苷酸。扩增反应的组分包括例如引物、多核苷酸模板、聚合酶、核苷酸等。术语“扩增”通常是指靶核酸的“指数”增加。然而,如本文所用,“扩增”还可以指核酸的选择靶序列数量的线性增加,如利用循环测序获得的。扩增和合成核酸序列的方法是本领域已知的。例如,参见第7,906.282号、第8,367,328号、第5,518,900号、第7,378,262号、第5,476,774号和第6,638,722号美国专利,其内容均通过引用整体并入本文中。
在一些实施方案中,扩增核酸序列包括聚合酶链式反应(PCR)。PCR对于本领域技术人员是众所周知的;参见,例如,第4,683,195号和第4,683,202号美国专利;和PCRProtocols:A Guide to Methods and Applications,Innis et al.,eds,1990,其内容均通过引用整体并入本文中。示例性的PCR反应条件通常包括两个或三个步骤循环。两个步骤循环具有变性步骤,然后是杂交/延伸步骤。三个步骤循环包括变性步骤,然后是杂交步骤,然后是单独的延伸步骤。
在使用基于测序的读出的情况下,可以利用条形码策略进行编码的可能坐标位置的总数将按BCn缩放,并且数据量将按n×log(BC)缩放,其中BC为条形码文库的大小,且n是串联体的数量。例如,考虑编码数据的2条形码文库(b0,b1),其中每个单独的条形码分配为位0或位1。可以利用单独的条形码文库进行地址编码。给出8条形码文库,典型DMD设备的所有坐标位置都可以用7串联体进行编码,从而提供87~2e6种可能的组合。因此,每个空间坐标可被分配独特的条形码序列标识符,其随后可通过测序读取。多字段的DMD写入事件也可以利用另外的地址条形码进行编码。如图6中所示,每个像素总共30个核酸条形码串联体可编码大约2.6GB的数据。另外的地址串联体将以指数方式增加存储的数据量。利用20个地址条形码和20个数据条形码串联体,该存储策略可存储多达1艾的数据。在一些实施方案中,条形码文库可以为任何可想象的大小,例如,2、3、4、5、6、7、8、9、10个、至少20个、至少25个或至少50个条形码文库。在一些实施方案中,可以存在任何可想象数量的地址条形码,例如,2、3、4、5、6、7、8、9、10个、至少20个、至少25个或至少50个地址条形码。
在一些实施方案中,DMD的每个像素将需要由30-40个单独的条形码链组成的核酸条形码,包括坐标位置的条形码链序列标识符和随后的数据本身。复制整个条形码序列将产生连续的DNA链,其可适合测序读出。对应于独特的空间坐标的条形码组合将被缝合在一起,以重构条形码(例如,DNA数据条形码)的位顺序。
编码延伸的其他策略是使用可能存在于每个可能的串联体位置处的条形码的组合和在测序阶段进行反卷积来鉴定编码的位数据。例如,如果控制使用DMD的条形码序列A的照明,以使得在一些情况下条形码以33%的占用率存在且在其他情况下其为66%的占用率,则条形码A现在存在四种可能状态:0%、33%、66%和100%,而不是原来的两种可能状态(0%或100%)。类似的策略也可以用于所有其他条形码和条形码的组合(例如,一个位置可能具有50%的条形码A、25%的条形码B和25%的条形码C)。以这种方式,具有BC种可能的条形码序列和不包括空状态(即0%交联的,例如20%、40%、60%、80%、100%将对应于5种状态)的g种可能的频率状态的策略现在将每位置编码log_2(BC多选g)位(而非默认的每像素log_2(BC)位。这等同于每像素log_2((BC+g-1)选g)位。例如,给出10个条形码序列和5个独特状态,每像素可以存储的像素数将为每循环每像素log_2(14选5)=10.97位,这将大约等同于相比简单的0相对于1写入方案,写入通量和数据密度更高的数量级(图7)。如果在进行测序之前必须先对序列进行扩增,则可以在引物上附加独特的分子标识符(UMIs),以确保排除单个串联体序列的重复读取。
另外,可以将辅助序列和序列编码多肽添加至条形码上。非限制性实例包括PCR引物、表面结合序列、中间互补结合结构域、分析物结合结构域、启动子、增强子、阻遏物、标记、标签或本领域已知的任何其他序列。
在某些实施方案中,单个核酸条形码的全长序列长度为20个碱基,其中条形码链包含6个核苷酸,并且两个侧翼的交替的杂交结构域中的每一个包含7个核苷酸。假设平均分子量为每碱基330道尔顿[4],这总计达到每6600道尔顿约1位,假设每个条形码编码单个信息位。
可以以对给定应用有用的任何形状或模式的形式存储本文提供的核酸条形码和/或对接链。明确定义的条形码模式可用于存储特定信息(例如,用于防伪或分子验证)。例如,序列的特定模式可以预先确定,并且可以在一种或多种分子条形码揭示试剂的存在下可视化或读取。本文提供的核酸条形码对于组合的分子验证系统也可能是有用的,从而使单独可寻址的区域(例如,像素)对应于不同的条形码。条形码链的多种组合可用于核酸序列的严格检测。
如本文所用,“条形码揭示试剂”是指在暴露或与本文提供的核酸接触时允许读取和/或可视化核酸条形码合成或生物来源的任何物质、化学成分、化学分子。条形码激活试剂充当存储组合的密钥或密码。条形码活化试剂可以是分析物、小分子、相变试剂、盐、代谢物、化合物、核酸、多肽或基因组编辑系统。可以将条形码活化试剂添加到底物或可压缩的水凝胶或水性溶液中,以诱导位标识符的交联。
在一些实施方案中,包含本文提供的核酸条形码的底物被暴露至条形码活化试剂。在一些实施方案中,包含本文提供的核酸条形码的底物未暴露至条形码揭示试剂。
仅通过实例的方式,可以经由互补或部分互补的核酸链的杂交或可以经由核酸链标记的任何分析物来执行本文提供的核酸的感测功能。可以在此背景下使用的核酸标签的非限制性实例包括亲和探针(抗体)、蛋白质/肽、纳米粒子、荧光团、FRET组件、间隔子、点击反应底物、金属标记,或者能够用本文所述方法(例如,光、荧光成像、荧光显微镜、电子显微镜、原子力显微镜、冷冻电子显微镜、照相机、电磁传感器、人肉眼、质谱、蛋白质印迹、凝胶电泳和其他检测器)检测的任何其他部分、修饰、化学间隔子、蛋白质、纳米抗体、适体、抗原和化学组合物。在某些实施方案中,互补链可以用作条形码揭示链或试剂,使得仅在存在所述条形码揭示链或试剂的情况下才揭示或能够感测编码的信息。这些试剂可以与它们的互补物瞬时或非瞬时结合,并且在某些实施方案中,多个链可以与空间拴系的互补链协同结合。模式化的感测可以帮助高度多路复用检测和/或定位要通过第二次测定检测的分析物。可以以荧光或比色读数的形式,或通过本文提供的或本领域已知的任何检测方法,来确认分析物的存在。
在本文提供的方法的其他实施方案中,来自本文提供的模式的信号可以被放大以提高条形码的可见性或可检测性。示例性的放大方法可以包括但不限于酪胺信号放大(TSA)和滚环放大(RCA)。可以想到,TSA或RCA可用于经由产生可感测和识别所需组合物的分析物的模式化的有条形码的表面而进行多价感测。例如,模式化的表面可用于识别同一分析物中的多个结构域或识别复合物的多个组分,如DNA纳米结构或寡核苷酸标记的的复合物。此外,经由创建可感测所需分子几何结构的分析物的模式化的有条形码的底物,可以将本文提供的条形码的感测功能用于几何感测。
在其他实施方案中,可以通过优先与核酸缔合或结合的分析物如嵌入染料(e.g.,Sybr Green
在一些实施方案中,其中模式特征低于光的衍射极限,例如已压缩的模式,可以首先对底物进行重新膨胀,然后再进行感测或可视化。在其他实施方案中,模式可用于将序列引导到所需位置上,以创建用于基于物理邻近性感测靶核酸链的平台。
在本文提供的方法的一些实施方案中,可以从其组装底物上离解、切割或移除条形码串联体。在该背景下,部分条形码序列可以包含有关底物上的位置或坐标的信息。仅通过实例的方式,这将包括以下内容:1)其中在底物上条形码序列物理组装的底物上,或2)其中在串联体编码的信息所述的较大数据集内。在后一种情况下,该位置信息可以用作在较大数据集的背景下串联体中编码的数据所位于的位置的“索引”。例如,0和1的位属于较大的数据串,其已被拆分以在许多串联体条形码中进行编码。作为另一个实例,索引可以包含关于整个全长数据串内编码的位串所属的位置的位置信息。因此,在已从底物去除串联体的情况下,其内编码的数据通常可以经由测序方法读取。
拷贝数据和长期存储
在一些实施方案中,酶,例如聚合酶可用于拷贝核酸条形码,例如在已在玻璃表面上形成条形码串联体时。拷贝的核酸条形码随后可被冻干并单独存储。一旦冻干,DNA即是稳定的,并且能够实现其最大体积密度,约艾字节/克。
核酸条形码可被存储任何合理的时间量。合理的时间量可以测量为小时、天、周、月、年或十年。在一些实施方案中,核酸条形码被存储至少1小时、至少6小时、至少12小时、至少18小时、至少24小时或至少36小时。在一些实施方案中,核酸条形码被存储至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少10天。在一些实施方案中,核酸条形码被存储1周、至少2周、至少3周或至少5周。在一些实施方案中,核酸条形码被存储至少1个月、至少2个月、至少3个月、至少6个月、至少9个月、至少15个月或至少18个月。在一些实施方案中,核酸条形码被存储至少1年、至少2年、至少3年、至少4年、至少5年、至少6年、至少7年、至少8年、至少9年或至少10年。在一些实施方案中,核酸条形码被存储至少10年、20年或至少30年。
在一些实施方案中,例如来自同一底物表面的单个样本的所有核酸条形码可存储在一起。在其他实施方案中,单个样本的核酸条形码可被存储在单独的位置中。在一些实施方案中,核酸条形码被存储在测试管、Eppendorf管或等同物中。在一些实施方案中,核酸条形码经由毛细管作用被存储在滤纸,例如Whatman滤纸上,并且可以在室温下干燥保存,或者通过表面与表面的接触转移至底物,例如可压缩的水凝胶上。
核酸条形码可在室温、低温或高温下存储。在一些实施方案中,低温是低于20℃、15℃、10℃、5℃、0℃、-10℃、-20℃、-50℃或-78℃的任何温度。在一些实施方案中,室温是5-35℃、10-30℃、15-30℃、15-25℃、20-25℃、约23℃或约20℃之间的任何温度。
可以使用市售的测序平台,包括二代测序或纳米孔测序进行读取由核酸条形码编码的数据。在一些实施方案中,为了避免核酸条形码的交联连接,每个核酸条形码可以杂交和交联,形成条形码序列自身的长链串联体和交替的杂交结构域。可以利用缺口填充聚合酶填充杂交复合物中的缺口,并连接在一起以形成一条完整的链。填充缺口后,可以利用305nm的光照射来反转交联的链[11],从而产生单拷贝的连续的DNA条形码序列。然后拷贝的连续的条形码序列可以适用于多种其他目的,包括测序,例如,通过附接携带可以用作聚合酶拷贝的位点的独特引物结合位点的DNA条形码(图8)。
存储核酸编码的底物
可以在写入和/或读取步骤之后,存储,即,保留或保持核酸编码的底物或水凝胶。在一些实施方案中,首先压缩底物或水凝胶,然后存储。底物或水凝胶的压缩可通过以下方法进行:通过降低底物或水凝胶周围的水浓度、通过增加非水性溶剂(例如有机溶剂)的浓度、通过增加总离子强度(例如,通过增加盐浓度)、通过改变温度(例如,降低温度)、通过改变底物或水凝胶的电势或磁势、通过改变底物或水凝胶上的压力(例如,增加压力)、改变底物或水凝胶周围环境的pH,以及其他可行的压缩方法。
在一些实施方案中,通过从底物或水凝胶周围环境去除水来压缩底物或水凝胶。在一些实施方案中,通过蒸发去除水。在一些实施方案中,去除了至少20%v:v、至少40%v:v、至少60%v:v、至少80%v:v或至少95%v:v总体积的水。
在一些实施方案中,通过增加底物或水凝胶周围环境中非水性溶剂的浓度来压缩底物或水凝胶。非水性溶剂可与水混合或不可与水混合。在一些实施方案中,非水性溶剂是有机溶剂如乙醇、甲醇、异丙醇、乙腈或己烷。在一些实施方案中,有机溶剂是乙醇。在一些实施方案中,通过包含至少20%v:v、至少40%v:v、至少60%v:v、至少80%v:v、至少95%v:v或100%v:v非水性溶剂的溶液压缩水凝胶。
在一些实施方案中,通过增加底物或水凝胶周围环境中的总离子浓度来压缩底物或水凝胶。在一些实施方案中,通过增加溶质浓度来增加总离子浓度。在一些实施方案中,溶质是盐,如氯化钠、氯化钾或磷酸盐。在一些实施方案中,通过将溶质浓度增加至至少5%w:v、至少10%w:v、至少20%w:v、至少40%w:v、至少60%w:v、至少80%w:v或至少95%w:v来压缩水凝胶。
在一些实施方案中,底物或水凝胶可被烘干(dried)或干燥(desiccated)。在一些实施方案中,使用真空干燥器、通过去除水或通过增加非水性溶剂的浓度来烘干或干燥底物或水凝胶。在一些实施方案中,压缩底物或水凝胶的方法也能够将底物或水凝胶干燥或脱水。
底物或压缩的水凝胶可被存储任何合理的时间量。合理的时间量可以测量为小时、天、周、月、年或十年。在一些实施方案中,底物或水凝胶被存储至少1小时、至少6小时、至少12小时、至少18小时、至少24小时或至少36小时。在一些实施方案中,底物或水凝胶被存储至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少10天。在一些实施方案中,底物或水凝胶被存储1周、至少2周、至少3周或至少5周。在一些实施方案中,底物或水凝胶被存储至少1个月、至少2个月、至少3个月、至少6个月、至少9个月、至少15个月或至少18个月。在一些实施方案中,底物或水凝胶被存储至少1年、至少2年、至少3年、至少4年、至少5年、至少6年、至少7年、至少8年、至少9年或至少10年。在一些实施方案中,底物或水凝胶被存储至少10年、20年或至少30年。
底物或水凝胶可存储在水性溶液(例如,基于水的)、非水性溶液(例如,有机溶剂,例如,乙醇)中或可以是完全干燥的(即不存在溶液或溶剂)。在一些实施方案中,底物或水凝胶可单独或与其他底物或水凝胶一起存储。在一些实施方案中,整个底物或水凝胶可存储在一起。在其他实施方案中,底物或水凝胶或其组分的一部分可存储在单独的位置。在一些实施方案中,底物或水凝胶存储在扁平的表面上。在一些实施方案中,底物或水凝胶存储在测试管、Eppendorf管或等同物中。在一些实施方案中,底物或水凝胶经由毛细管作用存储在滤纸,例如Whatman滤纸上,并且可以在室温下干燥保存。
底物或水凝胶可在室温、低温或高温下存储。在一些实施方案中,低温是低于20℃、15℃、10℃、5℃、0℃、-10℃、-20℃、-50℃或-78℃的任何温度。在一些实施方案中,室温是5-35℃、10-30℃、15-30℃、15-25℃、20-25℃、约23℃或约20℃之间的任何温度。
读取核酸编码的底物
在一些实施方案中,多种核酸能够与嵌入底物或可压缩的水凝胶内的核酸编码模式和/或核酸条形码结合。在一些实施方案中,多种核酸还可以包含可检测的部分,例如,荧光分子。在这些实施方案中,包含可检测的部分的多种核酸与核酸编码模式和/或核酸条形码的结合使得能够检测,即读取模式和/或条形码编码的信息。
在一些实施方案中,如上文所述,能够与核酸编码模式结合的核酸还包含可检测的部分。在一些实施方案中,可检测的部分是可以在将本文提供的条形码暴露至条形码活化试剂后进行检测的。在一些实施方案中,可检测的部分是可检测的,而无需暴露至条形码活化试剂。
如本文所用,“可检测的部分”或“标记”是指能够被检测的分子实体,例如,荧光团、比色染料、色素、光学活性试剂。可检测的部分可以与核酸共价连接或非共价连接。可以使用裸眼、显微镜、光片显微镜、荧光扫描仪、分光光度扫描仪、电子伏安计或任何其他检测方法来可视化可检测的部分。在一些实施方案中,可检测的部分是荧光团,例如有机荧光团或无机荧光团。在一些实施方案中,可检测的部分不是荧光。在一些实施方案中,可检测的部分不是荧光团。可以使用本领域已知的任何方法检测可检测的部分。检测方法的非限制性实例包括光成像、光学显微镜、荧光显微镜、原子力显微镜、
在一些实施方案中,可检测的部分未与核酸结合。在一些实施方案中,未与核酸结合的可检测的部分可以直接与核酸编码模式结合。在一些实施方案中,可检测的部分可以与核酸编码模式共价或非共价结合。在一些实施方案中,可检测的部分可以与核酸特异性地结合。在一些实施方案中,可检测的部分可以是Sybr Gold
荧光团是化学或分子实体,其吸收某些特征波长的电磁能,然后以其他特征波长发射电磁能。有机荧光团包括分子染料、荧光蛋白和固有的荧光团,通常包含芳族基团、带有几个π键的平面或环状分子。无机荧光团包括镧系元素和量子点,通常包含金属和/或纳米粒子。在文章提供的方法中,可以利用任何类别或家族的荧光团。用于所述方法的示例性的荧光团可以包括:Alexa Fluor 488(AF488)、Alexa Fluor 647(AF647)、德克萨斯红、荧光素、若丹明、香豆素、花青、俄勒冈绿、其他Alexa Fluor染料、曙红、丹磺酰基、prodan、蒽、蒽醌、级联蓝(cascade blue)、尼罗红、尼罗蓝、甲酚紫、吖啶橙、吖啶黄、结晶紫、孔雀绿、BODIPY、Atto、Tracy、磺基Cy染料、HiLyte Fluor,以及以上各种的衍生物。有用的荧光团的其他非限制性实例是本领域已知的(参见,例如Stockert,J.C和Blázquez-Castro,A.第3章Dyes and Fluorochromes,Fluorescence Microscopy in Life Sciences.2017,BenthamScience Publishers.第61-95页;Herman B.Absorption and emission maxima forcommon fluorophores,Curr.Protoc.Cell Biol.2001,附录1:附录1E.)。
在一些实施方案中,可检测的部分可以是蛋白质,例如荧光蛋白或酶。在一些实施方案中,用作可检测的部分的荧光蛋白可以是绿色荧光蛋白(GFP)、青色荧光蛋白或黄色荧光蛋白。荧光蛋白可以如Day,R.N.和Davidson,M.W.The fluorescent protein palette:tools for cellular imaging.Chem Soc Rev.2009Oct;38(10):2887–2921中所述。在一些实施方案中,用作可检测的部分的酶可以是过氧化物酶,例如辣根过氧化物酶。在一些实施方案中,过氧化物酶可以通过其氧化过氧化物酶底物的酶活性而使核酸编码模式可视化。示例性的过氧化物酶底物包括3'-二氨基联苯胺(DAB);3,3’,5,5’-四甲基联苯胺(TMB);2,2'-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS);鲁米诺;高香草酸;邻苯二胺(OPD);AmplexRed;和3-氨基-9-乙基咔唑(AEC)。
在一些实施方案中,可检测的部分是纳米粒子,例如重金属,例如,金纳米粒子。在一些实施方案中,可以使用显微镜,例如光学显微镜或原子力显微镜将纳米粒子可视化。
为了读取数据模式,互补(粉色)链的存在可被探测(读取,图3)。这可以例如,利用包含与互补链结合(例如,互补)的可检测的部分(例如,荧光分子)的核酸进行。包含可检测的部分的核酸将仅结合打开位(即,包含互补链的链),然后可以读取模式,例如,显微镜或其他荧光扫描仪上的荧光。
重置底物或水凝胶(重置)以便其可以返回至其原始的写入状态通常需要洗涤步骤,其去除包含可检测的部分的核酸并重新暴露任何互补链。在一些实施方案中,通过去除包含可检测的部分的多种核酸来重置底物或凝胶。在一些实施方案中,通过破坏底物或水凝胶的多种核酸与核酸编码模式之间的结合相互作用而临时去除包含可检测的部分的多种核酸。在一些实施方案中,可以通过将多种新的核酸条形码附接至串联体上来写入新的数据,预期较新的条形码相比串联体中更早写入的条形码占优。在一些实施方案中,在重置底物或水凝胶后底物(例如,水凝胶)可被压缩并任选地存储。
在一些实施方案中,拷贝串联体序列内的数据,并通过如本文提供的核酸测序读取拷贝。在一些实施方案中,串联体本身可被直接读取。对于具有单链条形码缺口的交替的链信息的串联体,可以在连接链以产生可识别的条形码记录(例如,通过二代测序方法鉴定的;也参见图8)之前利用聚合酶填充缺口。
重新写入核酸编码的底物
可以在任何步骤中从底物或水凝胶中永久去除或“擦除”底物或水凝胶的核酸编码模式,仅留下嵌入底物或水凝胶内的对接链。在一些实施方案中,在读取步骤之后从底物或水凝胶永久去除核酸编码模式。
在一些实施方案中,光诱导的交联可被逆转,从而永久去除模式。在一些实施方案中,CNVK交联在暴露至305nm UV光时可被逆转,去除交联的链,例如擦除先前写入进的数据。在一些实施方案中,重新暴露的对接链可被重复用于杂交携带相同或不同的互补链的新的交联链。在一些实施方案中,重复暴露的对接链可与一组新的有条形码的串联体链杂交,从而重新写入该对接链的数据内容。在一些实施方案中,可以使用与以前所用不同的光刻或DMD方法设计新的核酸编码模式。在一些实施方案中,可以同时擦除和重新写入数据的多个像素,例如通过使用DMD。
在一些实施方案中,可以使用酶促方法去除核酸编码模式。在一些实施方案中,酶可用于逆转对接链和交联链之间的交联。
其他实施方案
在一些实施方案中,可以在底物或可压缩的水凝胶的能够为增加数据存储密度的目的而被物理或化学压缩的任何合理的取代物上,将核酸条形码功能化和/或模式化。在一些实施方案中,底物或可压缩的水凝胶的合理的取代物可以是任何可收缩的材料,包括但不限于热收缩塑料和粘弹性泡沫(记忆泡沫)。
在一些实施方案中,主要的制备步骤,即底物表面与光指导的核酸数据写入相容所需的功能化是如本文提供的具有核酸对接链的表面的功能化。在一些实施方案中,可以通过使用包含至少一个单体单元的修饰的核酸,将对接链直接合并到聚合物网络,例如可压缩的水凝胶中,来进行功能化。在一些实施方案中,可以通过使用核酸与底物的非特异性相互作用的底物表面处理来进行功能化。
如本文提供的,可以通过存在一个结合的荧光团(编码1)或不存在荧光团(编码0)来检测核酸条形码。此外,在一些实施方案中,可以引入更多的可能状态,例如,存在两个结合的荧光团(编码2)。例如,当与一个结合的荧光团相比时,两个结合的荧光团将被解释为荧光信号的两倍。在一些实施方案中,可以修改用于光指导的核酸数据写入的方法,使得每个核酸可以经由DMD和光交联缀合至目标荧光材料上,并空间寻址到底物表面,例如玻璃或可压缩的水凝胶上。在这些实施方案中,可以使用记录每个荧光团的位置,例如,单分子荧光读数的高速相机读取数据。
在一些实施方案中,可以使用比色反应,例如3'-二氨基联苯胺(DAB)氧化或辣根过氧化物酶(HRP)的酶活性来读取或可视化核酸编码模式和/或条形码。在某些实施方案中,使用比色反应的读取或可视化可以被诱导在受限的空间位置中发生。
在一些实施方案中,可以利用核酸,任选地核酸条形码,使用任何物理或化学方法,或通过使用掩模和光刻的光模式化,将底物或可压缩的水凝胶模式化。由于DMD阵列内的>1e6个微镜提供了良好的空间控制,因此DMD可归类为“无掩模”光刻。在一些实施方案中,可以利用传统的“掩蔽”照明来实现与DMD可以提供的相同的空间照明特征,其中照明源是单个点源,并且其中预切掩模放置在光源前面以产生空间照明特征。
在一些实施方案中,底物或包括可压缩的水凝胶在内的水凝胶可以预先浇铸或之后浇铸在凝胶或其他嵌入材料中,其可以任选地包含不同的性质,例如对离子强度或温度的不同敏感性。例如,可以通过直接在预设的模具内聚合丙烯酰胺溶液而将水凝胶模塑或装配成特定形状。
在一些实施方案中,可以通过外部刺激,例如电场、磁场、压力、吸力、毛细作用、或脱水,促进组件,例如缓冲剂或核酸条形码流过可压缩的水凝胶。在一些实施方案中,电的使用可以加速核酸,例如核酸条形码或对接链向水凝胶内的运输。
在一些实施方案中,将从其所结合的底物表面去除或切割核酸。切割方案将根据所使用的底物表面而有所不同。例如,切割非共价结合到表面,例如玻璃表面上的链将通常需要温和的条件,例如温和的加热和/或甲酰胺。在一些实施方案中,从可压缩的表面,例如水凝胶或可收缩的塑料切割,可以使用温和的变性剂,例如氯化胍,以使可压缩的表面变性。在一些实施方案中,温和的变性剂可降解底物,仅将链保留在溶液中。
在一些实施方案中,与底物表面结合的对接链可包含核酸内切酶的同源结构域,从而在引入核酸内切酶后,串联体构建体从表面结合的对接链上切割出来。一些实施方案在对接序列中包括脱氧尿嘧啶碱基,使得其可以在引入USER酶后被切割。一些实施方案利用对接序列中的RNA碱基,使得RNA酶H家族酶可以用于消化RNA并从表面切割串联体构建体。
可以根据以下编号的段落中的任一个定义本文所述的方法和组合物的一些实施方案:
1)写入或存储数据的方法,包括:
将包含两侧为一对杂交结构域的条形码的第一核酸与包含两侧为一对杂交结构域的条形码结构域的第二核酸光交联;
任选地,还包括将第一或第二核酸与包含两侧为一对杂交结构域的条形码的至少一种另外的核酸光交联,
其中每一对的杂交结构域中的一个包含光反应性元件,并且其中每个条形码被分配独立的位值;以及
产生条形码的串联体。
2)段落1所述的方法,其中光反应性元件是光反应性核苷酸。
3)段落2所述的方法,其中光反应性核苷酸是CNVK或CNVD交联碱基。
4)段落1所述的方法,其中使用350-400nm,任选地365nm波长的光进行光交联。
5)段落1所述的方法,其中光反应性元件是补骨脂素。
6)段落1-5中任一项所述的方法,其中第一核酸和/或第二核酸的条形码选自具有4的最小汉明距离的条形码文库。
7)段落1-6中任一项所述的方法,其中在水性溶液中进行光交联。
8)段落1-7中任一项所述的方法,其中方法是没有酶的。
9)段落1-8中任一项所述的方法,其中第一核酸和/或第二核酸被附接至底物上。
10)段落9所述的方法,其中第一核酸和/或第二核酸被以预定的模式附接至底物上。
11)段落9所述的方法,其中底物选自:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物、环烯烃共聚物、链霉亲和素、树脂和生物材料。
12)段落9所述的方法,其中底物是可压缩的水凝胶。
13)段落11所述的方法,其中生物材料选自:组织、细胞、类器官和改造的组织;以及细胞外基质。
14)段落1-13中任一项所述的方法,其中条形码的串联体编码特定的信息和/或空间信息。
15)段落14所述的方法,其中特定的信息选自:文本、图像、坐标、图形、影像、测序数据、QR码、二进制代码和健康记录。
16)段落1-15中任一项所述的方法,其中每种核酸通过杂交结构域的单个光反应性元件与至少一种其他的核酸共价连接。
17)段落1-16中任一项所述的方法,其中每个条形码具有至少5个核苷酸,任选地5-10个核苷酸的长度。
18)包括在具有编码数据的核酸的底物上或其内写入数据的方法。
19)段落18所述的方法,其中底物是可压缩的水凝胶或生物材料。
20)段落18-19中任一项所述的方法,其中核酸以预定的模式嵌入底物上或其内。
21)段落18所述的方法,其中数据是数据模式,任选地其中编码数据的核酸使用数字微镜器件在可压缩的水凝胶上模式化。
22)段落18-21中任一项所述的方法,其中数据以0.5-5微米,任选地1微米的分辨率写入。
23)段落18所述的方法,其中水凝胶每立方厘米包含至少1拍字节的数据。
24)段落18-23中任一项所述的方法,其中底物包含水溶性聚合物或天然的聚合物。
25)段落24所述的方法,其中水溶性聚合物选自:聚(丙烯酸)、聚(乙烯醇)、聚(乙烯吡咯烷酮)、聚(乙二醇)、聚丙烯酰胺和多糖类。
26)段落24所述的方法,其中天然的聚合物选自:明胶、琼脂、右旋糖酐和胶原。
27)段落18-26中任一项所述的方法,还包括将底物压缩和任选地脱水。
28)段落27所述的方法,其中底物被化学压缩,任选地通过向底物添加非水性溶剂或通过增加底物周围的总离子浓度,或者其中可压缩的底物被物理压缩。
29)段落28所述的方法,其中底物大小被压缩至少一千倍、至少一百倍或至少十倍。
30)段落27-29中任一项所述的方法,还包括存储底物。
31)段落30所述的方法,还包括将底物解压缩(膨胀)。
32)段落31所述的方法,还包括读取底物的编码数据以及任选地重置底物。
33)段落32所述的方法,其中使用光学显微镜、光片显微镜、电子显微镜、原子力显微镜、肉眼或核酸测序技术读取编码的数据,任选地在从底物切割核酸后。
34)段落1-33中任一项所述的方法,其中在底物上或其内写入数据包括将对接链连接或嵌入底物上,任选地其中将对接链均匀地或随机地连接或嵌入底物上,并且任选地其中对接链包含使得能够将对接链与底物共价连接的修饰,任选地丙烯酰胺基修饰。
35)段落34所述的方法,其中写入的数据在底物上或其内是2维(2D)或3维(3D)的。
36)段落34-35中任一项所述的方法,还包括根据段落1-33中任一项所述的方法产生条形码的串联体,其中第一核酸与底物的对接链连接。
37)包括压缩利用编码数据的核酸写入,任选地模式化的可压缩的底物的方法。
38)段落37所述的方法,其中底物是可压缩的水凝胶。
39)段落37所述的方法,其中模式是2D或3D的。
40)包括读取在可压缩的水凝胶上写入,任选地模式化的编码数据的核酸的方法。
41)条形码制作方法,包括:
将包含条形码和杂交结构域的第一核酸附接至底物上;
将第一核酸与包含两侧为一对杂交结构域的条形码结构域的第二核酸光交联;
其中每一对的杂交结构域中的一个包含光反应性元件,
并且其中每个条形码被分配独立的位值;
并且其中光交联产生条形码的串联体。
42)段落41所述的方法,其中光反应性元件是光反应性核苷酸。
43)段落41-42中任一项所述的方法,其中第一核酸和/或第二核酸的条形码选自具有4的最小汉明距离的条形码文库。
44)段落41-43中任一项所述的方法,其中第一核酸和/或第二核酸被以预定的模式附接至底物上。
45)段落44所述的方法,其中预定的模式是几何形状、方形、圆形或三角形。
46)段落44所述的方法,其中预定的模式包含重复元件。
47)段落44所述的方法,其中预定的模式是非对称的或对称的。
48)段落44所述的方法,其中预定的模式包含空间信息和/或特定的信息。
49)段落41-48中任一项所述的方法,其中第一核酸以0.25-100微米,任选地1微米的分辨率附接。
50)段落41-49中任一项所述的方法,其中底物选自:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物、环烯烃共聚物、链霉亲和素、树脂和生物材料。
51)段落50所述的方法,其中底物是可压缩的水凝胶。
52)段落50所述的方法,其中生物材料选自:组织、细胞、类器官、改造的组织;以及细胞外基质。
53)段落41-52中任一项所述的方法,其中条形码的串联体编码空间信息和/或特定的信息。
54)段落53所述的方法,其中特定的信息选自:文本、图像、图形、坐标、影像、测序数据、QR码、二进制代码和健康记录。
55)段落41-54中任一项所述的方法,其中每种核酸通过杂交结构域的单个光反应性元件与至少一种其他的核酸共价连接。
56)段落41-55中任一项所述的方法,其中每个条形码具有至少5个核苷酸,任选地5-10个核苷酸的长度。
57)通过段落41-56中任一项所述的方法制作的有条形码的底物。
58)利用编码数据的核酸模式化的可压缩的水凝胶。
59)条形码组合物,其包含:
a.第一核酸,其包含两侧为一对杂交结构域的条形码结构域;
b.第二核酸,其包含两侧为一对杂交结构域的条形码结构域;
c.底物;
d.任选地,试剂,其中试剂允许将第一核酸附接至底物上;
e.任选地,至少一种另外的核酸,其包含两侧为一对杂交结构域的条形码结构域;
其中每个条形码结构域被分配独立的条形码,
其中至少一个杂交结构域包含光反应性元件,
其中至少一种核酸在预定的位置处被固定至底物上。
60)段落59所述的条形码组合物,其中光反应性元件是光反应性核苷酸。
61)段落59所述的条形码组合物,其中光反应性核苷酸是CNVK或CNVD交联碱基。
62)段落59所述的条形码组合物,其中光反应性元件是补骨脂素。
63)段落59-62中任一项所述的条形码组合物,其中第一核酸和/或第二核酸的条形码结构域选自具有4的最小汉明距离的条形码文库。
64)段落59-63中任一项所述的条形码组合物,其中至少一种核酸包含标记。
65)段落64所述的条形码组合物,其中标记是荧光团。
66)段落59-65中任一项所述的条形码组合物,其中底物选自:玻璃、透明聚合物、聚苯乙烯、水凝胶、金属、陶瓷、纸、琼脂糖、明胶、藻酸盐、右旋糖酐、氧化铁、不锈钢、金、铜、氯化银、聚碳酸酯、聚二甲硅氧烷、聚乙烯、丙烯腈-丁二烯-苯乙烯共聚物、环烯烃聚合物、环烯烃共聚物、链霉亲和素、树脂和生物材料。
67)段落59-66中任一项所述的条形码组合物,其中底物是可压缩的水凝胶。
68)段落66所述的条形码组合物,其中生物材料选自:组织、细胞、类器官、改造的组织;以及细胞外基质。
69)段落59-68中任一项所述的条形码组合物,还包含含有光反应性元件的核酸的串联体。
70)段落69所述的条形码组合物,其中核酸的串联体编码特定的信息和/或空间信息。
71)段落70所述的条形码组合物,其中特定的信息选自:文本、图像、坐标、图形、影像、测序数据、QR码、二进制代码和健康记录。
72)段落59-71中任一项所述的条形码组合物,其中每种核酸通过杂交结构域的单个光反应性元件与至少一种其他的核酸共价连接。
73)段落59-72中任一项所述的条形码组合物,其中每个条形码结构域包含至少5个核苷酸,任选地5-10个核苷酸。
74)段落59-73中任一项所述的条形码组合物,其中一个或多个核酸以预定的模式附接至底物上。
75)段落74所述的条形码组合物,其中预定的模式是几何形状、方形、圆形或三角形。
76)段落74所述的条形码组合物,其中预定的模式包含重复元件。
77)段落74所述的条形码组合物,其中预定的模式是非对称的或对称的。
78)段落74所述的条形码组合物,其中预定的模式包含空间信息和/或特定的信息。
79)段落59-78中任一项所述的条形码组合物,其中第一核酸以0.25-100微米,任选地1微米的分辨率附接。
80)段落59-79中任一项所述的条形码组合物,其中用于将第一核酸附接至底物上的试剂是附接核酸链;并且其中附接核酸链与至少一部分的第一核酸基本上互补。
81)段落59-80中任一项所述的条形码组合物,其中用于将第一核酸附接至底物上的试剂是包含条形码结构域和杂交结构域的附接核酸链,其中杂交结构域任选地包含光反应性元件。
实施例
实施例1:可压缩的水凝胶上核酸的模式化
在可压缩的水凝胶上实验验证了核酸模式化,如图6A-图6D中所示。首先在水凝胶基质的聚合过程中,利用对接链,使用丙烯酰胺基化学嵌入可压缩的水凝胶。在混合所有组分后,于室温下聚合包含丙烯酰胺单体、TEMPO、TEMED和2-4μM丙烯酰胺基修饰的DNA(对接链)的水凝胶。然后在磷酸盐缓冲盐水中以0.5μM的浓度制备荧光团标记的CNVK修饰的交联链(图10A中的序列‘a’),并与水凝胶一起孵育过夜。序列‘a’是TCGAXGCAT,其中X是CNVK。在将水凝胶与CNVK成像仪链一起孵育之后,在水凝胶表面上将具有405nm LED的DMD用于产生棋盘状模式1分钟(图10B)(写入)。在洗涤以去除未交联的链之后,然后在荧光扫描仪上将凝胶成像(读取)。然后通过在100%乙醇中孵育过夜来物理压缩水凝胶(图10C),然后在荧光扫描仪上成像。显示物理压缩之前和之后模式化的水凝胶的尺度的比较图像可以在图10D中看到。
随后验证了几种另外的序列,以用于光模式化实验,如上文针对序列‘a’(TCGAXGCAT)所进行的。对于以下提供的每个序列1-6,X代表光反应性交联碱基修饰(CNVK)。
1.GCATACCTCCTAATTCCC TTCA CCTATCTCTA X CTCCAGC(SEQ ID NO:1)
2.GGGAATTA X GAGGTATGC GCTC GCTGGAGATAGAGATAGG(SEQ ID NO:2)
3.TCGA X GCAT ccc ATGATGT TGTGGT GTTTATT AATAAAC ggg GTTG T TGTG(SEQID NO:3)
4.CACA X CAAC ccc GTTTATT TGTGGT ATGATGT ACATCAT ggg ATGC T TCGA(SEQID NO:4)
5.TCGA X GCAT ccc ATGATGT AATAAG GTTTATT AATAAAC ggg GTTG T TGTG(SEQID NO:5)
6.CACA X CAAC ccc GTTTATT AATAAG ATGATGT ACATCAT ggg ATGC T TCGA(SEQID NO:6)
实施例2:串联体化DNA以产生模式
利用两个DNA条形码(实施例1中提供的序列的序列3和序列4)来生成一系列的核酸条形码串联体。我们已经使用来自德州仪器(Texas Instruments)的DLP9500 DMD进行了初步的串联体化实验,以利用迭代串联体化将字母“MIST”拼写到了载玻片上。每次杂交事件都使用1x磷酸盐缓冲盐水(PBS)进行1分钟的时间,然后在365nm波长处照射10秒以用于UV交联。将过量的链在0.05x PBS缓冲液中冲洗掉,以完成一个循环的杂交和交联。利用另一DNA条形码重复杂交和交联的下一个迭代,以产生核酸条形码串联体。设计了实验,以使“MIST”中的每个字母都将重复地包含更多的荧光标记的有条形码的序列,其中期望字母“M”的荧光信号最弱,然后信号逐渐增强,直到在字母“T”处达到最高。在图11中,我们可以看到结果大致遵循此趋势(注意,物镜将一些光切断,导致边缘的照明不均匀。最后的字母“T”包含四个DNA条形码序列,利用了交替的0-1-0-1位编码方案。
参考文献
[1]Bancroft,C.,Bowler,T.,Bloom,B.&Clelland,C.T.Long-term storage ofinformation in DNA.Science 293,1763–1765(2001).
[2]Church,G.M.,Gao,Y.&Kosuri,S.Next-generation digital informationstorage in DNA.Science 337,1628(2012).
[3]Ionov,L.Hydrogel-based actuators:possibilities andlimitations.Mater.Today 17,494–503(2014).
[4]Bahram,M.,Mohseni,N.&Moghtader,M.An Introduction to Hydrogels andSome Recent Applications.in Emerging Concepts in Analysis and Applications ofHydrogels(ed.Majee,S.B.)(InTech,2016).
[5]Cangialosi,A.et al.DNA sequence–directed shape change ofphotopatterned hydrogels via high-degree swelling.Science 357,1126–1130(2017).
[6]Sun,J.-Y.et al.Highly stretchable and tough hydrogels.Nature 489,133–136(2012).
[7]Chen,F.,Tillberg,P.W.&Boyden,E.S.Optical imaging.Expansionmicroscopy.Science 347,543–548(2015).
[8]Chang,J.-B.et al.Iterative expansion microscopy.Nat.Methods 14,593–599(2017).
[9]Truckenbrodt,S.et al.X10 expansion microscopy enables 25-nmresolution on conventional microscopes.EMBO Rep.e45836(2018).
[10]Yoshimura,Y.&Fujimoto,K.Ultrafast reversible photo-cross-linkingreaction:toward in situ DNA manipulation.Org.Lett.10,3227–3230(2008).
[11]Vieregg,J.R.,Nelson,H.M.,Stoltz,B.M.&Pierce,N.A.Selective nucleicacid capture with shielded covalent probes.J.Am.Chem.Soc.135,9691–9699(2013).
[12]Erlich,Y.&Zielinski,D.DNA Fountain enables a robust and efficientstorage architecture.Science 355,950–954(2017).
[13]Dudley,D.,Duncan,W.M.&Slaughter,J.Emerging digital micromirrordevice(DMD)applications.in MOEMS Display and Imaging Systems 4985,14–26(International Society for Optics and Photonics,2003).
[14]Li,J.,Czajkowsky,D.M.,Li,X.&Shao,Z.Fast immuno-labeling byelectrophoretically driven infiltration for intact tissue imaging.Sci.Rep.5,10640(2015).
实施例3:串联体化DNA以产生模式的另外的实施方案
在利用均匀的对接链层功能化的载玻片上验证了核酸条形码的表面模式化。
对接链包含杂交序列、交联链和生物素官能团。利用BSA-生物素和链霉亲和素将玻璃表面钝化以用作生物素化的对接链的结合底物。交联链基本上与FIG 10A中序列‘a’相同,其包含CNVK光反应性核苷酸和Cy3b荧光团。在具有500mM NaCl的1x PBS缓冲液中,以100nM浓度将交联链与对接链杂交。
将DMD光掩模用于产生产生图12和图13中的模式。图12利用了光掩模,因此DMD阵列上只有一个镜子以规则的间隔翻转到“打开”位置。
图13利用了从照片产生的光掩模。365nm LED光源用作UV光源以启动交联。然后将DMD的UV照明轮廓通过10x显微镜物镜聚焦到包含对接和交联链的玻璃表面上。交联是在1秒UV照明时间内进行和完成的。在1x PBS缓冲液中冲洗掉过量的未交联链。通过在TRITC通道中利用40x物镜进行平铺扫描来验证交联的空间特征,并确定正确的模式。
本文所公开的所有参考文献、专利和专利申请针对其每个所引用的主题通过引用并入本文中,在一些情况下,可以涵盖整个文档。
除非明确指出相反,否则本文在说明书和权利要求书中使用的不定冠词“a”和“an”应理解为意指“至少一个”。除非上下文明确指出相反,否则单数术语“一个(a)”、“一种(an)”和“所述(the)”包括复数指示物。类似地,除非上下文明确指出相反,否则词语“或者(or)”旨在包括“和(and)”。尽管与本文提供的那些相似或等同的方法和材料可以用于本公开的实践或测试中,但是下文描述了合适的方法和材料。缩写“例如(e.g.)”来源于拉丁语例如(exempli gratia),并且在本文中用于指示非限制性实例。因此,缩写“例如(e.g.)”与术语“例如(for example)”同义。
术语“基本上相同的”意指两个或更多个核苷酸序列具有至少50%、60%、65%、70%、80%、85%、90%、95%或97%的相同核苷酸。在一些实施方案中,“基本上相同的”意指两个或更多个核苷酸序列具有相同的同样核苷酸。
还应该理解的是,除非明确指出相反,否则在本文所要求保护的包括一个以上步骤或动作的任何方法中,方法的步骤或动作的顺序不一定限于所述的步骤或动作的顺序。
在权利要求书以及以上说明书中,所有过渡性短语,如“包含(comprising)”、“包括(including)”、“携带(carrying)”、“具有(having)”、“含有(containing)”、“涉及(involving)”、“持有(holding)”、“由…组成(composed of)”等,应理解为开放性的,即意指包括但不限于。换句话说,术语“包含(comprising)”或“包含(comprises)”是关于组合物、方法和其各自的组件使用的,其对于方法或组合物是必须的,但不限制包括未指明的元件,无论是否是必需的。
如美国专利局专利审查程序手册(the United States Patent Office Manualof Patent Examining Procedures)第2111.03节所述,仅过渡性短语“由...组成(consisting of)”和“基本上由...组成(consisting essentially of)”应分别为封闭或半封闭过渡性短语。该术语允许存在另外的元素,它们不会实质性地影响本发明的该实施方案的基本和新颖的或功能的特性。
术语“统计学上显著的”或“显著地”是指统计学上的显著性,并且通常意指两个标准差(2SD)或更大的差异。
数值之前的术语“约”和“基本上”意指所述数值的±10%。
在提供了值的范围的情况下,该范围的上端和下端之间的每个值都被明确地考虑并在本文中提供。
- 基于核酸的条形码
- 使用核酸条形码分析与单细胞缔合的核酸
