检测猪塞内卡病毒A的rRT-RAA引物对和探针、试剂盒及应用
文献发布时间:2023-06-19 13:45:04
技术领域
本发明属于动物疫病检测技术领域,具体涉及一种可快速、灵敏地检 测猪塞内卡病毒A的rRT-RAA引物对和探针、试剂盒,并进一步公开其 基于实时荧光逆转录重组酶介导的等温扩增(real-time reverse transcription recombinase-aided amplification,rRT-RAA)方法进行猪塞内卡病毒A快速 检测领域的应用。
背景技术
猪塞内卡病毒感染是由塞内卡病毒A(Senecavirus A,SVA)引起的以 各生长阶段猪的鼻镜、鼻孔、口腔黏膜和/或蹄部冠状带出现水泡性损伤以 及新生仔猪发生急性死亡为特征的新发传染病,其临床症状与口蹄疫非常 相似。在分类上,SVA属于微RNA病毒科(Picornaviridae)塞内卡病毒属 (Senecavirus)成员,其基因组为不分节段的单股正链RNA,全长7.3kb左 右,由5’端非编码区(5’UTR)、一个编码多聚蛋白的开放阅读框(ORF) 和3’端非编码区(3’UTR)组成,具有微RNA病毒科病毒基因组的共同特 点,即呈现L-4-3-4分布。在病毒编码蛋白酶的作用下,多聚蛋白首先被裂 解成先导蛋白(L)和P1、P2、P3 3个蛋白中间体,P1进一步裂解成1A (VP4)、1B(VP2)、1C(VP3)和1D(VP1)4种结构蛋白,P2裂解成2A、2B和2C三种非结构蛋白,P3则裂解成3A、3B、3C和3D四种非结 构蛋白(Hales et al.,Journal of General Virology,2008,89:1265-1275)。
SVA对养猪业的危害值得关注与重视。2002年,美国科研人员在培养 人胚胎视网膜细胞时无意中发现并分离到SVA首例毒株(SVV-001株),推 测其可能来源于污染的胎牛血清或猪胰蛋白酶。随后研究发现,SVA具有 良好的溶瘤特性而被尝试应用于癌症治疗。在此后相当长的时间内,尽管人 们从猪体内成功分离到了多株SVA,但人工感染试验并未发现这些毒株能 够导致猪发病。直至2007年,加拿大Manitoba省7个养猪场的部分猪出现 跛行、口鼻和蹄冠部出现水泡和溃疡等临床症状,经检测发现与SVA感染 有关。此后,SVA虽然隐匿于猪群中却未造成大范围的传播与流行。但自 2014年底以来,巴西、美国等众多猪场暴发SVA感染,导致30%~70%新 生仔猪发生急性死亡。越来越多临床数据表明,SVA新流行毒株与先前分 离毒株对猪的致病性存在显著差异,新流行毒株可以导致健康猪发病,病猪 口鼻和蹄冠部出现水泡和溃疡,而先前分离毒株不能使猪发病。越来越多的 研究表明,SVA正朝着毒力更强的表型演化,危害加重,对养猪业健康构 成了潜在威胁。作为一种新发传染病,SVA给全球养猪业造成了较大的经 济损失,也给我国的口蹄疫防控与净化造成了干扰。临床上,SVA感染导 致猪的临床症状往往与其他具有重大经济影响的水疱性疾病(如口蹄疫、水 疱性口炎、猪水疱病)难以区分。因此,研发快速可靠的SVA检测方法对 于控制该病的进一步传播与流行至关重要。
迄今为止,已经有多种病原学、血清学和分子生物学方法可用于检测和 鉴别SVA感染,包括病毒分离、病毒中和试验、间接免疫荧光检测、间接 或竞争ELISA、荧光原位杂交、免疫组化、实时RT-PCR、微滴式数字PCR、 环介导等温扩增技术等。尽管这些检测方法在SVA的诊断中发挥着重要作 用,但他们通常需要复杂、昂贵的设备且非常耗时,因此不适合在资源有限 的实验室中使用。鉴于此,研究开发一种快速可靠、且便于用户使用的诊断 方法用于SVA的快速检测具有积极意义。
近年来,一种被称为重组酶聚合酶扩增(recombinase polymeraseamplification,RPA)或重组酶介导等温扩增(recombinase-aided amplification,RAA)的新型体外核酸等温扩增技术,因其在临床诊断中 显示出快速、准确检测多种病原体的能力而吸引了全世界的广泛关注。 RAA的整个扩增过程主要依赖于3个关键的酶(重组酶、单链DNA结合蛋 白和链置换DNA聚合酶),能够在相对恒定的温度范围(37℃~42℃)和 20min内完成扩增,而无需借助复杂、昂贵的仪器设备。RAA的扩增产物 既能通过凝胶糖凝胶电泳终点法或侧向流试纸条法检测,又可以借助荧光 探针检测法进行实时检测。因此,RAA是一种具有开发成动物疫病现场检 测的理想技术。
发明内容
为此,本发明所要解决的技术问题在于提供一种基于实时荧光逆转录 重组酶介导等温扩增方法检测猪塞内卡病毒A的rRT-RAA引物对和探针, 以实现基于rRT-RAA方法能够简单、快速、灵敏、特异地检测出猪塞内卡 病毒A;
本发明所要解决的第二个技术问题在于提供一种基于重组酶介导等温 扩增方法检测猪塞内卡病毒A的试剂盒;
本发明所要解决的第三个技术问题在于提供一种基于重组酶介导等温 扩增方法检测猪塞内卡病毒A的方法。
为解决上述技术问题,本发明所述的一种检测猪塞内卡病毒A的rRT- RAA引物对和探针:
所述引物对包括用于鉴定猪塞内卡病毒AVP2基因的正向引物SVA- VP2-F和反向引物SVA-VP2-R,其中所述正向引物SVA-VP2-F和反向引 物SVA-VP2-R的序列如下:
正向引物SVA-VP2-F:
5’-TACCGAAGAAATGGAAAACTCTGCTGATCG-3’;
反向引物SVA-VP2-R:
5’-TGTGCTGCTGGACGGAGGGTCAGATTTGGT-3’;
所述探针SVA-VP2-P的序列如下:
5’- GCAACACTGCCATAAACACGCAATCATCACTGGGTGTGTTGTGTGCCT AC-3’。
优选的,所述探针SVA-VP2-P自5’端起第31位碱基T标记FAM发 光基团,第33位碱基G被四氢呋喃THF代替,第35位碱基T标记 BHQ1淬灭基团,3’端进行C3-spacer阻断修饰;
所述探针SVA-VP2-P的序列如下:
5’-GCAACACTGCCATAAACACGCAATCATCAC(FAM- dT)G(THF)G(BHQ1-dT)GTGTTGTGTGCCTAC[C3-spacer]-3’。
本发明还公开了一种检测猪塞内卡病毒A的rRT-RAA试剂盒,所述 试剂盒包含所述的rRT-RAA引物对和探针。
具体的,所述试剂盒还包含适宜于逆转录重组酶介导等温扩增的试剂 体系和RT荧光基础反应单元。
更具体的,所述试剂体系包括反应缓冲液、RNase-Free ddH
具体的,所述RT荧光基础反应单元包含单链DNA结合蛋白、重组 酶、逆转录酶和聚合酶。优选的,所述RT荧光基础反应单元以冻干粉的 形式存在。
更具体的,所述的检测猪塞内卡病毒A的rRT-RAA试剂盒,所述试 剂盒(25μL体系)包括:
本发明还公开了一种所述检测猪塞内卡病毒A的rRT-RAA试剂盒的 使用方法,包括如下步骤:
(1)提取RNA:以常规方法提取待测样品的RNA;
(2)rRT-RAA反应体系扩增:以提取的RNA为模板,利用所述试剂 盒进行rRT-RAA扩增反应;
(3)结果判定。
具体的,所述rRT-RAA扩增反应的条件为在42℃下恒温扩增30 min。
具体的,所述步骤(3)中,所述结果判定为:
质控标准:阴性对照无扩增曲线,且阳性对照出现扩增曲线,则试验 数据有效,否则试验结果为无效;
结果描述及判定:待检测样品无扩增曲线,样品判为阴性;出现扩增 曲线,样品判为阳性;其中,阴性对照中的模板加入的是RNase-Free ddH
本发明还公开了所述检测猪塞内卡病毒A的rRT-RAA引物对和探针 或所述的检测猪塞内卡病毒A的rRT-RAA试剂盒在猪塞内卡病毒A检测 领域的应用。
本发明所述检测猪塞内卡病毒A的rRT-RAA引物对和探针,针对于猪 塞内卡病毒A的rRT-RAA检测,筛选出适宜于快速鉴定猪塞内卡病毒A VP2基因的正向引物SVA-VP2-F、反向引物SVA-VP2-R和探针SVA-VP2- P,可实现对SVA进行快速、特异、灵敏、简便地检测,从而弥补现有检测 技术的不足。
本发明所述检测猪塞内卡病毒A的rRT-RAA引物、探针和试剂盒,基 于所述rRT-RAA引物和探针进行猪塞内卡病毒A的扩增,只需在37℃~ 42℃恒温条件下反应20min即可完成,该方法反应快速,对仪器要求简 单,不需要热循环反应的温度控制仪器,极大缩短了检测时间,可以实现便 携式的现场快速核酸检测。
附图说明
为了使本发明的内容更容易被清楚地理解,下面根据本发明的具体实 施案例并结合附图,对本发明作进一步详细的说明,其中,
图1是本发明所述猪塞内卡病毒A的rRT-RAA优化的引物筛选原理示 意图,其中,A为第一次引物筛选,B为第二次引物筛选,C为第三次引物 筛选;
图2是本发明所述猪塞内卡病毒A的rRT-RAA优化的引物和探针在全 球250个SVA代表性毒株VP2基因中具体位置的示意图(毒株的来源国及 其GenBank登录号标注于图的左侧);
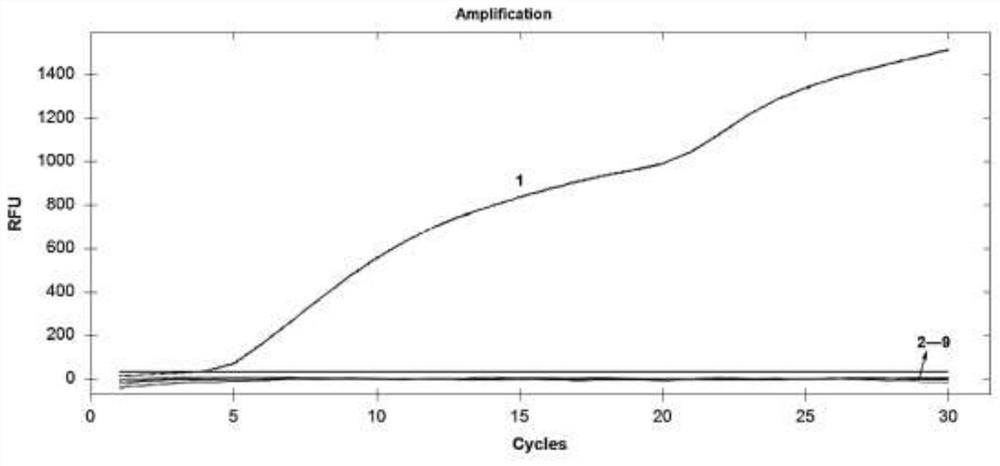
图3是本发明检测引物和探针特异性的rRT-RAA扩增结果;其中,1: 猪塞内卡病毒A;2-9:脑心肌炎病毒、猪伪狂犬病病毒、猪繁殖与呼吸综 合征病毒、猪圆环病毒2型、猪流行性腹泻病毒、猪丁型冠状病毒、口蹄疫 病毒和阴性对照;
图4是本发明检测引物和探针灵敏性的rRT-RAA扩增结果,其中,1: 10
图5是本发明用于检测引物和探针灵敏性比较的rRT-PCR扩增结果, 其中,1:10
具体实施方式
本发明下述实施例中,所涉及到的实验方法如无特殊说明,均为常规方 法。
实施例1猪塞内卡病毒A的rRT-RAA检测引物及探针设计与筛选
通过NCBI查找到源自全球相关国家已公开的250条猪塞内卡病毒A 的全基因组序列(如图2所示),利用Vector NTI软件对这250株SVA全 基因组序列进行比对分析保守区域,经同源性分析后,发现SVA的VP2基 因内部的一个区域在SVA的整个基因组中的保守性最高,因此根据SVA VP2基因的最保守区域设计rRT-RAA的引物和探针。
rRT-RAA引物的设计遵循以下基本原则:引物长度应大于等于30bp, 最好在30~35bp之间;扩增子长度不超过500bp,最好长度为100~200 bp之间;GC含量应大于30%而小于70%,最好在40%~60%之间;最好 避免引物中存在许多重复的短序列;避免引物直接形成发夹结构,或引物二 聚体的形成等等。为保证rRT-RAA扩增效率,需要对引物进行大量的筛选, 从而能够获得更好的引物组合。引物筛选原则如下:第一次筛选是随机选用 某一正向引物对所有反向引物进行筛选,再选择最优的反向引物对所有正 向引物进行筛选,最终筛选出一对好的引物;若需要获得高灵敏度的引物组 合则需进行第二次引物筛选,其筛选方法用第一次筛选出来的最佳引物组 合进行如下改进:将正向、反向引物在靶序列上的位置以1~3个碱基的幅 度前后移动或在引物两端增加和去掉几个碱基,来筛选出比第一次的引物 更好的引物组合。
根据上述原则,设计了下表1中的引物和探针,按照上面引物筛选原 则进行筛选。
表1设计的rRT-RAA引物和探针
所述引物对和探针的筛选包括如下步骤:
(1)配制rRT-RAA反应体系
所述rRT-RAA反应体系(25μL)包括:
阴性对照模板加入的是RNase-Free ddH
(2)rRT-RAA反应体系扩增
将检测反应条件设置为:在42℃下恒温扩增30min;
质控标准:阴性对照无扩增曲线,且阳性对照出现扩增曲线,则试验数 据有效,否则试验结果为无效;
结果描述及判定:待检测样品无扩增曲线,样品判为阴性;出现扩增曲 线,样品判为阳性。阳性起峰时间早,扩增速度快,说明该引物组合和探针 越好。
如图1所示,引物筛选步骤如下:第一次筛选是固定某一上游引物F1, 然后对VP2-R1~VP2-R8这8对下游引物进行筛选,筛选出了VP2-R2是 最优下游引物,再固定最优的下游引物VP2-R2,然后对VP2-F1~VP2-F7 这7对上游引物进行筛选,筛选出VP2-F4是最优的上游引物,因此,第一 次筛选的最佳引物组合是VP2-F4和VP2-R2。对于需要获得高灵敏度的引 物组合需进行第二次引物筛选,需用第一次筛选出来的最佳引物组合进行 如下改进:将第一次筛选出来的最佳引物在模板上的位置以1~3个碱基的 速度前后移动或在引物两端增加和去掉几个碱基,来继续筛选出比第一次 的引物更好的引物组合。用于第二次筛选的下游引物为VP2-R2-1~VP2-R2- 6和上游引物为VP2-F4-1~VP2-F4-6,最终筛选出了上游引物VP2-F4-2和 下游引物VP2-R2组合是最佳引物组合。第三次筛选是将第二次筛选所得的 最佳引物从3’末端逐一增减而得到的一系列引物,然后以不同组合测试这 些引物。第三次筛选涉及的引物有下游引物VP2-R2-2-1~VP2-R2-2-7和上 游引物VP2-F4-2-1~VP2-F4-2-4。
最终的最佳引物对是上游引物VP2-F4-2和下游引物VP2-R2组合,我 们将VP2-F4-2命名为SVA-VP2-F,将VP2-R2命名为SVA-VP2-R,将VP2- P命名为SVA-VP2-P,引物筛选示意图如图1所示。
本实施例中,最终筛选出最佳引物组合和探针序列如下:
正向引物SVA-VP2-F:
5’-TACCGAAGAAATGGAAAACTCTGCTGATCG-3’;
反向引物SVA-VP2-R:
5’-TGTGCTGCTGGACGGAGGGTCAGATTTGGT-3’;
探针SVA-VP2-P:
5’-GCAACACTGCCATAAACACGCAATCATCAC(FAM- dT)G(THF)G(BHQ1-dT)GTGTTGTGTGCCTAC[C3-spacer]-3’;
所述探针SVA-VP2-P自5’端起第31位碱基T标记FAM发光基团,第 33位碱基G被四氢呋喃THF代替,第35位碱基T标记BHQ1淬灭基团, 3’端进行C3-spacer阻断修饰。
实施例2引物对和探针的特异性检测
分别用脑心肌炎病毒、猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒、猪 圆环病毒2型、猪流行性腹泻病毒、猪丁型冠状病毒、口蹄疫病毒和猪塞内 卡病毒A作为反应模板,并设置阴性对照,按照前述加样方法进行rRT-RAA 核酸扩增,同时利用已发表文献(Zhang etal,BMC Veterinary Research,2019, 15:168)中的rRT-PCR进行对比。检测反应条件为:42℃恒温扩增30min。
通过图3中的结果显示,除了猪塞内卡病毒ARNA模板对应的试验组 出现了正常荧光检测曲线,其他病毒及阴性对照组均未出现扩增曲线。结果 表明,本发明所使用的引物和探针可以实现对猪塞内卡病毒A的特异性检 测,与其他相关病毒不发生交叉反应。
实施例3引物对和探针的灵敏度检测
设置5组不同浓度的猪塞内卡病毒A的RNA模板,在rRT-RAA最适 条件下进行核酸地扩增。
参照RNA提取试剂说明书提取猪塞内卡病毒A SDta/2018毒株 (GenBank登录号:MN433300.1)的RNA,将病毒滴度为5×10
如图4-5中的结果显示,本发明设计的引物和探针组合能够保证检测时 的灵敏性,可以检测到10
实施例4对实际样品的检测应用
取猪的临床样品(包括血清、水泡液拭子、溃疡拭子)共189份,按照 RNA提取试剂说明书提取待检的189份临床样品的RNA,提取的RNA放 在-80℃保存(反复冻融最好不超过3次)。
按照前述加样方法进行rRT-RAA核酸扩增,同时利用已发表文献 (Zhang et al,BMC Veterinary Research,2019,15:168)中的rRT-PCR方法同 时检测189份临床样品进行对比。
结果如下表2所示,189份临床样品rRT-RAA检出阳性146份,rRT- PCR检出阳性151份,rRT-RAA与rRT-PCR的Kappa值为0.927,p<0.001。
表2临床样品检测结果
综上所述,本发明中的方法可以实现对猪塞内卡病毒A进行快速、特 异、灵敏、可视化、简便地检测。该方法反应快速,对仪器要求简单,不需 要热循环反应的温度控制仪器,适合在基层或现场进行该病的即时检测。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方 式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可 以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予 以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保 护范围之中。
- 检测猪塞内卡病毒A的rRT-RAA引物对和探针、试剂盒及应用
- 一种用于猪赛内卡病毒巢式RT-PCR检测的引物组、试剂盒及应用
