一种液滴式数字PCR芯片
文献发布时间:2023-06-19 18:32:25
技术领域
本发明属于核酸检测芯片领域,具体地说,涉及一种液滴式数字PCR芯片。
背景技术
由于不依赖标准曲线定量,不受PCR扩增效率影响,同时具有更高灵敏度和准确度,液滴式数字PCR技术逐渐成为一种在癌症精准筛查、病原微生物检测和传染病筛查等临床医学辅助诊断领域发挥重要作用的检测技术手段。众所周知,通过增加液滴,可以提高液滴式数字PCR的检测精度和降低液滴式数字PCR的检测限。但是由于目前这些液滴式数字PCR检测流程中不包括核酸纯化的样品处理功能。换句话说,在液滴式数字PCR检测时,需要核酸检测人员先将样本在芯片外进行处理,然后再转移到额外的液滴生成芯片中以获得微液滴来进行数字PCR检测。但是,样本转移过程中存在不可避免的样品损失和样品污染的问题极大影响了液滴式数字PCR的应用。
因此,非常有必要开发能实现“样品进,结果出”的液滴式数字PCR芯片,以提高液滴式数字PCR检测的集成化和自动化程度,同时降低核酸泄露污染环境和影响检测人员身体健康的风险。
发明内容
本发明要解决的技术问题在于克服液滴式数字PCR芯片现有技术的不足,提供一种可以克服上述问题或者部分地解决上述问题的集核酸样品裂解、洗涤、洗脱、PCR反应液混合、液滴生成、数字PCR 检测全流程于一体的液滴式数字 PCR芯片,为广大PCR实验室高效精准地数字PCR检测服务的实施提供有力保障。
为了达到上述目的,本发明的技术方案是:
一种液滴式数字PCR芯片,所述芯片由基板和盖板构成,所述基板包括有核酸样品的裂解腔、洗涤腔、洗脱腔、PCR反应液混合腔(简称为:混合腔)、液滴腔和数字PCR检测腔(简称为:检测腔),能够在单一芯片上完成对核酸样品的处理、液滴生成和检测的工作,提高液滴式数字PCR检测的集成化和自动化程度,同时降低核酸泄露污染环境和影响检测人员身体健康的风险。
根据本发明的实施例,还可以对本发明作进一步的优化,以下为优化后形成的技术方案:
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片包括相贴合的基板和盖板。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板和盖板通过热压键合封装制成。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板和盖板通过等离子键合封装制成。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的盖板由PMMA和氮化硅的混合材料制成,所述混合材料中氮化硅的质量含量为1%-15%。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的盖板由PDMS和硼化锆的混合材料制成,所述混合材料中硼化锆的质量含量为0.5%-10%。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板由二氧化硅和PDMS的混合材料制成,所述混合材料中PDMS的质量含量为5%-25%。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板由氮化硼和PDMS的混合材料制成,所述混合材料中PDMS的质量含量为20%-40%。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板设置有裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔。
在本发明的一些实施方式中,一种液滴式PCR数字芯片,与所述芯片的基板不贴合的盖板的一面标有裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔的字样。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板分别设置有裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔的注入管路。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片的基板设置有安全管路。
在其中一个优选的实施例中,所述芯片基板的裂解腔与所述基板的洗涤腔之间设置有微流控孔道;所述微流控孔道设置有止逆阀。
在其中一个优选的实施例中,所述芯片基板的洗涤腔与所述基板的洗脱腔之间设置有微流控孔道;所述微流控孔道设置有止逆阀。
在其中一个优选的实施例中,所述芯片基板的洗脱腔与所述基板的混合腔之间设置有微流控孔道;所述微流控孔道设置有止逆阀。
在其中一个优选的实施例中,所述芯片基板的混合腔与所述基板的液滴腔之间设置有微流控孔道;所述微流控孔道设置有止逆阀和具有过滤磁珠和止逆功能的雾化喷嘴。
在其中一个优选的实施例中,所述芯片基板的液滴腔与所述芯片基板的检测腔之间设置有液滴平铺孔道;所述液滴平铺孔道设置有止逆阀;所述液滴平铺孔道为沙漏形状设计。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述连接不同腔的注入管路和安全管路的管径一致或不一致。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述连接不同腔的注入管路和安全管路的管径为0.5毫米-1.5毫米。在一个实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.51毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.52毫米,0.53毫米,0.54毫米,0.55毫米,0.56毫米,0.57毫米,0.58毫米,0.59毫米,0.6毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.61毫米-0.7毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.71毫米-0.8毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.81毫米-0.9毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为0.91毫米-1毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为1.1毫米-1.2毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为1.21毫米-1.3毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为1.31毫米-1.4毫米。在某些实施方式中,其中所述连接不同腔的注入管路和安全管路的管径为1.41毫米-1.5毫米。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片基板设置有的裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔之间分别相互连接的微流控通道截面积为所述裂解腔样品进样管路通道截面积的1/4-2/3。在一个实施方式中,其中所述微流控通道截面积为所述裂解腔注入管路通道截面积的1/3。在某些实施方式中,其中所述微流控通道截面积为所述裂解腔注入管路通道截面积的1/3和1/2。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述检测腔的体积为0.1微升-200微升。在一个实施方式中,其中所述单个检测腔的体积为0.2微升。在某些实施方式中,其中单个检测腔的体积分别为0.3微升,0.4微升,0.5微升,0.6微升,0.7微升,0.8微升,0.9微升,1.0微升。在某些实施方式中,其中单个检测腔的体积为1.1-5微升。在某些实施方式中,其中单个检测腔的体积为5.1-10微升。在某些实施方式中,其中单个检测腔的体积为10.1-15微升。在某些实施方式中,其中单个检测腔的体积为15.1-20微升。在某些实施方式中,其中单个检测腔的体积为20.1-25微升。在某些实施方式中,其中单个检测腔的体积为25.1-50微升。在某些实施方式中,其中单个检测腔的体积为50.1-100微升。在某些实施方式中,其中单个检测腔的体积为100.1-150微升。在某些实施方式中,其中单个检测腔的体积为150.1-199.9微升。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述通过雾化喷嘴形成的微液滴直径为0.05-50μm。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述液滴平铺通道的高度为微液滴直径的的1-2倍。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述检测腔的高度为微液滴直径的1.02-1.25倍。在一个实施方式中,其中检测腔的高度为微液滴直径的1.1倍。在某些实施方式中,其中检测腔的高度为微液滴直径的1.2倍。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述检测腔的数量为1-16个。在一个实施方式中,其中所述检测腔的数量为2个。在某些实施方式中,其中所述检测腔的数量分别为3个,4个,5个,6个,7个,8个,9个,10个,11个,12个,13个,14个,15个。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述芯片基板和盖板键合形成二层结构。
在其中一个优选的实施例中,一种液滴式PCR数字芯片,所述盖板的厚度为0.1-0.5毫米。在一个实施方式中,其中所述盖板的厚度为0.11毫米。在某些实施方式中,其中所述盖板的厚度分别为0.12毫米,0.13毫米,0.14毫米,0.15毫米,0.16毫米,0.17毫米,0.18毫米,0.19毫米,0.2毫米。在某些实施方式中,其中所述盖板的厚度为0.21毫米-0.3毫米。在某些实施方式中,其中所述盖板的厚度为0.31毫米-0.4毫米。在某些实施方式中,其中所述盖板的厚度为0.41毫米-0.5毫米。
一种液滴式数字PCR芯片的制备方法,包括如下步骤:
第一步,采用光刻技术制作硅片模具,刻蚀出裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔的边缘线及依次连通各腔的微流控孔道;第二步,在硅片模具上浇铸,倒模后形成芯片基板,在裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔打通孔道,并功能化;第三步,采用键合封装技术,将功能化的芯片基板与没有标有裂解腔、洗涤腔、洗脱腔、混合腔、液滴腔和检测腔字样的盖板一面键合,完成芯片制作。
一种液滴式数字PCR芯片的使用方法,包括如下步骤:
步骤一:分别依次打开芯片裂解腔、洗涤腔、洗脱腔和混合腔的注入口防护塞,通过移液器进油,让裂解腔、洗涤腔、洗脱腔和混合腔中的油相高度均为腔体高度的一半,然后复位各个注入口防护塞;步骤二:打开裂解腔的注入口防护塞,通过移液器依次加入裂解液,蛋白酶K和磁珠,然后复位注入口防护塞;步骤三:打开洗涤腔的注入口防护塞,通过移液器依次加入乙醇水溶液,然后复位试剂注入口防护塞;步骤四:打开洗脱腔的注入口防护塞,通过移液器分别依次加入PEG和氯化镁溶液;步骤五:打开混合腔的注入口防护塞,通过移液器分别依次PCR反应液的引物,酶,水,然后复位注入口防护塞;步骤六:打开芯片裂解腔的注入口防护塞,通过移液器加入样品,然后复位注入口防护塞;步骤七:将芯片在磁力架上放置一段时间,让裂解腔中各组分充分混匀,随后把芯片在恒温箱中放置一段时间,促使样本中核酸分子与磁珠充分结合;步骤八:打开裂解腔和洗涤腔之间的微流控通道阀门,让裂解腔中的磁珠借助磁力架进入洗涤腔,复位微流控通道阀门,充分混匀磁珠和洗涤液;步骤九:打开洗涤腔和洗脱腔之间的微流控通道阀门,让洗涤腔中的磁珠进入洗脱腔,复位微流控通道阀门,充分混匀磁珠和洗脱液;步骤十:打开洗脱腔和混合腔之间的微流控通道阀门,让洗脱腔中的磁珠进入混合腔,复位微流控通道阀门,充分混匀,静置一段时间,让核酸和磁珠脱离;步骤十一:打开混合腔和液滴腔之间的微流控通道阀门,让混合腔中的PCR反应液流经具有磁珠过滤功能的雾化喷嘴,把磁珠留在洗脱腔,复位微流控通道阀门;与磁珠分离的混合液流经具有止逆功能的雾化喷嘴孔边际时展开成液体层,因为空气动力的不稳定,将液体层断裂变成拉长了的管孔状的粗细的圆柱体,然后变成液滴。液体经过内部压力,将内部的液体挤压进喷嘴中,雾化喷嘴内部放置有一块石英叶片,高速活动的液体经过石英叶片的旋流腔冲击反弹后构成大小均一的独立的微液滴;步骤十二:打开液滴腔与检测腔的微液滴平铺孔道阀门,使微液滴沿平铺孔道进入和平铺于检测腔,复位微液滴平铺孔道阀门,将芯片放置于PCR仪中进行热循环,扩增完成后,转移到荧光显微镜下对微液滴依次成像,并通过软件统计阳性(有荧光)与阴性(无荧光)微液滴比例,根据数字PCR计算公式得出样品核酸浓度,给出检测结果。同样的,此芯片能够按照与上述类似的工作方式,应用于蛋白质样品的处理并实现数字酶联免疫吸附(ELISA)检测。如果发生安全故障问题,可以打开安全出口塞子和安全阀门,通过安全出口和安全管路进行安全故障排除,以保证操作安全。
与现有技术相比,本发明的有益效果是:
(1)液滴式数字PCR芯片生产时仅需键合一次,使用过程无须形成真空或负压环境;
(2)液滴式数字PCR芯片融合了核酸样品裂解,洗涤、核酸与PCR反应液混合、液滴生成和PCR反应检测的功能,实现核酸分析“样品进,结果出”的的全部流程;
(3)液滴式数字PCR芯片借助各个不同腔的递降式设计和各个腔之间具有止逆功能的微流控通道阀门实现了多个串联的不同腔的不同功能,且各腔之间液体能充分隔绝,无交叉污染;此外,雾化喷嘴生成微液滴的过程稳定,并能够通过微液滴平铺孔道让微液滴独立地稳定平铺于检测腔,有利于提高检测准确度;
(4)液滴式数字PCR芯片的样品在芯片上以油中的液滴形式存在,避免了核酸分子以气溶胶形式污染检测环境;且由于油的隔离作用,核酸样品全程与芯片结构不直接接触,避免了核酸分子吸附在不同芯片腔室表面或通道表面导致损失或残留的情况,使得芯片可以通过适当的设计实现反复重复使用。
附图说明
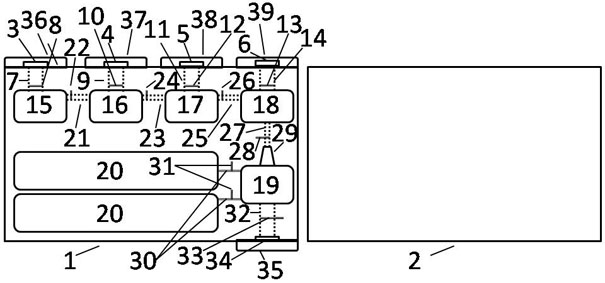
图1是本发明一个实施例的液滴式PCR数字芯片结构示意图。
图2是图1中雾化喷嘴29的结构示意图。
具体实施方式
以下将参考附图并结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。为叙述方便,下文中如出现“上”、“下”、“左”、“右”字样,仅表示与附图本身的上、下、左、右方向一致,并不对结构起限定作用。本发明的实施例仅仅是为了解释本发明,并非为了限制本发明,且本发明的实施例并不局限于说明书中给出的实施例。实施例中未注明具体实验条件或操作条件的按常规条件制作,或按材料供应商推荐的条件制作。此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后 还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的组合连接关系并不排斥在所述组合前后还可以存在其他连接或在这些明确提到的两个连接之间还可以插入其他连接,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。在下述实施例中,所使用到的试剂、材料以及仪器如没有特殊的说明,均可商购获得。
本发明的基板1,盖板2,裂解腔注入口3,洗涤腔注入口4,洗脱腔注入口5,混合腔注入口6,裂解腔注入管路7和止逆阀8,洗涤腔注入管路9和止逆阀10,洗脱腔注入管路11和止逆阀12,混合腔注入管路13和止逆阀14,裂解腔15,洗涤腔16,洗脱腔17,混合腔18,液滴腔19,检测腔20,裂解腔15与洗涤腔16之间的微流控通道21和止逆阀22,洗涤腔16和洗脱腔17之间的微流控通道23和止逆阀24,洗脱腔17和混合腔18的微流控通道25和止逆阀26,混合腔18和液滴腔19的微流控通道27,止逆阀28和雾化喷嘴29,液滴腔19和检测腔20之间的液滴平铺通道30和止逆阀31,安全管路32,安全阀门33,安全出口34,安全出口塞子35,裂解腔注入口塞子36,洗涤腔注入口塞子37,洗脱腔注入口塞子38,混合腔注入口塞子39部件均为通用标准件或本领域技术人员知晓的部件,其结构和原理都为本技术人员均可通过技术手册得知或通过常规实验方法获知。
实施例1
一种液滴式PCR数字芯片,如附图1所示,主要由基板1与盖板2两层结构组成,其中在基板1上有裂解腔注入口3,洗涤腔注入口4,洗脱腔注入口5,混合腔注入口6,裂解腔注入管路7和止逆阀8,洗涤腔注入管路9和止逆阀10,洗脱腔注入管路11和止逆阀12,混合腔注入管路13和止逆阀14,裂解腔15,洗涤腔16,洗脱腔17,混合腔18,液滴腔19,检测腔20。所述裂解腔15与所述洗涤腔16之间设置有微流控通道21和止逆阀22;所述洗涤腔16和所述洗脱腔17之间设置有具有止逆功能的微流控通道23和止逆阀24;所述洗脱腔17和所述混合腔18之间设置有具有止逆功能的微流控通道25和止逆阀26;所述混合腔18和所述液滴腔19之间设置有微流控通道27,止逆阀28和雾化喷嘴29;所述液滴腔19和检测腔20之间设置有液滴平铺通道30和止逆阀31。
实施例1中,所述液滴腔19下方设置有安全管路32,安全阀门33,安全出口34和安全出口塞子35;
实施例1中,所述裂解腔注入口配置有塞子36,所述洗涤腔注入口配置有塞子37,所述洗脱腔注入口配置有塞子38,所述混合腔注入口配置有塞子39;
实施例1中,所述雾化喷嘴29配置有过滤磁珠的滤膜40和石英叶片41,如附图2所示;
实施例1中,裂解腔注入管路7,洗涤腔注入管路9,洗脱腔注入管路11,混合腔注入管路13的管径均为0.25毫米,所述微流控通道截面积为所述注入管路通道截面积的1/2;
实施例1中,检测腔的数量为2个,所述单个检测腔的体积为0.5微升;
实施例1中,基板1由氮化硼和PDMS的混合材料制成,所述混合材料中PDMS的质量含量为40%;
实施例1中,盖板2由PDMS和硼化锆的混合材料制成,所述混合材料中硼化锆的质量含量为2.5%;
实施例1中,所述盖板的尺寸为0.25*45*75mm;
实施例1中,所述裂解腔15,洗涤腔16,洗脱腔17和混合腔18的内径均为5mm;
实施例1中,所述通过雾化喷嘴29形成的微液滴直径为0.05-50μm;
实施例1中,所述液滴平铺通道30的高度为微液滴直径的的1.2倍;
实施例1中,所述检测腔的高度为微液滴直径的1.2倍。
一种液滴式数字PCR芯片的制备方法,包括如下步骤:
第一步,使用AutoCAD软件绘制出设计的液滴式PCR数字芯片,制作成光刻用的胶片掩膜版;以四寸单晶硅片为衬底,采用光刻技术制作硅片模具,利用光刻胶上刻蚀出芯片基本的所述裂解腔15,所述洗涤腔16,所述洗脱腔17,所述混合腔18,所述液滴腔15和所述检测腔16的边缘线及分别连通各腔的所述裂解腔注入管路7,所述洗涤腔注入管路8,所述洗脱腔注入管路9,所述混合腔注入管路10,所述裂解腔15与所述洗涤腔16之间的微流控通道21,所述洗涤腔16和所述洗脱腔17之间的微流控通道23,所述洗脱腔17和所述混合腔18的微流控通道25,所述液滴腔15和所述检测腔16之间的液滴平铺通道30;
第二步,在模具上浇铸,倒模后,对所述裂解腔15,所述洗涤腔16,所述洗脱腔17,所述混合腔18,所述液滴腔19和所述检测腔20进行功能化;
第三步,制备对应于基板1的盖板2,不朝向基板1的盖板2上有对应于基板1各腔和各通道的标识;
第四步,采用热压封装技术,将功能化的基片和盖板键合,制成芯片。
一种液滴式数字PCR芯片的使用方法,包括如下步骤:
步骤一:分别依次打开芯片裂解腔15、洗涤腔16、洗脱腔17和混合腔18的注入口防护塞36, 防护塞37, 防护塞38和防护塞39,通过移液器分别注入矿物油,让裂解腔15、洗涤腔16、洗脱腔17和混合腔18中的油相高度均为腔体高度的一半,然后复位各个注入口防护塞;步骤二:打开裂解腔15的注入口防护塞36,通过移液器依次加入裂解液,蛋白酶K和磁珠,然后复位注入口防护塞36;步骤三:打开洗涤腔的注入口防护塞37,通过移液器依次加入乙醇水溶液,然后复位注入口防护塞37;步骤四:打开洗脱腔的注入口防护塞38,通过移液器分别依次加入PEG和氯化镁溶液,然后复位洗脱腔的注入口防护塞38;步骤五:打开混合腔的注入口防护塞39,通过移液器分别依次PCR反应液的引物, 酶,水,然后复位注入口防护塞39;步骤六:打开芯片裂解腔的注入口防护塞36,通过移液器加入样品,然后复位注入口防护塞36;步骤七:将芯片在磁力架上放置一段时间,让裂解腔15中各组分充分混匀,随后把芯片在恒温箱中放置一段时间,促使样本中核酸分子与磁珠充分结合;步骤八:打开裂解腔15和洗涤腔16之间微流控通道21的止逆阀22,让裂解腔15中的磁珠进入洗涤腔16,复位止逆阀22,充分混匀磁珠和洗涤液;步骤九:打开洗涤腔16和洗脱腔17之间的微流控通道23的止逆阀24,让洗涤腔16中的磁珠进入洗脱腔17,复位止逆阀24,充分混匀洗涤液和洗脱液;步骤十:打开洗脱腔17和混合腔18之间的微流控通道24的止逆阀25,让洗脱腔17中的磁珠进入混合腔18,复位止逆阀25,充分混匀,静置一段时间,让核酸和磁珠脱离;步骤十一:打开混合腔18和液滴腔19之间的具有磁珠过滤和止逆功能的雾化喷嘴29,让混合腔18中的PCR反应液进入液滴腔19,磁珠留在混合腔18,与磁珠分离的混合液流经具有止逆功能的雾化喷嘴29孔边际时展开成液体层,因为空气动力的不稳定,将液体层断裂变成拉长了的管孔状的粗细的圆柱体,然后变成液滴。液体经过内部压力,将内部的液体挤压进喷嘴29中,雾化喷嘴29内部放置有一块石英叶片41,高速活动的液体经过石英叶片41的旋流腔冲击反弹后构成直径为0.05-50μm微米左右的大小均一的分散的微液滴,复位雾化喷嘴29;步骤十二:打开液滴腔与检测腔的微液滴平铺孔道阀门31,使微液滴进入和平铺于检测腔20,复位微液滴平铺孔道阀门31,将芯片放置于PCR仪中进行热循环,扩增完成后,转移到荧光显微镜下对微液滴依次成像,并通过软件统计阳性(有荧光)与阴性(无荧光)微液滴比例,根据数字PCR计算公式得出样品核酸浓度,给出检测结果。同样的,此芯片能够按照与上述类似的工作方式,应用于蛋白质样品的处理并实现数字酶联免疫吸附(ELISA)检测。如果发生安全故障问题,可以打开安全出口塞子和安全阀门,通过安全出口和安全管路进行安全故障排除,以保证操作安全。
实施例2
第一步,分别依次打开芯片裂解腔15、洗涤腔16、洗脱腔17和混合腔18的注入口防护塞36, 防护塞37, 防护塞38和防护塞39,通过移液器分别注入矿物油,让裂解腔15、洗涤腔16、洗脱腔17和混合腔18中的油相高度均为腔体高度的一半,然后复位各个进油口防护塞;
第二步,打开裂解腔15的注入口防护塞36,通过移液器加入10微升裂解体系试剂(裂解液,蛋白酶K,磁珠),复位注入口防护塞36;打开洗涤腔16的注入口防护塞37,通过移液器加入5微升的洗涤液1(60%乙醇水溶液) ,复位注入口防护塞37;打开洗脱腔17的注入口防护塞38加入5微升的洗涤液 (13%PEG-8000,1mM氯化镁溶液) ,复位注入口防护塞38;打开混合腔18的注入口防护塞39,通过移液器加入4μL的PCR反应液(引物, 酶,水),复位注入口防护塞39;最后,在裂解腔室15中加入2.5微升的样品(癌症患者的血浆游离核酸),然后复位注入口防护塞36;
第三步,将芯片在磁力架上放置2分钟混匀,然后在50°恒温箱中放置12分钟让核酸分子并与磁珠充分结合;
第四步,打开止逆阀22,将磁珠从裂解腔15沿微流控通道21拖至洗涤腔16内,复位止逆阀22,将磁珠和洗涤液混匀1分钟,;
第五步,打开止逆阀24,将磁珠从洗涤腔16沿微流控通道23拖至洗脱腔17内,将磁珠和洗脱液混匀1分钟;
第六步,打开止逆阀26,将磁珠从洗脱腔17沿微流控通道25拖至混合腔18内,将磁珠和反应液混匀1分钟,然后静置10分钟;
第七步,打开止逆阀28,将混合物从混合腔18沿微流控通道27通过具有过滤磁珠和止逆功能的雾化喷嘴29,将磁珠和PCR反应液分离,让PCR反应液以微液滴形式进入液滴腔;
第八步,打开液滴平铺通道30的止逆阀门31,让液滴平铺于检测腔20;
第九步,芯片放置在原位PCR仪中,启动扩增程序,扩增后在荧光显微镜下检测液滴阴阳性,根据数字PCR计算公式得出样品核酸浓度,给出检测结果。
实施例3
本发明实例2中的液滴式PCR数字芯片对试样检测结果与商用PCR检测芯片的检测结果非常一致,但本发明相比商用PCR数字芯片检测样本所需的操作时间缩短了60分钟,大大提高了检测过程效率。此外,本发明相比商用PCR检测芯片样本检出准确率提高了10%,达到了100%。
实施例4
本发明实例1中所制备的13个液滴式PCR数字芯片对所采集的伤口拭子、血浆、脑脊液、骨髓液、房水、胸腹水、关节积液、组织、尿液、脓肿抽液、肺泡灌洗液、痰液或鼻咽拭子等样本按临床检验检测标准操作流程处理后进行液滴式PCR数字检测,结果表明实施例1中所构建的13个液滴式PCR数字芯片的检测结果均能准确地反应样本的真实情况。与商品化PCR数字芯片比较,实施例1中所构建的13个液滴式PCR数字芯片不仅检出准确率高达100%,而且检测时间短。按成本价计算,每个样本的检测费平均节省37元,不仅利于医院医保的采购使用,而且能给检测者节省一笔检测费用。
上述实施例阐明的内容应当理解为这些实施例仅用于更清楚地说明本发明,而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本实施例的各种等价形式的修改均落入本发明所附权利要求所限定的范围。
- 一种液滴数字PCR芯片及液滴数字PCR装置
- 一种液滴数字PCR芯片及液滴数字PCR装置
