肿瘤特异性CTL细胞的培养方法及细胞治疗产品
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及细胞培养领域,具体而言,涉及一种肿瘤特异性CTL细胞的培养方法及细胞治疗产品。
背景技术
近年来,肿瘤的免疫治疗因其对于常规疗法无效的晚期肿瘤具有显著疗效而受到极大关注。肿瘤免疫治疗(Cancer immunotherapy)是利用自身免疫系统对恶性肿瘤细胞进行特异性杀伤,并尽可能地降低对正常组织的副作用。肿瘤免疫治疗是继化疗和靶向治疗后最具前景的肿瘤治疗方法之一。T细胞是目前认为唯一能够特异性杀伤肿瘤细胞的细胞。DC将抗原提呈给T细胞,诱导T细胞的活化和增殖,包括CD4+辅助性T细胞和CD8+杀伤性T细胞。肿瘤抗原特异性T细胞一直是肿瘤治疗的重要目标。
作为肿瘤免疫治疗的靶点,肿瘤新生抗原和肿瘤相关抗原已得到了研究者的充分关注。肿瘤相关抗原(TAA,Tumor-associated antigen)是在肿瘤细胞中表达升高的抗原分子,其在正常细胞中也有一定的表达。也被称为是“自身抗原”,例如癌睾丸抗原家族。因此,肿瘤相关抗原在机体内会发生中枢耐受,即针对肿瘤相关抗原的特异性T细胞会在胸腺中被清除。
肿瘤新生抗原是由体细胞基因突变产生的,是病人体内由于体细胞基因突变而产生的突变蛋白,之后通过抗原提呈激起T细胞应答并杀伤肿瘤细胞,达到精准治疗的效果。非同义点突变、插入缺失突变、移码突变、基因融合等均可产生肿瘤新生抗原。肿瘤新生抗原也叫肿瘤特异性抗原(TSA,tumor specific antigen)或“非自身“抗原。肿瘤新生抗原作为免疫治疗的靶点主要优势包括无中枢耐受、与主要组织相容性复合物(MHC,Majorhistocompatibility complex)分子亲和力强、降低了正常组织的脱靶副反应、安全性高等。有研究表明,接种新生抗原表位与接种肿瘤相关抗原的患者相比,新生抗原表位引起的免疫反应更强。以往鉴定的新型肿瘤抗原有限,但是随着二代测序和生物信息学技术的发展,从人类的正常组织样本和肿瘤样本中快速完成序列比对,找到个体肿瘤特异性抗原将会越来越容易。
T细胞过继疗法(Adoptive T-cell therapy,ACT)是一种非常有效的消灭病人体内恶性肿瘤的方法,肿瘤的周围往往会存在大量高度富含肿瘤特异性T细胞的肿瘤浸润淋巴细胞群(tumor infiltrating lymphocytes,TILs)。早在1985年,Rosenberg等就发现体内注射IL-2和LAK细胞可以使某些转移性黑素瘤维持长久地消退,提示有特异性T细胞扩增。但由于全身性的毒性反应及Treg的扩增导致疗效不佳,最终无法全身使用IL-2进行肿瘤治疗。进一步的体外实验发现,从黑素瘤中提取出来的淋巴细胞含有能识别自身肿瘤的特异性细胞。随后临床试验结果发现,自身肿瘤浸润淋巴细胞可以介导转移性黑素瘤的客观消退。在体外对T细胞进行分离、扩增以及激活,之后再将T细胞回输给病人,确实有着一定的优势。
但是,对肿瘤浸润淋巴细胞进行体外扩增并不总是具有可行性。尤其是对于一些已经发生转移的恶性肿瘤,比如乳腺癌或者结直肠癌,初始T细胞群难以获取且和肿瘤实质接触有限。还有一些其他的原因也阻止了TIL疗法的广泛应用,比如:早期分离步骤需要新鲜的肿瘤组织、TILs扩增有难度、扩增后的TIL细胞功能受损以及来自于肿瘤微环境的负向调节(如PD-L1的表达以及Treg的活化)等。
因此,在实际临床治疗上,作为这类癌症患者群体的替代治疗策略,从外周血中获得特异性T淋巴细胞也是一种比较有前景的方法,该方法可以容易接触到数量巨大的T细胞,即初始T细胞源于从外周血中采集到的外周血单核细胞(PBMC,Peripheral bloodmononuclear cell)。但是,因为肿瘤患者在进行ACT疗法之前,可能已经进行了一系列诸如药物治疗、放疗、化疗等治疗方式,其体内的免疫细胞已经基本充分激活,产生免疫耐受现象,患者的免疫细胞相对健康人更为脆弱,其体内T细胞在接受刺激之后进行分化扩增的能力偏弱,尤其是晚期肿瘤患者,其T细胞活性很低,往往在临床应用过程中很难扩增出所需目标数量的T细胞。因此,如何通过优化体外T细胞培养方式来增强T细胞增殖活化为肿瘤特异性T细胞的能力,是一个非常具有前景的技术改进方案。
在T细胞过继疗法中,将从患者体内的T细胞转到体外进行培养扩增,得到大量具有杀伤性的T细胞再对患者进行回输。主体上可根据T细胞来源划分为两大类主要方法:一类是基于TILs(肿瘤浸润淋巴细胞)的体外T细胞培养扩增;另一类是基于从外周血分离出的外周血单核细胞(PBMC)进行体外T细胞的培养扩增。
鉴于过继性T细胞疗法的广泛应用前景,现今已有多种方法对如何优化体外扩增T细胞产物进行了深度研究。目前已有较为成熟的制备工艺如下:
方案1:直接使用包被anti-CD3/CD28的磁珠作为刺激物从PBMC(外周血单核细胞)中扩增大量的初始T细胞。使用多克隆刺激物直接对PBMC或者是TILs中的T细胞进行扩增,该方法具有简单快速且可以短时间内获得大量T细胞的优点,已被应用于多种癌症的ACT疗法(T细胞过继性疗法),用作大量源于外周血的自体同源T细胞的传代培养。比如,公开号为CN107090433A和公开号为CN107254440A的专利申请公开了一类T细胞体外培养方法,该方法直接加入CD3单抗包被好的保护液或者anti-CD3/CD28抗体包被的磁珠对初始T细胞进行刺激和扩增。
方案2:公开号为CN108220234A的专利申请公开了一种非前哨淋巴结来源抗肿瘤T细胞的体外扩增方法。该方法直接使用人工合成的肿瘤新生抗原肽对PBMC进行预刺激,然后使用CD3/CD28的免疫磁珠对T细胞进行无差别刺激扩增,使得T细胞快速大量增殖分化,之后再次使用肿瘤新生抗原肽对T细胞进行重刺激。
方案3:公开号为CN108289910A的专利申请公开了一种HER2特异性TH1细胞的体外扩增方法。该方法将成熟DC负载上肿瘤新生抗原肽,得到HER2-肽脉冲I型树突状细胞,再将HER2-肽脉冲I型树突状细胞共培养刺激来扩增Th1细胞。这个刺激过程可以重复多次,得到更多数量比例更高的HER2特异性Th1细胞。
方案4:将DC和肿瘤裂解液或者将DC直接与肿瘤新生抗原肽进行混合培养,使得DC上装载有肿瘤新生抗原肽,据此制备出DC疫苗,随后将其疫苗接种到PBMC或者TILs初始T细胞中,经过DC疫苗刺激,PBMC或者TILS会部分分化为肿瘤特异性T细胞,之后再加入刺激物如耦连有anti-CD3/CD28抗体的磁珠对已有T细胞进行无差别扩增。利用负载有肿瘤新生抗原的DC作为DC疫苗,在磁珠非特异性扩增步骤之前加上疫苗刺激步骤。最终的T细胞产物中,肿瘤特异性T细胞的所占比例明显提升,特异性增强。
方案5:使用TILs方法,先从患者体内取出肿瘤组织,肿瘤组织周围存在有大量TILs,将TILs和肿瘤组织一起培养,随后加上IL-2等细胞因子,活化T细胞同时T细胞杀伤肿瘤细胞,最终肿瘤细胞逐渐死亡,再对剩下的具有肿瘤特异性杀伤作用的T细胞进行培养,之后对病人进行回输。这个方法增加了肿瘤特异性T细胞的数目,而且将它们从肿瘤抑制的环境中移出。该方法最早被应用于黑色素瘤病人中,对源于TILs细胞的T细胞进行扩增,最终结果显示客观反应率大约为50%。
然而,上述培养方法在获得肿瘤特异性CTL细胞(即细胞毒性T淋巴细胞)的数量和/或占比方面仍有待提高。
发明内容
本发明的主要目的在于提供一种肿瘤特异性T细胞的培养方法及细胞治疗产品,以提高T细胞培养物中肿瘤特异性CTL细胞的数量和/或占比。
为了实现上述目的,根据本发明的一个方面,提供了一种肿瘤特异性CTL细胞的培养方法,培养方法包括:将PBMC体外诱导分化为负载肿瘤新生抗原多肽的成熟DC;将成熟DC与CD8+细胞进行共培养,从而刺激CD8+细胞活化为CTL细胞;对CTL细胞进行扩增。
进一步地,将PBMC体外诱导分化为负载肿瘤新生抗原多肽的成熟DC包括:分离PMBC并从PBMC中分选出CD14+细胞和CD8+细胞;将CD14+细胞进行定向分化,得到分化DC;将肿瘤新生抗原多肽与分化DC共孵育,得到负载肿瘤新生抗原多肽的成熟DC。
进一步地,将CD14+细胞进行定向分化,得到分化DC包括:采用DC培养基对CD14+细胞进行重悬,得到重悬细胞;向重悬细胞中加入rh GM-CSF和rh IL-4进行定向分化,得到第一阶段分化细胞;向第一阶段分化细胞中加入成熟因子继续培养,得到分化DC;优选地,DC培养基为含人血白蛋白的培养基;更优选地,DC培养基通过在如下任一种培养基中添加人血白蛋白获得:AIM-V培养基、X-VIVO 15培养基及Cell Genix的树突细胞培养基,优选地,人血白蛋白在DC培养基中的体积浓度为2.5%,rh GM-CSF的工作浓度为10ng/mL~120ng/mL,rh IL-4的工作浓度为10ng/mL~120ng/mL;优选地,成熟因子选自如下任意一种或多种:rh GM-CSF、rh IL-4、rh IL-1β、rh IL-6、TNF-α、PGE-2及Poly(I:C);更优选地,各成熟因子的终浓度分别如下:rh GM-CSF的浓度为50ng/mL~200ng/mL,rh IL-4的浓度为50ng/mL~120ng/mL,rh IL-1β的浓度为10ng/mL~120ng/mL,rh IL-6的浓度为10ng/mL~120ng/mL,TNF-α的浓度为10ng/mL~120ng/mL,PEG-2的浓度为10ng/mL~1000ng/mL,Poly(I:C)的浓度为2μg/mL~40μg/mL;优选地,在第1~2天进行定向分化,在第3~5天进行继续培养,在第6~9天将肿瘤新生抗原多肽与分化DC进行共孵育,得到负载肿瘤新生抗原多肽的成熟DC;更优选地,肿瘤新生抗原多肽的终浓度为0.1~40μg/mL。
进一步地,将成熟DC与CD8+细胞进行共培养,从而刺激CD8+细胞活化为CTL细胞包括:采用成熟DC对CD8+细胞进行分段刺激,从而使CD8+细胞活化为CTL细胞;优选地,采用成熟DC对CD8+细胞进行预刺激共培养7~10天,得到预活化细胞;采用成熟DC对预活化细胞进行再刺激共培养1~2天,得到CTL细胞。
进一步地,对CTL细胞进行扩增包括:通过向CTL细胞中添加偶联CD3/CD28的单克隆抗体的磁珠或可溶性单克隆抗体的方式扩增CTL细胞,得到肿瘤特异性CTL细胞;优选地,将CTL细胞与偶联CD3/CD28单克隆抗体的磁珠或可溶性抗-CD3/CD28单克隆抗体进行共培养,优选共培养1~5天,然后转至细胞培养袋或G-REX瓶进行扩大培养,优选扩大培养5~12天,得到肿瘤特异性CTL细胞;优选地,扩大培养的密度保持在1×10
进一步地,CTL细胞与磁珠的体积比为100:1~400:1,优选为200:1;优选地,CTL细胞与偶联CD3/CD28单克隆抗体的磁珠或可溶性抗-CD3/CD28单克隆抗体进行共培养,共培养体系包含自体血浆、rh IL-21、rh IL-7和rh IL-15,自体血浆的体积含量为0~10%,优选为2~3%,rh IL-21的浓度为5~30ng/ml,优选为20ng/ml,rh IL-7的浓度为5~120ng/mL,优选为20ng/mL,rh IL-15的浓度为5~120ng/mL,优选为20ng/mL;优选地,可溶性抗-CD3/CD28单克隆抗体在共培养体系中的浓度为30~50ng/mL;优选地,在共培养过程中,根据如下任意一种或多种观察指标确定共培养的细胞是否需要添加培养基或者转孔:细胞形态、细胞数量或培养基颜色。
进一步地,分离PMBC并从PBMC中分选出CD14+细胞和CD8+细胞包括:将外周血或单采血混匀,离心收集下层血细胞;对血细胞采用DPBS稀释后,置于Ficoll分离液中离心分离,收集中间白膜层细胞,得到PBMC;采用CD14磁珠对PBMC进行孵育分选,收集CD14+细胞;向CD14-细胞中加入CD8磁珠进行孵育,分选出CD8+细胞;更优选地,在采用CD14磁珠对PBMC进行孵育分选之前,培养方法还包括将含PBMC的悬液进行筛网过滤的步骤;进一步优选地,将外周血或单采血混匀,在650~750g的转速下离心3~6min收集下层血细胞;采用含有2.5%HSA(V/V)的DPBS对血细胞进行稀释,然后置于Ficoll分离液中离心分离,收集中间白膜层细胞,得到PBMC;对PBMC进行筛网过滤后,向每10
进一步地,肿瘤新生抗原多肽选自如下任意一种或多种:KLMGIVYKV、SLDWWAFGV、VTFHIPFEV、AVGSYVYSV及KLASYDMRL。
进一步地,在预刺激共培养时,成熟DC与CD8+细胞的细胞数量比为1:2~1:40;优选地,在预刺激共培养和/或再刺激共培养的过程中,采用共刺激培养体系进行培养,其中,共刺激培养体系含有自体血浆、共刺激因子和无血清培养基;优选地,共刺激培养体系中自体血浆的体积含量为0~10%,更优选地为2%-3%;优选地,共刺激因子为rh IL-21,且rhIL-21在共刺激培养体系中的浓度为5~30ng/ml;更优选地为20ng/ml。
进一步地,在预刺激共培养和/或再刺激共培养的过程中,还包括补加细胞生长因子或将共培养的细胞进行转孔的步骤,优选地,补加的细胞生长因子为终浓度5~120ng/mL的rh IL-7和终浓度为5~120ng/mL的rh IL-15;更优选地,补加的rh IL-7的终浓度为20ng/mL以及rh IL-15的终浓度为20ng/mL。
根据本发明的另一方面,提供了一种细胞治疗产品,包括体外培养的肿瘤特异性CTL细胞,细胞治疗产品中的肿瘤特异性CTL细胞采用上述任一种培养方法培养得到。
应用本发明的技术方案,通过在使用负载有CD3/CD28的磁珠刺激T细胞进行无差别克隆之前,加入负载有肿瘤特异性抗原肽段的DC对PBMC进行二次刺激,并进一步对每个培养阶段所需时间进行调整和把控。这一方法使得最终的T细胞产物中肿瘤特异性CTL细胞的数量和比例显著提升,同时CTL细胞培养周期缩短。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1示出了本发明的实施例1中不同比例自体血浆对CTL细胞扩增及IFN-γ分泌量的影响;
图2示出了本发明的实施例2中不同DC与CD8+共培养比例对特异性CTL细胞培养的影响;
图3示出了本发明的实施例3中不同细胞生长因子对CTL细胞培养的影响;
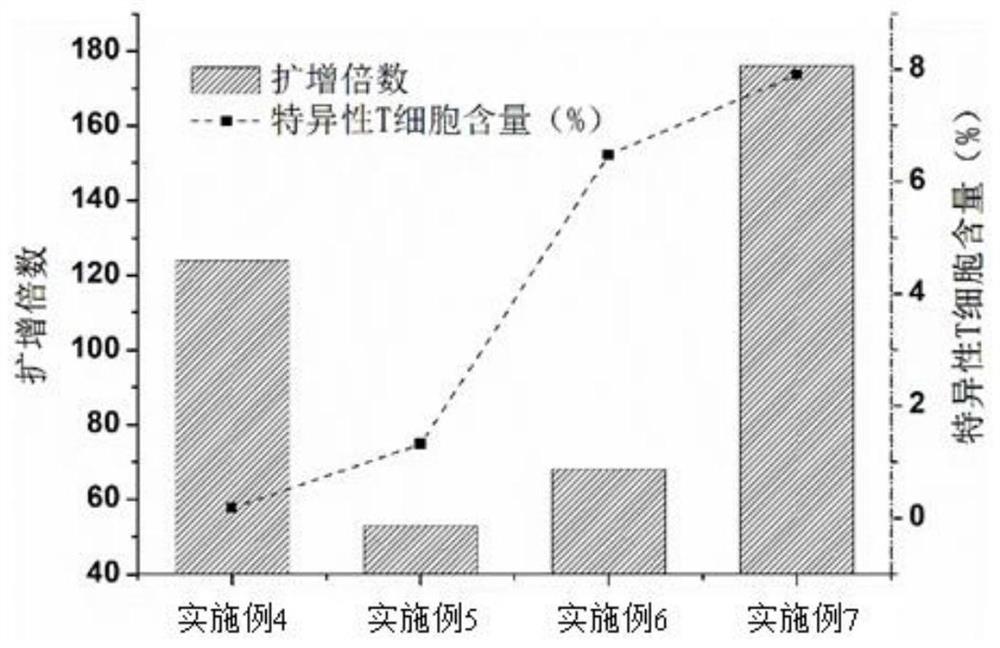
图4示出了根据本发明的实施例4至实施例7所得的细胞扩增倍数及特异性CTL细胞的含量;
图5示出了实施例4至实施例7所得的T细胞不同效靶比的细胞杀伤能力。
图6示出了实施例4至实施例7所得肿瘤特异性CTL细胞IFN-γ分泌量。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
术语解释:
PBMC:外周血单个核细胞,Peripheral Blood Mononuclear Cell。
DC:树突状细胞,Dendritic Cell。是目前发现的功能最强的抗原递呈细胞(Antigen Presenting Cell,APC)。
CTL:细胞毒性T淋巴细胞,又称杀伤性T淋巴细胞。专门分泌各种细胞因子参与免疫作用。对某些病毒、肿瘤细胞等抗原物质具有杀伤作用,与自然杀伤细胞(NK细胞)构成基体抗病毒、抗肿瘤免疫的重要防线。
DPBS:杜氏磷酸缓冲液,全称Dulbecco’s Phosphate Buffered Salin,与常用标准PBS相比不含钙镁离子。溶液的离子浓度和渗透压是等渗的,与人体相容。该缓冲液有助于提供和维持pH值稳定在7.2~7.6之间。常用来稀释或洗涤细胞。
rh GM-CSF:重组人粒细胞-巨噬细胞集落刺激因子。
rh IL-4:重组人白介素4。
Poly(I:C):聚肌胞苷酸,聚肌苷酸-聚胞苷酸是双链RNA的类似物,一条是Poly(I),另一条是Poly(C),是一种干扰素诱导剂,主要用于激活免疫淋巴细胞。
如背景技术中提到的,尽管目前已有一些肿瘤特异性CTL细胞的培养方法,但这些方法仍无法满足使用要求,为改善这一现状,本申请尝试提供一种新的培养方法。首先,发明人对现有方法进行了研究分析,并发现现有的这些方案往往只考虑到某一方面的诉求而忽略其他结果指标,或者由于工艺设计不完整,导致最终产物并不能达到实际要求。具体而言,针对背景技术中提到的各个方案,均有着其独特的缺陷所在,详述如下。
方案1:直接使用多克隆刺激物对PBMC(外周血单核细胞)进行无差别扩增,虽然操作简单、快速有效,但是使用类似于anti-CD3/CD28包被磁珠的多克隆刺激物,只能够扩增极少数的自发性诱导的肿瘤特异性T细胞,同时会得到大量的非肿瘤相关T细胞,因而靶向性弱且毒副反应较强。
方案2:直接使用新生抗原肽段对PBMC进行刺激,之后再对经受过刺激的T细胞进行无差别扩增和重刺激。该方法主要存在的问题是,直接使用抗原肽去激活PBMC中的特异性细胞,递呈效果远低于专职抗原提呈细胞(如DC)。
方案3:通过将成熟DC负载上肿瘤新生抗原肽,得到HER2-肽脉冲I型树突状细胞,再将HER2-肽脉冲I型树突状细胞共培养来扩增Th1细胞。这个刺激过程可以重复多次,从而得到更多数量且比例更高的HER2特异性Th1细胞。该方法的主要缺点是,培养的时间周期长且操作复杂,另外肿瘤特异性T细胞的所占比例虽然有所提升,但是最终的特异性T细胞的数量提升有限。
方案4:使用负载有肿瘤新生抗原的DC对初始T细胞进行刺激,之后再使用CD3/CD28包被的磁珠进行无差别扩增。该方法在最终细胞产物中,肿瘤特异性T细胞的数量虽然有所提升,但是最终肿瘤特异性T细胞的所占比例提升有限。
方案5:直接使用TILs方法,从肿瘤组织获取肿瘤浸润淋巴细胞,虽然该方法有着一定的优势。但是其操作较为复杂,而且该方法在早期分离步骤中需要获取新鲜的肿瘤组织,对于某些恶性肿瘤这个条件并不容易满足;与此同时,随后的种种处理会使得TILs遭受损伤,存在最终生成的T细胞功能缺失等问题。
综合上述现有方法的缺陷,本申请提出了一种改进的高效培养肿瘤特异性CTL细胞的方法,并经过试验验证该方法不仅能够缩短培养时间,而且能够得到更多数量且占比更高的肿瘤特异性CTL细胞。在该试验结果的基础上,申请人提出了本申请的技术方案,详述如下。
在本申请一种典型的实施方式中,提供了一种肿瘤特异性CTL细胞的培养方法,该培养方法包括:将PBMC体外诱导分化为成熟DC;将成熟DC与CD8+细胞进行共培养,从而刺激CD8+细胞活化为CTL细胞;将CTL细胞进行扩增。该培养方法在对CTL细胞进行无差别克隆之前,先采用负载有肿瘤特异性抗原肽段的成熟DC对从PBMC中分选出来的CD8+细胞进行刺激活化,使得最终的T细胞产物中肿瘤特异性CTL细胞的数量和比例显著提升,相应地,非肿瘤相关T细胞比例减少,因而靶向性提高而毒副作用减弱,同时CTL细胞培养周期缩短。
DC细胞需要从其他种类细胞(包括PBMC、脐带血CD34+细胞、骨髓等,其中PBMC最容易获取、数量也最多,临床上被广泛用作DC的来源细胞)诱导分化而来,且可分为不同的成熟阶段,通常分2个步骤来进行培养:1)从DC的祖细胞(如PBMC)诱导分化为未成熟DC(immature DC,iDC);2)从iDC诱导分化为成熟DC(mature DC,mDC)。上述将PBMC体外诱导分化为成熟DC的操作步骤,可以采用现有的DC细胞的分化方法,或者在其基础上进行改进得到。在一种优选实施例中,将PBMC体外诱导分化为成熟DC包括:分离PMBC并从PBMC中分选出CD14+细胞和CD8+细胞;将CD14+细胞进行定向分化,得到分化DC;将肿瘤新生抗原多肽与分化DC共孵育,得到负载肿瘤新生抗原多肽的成熟DC。
与采用抗原多肽直接激活T细胞扩增成抗原特异性CTL细胞功能弱相比,本申请中选择采用DC作为抗原递呈细胞,将负载肿瘤新生抗原多肽的DC与CTL细胞进行共培养,提高多肽-MHC的递呈能力,从而提高激活CTL细胞的功能。
另外,在本申请中,初始T细胞源于外周血,并非是从新鲜肿瘤样本中获取而来。由于外周血取材容易且可以接触到大量的T细胞,不存在现有TILs方法中的因为取材和实验步骤造成的种种问题,比如TILs方法对于已经发生转移的恶性肿瘤难以应用,初始T细胞群难以获取且与肿瘤实质接触有限,在早期分离步骤中需要新鲜的肿瘤组织、TILs扩增有难度、扩增后的TIL细胞功能受损以及来自于肿瘤微环境的负向调节(如PD-L1的表达以及Treg的活化等。本申请中采用PBMC作为初始T细胞来源,从而能够避免上述问题。
此外,本申请中虽以PBMC作为初始T细胞来源,但是先将PBMC体外诱导分化为成熟DC,再将成熟DC与CD8+细胞共培养,刺激CD8+细胞活化为CTL细胞,最后再特异性扩增CTL细胞,而非直接对PBMC进行激活扩增,是考虑到PBMC中包含T、B、NK细胞、单核细胞、树突状细胞等多种细胞类型。而发挥杀伤作用的是CD8+细胞毒性T淋巴细胞(即CD8+CTL)。若直接使用PBMC细胞进行扩增,不仅激活扩增了CD8+细胞,还扩增了其它淋巴细胞,从而导致得到的CD8+CTL细胞的特异性比例数量降低。因而运用本申请方法得到的CTL的抗肿瘤效果比刺激PBMC细胞得到的CTL的抗肿瘤效果好。
在一种优选实施例中,将CD14+细胞进行定向分化,得到分化DC包括:采用培养基对CD14+细胞进行重悬,得到重悬细胞;向重悬细胞中加入rh GM-CSF和rh IL-4进行定向分化,得到第一阶段分化细胞;向第一阶段分化细胞中加入成熟因子继续培养,得到分化DC。
在一种优选实施例中,上述培养基为含人血白蛋白的培养基;更优选地,该培养基通过在如下任一种培养基中添加人血白蛋白获得:AIM-V培养基,X-VIVO 15培养基及CellGenix的树突细胞培养基;优选地,人血白蛋白在DC培养基中的体积浓度为2.5%,rh GM-CSF的浓度为10ng/mL~120ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),更优选为80~100ng/mL,rh IL-4的浓度为10ng/mL~120ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),更优选为80~100ng/mL。
在一种优选实施例中,成熟因子选自如下任意一种或多种:rh GM-CSF、rh IL-4、rh IL-1β、rh IL-6、TNF-α、PGE-2及Poly(I:C);更优选地,各成熟因子的终浓度分别如下:rh GM-CSF的浓度为50ng/mL~200ng/mL(比如可以是50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL、120ng/mL、130ng/mL、140ng/mL、150ng/mL、160ng/mL、170ng/mL、180ng/mL、190ng/mL或200ng/mL),进一步优选为100ng/mL;rh IL-4的浓度为50ng/mL~120ng/mL(比如可以是50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),进一步优选为100ng/mL;rh IL-1β的浓度为10ng/mL~120ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),进一步优选为40ng/mL;rh IL-6的浓度为10ng/mL~120ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),进一步优选为40ng/mL;TNF-α的浓度为10ng/mL~120ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL),进一步优选为20ng/mL;PEG-2的浓度为10ng/mL~1000ng/mL,进一步优选为150~250ng/mL(比如可以是10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL、70ng/mL、80ng/mL、90ng/mL、100ng/mL、110ng/mL或120ng/mL、200ng/mL、300ng/mL、400ng/mL、500ng/mL、600ng/mL、700ng/mL、800ng/mL、900ng/mL或1000ng/mL),Poly(I:C)的浓度为2μg/mL~40μg/mL,进一步优选为15μg/mL~25μg/mL(比如可以是20ng/mL、25ng/mL、30ng/mL、35ng/mL或40ng/mL)。
在一种优选实施例中,在第1~2天进行定向分化,在第3~5天进行继续培养,在第6~9天将肿瘤新生抗原多肽与分化DC进行共孵育,得到成熟DC。
在一种优选实施例中,肿瘤新生抗原多肽的终浓度为0.1~40μg/mL,更优选为5~20μg/mL,最优选为10μg/mL。肿瘤新生抗原多肽可以根据肿瘤类型的不同,进行合理选择。
上述优选实施例中,rh GM-CSF是一种造血生长因子,在体外可刺激中性粒细胞和巨噬细胞集落的形成,促进单核细胞向大巨噬样细胞分化,细胞表面MHC II类分子的表达得以提高,从而增强细胞的抗原递呈功能。此外,rh GM-CSF也可以促进DC的存活。rh IL-4在由单核细胞诱导成DC的过程中发挥的作用是抑制巨噬细胞的过度生长,从而引导单核细胞向DC方向分化。若培养体系中不加rh IL-4,单核细胞将分化为巨噬细胞。同时rh IL-4还有降低细胞表面表达CD14分子的能力,CD14表达水平的降低是PBMC分化为DC的重要标志。rh GM-CSF和rh IL-4共同作用可使PBMC定向分化为未成熟DC(iDC),此时的DC具有较强的抗原摄取和加工能力,但抗原递呈能力很弱。细胞表面中度表达MHC I类、II类分子和B7家族分子(CD80、CD86等),但不表达或低表达CD14。上述优选实施例中,向重悬细胞中加入上述浓度范围的rh GM-CSF和rh IL-4进行定向分化,得到第一阶段分化细胞,其采用的是添加人血白蛋白的DC培养基,其中,在该DC培养基中人血白蛋白的添加体积含量为2.5%时,具有一定的诱导分化为iDC的能力。
rh IL-1β、rh IL-6和TNF-α均为促炎症因子,这3种细胞因子均可以下调未成熟DC的巨胞饮作用和表面Fc受体的表达,上调细胞表面MHC I类、II类分子和B7家族分子的表达,能够在体外培养体系中使未成熟DC分化为成熟DC,此时,DC的抗原摄取和加工能力明显减弱,而抗原递呈能力显著增强,可极强地激活T细胞。三因子组合抗原在无小牛血清培养条件下诱导DC的完全成熟,从而制备出可应用于临床的DC。在上述三因子组合中添加PGE2(Prostaglandin E2,前列腺素E2)可进一步提高DC的产量、成熟度、迁移能力和免疫激活能力。rh IL-1β、rh IL-6和TNF-α诱导成熟的DC迁移能力较弱,不能很好地抵达淋巴结而激活T细胞,而添加PGE2后能够诱导成熟DC因表面趋化因子受体的高表达,而更容易迁移至淋巴结,而引起机体对抗肿瘤的免疫反应。这四种因子的组合广泛应用于临床,并被认为是制备成熟DC的“金标准”,典型的工作浓度分别为rh IL-1β10ng/ml、rh IL-6 1000U/ml、TNF-α10ng/ml以及PGE2 1mg/ml。
需要说明的是PGE2不能添加到DC诱导分化的第一步中,如果在第一步加入了,则DC的分化将会被抑制。培养体系中所使用的无血清培养基种类的不同也可能会导致添加PGE2诱导成熟的DC在性质上的差异,因而临床上制备DC时最好能做充分的前期研究,然后确定用于治疗某种肿瘤最好的制备方法。本申请的上述优选实施例中,成熟因子除了上述四种因子外,还包括了rh GM-CSF、rh IL-4及Poly(I:C),Poly(I:C)即聚肌胞苷酸,聚肌苷酸-聚胞苷酸是双链RNA的类似物,一条是Poly(I),另一条是Poly(C),是一种干扰素诱导剂,主要用于激活免疫淋巴细胞。采用这三种因子与前述四种因子共同诱导iDC分化为mDC,具有使定向诱导的DC细胞高表达HLA-DR、CD86和CD83等,且在无细胞因子的培养基中培养24~48h,DC仍能保持其稳定的成熟度的优异性能。而将各成熟因子的工作浓度控制在上述优选范围内时,具有诱导的DC贴壁少、收获率高,且表面标志物分子表达高的有益效果。在一种更优选的实施例中,rh GM-CSF的浓度为50ng/mL~200ng/mL,rh IL-4的浓度为50ng/mL~120ng/mL,rh IL-1β的浓度为10ng/mL~120ng/mL,rh IL-6的浓度为10ng/mL~120ng/mL,TNF-α的浓度为10ng/mL~120ng/mL,PEG-2的浓度为10ng/mL~1000ng/mL,Poly(I:C)的浓度为2g/mL~40μg/mL。最优选地,各成熟因子的工作浓度分别为:rh GM-CSF的浓度为100ng/mL,rh IL-4的浓度为80ng/mL,rh IL-1β的浓度为40ng/mL,rh IL-6的浓度为40ng/mL,TNF-α的浓度为20ng/mL,PEG-2的浓度为200ng/mL,Poly(I:C)的浓度为20μg/mL。
在诱导iDC分化为mDC的过程中,通过采用肿瘤新生抗原肽与分化的DC共培养来刺激成熟DC表面递呈肿瘤抗原多肽,进而能够更有效地刺激活化CD8+细胞,从而有助于获得更高比例的肿瘤特异性CTL细胞。
在一种优选实施例中,将成熟DC与CD8+细胞进行共培养,从而刺激CD8+细胞活化为CTL细胞包括:采用成熟DC对CD8+细胞进行分段刺激,从而使CD8+细胞活化为CTL细胞;优选地,采用成熟DC对CD8+细胞进行预刺激共培养7~10天,得到预活化细胞;采用成熟DC对预活化细胞进行再刺激共培养1~2天,得到CTL细胞,并对CTL细胞进行大量扩增。
通过使用负载有肿瘤新生抗原多肽的成熟DC细胞对CD8+细胞进行预刺激和重刺激,有助于使最终制备出的T细胞产物中,肿瘤特异性CTL细胞所占比例提高,非肿瘤相关T细胞比例减少,靶向性提高而毒副作用减弱。通过控制预刺激共培养的时间在7~10天,而再刺激共培养的时间为1~2天,使得能在短时间内,有效地激活产生大量肿瘤特异性CTL细胞,从而既提高了肿瘤特异性CTL细胞的含量,也缩短了细胞培养时间。
上述对CTL细胞进行扩增的步骤是大量扩增细胞以提高培养的CTL细胞的总量,其具体步骤与现有的无差别大量扩增的步骤类似。在一种优选实施例中,对CTL细胞进行扩增包括:通过向CTL细胞中添加偶联CD3/CD28的单克隆抗体的磁珠或可溶性单克隆抗体的方式扩增CTL细胞;优选地,将CTL细胞与偶联CD3/CD28单克隆抗体的磁珠或可溶性抗-CD3/CD28单克隆抗体进行共培养,优选共培养1~5天,然后转至细胞培养袋或G-REX瓶进行扩大培养,优选扩大培养5~12天;优选地,扩大培养的密度保持在1×10
上述CTL细胞的大量扩增步骤中,采用偶联CD3/CD28的单克隆抗体的磁珠或可溶性抗-CD3/CD28单克隆抗体进行共培养,能够提供T细胞激活与扩增所需的主要及协同刺激信号,因而采用这样的方式进行扩增,能够在短时间内实现大量扩增。偶联了CD3/CD28的单克隆抗体的磁珠,能够提供T细胞活化和扩增所需的初级和共刺激信号,被激活的T细胞产生rh IL-2、rh GM-CSF、INFγ和TNF-α,发挥T细胞的作用和功能。偶联CD3/CD28的单克隆抗体的磁珠激活的T细胞能够在9-14天的培养期内扩增100~1000倍。
上述优选实施例中,基于培养时间、肿瘤新生抗原激活T细胞所需条件考虑,先共培养1~5天然后再转移至细胞培养袋或G-REX瓶进行扩大培养5~12天。在扩大培养阶段,控制培养的细胞密度在1×10
为了进一步提高CTL细胞的扩增速度,在一种优选实施例中,CTL细胞与磁珠的体积比为100:1~400:1,优选为200:1,在该体积比下具有刺激效果好,细胞扩增速度快的优势。更优选地,CTL细胞与偶联CD3/CD28单克隆抗体的磁珠或可溶性抗-CD3/CD28单克隆抗体进行共培养,且共培养体系包含体积含量为0~10%的自体血浆(优选为1%~5%,更优选为1%~3%,进一步优选为2%~3%)、浓度为5~30ng/ml的rh IL-21(优选为10~30ng/ml,更优选为20ng/ml)、浓度为5~120ng/mL的rh IL-7(优选为15~25ng/mL,更优选为20ng/mL)和浓度为5~120ng/mL的rh IL-15(优选为15~25ng/mL,更优选为20ng/mL),在共培养体系中添加自体血浆、rh IL-7和rh IL-15,有助于CTL细胞的生长和维持,控制在上述含量范围内,能够使CTL细胞在短期内显著增殖,抑制其老化。
更优选地,可溶性抗-CD3/CD28单克隆抗体在共培养体系中的浓度为30~50ng/mL,在该浓度下促进CTL细胞增殖的效果更显著;更优选地,在共培养过程中,为获得更高的扩增量,在培养期间观察细胞培养状态,并根据如下任意一种或多种观察指标确定共培养的细胞是否需要添加培养基或者转孔:细胞形态、细胞数量或培养基颜色。若细胞集落出现、细胞数量增多、培养基颜色变黄,则需要添加培养基或者转孔。
上述优选的实施例中,在使用负载有新生抗原肽的成熟DC细胞对T细胞进行重刺激之后,使用偶联抗-CD3/CD28的免疫磁珠对T细胞进行无差别刺激扩增。制备出的最终T细胞产物中,肿瘤特异性CTL细胞的总数量显著提升。与此同时经过培养工艺条件的改进,制备肿瘤特异性CTL细胞的生产周期也进一步缩短。
在一种优选实施例中,分离PMBC并从PBMC中分选出CD14+细胞和CD8+细胞包括:将外周血或单采血混匀,离心收集下层血细胞;对血细胞采用DPBS稀释后,置于Ficoll分离液中离心分离,收集中间白膜层细胞,即为PBMC;采用CD14磁珠对PBMC进行孵育分选,收集CD14+细胞;向CD14-细胞中加入CD8磁珠进行孵育,分选出CD8+细胞;更优选地,在采用CD14磁珠对PBMC进行孵育分选之前,培养方法还包括将含PBMC的悬液进行筛网过滤的步骤,进一步优选筛网的孔径为20~60μm。
在一种优选实施例中,将外周血或单采血混匀,在650~750g的转速下离心3~6min收集下层血细胞;采用含有2.5%HSA(v/v)的DPBS对血细胞进行稀释,然后置于Ficoll分离液中离心分离,收集中间白膜层细胞,得到PBMC;对PBMC进行筛网过滤后,向每10
本申请中的肿瘤新生抗原多肽,根据具体肿瘤类型的不同而不同。多肽序列可以通过已有报道获得,或者通过正常样本和肿瘤样本比较获得。若通过比较获得,其具体比较所采用的方法或分析软件均无特殊限定。比如,可以采用华大吉诺因自主研发的生物信息软件筛选的肿瘤新生抗原多肽。在一种优选实施例中,肿瘤新生抗原多肽选自如下任意一种或多种:SEQ ID NO:1(氨基酸序列:KLMGIVYKV)、SEQ ID NO:2(氨基酸序列:SLDWWAFGV)、SEQ ID NO:3(氨基酸序列:VTFHIPFEV)、SEQ ID NO:4(氨基酸序列:AVGSYVYSV)及SEQ IDNO:5(氨基酸序列:KLASYDMRL)。
在一种优选实施例中,在预刺激共培养时,成熟DC与CD8+细胞的细胞数量比为1:2~1:40,更优选为1:8~1:20,进一步优选为1:10~1:20。控制在比例范围内,对T细胞的刺激活化作用更强,进而有利于产生更高比例的肿瘤特异性CTL细胞。为进一步提高肿瘤特异性CTL细胞的刺激活化比例,优选地,采用共刺激培养体系进行预刺激共培养和/或再刺激共培养,其中共刺激培养体系含有自体血浆、共刺激因子和无血清培养基;优选地,共刺激培养体系中自体血浆的体积含量为0~10%,更优选地为2%-3%;优选地,共刺激因子为rhIL-21,且rh IL-21在共刺激培养体系中的浓度为5~30ng/ml,更优选地为20ng/ml。
在上述共刺激培养的基础上,为进一步减少或避免细胞增殖过程中受营养或环境的影响,优选地,在预刺激共培养和/或再刺激共培养的过程中,还包括补加细胞生长因子或将共培养的细胞进行转孔的步骤,优选地,补加的细胞生长因子为rh IL-7和rh IL-15,且补加的rh IL-7的终浓度为5~120ng/mL,补加的rh IL-15的终浓度为5~120ng/mL,进一步优选地,向培养基中补加终浓度分别为15~20ng/mL的rh IL-7和15~20ng/mL的rh IL-15,最优选地,向培养基中补加终浓度分别为20ng/mL的rh IL-7和20ng/mL的rh IL-15;通过补加上述终浓度的细胞生长因子rh IL-7和rh IL-15,能够进一步促进T细胞的增殖。
根据本申请的第二个方面,提供了一种细胞治疗产品,该细胞治疗产品包括体外培养的肿瘤特异性T细胞,其中的肿瘤特异性T细胞采用前述任一种培养方法培养得到。该培养方法得到的T细胞培养物中,肿瘤特异性CTL细胞的细胞总数量和占比均显著提升,因而适合包括TCR-T、CAR-T、DC-CIK或DC-CTL在内的细胞疗法中相应细胞的制备。
以下通过实施例来进一步阐述本发明的培养方法的有益效果。
需要说明的是,以下实施例中未注明条件者,均按照常规条件或者生产商建议的条件执行。实施例中所用的仪器或物料,均为可以通过市购得到的常规商品。
第一部分,培养条件的优化
实施例1:自体血浆对CTL细胞培养的影响
步骤1:PBMC的分离及分选;
将外周血或单采血混匀,离心收集下层血细胞。血细胞用DPBS稀释后,加于Ficoll分离液中,离心分离。收集中间白膜层细胞,即为外周血单个核细胞(PBMC)。离心条件为700g,5min,DPBS(Gibco)中含有2.5%HSA(v/v)。
将PBMC悬液过筛网,离心,加入CD14磁珠(Miltenyi Biotec)孵育,过柱分选,收集CD14+细胞。再于CD14-细胞中加入CD8磁珠(Miltenyi Biotec)孵育,分选出CD8+细胞。
过筛网后的PBMC,每10
步骤2:接种CD14+细胞,体外诱导分化成为成熟DC;
分选得到的CD14+细胞,使用含人血白蛋白(HSA)的DC培养基重悬,加入rh GM-CSF,rh IL-4,定向分化。第4天加入成熟因子rh GM-CSF、rh IL-4、rh IL-1β、rh IL-6,TNF-α、PGE-2、Poly I:C,继续培养。第5天将肿瘤新生抗原多肽与DC共孵育,然后收集成熟DC。
培养DC细胞的培养基通过在AIM V培养基中加入HSA获得,其中HSA的浓度为2%(v/v),rh GM-CSF的浓度100ng/mL,rh IL-4的浓度100ng/mL。
第4天加入成熟诱导因子组合,rh GM-CSF的浓度100ng/mL,rh IL-4的浓度100ng/mL,rh IL-6的浓度40ng/mL,TNF-α的浓度20ng/mL,rh IL-1β的浓度40ng/mL,PEG-2的浓度200ng/mL,Poly(I:C)的浓度20μg/mL,第5天负载肿瘤新生抗原多肽,多肽终浓度10μg/mL。
使用以下肿瘤新生抗原多肽,编号分别是SEQ ID NO:1(序列:KLMGIVYKV),SEQ IDNO:2(序列:SLDWWAFGV),SEQ ID NO:3(序列:VTFHIPFEV),SEQ ID NO:4(序列:AVGSYVYSV)及SEQ ID NO:5(序列:KLASYDMRL)。
步骤3:将负载多肽的成熟DC与CD8+细胞进行共培养,刺激活化为CTL细胞;
将负载多肽的成熟DC和CD8+细胞一起加入到HIPP-T009淋巴细胞无血清培养基中,再加入自体血浆和共刺激因子rh IL-21,进行预刺激,自体血浆添加量分别为0%、1%、3%及5%,rh IL-21的终浓度为20ng/ml。培养三天后添加细胞生长因子rh IL-7和rh IL-15,共培养7天后收集细胞,检测T细胞扩增倍数及IFN-γ分泌量。
图1示出了不同比例自体血浆(0%、1%、3%、5%)对特异性T细胞的扩增倍数及Elispot IFN-γ分泌量的影响。从0%到3%,T细胞扩增倍数随着自体血浆比例的提高而显著提高,当血浆比例从3%上升到5%,扩增倍数增长缓慢,基本处于平台期。
血浆比例为5%培养的特异性T细胞IFN-γ分泌量最高,血浆比例为1%培养的T细胞,其IFN-γ分泌量为95000,高于3%自体血浆培养的T细胞IFN-γ分泌量,无血浆培养的T细胞IFN-γ分泌量最低,仅为66000。
考虑到自体血浆采集量有限,结合T细胞扩增倍数及IFN-γ分泌量,1%~3%即能够满足T细胞的培养,因而优先选择2%的自体血浆进行CTL细胞扩增培养。
实施例2:DC与CD8+共培养比例对特异性T细胞扩增的影响
步骤1和步骤2同实施例1。
步骤3:将负载多肽的成熟DC与CD8+细胞进行共培养,刺激活化为CTL细胞;
将负载多肽的成熟DC和CD8+细胞一起加入到HIPP-T009淋巴细胞无血清培养基中,并向其中加入终浓度为20ng/mL的共刺激因子rh IL-21和体积浓度为2%的自体血浆进行预刺激,共培养的成熟DC与CD8+细胞数量比例分别为1:4、1:8、1:10及1:20,共培养时间为7天,检测T细胞扩增倍数和IFN-γ分泌量。
结果见图2。图2示出了DC与CD8+不同培养比例(1:4、1:8、1:10、1:20)对T细胞扩增倍数及IFN-γ分泌量的影响。共培养比例1:4、1:8、1:10到1:20,扩增倍数依次是13.7倍、12.3倍、12.3倍、13.3倍。
当DC:CD8+共培养比例1:10,特异性T细胞IFN-γ分泌量最高,高于1:20,DC:T比例1:4时,培养的特异性T细胞IFN-γ分泌量最低。
结合扩增倍数及IFN-γ分泌量,成熟DC对CD8+细胞进行预刺激,共培养细胞数量比例为1:10时,培养的CTL细胞数量及特异性比例最高。
实施例3:细胞生长因子对T细胞培养的影响
步骤1和2同实施例1。
步骤3:将DC与CD8+细胞进行共培养,刺激活化为CTL细胞;
将负载多肽的成熟DC和CD8+细胞一起加入到HIPP-T009淋巴细胞无血清培养基中进行共培养,并向培养体系中添加终浓度为20ng/ml的rh IL-21和2%(v/v)的自体血浆,共培养细胞数量比例为DC:CD8+=1:10,共培养时间为7天。其中,共培养的培养基中还分别添加了如下细胞生长因子:
A组:rh IL-2终浓度5ng/ml;
B组:rh IL-7终浓度20ng/ml,rh IL-15终浓度20ng/ml;
C组:rh IL-7终浓度10ng/ml,rh IL-15终浓度10ng/ml;
比较不同细胞因子培养的T细胞的扩增倍数和IFN-γ分泌量。结果见图3。
图3示出了A、B、C三组不同的细胞生长因子对T细胞培养的影响。其中A组:rh IL-2终浓度5ng/ml;B组:rh IL-7终浓度20ng/ml,rh IL-15终浓度20ng/ml;C组:rh IL-7终浓度10ng/ml,rh IL-15终浓度10ng/ml。当DC与CD8+共培养,刺激活化为CTL细胞,培养基中添加rh IL-7终浓度20ng/ml,rh IL-15终浓度20ng/ml,培养的CTL细胞扩增16.1倍,其IFN-γ分泌量36000,高于A组,CTL细胞扩增倍数14.6倍,IFN-γ分泌量5200和C组,扩增倍数13.9倍,IFN-γ分泌量17200。
因此,培养基中添加细胞生长因子rh IL-7终浓度20ng/ml,rh IL-15终浓度20ng/ml,进行特异性CTL细胞培养。
第二部分,该部分重点通过采用本申请改进思路的实施例7与现有常规方法扩扩增得到的肿瘤新生抗原特异性CTL细胞,在数量、所占比例及抗肿瘤能力等方面进行对比。其中,各实施例所涉及的培养条件均采用上述优化的培养条件。
实施例4
本实施例是将PBMC直接进行非特异性扩增,具体操作包括如下步骤:
将外周血或单采血混匀,离心收集下层血细胞。血细胞用DPBS稀释后,加于Ficoll分离液中,离心分离。收集中间白膜层细胞,即为外周血单个核细胞(PBMC)。其中,离心条件为700g,5min,DPBS(Gibco)中含有2.5%HSA(V/V)。
将PBMC与偶联CD3/CD28的免疫磁珠(Miltenyi Biotec)进行共培养,PBMC与CD3/CD28的添加比例为PBMC:beads=200:1(V/V)。
该共培养步骤中的基础培养基为HIPP-T009淋巴细胞无血清培养基(购自倍谙基生物科技有限公司),向其中进一步添加自体血浆、共刺激因子和细胞因子得到共培养体系,其中共培养体系包含2%自体血浆,20ng/ml rh IL-21、20ng/mLrh IL-7、20ng/mLrhIL-15。培养期间观察细胞培养状态,观察指标包括:细胞形态,细胞数量,培养基颜色。若细胞集落出现、细胞数量增多、培养基颜色变黄,需要添加培养基或者转孔。
快速扩增阶段共培养2天后,洗去残留磁珠,将细胞转至细胞培养袋或G-REX瓶进行大量扩增培养,细胞转孔密度为(2×10
实施例5
本实施例是用肿瘤新生抗原刺激PBMC后,进行非特异性扩增,再次用抗原进行重刺激,具体操作包括如下步骤:
将外周血或单采血混匀,离心收集下层血细胞。血细胞用DPBS稀释后,加于Ficoll分离液中,离心分离。收集中间白膜层细胞,即为外周血单个核细胞(PBMC)。离心条件为700g,5min,DPBS(Gibco)中含有2.5%HSA(V/V)。
肿瘤新生抗原肽对PBMC进行预刺激3天,培养期间根据细胞培养状态,决定是否补添加培养基或者转孔。DC培养基中HSA的含量为2%(v/v),rh GM-CSF的浓度100ng/mL,rhIL-4的浓度100ng/mL。
使用以下肿瘤新生抗原多肽,编号分别是SEQ ID NO:1(氨基酸序列:KLMGIVYKV),SEQ ID NO:2(氨基酸序列:SLDWWAFGV),SEQ ID NO:3(氨基酸序列:VTFHIPFEV),SEQ IDNO:4(氨基酸序列:AVGSYVYSV)及SEQ ID NO:5(氨基酸序列:KLASYDMRL)。
将PBMC与偶联CD3/CD28的免疫磁珠(Miltenyi Biotec)进行共培养,PBMC与CD3/CD28的比例为PBMC:beads=200:1(V/V)。基础培养基为HIPP-T009淋巴细胞无血清培养基(倍谙基),在此基础上添加自体血浆、共刺激因子及细胞因子得到共培养体系。其中,共培养体系包含2%(v/v)自体血浆,20ng/ml rh IL-21。培养期间观察细胞培养状态,观察指标包括:细胞形态,细胞数量,培养基颜色。若细胞集落出现、细胞数量增多、培养基颜色变黄,需要添加培养基或者转孔。
共培养3天后,洗去残留磁珠,将细胞转至细胞培养袋或G-REX瓶进行大量扩增培养,细胞转孔密度为2×10
将扩增后的PBMC与肿瘤新生抗原共培养,共培养的培养体系为HIPP-T009淋巴细胞无血清培养基中添加终浓度为20ng/mL的rh IL-7和终浓度为20ng/mL的rh IL-15。共培养3天,进行重刺激。培养期间根据细胞培养状态,决定是否补添加培养基或者转孔。
实施例6
本实施例是用负载肿瘤新生抗原的DC刺激T细胞后,然后再次使用DC重刺激T细胞,进行特异性扩增,具体操作包括如下步骤:
将外周血或单采血混匀,离心收集下层血细胞。血细胞用DPBS稀释后,加于Ficoll分离液中,离心分离。收集中间白膜层细胞,即为外周血单个核细胞(PBMC)。离心条件为700g,5min,DPBS(Gibco)中含有2.5%HSA(v/v)。
将PBMC悬液过筛网,离心,加入CD14磁珠(Miltenyi Biotec)孵育,过柱分选,收集CD14+细胞。再于CD14-细胞中加入CD8磁珠(Miltenyi Biotec)孵育,分选出CD8+细胞。
过筛网后的PBMC,每10
分选得到的CD14+细胞,使用含人血白蛋白(HSA)的DC培养基重悬,加入rh GM-CSF,rh IL-4,定向分化。第4天加入成熟因子rh GM-CSF、rh IL-4、rh IL-1β、rh IL-6,TNF-α、PGE-2、Poly I:C,继续培养。第5天将肿瘤新生抗原多肽与DC共孵育,然后收集成熟DC。
其中,含人血白蛋白的DC培养基通过在AIM V培养基加入HAS获得,其中HAS在DC培养基中的浓度为2%(v/v),加入的rh GM-CSF浓度为100ng/mL,rh IL-4浓度为100ng/mL。
第4天加入成熟诱导因子组合,rh GM-CSF的浓度100ng/mL,rh IL-4的浓度100ng/mL,rh IL-6的浓度40ng/mL,TNF-α的浓度20ng/mL,rh IL-1β的浓度40ng/mL,PEG-2的浓度200ng/mL,POLYI:C的浓度20ug/mL,第5天负载肿瘤新生抗原多肽,多肽终浓度10μg/mL。
使用以下肿瘤新生抗原多肽,编号分别是SEQ ID NO:1(氨基酸序列:KLMGIVYKV),SEQ ID NO:2(氨基酸序列:SLDWWAFGV),SEQ ID NO:3(氨基酸序列:VTFHIPFEV),SEQ IDNO:4(氨基酸序列:AVGSYVYSV)及SEQ ID NO:5(氨基酸序列:KLASYDMRL)。
成熟DC对CD8+细胞进行预刺激,共培养细胞数量比例为DC:CD8+=1:10,共培养时间为7天。期间,使用共刺激培养体系进行培养,共刺激培养体系通过在HIPP-T009淋巴细胞无血清培养基的基础上添加终浓度为20ng/mL的rh IL-21和2%(v/v)的自体血浆得到。
负载多肽的DC再次刺激CTL细胞,共培养1天,期间,使用HIPP-T009淋巴细胞无血清培养基培养,并向培养体系中添加终浓度为20ng/mL的rh IL-7、终浓度为20ng/mL的rhIL-15和2%(v/v)的自体血浆。培养期间观察细胞培养状态,观察指标包括:细胞形态,细胞数量,培养基颜色。若细胞集落出现、细胞数量增多、培养基颜色变黄,需要添加培养基或者转孔。
实施例7
本实施例是将负载肿瘤新生抗原的DC刺激T细胞后,然后再次使用DC重刺激T细胞,特异性扩增后,使用CD3/CD28免疫磁珠进行无差别扩增,具体操作包括如下步骤:
步骤1:PBMC的分离及分选,同实施例6;
步骤2:接种CD14+细胞,体外诱导分化成为成熟DC,同实施例6;
步骤3:将DC与CD8+细胞进行共培养,刺激活化为CTL细胞,同实施例6;
步骤4:将CTL细胞与偶联CD3/CD28单克隆抗体的磁珠进行快速大量扩增。
将CTL细胞与磁珠上偶联CD3/CD28的免疫磁珠(Miltenyi Biotec)进行共培养,CTL与CD3/CD28细胞的比例为T:beads=200:1(v/v)。共培养体系包含2%(v/v)的自体血浆、浓度为20ng/mL的rh IL-21,并在培养过程中添加终浓度为20ng/mL的细胞因子rh IL-7和终浓度为20ng/mL的细胞因子rh IL-15。培养期间观察细胞培养状态,观察指标包括:细胞形态,细胞数量,培养基颜色。若细胞集落出现、细胞数量增多、培养基颜色变黄,需要添加培养基或者转孔。
共培养3天后,洗去残留磁珠,将细胞转至细胞培养袋或G-REX瓶进行大量扩增培养,细胞转孔密度为2×10
检测:对上述实施例4-7的培养方法所培养的细胞的效果进行检测,具体如下:
(1)特异性T细胞扩增倍数评价试验,结果见附图4。具体操作包括如下步骤:
步骤1:于1.5mL的离心管中,加入10μL细胞悬液和10μL台盼蓝(碧云天)染色液,混合均匀,取10μL混合悬液置于血球计数板上,在显微镜下进行多次计数。
步骤2:活细胞不会被染成蓝色,死细胞会被染上蓝色。根据细胞计数,计算细胞密度、细胞数量,细胞活性要求≧90%。
细胞总数量=细胞密度×细胞悬液体积;
扩增倍数=最终所得T细胞数量/起始细胞数量。
(2)特异性T细胞比例评价试验(四聚体检测),结果见附图4。具体操作包括如下步骤:
步骤1:取6×10
步骤2:取50μL细胞悬液置于分别置于2个1.5mL离心管中,对照组不处理,实验组加入2μL肿瘤新生抗原肽制备的四聚体(APC-labelled)。
步骤3:分别向2管中加入2μL PE anti-human CD8(Biolegend)染色液混匀,室温避光孵育20min。
步骤4:向离心管中添加DPBS,稀释上述染色后的细胞,混匀后离心(400g,5min)弃上清。弹散细胞沉淀,加入200μL DPBS重悬细胞,每管加入5μL7-ADD(Biolegend)染色液,室温避光孵育5min,然后用流式细胞仪(Beckman)进行检测。
步骤5:首先选出7-ADD阴性细胞群,在7-ADD阴性细胞群中,再选出APC+/PE+双阳性细胞,其比例即为特异性T细胞比例。
(3)T细胞杀伤能力评价试验(CFSE、7-AAD染色实验)结果见附图5。具体操作包括如下步骤:
步骤1:取1×10
步骤2:用2%FBS的T细胞培养基分别重悬上述实施例4-7中制备的T细胞,40μm筛网过滤后,取细胞悬液计数,调整细胞密度为2×10
步骤3:向48孔板中加入250μL T细胞悬液和250μL靶细胞悬液(T细胞:靶细胞=10:1),共500μL/孔。空白组为250μL靶细胞悬液和250μL HIPP培养基,孔板外围未加样的孔加入250μL DPBS防止挥发。
步骤4:显微镜下观察,保证细胞均匀分散在培养孔中,将培养板放置于5%CO
步骤5:胰蛋白酶消化收集48孔板中的所有细胞,离心(300g,5min)弃上清。向细胞中加入150μL DPB和5μL 7-AAD(BioLegend)染色液室温避光染色10min。
步骤6:进行流式细胞仪(Beckman)检测,其中,CFSE、7-ADD双阳性细胞个数/CFSE阳性细胞个数的比例即为靶细胞中死细胞比例。
步骤7:进行T细胞:靶细胞=20:1的细胞杀伤实验。其步骤与上述步骤一致,不同之处在于步骤2中:取细胞悬液计数,调整细胞密度为4×10
杀伤率计算公式为:杀伤率(%)=实验组靶细胞中死细胞比例-阴性对照组靶细胞中死细胞比例。
(4)IFN-γ分泌量评价试验(ELISPOT试验),结果见附图6。具体操作包括如下步骤:
步骤1:取处于对数生长期的T2细胞,进行活细胞计数,离心(200g,5min)弃上清,IMDM培养基重悬细胞,调整细胞密度为2×10
步骤2:取5×10
步骤3:用无菌PBS(150μL/孔)洗涤ELISPOT(Mabtech)板5次,每孔加入150μL含10%FBS的RPMI 1640培养基,置于CO
IFN-γ分泌量(IFN-γ表达阳性细胞数/10
以上实施例,培养过程根据细胞需求进行细胞计数以及进行相关检测,监控收获时间。培养结束后,收获最终的T细胞产物,使用生理盐水进行洗涤,取样送检,进行细胞计数、四聚体流式检测特异性细胞比例、IFN-γ分泌量及细胞体外杀伤能力。
上述四项指标的检测结果见图4至图6。其中,
图4示出了本发明(实施例7)和其它3种实施例,通过细胞计数和四聚体检测实验,得到特异性T细胞扩增倍数及特异性T细胞的比例。由数据可以看出,实施例4(将PBMC进行非特异性扩增)的扩增倍数是124倍,但是其特异性T细胞的比例为0.18%,在4种实施例中是最低的。实施例5(使用肿瘤新生抗原肽直接刺激PBMC,使用CD3/CD28进行非特异性扩增,再次使用肿瘤新生抗原进行刺激),所得T细胞扩增倍数较低(53倍),特异性T细胞比例也不高(1.32%)。实施例6(用DC递呈肿瘤新生抗原肽,与T细胞共培养后,再次与DC共培养进行重刺激)所得特异性T细胞的比例较高(6.48%),由于缺少非特异性扩增,其扩增倍数较低(68倍)。本发明实施例7(将负载肿瘤新生抗原的DC刺激T细胞后,然后再次使用DC重刺激T细胞,特异性扩增后,使用CD3/CD28免疫磁珠进行无差别扩增),培养所得特异性T细胞的扩增倍数为176,其比例为7.91%。与其它3种实施例培养所得T细胞相比,其扩增倍数是最高的,特异性T细胞的含量也是最高。
图5示出了4种实施例所得T细胞不同效靶比的细胞杀伤能力。当T细胞:靶细胞=10:1时,本发明实施例7所得T细胞的杀伤率为71.2%。其杀伤率是实施例4的18倍,是实施例5的4.5倍,是实施例4的1.2倍。当T细胞:靶细胞=20:1时,本发明实施例7所得T细胞的杀伤率为92%,其杀伤率比效靶比为10:1的杀伤率提高了21.5%。实施例4的杀伤率由3.9%(10:1)提高至5.6%(20:1)。实施例5的杀伤率由15.4%(10:1)提高至23.7%(20:1)。实施例6的杀伤率由63.7%(10:1)提高至75.3%(20:1)。当效靶比提高时,4种实施例所得T细胞的杀伤率均有不同程度的升高。由此说明,实施例7的靶细胞杀伤率明显高于其它实施例,且效靶比越高,特异性T的细胞的杀伤率越高。
图6示出4种实施例所得肿瘤特异性T细胞IFN-γ分泌量。利用ELISOPT实验,检测IFN-γ分泌量,由数据可以得出,本发明实施例7培养的T细胞IFN-γ分泌量是最高的,也说明其T细胞特异性最好,与图4的实验结果一致。
从以上的描述中,可以看出,本发明上述的实施例通过对之前方案的工艺进行改进和创新,将DC重刺激步骤与磁珠扩增步骤结合到原有方案进行整合调整。经过实验验证,证明该创新工艺有效,在T细胞最终产物中,肿瘤特异性T细胞的数量和比例均有所提升。实现了如下技术效果:
1)在无差别刺激扩增之前,运用DC对PBMC来源的起始样本进行预先刺激和重刺激,使得最终T细胞产物中肿瘤特异性T细胞的所占比例显著提高,提高了肿瘤的靶向杀伤性,同时也降低了对机体的毒副作用。
2)在进行重刺激之后,使用负载有CD3/CD28的磁珠对T细胞进行无差别刺激与扩增,使得最终T细胞产物中肿瘤特异性T细胞的总数量显著提高。
3)使得肿瘤特异性T细胞制备时间缩短。
4)使得TILs方法现存的大部分问题被规避开。
需要说明的是,本申请提供的工艺流程从获得外周血单个核细胞到最后成品阶段的时间为22-25天,可以在此基础上进一步优化各个工艺步骤的时间来缩短和简化流程。此外,还可以通过将DC成熟的工艺进一步提升,使得预刺激阶段CTL中特异性T细胞比例进一步增加,从而进一步提升特异性T细胞的比例。
本申请所提供的特异性T细胞制备的培养方法所培养获得的细胞培养物中,肿瘤特异性CTL细胞的总数量和在最终T细胞产物中的占比显著提升,因而可以基于该工艺开展相应细胞治疗产品的研发,比如TCR-T、CAR-T、DC-CIK或DC-CTL等,都可采用本申请的工艺来进行细胞的制备。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 深圳吉诺因生物科技有限公司
武汉华大吉诺因生物科技有限公司
<120> 肿瘤特异性CTL细胞的培养方法及细胞治疗产品
<130> PN144292SZJN
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SITE
<222> (1)..(9)
<223> 人工筛选的肿瘤新生抗原多肽
<400> 1
Lys Leu Met Gly Ile Val Tyr Lys Val
1 5
<210> 2
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SITE
<222> (1)..(9)
<223> 人工筛选的肿瘤新生抗原多肽
<400> 2
Ser Leu Asp Trp Trp Ala Phe Gly Val
1 5
<210> 3
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SITE
<222> (1)..(9)
<223> 人工筛选的肿瘤新生抗原多肽
<400> 3
Val Thr Phe His Ile Pro Phe Glu Val
1 5
<210> 4
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SITE
<222> (1)..(9)
<223> 人工筛选的肿瘤新生抗原多肽
<400> 4
Ala Val Gly Ser Tyr Val Tyr Ser Val
1 5
<210> 5
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<221> SITE
<222> (1)..(9)
<223> 人工筛选的肿瘤新生抗原多肽
<400> 5
Lys Leu Ala Ser Tyr Asp Met Arg Leu
1 5
- 一种肿瘤特异性T细胞的分离培养方法及由其获得的产品
- 一种肿瘤特异性T细胞的分离培养方法及由其获得的产品
