一种促进肿瘤细胞凋亡的方法
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及一种促进肿瘤细胞凋亡的方法,属于生物医药技术领域。
背景技术
脑胶质瘤是因为大脑和脊髓胶质细胞癌变所产生的最常见的原发性颅脑恶性肿瘤,是所有恶性实体瘤中最致命、最顽固的肿瘤之一。其发病率约占颅内肿瘤的35.2~61.0%,由成胶质细胞衍化而来,具有发病率高、复发率高、死亡率高以及治愈率低的特点。在美国,共有大约5万名脑胶质瘤患者,且每年大约有1万名新确诊病例,患者5年生存率仅为5%。
脑胶质瘤病人的生存期及生存质量与手术切除程度密切相关。脑胶质瘤的治疗一直是困扰神经外科医师的难题之一,尤其是大脑功能区(与语言、运动和感觉功能密切相关的皮质和皮质下通路)胶质瘤及低级别胶质瘤的手术治疗是神经外科临床工作的一个难题,其主要矛盾是病灶切除程度与神经功能的取舍。尽管当前临床已有多种针对脑胶质瘤的治疗策略,但全球脑胶质瘤患者的平均中位生存期仅为12~14个月。
目前,治疗脑胶质瘤的常用方法主要有手术、放疗、化疗和消融技术等。其中,手术治疗基于脑胶质瘤的生长特点,理论上,手术不可能完全切除脑胶质瘤,生长在脑干等重要部位的脑胶质瘤有的则根本不能手术。放疗几乎是各型胶质瘤的常规治疗方法,包括X-刀和γ-刀等,因肿瘤的部位、瘤体大小及瘤体对射线的敏感程度,放疗的治疗范畴局限性较大,且疗效评价不一,例如,除髓母细胞瘤对放疗高度敏感,室管膜瘤对放疗中度敏感外,其他类型的肿瘤细胞均对放疗均不敏感。有观察发现,针对这部分对放疗不敏感的肿瘤细胞,放疗与非放疗者预后相同。并且,放疗所使用的的外射线引起的放射性坏死对于脑功能的影响亦不可低估。因此,现阶段可以认为,胶质瘤,特别是性质恶性的星形Ⅲ-Ⅳ级或胶质母细胞瘤均不适合采用放疗进行治疗。化疗受限于血脑屏障(BBB及BBTB)阻碍了药物的递送及药物的毒副作用,使其发挥有限的治疗效果变得非常困难。消融技术则主要包括射频消融、微波消融、冷冻消融和纳米刀(频率一般在5~10kHz)消融,这些消融方法对血管、神经等重要组织损伤较大,因此,消融技术也不适用于治疗脑胶质瘤。
亟需找到可有效治疗脑胶质瘤且对血管、神经等重要组织损伤较小的方法。
发明内容
为解决上述问题,本发明提供了一种促进肿瘤细胞凋亡的方法,所述方法为先用纳脉刀对肿瘤细胞进行消融(IRE),再将肿瘤细胞置于含有抗肿瘤药的孵育环境中进行孵育。
在本发明的一种实施方式中,所述方法为先用纳脉刀对肿瘤细胞进行消融,再将肿瘤细胞置于含有抗肿瘤药的孵育环境中进行孵育,最后将肿瘤细胞置于不含抗肿瘤药的孵育环境中进行培养。
在本发明的一种实施方式中,所述肿瘤细胞为脑胶质瘤细胞、胰腺癌细胞、肝癌细胞、胆管癌细胞、胃癌细胞、肺癌细胞、乳腺癌细胞、肠癌细胞、骨癌细胞或前列腺癌细胞中的至少一种。
在本发明的一种实施方式中,所述抗肿瘤药为替莫唑胺、吉西他滨、白蛋白紫杉醇、长春新碱或盐酸阿霉素中的至少一种。
在本发明的一种实施方式中,所述孵育环境中,抗肿瘤药的药物浓度为25nM~100μM。
在本发明的一种实施方式中,所述孵育环境的pH为7.0~7.4。
在本发明的一种实施方式中,所述孵育环境为生理盐水、缓冲液、血浆或组织液中的至少一种。
在本发明的一种实施方式中,所述孵育的温度为36~38℃、时间为2~8h。
在本发明的一种实施方式中,所述纳脉刀的电压为500~10000V、频率为50~500kHz、消融时间为1~30min。
本发明还提供了上述方法在促进肿瘤细胞凋亡中的应用。
在本发明的一种实施方式中,所述肿瘤细胞为脑胶质瘤细胞、胰腺癌细胞、肝癌细胞、胆管癌细胞、胃癌细胞、肺癌细胞、乳腺癌细胞、肠癌细胞、骨癌细胞或前列腺癌细胞中的至少一种。
本发明技术方案,具有如下优点:
本发明提供了一种促进肿瘤细胞凋亡的方法,所述方法通过联用基于抗肿瘤药的化疗和基于高频不可逆电穿孔的纳脉刀,有效克服了传统化疗和传统纳脉刀促进脑胶质瘤细胞凋亡效果差的缺陷,其中,联用化疗和纳脉刀促进脑胶质瘤细胞凋亡的效果较单独使用化疗和纳脉刀促进脑胶质瘤细胞凋亡的效果分别提高了10%和28%。
使用所述方法促进脑胶质瘤细胞凋亡时,使用低浓度(替莫唑胺25μM、紫杉醇2μM)化疗药物搭配纳脉刀就可获得远超单独使用高浓度(替莫唑胺50μM、紫杉醇5μM)化疗药物时的效果,因此,使用所述方法促进脑胶质瘤细胞凋亡具有化疗药物用量小以及毒副作用相对低的优势,在治疗脑胶质瘤方面具有极高的应用前景。
所述方法使用的纳脉刀基于的高频不可逆电穿孔,与传统消融技术相比,高频不可逆电穿孔对血管、神经等重要组织损伤较小,因此,所述方法在治疗脑胶质瘤方面具有极高的应用前景。
附图说明
图1:实验例1中不同处理条件下U87细胞的细胞存活率情况。
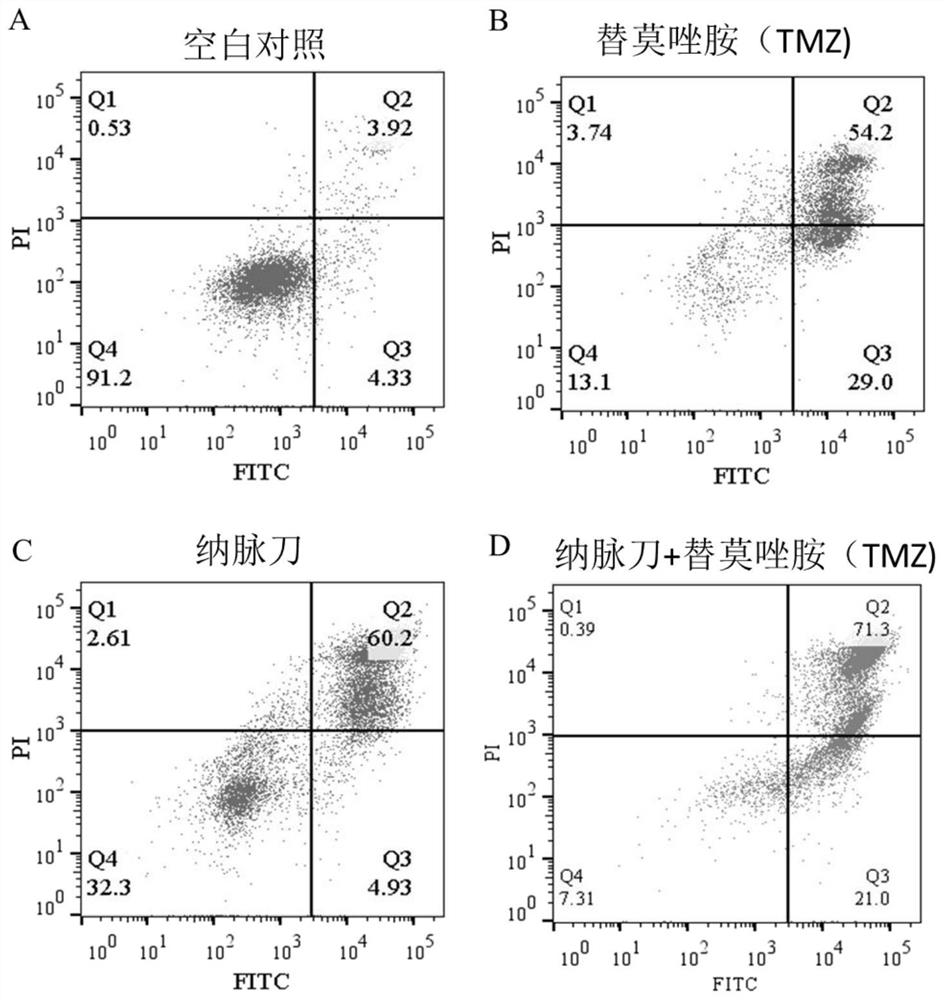
图2:实验例1中不同处理条件下U87细胞的细胞凋亡情况。图2中,A:空白对照;B:替莫唑胺(TMZ 50μM)处理、C:纳脉刀处理、D:纳脉刀联合替莫唑胺(TMZ 25μM)处理。
图3:实验例1中不同处理条件下U87细胞中BCL-2基因的表达情况。
图4:实验例1中不同处理条件下U87细胞中BAX基因的表达情况。
图5:实验例1中不同处理条件下U87细胞中Caspase-3基因的表达情况。
图6:实验例2中不同处理条件下U87细胞的细胞存活率情况。
图7:实验例2中不同处理条件下U87细胞的细胞凋亡情况。图2中,A:空白对照;B:紫杉醇(PTX 5μM)处理、C:纳脉刀处理、D:纳脉刀联合替紫杉醇(PTX 2μM)处理。
图8:实验例2中不同处理条件下U87细胞中BCL-2基因的表达情况。
图9:实验例2中不同处理条件下U87细胞中BAX基因的表达情况。
图10:实验例2中不同处理条件下U87细胞中Caspase-3基因的表达情况。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
下述实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
实施例1:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为50μM的替莫唑胺的RPMI培养基(pH7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为50μM的替莫唑胺的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH 7.4)中,于37℃的条件下继续培养44h。
实施例2:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为25μM的替莫唑胺的RPMI培养基(pH7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为25μM的替莫唑胺的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH 7.4)中,于37℃的条件下继续培养44h。
实施例3:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为5μM的白蛋白紫杉醇的RPMI培养基(pH 7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为5μM的白蛋白紫杉醇的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH 7.4)中,于37℃的条件下继续培养44h。
实施例4:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为2μM的白蛋白紫杉醇的RPMI培养基(pH 7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为2μM的白蛋白紫杉醇的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH 7.4)中,于37℃的条件下继续培养44h。
实施例5:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为100μM的吉西他滨的RPMI培养基(pH 7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为100μM的吉西他滨的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH7.4)中,于37℃的条件下继续培养44h。
实施例6:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为1μM的盐酸阿霉素的RPMI培养基(pH 7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为1μM的盐酸阿霉素的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH7.4)中,于37℃的条件下继续培养44h。
实施例7:一种促进脑胶质瘤细胞凋亡的方法
本实施例提供了一种促进脑胶质瘤细胞凋亡的方法,所述方法为:用纳脉刀(高频陡脉冲肿瘤治疗仪,记载于公开号为CN107809184A的专利申请文本中),对肿瘤细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将脑胶质瘤细胞置于含有浓度为0.5μM的长春新碱的RPMI培养基(pH 7.4)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为0.5μM的长春新碱的RPMI培养基(pH 7.4),将脑胶质瘤细胞置于RPMI培养基(pH7.4)中,于37℃的条件下继续培养44h。
实验例1:脑胶质瘤细胞的凋亡实验
本实施例提供了脑胶质瘤细胞的凋亡实验,实验过程如下:
取3D Flo Trix微载片(3D Flo Trix微载片购自北京华龛生物)放入干燥孔板的孔中,在孔板的孔与孔的间隙中加入RPMI培养基(pH 7.4,购自Gibco),加入的RPMI培养基(pH 7.4)不超过所述间隙的边沿,然后将孔板放在温度为37℃、含有5%(v/v)CO
空白组的处理方法为:不做任何处理;
对照组1的处理方法为:将U87细胞置于含有浓度为50μM的替莫唑胺的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为50μM的替莫唑胺的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v),将U87细胞置于RPMI培养基(pH 7.4,含有10%FBS和1%双抗)中,于37℃的条件下继续培养44h;
对照组2的处理方法为:用纳脉刀,对U87细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将U87细胞置于RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下继续培养44h;
实验组的处理方法为:用纳脉刀,对U87细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将U87细胞置于含有浓度为25μM的替莫唑胺的RPMI培养基(pH7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为25μM的替莫唑胺的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v),将U87细胞置于RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下继续培养44h。
实验结束后,通过MTT细胞毒性实验检测各组U87细胞的细胞存活率,检测结果见图1。MTT细胞毒性实验过程为:将按照实验条件处理过的各组U87细胞接种在96孔板(1×10^4细胞/孔)中后,于37℃、含有5%(v/v)CO
通过流式分析检测各组U87细胞凋亡的变化,检测结果见图2。流式分析实验过程为:将按照实验条件处理过的各组U87细胞接种在6孔板(2×10^5个细胞/孔)中后,于37℃、含有5%(v/v)CO
通过细胞凋亡相关基因表达分析检测各组U87细胞凋亡(BCL-2)/自噬(Bax)/焦亡(Caspase3)因子基因水平的变化,检测结果见图3~5。细胞凋亡相关基因表达分析实验过程为:先提取经过处理的各组U87细胞RNA,然后使用反转录试剂盒反转录提取出的RNA,最后使用
由图1可知,单纳脉刀消融后细胞存活率为35%,单替莫唑胺(50μM)孵育后细胞存活率为22%,纳脉刀消融联合替莫唑胺(25μM)孵育后细胞存活率为14%。结果表明纳脉刀联合替莫唑胺可显著抑制细胞增殖,且联合治疗组替莫唑胺浓度仅是单替莫唑胺的一半就取得了不错的治疗效果。
由图2可知,单纳脉刀消融后细胞凋亡65%,单替莫唑胺(50μM)孵育后细胞凋亡83%,纳脉刀消融联合替莫唑胺(25μM)孵育后细胞凋亡93%。结果表明纳脉刀联合替莫唑胺可显著促进细胞凋亡,且效果远优于单纳脉刀消融和单替莫唑胺(50μM)孵育,且纳脉刀治疗后再用替莫唑胺治疗在取得显著促进凋亡的效果同时,可大大减少替莫唑胺的用量,可极大避免全身系统毒性。
由图3~5可知,经单纳脉刀消融或单替莫唑胺(50μM)孵育后,U87细胞中凋亡相关基因的表达水平发生了变化,其中,单纳脉刀消融后,U87细胞中Bax凋亡基因的表达水平是空白对照组的1.5倍,Caspase3基因的表达水平是空白对照组的1.7倍,同时,抑制凋亡基因BCL-2的表达水平降低,单替莫唑胺(50μM)孵育的治疗效果和单纳脉刀消融的治疗效果相当;与单纳脉刀消融和单替莫唑胺(50μM)孵育相比,经纳脉刀消融联合替莫唑胺(25μM)孵育后,U87细胞中促凋亡基因BAX和Caspase的表达水平更高,其中,Bax凋亡基因的表达水平是空白对照组的2.2倍,Caspase3基因的表达水平是空白对照组的2.5倍,同时,抑制凋亡基因BCL-2表达水平的降低情况也更为明显。结果表明纳脉刀联合替莫唑胺可显著促进肿瘤细胞凋亡,有望成为一种新的脑胶质瘤治疗方法。
实验例2:脑胶质瘤细胞的凋亡实验
本实施例提供了脑胶质瘤细胞的凋亡实验,实验过程如下:
取3D Flo Trix微载片(3D Flo Trix微载片购自北京华龛生物)放入干燥孔板的孔中,在孔板的孔与孔的间隙中加入RPMI培养基(pH 7.4,购自Gibco),加入的RPMI培养基(pH 7.4)不超过所述间隙的边沿,然后将孔板放在温度为37℃、含有5%(v/v)CO
空白组的处理方法为:不做任何处理;
对照组1的处理方法为:将U87细胞置于含有浓度为5μM的紫杉醇的RPMI培养基(pH7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为5μM的紫杉醇的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v),将U87细胞置于RPMI培养基(pH 7.4,含有10%FBS和1%双抗)中,于37℃的条件下继续培养44h;
对照组2的处理方法为:用纳脉刀,对U87细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将U87细胞置于RPMI培养基(pH7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下继续培养44h;
实验组的处理方法为:用纳脉刀,对U87细胞于电压为1000V、频率为500kHz的条件下消融15min,消融结束后,将U87细胞置于含有浓度为2μM的紫杉醇的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下孵育4h,孵育结束后,吸掉含有浓度为2μM的紫杉醇的RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v),将U87细胞置于RPMI培养基(pH 7.4,含有10%FBS和1%双抗,v/v)中,于37℃的条件下继续培养44h。
实验结束后,通过MTT细胞毒性实验检测各组U87细胞的细胞存活率,检测结果见图6。MTT细胞毒性实验过程为:将按照实验条件处理过的各组U87细胞接种在96孔板(1×10^4细胞/孔)中后,于37℃、含有5%(v/v)CO
通过流式分析检测各组U87细胞凋亡的变化,检测结果见图7。流式分析实验过程为:将按照实验条件处理过的各组U87细胞接种在6孔板(2×10^5个细胞/孔)中后,于37℃、含有5%(v/v)CO
通过细胞凋亡相关基因表达分析检测各组U87细胞凋亡(BCL-2)/自噬(Bax)/焦亡(Caspase3)因子基因水平的变化,检测结果见图8~10。细胞凋亡相关基因表达分析实验过程为:先提取经过处理的各组U87细胞RNA,然后使用反转录试剂盒反转录提取出的RNA,最后使用
由图6可知,单纳脉刀消融后细胞存活率为34%,单紫杉醇(5μM)孵育后细胞存活率为46%,纳脉刀消融联合紫杉醇(2μM)孵育后细胞存活率为14%。结果表明纳脉刀联合紫杉醇可显著抑制细胞增殖,且联合治疗组紫杉醇浓度仅是单紫杉醇的一半就取得了不错的治疗效果。
由图7可知,单纳脉刀消融后细胞凋亡69%,单紫杉醇(5μM)孵育后细胞凋亡53%,纳脉刀消融联合紫杉醇(2μM)孵育后细胞凋亡95%。结果表明纳脉刀联合紫杉醇可显著促进细胞凋亡,且效果远优于单纳脉刀消融和单紫杉醇(5μM)孵育,且纳脉刀治疗后再用紫杉醇治疗在取得显著促进凋亡的效果同时,可大大减少紫杉醇的用量,可极大避免全身系统毒性。
由图8~10可知,经单纳脉刀消融或单紫杉醇(5μM)孵育后,U87细胞中凋亡相关基因的表达水平发生了变化,其中,单纳脉刀消融后,U87细胞中Bax凋亡基因的表达水平是空白对照组的1.4倍,Caspase3基因的表达水平是空白对照组的1.7倍,同时,抑制凋亡基因BCL-2的表达水平降低,单紫杉醇(5μM)孵育的治疗效果和单纳脉刀消融的治疗效果相当;与单纳脉刀消融和单紫杉醇(5μM)孵育相比,经纳脉刀消融联合紫杉醇(2μM)孵育后,U87细胞中促凋亡基因BAX和Caspase的表达水平更高,其中,Bax凋亡基因的表达水平是空白对照组的1.9倍,Caspase3基因的表达水平是空白对照组的2.8倍,同时,抑制凋亡基因BCL-2表达水平的降低情况也更为明显。结果表明纳脉刀联合紫杉醇可显著促进肿瘤细胞凋亡,有望成为一种新的脑胶质瘤治疗方法。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种促进肿瘤细胞凋亡的中药及其制备方法
- 通过干扰巢蛋白表达来筛选抑制肿瘤增殖和促进细胞凋亡的药物的方法
