一种用于拉直DNA的纳米孔装置及其应用
文献发布时间:2023-06-19 18:32:25
技术领域
本发明涉及生物技术领域,具体的说是涉及一种用于拉直DNA的纳米孔装置及其应用。
背景技术
基因测序作为科学研究和商业应用领域的基础性技术,正发挥着日益重要的作用。基因测序经历了一代,二代和三代技术的更替,目前正朝着第四代纳米孔测序技术快速发展。过去二十年纳米孔测序成为一个国际性的热门研究领域。纳米孔测序最早是在1996年由Daniel Branton和他的合作者们提出。该技术基本原理即从DNA过孔时纳米孔的离子电流的时间特性里推断出DNA的碱基排列。
随着纳米孔技术的发展,纳米孔传感检测技术被提出。在纳米孔传感检测中,纳米孔或通道(通常指小于100nm)通常位于一个绝缘的薄膜内,该薄膜将水池一分为二,形成两个单独的离子溶液池(通常为NaCl或KCl),即顺式面(Cis)和反式面(Trans)。两个AgCl电极分别插入这个水池中(如图2)当在这两侧施加一个稳定的偏置电压时,将会产生一个稳定的从孔的一侧到另一侧的离子电流。实验时,纳米孔孔两侧的离子通常随着时间而被记录下来,所得曲线为事件电流曲线。所得的这一电流值即为开孔电流,因此当DNA通过时会发生电流变化,从而逐渐应用于单分子检测领域。
目前,作为一种发展中的基因测序技术,纳米孔测序仍存在着较多的技术问题,其中之一就是DNA穿过纳米孔时热运动的干扰问题,许多实验证明DNA过孔时的热运动(布朗运动)会造成位置和电流测量误差,如何消除热运动成为纳米孔测序领域一个急需解决的问题。
发明内容
有鉴于此,本发明的目的在于提供一种用于拉直DNA的纳米孔装置,使得所述装置能够通过将穿过该装置纳米孔的DNA拉直,从而达到克服DNA分子热运动的目的,消除纳米孔测序的误差;
本发明的另外一个目的在于提供上述纳米孔装置在拉直DNA中的应用或在纳米孔测序中的应用;
本发明的另外一个目的在于提供一种基于上述纳米孔装置的拉直DNA的方法;
本发明的另外一个目的在于提供一种基于上述纳米孔装置的纳米孔DNA分析方法。
为了实现上述目的,本发明提供如下技术方案:
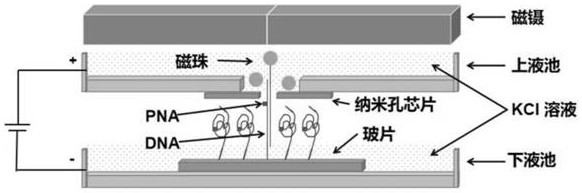
一种用于拉直DNA的纳米孔装置,包括上液池、下液池、磁珠、载体、磁性装置、电极和纳米孔芯片;
所述上液池内有电解质溶液且位于下液池上方,上液池底部开口并在此开口处覆盖有贯穿的纳米孔的纳米孔芯片,所述纳米孔与所述开口重合;所述上液池内有修饰了第一连接物质的磁珠,所述第一连接物质可与预拉直的DNA上其中一条链偶联的第二连接物质特异性偶联;
所述下液池内有电解质溶液并设置载体,所述载体可修饰活性基团,该活性基团用于连接预拉直的DNA的其中一条链上的活性基团,将所述DNA固定在载体上;
所述磁性装置位于上液池的上方,用于吸附上液池中的磁珠;所述上液池连接到电极的正极,所述下液池连接到电极的负极。
针对目前纳米孔测序技术易受到DNA过孔时的热运动(布朗运动)影响的问题,本发明通过将DNA拉直消除热运动现象,整个拉直过程借助于本发明提供的纳米孔装置。表面修饰有预拉直DNA其中一条链的载体固定在下液池中,载体靠近纳米孔,纳米孔两侧施加电压,在电场驱动下,电解质溶液中的DNA游离端穿过纳米孔(纳米孔可以是双层或者单层孔);纳米孔的上方液池内有自由扩散的磁珠(磁珠大小可根据需要进行调控及不同组合),磁珠表面带有固定的第一连接物质(如链霉亲和素),DNA游离端(不与载体连接的另一条链)的第二连接物质,如生物素可与磁珠表面的链霉亲和素形成特异性结合,这样在外加磁场梯度(磁镊)的驱动下,DNA就能完全被拉直。
作为优选,所述电解质溶液为氯化钾溶液或氯化钠溶液;所述第一连接物质和第二连接物质分别为生物素和亲和素;所述载体为玻片、塑料板、硅片或膜材料载体。
作为优选,所述活性基团为醛基;在本发明具体实施方式中,将玻片载体醛基化,预拉直DNA的一条链的一端连接引物并氨基化引物(氨基为DNA上的活性基团),后面与醛基化玻片通过醛胺缩合反应结合固定在玻片载体上。而预拉直DNA的另外一条链也可以连接引物并接上生物素和亲和素这种特异性结合的连接物质,用于与磁珠连接。
作为优选,所述磁性装置指能够施加磁场吸附磁珠的装置,如磁镊或光镊;所述电极优选为AgCl电极。
为了方便上、下液池的移动,本发明所述纳米孔装置还包括将上、下液池与移动机械装置,如纳米/微米移动平台建立连接关系,通过移动机械装置操控上、下液池的移动。
通过分析探针信号验证DNA是否被拉直,将测得的电信号数据转化为位移数据。若DNA未被拉直,DNA的分子热运动会使得其在孔内不断摆动,测得的信号位置较为混乱,且DNA有可能脱出孔外。将DNA拉直后,通过纳米移动平台上下移动会在同一位置反复测得探针信号。本发明所述装置重复检测探针信号,得到的探针位置大致相同,表明本发明所述纳米孔装置可以拉直DNA。因此,本发明提供了所述纳米孔装置在拉直DNA中的应用或在纳米孔测序中的应用。
依据上述应用,本发明提供了一种拉直DNA的方法,其基于前述纳米孔装置,包括:
步骤1、将预拉直的DNA一条链的5’端或3’端修饰活性基团,使其可与所述纳米孔装置中的载体上活性基团偶联,通过偶联将所述DNA固定在所述载体上;在修饰活性基团的DNA一条链的3’端或5’端修饰第二连接物质,或在所述DNA另外一条链的5’端或3’端修饰第二连接物质;所述第二连接物质可与所述纳米孔装置中的磁珠上的第一连接物质特异性偶联;
步骤2、移动所述纳米孔装置中的上、下液池,使所述载体靠近所述上液池底部的纳米孔芯片,在所述纳米孔装置中的电极驱动下,修饰第二连接物质的DNA链(游离端)穿过纳米孔,通过第一连接物质和第二连接物质的偶联作用与磁珠连接;
步骤3、开启所述纳米孔装置中的磁性装置,吸附磁珠,将所述DNA拉直。
此外,本发明还同时提供一种纳米孔DNA分析方法,其同样基于前述纳米孔装置,包括:
步骤1、将预拉直的DNA一条链的5’端或3’端修饰活性基团,使其可与所述纳米孔装置中的载体上活性基团偶联,通过偶联将所述DNA固定在所述载体上;在修饰活性基团的DNA一条链的3’端或5’端修饰第二连接物质,或在所述DNA另外一条链的5’端或3’端修饰第二连接物质;所述第二连接物质可与所述纳米孔装置中的磁珠上的第一连接物质特异性偶联;
步骤2、针对预拉直的DNA设计可互补结合的探针,并与所述DNA孵育;
步骤3、移动所述纳米孔装置中的上、下液池,使所述载体靠近所述上液池底部的纳米孔芯片,在所述纳米孔装置中的电极驱动下,修饰第二连接物质的DNA链(游离端)穿过纳米孔,通过第一连接物质和第二连接物质的偶联作用与磁珠连接;
步骤4、开启所述纳米孔装置中的磁性装置,吸附磁珠,将所述DNA拉直;
步骤5、上下移动所述纳米孔装置中的上、下液池,控制已拉直的DNA过纳米孔进行测序。
由以上技术方案可知,本发明提供的纳米孔装置可将预拉直的DNA一端在载体上固定,通过机械装置使载体与纳米孔靠近,在电场的驱使下预拉直的DNA游离端过孔后与磁珠表面结合以及引入磁场操控磁珠,拉直纳米孔中的DNA,有效克服了纳米孔中DNA分子热运动,可使纳米孔DNA分析技术得到进一步的应用。
附图说明
图1所示为本发明所述纳米孔装置用于DNA拉直和测序的示意图;
图2所示为当前纳米孔传感检测技术的原理示意图;
图3所示为本发明纳米孔DNA分析方法的流程图;
图4所示为添加PNA探针的DNA固定于玻片的示意图;
图5所示为结合了探针的DNA种植在玻片上的荧光表征;其中,λ-DNA(YOYO-1绿色荧光标记),探针PNA-地高辛+一抗+二抗(红色荧光标记);
图6所示为纳米孔处施加磁镊前后磁珠的明场显微镜图片;
图7所示为按照本发明方法拉直DNA后检测到的电信号数据结果;
图8所示为按照本发明方法拉直DNA后纳米移动平台位移图(电信号数据转化为位移数据);
图9所示不施加磁镊DNA过孔后检测到的电信号数据结果;
图10所示不施加磁镊DNA过孔后纳米移动平台位移图(电信号数据转化为位移数据)。
具体实施方式
本发明实施例公开了一种用于拉直DNA的纳米孔装置及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明所述纳米孔装置及其应用已通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述纳米孔装置及其应用进行改动或适当变更与组合,来实现和应用本发明技术。
PNA(Peptide nucleic acid,肽核酸)是一种人工合成的核苷酸类似物。PNA的骨架是由重复的N-2-(氨乙基)-甘氨酸为单位,经由肽键组合而成。碱基与骨架之间是以亚甲羧键相连。与多肽相似的是,PNA也有N端和C端的差别。同时由于PNA没有如DNA,RNA上的磷酸基团,因此PNA与DNA,RNA之间缺乏电性相斥的现象,使得两者之间的结合强度大于DNA与DNA之间的结合。由于PNA既不属于多肽,也不属于核酸,因此,PNA不易被蛋白酶或核酸酶水解,无论在体内还是在体外,PNA都相当稳定,同时,由于碱基之间配对特异性极强,热稳定性高。基于此原理,PNA可以作为各类探针,应用于生物学研究以及医学诊断中。在本发明中,所述针对预拉直的DNA所设计的可互补结合的探针优选采用PNA探针。PNA探针遵循以下原则设计:
a.PNA可以与目标序列双向互补,但反向互补作用力更强;
b.PNA在12-21个碱基最佳;
c.由于PNA自身互补亲和力大于与DNA互补,设计时需避免PNA自身互补、反向重复、发夹结构、回文序列等;
d.嘌呤过多会影响其溶解性,嘌呤含量需不超过60%,同时可在序列中加入linker及Lys提高溶解性;
e.序列选定后检查双链是否有重复位点。
在一个具体实施过程中,示意图见图1,表面修饰有DNA的玻片固定在微米/纳米移动平台上,通过平台的移动,玻片靠近纳米孔,纳米孔两侧施加电压,在电场驱动下,电解质溶液中的DNA游离端穿过纳米孔(纳米孔可以是双层或者单层孔);纳米孔的上方液池内有自由扩散的磁珠(磁珠大小可根据需要进行调控及不同组合),磁珠表面带有固定的链霉亲和素,DNA游离端生物素可与磁珠表面的链霉亲和素形成特异性结合。这样在外加磁场梯度(磁镊)的驱动下,DNA就能完全被拉直。然后在纳米平台的驱动下,纳米孔电流就能测出DNA上的探针位置。
整个DNA分析过程可参见流程图3;
在本发明中,活性基团以及第二连接物质可以共同修饰于DNA同一条链的两端(即5’端和3’端),也可以分别修饰于DNA两条链上,修饰端点相同,即都为5’端或都为3’端。
以下就本发明所提供的一种用于拉直DNA的纳米孔装置及其应用做进一步说明。
实施例1:DNA拉直与分析
1、获取完整DNA(DNA提取)
通过酚-氯仿法、盐析法等现有的DNA提取技术,提取样品DNA,并保证其完整性。
2、设计序列探针
根据所需检测的位置设计与DNA反向互补的PNA探针,遵循以下原则设计PNA探针:
a.PNA可以与目标序列双向互补,但反向互补作用力更强;
b.PNA在12-21个碱基最佳;
c.由于PNA自身互补亲和力大于与DNA互补,设计时需避免PNA自身互补、反向重复、发夹结构、回文序列等;
d.嘌呤过多会影响其溶解性,嘌呤含量需不超过60%,同时可在序列中加入linker及Lys提高溶解性。
e.序列选定后检查双链是否有重复位点;
3、合成探针
4、DNA与探针结合
PNA与DNA的量之比为100:1,室温孵育30min(时间及用量可调)。
5、添加PNA探针的DNA固定于玻片(图4,4/5步骤顺序可互换,可先将DNA固定于玻片再结合探针);
(1)超声清洗玻片;
(2)玻片表面醛基化;
(3)DNA两端连接连接引物;
5’端修饰氨基化引物,后面与醛基化玻片通过醛胺缩合反应结合。
3’端修饰biotin(生物素),后面与修饰了Streptavidin(链霉亲和素)的磁珠相结合。
(4)将两端修饰的DNA种植在醛基化的玻片上
6、拉直DNA
将种植好DNA的玻片固定在下液池,将纳米孔芯片固定于上液池底部开口处;
加入1MKCl作为电解液并插入AgCl电极,上液池接正电施,下液池接负电势;
上液池加入修饰了链霉亲和素的磁珠;
DNA带负电在电场力作用下向正电势方向移动,由于一端固定于玻片,通过移动机械装置靠近上液池纳米孔,当DNA通过纳米孔时,在电场力作用下未过孔的这部分DNA被拉直。过孔的一端由于修饰了生物素,与修饰了链霉亲和素的磁珠相结合。启动磁镊装置,吸起磁珠,整条DNA被拉直。
7、获得电流信号数据
将已拉直的经过探针修饰的DNA,通过机械装置上下移动过孔,记录电流数据。
实施例2:本发明所述装置及方法的验证
通过数据库NCBI(https://www.ncbi.nlm.nih.gov/)获取λ-DNA完整序列(NC_001416.1),并下载FASTA格式,PNA探针序列如SEQ ID NO:1所示(5'-ACTGATCGCACTTTA-3');
按照实施例1的方式进行λ-DNA的过孔分析,先将λ-DNA结合PNA探针,再将结合有PNA探针的DNA种植于玻片表面(见图5),通过纳米移动平台控制上下液池靠近使得λ-DNA过孔,DNA修饰有Biotin的一端将于上液池磁珠结合,启动磁镊装置将磁珠吸起,从而实现将DNA拉直。
通过分析探针信号验证λ-DNA是否被拉直,将测得的电信号数据转化为位移数据。若λ-DNA未被拉直,λ-DNA的分子热运动会使得其在孔内不断摆动,测得的信号位置较为混乱,且λ-DNA有可能脱出孔外。将λ-DNA拉直后,通过纳米移动平台上下移动会在同一位置反复测得探针信号。结果见图6-8。
图6结果显示,左侧图片显示为未加磁镊时,磁珠在纳米孔处沉积的状态;右侧图片显示为施加磁镊后,磁珠被磁镊吸起,纳米孔处表面无磁珠沉积,表明磁镊对磁珠吸附的可操作性好、有效性高;
图7结果显示,纳米移动平台控制上液池上下移动λ-DNA过孔,重复检测探针信号,得到的探针位置大致相同,测的信号的位置:
1:位置为+7.126um;
2:位置为+7.945um;
3:位置为+6.015um;
结合图8测得的信号位置(电信号数据转化为位移数据)可见三次测得的探针信号基本位于相同,精度2um左右。
同时,本实施例还对未施加磁镊的情形进行了检测,结果见图9和图10;
图9显示,上下移动纳米移动平台控制DNA过孔,重复检测探针信号,得到的探针位置混乱,说明DNA在孔内未被拉直,在孔内不规则运动。测的信号的位置:
1:位置为-1.0437um;
2:位置为1.6366um;
3:位置为-4.3495um;
结合图10测得的信号位置(电信号数据转化为位移数据)可见三次测得的探针信号明显不相同,精度2um左右。
以上所述只是用于理解本发明的方法及其核心思想,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利的保护范围。
序列表
<110> 材料科学姑苏实验室
苏州罗岛纳米科技有限公司
<120> 一种用于拉直DNA的纳米孔装置及其应用
<130> MP2037094
<160> 1
<170> SIPOSequenceListing 1.0
<210> 2
<211> 15
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
actgatcgca cttta 15
- 一种适用于电化学应用的沥青基蜂窝孔纳米炭层的制备方法
- 一种用于叶片榫头孔铜套镗铰孔的弹性胀紧自定心装置
- 一种DNA碱基序列检测的纳米孔三明治结构及其制作方法
- 一种DNA生物传感器及其应用于测定DNA的方法
- 一种基于纳米孔的超弹性颗粒剪切模量检测装置及方法
- 一种应用于纳米孔DNA测序技术的反应池装置
- 一种直径小于10nm的玻璃纳米孔、制备方法及其用于检测DNA的应用
