以超滤法之外泌体富集
文献发布时间:2023-06-19 18:34:06
技术领域
本揭示关于包含富集外泌体之外泌体组合物及其生产。
背景技术
外泌体为在大部分真核细胞之内体隔室中产生的膜结合细胞外囊泡(EV)。外泌体一般具有约40nm至160nm(平均约100nm)直径之大小范围,具有内体来源。其表面由来自供体细胞之细胞膜的脂质双层组成,且其含有来自产生外泌体之细胞的细胞溶质,且在表面上展现来自亲本细胞之膜蛋白。最初认为外泌体为用于移除不需要的蛋白质之机制。外泌体可以类似于细胞间相互作用之方式结合至细胞表面受体。此外,外泌体可连接至细胞膜且给予细胞新受体及特性。因此,外泌体可与目标细胞融合且在两种细胞类型之间交换膜蛋白及细胞溶质。已知其介导细胞之间的通讯且促进蛋白质之转移。亦已知外泌体负荷包括广泛范围之信号传导因子,且此等信号传导因子对细胞类型具特异性且视分泌细胞之环境而以不同方式调节。作为天然细胞间信息载剂,外泌体由于其天然材料输送特性、相对较小分子结构及极佳生物兼容性而在药物载剂领域中具有巨大应用潜能。
发明内容
本揭示之一个态样关于一种外泌体组合物,其包含具有特定大小及分子量分布之富集外泌体。
在一个实施例中,外泌体组合物包含浓度大于约1×10
在另一实施例中,组合物中外泌体之浓度大于约1×10
在一个实施例中,外泌体组合物包含具有约135nm至约150nm或约138nm至约148nm之平均粒度的富集外泌体群体。
在一个实施例中,本文所描述之富集外泌体群体包含具有大于约3kDa、约10kDa、约50kDa或约100kDa之分子量的外泌体。
在一个实施例中,本文所描述之富集外泌体群体包含大于约75%、大于约80%、大于约85%、大于约88%或大于约90%之具有小于约200nm之粒度的外泌体。在一些实施例中,本文所描述之富集外泌体群体包含约75%至约95%、约80%至约95%、约85%至约95%、约75%至约93%、约80%至约93%、约85%至约93%或约85%至约92%之具有小于约200nm之粒度的外泌体。
在一个实施例中,本文所描述之富集外泌体群体包含大于约10%、大于约12%或大于约15%之具有小于100nm之粒度的外泌体。在一些实施例中,本文所描述之富集外泌体群体包含约10%至约25%、约10%至约20%、约12%至约25%、约12%至约20%、约15%至约25%、约15%至约20%、约16%至约25%或约16%至约20%之具有小于约100nm之大小的外泌体。
在一些实施例中,本文所描述之富集外泌体群体包含分子量大于约3kDa之外泌体,其具有以下特征中之一或多者:
浓度大于1×10
约90%至约93%之外泌体具有小于约200nm之粒度;
约16%至约20%之外泌体具有小于约100nm之粒度;及
平均粒度为约135nm至约145nm。
在其他实施例中,浓度大于约2×10
在一些实施例中,本文所描述之富集外泌体群体包含分子量大于约10kDa之外泌体,其具有以下特征中之一或多者:
浓度大于2×10
约90%至约93%之外泌体具有小于约200nm之粒度;
约14%至约18%之外泌体具有小于约100nm之粒度;及
平均粒度为约138nm至约148nm。
在其他实施例中,浓度大于约2.5×10
在一些实施例中,本文所描述之富集外泌体群体包含分子量大于约50kDa之外泌体,其具有以下特征中之一或多者:
浓度大于1.0×10
约85%至约90%之外泌体具有小于约200nm之粒度;
约15%至约25%之外泌体具有小于约100nm之粒度;及
平均粒度为约140nm至约150nm。
在其他实施例中,浓度大于约1.0×10
在一些实施例中,本文所描述之富集外泌体群体包含分子量大于约100kDa之外泌体,其具有以下特征中之一或多者:
浓度大于1.0×10
约88%至约92%之外泌体具有小于约200nm之粒度;
约15%至约20%之外泌体具有小于约100nm之粒度;及
平均粒度为约138nm至约145nm。
在其他实施例中,浓度大于约1.2×10
在一个实施例中,本文所描述之外泌体衍生自干细胞。在一些实施例中,干细胞为胚胎干细胞(ESC)、间叶干细胞(MSC)、造血干细胞移植(HSCT)或诱导性富潜能干细胞(iPS细胞或iPSC)。
本揭示之另一态样关于一种用于产生此类外泌体群体之方法。
在一个实施例中,本揭示提供一种用于产生本文所描述之外泌体组合物之方法,其包含以下步骤:
在培养基中提供所需量之细胞;
将所述培养基离心以移除细胞碎片,且随后过滤所得上清液以移除细胞凋亡体及小胞;
用具有约3kDa至约100kDa之截留分子量的膜对所述所得上清液进行超滤法;及
用基于聚合物之沈淀来沈淀外泌体以获得包含富集外泌体之所述外泌体组合物。
在一个实施例中,方法中所用之细胞为干细胞。在一些实施例中,干细胞为胚胎干细胞(ESC)、间叶干细胞(MSC)、造血干细胞移植(HSCT)或诱导性富潜能干细胞(iPS细胞或iPSC)。
在本揭示之一些实施例中,利用具有截留分子量之膜的超滤法是经由浓缩器旋转管柱进行。
在一个实施例中,本揭示提供一种用于产生本文所描述之外泌体组合物之方法,其包含以下步骤:
在培养基中提供所需量之细胞;
将所述培养基离心以移除细胞碎片,且随后过滤所得上清液以移除细胞凋亡体及小胞;及
将所述所得上清液以约80,000g至约12,000g超速离心约50分钟至约90分钟,以获得包含富集外泌体之所述外泌体组合物。
在一个实施例中,超速离心法之范围为约80,000g至约12,000g、约85,000g至约11,500g、约90,000g至约11,000g或约95,000g至约10,500g,持续约50分钟至约90分钟、约55分钟至约85分钟、约60分钟至约80分钟或约65分钟至约75分钟。
图1展示超滤法之耗时结果。
图2展示实例1中之奈米粒子追踪分析的结果。
图3展示奈米粒子追踪分析之参数。平均大小、D90及D10展示于3kDa、10kDa、50kDa及100kDa超滤法中。
图4展示外泌体标记之表现。Alix为外泌体内蛋白质。CD81为外泌体之表面蛋白,与3kDa相比,在50kDa及100kDa中降低。
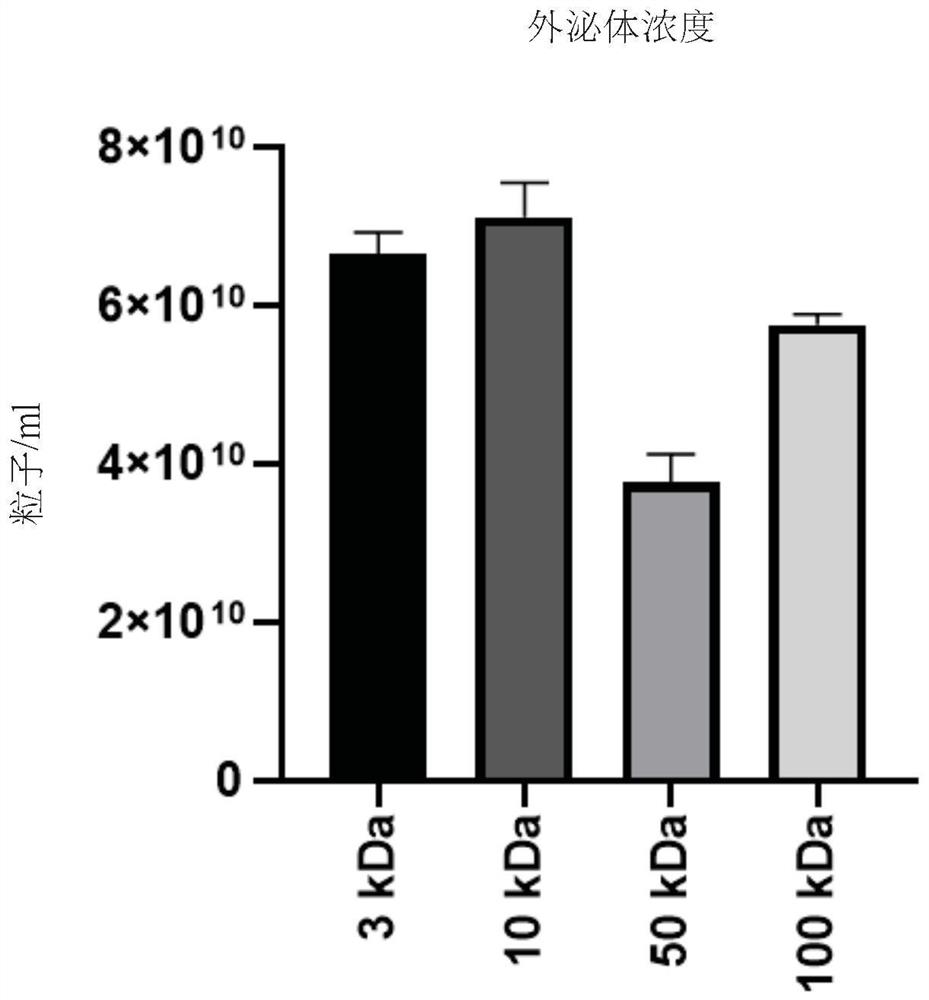
图5展示粒子浓度之表现。估计粒子浓度之表现。经由奈米粒子追踪分析,与3kDa相比,在50kDa及100kDa中粒子浓度降低。
图6展示UCMSC衍生之外泌体中之穿透电子显微术(TEM)分析。
图7展示实例1及实例3中之奈米粒子追踪分析的结果。
图8展示实例1及实例3中之奈米粒子追踪分析的参数。
图9展示实例1及实例3中之粒子浓度及外泌体标记之表现。
具体实施方式
定义
除非上下文另外规定或指示,否则术语“一(a/an)”及“所述”意谓“一或多个”。"
如本文所用,“约”将由一般熟习此项技术者理解且将在一定程度上根据使用其之上下文而变化。若术语之使用对于一般熟习此项技术者而言在使用其之上下文中不清楚,则“约”将意谓特定术语加或减10%。
如本文所用,术语“外泌体”指衍生自人类或动物之任何体液(例如血液)的任何细胞外囊泡,衍生自人类或动物细胞株、细胞培养物及初代培养物之任何细胞外囊泡不限于自体外泌体、通用供体外泌体、同种异体外泌体及经修饰之外泌体。
术语“调配物”指呈允许活性剂之生物活性有效之形式的制剂。
如本文所用,术语“干细胞”指呈未分化或部分分化状态之细胞,其具有自我更新特性且具有自然分化为更分化细胞类型之发育潜能,关于发育潜能无特定隐含含义(亦即,分化全能、富潜能、多潜能等)。自我更新意谓干细胞能够增殖且产生更多此类干细胞,同时维持其发育潜能。因此,术语“干细胞”指在特定情况下具有分化为更特定或分化表型之发育潜能,且在某些情况下保留增殖而不实质上分化之能力的任何细胞亚群。
如本文所用,术语“衍生自”应理解为指示特定样品或样品组来源于指定物种,但未必直接获自指定来源。
外泌体本身或作为递送药物有效负载之媒剂正被积极探究作为治疗剂。与脂质体相比,注射之外泌体有效进入其他细胞,且可在免疫清除极小之情况下递送功能性负荷,且在外源投与时展现良好耐受性。
外泌体之异质性可能反映其大小、内含物、对受体细胞之功能影响及细胞来源。大小不等性可归因于多泡体(MVB)之界限膜的不均匀内褶,导致流体及固体之总含量不同,或包括其他EV之分离方法。涉及EV之精细部分分离方法展现外泌体可含有由不同大小范围界定之亚群。大小异质性亦可导致不同量之外泌体内含物。细胞之微环境及固有生物学可影响外泌体之内含物及其生物标记(Raghu Kalluri及Valerie S.LeBleu,Science第367卷,第6478期,2020年2月7日)。
本文揭示包含浓度大于约1×10
外泌体组合物可衍生自任何数目之组织来源,诸如肌肉、脂肪、器官或骨或骨髓。各种细胞可用于制备本揭示之外泌体组合物。特定言之,外泌体组合物可衍生自细胞。在本揭示之一些实施例中,细胞衍生自真核生物体或细胞株。在本揭示之一些实施例中,细胞衍生自植物或动物。细胞可经基因修饰。在本揭示之一些实施例中,细胞为干细胞。在一些实施例中,干细胞为胚胎干细胞(ESC)、间叶干细胞(MSC)、造血干细胞移植(HSCT)或诱导性富潜能干细胞(iPS细胞或iPSC)。
特定方法用于产生本揭示之外泌体组合物。在用于产生本揭示之外泌体组合物之方法中首先提供所需量之细胞。在本揭示之一些实施例中,细胞在培养基中培养足以获得所需量之细胞的一段时间。在本揭示之一些实施例中,细胞量为约1×10
含有所需量之细胞的培养基经受用于移除死细胞及/或细胞碎片之预清除程序。在本揭示之一个实施例中,将培养基离心以移除死细胞。在本揭示之一些实施例中,死细胞可以约300g、约350g或约400g移除持续约5分钟、约6分钟、约7分钟、约8分钟、约9分钟、约10分钟、约11分钟、约12分钟、约13分钟、约14分钟或约15分钟。在本揭示之一个实施例中,将培养基离心以移除细胞碎片。在本揭示之一些实施例中,细胞碎片可以约1500g、约1600g、约1700g、约1700g、约1800g、约1900g、约2000g、约2100g、约2200g、约2300g、约2400g或约2500g移除持续约10分钟、约11分钟、约12分钟、约13分钟、约14分钟、约15分钟、约16分钟、约17分钟、约18分钟、约19分钟或约20分钟。
随后过滤移除死细胞及/或细胞碎片之后的所得上清液以移除细胞凋亡体及小胞。在本揭示之一个实施例中,所得上清液藉由通过约0.15μm、约0.16μm、约0.18μm、约0.20μm、约0.22μm、约0.24μm、约0.26μm或约0.28μm过滤器过滤。
在本揭示之一个实施例中,预清除之后所得上清液随后经受利用具有约3kDa至约100kDa之截留分子量之膜进行的超滤法。在本揭示之一些实施例中,超滤法经由浓缩器旋转管柱进行。在本揭示之一些实施例中,膜具有约3kDa之截留分子量,且超滤法进行480分钟。在本揭示之一些实施例中,膜具有约10kDa之截留分子量,且超滤法进行60分钟。
一种类型之膜过滤,其中力(诸如压力或浓度梯度)使得经由半透膜而分离。超滤膜通常特征在于膜之截留分子量。悬浮固体及较高分子量之溶质保留在保留物中,而水及低分子量溶质在渗透物中穿过膜。不同类型之模块可用于超滤过程。此等模块之实例为使用在塑料或纸管内侧上铸造之聚合膜的管状元件;含有多个中空纤维之中空纤维设计;螺旋卷绕模块,其中平坦膜片藉由在中心穿孔管周围卷起且安装至管状钢压力容器壳体中之薄网状间隔材料隔开;及板及框架总成,其使用置放于平板上藉由滤液穿过之网状材料隔开的膜。
在超滤法之后所得上清液随后经受外泌体沈淀以富集。在本揭示之一些实施例中,在超滤法之后所得上清液是用基于聚合物之沈淀进行沈淀。所得上清液包含浓度大于约1×10
细胞条件培养基为外泌体萃取之关键步骤。大量细胞条件培养基导致外泌体萃取及富集成本增加。藉由超滤法,浓缩细胞条件培养基以富集外泌体萃取。本揭示提供用于萃取之外泌体富集之效率制造方法。
在本揭示之一个实施例中,在预清除之后所得上清液随后以约80,000g至约12,000g经受超速离心法约50分钟至约90分钟。
外泌体组合物可藉由测定其分子量、平均粒度、外泌体浓度及粒度范围来鉴别。结果在本文中描述。在本揭示之一些实施例中,在奈米粒子追踪分析中,与传统超速离心法相比,3kDa超滤法之后外泌体萃取展示增加粒子数目。外泌体标记表现亦在3kDa超滤法中增加。另外,10kDa超滤法之后的外泌体萃取效率类似于超速离心法。平均大小为约150nm至约160nm,且大小分布为约100nm至约200nm。
本揭示外泌体组合物可用于治疗以下疾病中之任一者,包括但不限于:癌症及肿瘤病症;感染性疾病;心血管疾病;糖尿病,包括第1型糖尿病及第2型糖尿病;肝病;肥胖症;罕见疾病;胃肠疾病;骨骼疾病;及镰状细胞疾病。本揭示外泌体组合物亦可用于细胞治疗剂;载体及细胞工程改造,以及药理学及毒理学分析开发。
仅出于说明的目的,已在本文中使用特定实施例来描述本揭示。然而,一般熟习此项技术者将显而易见,本揭示之原理可以其他方式体现。因此,本揭示不应被视为在范畴上限于特定实施例及申请专利范围。
实例
实例1外泌体组合物之产生
将脐带间叶干细胞(MSC)在细胞条件培养基中培养,以达到细胞量1.5×10
30ml预清除细胞条件培养基经由3kDa、10kDa、50kDa及100kDa浓缩器旋转管柱
表1
外泌体藉由
表2
实例2包含外泌体群体之外泌体组合物
藉由电泳量测实例1中获得之UCMSC衍生之外泌体上Alix及CD81之量,且其展示于图4中。与3kDa相比,在50kDa及100kDa中Alix及CD81降低。
经由图5奈米粒子追踪分析,与3kDa相比,在50kDa及100kDa中粒子浓度降低。
UCMSC衍生之外泌体中的穿透电子显微术(TEM)分析展示于图6中。
实例3外泌体组合物之产生-超速离心法
将脐带间叶干细胞(MSC)在细胞条件培养基中培养,以达到细胞量1.5×10
将12mL预清除细胞条件培养基以100,000g超速离心70分钟。藉由奈米粒子追踪分析来分析此实例(超速离心法)及实例1(3kDa及10kDa)中外泌体之大小分布,且其展示于图7中。结果展示在100nm至200nm之间的类似大小分布。
藉由奈米粒子追踪分析来分析此实例(超速离心法)及实例1(3kDa及10kDa)中之奈米粒子追踪分析的参数,且其展示于图8中。所有粒子之平均大小为约150nm至160nm。D90及D10展示在100nm至200nm之间的大小分布。
量测此实例(超速离心法)及实例1(3kDa及10kDa)中获得之UCMSC衍生之外泌体上的粒子浓度以及Alix及CD81之量,且其展示于图9中。与10kDa及超速离心法相比,在3kDa超滤法中粒子浓度提高。Alix及CD81表现亦在3kDa中增加。
- 一种结合超滤法和超速离心法的外泌体提取方法
- 一种结合超滤法和超速离心法的外泌体提取离心管
