一种针对头颈动脉狭窄患者的脑血流自调节模拟方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于血流动力学建模领域。
背景技术
脑血流自调节是人体脑部微动脉血管针对脑灌注压的急性变化,为了维持脑血流的恒定所做出的适应性调节功能。面对脑灌注压在一定范围内骤增或骤降,该机制通过血管自主神经调节、血管平滑肌肌源性调节、剪切依赖性血管反应,控制微动脉血管舒缩,从而维持脑血流灌注在一定范围内几乎恒定。脑血流自调节机制在体外反搏期间容易被激活。
体外反搏(Enhanced external counterpulsation,EECP)是一种基于心电信号触发,通过包裹在四肢和臀部的气囊,在每个心动周期的舒张期通过体外无创性机械式按压下半身,使主动脉内舒张期血压增高,增加心、脑等脏器血流灌注的一种辅助循环方法。EECP作用于人体后以其独特的收缩、舒张“双脉冲”模式引起人体血流重分布,对缺血脏器血管进行有效的血运重建。EECP通过提高Mean arterial pressure(MAP),增加Cerebralblood flow(CBF),改善脑缺血,是其即时血流动力学效应,对头颈动脉狭窄患者脑缺血的治疗具有重要的意义。
体外反搏施加期间虽然会引起脑灌注压的大幅提升,但由于人体的脑血流自调节机制,脑血管会适应性收缩增大远端血流阻力,从而维持稳定的脑血流量。然而,研究表明,缺血性脑卒中患者的脑血流自调节能力弱于正常人。因此,在EECP期间,脑卒中患者的脑血流会得到一定程度的提升,并且血流增加量决定于脑动脉的狭窄严重程度。这也是EECP可以治疗脑卒中患者的另一个原因。
随着计算科学的发展,血流动力学数值模拟技术被运用于临床治疗策略的术前规划。对于临床心脑血管系统疾病中的血流动力学问题,建立血液循环系统血流动力学模型,利用计算流体动力学(Computational fluid dynamics,CFD)方法进行血流动力学仿真,可量化关键血流动力学参数,从生物力学的角度评估血管疾病的发展状况和治疗策略的优良,辅助临床决策。基于CFD的血流动力学建模仿真技术已被广泛地运用于冠脉搭桥虚拟手术模拟、血管支架术式优化、心肌缺血的定量化评估方面。然而,对于心脑血管系统疾病中的复杂血流动力学环境,仿真的可靠性的前提是必须建立精准的血流动力学数学模型。
因此,基于人体真实生理机制,建立准确的脑血流自调节数学模型,在脑血管的血流动力学数值模拟中具有不可忽视的作用,尤其对于不同头颈动脉狭窄程度患者,在其个性化的血流动力学仿真中更具有重要的意义。
发明内容
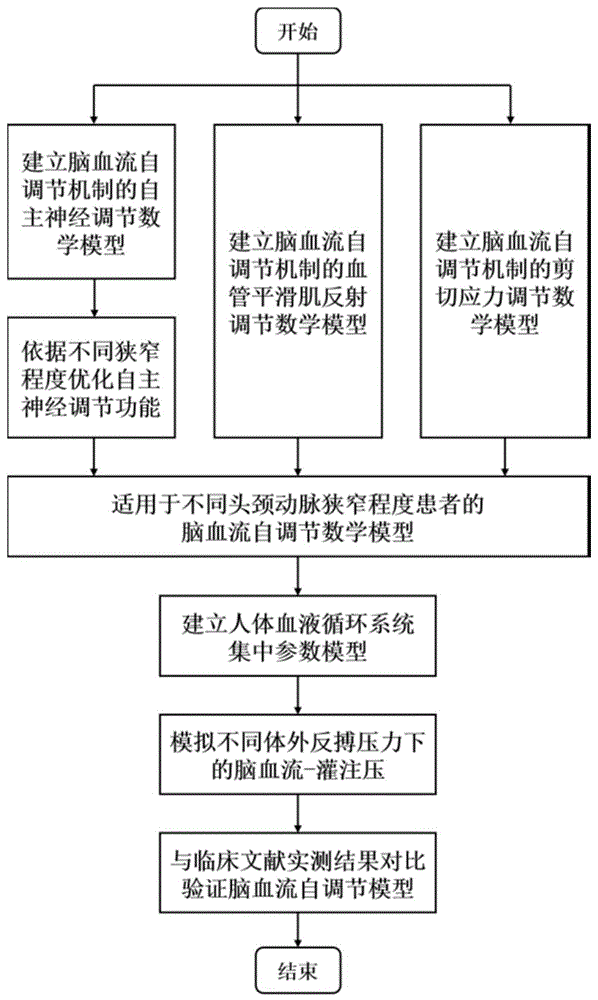
本发明提供一种针对头颈动脉狭窄患者的脑血流自调节模拟方法,可针对不同头颈动脉狭窄程度患者,建立符合其自身的个性化脑血流自调节数学模型,进而用于准确的血液循环系统血流动力学数值模拟。建立该项针对头颈动脉狭窄患者的脑血流自调节数学模型包括以下步骤:建立脑血流自调节机制的自主神经调节数学模型;建立脑血流自调节机制的血管平滑肌反射调节数学模型;建立脑血流自调节机制的剪切应力调节数学模型;针对头颈动脉狭窄患者,依据不同狭窄程度优化自主神经调节功能,从而建立准确的脑血流自调节数学模型;模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证模型。
为达到上述目的,本发明通过以下技术方案来实现:
一种针对头颈动脉狭窄患者的脑血流自调节模拟方法,其特征在于,通过以下方法建立准确的脑血流自调节数学模型,包括以下步骤:
步骤A1:建立脑部微动脉交感神经和迷走神经信号数学模型,模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型;
步骤A2:模拟脑灌注压变化时脑部微动脉血管平滑肌运动,从而建立脑血流自调节机制的血管平滑肌反射调节数学模型;
步骤A3:模拟脑灌注压变化时脑部微动脉血管剪切应力调节促使血管产生舒缩运动,从而建立脑血流自调节机制的剪切应力调节数学模型;
步骤A4:针对头颈动脉狭窄患者,依据不同狭窄程度优化自主神经调节功能,从而建立准确的脑血流自调节数学模型;
步骤A5:建立人体血液循环系统集中参数模型,将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型。
作为本发明的技术方案,步骤A1中所述特征,建立脑部微动脉交感神经和迷走神经信号数学模型,模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型。具体实施过程包括以下步骤:
步骤B1:建立脑部微动脉交感神经和迷走神经信号数学模型。脑部微动脉血管自主神经调节机制的数学模型基于交感神经和迷走神经信号的数值模拟。其中交感信号是与传入神经通路活动负相关的单调指数函数,可以用下式描述:
式中f
式中,f
式中,f
步骤B2:模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型。在脑灌注压发生急性变化时,脑部微动脉会根据交感神经和迷走神经两个信号的刺激进行收缩和舒张,自主神经调节作用下的脑部微动脉血流阻力,根据以下公式进行仿真:
R
式中G是增益指数,在无病变情况下,G=G
作为本发明进一步的技术方案,步骤A2中所述特征,模拟脑灌注压变化时脑部微动脉血管平滑肌运动,从而建立脑血流自调节机制的血管平滑肌反射调节数学模型。其中血管平滑肌反射调节指当血管跨壁压差升高,使血管平滑肌张力发生改变,从而牵引平滑肌使之收缩,反之舒张。在初始条件下(静息状态)平滑肌张力可描述为:
T
式中P
T
式中P
式中T
R′
式中Γ
作为本发明进一步的技术方案,步骤A3中所述特征,模拟脑灌注压变化时脑部微动脉血管剪切应力调节促使血管产生舒缩运动,从而建立脑血流自调节机制的剪切应力调节数学模型。其中剪切应力调节是指血液在血管中的流动遵循Hagan-Possuille定律,动脉通过剪应力调节,尽可能使相邻血管的壁面切应力(Wall shear stress,WSS)处于相同水平级别。在一段微小的理想血管中,WSS的计算公式为:
式中d为血管直径,Q为血流量,μ为血液粘度,μ=0.0035Pa。如若血压突然增大,微动脉血管收缩,直径变小,血流阻力变大,血流量几乎恒定,WSS升高。血压突然降低则相反。因此在血压变化过程中,为了稳定WSS,剪应力调节的激活为:
式中WSS
R
式中Γ
作为本发明进一步的技术方案,步骤A4中所述特征,针对头颈动脉狭窄患者,依据不同狭窄程度优化自主神经调节功能,从而建立准确的脑血流自调节数学模型。通过将公式(4)中的增益指数引入患者个性化的颈动脉狭窄程度,更新自主神经调节功能模型:
G=G
式中G
作为本发明进一步的技术方案,步骤A5中所述特征,建立人体血液循环系统集中参数模型,将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型,具体实施包括以下步骤:
步骤C1:首先基于三参数windkessel理论,结合人体血液循环系统的生理解剖结构,建立血液循环系统集中参数模型。构建模型如下:模型包含20个动脉单元,17个静脉单元,8个外周微循环单元,一个脑微循环单元,以及一个心肺循环单元,共计47个单元。人体血液循环系统的血流动力学集中参数模型中,电阻用于比拟血液循环系统血流阻力,电容比拟血管弹性,电感比拟血流惯性,二极管比拟生物瓣膜,模型计算出的电压比拟血压,电流比拟血流量。每个动静脉单元由一个电阻、一个电容和一个电感组成RLC三参数windkessel模型,其中模拟上腔静脉、下腔静脉和腿部的静脉单元还加入一个二极管模拟静脉瓣;外周微循环单元由两个电阻和一个电容组成,电阻分别模拟微动脉和微静脉阻力,电容模拟微动脉弹性;心肺循环中的二极管由左到右分别用于模拟三尖瓣、肺动脉瓣、二尖瓣、主动脉瓣,倒电容CLV、CRV分别模拟左右心室的收缩功能;脑微循环单位按照人体大脑血管生理解剖结构,A14、A15和A16分别模拟左颈内动脉、右颈内动脉、基底动脉,作为脑血管供血的入口,每支动脉供给两个脑血管分支,A14供给左大脑中动脉、左大脑前动脉,A15供给右大脑中动脉、右大脑前动脉,A16供给两支大脑后动脉,经过各自的微循环都汇总到颈静脉,最终回到右心房;冠脉循环单元包括三个电阻R、R_m、R_v,分别模拟冠状动脉阻力、冠脉微循环阻力和冠状静脉阻力,两个电容C、C_im分别模拟冠状动脉弹性和冠脉微循环弹性,C_im后接的电压源P模拟心室收缩对冠脉产生的挤压力。冠脉循环单元后接到URA,表示血流经过冠脉循环后回到右心房。
集中参数模型的求解基于显示欧拉法。在静息状态下,不施加外部反搏压力时,集中参数模型各节点的压力求解方程如下:
式中du是压力对时间的微分,i是流量,C是电容,dt是时间步长。模型各分支流量的求解方程为:
式中dI是流量对时间的微分,L是电感,ΔP是电感两端压差。
另外心脏模块的建模基于心室的压力-容量关系,可以通过如下式的时变函数E(t)来表示:
其中E(t)—时变倒电容函数,单位:mmHg/ml;
P
V
V
E(t)=(E
式中E
E
E
式中t
T
步骤C2:在模型中的臀部、大腿和小腿(A8-A13,V8-V13)部位施加外部压力源,模拟体外反搏对人体血液循环系统的压力。在反搏期间,单元A8-A13和V8-V14中的电容连接到外部压力源,其压力求解方程变为:
/>
式中dPe是反搏压力对时间的微分。体外反搏压力控制模式如图5所示。反搏模式的控制参数如表1所示:
表1体外反搏模式控制参数,其中Tc为心动周期(单位:s)
步骤C3:将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型。将上述脑部微动脉的自主神经调节模型、血管平滑肌反射调节模型、剪切应力调节模型都加入至集中参数模型中,作用于图4中的电阻R161,R261,R163,R263,R165,R265,R167,R267,R158,R258,R170,R270。模拟不同体外反搏压力(160-400mmHg)下,脑血流和脑灌注压的变化。并与文献中报道的临床实测结果对比,验证脑血流自调节模型。
附图说明:
图1:本发明的流程图
图2:交感神经和迷走神经信号频率与脑灌注压之间的关系图
图3:血液循环系统集中参数模型图
图4:集中参数模型各单元详细结构
图5:体外反搏模式控制图
图6:脑血流自调节模型模拟的脑血流灌注率-灌注压与临床文献实测结果对比
具体实施方式
下面结合具体的实施方式和附图对本发明进行详细的描述。但本发明并不限于以下实施例。
实施例1
一种针对头颈动脉狭窄患者的脑血流自调节数学模型,其特征在于,通过以下方法建立准确的脑血流自调节数学模型,包括以下步骤:
步骤A1:建立脑部微动脉交感神经和迷走神经信号数学模型,模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型;
步骤A2:模拟脑灌注压变化时脑部微动脉血管平滑肌运动,从而建立脑血流自调节机制的血管平滑肌反射调节数学模型;
步骤A3:模拟脑灌注压变化时脑部微动脉血管剪切应力调节促使血管产生舒缩运动,从而建立脑血流自调节机制的剪切应力调节数学模型;
步骤A4:针对头颈动脉狭窄患者,依据不同狭窄程度优化自主神经调节功能,从而建立准确的脑血流自调节数学模型;
步骤A5:建立人体血液循环系统集中参数模型,将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型。
作为本发明的技术方案,步骤A1中所述特征,建立脑部微动脉交感神经和迷走神经信号数学模型,模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型。具体实施过程包括以下步骤:
步骤B1:建立脑部微动脉交感神经和迷走神经信号数学模型。脑部微动脉血管自主神经调节机制的数学模型基于交感神经和迷走神经信号的数值模拟。其中交感信号是与传入神经通路活动负相关的单调指数函数,可以用下式描述:
式中f
式中,f
式中,f
步骤B2:模拟脑灌注压变化时神经活动,从而建立脑血流自调节机制的自主神经调节数学模型。在脑灌注压发生急性变化时,脑部微动脉会根据交感神经和迷走神经两个信号的刺激进行收缩和舒张,自主神经调节作用下的脑部微动脉血流阻力,根据以下公式进行仿真:
R
式中G是增益指数,在无病变情况下,G=G
作为本发明进一步的技术方案,步骤A2中所述特征,模拟脑灌注压变化时脑部微动脉血管平滑肌运动,从而建立脑血流自调节机制的血管平滑肌反射调节数学模型。其中血管平滑肌反射调节指当血管跨壁压差升高,使血管平滑肌张力发生改变,从而牵引平滑肌使之收缩,反之舒张。在初始条件下(静息状态)平滑肌张力可描述为:
T
式中P
T
式中P
式中T
R
式中Γ
作为本发明进一步的技术方案,步骤A3中所述特征,模拟脑灌注压变化时脑部微动脉血管剪切应力调节促使血管产生舒缩运动,从而建立脑血流自调节机制的剪切应力调节数学模型。其中剪切应力调节是指血液在血管中的流动遵循Hagan-Possuille定律,动脉通过剪应力调节,尽可能使相邻血管的壁面切应力(Wall shear stress,WSS)处于相同水平级别。在一段微小的理想血管中,WSS的计算公式为:
式中d为血管直径,Q为血流量,μ为血液粘度,μ=0.0035Pa。如若血压突然增大,微动脉血管收缩,直径变小,血流阻力变大,血流量几乎恒定,WSS升高。血压突然降低则相反。因此在血压变化过程中,为了稳定WSS,剪应力调节的激活为:
式中WSS
R
式中Γ
作为本发明进一步的技术方案,步骤A4中所述特征,针对头颈动脉狭窄患者,依据不同狭窄程度优化自主神经调节功能,从而建立准确的脑血流自调节数学模型。通过将公式(4)中的增益指数引入患者个性化的颈动脉狭窄程度,更新自主神经调节功能模型:
G=G
式中G
作为本发明进一步的技术方案,步骤A5中所述特征,建立人体血液循环系统集中参数模型,将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型,具体实施包括以下步骤:
步骤C1:基于三参数windkessel理论,依据人体血液循环系统生理解剖结构,建立血液循环系统的集中参数模型。模型包含20个动脉单元,17个静脉单元,8个外周循环单元,一个脑微循环单元,以及一个心肺循环单元,共计47个单元,如图3所示。人体血液循环系统的血流动力学集中参数模型中,各单元详细结构见图4。模型中电阻用于比拟血液循环系统血流阻力,电容比拟血管弹性,电感比拟血流惯性,二极管比拟生物瓣膜,模型计算出的电压比拟血压,电流比拟血流量。集中参数模型的求解基于显示欧拉法。在静息状态下,不施加外部反搏压力时,集中参数模型各节点的压力求解方程如下:
式中du是压力对时间的微分,i是流量,C是电容,dt是时间步长。模型各分支流量的求解方程为:
式中dI是流量对时间的微分,L是电感,ΔP是电感两端压差。
另外心脏模块的建模基于心室的压力-容量关系,可以通过如下式的时变函数E(t)来表示:
其中E(t)—时变倒电容函数,单位:mmHg/ml;
P
V
V
E(t)=(E
式中E
E
E
式中t
T
步骤C2:在模型中的臀部、大腿和小腿(A8-A13,V8-V13)部位施加外部压力源,模拟体外反搏对人体血液循环系统的压力。在反搏期间,单元A8-A13和V8-V14中的电容连接到外部压力源,其压力求解方程变为:
式中dPe是反搏压力对时间的微分。体外反搏压力控制模式如图5所示。反搏模式的控制参数如表1所示:
表1体外反搏模式控制参数,其中Tc为心动周期(单位:s)
步骤C3:将脑血流自调节模型加入集中参数模型,模拟不同体外反搏压力下的脑血流-灌注压,与临床文献实测结果对比验证脑血流自调节模型。将上述脑部微动脉的自主神经调节模型、血管平滑肌反射调节模型、剪切应力调节模型都加入至集中参数模型中,作用于图4中的电阻R161,R261,R163,R263,R165,R265,R167,R267,R158,R258,R170,R270。模拟不同体外反搏压力(160-400mmHg)下,脑血流和脑灌注压的变化。模拟结果如图6所示。与文献中报道的临床实测结果相比,在各脑灌注压下,模拟出的脑血流灌注率与临床实测结果之间的均方根误差为0.07。其中脑血流灌注率为:
式中CBF
- 一种大脑中动脉狭窄脑血流灌注异常的定量测量方法
- 一种基于冠状动脉CT血管造影评估狭窄病灶血流阻力的非侵入式方法
