一种智能工程细菌系统及其制备和在抗肿瘤药物中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于纳米生物医药技术领域,具体涉及一种智能工程细菌系统及其制备方法和在抗肿瘤药物中的应用。
背景技术
肿瘤一直是威胁人类生命健康的重大疾病。目前,针对肿瘤的治疗方法如手术治疗、放疗、化疗以及近些年兴起的免疫治疗、基因治疗、细胞疗法等,都能在一定程度上缓解肿瘤症状,但不可避免的存在一些各自弊端。其中负载药物的非靶向富集和释放是实现安全高效治疗的主要障碍。随着精准医疗概念的提出,利用多功能载体进行肿瘤靶向治疗得到大量研究与快速发展,展现出临床应用的潜能。
近年来,基于细菌的肿瘤治疗研究呈指数增长,也取得阶段性成果,表现出巨大的临床推广意义。因肿瘤组织存在的细胞因子和乏氧微环境,兼性厌氧菌和厌氧细菌有向肿瘤部位迁移的趋势;同时,肿瘤组织免疫抑制微环境也为细菌的定殖提供了便利条件。相比于传统肿瘤治疗方法,新概念细菌疗法是一种新型的、具有靶向性的高效肿瘤治疗方法,有效的避免了传统疗法中存在的前期不敏感和后期耐药性等问题。随着合成生物学的蓬勃发展,科研人员积极探索如何进一步优化肿瘤细菌疗法,为肿瘤治疗提供更多样化的策略。细菌基因组简单,易于进行工程改造。利用基因工程技术重塑细菌的合成基因网络,甚至将整个化学合成基因组移植到细菌内,是一种前瞻性的靶向肿瘤治疗方法。表达抗肿瘤蛋白的肿瘤靶向细菌可以降低对宿主的致病性和毒副作用,优化治疗方案。
作为非己异源物,基于细菌的肿瘤疗法其体内生物安全性一直是大家所关心的焦点问题。细菌的致病性以及细菌壁脂多糖成分引起的机体强烈炎症反应,都是细菌疗法过程中存在的问题。目前,针对这些问题普遍采用的应对策略是选用非致病性细菌或对菌株减毒处理。但治疗结束后肿瘤组织内部的细菌残留及去向仍然成迷,其对机体造成的潜在安全隐患不容忽视。此外,利用基因重组技术使细菌表达抗肿瘤蛋白,在此过程中抗肿瘤蛋白的精准合成与释放以及是否会损伤正常组织也是我们设计过程中需要考虑的细节。
发明内容
针对现有肿瘤细菌疗法的不足,本发明旨在构建一种智能工程细菌系统,其克服了传统肿瘤治疗过程中出现的药物非靶向富集、药物疗效不佳以及体内给药系统安全性问题,具有显著的抗肿瘤效果和高安全性。
为了实现上述目的,本发明的技术方案具体如下:
一种智能工程细菌系统,具体为装载有质粒的细菌,该细菌对肿瘤组织具有趋向作用,质粒包含编码融合蛋白的基因片段且该融合蛋白由上述细菌分泌表达,上述融合蛋白包含蛋白A、抗肿瘤肽以及连接二者且能被基质金属酶-2靶向切割的基质金属酶-2敏感肽,其中蛋白A具有失活抗肿瘤肽功能的作用。
在上述方案中,细菌作为载体,智能工程细菌系统的肿瘤靶向性是通过载体细菌对肿瘤组织的趋向作用实现的,而且载体细菌利用肿瘤组织的免疫抑制微环境能够定殖于肿瘤组织中,故载体细菌应为兼性厌氧菌或厌氧细菌,如大肠杆菌。
在上述方案中,智能工程细菌系统中的融合蛋白完全由载体细菌分泌表达,融合蛋白中的蛋白A可失活抗肿瘤肽的功能,使得该系统在非肿瘤组织中无明显细胞毒性;而当该系统到达肿瘤部位时,基质金属酶-2敏感肽被肿瘤部位高表达的基质金属酶-2(MMP-2)切断,进而蛋白A对抗肿瘤肽的功能抑制作用被解除,抗肿瘤肽发挥抗肿瘤效果,杀死肿瘤细胞。因此,该智能工程细菌系统实现了抗肿瘤肽的靶向递送和精准释放,提高杀死肿瘤细胞的效果。
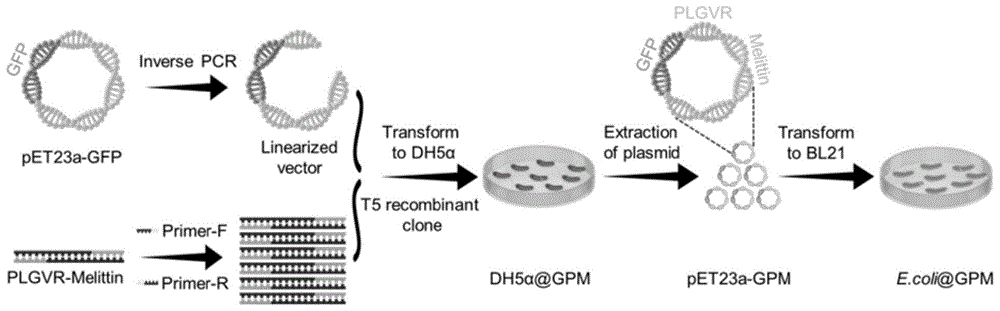
在本发明的一个具体实施例中,融合蛋白具体包含超折叠绿色荧光蛋白GFP和蜂毒素(Melittin,氨基酸序列为GIGAVLKVLTTGLPALISWIKRKRQQ),GFP通过基质金属酶-2敏感肽偶联于Melittin的N端。融合蛋白N端GFP作为非信号肽引导目的蛋白分泌,可以显著降低Melittin的细胞毒性,并且可以提高融合蛋白可溶性。同时GFP会附着在细胞膜上屏蔽细菌自身内毒素的毒性,降低细菌毒素给机体带来的炎症反应。当基质金属酶-2敏感肽被切断后,GFP对Melittin的功能抑制作用被解除,Melittin发挥抗肿瘤作用。而且Melittin也是抗菌肽并具有显著的抗炎效果,其被释放后还可以致死细菌并引起免疫原性肿瘤细胞死亡,加强抗肿瘤效果。因此,表达该融合蛋白的智能工程细菌系统不仅能实现蜂毒素的靶向递送和精准释放,还能清除细菌自身,实现体内肿瘤高效安全治疗。
进一步地,在上述实施例中,当基质金属酶-2敏感肽的氨基酸序列为PLGVR,且融合蛋白的N端修饰有6*His标签时,该融合蛋白(记为GPM)的氨基酸序列如SEQ ID NO.1所示,编码该融合蛋白的核苷酸序列如SEQ ID NO.2所示。
本发明进一步提供了构建分泌表达序列如SEQ ID NO.1所示融合蛋白的智能工程细菌系统的方法,具体为:
步骤1、利用PCR技术扩增目的基因片段和线性化载体,其中目的基因片段的核苷酸序列如SEQ ID NO.4所示,线性化载体为含有6*His-GFP的载体,且目的基因片段与线性化载体有同源区域;
步骤2、利用T
步骤3、将重组质粒转化至受体菌后进行诱导表达。
在上述构建方法中,目的基因片段的合成方法为:以序列如SEQ ID NO.9~10所示的引物互为模板,退火后互补配对成DNA双链,再以该双链为模板,在序列如SEQ ID NO.11~12所示引物对的引导下合成。
作为优选地,步骤3中的受体菌为大肠杆菌BL21(DE3)plysS且采用IPTG诱导表达。
本发明提供的智能工程细菌系统可用于制备抗肿瘤药物,所得药物可用于实体瘤的治疗,且给药方式为注射给药。
本发明的有益效果为:
(1)高效表达、智能响应:本发明提供的智能工程细菌系统E.coli@GPM利用大肠杆菌高效分泌表达融合蛋白GPM,且携带有基质金属酶敏感肽的GPM可在肿瘤部位环境响应性激活,使蜂毒素的抗菌、抗肿瘤活性得以恢复并在肿瘤局部精准释放。
(2)抗肿瘤效果显著:智能工程细菌系统E.coli@GPM利用大肠杆菌趋向肿瘤组织的特性,使工程菌富集于肿瘤部位后才释放并激活Melittin,能显著抑制肿瘤生长,对接种有结肠癌细胞的Babl/c小鼠肿瘤抑制率高达80%。
(3)具有显著生物安全性,无毒:融合蛋白GPM相对于裸露的蜂毒素蛋白,其溶血效果显著改善;且在荷瘤小鼠注射E.coli@GPM后,主要器官组织没有发现生理和病理上的改变;对注射后不同时间的荷瘤小鼠进行血液生化分析,肝肾功能指标在正常范围内出现轻微波动后随即恢复初始值。
附图说明
图1为实施例1构建的两种融合表达载体pET23a-GPM(上)和pET23a-GM(下)的结构示意图;
图2为实施例1中线性化载体pET23a-GFP的胶图,其中泳道M为Marker,泳道1为pET23a-GFP线性化载体;
图3为实施例1中搭建的目的基因片段PLGVR-Melitttin的胶图,其中泳道M为Marker,泳道1和2为引物融合PCR产物,泳道3和4为目的基因片段PLGVR-Melitttin;
图4为实施例1中重组子pET23a-GPM菌落的PCR胶图,其中泳道M为Marker,泳道1为菌落PCR结果;
图5为实施例1中线性化载体pET23a-GPM胶图,其中泳道M为Marker,泳道1为质粒模板,泳道2为线性化载体pET23a-GPM;
图6为实施例1重组子pET23a-GM菌落的PCR胶图,其中泳道M为Marker,泳道1为菌落PCR结果;
图7为实施例1中智能工程菌系统E.coli@GPM的构建流程图;
图8为实施例1中各工程细菌表达的融合蛋白的SDS-PAGE胶图,其中泳道M为Marker,泳道1、4、7分别为E.coli@G的裂解液、上清、沉淀,泳道2、5、8分别为E.coli@GM的裂解液、上清、沉淀,泳道3、6、9分别为E.coli@GPM的裂解液、上清、沉淀;
图9为实施例1中各工程细菌表达的融合蛋白的Western Blot检测图;
图10为蓝光仪分析智能工程菌表达的蛋白质在菌液、培养基上清、沉淀、洗膜液的分布情况;
图11为实施例1中抑菌圈实验检测结果图;
图12为实施例1中细胞活死染色实验结果图;
图13为实施例1中各融合蛋白酶切前后的溶血实验结果图;
图14为实施例2中细菌在小鼠体内各组织中的分布结果图;
图15为实施例2中不同材料治疗后小鼠体重和肿瘤体积变化统计图;
图16为实施例2中不同材料治疗后小鼠肿瘤质量统计图;
图17为实施例2中不同材料治疗后小鼠肿瘤实物图;
图18为实施例2中尾静脉注射E.coli@GPM后小鼠肝肾功能血生化分析结果图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例及实验数据,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
实施例1
本例构建的智能工程细菌系统记为E.coli@GPM,即采用的载体细菌为大肠杆菌,融合蛋白(GPM)由超折叠绿色荧光蛋白(GFP)、抗肿瘤肽-蜂毒素(Melittin)以及基质金属酶-2(MMP-2)敏感肽(PLGVR)组成。
(1)构建表达载体
利用体外PCR和引物搭建得到线性化载体和目的基因PLGVR-Melittin,T
表1
以表达载体pET23a-GFP为模板,F-23A-GFP和R-23A-GFP为引物将载体线性化(线性化后的胶图如图2所示)。以引物F-PLGVR-M-1和R-PLGVR-M-1互为模板,退火后互补配对成DNA双链,再以该双链为模板,在引物F-PLGVR-M-2和R-PLGVR-M-2的引导下合成目的基因链PLGVR-Melittin(该基因片段的胶图如图3所示,其核苷酸序列如SEQ ID NO.4所示,且编码的肽段的氨基酸序列如SEQ ID NO.3所示)。上述线性化载体和目的基因5'端含有15bp的同源区域,利用T
以pET23a-GPM为模板,F-SSSSG-M和R-SSSSG-M为引物,将质粒pET23a-GPM线性化(线性化后的胶图如图5所示),该线性化载体5'含有15bp的同源区域,利用T
将质粒pET23a-GFP转化至感受态细胞大肠杆菌BL21(DE3)plysS(即Escherichiacoli BL21(DE3)plysS,购于北京擎科生物有限公司)得到工程菌E.coli@G;将质粒pET23a-GM转化至感受态细胞大肠杆菌BL21(DE3)plysS得到智能工程菌系统E.coli@GM;将质粒pET23a-GPM转化至感受态细胞大肠杆菌BL21(DE3)plysS得到智能工程菌系统E.coli@GPM(其完整的构建流程见图7)。
(2)融合蛋白的诱导表达与表征。
将上述转化后的工程细菌涂布平板,挑取抗生素筛选的阳性菌株。将E.coli@G、E.coli@GM和E.coli@GPM接种于100mL含氨苄青霉素的液体培养基,放入37℃摇床振荡培养,当OD
①收集菌体进行超声破碎,对上清、沉淀均进行SDS-PAGE检测,判断融合蛋白是否表达,结果显示表达的融合蛋白分子大小与预期相符(如图8所示)。
②对破菌后的上清进行SDS-PAGE电泳,转膜后,进行Western Blot分析,目标蛋白条带与SDS-PAGE结果一致(如图9所示)。
从智能工程细菌E.coli@GPM在诱导表达重组蛋白后进行的SDS-PAGE检测和蛋白印迹分析的结果可知:GPM在BL21中成功实现高效表达。
③为了判断该融合蛋白是否为分泌表达,在加入诱导剂IPTG诱导细菌表达融合蛋白后,收集菌体。加入洗膜缓冲液后,放入4℃静音混匀器48h,收集上清,将智能工程细菌的菌液、离心后沉淀、培养基上清、菌体洗膜后上清进行蓝光分析。结果如图10所示,显示该融合蛋白为分泌表达,无需对细菌进行裂解即可收集融合蛋白。
(3)GPM融合蛋白的体外抗菌活性检测。
将E.coli@GM和E.coli@GPM分别进行平板涂布,将滤纸片浸泡在不同浓度的MMP-2溶液中,贴在平板上,过夜培养后,观察到形成明显的抑菌圈(见图11)。说明PLGVR被MMP-2酶切断,GFP对蜂毒素的失活作用解除,恢复抗菌活性。
(4)GPM融合蛋白的体外抗肿瘤活性检测与溶血试验。
活、死细胞染色:CT26细胞接种于6孔板中培养至细胞覆盖90%小室底部。分别向小孔中加入100μL收集的不同浓度的GFP、GM、GPM蛋白溶液,孵育18h后弃掉培养基并洗涤,各组细胞在PBS缓冲液中用Calcein-AM和PI染色30min,倒置荧光显微镜下观察,结果如图12所示,表明GPM蛋白表现出良好的肿瘤杀伤效果。
随后对智能工程细菌进行溶血反应评估:分别取150μL H
对照组转入质粒pET23a-GM,表达的重组蛋白GFP-SSSSG-Melittin(GM)无法被MMP-2切断。从上述检测结果可知:在不经外源MMP-2处理情况下,E.coli@GM和E.coli@GPM均表现出低细胞毒性;而经外源MMP-2处理后,E.coli@GPM表现出明显细胞毒性。
实施例2
本例将实施例1构建的E.coli@GPM用于荷瘤小鼠体内,观察其抗肿瘤效果。本例的动物实验严格遵守国际实验动物福利伦理标准,实验方案在湖北大学动物伦理委员会监督下执行。
(1)小鼠CT26荷瘤裸鼠模型的建立。
将新购Balb/c雌鼠进行一周适应性饲养。培养CT26细胞,待细胞长满培养皿底80~90%后用0.25%胰酶消化细胞,然后加入2mL含血清DMEM终止消化,将细胞吹打至单细胞悬液。1000rpm离心2min收集细胞,弃上清,用PBS缓冲溶液将细胞重悬后计数,将细胞浓度调整为10
(2)细菌的体内生物分布。
荷瘤小鼠尾静脉注射剂量为10
结果表明,小鼠主要器官中的细菌随着时间的延长被机体逐步代谢清除;与此相反,肿瘤部位的细菌定殖量呈现明显增长趋势。
(3)工程菌的抗肿瘤疗效评估。
当荷瘤小鼠的肿瘤体积约为100mm
在治疗期间,每天用电子天平监测每只小鼠的体重,利用游标卡尺记录每只小鼠肿瘤长、宽,计算肿瘤体积,结果如图15所示。治疗结束后对小鼠进行安乐死,剥离小鼠肿瘤组织,记录每只小鼠肿瘤质量(如图16所示),并拍照(如图17所示)。
图16和17表明:E.coli@GPM表现出显著的肿瘤抑制效果,E.coli@G表达的蛋白几乎没有抗肿瘤活性;但E.coli@GM也存在一定抗肿瘤活性,其原因在于,蜂毒素分子量较小,融合蛋白N端的大分子量GFP蛋白能阻止蜂毒素发挥活性作用,但是融合蛋白蜂毒素的C端没有进行修饰,所以无法使其功能完全失活。
(4)生物安全性分析。
评价注射E.coli@GPM对小鼠肿瘤组织和主要器官的生理作用,在指定的时间点(0、12、24、48、96、120h)采集小鼠血样,进行血液生化分析,结果如图18所示:肝肾功能在正常范围出现轻微波动后恢复初始值。
从上述检测结果可知,实施例1所构建的智能工程细菌系统E.coli@GPM在体内疗效评估实验中表现出显著的肿瘤趋向能力和肿瘤抑制效果,对接种有结肠肿瘤细胞的Babl/c荷小鼠肿瘤抑制率高达80%,且表现出较好的体内生物安全性。
综上所述,本发明提供的智能工程细菌系统能够克服传统肿瘤治疗过程中出现的药物非靶向富集、药物疗效不佳等问题,实现药物的靶向递送和精准释放,而且选用具备抗肿瘤和抗菌功能的蜂毒素,在杀死肿瘤细胞的同时并清除细菌自身,解决了现有细菌疗法的安全问题。
以上所述是本发明的优选实施方式,不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 化合物lithocarolsA-F及其制备方法和在制备抗肿瘤药物中的应用
- 一种红树内生真菌来源的1,4-萘醌类化合物及其制备方法和在制备抗炎药物中的应用
- 一种三萜类化合物及其制备方法和在制备抗癌药物中的应用
- 一种电解液及其制备方法和在双排链轮轴电解加工精密修形中的应用
- 负载前体药物的介孔纳米钌系统及制备和在制备治疗耐药细菌感染药物中的应用
- 负载前体药物的介孔纳米钌系统及制备和在制备治疗耐药细菌感染药物中的应用
