TRBC2抗体及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及抗体及其应用领域,具体涉及TRBC2抗体及其应用。
背景技术
从组织来源分辨,淋巴癌变大致上可以分为两类,即T细胞和B细胞来源。T细胞癌变临床及生物学意义上均较为异质,总体上各型T细胞淋巴瘤发病率低于B细胞淋巴瘤,在全体非霍奇金淋巴瘤中占10-20%,而在急性白血病中占20%。最常见的组织亚型包括外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL-NOS),血管免疫母细胞性T细胞淋巴瘤(angio-immunoblastic T-cell lymphoma,AITL)和间变性大细胞淋巴瘤(anaplasticlarge cell lymphoma,ALCL)。而急性淋巴母细胞白血病(acute LymphoblasticLeukaemias,ALL)病人群体中,约有20%为T细胞表型。
T细胞淋巴恶性肿瘤往往侵袭性强于B细胞淋巴瘤,病人5年生存率仅有30%,多与播散性发病、预后评分不良以及结外发病关联。单独化疗效果较差,现有疗法仅对不到30%的病人有效。
针对B细胞淋巴瘤,有抗CD20治疗性单抗,如利妥昔单抗(美罗华)可以极大改善治疗效果,而对T细胞淋巴瘤来说,目前尚无有效、低毒性的免疫治疗手段。这是因为,癌性(克隆化Clonal)T细胞与正常T细胞表面标记物差别有限,开发特异性针对癌性T细胞的药物难度较大。在B细胞淋巴瘤药物开发中,也存在类似问题,但无差别的清除B细胞带来的免疫抑制效应相对较小,病人可以耐受,而且,正常B细胞长期清除带来的免疫球蛋白损失,可以通过输注外源性的IgG获得补充。然而,类似的策略不能够应用于T细胞癌变的治疗---T细胞的清除往往造成严重的免疫抑制和严重副作用,并且,对T细胞的清除带来的副作用,尚无合理的临床补救措施。如Alemtuzumab,其靶点为CD52,对T细胞肿瘤具有一定的治疗效果,但其应用却因带来严重细胞免疫缺陷副作用而受到限制,这种副作用主要归因于T细胞清除,病人的感染率大为升高。
因此有必要开发治疗T细胞来源淋巴瘤/白血病的新治疗手段。Suman Paμl(S.Paμl et al.,Sci.Transl.Med.10.1126/scitranslmed.abd3595(2021).)等人开发了一种T细胞接合器形式的双特异性抗体(bispecific antibody,BsAb),该型抗体一端特异性的靶向克隆性T细胞(肿瘤)表面的T细胞受体β分子的可变区,另一端靶向T细胞表面的CD3分子,从而介导正常T细胞对(T细胞)肿瘤的杀伤。这项研究是一次研发特异性针对T细胞肿瘤的有益尝试,颇具启发性。然而,该研究获得的两个BsAb用于T细胞肿瘤却具有以下成药性方面的问题:
(i)由于T细胞β受体亚基可变区具有多态性,如果要做成货架(off-the-shelf)产品,则需要开发数十种分子实体(TRBV编码基因共有68种,分属于30个家族),效率较低。
(ii)采取scFv串联的形式,将针对T细胞受体β亚基可变区(TRBV)和CD3亚基的两臂相连构建的双抗分子仅含有250个左右氨基酸,分子量小于30KD,药物代谢不具备优势,从而预测其临床给药不友好,病人依从性较差。
(iii)T细胞接合器形式的双抗诱发细胞因子风暴的几率较大,副作用发生率高且较严重。
(iv)T细胞接合器形式的双抗用于T细胞肿瘤的疗法,原则上,难以避免顺式结合出现,进一步加剧副作用;而反式结合诱导的杀伤过程,也会由于两个T细胞之间的受体-配体信号综合输出导致的药效/安全风险不完全可控。
Paμl M Maciocia等人曾开发了一种靶向TRBC的CAR-T疗法(doi:10.1038/nm.4444)。但CAR-T疗法由于其苛刻的制备和储运条件,难以推广,且该方法在临床应用上仍难以避开以上所述的弊端。
细胞受体(T cell receptor,TCR)是T细胞表面的特异性受体,负责识别由主要组织相容性复合体(MHC)所呈递的抗原,与B细胞受体不同,并不能识别游离的抗原。通常情况下,T细胞受体与抗原间拥有较低的亲和力,因而同一抗原可能被不同的T细胞受体所识别,某一受体也可能识别许多种抗原。
T细胞受体的β亚基恒定区(TRBC)仅有两种多态性,即TRBC1或TRBC2。带有TRBC1或者TRBC2的T细胞群体往往数量大致相同,有些情况下TRBC1/2占到35-45%。这样一来,针对TRBC1或TRBC2进行靶向抗体药物开发并给药,则有望清除克隆化T细胞及与该癌性T细胞带有同样TRBC肽段正常T细胞的同时,仍有望保留一半的T细胞群体,从而避免免疫抑制带来的副作用。TRBC1和TRBC2高度同源,两者胞外区有145个氨基酸,其中仅有5个氨基酸的差异,且分布于不同的结构域。
发明内容
本发明要解决的技术问题是:如何有效治疗T细胞来源的癌症。
第一个方面,本发明提供特异性结合TRBC2蛋白的抗体或其抗原结合片段,
所述抗体包含重链可变区和轻链可变区,所述重链可变区包含氨基酸序列分别是SEQ IDNo.20第26-35位、SEQ ID No.20第50-66位和SEQ ID No.20第99-109位的HCDR1、HCDR2和HCDR3;所述轻链可变区包含氨基酸序列分别是SEQ ID No.25第24-38位、SEQ IDNo.25第54-60位和SEQ ID No.25第93-101位的LCDR1、LCDR2和LCDR3(10A5);
或,所述重链可变区包含氨基酸序列分别是SEQ ID No.27第26-33位、SEQ IDNo.27第51-58位和SEQ ID No.27第97-107位的HCDR1、HCDR2和HCDR3;所述轻链可变区包含氨基酸序列分别是SEQ ID No.30第27-32位、SEQ ID No.30第50-52位和SEQ ID No.30第89-97位的LCDR1、LCDR2和LCDR3(27B10)。
其中,HCDR1、HCDR2和HCDR3为重链可变区中的三个互补决定区(CDR),LCDR1、LCDR2和LHCDR3为轻链可变区中的三个互补决定区(CDR)。互补决定区的序列根据Kabat(10A5)或IMGT(27B10)编号系统定义。
进一步地,上述的抗体或其抗原结合片段中,所述抗体可为鼠源抗体、嵌合抗体或人源化抗体中的任一种或几种。
进一步地,上述的抗体或其抗原结合片段中,所述重链可变区和轻链可变区可选自下述任一种:
A1)、所述重链可变区的氨基酸序列为SEQ ID No.20或与SEQ ID No.20具有至少90%的同一性,所述轻链可变区的氨基酸序列为SEQ ID No.25或与SEQ ID No.25具有至少90%的同一性;
A2)、所述重链可变区的氨基酸序列为SEQ ID No.27或与SEQ ID No.27具有至少90%的同一性,所述轻链可变区的氨基酸序列为SEQ ID No.30或与SEQ ID No.30具有至少90%的同一性;
A3)、所述重链可变区的氨基酸序列为SEQ ID No.5或与SEQ ID No.5具有至少90%的同一性,所述轻链可变区的氨基酸序列为SEQ ID No.6或与SEQ ID No.6具有至少90%的同一性;
A4)、所述重链可变区的氨基酸序列为SEQ ID No.7或与SEQ ID No.7具有至少90%的同一性,所述轻链可变区的氨基酸序列为SEQ ID No.8或与SEQ ID No.8具有至少90%的同一性。
进一步地,上述的抗体或其抗原结合片段中,所述抗体还包括重链恒定区和轻链恒定区,所述重链恒定区可为IgG1、IgG2、IgG3或IgG4中的一种,所述轻链恒定区的类别可为κ链或λ链。
进一步地,上述的抗体或其抗原结合片段中,所述重链恒定区可为人或小鼠的IgG1、IgG2、IgG3或IgG4中的一种,所述轻链恒定区的类别可为人或小鼠的κ链或λ链。
进一步地,上述的抗体或其抗原结合片段中,所述重链恒定区可为人或小鼠的IgG1,所述轻链恒定区的类别可为人或小鼠的κ链。
进一步地,上述的抗体或其抗原结合片段中,所述重链恒定区可为人的IgG1,所述轻链恒定区的类别可为人的κ链。
进一步地,上述的抗体或其抗原结合片段中,所述抗原结合片段可为Fab片段、Fv片段、Fab′片段、F(ab′)
第二个方面,本发明还提供生物材料,所述生物材料可为下述中的任一种:
B1)、编码上述抗体或其抗原结合片段的重链可变区和/或轻链可变区的核酸分子;
B2)、编码上述抗体或其抗原结合片段的重链和/或轻链的核酸分子;
B3)、编码上述抗体或其抗原结合片段的核酸分子;
B4)、含有B1)-B3)任一所述核酸分子的表达盒;
B5)、含有B1)-B3)任一所述核酸分子的重组载体、或含有B4)所述表达盒的重组载体;
B6)、含有B1)-B3)任一所述核酸分子的重组微生物、或含有B4)所述表达盒的重组微生物、或含有B5)所述重组载体的重组微生物;
B7)、含有B1)-B3)任一所述核酸分子的细胞系、或含有B4)所述表达盒的细胞系、或含有B5)所述重组载体的细胞系。
进一步地,上述的生物材料中,所述核酸分子可为下述任一种:
C1)、核苷酸序列是SEQ ID No.35的DNA分子(编码Hu10A5-33的重链可变区);
C2)、核苷酸序列是SEQ ID No.40的DNA分子(编码Hu10A5-33的轻链可变区);
C3)、核苷酸序列是SEQ ID No.9的DNA分子(编码10A5的重链可变区);
C4)、核苷酸序列是SEQ ID No.10的DNA分子(编码10A5的轻链可变区);
C5)、核苷酸序列是SEQ ID No.15的DNA分子(编码Hu10A5-33的重链);
C6)、核苷酸序列是SEQ ID No.16的DNA分子(编码Hu10A5-33的轻链);
C7)、核苷酸序列是SEQ ID No.42的DNA分子(编码Hu27B10-11的重链可变区);
C8)、核苷酸序列是SEQ ID No.45的DNA分子(编码Hu27B10-11的轻链可变区);
C9)、核苷酸序列是SEQ ID No.11的DNA分子(编码27B10的重链可变区);
C10)、核苷酸序列是SEQ ID No.12的DNA分子(编码27B10的轻链可变区);
C11)、核苷酸序列是SEQ ID No.51的DNA分子(编码Hu27B10-11的重链);
C12)、核苷酸序列是SEQ ID No.52的DNA分子(编码Hu27B10-11的轻链)。
第三个方面,本发明还提供药物组合物,所述药物组合物包含上述抗体或其抗原结合片段。
第四个方面,本发明还提供下述任一项所述的应用:
D1)、上述的生物材料在制备上述抗体或其抗原结合片段中的应用;
D2)、上述的生物材料在制备上述的药物组合物中的应用;
D3)、上述抗体,和/或,上述的生物材料,和/或,上述的药物组合物在制备用于预防和/或治疗T细胞来源疾病的产品中的应用。
进一步地,上述的应用中,所述T细胞来源疾病可为T细胞淋巴瘤,包括T淋巴母细胞淋巴瘤/白血病(T lymphoblastic leukemia/lymphoma),皮肤T淋巴瘤(Cutaneous T-cell lymphomas),血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-celllymphoma,AITL),间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL),外周T细胞淋巴瘤-非特指型(Peripheral T-cell lymphoma,not otherwise specified,PTCL-NOS)等。
本文中,同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如NCBI主页网站的BLAST网页。例如,可在高级BLAST2.1中,通过使用blastp作为程序,将Expect值设置为10,将所有Filter设置为OFF,使用BLOSUM62作为Matrix,将Gap existence cost,Per residue gap cost和Lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
本文中,所述至少90%的同一性可为至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
术语“抗原结合片段”是指抗体的抗原结合片段及抗体类似物,其通常包括至少部分母体抗体(parental antibody)的抗原结合区或可变区(例如一个或多个CDR)。所述抗原结合片段保留母体抗体的至少某些结合特异性。通常,当基于摩尔来表示活性时,所述抗原结合片段保留至少10%的母体结合活性。具体地,所述抗原结合片段保留至少20%、50%、70%、80%、90%、95%或100%或更多的母体抗体对靶标的结合亲和力。
术语“Fab片段”是由重链Fd和完整轻链通过二硫键结合而成的异二聚体,仅含一个抗原结合位点。将重链Fd和完整轻链的编码基因连接,融合细菌蛋白信号肽基因后可在大肠杆菌内分泌表达Fab抗体(Fab片段),并有完整的立体折叠和链内、链间二硫键。所述重链Fd指Fab中约1/2的H链部分(约含225个氨基酸残基,包括VH、CH1和部分铰链区)。
术语“Fv片段”是指可分别构建含有VH和VL基因的载体,共转染细胞,使之分别表达,再组装成功能性Fv抗体;也可在载体中的VH和VL之间设置终止密码,分别表达两个小分子蛋白片段,再通过非共价键结合而形成Fv抗体(Fv片段)。
术语“Fab′片段”含有一条轻链和包含VH结构域和CH1结构域以及CH1和CH2结构域之间区域的一条重链的部分,由此可在两个Fab′片段的两条重链之间形成链间二硫键以形成F(ab′)
术语“F(ab′)
术语“单链抗体(ScFv)”是指用适当的寡核苷酸接头(linker)连接轻链和重链可变区基因,使之表达单一的多肽链,称为单链抗体(ScFv)。多肽链能自发折叠成天然构象,保持Fv的特异性和亲和力。
术语“纳米抗体(单域抗体)”是指将抗体重链V区通过基因工程方法表达,获得仅含VH片段的抗体。单域抗体与抗原结合的能力及其稳定性,与完全抗体基本一致。
术语“双特异性抗体”是指将两套轻链、重链基因导入骨髓瘤细胞中,选择合适的抗体恒定区及Ig类型,可获得产量大、均一性和纯度高的双特异性抗体。另外,以化学交联技术或杂交-杂交瘤技术也可获得双特异性抗体。
术语“最小识别单位(MRU)”是指仅含可变区中单一CDR结构,分子质量仅为完整抗体的1%左右,可结合相应抗原。
本文所述载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体(如λ噬菌体或M13丝状噬菌体等)、黏粒(即柯斯质粒)、病毒载体(如杆状病毒载体、逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒或疱疹病毒(如单纯疱疹病毒)等)。
本文所述微生物可为酵母、细菌或真菌。其中,细菌可来自埃希氏菌属(Escherichia),欧文氏菌(Erwinia),根癌农杆菌属(Agrobacterium)、黄杆菌属(Flavobacterium),产碱菌属(Alcaligenes),假单胞菌属(Pseudomonas),芽胞杆菌属(Bacillus)等;酵母可为毕赤酵母(P.pastoris)。
所述细胞系(宿主细胞)是指可用于导入载体的细胞,其包括但不限于:真核细胞(如酵母细胞、曲霉菌)、动物细胞(如哺乳动物细胞、昆虫细胞)或原核细胞。在本发明的一个实施例中,所述细胞系具体可为293F细胞。
术语“细胞”和“细胞系”可互换使用,并且所有这类名称都包括其后代。
具有改善的亲和力和/或效价的本发明所述抗体的变体可通过采用在本领域已知的方法来获得,并包括在本发明的范围内。例如,氨基酸置换可用于获得具有进一步改善的亲合力的抗体。或者,核苷酸序列的密码子优化也可用来改善用于产生抗体的表达系统中的翻译效率。此外,包含通过对本发明的任何核酸序列应用定向进化法而优化抗体特异性或中和活性的序列的多核苷酸也属于本发明的范围内。
本发明的抗体可以本领域已知的各种方法来制备,例如通过基因工程重组技术来获得。例如,通过化学合成或PCR扩增获得编码本发明抗体的重链和轻链基因的DNA分子。将所得DNA分子插入表达载体内,然后转染宿主细胞,在特定条件下培养转染后的宿主细胞,并表达本发明的抗体。
本领域技术人员熟知,所述抗原结合片段可以可通过重组DNA技术或通过完整抗体的酶促或化学断裂产生抗体的抗原结合片段。
本发明取得有益技术效果如下:
获得了特异的针对TRBC2,却不针对TRBC1的鼠源抗体分子10A5和27B10,在人-鼠嵌合、鼠抗体人源化工程改造之后仍然保持亲和力和特异性。报告基因分析表明,10A5和27B10可以介导CD16a受体阳性的效应细胞对靶细胞的杀伤,从而具备抑制肿瘤的潜力。
附图说明
图1为鼠单抗10A5与抗原TRBC1和TRBC2的结合活性。
图2为鼠单抗27B10与抗原TRBC2的结合活性。
图3为嵌合抗体与T细胞结合测定结果。。
图4为以27B10为基础人源化改造获得的人源化抗体的结合活性测定结果。
图5为以10A5为基础人源化改造获得的人源化抗体的结合活性测定结果。
图6为人源化抗体ADCC杀伤活性测定结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中,载体pHR'CMV GFP购自Addgene,Plasmid#14858。
下述实施例中,293F细胞来源于珠海恺瑞。
下述实施例中,PBS制备方法为:NaCl 8g,KCl 0.2g,Na
下述实施例中,甘氨酸洗脱液(pH3.2)的制备方法为:0.1M glycine(甘氨酸),并以盐酸调节pH至3.2。
下述实施例中,含15mM咪唑的PBS的制备方法为:首先制备咪唑母液:称取136.16g咪唑溶于1L去离子水,得2M的咪唑母液,取5ml 10×PBS,375μl咪唑母液,加水定容至50ml;
下述实施例中,含200mM咪唑的PBS洗脱液(pH7.2)的制备方法为:取5ml 10×PBS,5ml咪唑母液以及40ml离子水,混匀即可。
下述实施例中,PBS-T的组成为:PBS中加入0.05%(v/v)吐温20(北京索莱宝T8220)。
实施例1、杂交瘤筛选
1.1、小鼠免疫
以融合蛋白TRBC2-His与弗氏完全佐剂按说明书所载的方法混匀后以腹腔注射方式免疫小鼠(6-8周龄的SJL,购买自The Jackson Laboratory)。初次免疫的注射悬浊液配制120%用量,每只小鼠注射体积在100-200μl,首次免疫中TRBC2-His免疫剂量为60μg/只。首次免疫两周后按照TRBC2-His为30μg/只的免疫剂量将TRBC2-His与弗氏不完全佐剂混匀进行加强免疫。加强免疫每两周进行一次,共加强免疫4次。免疫间隔期对小鼠进行剪尾取血,每次取5μl左右,12000rpm离心取上清,即得到TRBC2免疫组的免疫血清。其中,融合蛋白TRBC2-His的氨基酸序列是SEQ ID No.1。
1.2、效价测定
TRBC2免疫组的免疫血清的效价测定:用PBS稀释TRBC2-hFc蛋白获得TRBC2-hFc蛋白溶液,其中,TRBC2-hFc蛋白浓度为2μg/ml,将TRBC2-hFc蛋白溶液按照100ng/孔/50μl分装于96孔ELISA酶标板,37℃孵育1小时进行抗原包被,然后用5%脱脂牛奶(溶于PBS-T,0.05%吐温20)对酶标板板孔进行封闭,封闭条件为37℃、2小时。弃去封闭液后,用PBS-T洗一次,拍干后用于效价测试。具体步骤为:将获得的TRBC2免疫组免疫血清梯度稀释于1%BSA溶液,获得1:500到1:1,500,000的血清稀释液,加入ELISA板孔内,反应1小时,以PBS-T洗板,加入辣根过氧化物酶偶联的山羊抗鼠IgG抗体(Jackson immunoResearch,货号#115-035-062),反应1小时后,以PBS-T洗板。加入单组分TMB显色液100μl,显色5分钟后,以200μl2M浓硫酸终止。用酶标仪读取各孔在OD450的光吸收值。
将各稀释度的光吸收值除以小鼠免疫前血清2000倍稀释的光吸收值,倍数F大于2.1则视为阳性,F阳性的最大稀释倍数记为小鼠效价。统计各小鼠的效价。大于1百万的,进行冲刺免疫(final boost)。冲刺免疫通过腹腔注射30μg蛋白完成。冲刺免疫3-5天后,进行手术取脾,提取脾细胞,并与小鼠骨髓瘤细胞SP2/0进行融合。
1.3、杂交瘤细胞制备
1.3.1、SP2/0细胞的准备
取5瓶T175中培养的生长度为80-90%的SP2/0细胞(购自武汉尚恩生物技术有限公司,SKU:SNL-120),吸弃上清,在桌上拍打使细胞脱落,用PBS收集细胞至50ml离心管中定容至40ml,1500rpm离心3分钟收集细胞,40ml PBS重悬细胞,SP2/0细胞计数为:3.9*E6/ml,活率94.57%。
1.3.2、脾细胞的处理
(1)、脱颈处死小鼠,75%酒精浸泡5min,用无菌眼科剪和镊子分别取出小鼠脾脏,去除脾脏周边结缔组织。
(2)、在200目不锈钢细胞筛上(PBS浸没滤网)用5ml注射器推头研磨脾脏,并用PBS冲洗掉残留在滤网和注射器推头上的脾细胞,过40μm细胞筛至50ml刻度离心管中,300×g,离心7min。
(3)、吸弃上清,加入2ml RBC lysis buffer(Sigma),并重悬细胞,1min后加入20ml PBS终止裂解。300×g,离心7min,吸弃上清,加入2ml PBS重悬细胞并定容至20ml。计数小鼠脾细胞为:3.16*E6/ml,活率为60.54%;SP2/0为:3.41*E6/ml,活率为66.16%。
1.3.3、融合
分别将TRBC2免疫小鼠脾细胞与SP2/0细胞按2:1比例混合,300×g,离心7min,并用15ml Medium C(BTX)进行重悬洗涤,300×g,离心7min。重复两次。最终重悬于12mlMedium C中。取6ml细胞混悬液加入9ml融合电极中(BTX ECM2001),按表1参数融合获得TRBC2杂交瘤细胞。将融合后的TRBC2杂交瘤细胞重悬于600ml完全培养基中(PRIM1640+15%FBS+1*HAT;Sigma),按200μl/孔把细胞接种于30个96孔培养板中,放置于37℃,5%CO2培养箱中培养获得TRBC2杂交瘤细胞培养上清。
表1:细胞融合参数设置
1.4、筛选
用pH7.2的0.01M PBS稀释TRBC2-hFc(100ng/孔/100μl)包被酶标板4℃过夜,用PBS-T洗涤3次。按每孔300μl加入5%脱脂牛奶(脱脂奶粉溶于PBS-T,PBS中加入0.05%(v/v)吐温20),于37℃孵箱内放置2小时后,弃去液体,用200μl/孔PBS-T清洗2次。小心的吸取50μl梯度稀释的TRBC2组杂交瘤细胞培养上清,加到包被了TRBC2-hFc的酶标板中37℃反应1小时。以PBS-T洗板5次,加入辣根过氧化物酶偶联的山羊抗鼠IgG抗体(JacksonimmunoResearch,货号#115-035-062),反应1小时后,以PBS-T洗板5次,TMB(100μl,北京索莱宝生物科技有限公司,货号#PR1200)显色10分钟以2M H
TRBC2杂交瘤细胞培养上清与TRBC1-hFc的结合活性测定参照上述方法,其区别仅在于将包被抗原TRBC2-hFc替换为TRBC1-hFc。其中融合蛋白TRBC2-hFc的氨基酸序列是SEQID No.2,TRBC1-hFc的氨基酸序列是SEQ ID No.3。
最终获得如表2所示的阳性杂交瘤克隆。表2的结果表明:初步筛选获得TRBC2的杂交瘤克隆27B10、10A5。
表2:阳性杂交瘤克隆的结合活性
备注:表2中“+”表示与相应的抗原结合的强弱。
初次筛选获得阳性杂交瘤克隆,经亚克隆可得到单克隆化的杂交瘤细胞株。扩大培养至30ml无血清培养基(SFM,购自英潍捷基,货号#12045076)可生产单抗并用Protein A亲和层析获得纯度>95%的单克隆抗体(鼠单抗mAb)。以ELISA法测试纯化获得的鼠单抗结合TRBC2或TRBC1的活性。具体方法为:用pH7.2的0.01M PBS稀释TRBC2-hFc(100ng/孔/50μl)包被96孔板置于37℃静置2小时后,弃掉溶液,以PBS-T洗一次,然后加入200μl 5%脱脂牛奶,37℃孵育两小时进行封闭。弃掉牛奶溶液,以PBS-T洗一次后用于抗体活性检测。将制备鼠源抗体27B10和10A5分别以1%BSA(w/v溶于PBST)稀释抗体,最大浓度为20ug/ml,5倍倍比稀释,即得4ug/ml,0.8ug/ml,0.16ug/ml,0.032ug/ml,0.0064ug/ml,0.00128ug/ml和0ug/ml的抗体溶液。吸取50μl抗体溶液加到包被了TRBC2-hFc的酶标板中37℃反应1小时。以PBS-T洗板5次,加入辣根过氧化物酶偶联的山羊抗鼠IgG抗体(JacksonimmunoResearch,货号#115-035-062),反应1小时后,以PBS-T洗板5次,TMB(100μl)显色10分钟以200μl 2M H
鼠单抗与TRBC1-hFc的结合活性测定参照上述方法,其区别仅在于将TRBC2-hFc替换为TRBC1-hFc。
结果如图1和图2所示,图1和图2中纵坐标为读取的OD450值,横坐标为抗体浓度的对数值(以10为底)。图1中10A5-T1表示鼠单抗10A5与抗原TRBC1结合活性,10A5-T2表示鼠单抗10A5与抗原TRBC2结合活性。图2为鼠单抗27B10与抗原TRBC2结合活性。
实施例2、抗体测序和重组嵌合抗体构建
具有结合活性的杂交瘤克隆,进行细胞扩大培养,收集1×10^6个细胞,使用天根公司的RNA提取试剂盒,提取总RNA,并以赛默飞公司的RNA-to-DNA试剂盒反转录获得抗体编码基因的cDNA。
以cDNA为模板,进行聚合酶链式反应(PCR)扩增获得抗体可变区的轻重链编码DNA片段,交由测序公司完成DNA测序,从而获得相应抗体可变区的核苷酸序列,经翻译获得可变区的氨基酸序列。其中,鼠单克隆抗体27B10重链可变区的氨基酸序列是SEQ ID No.5,其编码基因是SEQ ID No.9;轻链可变区的氨基酸序列是SEQ ID No.6,其编码基因是SEQ IDNo.10。鼠单克隆抗体10A5重链可变区的氨基酸序列是SEQ ID No.7,其编码基因是SEQ IDNo.11;轻链可变区的氨基酸序列是SEQ ID No.8,其编码基因是SEQ ID No.12(表3)。
表3:筛选获得的鼠单克隆抗体可变区的氨基酸序列
将嵌合抗体的重链可变区基因构建至载体pHr-IgG1,以27B10重链的重组表达为例,用核苷酸序列是SEQ ID No.9的DNA分子替换载体pHr-IgG1的BsmBI酶切识别位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-IgG1-27B10,重组表达载体pHr-IgG1-27B10可表达嵌合抗体27B10的重链。
用核苷酸序列是SEQ ID No.11的DNA分子替换载体pHr-IgG1的BsmBI酶切识别位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-IgG1-10A5,重组表达载体pHr-IgG1-10A5可表达嵌合抗体10A5的重链。
将嵌合抗体的轻链可变区基因构建至载体pHr-Kappa,以27B10轻链的重组表达为例,用核苷酸序列是SEQ ID No.10的DNA分子替换载体pHr-Kappa的BsmBI酶切识别位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-Kappa-27B10,重组表达载体pHr-Kappa-27B10可表达嵌合抗体27B10的轻链。
用核苷酸序列是SEQ ID No.12的DNA分子替换载体pHr-Kappa的BsmBI酶切识别位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-Kappa-10A5,重组表达载体pHr-Kappa-10A5可表达嵌合抗体10A5的轻链。
载体pHr-IgG1和pHr-Kappa是在载体pHR'CMV GFP基础上改造获得的,以载体pHr-IgG1为例,具体为:用核酸序列是SEQ ID No.13所示的目的DNA分子替换载体pHR'CMV GFP的KpnI和Not I酶切识别位点之间的片段(KpnI和Not I酶切识别位点之间的小片段),保持载体pHR'CMV GFP其他核苷酸序列不变即获得重组载体pHr-IgG1。其中SEQ IDNo.13第19-75位为信号肽基因,第76-123位为缓冲序列(缓冲序列的两端带有BsmBI酶切识别位点),第124-1116位为人IgG1恒定区(CH1+junction+CH2+CH3)。
载体pHr-Kappa的构建参照pHr-IgG1,其区别仅在于将目的DNA替换为SEQ IDNo.14所示的DNA片段。其中SEQ ID No.14第19-84位为信号肽基因,第85-132位为缓冲序列(缓冲序列的两端为BsmBI酶切识别位点),第133-456位为人Kappa恒定区(ConstantKappa)。
将嵌合抗体27B10的重链表达质粒和轻链表达质粒以1.5:1的比例,共同转染293F细胞,将细胞培养液亲和纯化后获得目的抗体(嵌合抗体27B10)。具体地,以总重250微克(其中重组表达载体pHr-IgG1-27B10 150微克,重组表达载体pHr-Kappa-27B10 100微克)嵌合抗体的重链表达质粒和轻链表达质粒与转染试剂PEI混合,并以培养基(opti-mem5ml)稀释后静置,加入到293F细胞培养液中,37℃,5%二氧化碳震荡培养24小时后,加入补料A(购自珠海恺瑞,K40001),继续震荡培养3天,获得细胞培养液。以12000rpm离心细胞培养液30分钟,收集上清液至新的摇瓶中。向收集有上清的摇瓶中加入1ml Protein A凝胶填料(博格隆,AA0131),室温下震荡(145rpm)孵育1-3小时后,使其流过重力层析柱,收集流出液取样冻存以备复测。
以PBS 5ml淋洗柱料,让洗液缓慢流过凝胶柱。加入3ml甘氨酸洗脱液(pH3.2),洗脱捕获的蛋白。用Protein A凝胶亲和纯化获得纯度大于95%的重组嵌合抗体溶液,并最终换液至磷酸盐缓冲液PBS中。
嵌合抗体10A5的制备方法参照27B10,其区别仅在于:将转染293F细胞的重链表达载体和轻链表达载体pHr-IgG1-27B10和pHr-Kappa-27B10替换为pHr-IgG1-10A5和pHr-Kappa-10A5。
实施例3、人T细胞结合
冻存的人外周血单核细胞(PBMC)购自儒佰生物(货号为PBMNC025C),以RPMI1640培养基添加白介素2(义翘神州,货号11848)进行培养,获得CD3+细胞>85%的细胞群。以此T细胞群进行流式细胞分析,检测重组嵌合抗体10A5、27B10、15G9、9E1、和7D3的结合活性。
具体的,将T细胞分装至96孔板,每孔含T细胞5×10^4个,离心弃去上清。制备浓度为20μg/ml的重组嵌合抗体稀释液(稀释液为1%胎牛血清FBS,以PBS稀释FBS,v/v为1%),然后用1%胎牛血清(FBS,以pH7.2的0.01M的PBS稀释)对重组嵌合抗体稀释液进行5×倍比稀释,每种抗体均获得8个不同浓度的溶液(最大浓度为20ug/ml,5倍倍比稀释,即得4ug/ml,0.8ug/ml,0.16ug/ml,0.032ug/ml,0.0064ug/ml,0.00128ug/ml和0ug/ml的抗体溶液(即稀释液)),用这些抗体溶液重悬T细胞后,置于冰上反应1小时。以1% FBS冲洗细胞两次后,以荧光标记(Alexa Fluo488)的山羊抗人IgG(Jackson immunoResearch,109-545-008)溶液(1:200稀释与1% FBS)重悬细胞,置于冰上反应1小时。以1% FBS溶液冲洗细胞两次后,以100μl PBS重悬细胞,并转入welgrow流式细胞分析专用的样品管,上机进行流式细胞分析。收集每种抗体浓度与T细胞结合的平均荧光强度(MFI)数据,并做四参数拟合曲线,可以看到抗体与T细胞的结合强弱。
结果如图3所示。图3的纵坐标为抗体与T细胞结合的平均荧光强度(MFI),横坐标为抗体浓度的对数值(以10为底)。图3结果表明:嵌合抗体T细胞的结合强弱由强到弱分别为10A5、27B10、15G9、9E1、7D3。
实施例4、亲和力测定
采用仪器:Reichert 4SPR,芯片为SAM芯片(cat#13206061)。
环境温度设定为25℃,运行缓冲液为PBS-T。取EDC((1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐))40mg,NHS(N-羟基丁二酰亚胺)10mg溶入1mL去离子水中,流速10μL/min,EDC/NHS注射7min;抗体用10mM乙酸钠溶液(溶质为乙酸钠,溶剂为去离子水,pH5.0)稀释至10μg/mL,以流速10μl/min注射7min,以便将抗体固定在芯片表面。然后用pH8.5 1M乙醇胺封闭7min。
抗原用PBS-T稀释,2倍梯度稀释获得浓度分别为6.25nM,12.5nM,25nM,50nM,100nM的抗原稀释液,流速为25μL/min,结合3min,解离5min。测定抗体的亲和力。结果如表4所示,表4中ka(1/(M*s))表示抗原抗体结合速率,kd(1/s)表示抗原抗体解离速率,KD(M)表示亲和力常数。其中抗体为嵌合抗体10A5或27B10,抗原为融合蛋白TRBC2-hFc或融合蛋白TRBC1-hFc。芯片再生条件:pH2.0 10mM甘氨酸冲洗表面15秒。
结果如表4所示,表4的结果表明:嵌合抗体10A5或27B10:结合TRBC2的活性远远强于结合TRBC1。
表4:亲和力测定结果
实施例5、抗体人源化
5.1、人源化抗体制备
选定27B10和10A5做抗体人源化改造。以IMGT划定标准确定鼠源抗体27B10、以Kabat划定标准确定鼠源抗体10A5的HCDR1、HCDR2、HCDR3和LCDR1、LCDR2、LCDR3,搜索合适的人IgG种系,并将CDR区域移植到该人种系IgG可变区(保留了框架区FR)。通过DiscoveryStudio软件鉴定需要回突变(back mutation)的关键氨基酸,改动为相应的母本单抗氨基酸,将这些带有不同回突变氨基酸的轻重链分子进行配对组合,共转染293F细胞,表达并纯化相应的抗体分子。人源化改造的具体信息如表5。
表5:人源化改造的具体信息
其中,VH0/VL0为重链CDR1/2/3移植到人IgG/Ig-kappa可变区之后,没有进行任何氨基酸位点的回突变,而VH1-4或VL1-3则是进行了若干回突变。
其中10A5分子中,VH0的氨基酸序列为SEQ ID No.17,VH0的核苷酸序列为SEQIDNo.32;VH1的氨基酸序列为SEQ ID No.18,VH1的核苷酸序列为SEQ ID No.33;VH2的氨基酸序列为SEQ ID No.19,VH2的核苷酸序列为SEQ ID No.34;VH3的氨基酸序列为SEQIDNo.20,VH3的核苷酸序列为SEQ ID No.35;VH4的氨基酸序列为SEQ ID No.21,VH4的核苷酸序列为SEQ ID No.36;VL0的氨基酸序列为SEQ ID No.22,VL0的核苷酸序列为SEQIDNo.37;VL1的氨基酸序列为SEQ ID No.23,VL1的核苷酸序列为SEQ ID No.38;VL2的氨基酸序列为SEQ ID No.24,VL2的核苷酸序列为SEQ ID No.39;VL3的氨基酸序列为SEQIDNo.25,VL3的核苷酸序列为SEQ ID No.40。
27B10分子中,VH0的氨基酸序列为SEQ ID No.26,VH0的核苷酸序列为SEQ IDNo.41;VH1的氨基酸序列为SEQ ID No.27,VH1的核苷酸序列为SEQ ID No.42;VH2的氨基酸序列为SEQ ID No.28,VH2的核苷酸序列为SEQ ID No.43;VL0的氨基酸序列为SEQ IDNo.29,VL0的核苷酸序列为SEQ ID No.44;VL1的氨基酸序列为SEQ ID No.30,VL1的核苷酸序列为SEQ ID No.45;VL2的氨基酸序列为SEQ ID No.31,VL2的核苷酸序列为SEQ IDNo.46。
将人源化抗体的重链可变区基因构建至载体pHr-IgG1,以hu10A5-33为例,用核苷酸序列是SEQ ID No.35的DNA分子替换载体pHr-IgG1的BsmBI酶切位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-IgG1-hu10A5-33,重组表达载体pHr-IgG1-hu10A5-33可表达人源化抗体hu10A5-33的重链。人源化抗体hu10A5-33的重链编码基因是核苷酸序列为SEQ ID No.15的DNA分子,重链可变区的氨基酸序列是SEQIDNo.20,重链的氨基酸序列是SEQ ID No.47。
将人源化抗体的轻链可变区基因构建至载体pHr-Kappa,以hu10A5-33为例,用核苷酸序列是SEQ ID No.40的DNA分子替换载体pHr-Kappa的BsmBI酶切位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-Kappa-hu10A5-33,重组表达载体pHr-Kappa-hu10A5-33可表达人源化抗体hu10A5-33的轻链。人源化抗体hu10A5-33的轻链编码基因是核苷酸序列为SEQ ID No.16的DNA分子,可变区的氨基酸序列是SEQIDNo.25,轻链的氨基酸序列是SEQ ID No.48。
用核苷酸序列是SEQ ID No.42的DNA分子替换载体pHr-IgG1的BsmBI酶切位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-IgG1-hu27B10-11,重组表达载体pHr-IgG1-hu27B10-11可表达人源化抗体hu27B10-11的重链。人源化抗体hu27B10-11的重链编码基因是核苷酸序列为SEQ ID No.51的DNA分子,重链可变区的氨基酸序列是SEQ ID No.27,重链的氨基酸序列是SEQ ID No.49。
用核苷酸序列是SEQ ID No.45的DNA分子替换载体pHr-Kappa的BsmBI酶切位点之间的片段(包含BsmBI酶切识别位点在内的小片段)获得重组表达载体pHr-Kappa-hu27B10-11,重组表达载体pHr-Kappa-hu27B10-11可表达人源化抗体hu27B10-11的轻链。人源化抗体hu27B10-11的轻链编码基因是核苷酸序列为SEQ ID No.52的DNA分子,可变区的氨基酸序列是SEQ ID No.30,轻链氨基酸序列是SEQ ID No.50。
将人源化抗体hu10A5-33的重链表达质粒和轻链表达质粒以1:2的比例,共同转染293F细胞,进行人源化抗体hu10A5-33的制备,细胞培养上清亲和纯化后获得目的抗体(人源化抗体hu10A5-33)。具体地,以总重250微克人源化抗体hu10A5-33的重链表达质粒和轻链表达质粒(pHr-IgG1-hu10A5-33 50微克和pHr-Kappa-hu10A5-33 100微克)与转染试剂PEI混合,并以培养基(opti-mem 5ml)(稀释后静置,加入到293F细胞培养液中,37℃,5%二氧化碳震荡培养24小时候,加入补料A(购自珠海恺瑞,K40001),继续震荡培养3天,获得细胞培养液。以12000rpm离心细胞培养液30分钟,收集上清液至新的摇瓶中。向收集有上清的摇瓶中加入1ml Protein A凝胶填料(博格隆,AA0131),室温下震荡(145rpm)孵育1-3小时后,使其流过重力层析柱,收集流出液取样冻存以备复测。以PBS 5ml淋洗柱料,让洗液缓慢流过凝胶柱。加入3ml甘氨酸洗脱液(pH3.2),洗脱捕获的蛋白。用Protein A凝胶亲和纯化获得纯度大于95%的重组人源化抗体溶液,并最终换液至磷酸盐缓冲液PBS中。
人源化抗体hu27B10-11的制备过程参照人源化抗体hu10A5-33,其区别仅在于:将转染质粒替换为人源化抗体hu27B10-11的重链表达载体pHr-IgG1-hu27B10-11和轻链表达载体pHr-Kappa-hu27B10-11。其他人源化抗体的制备过程参照人源化抗体hu10A5-33,其区别仅在于将转染质粒替换为对应人源化抗体的表达载体。
5.2、结合活性测定
用pH7.2的0.01M PBS稀释TRBC2-mFc(100ng/孔/50μl)包被96孔板置于37℃静置2小时后,弃掉溶液,以PBS-T洗一次,然后加入200μl 5%脱脂牛奶,37℃孵育两小时进行封闭。弃掉牛奶溶液,以PBS-T洗一次后用于抗体活性检测。其中TRBC2-mFc的氨基酸序列是SEQ ID No.4。
将制备获得的人源化抗体分别用1% BSA(w/v溶于PBST)稀释抗体,最大浓度为20ug/ml,5倍倍比稀释,即得4ug/ml,0.8ug/ml,0.16ug/ml,0.032ug/ml,0.0064ug/ml,0.00128ug/ml和0ug/ml的抗体溶液。吸取50μl抗体溶液加到包被了TRBC1-mFc的酶标板中37℃反应1小时。以PBS-T洗板5次,加入辣根过氧化物酶偶联的山羊抗人IgG抗体,反应1小时后,以PBS-T洗板5次,TMB(100μl)显色10分钟以200μl 2M H
实验结果如图4和图5所示,图4和图5中纵坐标为读取的OD450值,横坐标为抗体浓度的对数值(以10为底)。图4和图5的结果表明:以10A5或27B10为基础人源化改造获得的人源化抗体与TRBC2均有较强的结合活性,其中hu10A5-33
实施例6、ADCC杀伤
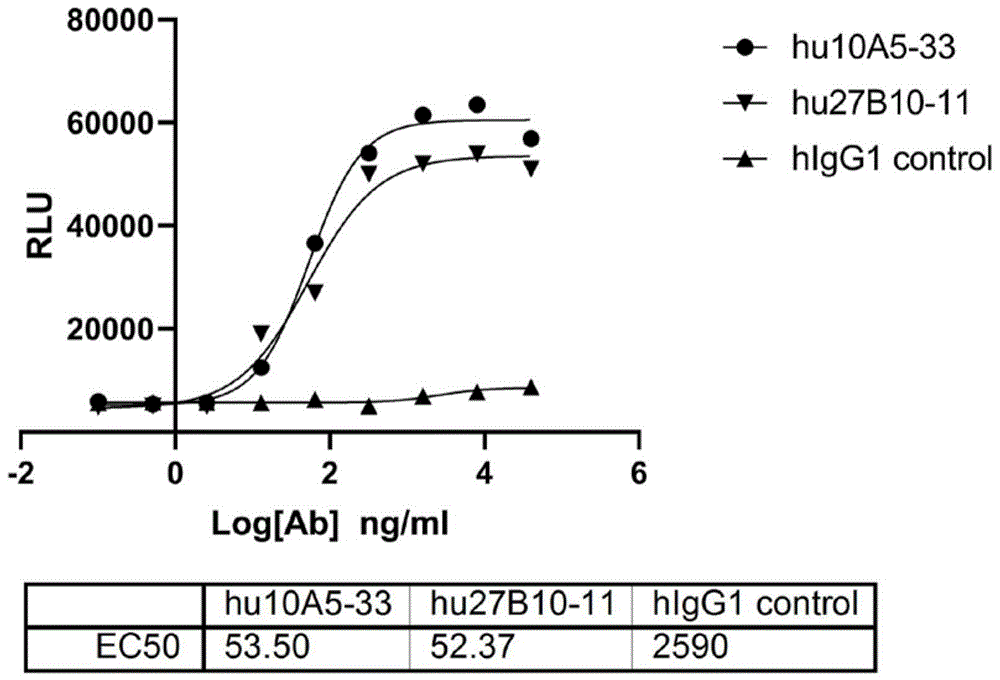
采用Rhino biotech的ADCC报告基因系统(货号为RA-CK01),按照操作手册测试人源化抗体hu10A5-33或hu27B10-11介导的ADCC效应,其中人源化抗体以1% BSA(w/v溶于PBST)稀释抗体,最大浓度为20ug/ml,5倍倍比稀释,即得4ug/ml,0.8ug/ml,0.16ug/ml,0.032ug/ml,0.0064ug/ml,0.00128ug/ml和0ug/ml的抗体溶液。以hlgG1为对照。该系统的效应细胞表面稳定表达功能性的CD16a分子,当抗体药物分子成功靶向靶细胞,且其Fc功能区结合了CD16a,则信号转导将会启动,从而激活NFAT启动子控制的Luciferase表达,裂解细胞,并加入luciferein底物,就会发光,且能够被多功能酶标仪捕捉到,从而量化抗体分子介导ADCC杀伤的活性。
实验结果如图6所示,图6中纵坐标为抗体浓度与T细胞结合的平均发光强度(RLU),横坐标为抗体浓度的对数值(以10为底);图6中hlgG1 control代表同型对照hlgG1,hu10A5-33代表人源化抗体hu10A5-33,hu27B10-11代表人源化抗体hu27B10-11。图6结果表明:结果表明人源化抗体hu10A5-33或hu27B10-11分子均可以有效介导效应细胞的激活,而同型对照IgG1则不具备这种活性。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。
