一种用于生产PD-1抗体的CHO细胞高效灌流补料培养方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物制药及生物工程领域,具体涉及抗体药生产的细胞培养技术领域,尤其是涉及一种用于生产PD-1抗体的CHO细胞灌流补料培养方法。
背景技术
自上世纪70年代,随着DNA重组技术和单克隆抗体技术的出现,推动着生物制药领域的迅速发展。从1986年第一个治疗性抗体——抗CD3单抗OKT3进入市场以来,已有百余种治疗性抗体药获得FDA批准,成为现代生物医药的重要组成部分,广泛用于恶性肿瘤、免疫性疾病、遗传缺陷疾病、病毒性疾病等方面的治疗。
程序死亡受体1(Programmed Death-1)是免疫检查点蛋白之一,属于免疫球蛋白超家族CD28家族成员。其在限制T细胞活性中发挥着重要作用,活化的T细胞表面的PD-1与在肿瘤细胞表面的PD-L1相互作用,对免疫应答起负调节并减弱抗肿瘤免疫力。目前,已有针对PD-1靶点的多种抗体类药物获批上市。
CHO细胞因其能够快速、高水平的表达多种重组蛋白,使用悬浮培养工艺易于放大培养,在生物制药领域中被广泛应用于生产治疗型蛋白。常用的CHO细胞培养方式包括批次培养、补料分批培养和连续培养(灌流培养)。其中,灌流培养通过不断更换新鲜培养基,及时去除培养环境中的代谢废弃物如乳酸、铵离子等,能维持较高密度和活率的细胞生长,延长了细胞的培养时间,并且大幅提高了蛋白产量、确保了良好的产品一致性。因此,该方法在生产上越来越受重视和推广。
目前,典型的连续灌流培养方式是采用截留装置将细胞分泌的产物在培养期间被保留在生物反应器内或被收获。这种灌流培养工艺一方面需要消耗大量培养基,大大增加了生产成本;另一方面细胞截留装置长时间运行也会增加截留膜孔堵塞的概率,导致蛋白损失和质量下降。因此,需要对连续灌流培养工艺进一步优化,在实现细胞高密度、高活率、高产量的同时,降低生产成本,提高产品质量。
发明内容
发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种用于生产PD-1抗体的CHO细胞高效灌流补料培养方法,通过优化培养基、溶氧设置、温度设置等,使得细胞培养过程中营养充分、传质均匀、代谢废物减少,降低了生产能耗,有效地改善了抗体产品的电荷异质性,显著增加了抗体的表达量,方法具有极广的适应性。
为了解决上述技术问题,本发明公开了一种用于生产PD-1抗体的CHO细胞高效灌流补料培养方法,包括如下步骤:
(1)在细胞培养容器中加入基础培养基,接种表达PD-1单克隆抗体的CHO细胞后进行培养;其中,所述表达PD-1单克隆抗体的CHO细胞可通过如下方法获得:宿主细胞CHO-K1购自ATCC(NO.CCL61),编码PD-1抗体的轻、重链基因见专利CN106432494A,构建携带抗体轻、重链基因的表达载体pcDNA3.1-LC-G418和pcDNA3.1-HC-zeocin转染CHO-K1细胞。将转染24h后的细胞用选择性培养基(500ug/mL G418+400ug/mL Zeocin)筛选以获得迷你细胞群。迷你细胞群恢复后利用流式分选技术进行克隆筛选,通过摇管分批补料实验进行克隆评估后挑选表达量最高、抗体质量最佳的克隆用于上游细胞培养工艺,将该克隆命名为Clone1。
(2)培养过程中,当细胞培养至活细胞密度为50×10
其中,所述基础培养基为Hycell CHO培养基,所述Hycell CHO培养基中添加如下组分:4mM谷氨酰胺、1%v/v HT添加剂、0.7g/L CB5、1g/L泊洛沙姆188和0.1mg/LCuSO
其中,灌流补料培养中,在第2天至第6天,基础培养基按照0.2~1.0VVD速率进行灌流;第一补料培养基按照0.02~0.10VVD速率进行灌流;第二补料培养基按照0.002~0.01VVD速率进行灌流。优选的,灌流补料培养中,在第2天至第6天,基础培养基按照0.2~0.8VVD阶梯递增的速率进行灌流;第一补料培养基按照0.02~0.08VVD速率进行灌流;第二补料培养基按照0.002~0.008VVD速率进行灌流。
在一种优选的实施方式中,第2天和第3天,基础培养基按照0.4VVD速率进行灌流,第一补料培养基按照0.04VVD速率进行灌流;第二补料培养基按照0.004VVD速率进行灌流;第4天和第5天,基础培养基按照0.6VVD速率进行灌流,第一补料培养基按照0.06VVD速率进行灌流;第二补料培养基按照0.006VVD速率进行灌流;第6天,基础培养基按照0.8VVD速率进行灌流,第一补料培养基按照0.08V速率进行灌流,第二补料培养基按照0.008VVD速率进行灌流。
在流加培养中,以初始培养体积的3~7%在第7天、第9天、第11天和第13天流加第一补料培养基,以初始培养体积的0.3~0.7%在第7天,第9天,第11天和第13天流加第二补料培养基。上述初始培养体积的含义为初始培养时整个培养基的体积。
优选地,在流加培养中,以5%培养体积的比例在第7天,第9天,第11天和第13天流加第一补料培养基,以0.5%培养体积的比例在第7天,第9天,第11天和第13天流加第二补料培养基。
在本发明的一些实施方式中,在活细胞密度达到峰值前降低细胞培养温度,诱导CHO细胞停留在G1/G0期,从而促进抗体蛋白的表达,同时抑制CHO细胞有丝分裂,抑制细胞过度生长。步骤(2)中,培养温度降低至30-34℃,溶氧值(DO)由初始的DO≥15%,设定值40%,调整为DO≥10%,设定值20%。
优选地,细胞培养容器转速在第0天到第5天为200~260rpm,第6天后调整为300-320rpm。
在本发明的一些实施方式中,通过具有中空纤维过滤器的细胞截留系统将细胞和产物保留在生物反应罐内。在一些实施方式中,具有中空纤维过滤器的截留系统是交替切向流(ATF)装置。在一些实施方式中,该中空纤维过滤器的膜孔径为约50KD。
优选地,培养至第14天或当细胞活率低于60%时结束培养,收获上清液并检测抗体表达量及质量。
其中,步骤(1)中,细胞接种量为1.3~1.9×10
有益效果:本发明通过筛选了一种适用于PD-1抗体生产的培养基配方并优化了DO设置,有助于降低生产能耗;同时本发明的抗体生产方法显著增加了抗体产量,并提高了抗体质量。在优选的实施方案中,酸性峰含量降至23.1%,抗体表达量提高至5.98g/L,为PD-1抗体在生产过程中产品质量和产量的提升提供一种非常简便、有效、稳定的方法。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
图1显示了本发明实施例和比较例的活细胞密度随培养时间的变化图;
图2显示了本发明实施例和比较例的细胞活率随培养时间的变化图;
图3显示了本发明实施例和比较例的乳酸浓度随培养时间的变化图;
图4显示了本发明实施例和比较例的葡萄糖浓度随培养时间的变化图;
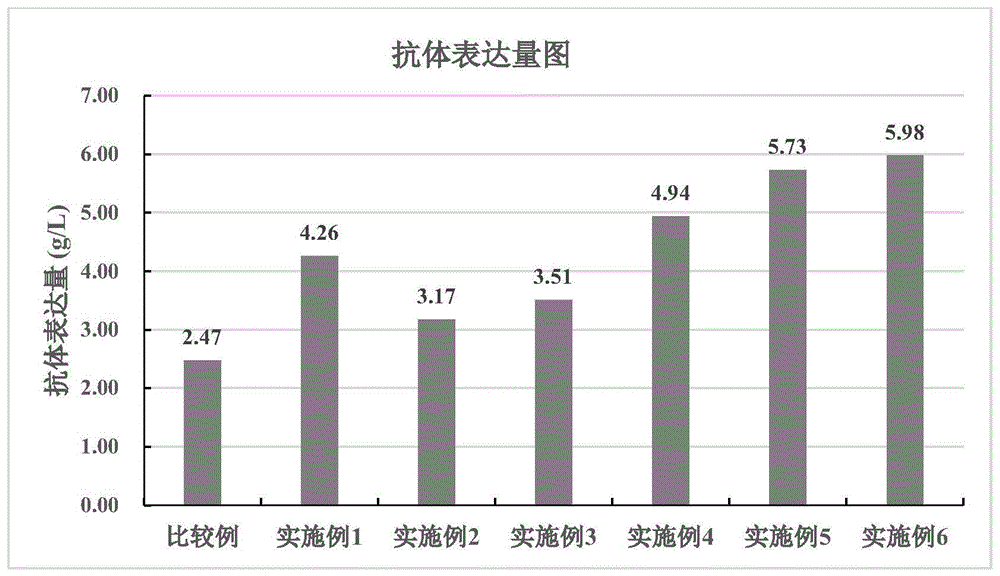
图5显示了本发明实施例和比较例的抗体表达量图;
图6显示了本发明实施例和比较例的体积排阻色谱法(SEC)聚体检测结果图;
图7显示了本发明实施例和比较例的体积排阻色谱法(SEC)单体检测结果图;
图8显示了本发明实施例和比较例的阳离子色谱法(CEX)酸性峰检测结果图;
图9显示了本发明实施例和比较例的阳离子色谱法(CEX)主峰检测结果图;
图10显示了本发明实施例和比较例的阳离子色谱法(CEX)碱性峰检测结果图。
具体实施方式
除非另有说明,本发明所述的技术和科学术语均与本领域内普通技术人员通常理解的含义相同。
术语“抗体”指免疫球蛋白分子,可以通过可变区内至少一个抗原识别位点特异性结合靶标分子。本属于包括但不限于单克隆抗体、多克隆抗体、抗体片段、融合蛋白。本发明优选实施方式中,抗体是PD-1单克隆抗体。
术语“细胞培养物”包括培养体系中所有的细胞及细胞碎片。
术语“灌流培养”指把细胞和培养基一起加入反应器后,在细胞增长和产物形成过程中,不断地将部分条件培养基取出,同时又连续不断地灌注新的培养基。
术语“生物反应器”指用于细胞培养的系统,该系统可以提供细胞生长所需的合适的温度、pH、氧浓度、搅拌等。所述反应器的体积具有多种尺寸,可以是3升、7升、15升或更多。
术语“细胞截留系统”是指一种有效的过滤截留技术,可以用来分离混合物、细胞培养物、分子混合物或者别的片段,可以与生物反应器连接。所述该系统由控制器和过滤系统组成。本发明优选细胞截留系统包括ATF2或ATF10。
术语“微泡底通装置”是指可以向生物反应器中提供氧气和/或其他气体的通气装置。本申请通过微泡底通装置进行调节空气底通。
术语“基础培养基”是指用于起始细胞培养并能支持细胞生长的细胞培养基,包括但不限于CD OptiCHO AGT(Invitrogen),CD CHO AGT(Invitrogen)。
术语“补料培养基”是指在细胞生长旺盛期继续添加成分限定的营养物质支持细胞生长,包括但不限于Cell boost7a/Cell boost7b(Invitrogen)(即CB7a和CB7b)。
术语“活细胞密度”是指一定体积的培养基中含有的活细胞的数量,使用单位“cells/mL”表示。
术语“细胞活率”是指一定体积的培养基中含有的活细胞总数与总细胞数的比例,使用单位“%”表示。
术语“抗体表达量”是指一定体积细胞培养物中所产生的抗体总量,使用单位“g/L”表示。
下面具体实施例中,通过考察培养基选择、补料策略等对于培养的影响,进一步的详述本申请的技术方案。
下述实施例中,采用同样的种子细胞扩增方法:将稳定表达PD-1单克隆抗体的CHO细胞水浴锅复苏后,转移至含有4mM谷氨酰胺的CD CHO AGT培养基中扩增培养,每2~3天传代一次,使用250~3000mL的摇瓶进行扩增,控制培养摇床的温度为36.0~37.0℃,转速110rpm,相对湿度70%,待细胞生长活细胞密度达到2.00~6.00×10
其中,所述表达PD-1单克隆抗体的CHO细胞可通过如下方法获得:宿主细胞CHO-K1购自ATCC(NO.CCL61),编码PD-1抗体的轻、重链基因见专利CN 106432494A,构建携带抗体轻、重链基因的表达载体pcDNA3.1-LC-G418和pcDNA3.1-HC-zeocin转染CHO-K1细胞。将转染24h后的细胞用选择性培养基(500ug/mL G418+400ug/mL Zeocin)筛选以获得迷你细胞群。迷你细胞群恢复后利用流式分选技术进行克隆筛选,通过摇管分批补料实验进行克隆评估后挑选表达量最高、抗体质量最佳的克隆用于上游细胞培养工艺,将该克隆命名为Clone1。
在生物反应器中的细胞培养过程中采用孔径50KD的中空纤维柱及ATF控制器进行灌流。
下述实施例中,HT添加剂即为100x HT补充液(Life TechnologiesCorporation)。
除非另外说明,下述比较例和实施例中,接种前调整各工艺参数为设定值,包括:反应器初始温度36.5℃,pH值6.90,死区值±0.3,溶氧≥15%,转速240rpm,表通空气0.5LPM,底通空气0.05LPM,底通二氧化碳关联至pH值。
比较例
本比较例采用流加培养方法进行抗体生产,具体过程如下:
(a)细胞复苏阶段:将Clone1复苏,37℃水浴,120~150秒内快速解冻;将细胞悬液移至含有40ml预热好的完全培养基,组分为:CD CHO+4mM Glutamine+1%HT(含义为含有1%v/v HT添加剂(次黄嘌呤钠盐/胸苷)和4mM谷氨酰胺的CD CHO培养基,下文中相关培养基具有类似的含义)中,调节细胞接种密度至0.4×10
(b)种子扩增阶段:按照扩增计划,细胞培养2~4天后,取样检测活细胞密度及细胞活率,观察细胞形态。当活细胞密度及细胞活率满足下一级扩增要求后,在生物安全柜内用预热的完全培养基将细胞按种子扩增计划要求接种至相应规格一次性无菌锥形瓶中;
(c)细胞培养阶段:待种子液活细胞密度达到2~6×10
(d)细胞培养至第5天~第7天,培养温度降至31℃;培养第6天,将转速调整为312rpm;同时在第3、5、7、9、11天以如下的策略进行补料培养,直至培养结束,第一补料培养基为CB7a,第二补料培养基为CB7b,补料策略为:每两天补料一次,第一补料培养基补料比例为初始培养体积的5%,第二补料培养基添加比例为初始培养体积的0.5%;当葡萄糖浓度低于3g/L时,补加葡萄糖母液至6g/L;
(e)待细胞活率降至60%或培养至第14天时结束细胞培养,收获上清液;
(f)本比较例对培养产物进行测试,得到如下结果:抗体表达量为2.47g/L,聚体和单体含量分别是2.0%、97.8%;酸性峰含量为28.3%,主峰含量为50.1%。
实施例1
本实施例采用与比较例相同的方法进行培养,不同的是:
(a)采用先灌流后流加的培养策略,具体为第2天至第6天进行灌流培养,灌流策略如表1;第7天、第9天、第11天和第13天流加第一补料培养基和第二补料培养基,分别按照初始培养体积的5%、0.5%比例进行流加培养;
表1灌流策略
(b)基础培养基为Hycell CHO培养基,所述Hycell CHO培养基中添加如下组分:4mM谷氨酰胺、1%v/v HT添加剂、0.7g/L CB5、1g/L泊洛沙姆188;第一补料培养基为CB7a,第二补料培养基为CB7b。
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相较于比较例,实施例1活细胞密度整体提高,第7天~第8天达到峰值,约60×10
从本实施例的以上结果可知,采用先灌流后流加的培养方式有利于提高抗体表达量,降低酸性峰含量。
实施例2
本实施例采用与实施例1相同的方法进行培养,不同的是:基础培养基为CD04培养基,并添加如下组分:4mM谷氨酰胺、1%v/v HT添加剂、0.7g/L CB5和1g/L泊洛沙姆188;第一补料培养基为Feed02A,第二补料培养基为FeedB02。
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相较于实施例1,实施例2的活细胞密度整体较低,培养后期细胞衰亡趋势增大,收获时细胞活率在90%以上;乳酸水平早期快速上升后下降,后期波动明显;葡萄糖水平较稳定,维持在1-6g/L之间。实施例2抗体表达量为3.17g/L;聚体含量为2.7%,单体含量为97.2%;酸性峰含量为29.0%,碱性峰含量为22.5%,主峰含量为48.5%。
实施例3
本实施例采用与实施例1相同的方法进行培养,不同的是:基础培养基为ActiPro培养基,并添加如下组分:4mM谷氨酰胺、1%v/v HT添加剂、0.7g/L CB5、1g/L泊洛沙姆188;第一补料培养基为CB7a,第二补料培养基为CB7b。
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相较于实施例1,实施例3的活细胞密度整体较低,在第6天~第7天达到峰值,约40×10
从实施例1、实施例2和实施例3的结果可知,基础培养基为Hycell CHO+4mM谷氨酰胺+1%v/v HT添加剂+0.7g/L CB5+1g/L泊洛沙姆188更有利于抗体表达。
实施例4
本实施例采用与实施例1相同的方法进行培养,不同的是:基础培养基为HycellCHO培养基,并添加如下组分:4mM谷氨酰胺、1%v/v HT添加剂、0.7g/L CB5、1g/L泊洛沙姆188和0.1mg/L CuSO
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相对于实施例1,实施例4活细胞密度增高,第6天~第7天达到峰值,约64×10
从本实施例的以上结果可知,基础培养基中添加硫酸铜能显著降低乳酸含量,降低酸性峰含量,提高主峰含量。
实施例5
本实施例采用与实施例4相同的方法进行培养,不同的是:当VCD≥50×10
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相对于实施例4,实施例5活细胞密度增高,第6天~第7天达到峰值,约61×10
从本实施例的以上结果可知,优化降温设置,抗体产量和质量明显提高。
实施例6
本实施例采用与实施例5相同的方法进行培养,不同的是:降温的同时,DO从≥15%,设定值40%调整为≥10%,设定值20%。
对细胞生长状态及培养产物进行测试,结果如图1-图10所示。
其中,相对于实施例5,实施例6活细胞密度整体维持较高,第6天~第7天达到峰值,约69×10
从本实施例的以上结果可知,优化DO设置及降温设置后,抗体产量明显提高,酸性峰含量显著降低。
综上所述,本发明采用先灌流后补料的培养方式减少了培养基的消耗量,并筛选出一种更优的培养基配方,能降低培养过程中产生的乳酸。此外,创新性的优化了DO和降温设置,显著降低酸性电荷异构体含量,并提高抗体产量。
