基于点击化学的DNA中5-羧基胞嘧啶(5caC)的富集与定位分析方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及化学技术领域,具体涉及一种基于点击化学的DNA中5-羧基胞嘧啶(5caC)的富集与定位分析方法。
背景技术
由鸟嘌呤(G)、胞嘧啶(C)、腺嘌呤(A)和胸腺嘧啶(T)组成的DNA序列构成了地球上绝大部分生命的遗传信息。DNA的化学修饰并不改变其基本序列,但是能够从新的层面调控遗传信息的表达。最早发现的5-甲基胞嘧啶(5mC)是脊椎动物基因组中最常见,同时也是被研究最广泛的一种修饰碱基。5mC主要发生在CpG二核苷酸上,对哺乳动物的基因表达调控至关重要。5mC由DNA甲基转移酶(DNMTs)催化产生,它参与调节基因组印记、X染色体失活、转座子沉默和胚胎发育等过程,被视为第五种碱基。在发育和分化过程中,DNA甲基化的模式会发生重组,一种是通过复制依赖性的5mC被动稀释,一种是通过主动从DNA上抹去这种表观遗传标记。近年来,DNA主动去甲基化的机制得到了广泛的研究,DNA中5mC能够被双加氧酶TET蛋白氧化为5-羟甲基胞嘧啶(5hmC)、5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),随后5fC/5caC被胸腺嘧啶DNA糖苷酶切除,并由碱基切除修复(BER)对产生的无碱基位点进行修复。因此,5mC的氧化衍生物可以作为DNA主动去甲基化的标志。此外,许多迹象表明,尽管含量极低,5fC和5caC都能够参与转录和染色体定位,被认为是哺乳动物中功能化的表观遗传修饰。
为了研究5mC及其氧化衍生物的功能,需要对其进行定位分析,胞嘧啶修饰的检测和分析一直是一项挑战。对于含量极低的5caC修饰,目前已经发展的测序方法主要分为两种:一种是基于抗体富集测序的方法,另一种是基于化学或酶促脱氨测序的方法。基于抗体富集的方法具有简单、快速的优点,适用于对丰度较低的修饰进行测序分析。但是,5caC抗体的特异性限制了该方法的广泛应用。传统亚硫酸氢盐测序(BS-seq)一直是5mC测序的金标准,在BS-seq中,胞嘧啶在亚硫酸氢盐处理后脱氨生成尿嘧啶,但5mC能够抵抗脱氨,因此通过测序能够区分C和5mC。基于此,有人开发了化学修饰辅助的亚硫酸氢盐测序法(CAB-seq)用于DNA中5caC的定位分析,在CAB-seq中,5caC能够与1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)反应,生成的产物能够抵抗亚硫酸氢盐的脱氨,因此,通过比较BS-seq与CAB-seq的结果,能够获取5caC的位置信息。然而,亚硫酸氢盐转化需要严苛的化学脱氨条件,导致高达99%的DNA被降解。因此,有人提出使用胞嘧啶脱氨酶APOBEC3A(A3A)进行酶促脱氨,A3A能够高效完成对除5caC外的其它胞嘧啶及其修饰(5mC、5hmC和5fC)进行脱氨,而5caC由于空间位阻大而抵抗A3A的脱氨,基于此能够对DNA中的5caC进行区分(AMD-seq)。此外,还有人采用吡啶硼酸对5caC进行定位分析(PS-seq、PS-c-seq),吡啶硼酸能够将5fC和5caC转化为二氢尿嘧啶(DHU),而C、5mC和5hmC不反应,结合羟胺标记5fC,抑制5fC的脱氨,能够实现对5caC的定位分析。然而,上述基于化学和酶促脱氨的方法无法实现对5caC的富集,对于丰度在0.1~1ppm的5caC而言,实现准确定位分析仍然挑战很大。
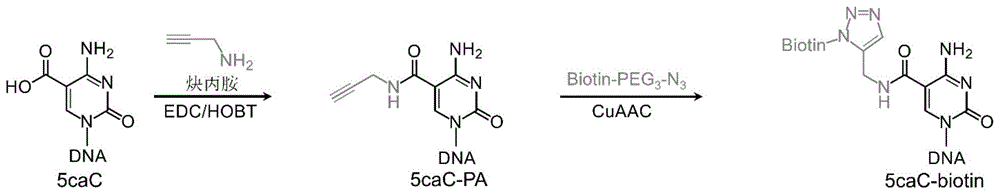
因此,本发明提出了一种化学标记的方法用于5caC的富集和定位分析,本发明利用首先利用EDC催化5caC与炔丙胺脱水缩合,再通过点击化学在5caC上标记生物素,利用生物素与链霉亲和素的强烈亲和作用,实现了对5caC的高效富集,并用于后续测序分析。
发明内容
本发明的目的在于提供一种基于点击化学的DNA中5caC的富集与定位分析方法,即一种不依赖于抗体富集、无需亚硫酸氢盐处理、高选择性、操作简单的5caC定位分析方法。
本发明的目的通过下述技术方案实现:
一种基于点击化学的DNA中5caC的富集与定位分析方法,包括以下步骤:
(1)利用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)与1-羟基苯并三唑(HOBT)催化待检DNA中的5caC与炔丙胺脱水缩合,形成5-炔丙氨酰基胞嘧啶(5caC-PA);
(2)回收5caC-PA标记的DNA;
(3)利用铜(II)-TBTA络合物催化5caC-PA与生物素-聚乙二醇-叠氮(Biotin-PEG
(4)回收生物素标记后的DNA;
(5)利用链霉亲和素磁珠亲和富集生物素标记的含5caC修饰的DNA;
(6)磁捕获的待检DNA进行文库构建并进行高通量测序分析,绘制5caC修饰谱图。
步骤(1)中,DNA与炔丙胺反应的条件为:待检DNA在含1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)10~50mM、1-羟基苯并三唑(HOBT)1~10mM、2-(N-吗啉)乙磺酸(MES)50~150mM、pH 4.0~5.5、炔丙胺5~20mM的反应体系中,于40~60℃反应1.5~3小时。
步骤(3)中,5caC-PA进行生物素标记的点击化学反应条件为:炔丙胺标记后的DNA在三乙胺乙酸50~200mM、pH 6.0~8.0、二甲亚砜3~6M、抗坏血酸0.2~2mM、生物素-聚乙二醇-叠氮(Biotin-PEG
步骤(5)中,生物素标记后的DNA进行亲和富集的方法为:采用链霉亲和素磁珠结合生物素化的DNA,利用磁捕获分离结合在链霉亲和素磁珠上的DNA。
步骤(6)中,将磁捕获的待检DNA构建实验组DNA文库;同时,将步骤(4)回收后的DNA作为对照DNA,构建对照组DNA文库。将实验组和对照组文库进行高通量测序,绘制5caC修饰图谱。
本发明方法的原理见图1和图2,首先利用EDC与HOBT催化5caC与炔丙胺脱水缩合,形成5-炔丙氨酰基胞嘧啶(5caC-PA),后者进一步在铜(II)-TBTA络合物的催化作用下与生物素-聚乙二醇-叠氮(Biotin-PEG
本发明方法标记效率高、特异性强、无需亚硫酸氢盐处理,可高效富集5caC并用于DNA中5caC的定位分析。
本发明的优点及有益效果如下:
1.本发明中无需亚硫酸氢盐处理,反应条件温和,避免了DNA的大量降解。
2.本发明方法涉及的两步标记反应转化率高,第一步EDC催化缩合反应效率97.5%,第二部点击化学反应转化率99.6%,有利于5caC的全面分析。
3.本发明方法的化学标记方法特异性强,仅标记5caC,不与正常胞嘧啶及其它胞嘧修饰(如5mC、5hmC和5fC)反应。
4.本发明方法对单链和双链DNA均能实现高效标记,标记效率>97%。
5.本发明方法对5caC富集效率高,有利于极低丰度的5caC的定位分析。
6.本发明方法能够广泛应用于DNA中5caC修饰定位分析,有助于对5caC的生物学功能进行更加深入的研究。
附图说明
图1为本发明方法原理图。EDC与HOBT催化DNA中的5caC与炔丙胺脱水缩合,形成5-炔丙氨酰基胞嘧啶(5caC-PA),后者发生CuAAC点击化学反应,最终在5caC上修饰上生物素基团。通过链霉亲和素亲和纯化,能够富集5caC修饰的DNA片段,并用于后续的高通量测序分析,从而获得5caC的修饰谱图。
图2为5caC进行生物素标记的反应式。
图3为实施例1中5-炔丙氨酰基胞嘧啶(5caC-PA)的高分辨质谱图。
图4为实施例1中生物素标记5-caC(5caC-biotin)的高分辨质谱图。
图5为实施例1中利用LC-MS/MS检测炔丙胺标记前后5caC的提取离子谱图。
图6为实施例1中利用LC-MS/MS检测中间产物5caC-PA和终产物5caC-biotin的提取离子谱图。
图7为实施例1中含不同胞嘧啶修饰的DNA链的标记效率。
图8为实施例1中含不同胞嘧啶修饰的DNA链富集后的回收率。
图9为实施例1中含不同胞嘧啶修饰的DNA链的富集倍数。
图10为利用本发明方法对基因组DNA中5caC进行定位分析的流程图。
图11为实施例2中通过本发明方法对小鼠胚胎干细胞(mESC)DNA中5caC进行富集与高通量测序的质控结果。Input_1和Input_2为富集前的对照组文库,IP_1和IP_2为富集后的实验组文库。原始读数:原始测序序列的个数。有效读数:过滤后被保留的reads的数目。读数有效率:过滤后的碱基数目占原始碱基数目的百分比。匹配率:有效读数中能比对到参考序列上的reads的百分比。Q20比例:过滤后的数据中Phred数值大于20的碱基占总体碱基的百分比。Q30比例:过滤后的数据中Phred数值大于30的碱基占总体碱基的百分比。
图12为实施例2中通过本发明方法对mESC细胞DNA中5caC进行富集与高通量测序,5caC在基因功能区域的分布统计。结果表明5caC主要分布于近基因启动子区(promoter,≤1kb)、内含子(intron)和远端基因间序列(distal intergenic)。
图13为实施例2中通过本发明方法对mESC细胞DNA中5caC进行富集与高通量测序,5caC在基因本体及其上下游中的分布统计,上图为实验组,下图为对照组。结果表明5caC富集于基因起始区。
图14为实施例2中通过本发明方法对mESC细胞DNA中5caC进行富集与高通量测序,5caC在转录起始位点(TSS)及其上下游中的分布统计,图中分别展示了实验组和对照组的结果,结果表明5caC主要富集于TSS位点及其下游150bp处。
图15为实施例2中通过本发明方法对mESC细胞DNA中5caC进行富集与高通量测序,5caC在TSS及其上下游中的分布。
图16为实施例2中通过本发明方法对mESC细胞DNA中5caC进行富集与高通量测序,5caC在小鼠基因组上的分布情况。
具体实施方式
在一些实施方案中,本发明基于点击化学的DNA中5caC的富集与定位分析方法,包括下述步骤:
(1)配制高浓度的MES缓冲液:750mM MES,pH 4.0~5.5。
(2)配制高浓度的TEAA缓冲液:1M三乙胺乙酸,pH 6.0~8.0。
(3)在DNA样品(10~100μg)中加入EDC至终浓度10~50mM,HOBT终浓度1~10mM,加入步骤(1)中的高浓度MES缓冲液至终浓度50~150mM,pH 4.0~5.5,加入炔丙胺(Bidepharmatech)至终浓度5~20mM,补加水至100μL于40~60℃反应1.5~3小时。
(4)在步骤(3)中得到的DNA中,加入乙酸铵至终浓度为20~100mM、糖原5~10μg、乙醇800~900μL,补加水至总体积1mL,于-60~-80℃中放置8~16小时,4~10℃下12000~13000转/分钟离心20~40分钟,弃上清,80%乙醇清洗沉淀2次。
(5)在步骤(4)回收后的DNA中加入步骤(2)中的高浓度三乙胺乙酸缓冲液至终浓度为50~200mM、pH 6.0~8.0、二甲亚砜3~6M、抗坏血酸0.2~2mM、生物素-聚乙二醇-叠氮(Biotin-PEG
(6)利用步骤(4)所述方法回收生物素标记反应后的DNA。
(7)利用链霉亲和素磁珠(PuriMag Biotech)亲和富集生物素标记的含5caC的DNA,利用磁力捕获分离结合了链霉亲和素磁珠的DNA。
(8)将磁捕获的待检DNA构建实验组DNA文库;同时,将步骤(6)回收的DNA样品作为对照DNA,构建对照组DNA文库。将实验组和对照组文库进行高通量测序,绘制5caC修饰图谱。
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
若未特别指明,实施例中所用的技术手段(包括乙醇沉淀回收DNA、DNA酶解为核苷以及聚合酶链式反应等)为本领域技术人员所熟知的常规手段,实施例中涉及商品化试剂盒的技术手段(如DNA的提取、链霉亲和素亲和分离以及DNA文库制备等)均采用试剂商推荐的操作方法。
实施例1.利用人工合成的DNA链评估5caC的标记效率与富集效率
A.利用LC-HRMS鉴定5caC标记产物
为了鉴定5caC的标记产物,合成了80nt的含5caC修饰的DNA链,80nt-caC的序列为:5’-AGATGGTGATGGTAGTTATGAGGAAAGAGTGGAGTGTAGATATCA
(1)反应总体积为100μL,包含2μL 5μM的80nt-caC、10mM炔丙胺(Bidepharmatech)、20mM EDC(MackLin)、2mM HOBT(Aladdin)和75mM MES缓冲液,pH 5.0,37℃下反应4小时。反应结束后,加入38μL水、70μL 7.5M乙酸钠、2μL 5mg/mL糖原(生工)和840μL无水乙醇。-80℃中放置12小时,4℃下12000转/分钟离心30分钟,弃上清,80%乙醇清洗沉淀2次,回收后的DNA溶于20μL水。
(2)取10μL步骤A(1)回收的DNA酶解为核苷,利用液相色谱串联高分辨质谱(LC-HRMS)鉴定5caC的标记产物。如图3所示,5caC与炔丙胺的反应产物5caC-PA检测的精确分子量(309.1205)与理论值(309.1193)相符,表明反应成功发生。
(3)将步骤A(1)回收剩下的10μL DNA进行下面的反应。反应总体积为40μL,包含10μL DNA、100mM TEAA、pH 7.0、16μL DMSO、1mM Biotin-PEG
(4)将步骤A(3)回收的DNA酶解为核苷,利用液相色谱串联高分辨质谱(LC-HRMS)鉴定生物素化后的5caC的标记产物。如图4所示,5caC-PA与生物素叠氮的反应产物5caC-biotin检测的精确分子量(753.3382)与理论值(753.3348)相符,表明反应成功发生。
B.利用LC-MS/MS考察5caC标记效率
为了考察5caC的标记效率,选择步骤A中的80nt-caC进行炔丙胺标记与点击化学反应,反应条件与步骤A一样,将DNA酶解后的核苷进LC-MS/MS分析,在正离子模式下采用多反应监测模式(MRM)检测底物5caC(m/z 292.2>156.1)、中间产物5caC-PA(m/z 309.2>193.1)和终产物5caC-biotin(m/z 753.4>637.3)。如图5-6所示,5caC反应后剩余2.5%,表明第一步EDC催化的脱水缩合反应转化率达到97.5%。如图6所示,第二部点击化学反应的转化率高达99.6%,表明该反应能够用于5caC的高效标记。
C.利用LC-MS/MS考察5caC的标记特异性
为了评估标记反应的特异性,选择了未修饰胞嘧啶、5mC、5hmC、5fC和5caC修饰的DNA链进行标记反应,反应条件与步骤A一样。合成的304bp Oligo-C序列如SEQ ID NO.2所示;合成的237bp Oligo-5mC序列如SEQ ID NO.3所示;合成的382bp Oligo-5hmC序列如SEQID NO.4所示;合成的393bp Oligo-5fC序列如SEQ ID NO.5所示;合成的258bp Oligo-5caC序列如SEQ ID NO.6所示。
/>
将反应后的DNA酶解为核苷,随后进LC-MS/MS分析,通过检测反应前后C、5mC、5hmC、5fC和5caC的含量计算反应的转化率。结果表明,标记反应后,只有5caC含量显著降低,转化率达到97%,而其它修饰的含量没有显著变化,表明标记反应只发生于5caC(图7)。此外还考察了单链或双链DNA对改标记反应的影响,结果表明,单链和双链DNA中的5caC均能被高效标记(图7)。
D.利用定量聚合酶链式反应(qPCR)考察生物素标记5caC的富集效率
采用步骤C中不同胞嘧啶修饰的DNA链为底物,进行生物素标记反应与富集分析。
(1)混合200ng Oligo-C、10ng Oligo-5mC、10ng Oligo-5hmC、10ng Oligo-5fC和10ng Oligo-5caC,按照本实施例步骤A中的标记方法进行两步标记反应。反应后的DNA一分为二,一份留作对照(体积调整为40μL),一份进行链霉素磁珠富集。
(2)亲和富集:DNA溶于10μL水,加入10μL链霉素磁珠(普睿迈格)和20μL结合缓冲液(100mM Tris-HCl,pH 8.0,200mM NaCl),混合均匀后于室温放置15分钟。磁力吸附,弃上清。用1mL清洗液(50mM Tris-HCl,pH 8.0,100mM NaCl)清洗三次,最后将磁珠均匀分散于40μL水中。
(3)富集前后的DNA进行qPCR检测,扩增体系包含:
对于不同修饰的DNA链,分别采用不同的引物进行qPCR,引物序列分别为:
扩增程序为:
(4)结果分析。根据qPCR的循环数计算了不同修饰DNA链的相对含量,结果表明,链霉素磁珠结合生物素标记的5caC修饰DNA链的回收率达到80%,对Oligo-5caC链的富集倍数为180,而其它修饰及未修饰的DNA链几乎没有富集效果(图8和图9)。
综上,本发明中基于点击化学的标记方法能够以高转化率和高选择性地与5caC反应,并通过链霉素磁珠高效富集,能够对实际样品DNA中的5caC进行富集与测序。
实施例2.小鼠胚胎干细胞基因组DNA中5caC的定位分析
为了证明本发明方法在实际样品中的应用,对小鼠胚胎干细胞(mESC)基因组DNA中5caC进行化学标记、富集与测序分析,具体包括如下步骤(10):
A.培养mESC,收获细胞,利用组织DNA提取试剂盒(Omega)提取DNA。
B.使用超声波均质器(Scientz)将基因组DNA分割成平均大小为300bp上下的片段。
C.然后使用实施例1中的方法,先用炔丙胺标记5caC,再通过CuAAC点击化学反应使5caC标记上生物素。经过链霉亲和素磁珠富集后,采用文库构建试剂盒(Yeason)进行文库构建,对生物素标记后未经过链霉素富集的DNA构建对照文库,对生物素标记链霉素富集后的DNA构建实验文库。最后利用Illumina高通量测序(Novogene)分析对照文库和实验文库,从而获得5caC的测序谱图(图10)。
将对照文库(Input_1、Input_2)和实验文库(IP_1、IP_2)进行了高通量测序,在四个文库中得到了24,757,062~36,163,912个原始读数,有效读数占比大于88.7%,匹配率大于89.7%,表明文库质量良好(图11)。
接下来,分析了5caC在mESC基因组中的分布特征。首先分析了功能区域中5caC的分布,结果表明,大约一半的5caC富集于临近基因启动子区(≤1kb,47.5%),在远端基因间区域(Distal Intergenic,18.04%)和其它内含子(Other Intron,14.65%)也有部分富集(图12)。进一步的分析表明,5caC在基因本体的3’端,也就是转录起始位点(TSS)附近含量较高,表明5caC可能参与基因的表达调控(图13-15)。最后,绘制了mESC基因组中5caC的分布谱图(图16),结果显示,5caC广泛分布在小鼠的21条染色体中,其中,Y染色体(NC_000087.8)中5caC的含量较低,其它染色体中分布较为均匀。
综上,本发明方法能够用于基因组中极低含量的5caC的定位分析,利用该方法可以进一步研究5caC的生物学功能。
