一种产β-榄香烯的工程菌及应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物技术领域,涉及一种产β-榄香烯的工程菌及应用,特别涉及一种莴苣来源的吉马烯A合成酶及其突变株的制备及在β-榄香烯的高效生物合成。
背景技术
β-榄香烯是从传统中药温郁金中分离出的一种倍半萜类成分,因其抗肿瘤活性强、作用范围广、毒副作用轻微及不易产生耐药性等优点而具有广泛的应用前景。目前β-榄香烯的获取主要依靠从温郁金中分离提取,但传统的生产方式分离纯化难度大、得率低且成本高,严重阻碍了β-榄香烯的大规模生产与应用。随着合成生物学的发展,利用微生物构建细胞工厂生物合成天然药物成为研究热点,也为β-榄香烯的生产提供了新的思路。
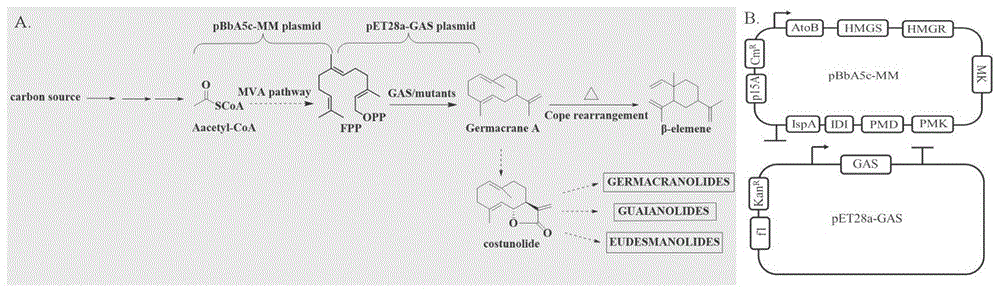
β-榄香烯是一种倍半萜烯,属于倍半萜类大家族。一般来说,植物来源的倍半萜以异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)作为基本的结构元件。IPP和DMAPP在植物中主要通过甲羟戊酸途径(MVA)和甲基赤藓糖醇4-磷酸途径(MEP)进行合成。1分子IPP和1分子DMAPP在异戊烯转移酶的催化作用下,头尾缩合生成香叶基焦磷酸(GPP),GPP再与1分子IPP缩合生成—法尼基焦磷酸(FPP),后者在吉马烯A合成酶的作用下生成吉马烯A,进一步发生Cope重排,生成β-榄香烯。目前,在酵母细胞中可构建了吉马烯A的生物合成途径,可用于β-榄香烯的生产。但由于酵母细胞发酵时间长,最短约72小时,产量达到309.8mg/L,时空产率为4.20mg/L.h。张等人构建的酵母工程菌诱导培养144小时后,产量达到469mg/L,时空产率为3.26mg/L.h。
目前国内外文献报道中的β-榄香烯的生物合成多在酿酒酵母中进行,目前还未见在大肠杆菌中进行β-榄香烯全生物合成的报道,而大肠杆菌由于生长迅速,遗传操作简单,发酵方法简单成熟,用于中药活性成分的生物全合成具有很大的优势。
发明内容
本发明的第一个目的是针对现有技术的不足,提供一种重组菌,为体内含有或表达异戊烯基焦磷酸IPP和二甲基烯丙基焦磷酸DMAPP生物合成途径相关酶基因以及法尼基焦磷酸合成酶,莴苣来源的吉马烯A合成酶基因突变体。
作为优选,所述莴苣来源的吉马烯A合成酶基因的编码基因的核苷酸序列为SEQ.ID NO.1所示。所述莴苣来源的吉马烯A合成酶的氨基酸序列为SEQ.ID NO.2所示。
作为优选,所述莴苣来源的吉马烯A合成酶突变体是将莴苣来源的吉马烯A合成酶BL21氨基酸序列中第229位、第243位、第364位、第392位、第410位中至少一个进行定点突变。其中第364位的I突变为K,第410位的T突变为S,第392位的T突变为A,第392位的T突变为V,第229位的A突变为S,第243位的S突变为N;
作为优选,所述莴苣来源的吉马烯A合成酶突变体是将莴苣来源的吉马烯A合成酶氨基酸序列中第364位的I突变为K和第410位的T突变为S。
本发明的第二个目的是提供一种重组基因工程菌,其特征在于由莴苣来源的吉马烯A合成酶编码基因构建的重组载体、pBbA5c-MM重组载体转化至大肠杆菌E.coli BL21(DE3)star中得到;
所述莴苣来源的吉马烯A合成酶编码基因构建的重组载体由莴苣来源的吉马烯A合成酶突变体与pET28a载体连接得到。
作为优选,所述莴苣来源的吉马烯A合成酶基因的编码基因的核苷酸序列为SEQ.ID NO.1所示。所述莴苣来源的吉马烯A合成酶的氨基酸序列为SEQ.ID NO.2所示。
作为优选,所述莴苣来源的吉马烯A合成酶突变体是将莴苣来源的吉马烯A合成酶氨基酸序列中第38位、第58位、第229位、第243位、第364位、第392位、第410位和第492位中至少一个进行定点突变。
作为优选,所述莴苣来源的吉马烯A合成酶突变体是将莴苣来源的吉马烯A合成酶氨基酸序列中第364位的I突变为K和第410位的T突变为S。
本发明的第三个目的是提供上述重组基因工程菌在制备吉马烯A及β-榄香烯中的应用。
作为优选,该应用具体是将上述重组基因工程菌在SBMSE培养基中至OD
为实现上述目的,本发明采用的技术方案是:
本发明提供一种含有所述莴苣来源的吉马烯A合成酶或突变体编码基因的重组载体。
上述技术方案所述莴苣来源的吉马烯A合成酶或突变体编码基因构建的重组载体,其中:所述重组载体为pET28a-LTC2 I364K-T410S,是由SEQ.ID NO.1所示的莴苣来源的吉马烯A合成酶编码基因与pET28a载体连接得到。
上述技术方案所述重组载体转化制备的重组基因工程菌,其中:所述重组基因工程菌为E.coli BL21(DE3)star MM,是由重组载体pBbA5c-MM及pET28a-LTC2 I364K-T410S转化至E.coli BL21(DE3)star中得到。重组载体pBbA5c-MM在大肠杆菌细胞中的表达可将生成吉马烯A合成酶的前体FPP。
上述技术方案所述吉马烯A合成酶及突变体在制备吉马烯A及β-榄香烯的应用。上述技术方案所述的应用,其中,所述的应用为:采用定点突变的方法对关键元件LTC2进行改造以提高LTC2的催化活性。基于文献调研和同源序列对比结果选定突变位点,获得了10个突变体,单突变T410S、T392A、T392V、A229S、S243N和I364K体外催化β-榄香烯产量是野生型的1.27倍、1.11倍、1.12倍、1.08倍、1.10倍和1.21倍。接着,构建LTC2双突变载体,T392A-T410S、S243N-T410S和I364K-T410S在SBMSN培养基中诱导培养18h所生成的β-榄香烯产量分别为73.60mg/L、98.20mg/L和126.39mg/L,是野生型产率的1.10倍、1.47倍和1.89倍。
本发明还提供了一种上述β-榄香烯工程菌株的应用,通过诱导工程菌株中LTC2突变酶I364K-T410S及外源MVA生物合成途径的表达生产β-榄香烯,具体为:将工程菌E.coliBL21(DE3)star LTC2 I364K-T410S+pBbA5c-MM活化后转接到SBMSN培养基中培养至OD600为0.6-1.0,加入IPTG诱导,终浓度为0.4mM,25℃发酵18h,并加入10%的正十二烷富集产物,发酵结束后,直接离心收集上层产物,产量达到126.39mg/L,本发明的工程菌具有目前报道最高的时空产量,适用于β-榄香烯的工业化生产。
附图说明
图1β-榄香烯前体在大肠杆菌中的生物合成途径及重组质粒组成
图2大肠杆菌宿主菌及培养基的优化
图3LTC2及突变体产β-榄香烯产量及发酵菌体OD的比较
具体实施方式
下面结合具体实施例对本发明做进一步的分析。
图1是β-榄香烯前体在大肠杆菌中的生物合成途径及重组质粒组成示意图。
实施例1高产FPP前体的工程菌菌株及培养基筛选
选择E.coli BL21(DE3)、E.coli BW25113、E.coli JM109(DE3)、E.coli BL21 txB(DE3)和E.coli BL21 Star(DE3)作为宿主细胞,采用CaCl2法制备感受态细胞,热激法将pBbA5c-MM质粒(大肠杆菌表达载体pBbA5c-MevT(CO)-MBIS(CO,ispA))引入上述不同的大肠杆菌宿主细胞中,氯霉素(25μg/mL)抗性筛选阳性克隆,获得MM工程菌。
将构建成功的MM工程菌分别在三种不同的培养基(SBMSN培养基、LB培养基、YM9培养基)中进行IPTG诱导表达,测定其生物合成FPP的能力。在大肠杆菌中存在焦磷酸酶,FPP被进一步水解生成法尼醇,所以通过测定工程菌生成的法尼醇的产量推断其生成FPP的能力。从图2结果表明不同宿主的MM工程菌在SBMSN培养基中诱导发酵产生不同量法尼醇,以MM-BL21为例,在SBMSN培养基中诱导发酵产生的法尼醇分别是在LB培养基和YM9培养基诱导发酵产生的法尼醇的4.88倍和3.34倍。在以SBMSN培养基时,MM-BL21 star诱导发酵产生的法尼醇更多,经过18小时摇瓶发酵,产生了7.83mg/L的法尼醇。因此,选择BL21 star作为表达菌株,SBMSN作为培养基进行后续的筛选。
SBMSN培养基配方为:蛋白胨12g,酵母提取物24g,KH
YM9培养基配方为:酵母提取物2g,Na
LB培养基按常规配置。
实施例2LTC2突变酶的构建及分析
通过文献查阅及同源序列比对,LTC2的38位(苏氨酸)、58位(亮氨酸)、229位(丙氨酸)、243位(丝氨酸)、364位(异亮氨酸)、392位(苏氨酸)、410位(苏氨酸)和492位(异亮氨酸),进行定点突变,采用Fast Mutagenesis System试剂盒,突变引物见表1。
取PCR产物20μL,加入DMT酶1μL,充分混匀,37℃消化1h。取DMT酶消化产物5μL,加入到50μL E.coli DMT感受态细胞中,轻轻混匀,冰上静置30min;水浴42℃热激1min,立即取出,继续冰上放置2min;加入500μL无抗LB培养基,37℃,200rpm振荡培养1h;5000rpm离心1min,弃上清至终体积200μL;均匀涂布至含卡那霉素抗性(50μg/mL)的LB固体培养基上,37℃倒置过夜培养筛选获得阳性克隆,经PCR鉴定后确定为突变质粒,突变后的质粒转入BL21(DE3)进行诱导表达,提取粗酶液,加入FPP作为底物,30℃,280rpm,反应2h。同时用固相微萃取顶空采集样品,反应结束后GC分析产物,经产量计算,T410S、T392A、T392V、A229S、S243N和I364K有利于提高LTC2催化FPP生成β-榄香烯的产量,是野生型的1.27倍、1.11倍、1.12倍、1.08倍、1.10倍和1.21倍。
在此基础上进一步构建双突变,获得了LTC2-S243N-T410S、LTC2-I364K-T410S、LTC2-T392A-T410S、LTC2-T392V-T410S共4个双突变基因,突变后的质粒转入BL21(DE3)进行诱导表达,提取粗酶液,加入FPP作为反应底物,30℃,280rpm,反应2h。同时用固相微萃取顶空采集样品,反应结束后GC分析产物,经产量计算,LTC2-T392A-T410S和LTC2-S243N-T410S有利于提高LTC2催化FPP生成β-榄香烯的产量;产量是野生型的1.40倍和1.09倍。
表1定点突变LTC2中所用的引物
3携带LTC2突变酶的工程菌产β-榄香烯的分析
将PET-28a-LTC2-T410S、PET-28a-LTC2-T392A、PET-28a-LTC2-T392V、PET-28a-LTC2-S243N、PET-28a-LTC2-I364K、PET-28a-LTC2-T392A-T410S、PET-28a-LTC2-T392V-T410S、PET-28a-LTC2-S243N-T410S和PET-28a-LTC2-I364K-T410S质粒采用热激法转化至含有pBbA5c-M-M质粒的E.coli BL21star(DE3)中,用通用引物T7和进行菌落PCR检测确定阳性克隆,进而分别在SBMSN培养基中进行诱导发酵18h,获得含有吉马烯A的培养液;并采用正十二烷覆盖收集挥发性吉马烯A产物,经260℃以上高温转化后生成β-榄香烯。测定其摇瓶发酵生成β-榄香烯的产量。通过GC分析,MM-LTC2-LTC2-I364K-T410S S-BL21 star(126.39mg/L)相较于野生型MM-LTC2-BL21 star(66.71mg/L),摇瓶发酵产生的β-榄香烯产量有所提高。β-榄香烯产量最高的工程菌为MM-LTC2-I364K-T410S-BL21 star,β-榄香烯产量达到了126.39mg/L,是野生型的1.89倍。
图3LTC2及突变体产β-榄香烯产量及发酵菌体OD的比较结果。
本发明利用大肠杆菌为宿主,构建了β-榄香烯异源生物合成工程菌,通过宿主细胞、培养基的优化提高前体FPP的供应,并对关键酶吉马烯A合成酶的筛选和突变改造,使在大肠杆菌中生物合成β-榄香烯的产量提高到了126.39mg/L。继续通过上罐发酵,将获得更高的β-榄香烯产量,为高效合成中药抗癌活性成分β-榄香烯奠定了基础。
