用于预防或改善与抗癌药物治疗相关的副作用的药物组合物
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及包含基于萘醌的化合物、其前药、溶剂化物或异构体作为活性成分的药物组合物,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
背景技术
癌症是威胁人类健康和生命的严重疾病之一,其呈现不断增长的趋势。癌症的治疗方法包括手术、放疗、生物治疗和化疗。在这些方法中,采用抗癌药剂进行化疗,所述抗癌药剂涉及癌细胞的代谢通路中,以直接与DNA相互作用(准确地来说,阻断DNA的复制、转录和翻译),扰乱核酸前体的合成,或抑制细胞分裂,从而导致细胞毒性。在癌症患者中,从癌症组织自身分泌炎性细胞因子,导致代谢率升高,从而能量需求增加。同时,癌症患者因为食欲减退而减少营养摄入,致使体重减轻和营养状态恶化(Van Cutem等.2005)。作为主要的癌症治疗方法,抗癌化疗增加炎性细胞因子的产生,这引起多种副作用。细胞因子的过度产生和过多分泌与抗癌药物治疗引起的副作用例如疲劳、恶病质、疼痛和认知衰退密切相关(Wood等.2006;Meriggi F.2014;Madeddu等.2015;Cheung等.2013;Cheung等.2015)。因此,调节细胞因子可以作为一种提高抗癌化疗的疗效同时使由化疗引起的疲劳、恶病质、疼痛和认知衰退最小化的方式。在炎症反应条件下,造血干细胞分化加速,这降低自我复制能力,并最终使造血干细胞耗尽(King等.2011)。因此,调节细胞因子可以作为预防或改善抗癌药物的副作用且同时使由抗癌药物治疗引起的造血干细胞减少最小化的方法。所述细胞因子是影响细胞功能和调节涉及免疫、炎症反应或造血反应的细胞间相互作用的多肽,并且包括单核因子(由单核细胞例如巨噬细胞和单核白细胞产生和分泌)和淋巴因子(由淋巴细胞产生和分泌)。细胞因子的例子有白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-17(IL-17)和肿瘤坏死因子(TNF,包括TNF-α和TNF-β)。已经证明细胞因子参与多种反应,尤其是免疫系统和炎症反应(Stark等.2015;Kim等.2016;Lopez Gonzalez I等.2016)。但是,细胞因子过度的或不受控的产生和分泌导致免疫调节功能低下,而细胞因子正是通过免疫调节功能介导或加重多种疾病和病症(Conti等.2016;Leitner等.2016;RidkerPM.2016;Stark等.2015)。细胞因子在多种类型的细胞中产生,在控制宿主免疫反应中扮演重要的角色,并且也参与各种病理过程(Fang等.2015;Ezeoke等.2015;Inacio Pinto等.2015)。
细胞因子在癌症相关疲劳(CRF)中的作用
在癌症治疗期间或者治疗后最常观察到的副作用之一就是癌症相关疲劳。根据国家综合癌症网(National Comprehensive Cancer Network,NCCN),癌症相关疲劳定义为“由于癌症和抗癌治疗引起的令人痛苦和持续的主观的疲乏感觉,但与近期活动无关,且扰乱正常功能”(国家综合癌症网.2016)。癌症相关疲劳(CRF)可不同于一般疲劳,在于CRF不能通过休息缓解,且主要不是由身体活动引起的。癌症患者的CRF是非常严重的、长期的和痛苦的,不通过休息缓解。很多研究已显示,在癌症相关的多种副作用中,CRF对日常生活受限的癌症患者的生活质量的消极影响最大(Cleeland等.2003;Curt等.2000;Tsai等.2006)。CRF的确切原因尚不非常清楚,但是已知癌症本身或癌症治疗过程与CRF的发展有关。尤其是,已知基于几乎所有抗癌药剂的化疗都增加CRF发生率。癌症治疗过程中癌症相关疲劳(CRF)发生率因治疗方法和治疗时间而不同,但是几乎所有癌症患者都会经历CRF(Weis J.2011)。即,癌症相关疲劳(CRF)的发生率在未正接受化疗的癌症患者中为70-80%,而在接受化疗的癌症患者中则更高(Hofman等.2007)。已接受骨髓移植和化疗的癌症患者比已采用辅助化疗治疗但未进行骨髓移植的那些患者感受到的CRF更严重。采用辅助化疗治疗的癌症患者比采用放疗治疗的那些患者感受到的CRF更频繁和严重(Manir等.2012)。如上所述,癌症相关疲劳(CRF)需要过多的休息,从而导致肌肉无力、肌肉萎缩、肌无力和心肺功能不全,使得癌症患者日常生活受到更大的破坏(Glaus A.1998;Winningham等.1994)。
癌症相关疲劳(CRF)的药物治疗大部分是治疗症状,而非针对病因,不能解决在癌症治疗过程中观察到的体能降低和肌肉量与肌肉功能衰减的问题。
目前,莫达非尼联合基于多西紫杉醇的化疗作为用于转移乳腺癌和前列腺癌患者的癌症相关疲劳(CRF)的治疗剂正在进行临床试验(Hovey等.2014)。莫达非尼最主要的药理活性是提高认知。在癌症相关疲劳动物模型中已证明莫达非尼促进认知(Touret等.1995;Edgar和Seidel,1997;Shelton等.1995;Hernant等.1991;Panckeri等.1996;Shelton等.1995)。
同时,在癌症治疗过程中,也已尝试通过适当的运动疗法来缓解CRF(Tian等.2015;Dash等.2016)。
在接受化疗的癌症患者中观察到的癌症相关疲劳(CRF)的原因极有可能是促炎性细胞因子活性增强和食欲素(orexin)活性降低连同肌内糖原合成减少。因此,需要基于CRF诱导机制开发一种新的药物(Ryan等.2007;Barsevick等.2010;Weymann等.2014)。
炎性细胞因子,如IL-1β、IL-6和TNF-α,在恶性肿瘤期间或在其治疗过程中显著增加。根据之前的报道,炎性细胞因子参与引起疲劳的机制与视交叉上核(SCN)功能失常密切相关(Neefjes等.2013)。视交叉上核(SCN)正好位于大脑下丘脑的前部,视神经交叉点的上方。为了调节生理周期,神经和激素的活动通过神经元来控制以便诱导和调节人24小时周期的多种功能。特别地,激素皮质醇和5-羟色胺分别活化糖皮质激素受体和HT-1a受体,从而调节视交叉上核(SCN)功能,如调节生理周期等。同时,在恶性肿瘤中或在其治疗过程中产生的炎性细胞因子IL-1β、IL-6和TNF-α通过扰乱正常激素合成或功能而引起视交叉上核(SCN)功能失常,从而导致疲劳状况。
食欲素是下丘脑中的食欲素神经元分泌的神经激素。食欲素已知是一种唤醒意识和提高注意力的激素。最近报道,下丘脑中的炎性反应降低下丘脑中食欲素神经元的活性,并由此食欲素产生/释放的减少导致通过化疗的癌症治疗过程中观察到的癌症相关疲劳(Weymann等.2014)。
因此,开发能够抑制炎性细胞因子的产生或活性或者增加食欲素的产生的药物,为将所述药物用于预防或减轻疲劳,由恶性肿瘤的抗癌药物治疗引起的副作用之一提供极大的可能性。
炎性细胞因子在恶病质中的作用
伴随着疲劳,恶病质是癌症晚期形式的癌症患者的常见症状。该症状可随着癌症进展而加重。大约50-80%的癌症晚期形式的那些患者经历恶病质。恶病质的发生率因癌症种类而不同。特别地,80%的胃肠癌症患者在被诊断出癌症时正经历恶病质,而淋巴瘤或乳腺癌患者中的发病率却相对较低(Bruera E.1997)。恶病质可以由癌症本身引起,也可以在癌症治疗如化疗过程中发生(Aoyagi等.2015;Braun等.2014)。
不像单纯的禁食或食欲减退,在癌症患者中观察到的这种症状伴随着严重的体重减轻和骨骼肌萎缩。体重减轻不仅降低生活质量,而且缩短生命预期。已有研究显示,体重减轻介导的恶病质是10-20%的癌症患者死亡的直接原因(Bruera E.1997)。恶病质与疲劳、肌力丧失和神经激素及生化异常相关。恶病质的通路生理特征是由食物摄入减少和失常代谢的多种组合导致的负性蛋白和能量失衡。实体肿瘤患者,如结直肠癌(CRC)和非小细胞肺癌(NSCLC)患者表现出相对较高的恶病质发生率,分别为大约28%和34%(Kern等.1988;Lahdevirta等.1988)。经历恶病质的癌症患者对抗癌化疗显示低应答,并且经历更严重的副作用(Slaviero等.2003)。
恶病质介导的体重减轻和肌肉萎缩(肌肉无力)摧毁了生活方式和人际关系。它还影响患者抗击癌症的意志或能力,因此它对癌症晚期形式的那些患者的康复起着负面作用。为了减轻恶病质,可以进行营养治疗和内分泌治疗,但它们的疗效并不如预期的那样令人满意。
特别地,如果恶病质因癌症而发生,治疗过程会被严重扰乱,因为如果恶病质发展,抗癌化疗的使用就无法施用。尤其是如果癌症引起的恶病质进展的话,抗癌化疗无法继续,意味着治疗过程中断甚或失败。任何用于减轻恶病质症状的治疗效果反而都会加重癌症,并缩短癌症患者的生存期。恶病质最主要因为癌症而起,因此施用抗癌药物可以控制癌症。但是,在这种情况下,药物的其它副作用会叠加,最终恶病质根本没有得到改善,反而更加严重(Nelson等.1994)。
已经发现,已知是恶病质引起物质的恶病质素(cachectin)是和TNF一样的因子,且如白细胞介素(IL-1)或IL-6的细胞因子对该物质起相同的作用。因此,炎性细胞因子的过度表达已经被指出是恶病质的主要原因(Argiles等.2005;Lelbach等.2007)。当正常组织和癌症组织中产生的炎性细胞因子例如TNF-α、IL-6和IL-1β与它们的受体结合而提高表达POMC(促阿片黑皮质素)的神经元的活性,且同时通过释放α-MSH(α-黑素细胞刺激素)活化MC4R(黑皮质素-4受体)时,主要在癌症患者中观察到的厌食性恶病质发展。这类受体的活化会降低食欲,提高能量消耗以及增加瘦组织分解。相反,饥饿激素刺激GHSR-1a受体,从而提高与食欲刺激相关的AgRP(agouti相关肽)和神经肽-Y的表达和分泌。最近已经尝试通过使用GHSR-1a受体的激动剂或饥饿激素来预防和治疗恶病质(Mark D.DeBoer.2011)。瘦素是作用于下丘脑以减少食物摄入和刺激能量消耗,从而导致体重减轻的最具代表性的激素。根据以前的报道,在由慢性疾病如慢性肾病和充血性心衰引起的恶病质病例中,瘦素的表达升高(Engineer等.2012)。特别地,还报道了体重减轻不仅单由食欲减退引起,而且慢性炎症也是体重减轻更重要的原因(Walsmith等.2002)。与上述研究一致的是,在佐剂性关节炎大鼠模型中不仅观察到体重减轻,还观察到肌肉流失,其中骨骼肌中TNF-α和IL-1β的基因和蛋白表达增加。当TNF-α和IL-1β同时被抑制相比单独抑制TNF-α,更有效地预防了由佐剂性关节炎引起的大鼠模型的体重减轻和骨骼肌重量流失。因此,提示TNF-α和IL-1β共同作用导致肌肉流失由此引起恶病质(Walsmith等.2002)。
同时,由炎症反应引起的骨骼肌重量流失和肌肉消耗激活泛素-蛋白酶体蛋白水解通路和自噬/溶酶体蛋白水解通路,肌肉蛋白正是通过这些通路被分解的(Zhao等.2007)。特别地,泛素连接酶如MAFbx/Atrogin-1(肌肉萎缩F-Box)和MuRF1(肌环指-1)的升高以及自噬相关基因如Bnip3的上调直接参与肌肉蛋白分解。抑制NF-κB(其是参与调节炎性细胞因子表达的重要转录因子)能够引起骨骼肌中蛋白酶体的下调(Wyke等.2004)。
因此,开发能够抑制炎性细胞因子的产生或功能,并由此抑制泛素-蛋白酶体蛋白水解通路和自噬/溶酶体蛋白水解通路的药物,为将所述药物用于预防或改善作为抗癌药物治疗过程中观察到的一种副作用的恶病质提供极大的可能性。
炎性细胞因子在癌症相关疼痛中的作用
对于提高癌症患者的生活质量和疗效,疼痛控制是癌症治疗的一个重要部分。癌症相关疼痛是由癌细胞骨转移、癌细胞的神经压迫、血管侵入浸润、淋巴和组织浸润或血管闭塞导致的(Delaney等.2008;Vendrell等.2015;Laird等.2013)。根据以前的报道,33-64%的晚期癌症患者诉说疼痛,而他们中超过50%其疼痛没有得到适当的治疗(Mantyh等.2002;Teunissen等.2007)。癌症相关疼痛可以由原位癌本身引起,或由癌症扩散到的身体其他部分(已转移的)引起。随着肿瘤生长,它可压迫神经、骨骼或其它组织,这可引起疼痛。癌症相关疼痛是睡眠障碍的原因之一,睡眠障碍加重疲劳,并引起身体症状如食欲减退和情绪症状如焦虑等(Cleeland CS.1984;McGuire DB.1987)。至少60%诉疲劳的那些癌症患者还经受严重的疼痛,提示疲劳和疼痛密切相关(Blesch等.1991;Haghighat等.2003;Hwang等.2003)。还有报道称,在放疗过程中导致的骨转移癌症患者的严重疼痛引起了睡眠障碍,结果加重了疲劳(Miaskowski等.1999)。
用于治疗癌症相关疼痛的两类主要药物是阿片类镇痛药和非甾体类抗炎药(NSAID)。这些药物通常都全身给药。阿片类全身给药引起恶心、肠功能紊乱、尿潴留和肺功能障碍。
根据近来的研究,癌症相关疼痛不仅由体内癌症的生理结果引起,也由从癌细胞分泌的炎性细胞因子(TNF-α、IL-6、IL-1β和IL-17等)引起(Laird等.2011;Zhang等.2007;Sommer等.2004)。细胞因子是介导炎性反应的代表性物质,炎性反应已知是脊髓损伤和神经性疼痛的主要原因,且已知在慢性疼痛的发展和维持中起一定作用(Gaultier等.2008;Choi等.2010)。对于癌症治疗进行的化疗伴随着诸如抗癌药剂引发的神经痛的副作用。30-90%的接受过包括紫杉醇的基于紫杉烷的抗癌药剂和其它联合抗癌药剂的癌症患者经历了抗癌药剂引发的神经痛(Farquhar-Smith P.2011;Polomano等.2001;Xiao等.2012)。当NF-κB和MAPK(ERK和p38)的活化促进炎性和神经毒性细胞因子(TNF-α、IL-1β等)的产生时,导致抗癌药剂引发的神经痛(Janes等.2014)。大多数抗癌药剂通过血-神经屏障,并与背根神经节和外周轴突结合而增强神经毒性(Wang等.2012)。一些抗癌药剂抑制微管功能,因而阻断营养物的轴突传输并引起感觉神经退化,释放炎性细胞因子(Mantyh等.2002)。
血脑屏障是一种位于毛细血管和脑组织之间的低通透性膜。通过大脑毛细血管内皮细胞间的粘附连接和紧密连接,它在维持中枢神经系统中的动态平衡中起到重要作用(Brown等.2002)。在如炎性疼痛这样的病理条件下,在血脑屏障中观察到了离子稳态受损和传输功能紊乱(Huber等.2001)。血液炎性细胞因子引起血脑屏障的损伤,通过血脑屏障的流入的白细胞和巨噬细胞数量增加。这类免疫细胞增加TNF-α的产生,因此使得脑组织内的炎性反应更加严重,进一步导致脑损伤(Keep等.2008)。在正常情况下,TNF-α受到严格调节,但是当脑内发生炎症时,巨噬细胞和小胶质细胞增加TNF-α的产生和活性(Gearing等.1994;Bethea JR等.1990)。TNF-α是一种炎症反应的重要介质,增加其它炎性细胞因子如IL-6(白细胞介素-6)的产生(Arvin等.1996)。
因此,开发能够抑制炎性细胞因子的产生或功能的药物,可以为将所述药物用于预防或改善作为治疗恶性肿瘤的抗癌药物治疗的副作用而引起的癌症相关疼痛提供极大的可能性。
细胞因子在认知损害中的作用
化疗相关的认知损害(CRCI)是一种记忆力和专注力衰减的症状。通常,它被称为“化疗脑”或“化疗雾(chemofog)”(Berger等.2013)。据报道,在乳腺癌患者中CRCI的发生率是18-78%(Ahles等.2012;Cull等.1996)。已知17-35%的所述患者经历长期严重的CRCI(Ahles等.2002;Silberfarb PM.1983)。化疗已知在注意力、执行功能、信息处理速度、语言和视觉记忆以及精神运动区的全面范围内引起认知损害(Boykoff等.2009;Reid-Arndt等.2010)。自化疗结束,语言记忆、视觉记忆和精神处理速度开始衰退,并且在一些情况下,认知衰退和损害持续超过五年(de Ruiter等.2011;Heflin等.2005;Vardy等.2008)。经受认知衰退的癌症患者在以下方面具有困难:就治疗方法预先同意或作出决定(Nelson等.2007);在日常生活的角色扮演中;因为心理萎缩而在社会生活中;和在重返工作时适应工作环境中,这提示CRCI对癌症患者生活的适应和质量都有负面影响(Cheung等.2012;Munir等.2010;Boykoff等.2009;Reid-Arndt等.2010)。
CRCI的确切机制还未完全揭示,但是从被抗癌药物治疗损伤的那些细胞分泌的炎性细胞因子(TNF-α、IL-6和IL-1β等)推测是CRCI的主要原因。根据近来的研究,炎性细胞因子在化疗引起的认知衰退中起到主要介质作用(Kesler等.2013;Ganz等.2013;Janelsins等.2011)。在许多临床研究中,当癌症患者采用标准剂量的抗癌药剂给药时,在他们中都观察到了炎性细胞因子如TNF-α和IL-6的上调。在经受认知衰退的那些患者中,这类炎症因子的上调更显著,提示炎症因子表达模式与认知功能密切相关(Tsavaris等.2002;Janelsins等.2012;Meyers等.2005)。
细胞因子已知是神经内分泌和免疫系统调节的介质,能够调节神经递质代谢、神经元和神经胶质细胞的功能以及神经元的修复和再生(Ahles等.2007;Wilson等.2002;Raison等.2003)。采用化疗治疗的癌症患者的血液中上调的细胞因子穿过血脑屏障,然后激活脑内的巨噬细胞和小胶质细胞,提示细胞因子在脑组织内的产生增加而引起炎症反应。细胞因子诱导的炎性反应刺激负责细胞因子产生和响应于身体或精神应激的皮质醇分泌调节的下丘脑-垂体轴(HPA),并且因此通过提高脑组织中的氧化应激引起认知衰退(Wang等.2015)。
因此,开发能够抑制炎性细胞因子的产生或功能的药物,可以为将所述药物用于预防或改善作为治疗恶性肿瘤的抗癌药物治疗的副作用而引起的认知衰退提供极大的可能性,因为这类药物能够保护大脑免于炎症和损伤。
细胞因子在维持造血干细胞中的作用
造血干细胞是可自复制的。它们能够分化成多种骨髓和淋巴细胞祖细胞,并能够发挥体内维持造血系统的作用(Summers等.2004)。骨髓具有有助于造血干细胞自我复制和分化成多种细胞的特定微环境(龛)。在这样的微环境中,造血干细胞的自我复制、间期和分化受到控制,且决定造血干细胞的命运或大小(Schoflied等.1978)。
骨髓损伤是采用抗癌药剂治疗癌症过程中最常见的副作用之一,其限制抗癌药剂的剂量,导致癌症治疗的无效。采用抗癌药剂的化疗不仅损伤癌细胞,也损伤正常细胞,特别是造血干细胞,引起体内造血功能和免疫功能障碍的严重问题。一般用于癌症治疗的抗癌药剂引起造血细胞和造血干细胞凋亡、造血干细胞的分化和衰老以及对骨髓基质和造血干细胞龛的损害,导致急性或慢性骨髓损害(Shao等.2010;Lotem等.1993;Wlodarski等.1998;Yu等.2010;Testa等.1985)。造血干细胞在骨髓微环境中处于间期,且在需要时进入分化期。那些处于间期的造血干细胞不容易被抗癌治疗损伤(Corazza等.2004)。但是,在抗癌药剂引起的炎症条件下,造血干细胞分化加速,这种活化的细胞成为抗癌药剂的靶标,使得骨髓中的造血干细胞被最终耗尽(King等.2011)。已知正常的造血干细胞通过减少炎性细胞因子如TNF-α、IL-1β和IFN-γ,且通过增加抗炎细胞因子如IL-10,在维持免疫动态平衡中起到重要的作用(Siniscalco等.2013)。但是,过度产生的TNF,一种已知的炎性细胞因子,打破造血干细胞的休眠(Bryder等.2001;Dybedal等.2001),提示维持造血干细胞的数量和功能对预防或改善抗癌药剂引起的副作用有重要意义。
因此,开发能够通过控制炎性细胞因子维持造血干细胞的休眠状态,从而维持和提高造血干细胞的数量和功能的药物,为将所述药物用于预防或改善与抗癌药物治疗相关的多种副作用提供极大的可能性。
已知基于萘醌的化合物是一些药物组合物的活性成分。其中,董尼酮(dunnione)分为两种结构,α-董尼酮(2,3-二氢-2,3,3-三甲基萘并[1,2-b]呋喃-4,9-二酮)和董尼酮(2,3-二氢-2,3,3-三甲基萘并[1,2-b]呋喃-4,5-二酮),其可以从分布于南美的邓氏旋果苣(Streptocarpus dunnii)的叶或从蒲包花属(Calceolaria)的几个种获得。同时,从分布于南美的拉帕乔(laphacho)树(褐色钟花树(Tabebuia avellanedae))获得β-拉帕醌(3,4-二氢-2,2-二甲基-2H-萘并[1,2-b]吡喃-5,6-二酮)。
参见迄今为止描述了药代动力学的专利申请或注册文件,β-拉帕醌或其衍生物可以用来预防治疗癌症的放疗过程中观察到的白细胞减少症、单核细胞增多症和淋巴细胞减少症(US7,649,013B2)。还有报道称β-拉帕醌通过NQO-1(NAD(P)H醌氧化还原酶-1)依赖的无功氧化还原循环产生活性氧如H
本发明人和Park D等曾报道过β-拉帕醌和董尼酮有效地促进作为抗癌药物治疗副作用引起的肾及多种其它器官损伤的修复(Oh等.2014;Kim等.2014;Park等.2015)。特别地,在本发明人早前的研究中证明,β-拉帕醌剂量依赖地升高细胞内NAD+NQO-1,由此β-拉帕醌显示出抑制癌症相关DNA损伤和PARP-1超活化的作用和结果保护肾脏和内耳免受损害的作用。Tzeng等也报道β-拉帕醌能够预防内毒素治疗引起的肺损伤动物模型中的肺损伤(Tzeng等.2003)。Duke大学也报道基于萘醌的化合物如β-拉帕醌有效治疗和改善肺疾病和支气管疾病(US 20140155361)。此外,Kwak TH等报道基于萘醌的化合物如β-拉帕醌有效改善和治疗心脏病(US 2014/0154319A1)。
但是,迄今还没有有关基于萘醌的化合物如β-拉帕醌预防或改善在抗癌药物治疗过程中引起的疲劳、恶病质、疼痛、认知衰退和造血干细胞减少方面的效果或作用的报道。
因此,本发明人已研究以筛选有效预防或改善癌症相关的疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的物质。结果是,本发明人证明基于萘醌的化合物β-拉帕醌和董尼酮具有减少抗癌药物治疗引起的炎性细胞因子分泌和产生的能力,以减轻疲劳,改善恶病质,减轻疼痛,提高认知能力,预防造血干细胞减少。据此,本发明人证明基于萘醌的化合物、其药学上可以接受的盐、前药、溶剂化物或异构体可以有效用作用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用的药物组合物,从而完成了本发明。
【现有技术参考文献】
【专利文献】
ARQULE,INC.等,Methods of protecting against radiation injury.US 7,649,013 B2;
Duke University Durham NC,Method for treating lung disease.US20140155361;
Jose Angel,Olalde Rangel,Phyto-neutriceutical synergistic compositionfor Parkinson's disease.US 7,553,503 B2;
MD BIOALPHA CO.,LTD./KT&G CO,.LTD,Pharmaceutical composition for thetreatment or prevention of diseases involving obesity,diabetes,metabolicsyndrome,neuro-degenerative diseases and mitochondria dysfunction diseases.US9,066,922,B2
Taehwan KWAK/Myung-Gyu Park,Pharmaceutical composition for thetreatment or prevention of cardiac disease.US 2014/0154319 A1。
【非专利文献】
Ahles TA等.Neuropsychologic impact of standard-dose systemicchemotherapy in long-term survivors of breast cancer and lymphoma.J ClinOncol 2002;20(2):485-493;
Ahles TA,Root JC,Ryan EL.Cancer-and cancer treatment-associatedcognitive change:an update on the state of the science.J Clin Oncol2012;30(30):3675-3676;
Ahles TA,Saykin AJ.Candidate mechanisms for chemotherapy-inducedcognitive changes.Nat Rev Cancer 2007;7(3):192-201;
Aoyagi T,Terracina KP,Raza A,Matsubara H,Takabe K.Cancer cachexia,mechanism and treatment.World J Gastrointest Oncol.2015;7(4):17-29;
Argiles JM,Busquets S,Lopez-Soriano FJ.The pivotal role of cytokinesin muscle wasting during cancer.Int J Biochem Cell Biol.2005;37(10):2036-2046;
Arvin B,Neville LF,Barone FC,Feuerstein GZ.The role of inflammationand cytokines in brain injury.Neurosci Biobehav Rev.1996;20:445-452;
Babar T,Blomberg C,Yan X.Anti-HER2 cancer therapy andcardiotoxicity.Current Phamaceutical Design 2014;20:4911-4919;
Barsevick A,Frost M,Zwinderman A,Hall P,Halyard M.GENEQOLConsortium.I'm so tired:biological and genetic mechanisms of cancer-relatedfatigue.Qual Life Res.2010;19(10):1419-1427;
Bendall LJ&Bradstock KF.G-CSF:From granulopoietic stimulant to bonemarrow stem cell mobilizing agent.Cytokine Growth Factor Rev.2014;25:355-67;
Berger A,Shuster JL,Von Roenn JH.Principles and practice ofpalliative care and supportive oncology.vol.xvii.4th ed.Philadelphia:WoltersKluwer Health/Lippincott Williams&Wilkins;2013;
Bethea JR,Gillespie GY,Chung IY,Benveniste EN.Tumor necrosis factorproduction and receptor expression by a human malignant glioma cell line,D54-MG.J Neuroimmunol.1990;30:1-13;
Bey E.A.等.Catalase abrogates beta-lapachone-inducedPARP1hyperactivation-directed programmed necrosis in NQO1-positive breastcancers.Molecular cancer therapeutics 2013;12,2110-2120;
Blesch等.Correlates of fatigue in people with breast or lungcancer.Oncol Nurs Forum 1991;18(1):81-87;
Boykoff N,Moieni M,Subramanian SK.Confronting chemobrain:an in-depthlook at survivors'reports of impact on work,social networks,and health careresponse.J Cancer Surviv.2009;3:1-10;
Braun TP,Szumowski M,Levasseur PR,Grossberg AJ,Zhu X,Agarwal A,MarksDL.Muscle atrophy in response to cytotoxic chemotherapy is dependent onintact glucocorticoid signaling in skeletal muscle.PLoS One.2014;9(9):e106489;
Brown RC,Davis TP.Calcium Modulation of Adherens and Tight JunctionFunction:A Potential Mechanism for Blood-Brain Barrier Disruption AfterStroke.Stroke.2002;33:1706-1711;
Bruera E.Anorexia,cachexia and nutrition.BMJ 1997;315:1219-22;
Bryder D,Ramsfjell V,Dybedal I,Theilgaard-Monch K,Hogerkorp CM,Adolfsson J,Borge OJ,Jacobsen SE.Self-renewal of multipotent long-termrepopulating hematopoietic stem cells is negatively regulated by FAS andtumor necrosis factor receptor activation.J Exp Med.2001;194:941-952;
Cetean S,Cainap C,Constantin AM,Cainap S,Gherman A,Oprean L,Hangan A,Oprean R.The importance of the granulocyte-colony stimulating factor inoncology.Clujul Med.2015;88:468-72;
Cheung YT,Lim SR,Ho HK,Chan A.Cytokines as mediators of chemotherapy-associated cognitive changes:current evidence,limitations and directions forfuture research.PLoS One.2013;8(12):e81234;
Cheung YT,Maung Shwe HG,Tan YP,Fan GKT,Ng RCH等.Cognitive changes inmultiethnic Asian breast cancer patients:A focus group study.Ann Oncol 2012;23:2547-2552;
Cheung YT,Ng T,Shwe M,Ho HK,Foo KM,Cham MT,Lee JA,Fan G,Tan YP,YongWS,Madhukumar P,Loo SK,Ang SF,Wong M,Chay WY,Ooi WS,Dent RA,Yap YS,Ng R,ChanA.Association of proinflammatory cytokines and chemotherapy-associatedcognitive impairment in breast cancer patients:a multi-centered,prospective,cohort study.Ann Oncol.2015;26(7):1446-1451;
Choi JI,Svensson CI,Koehrn FJ,Bhuskute A,Sorkin LS.Peripheralinflammation induces tumor necrosis factor dependent AMPA receptortrafficking and Akt phosphorylation in spinal cord in addition to painbehavior.Pain 2010;149(2):243-253;
Cleeland CS,Bennett GJ,Dantzer R,Dougherty PM,Dunn AJ,Meyers CA,Miller AH,Payne R,Reuben JM,Wang XS等.Are the symptoms of cancer and cancertreatment due to a shared biologic mechanism?A cytokine-immunologic model ofcancer symptoms.Cancer 2003;97:2919-2925;
Cleeland CS.The impact of pain on the patient withcancer.Cancer.1984;54(11Suppl):2635-2641;
Conti P,Kempuraj D.Important role of mast cells in multiplesclerosis.Mult Scler Relat Disord.2016;5:77-80;
Corazza F,Hermans C,Ferster A,Fondu P,Demulder A,Sariban E.Bonemarrow stroma damage induced by chemotherapy for acute lymphoblastic leukemiain children.Pediatr Res 2004;55:152-158;
Cull A,Hay C,Love SB,Mackie M,Smets E,Stewart M.What do cancerpatients mean when they complain of concentration and memory problems?BrJCancer 1996;74(10):1674-1679;
Curt GA,Breitbart W,Cella D,Groopman JE,Horning SJ,Itri LM等.Impactof cancer-related fatigue on the lives of patients:new findings from thefatigue coalition.Oncologists 2000;5:353-360;
Dash C,Randolph-Jackson PD,Isaacs C,Mills M,Makambi K,Watkins VV,Adams-Campbell LL.An exercise trial to reduce cancer related fatigue inAfrican American breast cancer patients undergoing radiation therapy:Design,rationale,and methods.Contemp Clin Trials.2016;47:153-157;
de Ruiter MB等.Cerebral hyporesponsiveness and cognitive impairment10years after chemotherapy for breast cancer.Hum Brain Mapp2011;32(8):1206-1209;
Delaney A,Fleetwood-Walker SM,Colvin LA and Fallon M.Translationalmedicine:cancer pain mechanisms and management.British Journal of Anaesthesia2008;101(1):87-94;
Dybedal I,Bryder D,Fossum A,Rusten LS,Jacobsen SE.Tumor necrosisfactor(TNF)-mediated activation of the p55 TNF receptor negatively regulatesmaintenance of cycling reconstituting human hematopoietic stemcells.Blood.2001;98:1782-1791;
Edgar DM,Seidel WF.Modafinil induces wakefulness without intensifyingmotor activity or subsequent rebound hypersomnolence in the rat.J PharmacolExp Ther.1997;283(2):757-769;
Engineer DR,Garcia JM.Leptin in anorexia and cachexia syndrome.IntJPept.2012;2012:287457;
Ezeoke CC,Morley JE.Pathophysiology of anorexia in the cancercachexia syndrome.J Cachexia Sarcopenia Muscle.2015;6(4):287-302;
Fang H,Jiang W,Cheng J,Lu Y,Liu A,Kan L,Dahmen U.Balancing InnateImmunity and Inflammatory State via Modulation of Neutrophil Function:A NovelStrategy to Fight Sepsis.J Immunol Res.2015;2015:187048;
Farquhar-Smith P.Chemotherapy-induced neuropathicpain.Curr.Opin.Support Palliat.Care.2011;5(1):1-7;
Ganz PA,Bower JE,Kwan L,Castellon SA,Silverman DHS等.Does tumornecrosis factor-alpha(TNF-a)play a role in post-chemotherapy cerebraldysfunction?Brain Behav Immun 2013;30Suppl:S99-108;
Gaultier A,Arandjelovic S,Li X,Janes J,Dragojlovic N,Zhou GP,DolkasJ,Myers RR,Gonias SL,Campana WM.A shed form of LDL receptor-related protein-1regulates peripheral nerve injury and neuropathic pain in rodents.J ClinInvest.2008;118(1):161-172;
Gearing AJ,Beckett P,Christodoulou M,Churchill M,Clements J,DavidsonAH,Drummond AH,Galloway WA,Gilbert R,Gordon JL.Processing of tumor necrosisfactor-alpha precursor by metalloprot-einases.Nature.1994;370:555-557;
Glaus A.Fatigue in patients with cancer.Analysis andassessment.Recent Results in Cancer Research,1998;145(I-I):1-172;
Haghighat S,Akbari ME,Holakouei K,Rahimi A,Montazeri A.Factorspredicting fatigue in breast cancer patients.Support Care Cancer.2003;11(8):533-538;
Heflin LH等.Cancer as a risk factor for long-term cognitive deficitsand dementia.J Natl Cancer Inst 2005;97(11):854-856;
Hermant JF,Rambert FA,Duteil J.Awakening properties of modafinil:effect on nocturnal activity in monkeys(Macaca mulatta)after acute andrepeated administration.Psychopharmacology(Berl).1991;103(1):28-32;
Hofman M,Ryan JL,Figueroa-Moseley CD,Jean-Pierre P,Morrow GR.Cancer-related fatigue:the scale of the problem.Oncologist.2007;12Suppl1:4-10;
Hovey E,de Souza P,Marx G,Parente P,Rapke T,Hill A,Bonaventura A,Michele A,Craft P,Abdi E,Lloyd A.MOTIF investigators.Phase III,randomized,double-blind,placebo-controlled study of modafinil for fatigue in patientstreated with docetaxel-based chemotherapy.Support Care Cancer.2014;22(5):1233-1242;
Huber JD,Witt KA,Hom S,Egleton RD,Mark KS,Davis TP.Inflammatory painalters blood-brain barrier permeability and tight junctional proteinexpression.Am J Physiol.2001;280:H1241-1248;
Hwang SS,Chang VT,Rue M,Kasimis B.Multidimensional independentpredictors of cancer-related fatigue.J Pain Symptom Manage.2003;26(1):604-614;
Inacio Pinto N,Carnier J,Oyama LM,Otoch JP,Alcantara PS,Tokeshi F,Nascimento CM.Cancer as a Proinflammatory Environment:Metastasis andCachexia.Mediators Inflamm.2015;2015:791060;
Janelsins MC,Mustian KM,Palesh OG,Mohile SG,Peppone LJ等.Differentialexpression of cytokines in breast cancer patients receiving differentchemotherapies:implications for cognitive impairment research.Support CareCancer 2011;20:831-839;
Janes K,Little JW,Li C,Bryant L,Chen C,Chen Z,Kamocki K,Doyle T,Snider A,Esposito E,Cuzzocrea S,Bieberich E,Obeid L,Petrache I,Nicol G,Neumann WL,Salvemini D.The development and maintenance of paclitaxel-inducedneuropathic pain require activation of the sphingosine1-phosphate receptorsubtype 1.J Biol Chem.2014;289(30):21082-21097;
Keep RF,Xiang J,Ennis SR,Andjelkovic A,Hua Y,Xi G,Hoff JT.Blood-brainbarrier function in intracerebral hemorrhage.Acta Neurochir Suppl.2008;105:73-77;
Kern KA,Norton JA.Cancer Cathexia.JPEN J Parenteral and EnteralNutr.1988;12(3):286-298;
Kesler S,Janelsins M,Koovakkattu D,Palesh O,Mustian K等.Reducedhippocampal volume and verbal memory performance associated with interleukin-6and tumor necrosis factor-alpha levels in chemotherapy treated breast cancersurvivors.Brain Behav Immun 2013;30Suppl:S109-116;
Kim HJ,Oh GS,Shen A,Lee SB,Choe SK,Kwon KB,Lee S,Seo KS,Kwak TH,ParkR,So HS.Augmentation of NAD(+)by NQO1 attenuates cisplatin-mediated hearingimpairment.Cell Death Dis.2014Jun 12;5:e1292;
Kim HK,Nunes PV,Oliveira KC,Young LT,Lafer B.Neuropathologicalrelationship between major depression and dementia:A hypothetical model andreview.Prog Neuropsychopharmacol Biol Psychiatry.2016;67:51-57;
King KY,Goodell MA.Inflammatory modulation of HSCs:viewing the HSC asa foundation for the immune response.Nat Rev Immunol.2011;11:685-692
Lahdevirta J,Maury CP,Teppo AM,Repo H.Am J Med.Elevated levels ofcirculating cachectin/tumor necrosis factor in patients with acquiredimmunodeficiency syndrome.1988;85(3):289-291;
Laird BJ,McMillan DC,Fayers P,Fearon K,Kaasa S,Fallon MT,KlepstadP.The systemic inflammatory response and its relationship to pain and othersymptoms in advanced cancer.Oncologist.2013;18(9):1050-5;
Laird BJ,Scott AC,Colvin LA等.Cancer pain and its relationship tosystemic inflammation:An exploratory study.Pain 2011;152:460-463;
Lee JS,Park AH,Lee SH,Lee SH,Kim JH,Yang SJ,Yeom YI,Kwak TH,Lee D,LeeSJ,Lee CH,Kim JM,Kim D.Beta-lapachone,a modulator of NAD metabolism;
Leitner GC,Vogelsang H.Pharmacological-and non-pharmacologicaltherapeutic approaches in inflammatory bowel disease in adults.WorldJGastrointest Pharmacol Ther.2016;7(1):5-20;
Lelbach A,Muzes G,Feher J.Current perspectives of catabolic mediatorsof cancer cachexia.Med Sci Monit.2007;13(9):RA168-173;
Liu S和Kurzrock R.Toxicity of targeted therapy:Implications forresponse and impact of genetic polymorphisms.Cancer Treatment Review2014;49(7):883-891;
Lopez Gonzalez I,Garcia-Esparcia P,Llorens F,Ferrer I.Genetic andTranscriptomic Profiles of Inflammation in Neurodegenerative Diseases:Alzheimer,Parkinson,Creutzfeldt-Jakob and Tauopathies.Int J Mol Sci.2016;17(2).pii:E206;
Lotem J,Sachs L.Hematopoietic cells from mice deficient in wild-typep53are more resistant to induction of apoptosis by some agents.Blood.1993;82:1092-1096;
Madeddu C,Mantovani G,Gramignano G,Maccio A.Advances in pharmacologicstrategies for cancer cachexia.Expert Opin Pharmacother.2015;16(14):2163-2177;
Manir KS,Bhadra K,Kumar G,Manna A,Patra NB,Sarkar SK.Fatigue inbreast cancer patients on adjuvant treatment:course and prevalence.IndianJPalliat Care.2012;18(2):109-116;
Mantyh PW,Clohisy DR,Koltzenburg M,和Hunt SP.Molecular mechanisms ofcancer pain,Nature Reviews Cancer 2002;2(3):201-209;
Mantyh PW,Clohisy DR,Koltzenburg M,Hunt SP.Molecular mechanisms ofcancer pain.Nat Rev Cancer.2002;2(3):201-209;
Mark D.DeBoer.Ghrelin and cachexia:Will treatment with GHSR-1aagonists make a difference for patients suffering from chronic wastingsyndromes?Mol Cell Endocrinol.2011;340(1):97-105;
McCabe A&MacNamara KC.Macrophages:Key regulators of steady-state anddemand-adapted hematopoiesis.Exp Hematol.2016;44:213-22;
McGuire DB.Advances in control of cancer pain.Nurs Clin NorthAm.1987;22(3):677-690;
Meriggi F.Cancer-related fatigue:still an enigma to be solvedquickly.Rev Recent Clin Trials.2014;9(4):267-270;
Meyers CA,Albitar M,Estey E.Cognitive impairment,fatigue,and cytokinelevels in patients with acute myelogenous leukemia or myelodysplasticsyndrome.Cancer 2005;104(4):788-793;
Miaskowski C,Lee KA.Pain,fatigue,and sleep disturbances in oncologyoutpatients receiving radiation therapy for bone metastasis:a pilot study.JPain Symptom Manage.1999;17(5):320-332;
Munir F,Burrows J,Yarker J,Kalawsky K,Bains M.Women'perceptions ofchemotherapy-induced cognitive side affect on work ability:A focus groupstudy.J Clin Nurs 2010;19:1362-1370;
National Cancer Information Center.Cancer InformationService.2015.Available at:http://www.cancer.go.kr;
National Cancer Institute.Targeted Cancer Therapies.2016.Availableat:http://www.cancer.gov;
National Comprehensive Cancer Network.Clinical Practice Guidelines inOncology.Cancer Related Fatigue version 1.2016.Available at:http://www.nccn.org/professionals/physician_gls/pdf/fatigue.pdf;
Neefjes EC,van der Vorst MJ,Blauwhoff-Buskermolen S,Verheul HM.Aimingfor a better understanding and management of cancer-relatedfatigue.Oncologist.2013;18(10):1135-1143;
Nelson CJ,Nandy N,Roth AJ,Chemotherapy and cognitive deficits:mechanisms,findings,and potential interventions.Palliat Support Care.2007;5(3):273-280;
Nelson KA,Walsh D,Sheehan FA.The cancer anorexia-cachexia syndrome.JClin Oncol.1994;12(1):213-225;
Oh GS,Kim HJ,Choi JH,Shen A,Choe SK,Karna A,Lee SH,Jo HJ,Yang SH,KwakTH,Lee CH,Park R,So HS.Pharmacological activation of NQO1increases NAD levelsand attenuates cisplatin-mediated acute kidney injury in mice.KidneyInt.2014;85(3):547-560;
Panckeri KA,Schotland HM,Pack AI,Hendricks JC.Modafinil decreaseshypersomnolence in the English bulldog,a natural animal model of sleep-disordered breathing.Sleep.1996;19(8):626-631;
Park D,Jo IG,Jang JY,Kwak TH,Yoo SK,Jeon JH,Choi EK,Joo SS,Kim O,KimYB.A Dunnione Compound MB12662 Improves Cisplatin-Induced Tissue Injury andEmesis.Biomol Ther(Seoul).2015;23(5):449-457;
Pietras EM,Reynaud D,Kang YA,Carlin D,Calero-Nieto FJ,Leavitt AD,Stuart JM,Gottgens B,Passegue E.Functionally Distinct Subsets of Lineage-Biased Multipotent Progenitors Control Blood Production in Normal andRegenerative Conditions.Cell Stem Cell.2015;17:35-46;
Pink J.J.等.NAD(P)H:Quinone oxidoreductase activity is the principaldeterminant of beta-lapachone cytotoxicity.The Journal of biologicalchemistry2000;275,5416-5424;
Polomano RC,Mannes AJ,Clark U S,Bennett GJ.A painful peripheralneuropathy in the rat produced by the chemotherapeutic drug,paclitaxel.Pain2001;94(3):293-304;
prevents health declines in aged mice.PLoS One.2012;7(10):e47122;
Queiroz ML等.Comparative studies of the effects of Tabebuiaavellanedae bark extract and beta-lapachone on the hematopoietic response oftumor-bearing mice.J.Ethnopharmacol.2008;117(2):228-235;
Raison CL,Miller AH.Depression in cancer:new developments regardingdiagnosis and treatment.Biol Psychiatry 2003;54(3):283-294;
Reid-Arndt SA,Hsieh C,Perry MC Neuropsychological functioning andquality of life during the first year after completing chemotherapy forbreast cancer.Psychooncology 2010;19:535-544;
Ridker PM.From C-Reactive Protein to Interleukin-6to Interleukin-1:Moving Upstream To Identify Novel Targets for Atheroprotection.Circ Res.2016;118(1):145-156;
Ryan JL,Carroll JK,Ryan EP,Mustian KM,Fiscella K,Morrow GR.Mechanismsof cancer-related fatigue.Oncologist.2007;12Suppl 1:22-34;
Schofield R.The relationship between the spleen colony-forming celland the haematopoietic stem cell.Blood Cells 1978;4:7-25;
Schulte R,Wilson NK,Prick JC,Cossetti C,Maj MK,Gottgens B,KentDG.Index sorting resolves heterogeneous murine hematopoietic stem cellpopulations.Exp Hematol.2015;43:803-811;
Shao L,Sun Y,Zhang Z等.Deletion of proapoptotic Puma selectivelyprotects hematopoietic stem and progenitor cells against high-doseradiation.Blood.2010;115:4707-4714;
Shelton J,Nishino S,Vaught J,Dement WC,Mignot E.Comparative effectsof modafinil and amphetamine on daytime sleepiness and cataplexy ofnarcoleptic dogs.Sleep.1995;18(10):817-826;
Silberfarb PM.Chemotherapy and cognitive defects in cancerpatients.Annu Rev Med 1983;34:35-36;
Siniscalco D,Bradstreet JJ,Antonucci N.Therapeutic role ofhematopoietic stem cells in autism spectrum disorder-relatedinflammation.Front Immunol.2013;4:140;
Slaviero KA,Read JA,Clarke SJ,Rivory LP.Baseline nutritionalassessment in advanced cancer patients receiving palliative chemotherapy.NutrCancer 2003;46:148-157;
Sommer C,Kress M.Recent findings on how proinflammatory cytokinescause pain:peripheral mechanisms in inflammatory and neuropathichyperalgesia.Neurosci Lett.2004;361(1-3):184-187;
Stark T,Livas L,Kyprianou N.Inflammation in prostate cancerprogression and therapeutic targeting.Transl Androl Urol.2015;4(4):455-463;
Stark T,Livas L,Kyprianou N.Inflammation in prostate cancerprogression and therapeutic targeting.Transl Androl Urol.2015;4(4):455-463;
Summers YJ,Heyworth CM,de Wynter EA,Hart CA,Chang J,Testa NG.AC133+G0cells from cord blood show a high incidence of long-termculture-initiatingcells and a capacity for more than 100million-fold amplification of colony-forming cells in vitro.Stem Cells 2004;22:704-715;
Testa NG,Hendry JH,Molineux G.Long-term bone marrow damage inexperimental systems and in patients after radiation orchemotherapy.Anticancer Res.1985;5:101-110;
Teunissen SC,Wesker W,Kruitwagen C等.Symptom prevalence in patientswith incurable cancer:A systematic review.J Pain Symptom Manage2007;34:94 -104;
Tian L,Lu HJ,Lin L,Hu Y.Effects of aerobic exercise on cancer-relatedfatigue:a meta-analysis of randomized controlled trials.Support CareCancer.2015;
Touret M,Sallanon-Moulin M,Jouvet M.Awakening properties of modafinilwithout paradoxical sleep rebound:comparative study with amphetamine in therat.Neurosci Lett.1995;189(1):43-46;
Tsai JS,Wu CH,Chiu TY,Hu WY,Chen CY.Symptom patterns of advancedcancer patients in a palliative care unit.Palliat Med.2006;20(6):617-622;
Tsavaris N等.Immune changes in patients with advanced breast cancerundergoing chemotherapy with taxanes.Br J Cancer 2002;87(1):21-27;
Tzeng HP,Ho FM,Chao KF,Kuo ML,Lin-Shiau SY,Liu SH.beta-Lapachonereduces endotoxin-induced macrophage activation and lung edema andmortality.Am J Respir Crit Care Med.2003;168(1):85-91;
Van Cutsem E,Arends J.The causes and consequences of cancer-associated malnutrition.Eur J Oncol Nurs.2005;9Suppl 2:S51-63;
Vardy J等.Cancer and cancer-therapy related cognitive dysfunction:aninternational perspective from the Venice cognitive workshop.Ann Oncol2008;19(4):623-629;
Vendrell I,Macedo D,Alho I,Dionisio MR,Costa L.Treatment of CancerPain by Targeting Cytokines.Mediators Inflamm.2015;2015:984570;
Walsmith J,Roubenoff R.Cachexia in rheumatoid arthritis.Int JCardiol.2002;85(1):89-99;
Wang XM,Lehky TJ,Brell JM,Dorsey SG.Discovering cytokines as targetsfor chemotherapy-induced painful peripheral neuropathy.Cytokine2012;59:3-9;
Wang XM,Walitt B,Saligan L,Tiwari AF,Cheung CW,Zhang ZJ.Chemobrain:Acritical review and causal hypothesis of link between cytokines andepigenetic reprogramming associated with chemotherapy.Cytokine2015;72:86-96;
Weis J.Cancer-related fatigue:prevalence,assessment,and treatment strategies.Expert.Rev.Pharmacoecon Outcomes Res.2011;11(4):441-446;
Weymann KB,Wood LJ,Zhu X,Marks DL.A role for orexin in cytotoxicchemotherapy-induced fatigue.Brain Behav Immun.2014;37:84-94;
Wilson CJ,Finch CE,Cohen HJ.Cytokines and cognition-he case forahead-to-toe inflammatory paradigm.J Am Geriatr Soc 2002;50(12):2041-2056;
Winningham ML,Nail LM,Burke MB,Brophy L,Cimprich B,Jones LS等.Fatigueand the cancer experience:The state of the knowledge.Oncology NursingForum.1994;21:23-36;
Wlodarski P,Wasik M,Ratajczak MZ,等.Role of p53 in hematopoieticrecovery after cytotoxic treatment.Blood.1998;91:2998-3006;
Wognum A.W.Hematopoietic Stem and Progenitor Cells.Mini-ReviewStemcell Technologies.2015;
Wood LJ,Nail LM,Gilster A,Winters KA,Elsea CR.Cancer chemotherapy-related symptoms:evidence to suggest a role for proinflammatorycytokines.Oncol Nurs Forum.2006;33(3):535-542;
Wyke SM,Russell ST,and Tisdale MJ.Induction of proteasome expressionin skeletal muscle is attenuated by inhibitors of NF-κB activation.Br JCancer.2004;91(9):1742-1750;
Xiao WH,Zheng H,Bennett GJ.Characterization of oxaliplatin-inducedchronic painful peripheral neuropathy in the rat and comparison with theneuropathy induced by paclitaxel.Neuroscience 2012;203:194-206;
Yu H,Shen H,Yuan Y等.Deletion of puma protects hematopoieticstemcells and confers long-term survival in response to high-dose gamma-irradiation.Blood.2010;115:3472-3480;
Zhang JM,An J.Cytokines,inflammation,and pain.Int AnesthesiolClin.2007;45(2):27-37;
Zhao J,Brault JJ,Schild A,Cao P,Sandri M,Schiaffino S等.FoxO3coordinately activates protein degradation by the autophagic/lysosomaland proteasomal pathways in atrophying muscle cells.Cell Metab.2007;6:472-483。
发明内容
本发明的一个目的在于提供一种包含基于萘醌的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体作为活性成分的药物组合物,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
为了达到上述目的,本发明提供一种包含下列式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体作为活性成分的药物组合物,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用:
[式1]
[式2]
本发明还提供一种用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用的方法,所述方法包括给哺乳动物施用式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体的步骤。
此外,本发明提供式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体用于制备药物的用途,所述药物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
有益效果
在本发明中,证明基于萘醌的化合物如β-拉帕醌和董尼酮减少由抗癌药物治疗增加的炎性细胞因子的分泌和产生,并且预防作为与与抗癌药物治疗相关的副作用的疲劳、恶病质、认知减退和造血干细胞减少。因此,基于萘醌的化合物、其药学上可以接受的盐、前药、溶剂化物或异构体可以有效地用作药物组合物,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
附图说明
结合附图最好地理解本发明的优选实施方案的应用,其中:
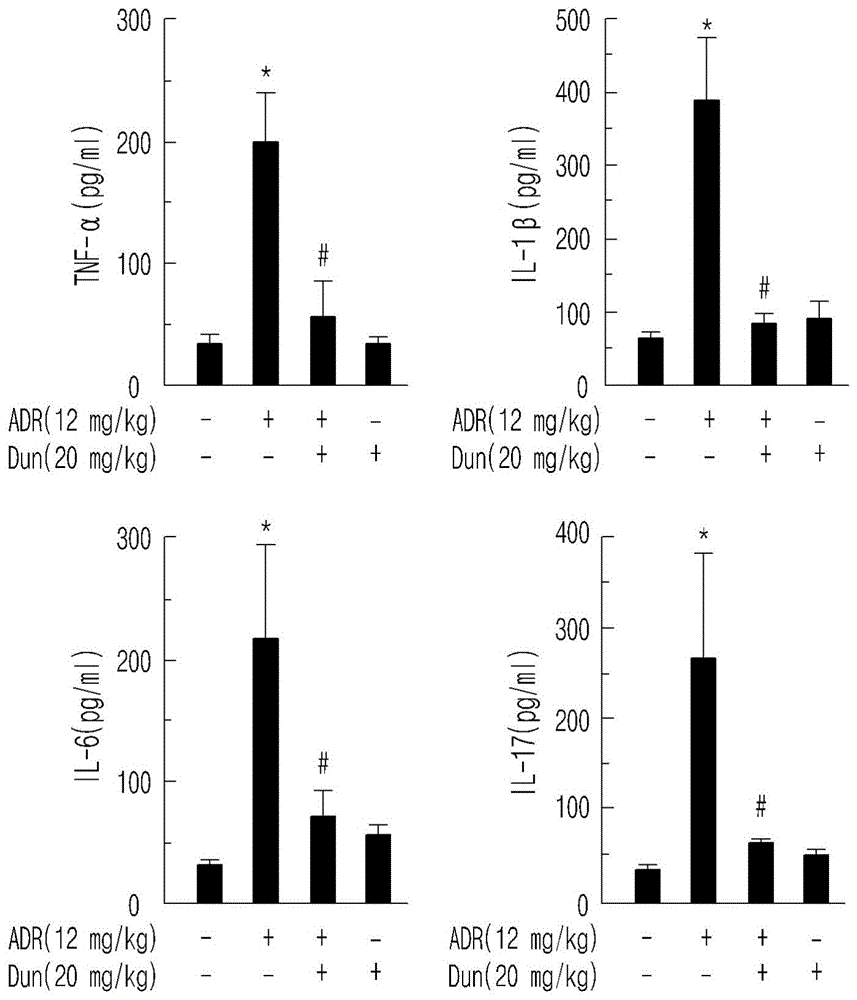
图1的图示出了董尼酮对血浆中阿霉素诱导的炎性细胞因子(TNF-α、IL-1β、IL-6和IL-17)的调节作用。
对照:PBS给药组;ADR:阿霉素(4mg/kg×3)给药组;ADR+Dun:阿霉素和董尼酮(20mg/kg)共同给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:对照组和阿霉素给药组比较;
#p<0.05:阿霉素给药组和董尼酮给药组比较。
图2的图示出了董尼酮对血浆中吉西他滨诱导的炎性细胞因子(TNF-α、IL-1β、IL-6和IL-17)的调节作用。
对照:PBS给药组;GEM:吉西他滨(500mg/kg)给药组;GEN+Dun:吉西他滨和董尼酮(20mg/kg)共同给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:对照组和吉西他滨给药组比较;
#p<0.05:阿霉素给药组和吉西他滨给药组比较。
图3的图示出了董尼酮对血浆中环磷酰胺、阿霉素和紫杉醇(ACP)在两种不同浓度下(3×,6×ACP)共同给药诱导的炎性细胞因子(TNF-α、IL-1β、IL-6和IL-17)的调节作用。
对照:PBS给药组;3×ACP:阿霉素(4.62mg/kg)、环磷酰胺(46.2mg/kg)和紫杉醇(6.18mg/kg)共同给药组;6×ACP:阿霉素(9.24mg/kg)、环磷酰胺(92.4mg/kg)和紫杉醇(12.36mg/kg)共同给药组;3×ACP+Dun:3×ACP和董尼酮(20mg/kg)共同给药组;6×ACP+Dun:6×ACP和董尼酮(20mg/kg)共同给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:3×ACP给药组和董尼酮给药组比较;
#p<0.05:6×ACP给药组和董尼酮给药组比较。
图4的图示出了董尼酮对环磷酰胺、阿霉素和紫杉醇共同给药(4×ACP)诱导的小鼠下丘脑中食欲素蛋白产生的调节作用。
对照:PBS给药组;4×ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天1次,给药4次);4×ACP+Dun:在ACP给药前3天以80mg/kg每天给予董尼酮给药组;Dun:董尼酮(80mg/kg)给药组。
*p<0.05:对照组和4×ACP给药组比较;
#p<0.05:4×ACP给药组和董尼酮给药组比较。
图5的图示出了董尼酮对环磷酰胺、阿霉素和紫杉醇共同给药诱导的大脑炎性反应的调节作用。
对照:PBS给药组;4×ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天给药1次,给药4次);4×ACP+Dun:在ACP给药前3天以80mg/kg每天给予董尼酮给药组;Dun:董尼酮(80mg/kg)给药组。
*p<0.05:对照组和4×ACP给药组比较;
#p<0.05:4×ACP给药组和董尼酮给药组比较。
图6的图示出了董尼酮对环磷酰胺、阿霉素和紫杉醇共同给药(3×ACP)诱导的肌肉减少模型的作用。
对照:PBS给药组;3×ACP 2D:阿霉素(4.62mg/kg)、环磷酰胺(46.2mg/kg)和紫杉醇(6.18mg/kg)2天共同给药组;3×ACP 2D+Dun:每天给予董尼酮(20mg/kg)连续3天、然后给予3×ACP 2天给药组;3×ACP4D:阿霉素(4.62mg/kg)、环磷酰胺(46.2mg/kg)和紫杉醇(6.18mg/kg)4天共同给药组;3×ACP 2D+Dun:董尼酮(20mg/kg)3天、然后3×ACP 4天给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:对照组和3×ACP给药组比较;
#p<0.05:3×ACP给药组和董尼酮给药组比较。
图7的图示出了董尼酮对环磷酰胺诱导的肌肉减少模型的作用。
对照:PBS给药组;CYP:环磷酰胺(150mg/kg+200mg/kg)给药组;CYP+Dun:环磷酰胺给药前3天每天给予董尼酮(20mg/kg)给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:对照组和CYP给药组比较;
#p<0.05:CYP给药组和董尼酮给药组比较。
图8的图示出了董尼酮对环磷酰胺诱导的肌肉减少模型中肌肉减少相关基因的调节作用。
对照:PBS给药组;CYP:环磷酰胺(150mg/kg+200mg/kg)给药组;CYP+Dun:环磷酰胺给药前3天每天给予董尼酮(20mg/kg)给药组;Dun:董尼酮(20mg/kg)给药组。
*p<0.05:对照组和CYP给药组比较;
#p<0.05:CYP给药组和董尼酮给药组比较。
图9(a)的图示出了进行流式细胞术研究董尼酮对阿霉素、环磷酰胺和紫杉醇联合给药诱导的骨髓细胞和造血干/祖细胞减少的作用的结果,其中研究了所有细胞中的Lin细胞和Lin细胞中的LSK(Lin-Sca-1+Kit+)细胞。实验在图9(b)中继续示出。
图9(b)的图示出了对上述LSK(Lin-Sca-1+Kit+)细胞中的多能祖细胞-4(MPP4)和造血干/祖细胞(HSPC)的研究,和对HSC
Cont:PBS给药组;3×ACP:阿霉素(4.62mg/kg)、环磷酰胺(46.2mg/kg)和紫杉醇(6.18mg/kg)共同给药组;3×ACP+Dun:3×ACP给药前3天以20mg/kg每天给予董尼酮给药组。
MPP2:最终分化为巨核细胞和红细胞的祖细胞;MPP3:最终分化为多核细胞和单核细胞的祖细胞;MPP4:最终分化为淋巴细胞的祖细胞。
图10的图示出了董尼酮对阿霉素、环磷酰胺和紫杉醇联合给药诱导的骨髓细胞和造血干/祖细胞减少的保护作用的研究,通过比较绝对细胞数来证明。
总细胞计数:从骨髓获得的细胞总数;LSK细胞计数:分化前Sca-1和c-Kit阳性细胞;HSC
Cont:PBS给药组;3×ACP:阿霉素(4.62mg/kg)、环磷酰胺(46.2mg/kg)和紫杉醇(6.18mg/kg)共同给药组;3×ACP+Dun:3×ACP给药前3天以20mg/kg每天给予董尼酮给药组。
*
**
图11的图示出了董尼酮对阿霉素、环磷酰胺和紫杉醇联合给药诱导的股骨中TNF-α表达的作用。
Cont:PBS给药组;ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天一次,给药4次);ACP+Dun:ACP给药前3天以80mg/kg每天给予董尼酮给药组;Dun:董尼酮(80mg/kg)给药组。
图12的图示出了董尼酮对阿霉素、环磷酰胺和紫杉醇联合给药诱导的巨噬细胞内流入股骨的作用。
Cont:PBS给药组;ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天一次,给药4次);ACP+Dun:ACP给药前3天以80mg/kg每天给予董尼酮给药组;Dun:董尼酮(80mg/kg)给药组。
图13的图示出了β-拉帕醌对血浆中阿霉素诱导的炎性细胞因子(TNF-α、IL-1β、IL-6和IL-17)的调节作用。
对照:PBS给药组;阿霉素:阿霉素(4mg/kg×3)给药组;阿霉素+β-拉帕醌:阿霉素和β-拉帕醌(20mg/kg)共同给药组;β-拉帕醌:β-拉帕醌(20mg/kg)给药组。
*p<0.05:对照组和阿霉素给药组比较;
#p<0.05:阿霉素给药组和β-拉帕醌给药组比较。
图14的图示出了β-拉帕醌对环磷酰胺、阿霉素和紫杉醇共同给药(4×ACP)诱导的小鼠下丘脑中食欲素蛋白产生的调节作用。
对照:PBS给药组;4×ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天1次,给药4次);4×ACP+β-拉帕醌:在ACP给药前3天以20mg/kg每天给予β-拉帕醌给药组;β-拉帕醌:β-拉帕醌(20mg/kg)给药组。
*p<0.05:对照组和4×ACP给药组比较;
#p<0.05:4×ACP给药组和β-拉帕醌给药组比较。
图15的图示出了β-拉帕醌对环磷酰胺、阿霉素和紫杉醇共同给药(ACP)诱导的大脑炎性反应的调节作用。
对照:PBS给药组;4×ACP:1×ACP阿霉素(1.54mg/kg)、环磷酰胺(15.4mg/kg)和紫杉醇(2.06mg/kg)共同给药组(每两天1次,给药4次);4×ACP+β-拉帕醌:在ACP给药前3天以20mg/kg每天给予β-拉帕醌给药组;β-拉帕醌:β-拉帕醌(20mg/kg)给药组。
*p<0.05:对照组和4×ACP给药组比较;
#p<0.05:4×ACP给药组和β-拉帕醌给药组比较。
具体实施方式
以下,对本发明所用的术语进行描述。
术语“药学上可以接受的盐”指的是化合物的一种形式,其对施用所述化合物的生物体没有严重刺激,且不会破坏所述化合物的生物学活性和特征。所述药学盐包括由酸形成的酸加成盐,所述酸形成含有药学上可以接受的阴离子的无毒酸加成盐,例如无机酸(如盐酸、硫酸、硝酸、磷酸、氢溴酸和氢碘酸)、有机羧酸(如酒石酸、蚁酸、柠檬酸、醋酸、三氯乙酸、三氟乙酸、葡萄糖酸、苯甲酸、乳酸、富马酸、马来酸和水杨酸)和磺酸(如甲磺酸、乙磺酸、苯磺酸和对甲苯磺酸)。药学上可以接受的羧酸盐包括与锂、钠、钾、钙和镁形成的金属盐或碱土金属盐,氨基酸盐(如赖氨酸、精氨酸和胍),以及有机盐(如二环己胺、N-甲基-D-葡糖胺、三(羟甲基)甲胺、二乙醇胺、胆碱和三乙胺)。本发明的式1和式2所示的化合物可以通过常规方法转化为盐。
术语“前药”指的是在体内转换成它的母体药物的一种物质。前药经常被使用,因为它们比其母体药物更便于给药。例如,前药口服给药可以保证生物活性,而母体药物则可能未必。前药在药物组合物中比母体药物的溶解度高。例如,尽管前药的水溶解性对流动性不利,但前药可以是可作为酯(前药)给药的化合物,其可以通过代谢水解成活性羧酸,且可以在细胞中容易地通过细胞膜,在此水溶解性就成为有益的。前药的另一个例子是短肽(聚氨基酸)结合到酸基团,所述酸基团可以被转化以便给肽示出活性部位。
术语“溶剂化物”指的是包含化学计量量的或非化学计量量的通过分子间非共价力连接的溶剂的本发明的化合物或它的盐。优选的溶剂是挥发性溶剂、无毒溶剂和/或适合施用给人的溶剂,且当溶剂是水时,溶剂化物是水合物。
术语“异构体”指的是化学或分子式相同、但光学或立体结构不同的本发明的化合物或它的盐。
除非另有说明,术语“式1或式2所示的化合物”指的是包括所述化合物本身、其药学上可以接受的盐、其前药、其溶剂化物和其异构体的全部的概念。
此外,术语“治疗有效量”指的是施用的活性成分的量,该量有效减少或减轻目标疾病的一种或多种症状,或用于预防时有效延缓目标疾病的症状或临床标志物的发展。因此,治疗有效量指的是活性成分的量,该量能够显示(1)逆转疾病发展速度的效果,(2)阻止疾病任何进一步发展的效果,和/或(3)缓解(优先消除)一种或多种疾病相关症状的效果。化合物的治疗有效量可以通过在公认的体内和体外疾病模型中测试所述化合物而确定。
口服给药制剂的示例是片剂、丸剂、硬/软胶囊、溶液剂、混悬剂、乳剂、糖浆剂、颗粒剂和酏剂等。这些制剂在活性成分之外还可以包括稀释剂(例如,乳糖、葡萄糖、蔗糖、甘露醇、山梨醇、纤维素和/或甘氨酸)和润滑剂(例如,二氧化硅、滑石、硬脂酸及其镁盐或钙盐和/或聚乙二醇)。片剂可以包括粘合剂(如硅酸铝镁、淀粉糊、明胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮),并且如有必要,还可以包括崩解剂(如淀粉、琼脂糖、海藻酸或其钠盐或共沸混合物)和/或吸收剂、着色剂、香料和甜味剂。
本发明所述基于萘醌的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体可以经胃肠外给药,所述胃肠外给药包括皮下注射、静脉注射、肌肉注射和胸腔内注射。为将本发明所述基于萘醌的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体制备成胃肠外给药制剂,本发明所述基于萘醌的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体与稳定剂或缓冲剂混合以制备溶液或混悬液,然后再配制为安瓿瓶或小瓶。瓶中的组合物可以消毒灭菌,并另外再包含防腐剂、消毒剂、可湿性粉剂或乳化剂、用于调节渗透压的盐和/或缓冲剂和其它治疗有用的物质,且所述组合物可以通过常规的混合、造粒或包衣方法进行制剂。
本发明所述组合物的有效剂量可以根据年龄、体重、性别、给药形式、健康条件和疾病的严重程度决定。所述组合物的剂量为每天0.001~2,000mg/60kg,优选为每天0.01~1,000mg/60kg,根据医生或药剂师的判断,给药频率为一天一次或优选为一天数次。本发明所述药物组合物可以含有0.01~100重量%的所述基于萘醌的化合物。
在本发明的一个优选实施方案中,在制备所述活性物质过程中,无定形结构可以形成为细颗粒。所述细颗粒可以通过活性物质的喷雾干燥法、用于形成聚合物和融合物的熔融法、用于通过将溶解在溶剂中形成与聚合物的共沉淀物的共沉淀法、包合物形成法和溶剂挥发法来制备。优选地,本文中可以采用喷雾干燥法。同时,尽管结构不是无定形结构,而是结晶晶体结构或半结晶晶体结构,通过机械粉碎方法对活性材料进行精细雾化会由于大的比表面积而有助于提高溶解度,结果是,其可以帮助提高体内的溶解速率和吸收速率。
喷雾干燥法是一种通过将活性物质溶解于适当的溶剂中,然后在喷雾时将其干燥的制备细颗粒的方法。在喷雾干燥进行过程中,基于萘醌的化合物自身的结晶度损失很大,导致无定形形式。结果是,获得的细颗粒的喷雾干燥产品。
机械粉碎方法是一种通过以强物理力压制活性物质而将活性物质粉碎成细颗粒的方法,为此可以采用诸如射流粉碎机、球磨机、振动粉碎机、锤式粉碎机等的粉碎工艺。优选地,可以采用能够在40℃或更低温度的条件下使用空气压力进行粉碎的射流粉碎机。
无论晶体结构如何,随着细颗粒型活性物质的粒度减小,溶解速率和溶解度由于比表面积的增加而增加。然而,如果颗粒尺寸太小,不容易制备这种尺寸的细颗粒,并且由于颗粒的团聚或聚集,溶解度甚至会降低。在本发明的优选实施方案中,所述活性物质的优选颗粒尺寸可以在5nm至500μm的范围内。在该范围内,最大限度地抑制了聚集现象,而由于比表面积的增加,溶解速率和溶解度达到最大。
以下,将详细描述本发明。
本发明提供一种包含下列式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体作为活性成分的药物组合物,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用:
[式1]
[式2]
上述组合物特征性地降低炎性细胞因子的表达,特别是降低下丘脑、血液和骨髓中的炎性细胞因子的表达。本文中,所述炎性细胞因子选自TNF-α、IL-1β、IL-6和IL-17。
上述组合物特征性地抑制肌内基因如MAFbx、MuRF1和Bnip3的表达,将造血干细胞阻滞在休眠状态,并预防或改善造血干细胞减少。上述造血干细胞特征性地是长期造血干细胞(HSC
优选地,癌症选自肝癌、胃癌、结肠癌、乳腺癌、肺癌、非小细胞肺癌、骨癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内黑色素瘤、宫颈癌、卵巢癌、结直肠癌、小肠癌、直肠癌、肛门癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金氏病、食管癌、小肠癌、淋巴瘤、膀胱癌、胆囊癌、内分泌癌、甲状腺癌癌症、乳突癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞淋巴瘤、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(CNS)肿瘤、原发性CNS淋巴瘤、脊髓肿瘤、脑干胶质瘤和垂体腺瘤。
对于上述抗癌药物治疗,优选单独施用抗癌药物或联合施用两种或更多种抗癌药物。在联合治疗的情况下,那些抗癌药物中的至少两种可以在彼此不同的时间给药。
上述抗癌药物可以是常规抗癌药物或靶向抗癌药物,但并不总限于此,所述靶向抗癌药物通过癌症特异性分子靶向(通过与癌症生长和癌症发生有关的特定分子的癌症生长和转移)而仅攻击靶癌细胞。
上述常规抗癌药物为选自阿霉素(ADR)、环磷酰胺(CYP)、紫杉醇(PTX)、多西紫杉醇、吉西他滨(GEM)、顺铂、丝裂霉素C、道诺霉素、多柔比星、柔红霉素、表柔比星、伊达比星、依托泊苷、替尼泊苷、长春花生物碱、长春新碱、长春花碱和5-氟尿嘧啶的一种或多种药物。
上述靶向抗癌药物的示例是信号传导通路抑制剂,如酪氨酸激酶拮抗剂,伊马替尼/格列卫(Glivec)、曲妥珠单抗/赫赛汀(Herceptin)、西妥昔单抗/爱必妥(Erbitux)、吉非替尼/易瑞沙(Iressa)和厄洛替尼/特罗凯(Taceva);和血管生成抑制剂和VEGF(血管内皮生长因子抑制剂,如贝伐单抗/阿瓦斯汀(Avsatine)、舒尼替尼/索坦(Sutent)和索拉非尼/多吉美(Nexavar)(National Cancer Information Center,2015)。
抗癌靶向治疗具有仅特异性治疗癌细胞的优点,但是,尽管发生率低于化疗,但是仍然存在药物伴随的副作用问题(骨髓功能障碍、疲劳、无能、恶心和呕吐、口腔炎和腹泻、出血性膀胱炎、脱发、神经系统副作用以及肝功能障碍)。作为一种酪氨酸激酶抑制剂,Gleevec在约10%的患者中引起诸如恶心、呕吐、水肿、肌肉痉挛、腹泻、胃肠道和中枢神经系统出血、肌肉骨骼疼痛、斑点、头痛、疲劳、关节痛、体重增加、发烧和腹痛的副作用;赫赛汀(Herceptin)在约22%的患者中引起心力衰竭。爱必妥(Erbitux)伴随诸如面部、胸部、背部和头皮痤疮疹、发烧、寒颤、恶心、腹泻、急性气道阻塞、荨麻疹、低血压症状、结膜炎、呼吸困难、白细胞减少和脱发的副作用。易瑞沙(Iressa)在约5%的患者中引起腹泻、红斑、痤疮、皮肤干燥、恶心、呕吐、瘙痒、厌食和乏力。特罗凯(Taceva)在约10%的患者中伴随红肿、腹泻、厌食、疲劳、恶心、呕吐、感染、口腔炎、瘙痒、皮肤干燥、结膜炎和腹痛。同时,作为一种血管生成抑制剂,阿瓦斯汀(Avsatine)引起胃肠道穿孔、出血、血栓形成、高血压和蛋白尿。索坦(Sutent)导致诸如特征性手部综合征和皮疹的副作用(National Cancer Institute,2016;National Cancer Information Center,2015;Babar等.2014;Liu和Kurzrock.2014)。
本发明还提供一种用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用的方法,所述方法包括给哺乳动物施用式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体的步骤。
此外,本发明提供式1或式2所示的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体用于制备药物的用途,所述药物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
在本发明的优选实施方案中,本发明人通过一次或多次将一种抗癌药物腹腔注射到小鼠中,或通过将几种类型的抗癌药物一次或多次或者以不同浓度腹腔注射到小鼠中而建立了动物模型。从在抗癌药物给药前3天的每天口服给予董尼酮和β-拉帕醌。抗癌药物末次给药后2-4天,进行FACS检测每只抗癌药物试验动物中血液、细胞因子、食欲素-A、体重、腓肠肌重量的变化,骨髓细胞和造血干细胞/祖细胞的数量和质量变化。结果是,证实了董尼酮和β-拉帕醌对与抗癌药物治疗有关的副作用,疲劳、恶病质、疼痛、认知衰退和造血干细胞减少有作用。
在每种抗癌药物实验动物模型中,都研究了血浆中炎性细胞因子的变化。结果是,抗癌药物给药组(给予阿霉素或吉西他滨治疗的,或联合给予阿霉素、环磷酰胺和紫杉醇)血浆中炎性细胞因子(TNF-α、IL-1β、IL-6和IL-17)的水平与正常组相比显著提高。同时,董尼酮或β-拉帕醌治疗组的血浆中炎性细胞因子的水平显著降低(参见图1、图3和图13)。
考虑到先前的报道称,食欲素(在下丘脑中产生/分泌的神经激素)的减少与抗癌药物治疗过程中的癌症相关疲劳有关,本发明人研究了阿霉素、环磷酰胺和紫杉醇联合给药的小鼠的下丘脑中食欲素蛋白的量的变化。结果是,证实与正常组相比,阿霉素、环磷酰胺和紫杉醇联合给药显著降低了下丘脑中食欲素的表达。还证实了董尼酮或β-拉帕醌联合治疗能够显著提高食欲素的表达,从而恢复到正常水平(参见图4和图14)。
众所周知,下丘脑中炎性细胞因子的增加导致下丘脑中食欲素神经元活性下降,并导致化疗过程中的癌症相关疲劳。因此,本发明人研究了在联合应用阿霉素、环磷酰胺和紫杉醇的小鼠下丘脑中炎性细胞因子TNF-α和IL-1β的表达模式。结果是,证实阿霉素、环磷酰胺和紫杉醇联合给药在RNA水平和蛋白质水平都显著增加了小鼠下丘脑中TNF-α和IL-1β的表达。还证实了董尼酮或β-拉帕醌联合治疗在RNA水平和蛋白质水平均显著抑制TNF-α和IL-1β的下降,从而使它们维持在正常水平(参见图5和图15)。
为了研究董尼酮对抗癌药物治疗过程中引起的恶病质的作用,本发明人研究了董尼酮对乳腺癌动物模型和其他抗癌药物动物模型中肌肉流失的影响。结果是,证实董尼酮联合治疗显著恢复了抗癌药物治疗诱导的腓肠肌重量减轻。董尼酮对肌肉流失的抑制作用被证实与调节直接参与肌肉蛋白降解的泛素连接酶(MAFbx和MuRF1)和自噬基因(Binp3)的表达有关(参见图6~图8)。
本发明人研究了董尼酮对抗癌药物治疗诱导的骨髓造血干细胞减少的作用。结果是,联合应用阿霉素、环磷酰胺和紫杉醇可显著减少骨髓细胞总数。然而,当合用董尼酮时,骨髓细胞总数显著增加。通过抗癌药物治疗,造血干/祖细胞的数量也显著减少,但是当董尼酮与这些抗癌药物联合应用时,数量恢复到正常水平(参见图9和图10)。
已知骨髓造血干细胞的减少是由巨噬细胞分泌的已知作为炎性细胞因子的TNF-α的增加引起的。因此,通过免疫组织化学染色研究了从阿霉素、环磷酰胺和紫杉醇联合给药动物模型获得的股骨组织中TNF-α和F4/80(巨噬细胞标志物)的表达。结果是,联合应用阿霉素、环磷酰胺和紫杉醇的骨中TNF-α和F4/80的表达与正常组相比总体上显著增加。然而,在董尼酮治疗组中,上述表达显著减少(参见图11和图12)。
因此,证实了本发明的基于萘醌的化合物董尼酮和β-拉帕醌能够减少抗癌药物治疗上调的炎性细胞因子的产生,抑制食欲素减少,并且预防认知衰退和造血干细胞减少。因此,本发明的基于萘醌的化合物、其药学上可以接受的盐、其前药、其溶剂化物或其异构体可有效地用作药物组合物的活性成分,所述药物组合物用于预防或改善任意一种或多种选自疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的与抗癌药物治疗相关的副作用。
本发明实际的和当前优选的实施方案示例性地如以下实施例所示。
然而,应注意的是,本领域技术人员考虑本文的披露,可以在本发明的精神和范围内进行修改和改进。
实施例1:β-拉帕醌的合成
由于β-拉帕醌从拉帕乔树(lapacho trees)获得的量相对较少,却能从拉帕乔树中获得相当大量的拉帕醇,即合成β-拉帕醌的原料。于是,很早以前就开发了用于利用拉帕醇合成β-拉帕醌的方法。即,如果将拉帕醇和硫酸混合在一起,在室温下剧烈搅拌,可以相对较高的产率获得β-拉帕醌。
在本发明的优选实施方案中,为了获得拉帕醇,将2-羟基-1,4-萘醌(17.4g,0.10M)溶解在DMSO(120ml)中,缓慢加入LiH(0.88g,0.11M)。此时,需要注意,因为氢生成。搅拌反应溶液。确认氢气不再生成后,继续搅拌反应溶液30分钟。然后,缓慢添加异戊二烯基溴(1-溴-3-甲基-2-丁烯,15.9g,0.10M)和LiI(3.35g,0.025M)。将反应溶液加热至温度达到45℃,然后剧烈搅拌12小时。反应溶液冷却至10℃以下。然后加入冰(76g),再加入水(250ml)。加入浓盐酸(25ml)使溶液的pH保持在1。向反应溶液中加入EOtAc(200ml),然后剧烈搅拌。结果是,形成了不溶于EtOAc的白色固体。过滤固体,分离EtOAc层。水层再次用EtOAc(100ml)提取,然后将其与已经提取的有机层混合。有机层用5%的NaHCO
上述过程表示在以下的一般结构式中。
[结构式]
接着,向反应物中加入CH
1H-NMR(CDCl3,δ):8.05(1H,dd,J=1,8Hz),7.82(1H,dd,J=1,8Hz),7.64(1H,dt,J=1,8Hz),7.50(1H,dt,J=1,8Hz),2.57(2H,t,J=6.5Hz),1.86(2H,t,J=6.5Hz)1.47(6H,s).
实施例2:董尼酮的合成
在实施例1的获得拉帕醇的过程中,未溶解在EtOAc中的分离出的固体是O-取代的2-异戊烯基氧基-1,4-萘醌(O-alylated2-prenyloxy-1,4-maphthoquinone),与C-取代化的拉帕醇(C-alylated lapachol)不同。该固体用EtOAc再次重结晶来提纯。接着,纯化的固体(3.65g,0.015M)溶解于甲苯,然后回流5小时,以便诱导克莱森(Claisen)重排。减压蒸馏浓缩甲苯,所得混合物在室温下剧烈搅拌10分钟,同时在无需进一步纯化的情况下与硫酸(15ml)混合,然后加入冰(100g)终止反应。
反应物中加入CH
1H-NMR(CDCl3,δ):8.05(1H,d,J=8Hz),7.64(2H,d,J=8Hz),7.56(1H,m),4.67(1H,q,J=7Hz),1.47(3H,d,J=7Hz),1.45(3H,s)1.27(3H,s).
实施例3:α-董尼酮的合成
将在实施例2中纯化的2-异戊烯基氧基-1,4-萘醌(O-alylated2-prenyloxy-1,4-maphthoquinone)(4.8g,0.020M)溶解在二甲苯中,然后回流15小时,以便在比实施例1的条件更高的温度和更长的时间下诱导克莱森(Claisen)重排。在所述工艺过程中,获得处于进行到环化反应状态的α-董尼酮,以及其中两个甲基中的一个被重排的拉帕醇衍生物。然后减压蒸馏浓缩二甲苯,接着进行硅胶层析。结果是,获得纯α-董尼酮(1.65g)。
1H-NMR(CDCl3,δ):8.06(1H,d,J=8Hz),7.64(2H,m),7.57(1H,m),3.21(1H,q,J=7Hz),1.53(3H,s),1.51(3H,s)1.28(3H,d,J=7Hz).
实施例4:阿霉素动物模型的制备
本发明采用11周龄C57BL/6小鼠。本发明实验所用所有小鼠均在无菌动物室中饲养,温度22~26℃,湿度55~60%。允许小鼠自由进食一般固体饲料(SAMTACO Co.,Ltd.,韩国)和水。小鼠在实验前适应1周。根据圆光(Wonkwang)大学的实验室动物护理和伦理规定,所有实验均在获得临床试验管理委员会批准后进行。本发明的小鼠动物模型用不同的抗癌药物进行治疗。特别地,一种抗癌药物一次或多次腹腔注射给药,或几种抗癌药物一次或多次或以不同浓度给药,从而建立本发明的动物模型。在阿霉素诱导的动物模型中,将小鼠分为如下6组:给予PBS的对照组(对照,5只小鼠),腹腔注射阿霉素(4mg/kg/天)3次的组(ADR,5只小鼠),从阿霉素治疗前3天每天灌胃给予董尼酮或β-拉帕醌的组(20mg/kg,5只小鼠),以及给予董尼酮或β-拉帕醌的组(20mg/kg,5只小鼠)。阿霉素末次给药后4天,对小鼠进行分析。
1.对照(n=5)
2.阿霉素(12mg/kg)(n=5)
3.阿霉素+董尼酮(n=5)
4.董尼酮(20mg/kg)(n=5)
5.阿霉素+β-拉帕醌(n=5)
6.β-拉帕醌(20mg/kg)(n=5)
实施例5:吉西他滨(500mg/kg)动物模型的制备
在吉西他滨(500mg/kg)诱导的动物模型中,将小鼠分为如下4组:给予PBS的对照组(对照,5只小鼠),腹腔注射吉西他滨(500mg/kg/天)1次的组(GEM,5只小鼠),从吉西他滨给药前3天每天灌胃给予董尼酮的组(20mg/kg,5只小鼠),以及给予董尼酮的组(20mg/kg,5只小鼠)。
吉西他滨给药后2天,对小鼠进行分析。
1.对照(n=5)
2.吉西他滨(500mg/kg)(n=5)
3.吉西他滨+董尼酮(n=5)
4.董尼酮(20mg/kg)(n=5)
实施例6:阿霉素、环磷酰胺和紫杉醇共同治疗(3×ACP)的动物模型的制备
本发明人在本实验中建立了三种不同抗癌药物联合治疗的动物模型。本文中使用的抗癌药物是阿霉素(ADR)、环磷酰胺(CYP)和紫杉醇(PTX),它们被标记为ACP(临时命名)。每种抗癌药物用于治疗小鼠的浓度基于临床上用于癌症患者的单剂量(标记为1×浓度),且有关剂量的基本信息从国家综合癌症网(NCNN)获得。阿霉素、环磷酰胺和紫杉醇3×的浓度分别为4.62mg/kg、46.2mg/kg和6.18mg/kg,在抗癌药物治疗过程中,间隔1小时给药以完全吸收每种药物。在ACP诱导的动物模型中,将小鼠分为如下4组:给予PBS的对照组(对照,10只小鼠),腹腔注射3×ACP 1次的组(3×ACP,10只小鼠),从3×ACP给药前3天每天灌胃给予董尼酮的组(20mg/kg,10只小鼠),以及给予董尼酮的组(20mg/kg,10只小鼠)。ACP给药后2天和4天,对小鼠进行分析。
1.对照(n=10)
2. 3×ACP(n=10) 3×ACP:4.62mg/kg ADR
3. 3×ACP+董尼酮(20mg/kg)(n=10) 46.2mg/kg CYP
4.董尼酮(20mg/kg)(n=10) 6.18mg/kg PTX
实施例7:阿霉素、环磷酰胺和紫杉醇共同治疗(3×,6×ACP)的动物模型的制备
本发明人在本实验中建立了三种不同抗癌药物联合治疗的动物模型。本文中使用的抗癌药物是阿霉素(ADR)、环磷酰胺(CYP)和紫杉醇(PTX),它们被标记为ACP(临时命名)。每种抗癌药物用于治疗小鼠的浓度基于临床上用于癌症患者的单剂量(标记为1×浓度),且有关剂量的基本信息从国家综合癌症网(NCNN)获得。阿霉素、环磷酰胺和紫杉醇3×的浓度分别为4.62mg/kg、46.2mg/kg和6.18mg/kg,6×的浓度分别为9.24mg/kg、92.4mg/kg和12.36mg/kg,在抗癌药物治疗过程中,间隔1小时给药以完全吸收每种药物。在ACP诱导的动物模型中,将小鼠分为如下6组:给予PBS的对照组(对照,5只小鼠),腹腔注射3×ACP 1次的组(3×ACP,5只小鼠),从3×ACP治疗前3天每天灌胃给予董尼酮的组(20mg/kg,5只小鼠),腹腔注射6×ACP 1次的组(6×ACP,5只小鼠),从6×ACP给药前3天每天灌胃给予董尼酮的组(20mg/kg,5只小鼠),以及给予董尼酮的组(20mg/kg,5只小鼠)。ACP给药后3天,对小鼠进行分析。
1.对照(n=5)
2. 3×ACP(n=5)
3. 6×ACP(n=5)
4. 3×ACP+董尼酮(n=5) 3×ACP:4.62mg/kg ADR,46.2mg/kg CYP,6.18mg/kgPTX
5. 6×ACP+董尼酮(n=5) 6×ACP:9.24mg/kg ADR,92.4mg/kg CYP,12.36mg/kgPTX
6.董尼酮(20mg/kg)(n=5)
实施例8:阿霉素、环磷酰胺和紫杉醇共同治疗(4×ACP)的动物模型的制备
本发明人在本实验中建立了三种不同抗癌药物联合治疗的动物模型。本文中使用的抗癌药物是阿霉素(ADR)、环磷酰胺(CYP)和紫杉醇(PTX),它们被标记为ACP(临时命名)。每种抗癌药物用于治疗小鼠的浓度基于临床上用于癌症患者的单剂量(标记为1×浓度),且有关剂量的基本信息从国家综合癌症网(NCNN)获得。阿霉素、环磷酰胺和紫杉醇1×的浓度分别为1.54mg/kg、15.4mg/kg和2.06mg/kg,以2天的间隔腹腔给药共4天。在4×ACP诱导的动物模型中,将小鼠分为如下6组:给予PBS的对照组(对照,5只小鼠),每天腹腔给予1×ACP共4天的组(4×ACP,5只小鼠),从4×ACP给药前3天每天灌胃给予董尼酮的组(80mg/kg,5只小鼠)或β-拉帕醌的组(20mg/kg,5只小鼠),以及给予董尼酮的组(80mg/kg,5只小鼠)或β-拉帕醌的组(20mg/kg,5只小鼠)。ACP给药后2天,对小鼠进行分析。
/>
实施例9:环磷酰胺(350mg/kg)诱导的动物模型的制备
在环磷酰胺诱导的动物模型中,将小鼠分为如下4组:给予PBS的对照组(对照,5只小鼠),以150mg/kg和200mg/kg的浓度以3天的间隔逐步腹腔注射环磷酰胺(共350mg/kg)的组(CYP,5只小鼠),从环磷酰胺给药前3天每天灌胃给予董尼酮的组(20mg/kg,5只小鼠),以及给予董尼酮的组(20mg/kg,5只小鼠)。阿霉素给药后48小时,对小鼠进行分析。
1.对照(n=4)
2.CYP(350mg/kg)(n=4)
3.CYP+董尼酮(n=4)
4.董尼酮(20mg/kg)(n=4)
实施例10:阿霉素、环磷酰胺和紫杉醇联合给药(3×ACP)的动物模型的制备以分
在用于分析骨髓造血干细胞的保护作用的3×ACP诱导的动物模型中,将小鼠分为如下4组:给予PBS的对照组(对照,4只小鼠),腹腔注射3×ACP1次的组(3×ACP,4只小鼠),从3×ACP给药前3天每天灌胃给予董尼酮的组(20mg/kg,4只小鼠),以及给予董尼酮的组(20mg/kg,4只小鼠)。ACP给药后2天,对小鼠进行分析。
1.对照(n=4)
2. 3×ACP(n=4) 3×ACP:4.62mg/kg ADR
3. 3×ACP+董尼酮(20mg/kg)(n=4) 46.2mg/kg CYP
4.董尼酮(20mg/kg)(n=4) 6.18mg/kg PTX
实验例1:董尼酮对阿霉素诱导的炎性细胞因子的调节作用
细胞因子参与免疫系统和炎症反应,并且因此调节多种生物反应。在正常情况下,细胞因子受到严格调控,但任何体内变化,包括炎症,都可能导致细胞因子的过度产生和分泌,这可介导或加重各种疾病和紊乱。尤其是TNF-α、IL-1β、IL-6或IL-17的过度产生和分泌已被证实不仅与癌症本身密切相关,而且与癌症相关的疲劳、恶病质、疼痛、认知衰退和造血干细胞减少密切相关。因此,本发明人分析了本文中建立的动物模型的血浆中细胞因子的水平。
具体地,从按照实施例4中所述相同的方式制备的阿霉素动物模型分离血浆,通过ELISA(酶联免疫吸附试验)分析炎性细胞因子TNF-α(R&DSystems,MTA00B)、IL-1β(R&DSystems,MLB00C)、IL-6(R&D Systems,M6000B)和IL-17(R&D Systems,M1700)。
结果如图1所示,证实了与正常组相比,阿霉素给药组的血浆中炎性细胞因子的量显著增加。同时,董尼酮联合给药组中那些细胞因子的水平显著降低。
实验例2:董尼酮对吉西他滨诱导的炎性细胞因子的调节作用
从按照实施例5中所述相同的方式制备的吉西他滨动物模型分离血浆,通过ELISA分析炎性细胞因子TNF-α、IL-1β、IL-6和IL-17。
结果如图2所示,证实了与正常组相比,吉西他滨给药组的血浆中炎性细胞因子的量显著增加。同时,董尼酮联合给药组中那些细胞因子的水平显著降低。
实验例3:董尼酮对阿霉素、环磷酰胺和紫杉醇诱导的炎性细胞因子的调节作用
从按照实施例7中所述相同的方式制备的3×和6×ACP动物模型分离血浆,通过ELISA分析炎性细胞因子TNF-α、IL-1β、IL-6和IL-17。
结果如图3所示,与正常组相比,随着ACP浓度的升高,那些细胞因子的水平也升高。同时,在董尼酮联合给药组中,不仅在3×ACP治疗组中而且在6×ACP给药组中那些细胞因子的水平均被显著抑制。
实验例4:董尼酮对阿霉素、环磷酰胺和紫杉醇诱导的食欲素的调节作用
为了分析按照实施例8中所述相同的方式制备的4×ACP动物模型中的食欲素蛋白,提取小鼠下丘脑,然后制备匀浆。进行ELISA研究食欲素(MyBioSurCE,MbS2505504)根据董尼酮浓度的变化。
结果如图4所示,与正常组相比,4×ACP的治疗使下丘脑中的食欲素显著减少。在以80mg/kg的浓度给予董尼酮的治疗组中,食欲素减少显著恢复至几乎与对照组相同的水平。
实验例5:董尼酮对阿霉素、环磷酰胺和紫杉醇诱导的大脑炎性反应的调节作用
从按照如实施例8所述相同的方式制备的4×ACP动物模型提取小鼠下丘脑,从中提取RNA和蛋白质。进行RT-PCR和ELISA研究脑组织中炎性细胞因子TNF-α和IL-1β的表达。
结果如图5所示,与对照组相比,通过4×ACP治疗,下丘脑中TNF-α和IL-1β在RNA水平(左)和蛋白质水平(右)的表达都显著增加。在以80mg/kg的浓度给予董尼酮的治疗组中,下丘脑中由4×ACP治疗诱导的TNF-α和IL-1β在RNA水平和蛋白质水平上的上调均受到显著抑制。
实验例6:董尼酮对阿霉素、环磷酰胺和紫杉醇诱导的肌肉流失的调节作用
为了研究董尼酮对按照如实施例6中所述相同的方式制备的3×ACP动物模型中肌肉流失的调节作用,测量了药物治疗后体重和腓肠肌重量的变化。
结果如图6所示,董尼酮显著恢复了由3×ACP诱导的体重减轻。董尼酮治疗还显著恢复了3×ACP引起的腓肠肌重量下降和腓肠肌重量变化。
实验例8:董尼酮对环磷酰胺诱导的肌肉流失的调节作用
在按照实施例9中所述相同的方式制备的环磷酰胺(150mg/kg+200mg/kg)诱导的动物模型中,测量用药后体重和腓肠肌重量的变化,以研究董尼酮对肌肉流失的调节作用。
结果如图7所示,董尼酮显著恢复了由环磷酰胺诱导的体重减轻。董尼酮治疗还显著恢复了环磷酰胺引起的腓肠肌重量下降和腓肠肌重量变化。
实验例9:董尼酮对环磷酰胺诱导的肌肉流失相关基因表达的调节作用
在按照实施例9中所述相同的方式制备的环磷酰胺(350mg/kg)诱导的动物模型中,研究了董尼酮对肌肉中蛋白质降解直接相关的泛素连接酶(MAFbx和MuRF1)和自噬基因(Bnip3)表达的调节作用。
结果如图8所示,环磷酰胺显著增加了MAFbx、MuRF1和Bnip3 mRNA的表达,但董尼酮治疗显著降低了增加的表达。
实验例10:董尼酮对阿霉素、环磷酰胺和紫杉醇联合用药(3×ACP)诱导的骨髓造
从按照实施例10中所述相同的方式制备的动物模型提取股骨和胫骨,通过完全去除软组织从其获得骨组织。为了分离骨中的细胞,使用注射器推入HEPES缓冲液以获得骨髓细胞。为了确认骨髓细胞,如造血干细胞(HSC)和多能祖细胞(MPP),将细胞与每种细胞标记物相应的抗体反应;谱系阳性细胞(Lin+)抗体(CD3、B220、CD11b、TER-119和Ly-6G);和谱系阴性细胞(Lin-)抗体(Sca-1、c-Kit、CD150、CD48和Flk2),然后进行流式细胞术(Pietras等.2015;Schulte等.2015;Wognum.2015)。
结果如图9所示,显示了流式细胞术定量分析骨髓造血细胞的结果,对谱系阴性细胞分布的区域进行门控。然后,在其中确认了对干细胞标记物Sca-1和c-Kit双阳性(LSK;Lin-Sca-1+c-Kit+)的细胞。接下来,分离并分析造血干细胞和多能祖细胞,得到对多能祖细胞-4(MPP4)和造血干细胞/祖细胞(HSPC)的分析。用造血干细胞/祖细胞组,对长期造血干细胞(HSC
在图10中,从流式细胞术获得的各细胞系的数量以条形图表示,用于定量比较。抗癌药物阿霉素、环磷酰胺和紫杉醇的治疗使骨髓细胞总数减少至少65%。然而,当董尼酮与它们联合用药时,总数上升为是抗癌药物治疗组的数量的至少三倍。阿霉素、环磷酰胺和紫杉醇治疗使造血干细胞/祖细胞数量减少至少75%,而董尼酮治疗使造血干细胞/祖细胞数量再次上升为是之前数量的3倍那样多。同时,对造血细胞的分布也进行了研究。结果是,抗癌药物阿霉素、环磷酰胺和紫杉醇的给药使长期造血干细胞(HSC
实验例11:董尼酮对阿霉素、环磷酰胺和紫杉醇共同治疗诱导的骨中TNF-α表达的
TNF-α是一种炎性细胞因子,抑制抑制造血干细胞的维持。因此,为了研究TNF-α在骨中的表达,从按照实施例8中所述相同的方式制备的4×ACP动物模型分离股骨,接着使用TNF-α抗体(Santa Cruz,USA,sc-1348)进行免疫组织化学染色。
结果如图11所示,与对照组相比,4×ACP治疗总体上显著增加了骨中TNF-α(红棕色)的表达。然而,在以80mg/kg的浓度给予董尼酮的给药组中,由4×ACP治疗引起的骨中TNF-α的上调受到显著抑制。
实验例12:董尼酮对阿霉素、环磷酰胺和紫杉醇共同治疗诱导的巨噬细胞内流入
已知抑制造血干细胞的维持和活化的TNF-α表达主要在巨噬细胞中分泌。因此,为了研究骨中巨噬细胞的变化,从按照实施例8中所述相同的方式制备的4×ACP动物模型分离股骨,接着使用已知是巨噬细胞标记物的F4/80抗体(Santa Cruz,USA,sc-1348)进行免疫组织化学染色。
结果如图12所示,与对照组相比,4×ACP治疗显著增加了骨中F4/80阳性细胞(用箭头标记)的数量。同时,在以80mg/kg的浓度给予董尼酮的给药组中,4×ACP治疗诱导的增加的F4/80阳性细胞显著减少。
实验例13:β-拉帕醌对阿霉素诱导的炎性细胞因子的调节作用
为了研究β-拉帕醌对阿霉素诱导的炎性细胞因子的调节作用,从按照实施例4中所述相同的方式制备的阿霉素动物模型分离血浆,用ELISA分析炎性细胞因子TNF-α、IL-1β、IL-6和IL-17。
结果如图13所示,证实了与正常组相比,阿霉素治疗组的血浆中炎性细胞因子的量显著增加。同时,β-拉帕醌联合给药组中那些细胞因子的水平显著降低。
实验例14:β-拉帕醌对阿霉素、环磷酰胺和紫杉醇诱导的食欲素的调节作用
为了分析按照实施例8中所述相同的方式制备的4×ACP动物模型中的食欲素蛋白,提取小鼠下丘脑,然后制备匀浆。用ELISA分析食欲素(MyBioSurCE,MbS2505504)以研究β-拉帕醌对食欲素的调节作用。
结果如图14所示,与正常组相比,4×ACP给药显著减少了下丘脑中的食欲素。在β-拉帕醌治疗组中,食欲素下降显著恢复。
实验例15:β-拉帕醌对阿霉素、环磷酰胺和紫杉醇诱导的大脑炎性反应的调节作
从按照实施例8中所述相同的方式制备的4×ACP动物模型提取小鼠下丘脑,制备匀浆。然后,采用ELISA分析脑组织中炎性细胞因子TNF-α和IL-1β的表达。
结果如图15所示,与对照组相比,4×ACP给药显著增加了下丘脑中TNF-α和IL-1β的表达。在β-拉帕醌治疗组中,下丘脑中由4×ACP治疗诱导的TNF-α和IL-1β的上调受到显著抑制。
从以上结果证实了,通过减少已由抗癌药物治疗增加的炎性细胞因子的分泌和产生,基于萘醌的化合物董尼酮和β-拉帕醌在改善癌症相关疲劳、抑制恶病质、缓解疼痛、改善认知衰退和维持造血干细胞数量方面具有优异的作用。
本领域技术人员将理解,上述说明书中公开的概念和特定实施方案可容易地被用作修改或设计其他实施方案以实现本发明相同目的的基础。本领域技术人员还将理解,这些等同的实施方案不背离所附权利要求书中所阐述的本发明的精神和范围。
- 包含基于萘醌的化合物作为活性成分的用于预防或改善作为与抗癌药物治疗相关的副作用的疲劳、恶病质、疼痛、认知衰退和造血干细胞减少的组合物
- 用于抑制化疗引起的副作用的药物治疗以及相关药物组合物、诊断试剂、筛选技术和试剂盒
