一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物技术领域,具体涉及一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法。
背景技术
跨膜受体低密度脂蛋白受体相关蛋白5(Low-density lipoprotein receptor-related protein 5,LRP5)与骨密度密切相关,主要认为其通过经典Wnt/β-catenin信号通路调控骨形成,LRP5功能获得性突变可引起骨密度增加、骨皮质增厚、骨硬度和抗骨折能力增强等高骨量表现,通常不伴视网膜、心脏等其他系统疾病,相关神经并发症主要由过度骨形成所致,整体表现为良性突变。
研究发现LRP5高骨量突变具有降低因老龄化、长期使用激素、绝经、废用性萎缩等引起的骨质疏松风险,可挽救成骨不良、Stat3缺失导致的骨骼缺陷等,还可延缓胰岛素缺乏小鼠血糖升高以及控制血糖水平,这可能与增强糖酵解作用相关,表明其在治疗骨质疏松、成骨不良、糖尿病等疾病中的潜在应用价值。此外,LRP5功能获得性突变还可能与软骨发育、牙齿发育关系密切,但具体作用及相关机制有待进一步探究。
LRP5 A242T(c.724G>A,p.Ala242Thr)是临床最常见的LRP5功能获得性突变之一,迄今为止已在8个家族中发现,除了骨密度增高、骨皮质增厚、抗折性能增强外,部分患者还表现出硬腭骨赘生物,不伴视网膜、心脏等系统并发症。现有技术已利用Cre/loxP系统与同源重组方法构建携带Lrp5 A214V和G171V突变的条件性敲入小鼠,探究高骨量小鼠的骨特性及相关机制,其原理是利用Cre/loxP系统构建转基因小鼠,首先设计并构建同源重组载体,需包含目标突变基因和两端携带loxP修饰的新霉素抗性基因(Neomycin-resistancecassette,NeoR),NeoR的转录方向同目标基因相反并由强启动子驱动,或者loxP方向同目标基因相反,从而干扰目标基因表达。将同源重组载体显微注射至胚胎干细胞(Embryonicstem cell,ESCs,简称ES细胞)进行基因改造,筛选并验证中靶的阳性ES细胞,然后将阳性ES细胞注射到小鼠囊胚腔中,将获得的小鼠囊胚移植到假孕母鼠子宫内,获得并验证阳性F0代转基因小鼠,该小鼠仅携带但不表达目标突变基因。该F0代小鼠同野生型小鼠杂交获得稳定遗传的F1代,之后还需同Cre小鼠杂交获得F2代杂合子小鼠,F2代通过自交获得同时携带目标基因和Cre纯合子基因,表达的Cre重组酶可识别两个loxP位点,从而去除loxP和NeoR,使目的基因稳定表达。该过程往往需繁殖多代方可获得目标转基因小鼠,技术周期长,且引入筛选基因如NeoR,同患者人群的真实突变存在差异。
发明内容
本发明的目的在于提供一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法,本发明的方法周期短、且不携带其他基因修饰,小鼠Lrp5中的氨基酸A241与人LRP5的A242相对应,本发明的方法构建的小鼠同患者人群的真实突变一致。
本发明提供了一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法,包括以下步骤:
将Cas9 mRNA、Donor DNA和guideRNA混合后对供体小鼠的受精卵进行显微注射,再将显微注射后的受精卵移植到假孕母鼠中,繁殖子代,得到Lrp5 A241T基因点突变高骨量小鼠模型;
所述Donor DNA的核苷酸序列如SEQ ID NO.1所示;
所述guideRNA的核苷酸序列如SEQ ID NO.2所示。
优选的,所述繁殖子代包括对繁殖获得的F0代小鼠进行基因型鉴定,选取其中携带A241T突变的阳性小鼠与野生型小鼠交配,获得稳定遗传Lrp5 A241T突变的F1代杂合子小鼠。
优选的,所述野生型小鼠包括C57BL/6J小鼠。
优选的,所述供体小鼠包括C57BL/6J小鼠。
本发明还提供了上述方案所述的方法得到的Lrp5 A241T基因点突变高骨量小鼠模型在Lrp5A241T基因点突变相关的高骨量形成机制及骨质疏松治疗药物研究中的应用。
本发明还提供了一种基于CRISPR/Cas9技术制备Lrp5 A241T基因点突变高骨量小鼠模型的试剂盒,所述试剂盒中包括识别Lrp5 exon4目标位点区域的guideRNA,所述guideRNA的核苷酸序列如SEQ ID NO.2所示;所述Lrp5 exon4的核苷酸序列如SEQ ID NO.3所示。
优选的,所述试剂盒还包括Cas9 mRNA和Donor DNA;所述Donor DNA的核苷酸序列如SEQ ID NO.1所示。
本发明提供了一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法,包括以下步骤:将Cas9 mRNA、Donor DNA和guideRNA混合后对供体小鼠的受精卵进行显微注射,再将显微注射后的受精卵移植到假孕母鼠中,繁殖子代,得到Lrp5 A241T基因点突变高骨量小鼠模型;所述Donor DNA的核苷酸序列如SEQ ID NO.1所示;所述guideRNA的核苷酸序列如SEQ ID NO.2所示。本发明利用CRISPR/Cas9技术,通过构建打靶载体,利用同源重组修复方式引入LRP5目的点突变,从而获得Lrp5 A241T基因点突变的杂合子小鼠。本发明的方法较传统Cre/loxP系统操作更为简单,能够实现精准基因修饰,具有技术周期短、效率高的优点。此外,本发明构建的小鼠仅发生目的基因点突变,不携带其他基因修饰,同患者人群的真实突变一致,通过microCT等方式检测小鼠具有高骨量表征,对后续探究高骨量相关机制、研发相关靶向治疗药物或基因修饰疗法治疗骨质疏松等疾病、拓展LRP5高骨量突变的临床应用具有重要应用意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1表示突变型和野生型基因及引物设计示意图;
图2为水平电泳检测结果;
图3为野生型基因组序列和突变后实际测序结果;
图4为野生型小鼠突变位点附近峰形图;
图5为Lrp5 A241T杂合子小鼠突变位点附近峰形图;
图6为LRP5 A241T杂合子和野生型小鼠体型比较,其中A.野生型和突变杂合子小鼠;B.突变组小鼠身高与对照组无显著差异;C.突变组小鼠体重与对照组无显著差异;
图7为LRP5 A241T杂合子和野生型小鼠腰椎骨密度比较,其中,A.16周雄性小鼠第五腰椎microCT图像显示突变组骨皮质更厚,锥体骨密度更高;B、C.第五腰椎锥体的BV/TV、BMD显示在8周后突变组均高于对照组;
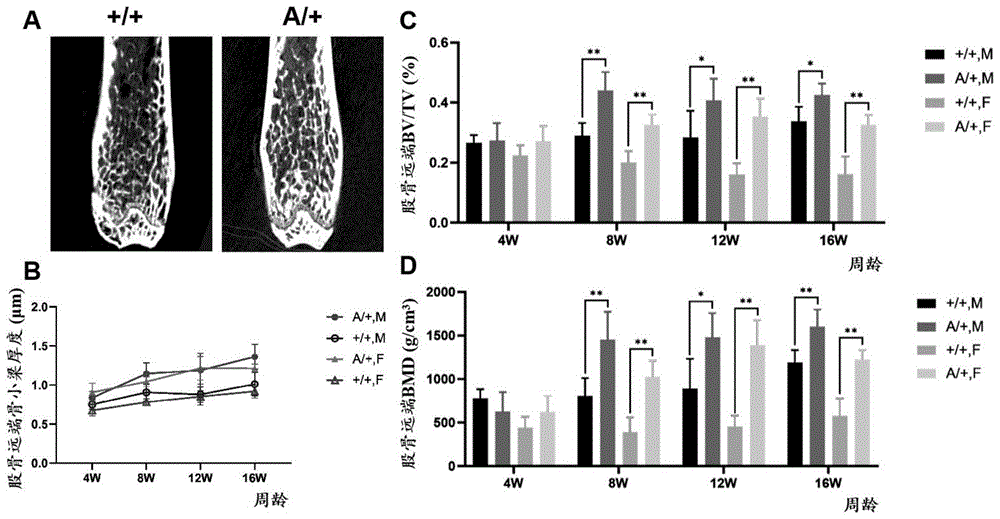
图8为LRP5 A241T杂合子和野生型小鼠股骨远端骨密度比较,其中,A.16周雄性小鼠股骨远端microCT图像;B.股骨远端的骨小梁厚度突变组高于对照组;C、D.股骨远端的BV/TV、BMD显示在8周后突变组均高于对照组;
图9为LRP5 A241T杂合子和野生型小鼠股骨干皮质厚度及胫骨机械强度比较,其中,A.16周雄性小鼠股骨干横截面microCT图像;B.股骨干的骨皮质厚度随年龄逐渐增厚,且突变组高于对照组,雄性高于雌性;C.突变组小鼠胫骨的极限荷载高于对照组。
具体实施方式
本发明提供了一种构建Lrp5 A241T基因点突变高骨量小鼠模型的方法,包括以下步骤:
将Cas9 mRNA、Donor DNA和guideRNA混合后对供体小鼠的受精卵进行显微注射,再将显微注射后的受精卵移植到假孕母鼠中,繁殖子代,得到Lrp5 A241T基因点突变高骨量小鼠模型;
所述DonorDNA的核苷酸序列如SEQ ID NO.1所示,具体为:
TGCCTGTTTCCTACCTACTGCAGGCAGAAGGTGGTGGAGGGCAGCCTCACT
所述guideRNA的核苷酸序列如SEQ ID NO.2所示,具体为:TTTGCCCTGACACTCTCTGG,其中加粗碱基为需突变的碱基。
在本发明中,所述Cas9mRNA是基于Cas9质粒,进行体外转录和提纯获得。Cas9mRNA可在细胞内瞬时表达Cas9蛋白,在guideRNA指导下对目的DNA序列特定位点进行剪切,可有效降低CRISPR基因编辑的脱靶效应。
在本发明具体实施过程中,Cas9mRNA是基于Cas9质粒,采用mMESSAGE mMACHINET7 Ultra Kit(Ambion,TX,USA)试剂盒进行体外转录,之后再采用MEGAclearTM Kit(ThermoFisher,USA)试剂盒进行纯化,具体操作按照试剂盒说明进行。
本发明在模型构建过程中,DonorDNA直接使用了同时含同义突变和目标突变这2个突变的Donor DNA:突变1:第一个的T,为突变后引入同义突变(加粗+下划线);突变2:A突变,是目标突变(加粗)。本发明所述Donor DNA将对应gRNA的PAM或邻近PAM的序列进行同义突变,以防止Donor DNA插入基因组前后被CAS9识别并切割。PAM序列的特征为NGG(其中N为任何碱基)。Cas9的切割位点则在NGG的5’端的第三个碱基。
在本发明中,为了防止guideRNA引导Cas9二次切割DonorDNA,在SEQ ID NO.4所示的初始设计的DonorDNA核苷酸下划线碱基处引入同义突变(CAT),但不改变对应的组氨酸;SEQ ID NO.4所示序列具体为:TGCCTGTTTCCTACCTACTGCAGGCAGAAGGTGGTGGAGGGCAGCCTCACT
本发明对Cas9 mRNA、Donor DNA和guideRNA的使用浓度和剂量没有特殊限制,采用本领域的常规使用浓度和剂量即可。
在本发明中,所述供体小鼠优选的包括C57BL/6J小鼠。
在本发明中,所述繁殖子代优选的包括对繁殖获得的F0代小鼠进行基因型鉴定,选取其中携带A241T突变的阳性小鼠与野生型小鼠交配,获得稳定遗传Lrp5 A241T突变的F1代杂合子小鼠。
在本发明中,携带A241T突变的阳性小鼠的突变位点的基因碱基为A,野生型小鼠为G。
本发明对所述鉴定的方法没有特殊限制,采用本领域的常规方法即可。
在本发明中,所述野生型小鼠优选的包括C57BL/6J小鼠。
在本发明中,稳定遗传Lrp5 A241T突变的F1代杂合子小鼠及后代基因鉴定阳性小鼠可用于后续研究,野生型C57BL/6J小鼠作为研究对照组。
本发明还提供了上述方案所述的方法得到的Lrp5 A241T基因点突变高骨量小鼠模型在Lrp5 A241T基因点突变相关的高骨量形成机制及骨质疏松等疾病治疗药物研究中的应用。
本发明还提供了一种基于CRISPR/Cas9技术制备Lrp5A241T基因点突变高骨量小鼠模型的试剂盒,所述试剂盒中包括识别Lrp5exon4目标位点区域的guideRNA,所述guideRNA的核苷酸序列如SEQ ID NO.2所示;所述Lrp5 exon4的核苷酸序列如SEQ ID NO.3所示,具体为:
在本发明中,SEQ ID NO.3所示的Lrp5 exon4的核苷酸序列为野生型基因组序列片段,其中有下划线且加粗的碱基为需突变的碱基,下划线所示序列为guideRNA的核苷酸序列。
在本发明中,所述试剂盒优选的还包括Cas9 mRNA和Donor DNA;所述Donor DNA的核苷酸序列如SEQ ID NO.1所示。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种构建Lrp5A241T基因点突变高骨量小鼠模型的方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
小鼠品系全名:C57BL/6J-Lrp5
1、获得Cas9 mRNA和guideRNA
通过体外转录的方式,获得Cas9 mRNA和guideRNA。
Cas9 mRNA是基于Cas9质粒,体外采用mMESSAGE mMACHINE T7 Ultra Kit(Ambion,TX,USA)试剂盒进行体外转录,之后再采用MEGAclearTM Kit(ThermoFisher,USA)试剂盒进行纯化,具体操作按照试剂盒说明进行。
野生型基因组序列信息如SEQ ID NO.5所示,具体为:
其中,小写碱基为内含子序列,大写碱基为外显子序列,即Lrp5 exon4序列,加下划线且加粗碱基为需突变的碱基,下划线所示序列为guideRNA序列。
2、合成获得Donor DNA
Donor DNA核苷酸序列如SEQ ID NO.1所示,具体为:
其中加粗且下划线的碱基为突变后的碱基,第一个为同义突变,第二个为目的突变。
3、同源重组获得F0阳性小鼠
将Cas9 mRNA、guideRNA和Donor DNA显微注射到C57BL/6J小鼠的受精卵中,将注射后的受精卵移植到假孕母鼠中,20天左右后获得F0代小鼠。
通过PCR扩增及测序对其进行基因型鉴定,携带Lrp5 A241T突变的小鼠视为阳性。具体如下:
1)小鼠基因组DNA提取:对小鼠进行编号并剪取3~5mm鼠尾放入已编号的1.5ml离心管中,并盖好盖子。每管加0.5mL裂解液和50μL蛋白酶K贮存液,将离心管置杂交炉中,56℃转动过夜。次日将样本于室温、12000rpm离心10min。取上清至新的1.5mLEP管中,加入1mL无水乙醇(约2倍上清体积),盖紧盖子后轻摇,可见絮状沉淀。13000rpm离心15min,弃上清。加入70%乙醇1mL,洗涤,13000rpm离心15min,弃上清,收集沉淀,室温晾15min。每管加80~100μL灭菌水,盖好后置室温或37℃1h充分溶解。待DNA全部溶解后-20℃保存,或直接进行PCR。DNA浓度控制在50~100ng/μL,OD260/280在1.8~2.0之间。
2)PCR扩增:
引物信息如下所示以及参见图1:
Primer I,上游引物:5’-AGTGAGGAGAGTGTGCTTGC-3’(SEQ ID NO.6);
Primer II,下游引物:5’-TGGCTCAGCACTTGGATGTC-3’(SEQ ID NO.7)。
反应体系参见表1:
表1反应体系
注:*PrimeStar GXL DNA Polymerase(TaKaRa,Code No:R050A)。
反应条件参见表2。
表2反应条件
水平电泳检测:制备1.7%琼脂糖凝胶,点样后水平电泳,确认324bp条带,结果参见图2。
3)基因测序:PCR产物进行DNA测序明确碱基序列。
测序引物:5’-AGTGAGGAGAGTGTGCTTGC-3’(SEQ ID NO.8)。
野生型基因组序列和突变后实际测序结果参见图3。其中,Query为野生型基因组序列,Subject为突变后实际测序结果。
4、获得可稳定遗传Lrp5 A241T突变的转基因小鼠
F0代阳性小鼠与野生型C57BL/6J小鼠交配,繁育获得F1代小鼠,通过PCR扩增及测序对其进行基因型鉴定,获得可稳定遗传Lrp5 A241T突变的F1代杂合子小鼠。F1及后代基因鉴定阳性小鼠可用于后续研究,野生型C57BL/6J小鼠作为研究对照组。基因鉴定流程如下:
1)小鼠基因组DNA提取:对小鼠进行编号并剪取3~5mm鼠尾放入已编号的1.5ml离心管中,并盖好盖子。每管加入100μL 50mmol/L NaOH溶液,置于金属浴上煮沸至100℃,持续30min,然后置于冰上。每管加入26μL 10mmol/L Tris-HCl溶液,涡旋混匀,离心3000rpm1min。
2)PCR扩增:
引物信息(同前):
上游引物:5’-AGTGAGGAGAGTGTGCTTGC-3’(SEQ ID NO.6);
下游引物:5’-TGGCTCAGCACTTGGATGTC-3’(SEQ ID NO.7)。
PCR反应体系参见表3。
表3PCR反应体系
注:*2X Rapid Taq Master Mix(Vazyme,P222-03)
PCR循环条件参见表4。
表4PCR循环条件
水平电泳检测结果同前
PCR产物基因测序,测序引物同前。
野生型小鼠突变位点附近峰形图参见图4。
Lrp5 A241T杂合子小鼠突变位点附近峰形图参见图5。
实施例2
采集4、8、12、16周龄的Lrp5 A241T小鼠,以野生型小鼠为对照,每小组各6只,测量并比较身高和体重,收集股骨、第五腰椎、颅骨、胫骨,通过microCT检测骨形态表征,测量股骨干、颅骨骨皮质厚度,股骨远端和第五腰椎的骨密度(BMD、BV/TV)、骨小梁参数(Tb.Th、Tb.N等),通过三点弯曲试验检测胫骨机械强度,结果表明虽然身高和体重无明显差异,Lrp5 A241T小鼠具有高骨量表现,且胫骨具有更强的抗折性,具体参见图6~图9。从图6来看,Lrp5 A241T小鼠与野生型小鼠之间的身高和体重无明显差异,但存在性别差异,雄性高于雌性,A/+:Lrp5 A241T杂合子小鼠;+/+:野生型小鼠。从图7来看,LRP5 A241T小鼠腰椎骨密度高于野生型小鼠,A.16周雄性小鼠第五腰椎microCT图像显示突变组骨皮质更厚,锥体骨密度更高;B、C.第五腰椎锥体的BV/TV、BMD显示在8周后突变组均高于对照组。从图8来看,LRP5 A241T小鼠股骨远端骨密度高于野生型小鼠,A.16周雄性小鼠股骨远端microCT图像;B.股骨远端的骨小梁厚度突变组高于对照组;C、D.股骨远端的BV/TV、BMD显示在8周后突变组均高于对照组。从图9来看,LRP5 A241T小鼠的股骨干皮质厚度和胫骨机械强度高于,A.16周雄性小鼠股骨干横截面microCT图像;B.股骨干的骨皮质厚度随年龄逐渐增厚,且突变组高于对照组,雄性高于雌性;C.突变组小鼠胫骨的极限荷载高于对照组。
综上来看,本发明利用CRISPR/Cas9技术和同源重组方式成功构建了Lrp5 A241T基因点突变的杂合子小鼠,该LRP5点突变小鼠为首次构建,且CRISPR/Cas9技术具有技术周期短、效率高的优点。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 一种COL4A3 p.P408H基因点突变小鼠模型及其构建方法、应用和试剂盒
- 一种Foxi3基因定点突变小鼠模型的构建方法及其应用
