一种生产L-缬氨酸的基因工程菌及其构建方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于基因工程技术领域,具体涉及一种生产L-缬氨酸的基因工程菌及其构建方法与应用。
背景技术
L-缬氨酸是哺乳动物的八大必需氨基酸之一,与亮氨酸、异亮氨酸合称支链氨基酸,具有多种生理功能,被广泛应用于动物饲料、化妆品、医药、食品、农药等领域。L-缬氨酸分子式为C
L-缬氨酸的生产方法主要有蛋白质水解提取法、化学合成法和微生物发酵法。随着全世界对环保问题的重视,可持续发展的绿色生物合成技术正逐步替代传统化学合成技术。同时微生物发酵法具有反应条件温和、成本低、纯度高等优点,因此利用葡萄糖从头合成L-缬氨酸成为主流的生产方式。目前,国内L-缬氨酸的主要供应商为沈阳希杰、宁夏伊品、安徽华恒、廊坊梅花等公司,年产能分别为5、2、1、1万吨。随着市场需求的快速增长,L-缬氨酸有望迈入高附加值的大宗化学品行列。因此如何提高L-缬氨酸产量、转化率和生产强度等工业化指标成为研究机构重点关注的热点。
为了获得高效的L-缬氨酸生产菌株,研究者们已做出了诸多尝试。Park等(ParkJH,Lee KH,Kim TY,Lee SY.Metabolic engineering of Escherichia coli for theproduction of L-valine based on transcriptome analysis and in silico geneknockout simulation.Proc Natl Acad Sci U S A.2007,104(19):7797-802.)以大肠杆菌为出发菌,定点突变乙酰羟酸合成酶解除L-缬氨对其的反馈抑制,用强启动子tac过表达合成途径的ilvBNEDA基因以及负责L-缬氨酸外排系统的lrp、ygaZH基因,删除aceF、mdh和pfkA基因,所获得的重组菌株利用20g/L葡萄糖生产7.55g/L L-缬氨酸,糖酸转化率为37.8%。在此基础上,Park等以E.coli W为底盘细胞,构建的重组菌株在29.5h内合成60.7g/L L-缬氨酸(Park JH,Jang YS,Lee JW,Lee SY.Escherichia coli W as a newplatform strain for the enhanced production of L-valine by systems metabolicengineering.Biotechnol Bioeng.2011,108(5):1140-7.)。Hasegawa等定点突变乙酰羟酸还原异构酶和引入球形芽胞杆菌的亮氨酸脱氢酶,将L-缬氨酸合成所需的辅酶由NADPH转化为NADH,解决了辅因子失衡问题,使得经预培养的重组谷氨酸棒杆菌菌株在缺氧条件下24h合成172g/L L-缬氨酸,糖酸转化率为41%(Hasegawa S,Uematsu K,Natsuma Y,SudaM,Hiraga K,Jojima T,Inui M,Yukawa H.Improvement of the redox balanceincreases L-valine production by Corynebacterium glutamicum under oxygendeprivation conditions.Appl Environ Microbiol.2012,78(3):865-75.)。Blombach等用启动子dapA-A16替换aceE的天然启动子来降低丙酮酸脱氢酶的表达,使得重组谷氨酸棒杆菌菌株合成85.6g/L L-缬氨酸,糖酸转化率为23.4%(Buchholz J,Schwentner A,Brunnenkan B,Gabris C,Grimm S,Gerstmeir R,Takors R,Eikmanns BJ,BlombachB.Platform engineering of Corynebacterium glutamicum with reduced pyruvatedehydrogenase complex activity for improved production of L-lysine,L-valine,and 2-ketoisovalerate.Appl Environ Microbiol.2013,79(18):5566-75.)。黄建忠等利用紫外诱变结合高通量筛选的方法,选育出一株产量为70.1g/L L-缬氨酸、糖酸转化率为36.5%的黄色短杆菌突变株(Huang QG,Zeng BD,Liang L,Wu SG,Huang JZ.Genomeshuffling and high-throughput screening of Brevibacterium flavum MDV1 forenhanced L-valine production.World J Microbiol Biotechnol.2018,34(8):121-130.)。张学礼等利用厌氧适应性进化的方法,选育出一株在48h内产量为80g/L L-缬氨酸、糖酸转化率为60%的大肠杆菌突变株(CN 114457122 A)。饶志明等通过比较不同溶解氧条件下缬氨酸生产菌株的转录水平,挖掘出新的代谢改造靶点,使得大肠杆菌重组菌株产量达到92g/L,糖酸转化率为34%(Hao Y,Pan X,Xing R,You J,Hu M,Liu Z,Li X,Xu M,RaoZ.High-level production of L-valine in Escherichia coli using multi-modularengineering.Bioresour Technol.2022,359:127461)。
尽管进行了诸多尝试,但是现有L-缬氨酸生产菌株的性能仍有待提升。丙酮酸是L-缬氨酸合成的前体物质,也是糖酵解途径与三羧酸循环途径的连接点。同时三羧酸循环途径为大肠杆菌生长提供大量的能量、还原力和中间代谢物,故此现阶段利用微生物发酵法生产L-缬氨酸存在“生长与生产竞争碳流”的问题,导致大规模工业生产面临发酵周期长,糖酸转化率低等难题。
发明内容
针对现有技术不足,本发明的目的是构建一种生产L-缬氨酸的大肠杆菌基因工程菌株,该菌株对L-缬氨酸合成模块、辅因子再生模块进行了系统性改造,实现在限氧和/或缺氧条件下大肠杆菌中L-缬氨酸的高效、稳定生产。
为了实现上述目的,本发明采取如下的技术方案:
第一方面,本发明提供了一种基因工程菌,该基因工程菌以大肠杆菌为宿主,异源过表达Bacillus subtilis的编码乙酰乳酸合成酶的alss基因和编码亮氨酸脱氢酶的bcd基因,Corynebacterium glutamicum的编码支链氨基酸膜转运蛋白的brnFE基因,并且过表达大肠杆菌的编码酮醇酸还原异构酶突变体L67E/R68F/K75E的ilvC基因,编码二羟酸脱水酶的ilvD基因,编码3-磷酸甘油醛脱氢酶的gapA基因和编码烟酸磷酸核糖转移酶的pncB基因;并且不表达编码苹果酸脱氢酶的mdh基因;并且将硫辛酰胺脱氢酶替换为突变体A321T。
第二方面,本发明提供了如上所述的基因工程菌的构建方法,包括:在宿主大肠杆菌中引入Bacillus subtilis的alss基因和bcd基因并过表达,引入Corynebacteriumglutamicum的brnFE基因并过表达;并且过表达大肠杆菌的编码酮醇酸还原异构酶突变体L67E/R68F/K75E的ilvC基因,编码二羟酸脱水酶的ilvD基因,编码3-磷酸甘油醛脱氢酶的gapA基因和编码烟酸磷酸核糖转移酶的pncB基因;并且将mdh基因敲除或失活;并且将硫辛酰胺脱氢酶基因lpd替换为突变体A321T的编码基因。
第三方面,本发明提供了如上所述的基因工程菌在高效生产L-缬氨酸中的应用。
第四方面,本发明提供了利用如上所述的基因工程菌生产L-缬氨酸的方法,包括:在培养基中培养所述基因工程菌以使其生产L-缬氨酸;以及,从所述基因工程菌和/或所述培养基中收集所述L-缬氨酸。
本发明的有益效果如下:
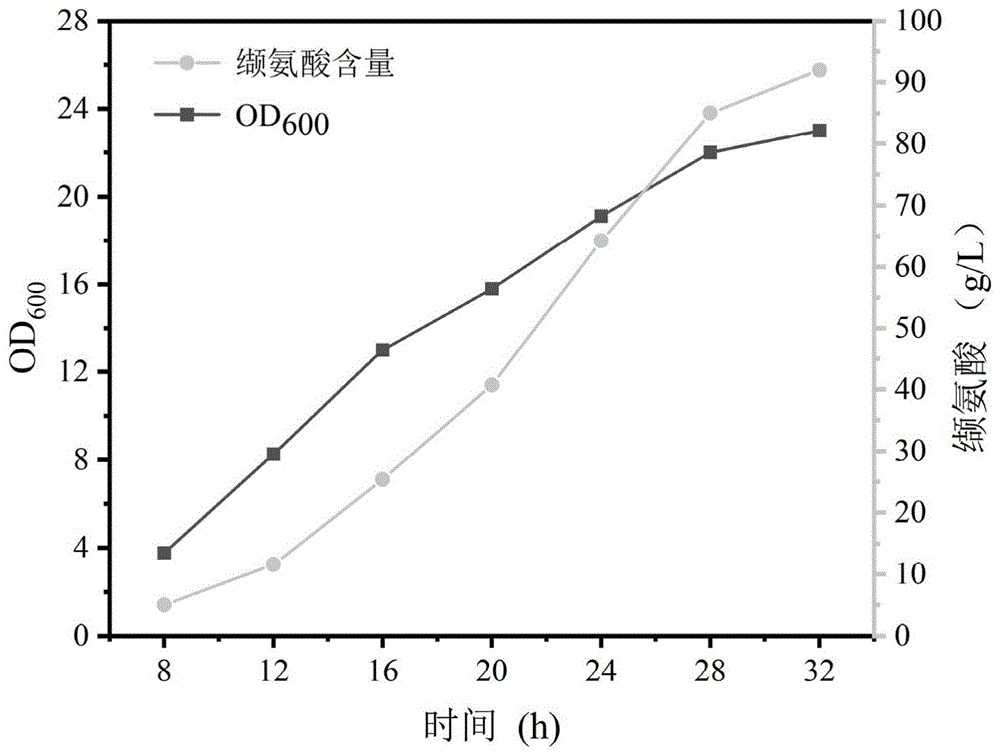
本发明以大肠杆菌为出发菌株,经过对L-缬氨酸的合成模块、辅因子再生模块进行系统的代谢工程改造得到一株遗传背景清晰,能稳定高效生产L-缬氨酸的基因工程菌株VAL9,该菌株在60r/min条件下,摇瓶发酵20h可生产L-缬氨酸24.36g/L;在5L发酵罐上进行分批补料发酵,限氧发酵32h可生产L-缬氨酸92g/L,转化率60.4%,未有其它副产物的显著积累。本发明提供的L-缬氨酸发酵生产方法,L-缬氨酸产量、生产强度和转化率为目前报道的最高水平,并且发酵过程基本实现自动化,可显著降低生产成本。
附图说明
图1:VAL9 5L发酵罐分批补料发酵曲线。
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
第一方面,本发明提供了一种基因工程菌,该基因工程菌以大肠杆菌为宿主,异源过表达Bacillus subtilis的编码乙酰乳酸合成酶的alss基因和编码亮氨酸脱氢酶的bcd基因,Corynebacterium glutamicum的编码支链氨基酸膜转运蛋白的brnFE基因,并且过表达大肠杆菌的编码酮醇酸还原异构酶突变体L67E/R68F/K75E的ilvC基因,编码二羟酸脱水酶的ilvD基因,编码3-磷酸甘油醛脱氢酶的gapA基因和编码烟酸磷酸核糖转移酶的pncB基因;并且不表达编码苹果酸脱氢酶的mdh基因;并且将硫辛酰胺脱氢酶替换为突变体A321T。
根据本发明,突变体的标识:氨基酸残基使用公认IUPAC命名法,DNA核酸序列使用公认IUPAC命名法。采用“原始氨基酸位置替换的氨基酸”来表示蛋白突变体中突变的氨基酸。例如A321T,表示硫辛酰胺脱氢酶的氨基酸序列(NCBI-ProteinID:NP_414658.1)第321位的氨基酸由丙氨酸(A)替换为苏氨酸(T),其编码基因则以lpd A321T表示。根据本发明一种具体实施方式,其编码基因的核苷酸序列(NCBI-GeneID:944854)第961位的碱基由鸟嘌呤(G)替换为腺嘌呤(A),以lpd
再例如L67E/R68F/K75E,表示酮醇酸还原异构酶的氨基酸序列(NCBI-ProteinID:NP_418222.1)第67位、第68位、第75位的氨基酸均发生了替换,其编码基因则以ilvC L67E/R68F/K75E表示。根据本发明一种具体实施方式,其编码基因的核苷酸序列(NCBI-GeneID:948286)第199位的碱基由胞嘧啶(C)替换成鸟嘌呤(G),第200位的碱基由胸腺嘧啶(T)替换成腺嘌呤(A),第202位的碱基由胞嘧啶(C)替换成胸腺嘧啶(T),第203位的碱基由鸟嘌呤(G)替换成胸腺嘧啶(T),以及第223位的碱基由腺嘌呤(A)替换成鸟嘌呤(G),以ilvC
根据本发明,用于构建所述基因工程菌的宿主可以是任意的大肠杆菌,例如,本领域常见用作基因工程宿主的E coli W3110、E coli W3110、E coli BL21、E.coli BW25113等模式菌株,只要可以对其进行基因编辑表达上述需要过表达或异源过表达的基因即可;上述大肠杆菌各基因的选择根据所选宿主进行选择,但均是实现同一功能的基因。
根据本发明一种优选的实施方式,所述宿主是E.coli MG1655。
根据本发明,不表达上述基因的方式可以采取本领域常规手段,例如,通过本领域常规手段使该基因失活或者将该基因敲除。
根据本发明,所述不表达是指该基因表达产物的量显著低于原有水平,例如,显著降低了至少50%、60%、70%、80%、90%、100%。
根据本发明,所述过表达是指该基因表达产物的量显著高于原有水平,例如,提高了150%或更多,200%或更多,300%或更多。
根据本发明,过表达上述基因的方式,可以通过在大肠杆菌基因组中引入和/或增加该基因的拷贝数(例如,通过pET28a、pTrc99a、pSTV28等自主复制质粒增加基因的拷贝数,或者增加大肠杆菌染色体中该基因的拷贝数),或者修饰该基因的表达调控序列(例如,启动子,核糖体结合位点等),或者以上方法的组合。
根据本发明一种优选的实施方式,过表达上述基因的方式是将该基因连接了强启动子并整合在大肠杆菌基因组中,其中基因的整合位点可以根据本领域技术人员常规认知选择一些不会对细菌生长和基础代谢产生明显影响的假基因位点,例如yeeP、ygiP、yghX、ygaY、yjiT、yjiP、ycjV、ycgH、ygaY、yeeL、ilvG、rph等基因位点都是可以选择的;所述强启动子可以选择P
第二方面,本发明提供了如上所述的基因工程菌的构建方法,包括:在宿主大肠杆菌中引入Bacillus subtilis的alss基因和bcd基因,引入Corynebacterium glutamicum的brnFE基因;并且过表达大肠杆菌的编码酮醇酸还原异构酶突变体L67E/R68F/K75E的ilvC基因,编码二羟酸脱水酶的ilvD基因,编码3-磷酸甘油醛脱氢酶的gapA基因和编码烟酸磷酸核糖转移酶的pncB基因;并且将mdh基因敲除或失活;并且将硫辛酰胺脱氢酶基因lpd替换为突变体A321T的编码基因。
本发明第一方面已经详细介绍了上述各基因的选择、宿主的选择等,此处不再赘述第一方面已经介绍过的内容。
根据本发明一种具体的实施方式,该方法包括:
(1)强化L-缬氨酸合成途径
在宿主大肠杆菌的基因组上分别整合Bacillus subtilis来源的编码乙酰乳酸合成酶的alss基因,编码亮氨酸脱氢酶的bcd基因,大肠杆菌的酮醇酸还原异构酶突变体L67E/R68F/K75E的编码基因ilvC和二羟酸脱水酶的编码基因ilvD,并分别由启动子P
(2)提高L-缬氨酸的胞外转运
将Corynebacterium glutamicum来源的brnEF基因整合在大肠杆菌基因组中,并由启动子P
(3)提高辅因子NADH的供应
在宿主大肠杆菌的基因组上整合自身编码3-磷酸甘油醛脱氢酶的gapA基因,编码烟酸磷酸核糖转移酶的pncB基因,并由启动子P
(4)提高菌株对限氧环境的耐受性
将硫辛酰胺脱氢酶的编码基因lpd替换为突变体A321T的编码基因,该步骤可提高菌株对限氧环境的耐受性,进一步提高菌株在限氧发酵条件下L-缬氨酸的生产性能。
第三方面,本发明提供了如上所述的基因工程菌在高效生产L-缬氨酸中的应用。
第四方面,本发明提供了利用如上所述的基因工程菌生产L-缬氨酸的方法,包括:在培养基中培养所述基因工程菌以使其生产L-缬氨酸;以及,从所述基因工程菌和/或所述培养基中收集所述L-缬氨酸。
根据本发明第四方面,所述基因工程菌的培养可以采用本领域常规方法进行。用于生产L-缬氨酸的培养基可以是合成的或天然的培养基,例如含有碳源、氮源、硫源、无机离子和需要的其它有机和无机组分的典型培养基。
所述基因工程菌可以在限氧和/或缺氧条件下进行培养,持续16至72小时,或20至60小时,或24至48小时;培养温度可以控制在30至45℃,或30至37℃内;且pH可以调节在5.0至8.0之间,或6.0至7.5之间,或6.8至7.2之间。可以通过使用无机或有机酸性或碱性物质,以及氨气调节pH。
培养后,可以通过常规技术(例如离心,膜过滤)从液体培养基中除去固体,如细胞和细胞碎片,然后可以通过常规技术(例如浓缩,离子交换层析,结晶)的任意组合从发酵液回收L-缬氨酸。
根据本发明一种优选的实施方式,优选的培养基组成如下:葡萄糖10-30g/L,酵母浸粉0.5-3g/L,(NH
根据本发明另一种优选的实施方式,优选的培养基组成如下:葡萄糖10-30g/L,酵母浸粉1-6g/L,柠檬酸钠1-5g/L,(NH
以下将通过具体的实施例对本发明进行更详细描述。以下实施例中:
如无特别说明,本发明实施例中所涉及的基因编辑方法参照文献(Li Y,Lin Z,Huang C,et al.Metabolic engineering of Escherichia coli using CRISPR–Cas9meditated genome editing.Metabolic engineering,2015,31:13-21.)进行。其中pREDCas9携带gRNA表达质粒pGRB的消除系统,λ噬菌体的Red重组系统及Cas9蛋白表达系统,奇霉素抗性(工作浓度:100mg/L),32℃培养;pGRB以pUC18为骨架,包括启动子J23100,gRNA-Cas9结合区域序列和终止子序列,氨苄青霉素抗性(工作浓度:100mg/L),37℃培养。该方法通过pGRB质粒和重组DNA片段的转化,筛选阳性菌株后再将质粒消除,实现重组片段的敲除或敲入。其中用于敲除的重组片段由需敲除基因的上下游同源臂组成(上游同源臂-下游同源臂),用于整合的重组片段以整合位点的上下游同源臂及待整合的基因片段组成(上游同源臂-目的基因-下游同源臂)。其他所涉及的分子生物学、基因工程等具体操作手段根据本领域人员容易获得的技术手册、教科书或文献报道均可以实现,不必在此详细描述操作过程。此外,以下实施例中选用了具体的菌株作为宿主,因而根据宿主选择了具体的基因整合位点、目标基因及其引物等,但并不意味着本发明目的仅能通过这些具体的选择得以实现,不能以此限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。
实施例1:大肠杆菌基因工程菌VAL9的构建
1菌株构建过程中用到的引物,如下表所示:
/>
/>
2菌株的构建过程
2.1alss基因整合
以E.coli MG1655基因组为模板,根据其mbhA基因的上下游序列设计上游同源臂引物(UP-mbhA-S、UP-mbhA-A)和下游同源臂引物(DN-mbhA-S、DN-mbhA-A),PCR扩增其上下游同源臂片段;根据Bacillus subtilis 168的alss基因序列(NCBI-GeneID:936852)设计扩增alss片段所需引物alss-S和alss-A,启动子P
2.2bcd基因整合
以E.coli MG1655基因组为模板,根据其yjiv基因的上下游序列设计上游同源臂引物(UP-yjiv-S、UP-yjiv-A)和下游同源臂引物(DN-yjiv-S、DN-yjiv-A),PCR扩增其上下游同源臂片段;根据Bacillus subtilis 168的bcd基因序列(NCBI-GeneID:938670)设计扩增bcd片段所需引物bcd-S和bcd-A,启动子P
2.3brnFE基因整合
以E.coli MG1655基因组为模板,根据其yjiT基因的上下游序列设计上游同源臂引物(UP-yjiT-S、UP-yjiT-A)和下游同源臂引物(DN-yjiT-S、DN-yjiT-A),PCR扩增其上下游同源臂片段;根据Corynebacterium glutamicum ATCC 13032的brnE、brnF基因序列(KEGG-ID:cg0315、cg0314)设计扩增brnEF片段所需引物brnEF-S和brnEF-A,启动子P
2.4 ilvC
以E.coli MG1655基因组为模板,根据其gapC基因的上下游序列设计上游同源臂引物(UP-gapC-S、UP-gapC-A)和下游同源臂引物(DN-gapC-S、DN-gapC-A),PCR扩增其上下游同源臂片段;根据ilvC基因序列(NCBI-GeneID:948286)设计扩增ilvC
2.5ilvD基因整合
以E.coli MG1655基因组为模板,根据其ydeU基因的上下游序列设计上游同源臂引物(UP-ydeU-S、UP-ydeU-A)和下游同源臂引物(DN-ydeU-S、DN-ydeU-A),PCR扩增其上下游同源臂片段;根据ilvD基因序列(NCBI-GeneID:948277)设计扩增ilvD片段所需引物ilvD-S和ilvD-A,启动子P
2.6gapA基因整合
以E.coli MG1655基因组为模板,根据其rph基因的上下游序列设计上游同源臂引物(UP-rph-S、UP-rph-A)和下游同源臂引物(DN-rph-S、DN-rph-A),PCR扩增其上下游同源臂片段;根据gapA基因序列(NCBI-GeneID:947679)设计扩增gapA片段所需引物gapA-S和gapA-A,启动子P
2.7pncB基因的整合
以E.coli MG1655基因组为模板,根据其yghE基因的上下游序列设计上游同源臂引物(UP-yghE-S、UP-yghE-A)和下游同源臂引物(DN-yghE-S、DN-yghE-A),PCR扩增其上下游同源臂片段;根据pncB基因序列(NCBI-GeneID:946648)设计扩增pncB片段所需引物pncB-S和pncB-A,启动子P
2.8mdh基因的敲除
以E.coli MG1655基因组为模板,根据其mdh基因(NCBI-GeneID:947854)的上下游序列设计上游同源臂引物(UP-Δmdh-S、UP-Δmdh-A)和下游同源臂引物(DN-Δmdh-S、DN-Δmdh-A),PCR扩增其上下游同源臂片段,上述片段通过重叠PCR的方法融合获得Δmdh基因的整合片段(上游同源臂-下游同源臂),构建质粒pGRB-mdh使用的含靶序列的DNA片段通过引物gRNA-mdh-S和gRNA-mdh-A的退火制得。将该重组片段和质粒pGRB-mdh电转至VAL7的感受态细胞,筛选阳性菌株后再将质粒消除获得菌株VAL8。阳性菌株通过PCR及电泳验证mdh基因敲除成功。
2.9lpd基因的突变
以E.coli MG1655基因组为模板,根据其lpd基因(NCBI-GeneID:944854)的上下游序列设计上游同源臂引物(UP-Δlpd-S、UP-Δlpd-A)和下游同源臂引物(DN-Δlpd-S、DN-Δlpd-A),PCR扩增其上下游同源臂片段,将上述片段通过重叠PCR的方法融合获得Δlpd基因片段(上游同源臂-下游同源臂);构建pGRB-lpd使用的含靶序列的DNA片段通过引物gRNA-Δlpd-S和gRNA-Δlpd-A的退火制得。制备VAL8的感受态细胞,按照上述的基因编辑方法操作,将VAL8工程菌中原始的lpd基因部分片段敲除,并引入新的gRNA切割序列(gRNA-lpd*-S),新的gRNA切割序列则设计在UP-Δlpd-A引物和DN-Δlpd-S引物中。筛选阳性菌株后再将质粒pGRB-lpd消除获得菌株VAL8:Δlpd。阳性菌株通过PCR及电泳验证lpd基因敲除成功。
以E.coli MG1655基因组为模板,根据其lpd基因的上下游序列设计上游同源臂引物(UP-lpd*-S、UP-lpd*-A)和下游同源臂引物(DN-lpd*-S、DN-lpd*-A),PCR扩增其上下游同源臂片段,将上述片段通过重叠PCR的方法融合获得lpd
实施例2:基因工程菌VAL8、VAL9摇瓶发酵生产L-缬氨酸
利用上述构建的基因工程菌株摇瓶发酵生产L-缬氨酸的方法如下:
斜面活化培养:取-80℃保藏菌种划线接种于活化斜面,37℃培养12h。
种子培养:用接种环刮取一环斜面种子接种于装有30mL种子培养基的500mL三角瓶中,九层纱布封口,37℃,200rpm培养8-10h;
发酵培养:按种子培养液体积10-15%的接种量接种到装有发酵培养基的500mL三角瓶中(终体积为30mL),九层纱布封口,37℃,60r/min振荡培养,发酵过程中按苯酚红指示剂指示,按少量多次的原则补加氨水,控制培养基pH在7.0左右;当培养基中葡萄糖消耗完毕,及时补加1mL 60%(m/v)葡萄糖溶液至发酵结束,发酵周期20h;
活化斜面培养基:葡萄糖1g/L,蛋白胨10g/L、牛肉膏10g/L,酵母浸粉5g/L,NaCl5g/L,琼脂粉25g/L,其余为水。
种子培养基:葡萄糖20g/L,酵母浸粉5g/L,蛋白胨10g/L,NaCl 10g/L,其余为水。
摇瓶发酵培养基:葡萄糖20g/L,酵母浸粉2g/L,柠檬酸钠1g/L,(NH
VAL8通过摇瓶发酵培养20h,可生产L-缬氨酸21.54g/L,OD
实施例3:基因工程菌VAL9发酵罐发酵生产L-缬氨酸
利用上述构建的基因工程菌株5L发酵罐发酵生产L-缬氨酸的方法如下:
斜面活化培养:从-80℃冰箱保菌管中刮一环菌种,均匀涂布于活化斜面,37℃培养12h,转接茄形瓶继续培养12h;
发酵培养:取适量无菌水将茄形瓶中菌体洗下,并将菌悬液接入含3L发酵培养基中的5L发酵罐中,开始发酵。发酵过程中控制pH稳定在7.0左右,温度维持在35℃,通风维持在0.2L/min,转速维持在300r/min;发酵开始后,当培养基中的底糖消耗完之后,通过补料流加速率的调整,维持发酵培养基中的葡萄糖浓度在0.1-2g/L;
斜面和茄形瓶培养基组成为:葡萄糖1g/L,蛋白胨10g/L,牛肉膏10g/L,酵母粉5g/L,NaCl 5g/L,琼脂25g/L,其余为水;
发酵培养基组成为:葡萄糖10g/L,酵母浸粉2g/L,柠檬酸钠1g/L,(NH
基因工程菌VAL9在5L发酵罐中培养32h后,L-缬氨酸的积累量达到92g/L,转化率60.4%,未有其它氨基酸和有机酸等副产物的明显累积,发酵过程曲线见附图1。
虽然本发明已经以较佳实施例公开如上,但其并非用以限定本发明,任何本领域技术人员,在不脱离本发明的精神和原理的情况下,可以对这些实施例进行各种形式和细节的变化、修改、替换和变型,本发明的范围由权利要求及其等同物所限定。
