GM-CSF在制备胃癌预后诊断产品中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于生物医药技术领域,具体涉及粒细胞-巨噬细胞集落刺激因子(GM-CSF)在制备胃癌预后诊断产品中的应用。
背景技术
胃癌是常见消化道恶性肿瘤之一,总体生存率低。虽然近年来进展期胃癌围手术期的辅助治疗等取得了长足进步,但胃癌的预后状况仍亟待改善。胃癌微环境细胞包括免疫细胞,间充质干细胞(MSC),内皮细胞,各类基质细胞等,能够为胃癌细胞提供支持,促进胃癌发展。集落刺激因子2(CSF2)编码粒细胞-巨噬细胞集落刺激因子(GM-CSF),能够控制粒细胞和巨噬细胞的产生、分化和功能,是炎症反应的重要介质。GM-CSF已被证明通过免疫依赖性和非依赖性机制调节肿瘤微环境的形成并促进肿瘤进展。
发明人前期研究发现,GM-CSF在胃癌微环境MSC中高表达;过表达CSF2的MSC能够分泌GM-CSF,促进胃癌细胞的增殖、迁移等恶性进展。同时,GM-CSF的高表达与胃癌预后不良有关,胃癌术后1年内复发的患者,其胃癌组织标本中GM-CSF的表达量显著高于胃癌术后3年内未复发的患者。因此,本发明设计采用GM-CSF作为标志物以制备胃癌预后诊断产品。
发明内容
本发明的目的之一是提供粒细胞-巨噬细胞集落刺激因子(GM-CSF)在制备胃癌预后诊断产品中的应用。
进一步地,所述诊断产品可以为诊断试剂或诊断试剂盒。
更进一步地,所述的试剂或试剂盒采用免疫组化方法检测GM-CSF在胃癌组织中的相对表达量,从而判断胃癌患者出现复发的风险及生存状况。
具体地,所述的应用是指将GM-CSF作为分子标记,利用GM-CSF单克隆抗体或多克隆抗体,结合免疫组化试剂,检测GM-CSF在胃癌组织中的相对表达量,从而判断胃癌患者出现复发的风险及生存状况,预测胃癌患者预后。
本发明的目的之二是提供一种胃癌预后检测试剂盒,包括GM-CSF抗体。
本发明的目的之三是提供一种检测GM-CSF表达量的免疫组化试剂盒,包括人源化GM-CSF抗体、HRP标记的羊抗鼠IgG、DAB显色液和苏木素复染液。
本发明从临床样本中发现GM-CSF这一指标,围绕GM-CSF开展基础性研究,通过体外功能学实验证明GM-CSF是调控胃癌微环境细胞,促进胃癌恶性进展的重要分子之一。在基础研究成果之上,进一步制备了一种能够检测人源性胃癌GM-CSF表达量的免疫组化试剂盒,并再次回归临床样本检测,证明GM-CSF可以作为胃癌预后判断的指标。
与现有技术相比,本发明的有益效果如下:
1、本发明提供的试剂盒敏感性高,GM-CSF抗体与其他胃癌标志物相比,阳性强度可达到+++,符合临床监测标准。
2、本发明提供的试剂盒准确性高,GM-CSF抗体与其他胃癌标志物相比,准确性较高,符合临床监测标准。
3、本发明提供的试剂盒,可以应用于人胃癌组织中GM-CSF抗原的检测,GM-CSF的表达量作为胃癌患者术后复发预测指标。
本发明以患者肿瘤组织为检测样本,具有快捷,敏感性好,特异性高,易于推广应用等特点,可用于指导胃癌术后辅助治疗,降低高危患者术后复发率。
附图说明
图1为GM-CSF在胃癌微环境MSC中高表达的实验结果。其中:A为GM-CSF与胃癌微环境MSC指标α-SMA免疫荧光组织共定位情况;B为ELISA检测MSC细胞上清中GM-CSF的表达水平。
图2为GM-CSF编码基因(CSF2)调控MSC促进胃癌恶性进展的实验结果。其中:A为胃癌细胞平板克隆形成实验结果;B为胃癌细胞迁移实验结果。
图3为实施例3中试剂盒用于胃癌患者免疫组化检测的结果(20X)。其中:A为胃癌术后1年内复发患者GM-CSF的表达情况;B为胃癌术后3年内未复发患者GM-CSF的表达情况。
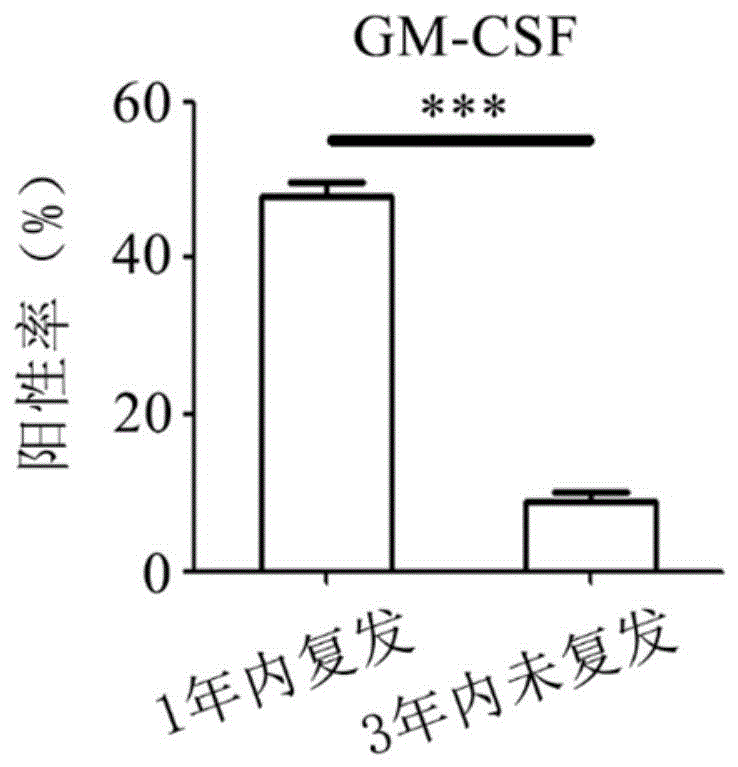
图4为胃癌患者GM-CSF表达阳性率与胃癌复发的结果。
实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1 胃癌组织来源间充质干细胞(MSC)高表达GM-CSF
1、取临床胃癌病理切片(来自镇江市第一人民医院病理科),进行如下操作:
(1)组织切片脱蜡、水化和抗原修复。切片置于二甲苯中,浸泡15min×2次。甩去多余液体后,置于无水乙醇中,浸泡30s。甩去多余液体后,置于95%乙醇中,浸泡30s。甩去多余液体后,置于70%乙醇中,浸泡30s。流水冲洗3min后,PBS溶液(0.01mol/L,pH 7.2-7.4)漂洗3min×2次。切片置于柠檬酸钠抗原修复液(武汉博士德,AR0024)中,压力锅煮沸修复3min,自然冷却至室温。PBS溶液漂洗3min×3次。
(2)封闭。每张切片滴加山羊血清(武汉博士德,AR0009)50μL,37℃孵育30min,甩去多余液体,不洗。
(3)孵育一抗。每张组织切片滴加含α-SMA(Immunoway,YM3364,1:500)和GM-CSF(CST,56712S,1:200)的抗体稀释液共50μL,4℃孵育过夜。PBS溶液漂洗3min×3次。
(4)孵育荧光二抗。每张组织切片滴加含FITC标记山羊抗鼠IgG(碧云天,A0568,1:500)和Cy3标记山羊抗兔IgG(碧云天,A0516,1:500)的抗体稀释液共50μL,37℃避光孵育30min,PBS溶液漂洗3min×3次。
(5)细胞核荧光染色。每张组织切片滴加hoechst33258(碧云天,C1017)染料50μL,37℃避光孵育20min,PBS溶液漂洗5min×3次。
(6)荧光显微镜下观察切片标本。
2、取新鲜临床胃癌组织和相应癌旁组织标本(来自镇江市第一人民医院普外科),进行如下操作:
(1)采用组织贴壁法分离培养组织来源MSC。胃癌组织和相应癌旁组织浸泡于含100U/mL青霉素和100μg/mL链霉素的PBS溶液中30min。将组织剪成直径约为1~3mm的组织块,贴附于3.5cm的细胞培养皿中。培养皿倒置于含5% CO
(2)GM-CSF表达量的检测。分别收集胃癌组织来源MSC和相应癌旁组织来源MSC的细胞培养上清,采用ELISA的方法检测GM-CSF的表达量。根据试剂盒(ExCell,EH012-48)说明书进行操作:在GM-CSF抗体包被板中依次加入100μL/孔稀释好的标准液(试剂盒配套产品),待测样本,阴性对照和阳性对照(试剂盒配套产品),37℃孵育60min,洗涤液漂洗5min×3次。加入新鲜配制的酶标抗体100μL/孔,37℃孵育60min,洗涤液漂洗5min×3次。加入新鲜配制的TMB显色溶液100μL/孔,37℃孵育15min,加入终止液50μL/孔,读取各孔吸光度值。根据标准曲线计算待测样本中GM-CSF的浓度。
如图1所示,GM-CSF与胃癌微环境MSC指标α-SMA存在共定位(A),GM-CSF主要来源于胃癌微环境中的MSC;与癌旁组织来源MSC相比,胃癌组织来源MSC分泌大量GM-CSF(B)。
实施例2 GM-CSF能够调控胃癌组织MSC促进胃癌细胞恶性进展
(1)细胞转染。GM-CSF编码基因CSF2的质粒(上海吉玛)和小干扰RNA(上海吉玛,5’-CΜGAACCΜGAGUAGAGACATT-3’,3’-ΜGUCUCUACUCAGGUUCAGTT-5’)分别转染癌旁组织MSC和胃癌组织MSC。6孔板的每孔加入2mL的完全培养基和125μL转染混合物,包括121μLOpti-MEM® Medium(ThermoFisher,31985062)+ 4μL lipo8000转染试剂(碧云天,C0533)+2.5 μg质粒或200 pmol/L siRNA。转染6h后,更换为正常干细胞专用培养基。48h后收集各组MSC的培养上清。
(2)消化HGC-27细胞,计数1×10
(3)消化HGC-27细胞,计数5×10
如图2所示,过表达CSF2的癌旁组织来源MSC来源上清能够诱导胃癌细胞克隆形成(A)和迁移能力增强(B);而敲减CSF2能够逆转胃癌组织来源MSC上清促进胃癌细胞克隆形成(A)和迁移(B)的能力。高表达GM-CSF能够赋予正常MSC以肿瘤MSC相似的促胃癌功能,表明GM-CSF是促进胃癌发展的重要分子之一。
实施例3 GM-CSF制备预后诊断试剂盒进行临床样本检测
1、试剂盒组成。胃癌个体化诊断检测试剂盒包括如下组分:
(1)5μg/mL人源化GM-CSF抗体(CST,56712S)1mL
(2)HRP标记的羊抗兔IgG(武汉博士德)1mL
(3)DAB显色液(武汉博士德)1mL
(4)苏木素复染液(武汉博士德)1mL
(5)3% H
2、试剂盒的使用方法:
(1)组织切片脱蜡、水化和抗原修复,具体步骤详见实施例1。
(2)3% H
(3)5μg/mL人源化GM-CSF抗体每张组织切片滴50μL,4℃孵育过夜。PBS漂洗2min×3次。
(4)HRP标记的羊抗兔IgG每张组织切片滴50μL,37℃孵育1h。PBS漂洗2min×3次。
(5)DAB显色液每张组织切片滴50μL,室温孵育3-10min。
(6)苏木素复染1-2min,盐酸酒精泛蓝1min。
(7)脱水,透明,树脂封片剂封片,显微镜拍照观察。
3、试剂盒进行胃癌临床标本的检测:
收集了镇江市第一人民医院胃癌手术病理切片,根据试剂盒使用方法进行实验。按照染色程度+(<=20%),++(20-50%),+++(51-75%),++++(76-100%)4级进行评分。最后用统计软件进行分析。
如图3所示,GM-CSF在胃癌术后1年内复发患者中的表达呈强阳性(A),在胃癌术后3年内未复发的患者中的表达呈阴性或弱阳性(B)。结果表明,GM-CSF的高表达与胃癌预后不良有关,胃癌术后1年内复发的患者,其组织标本中GM-CSF的表达量显著高于胃癌术后3年内未复发的患者。
实施例4 扩大样本量验证试剂盒的临床检测效率
发明人回顾性分析了镇江市第一人民医院2013年-2022年胃癌手术患者的随访数据,选取胃癌术后1年内复发患者和胃癌术后3年内未复发患者各10例,应用上述GM-CSF试剂盒进行样本检测。
如图4所示,胃癌术后1年内复发患者GM-CSF的平均阳性率达47.8%,胃癌术后3年内未复发患者GM-CSF的平均阳性率仅8.8%,统计具有显著性差异。通过临床样本检测和预后数据分析发现,GM-CSF强阳性患者预后差,复发率高,因此可以作为胃癌预后判断的评判标准之一。
根据以上结果可知,本发明首次通过检测GM-CSF表达量评估胃癌术后复发风险,这为胃癌术后开展规范化和个体化的治疗提供临床依据。
- miR-495-5p在制备诊断、预后、预防或治疗胰腺癌的产品中的应用
- MACC1-AS1探针在制备用于预测胃癌临床预后的诊断试剂中的应用
- MACC1‑AS1探针在制备用于预测胃癌临床预后的诊断试剂中的应用
