包括核仁素结合肽的抗病毒组合物
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及与核仁素特异性结合的新型肽的抗病毒用途,并且更具体地,涉及一种包括由特定氨基酸序列表示的肽的抗病毒组合物,一种包括其中所述肽与细胞穿透肽融合的融合肽的抗病毒组合物,一种包括所述组合物的用于预防或治疗病毒感染的组合物,以及一种用于预防或改善病毒感染的健康功能性食品组合物。
背景技术
作为传统诊断和治疗方法的替代,癌症特异性肽可用于提高治疗效率并减少与纳米粒子和抗体癌症疗法相关的副作用(Mori T.Curr Pharm Des.2004;10:2335-43)。肽配体具有许多优点,包括易于大规模合成、低免疫原性、无毒代谢物的生成以及高体内生物相容性(McGregor DP.Curr Opin Pharmacol.2008;8:616-9)。在许多开发肽的方法中,一珠一化合物(OBOC)组合方法是筛选肽配体的有力方法(Lam KS,et al.Chem Rev.1997;97:411-48)。基于OBOC组合库的肽筛选方法促进了癌症和其他疾病中用于细胞靶向的新型肽配体的发现(Mikawa M,et al.Mol Cancer Ther.2004;3:1329-34)。虽然已经使用体外OBOC组合筛选或其他方法分离了许多癌症特异性肽,但是仍然存在一些挑战。特别是,使用肽的药物的主要缺点是半衰期非常短,因为被肽酶非常快速地切割(Borchardt TR,etal.Adv Drug Deliv Rev.1997;27:235-56)。本发明人试图通过开发一种专门的方法来合成树枝状形式的多抗原肽(MAP)的形式的生物活性肽,从而克服这些问题。由于获得了对蛋白酶和肽酶活性的抗性,树枝状形式的单体肽的合成增加了稳定性(McGuire MJ,etal.Sci Rep.2014;4:4480)。
因此,本发明人构思了一系列被称为“AGM”或“AGM肽”的肽配体,其通过将OBOC组合筛选与MAP合成相结合而与人乳腺癌和结肠直肠癌细胞特异性结合。此外,本发明人通过下拉(pull-down)分析和LC-MS/MS鉴定了核仁素(NCL)是AGM的靶蛋白。NCL是核仁中最丰富的蛋白质。在本发明中,发现使用抗NCL抗体等通过病毒感染增加了NCL的表达,并且发现当将受到包括冠状病毒和流感病毒在内的各种病毒感染的细胞用AGM肽处理时,病毒的增殖和复制被抑制并且获得了抗病毒功效。基于此,完成了本发明。
在该背景技术部分中公开的信息仅仅是为了增强对本发明的背景的理解而提供的,因此它可能不包括形成对本领域技术人员来说已经显而易见的现有技术的信息。
发明内容
本发明的一个目的是提供一种抗病毒组合物,其包括与核仁素(NCL)特异性结合的肽。
本发明的另一个目的是提供一种包括其中与核仁素(NCL)特异性结合的肽与细胞穿透肽(CPP)融合的融合肽的抗病毒组合物。
本发明的另一个目的是提供一种包括抗病毒组合物的用于预防或治疗病毒感染的组合物。
本发明的另一个目的是提供一种预防或治疗病毒感染的方法,该方法包括向受试者给药抗病毒组合物。
本发明的另一个目的是提供抗病毒组合物用于预防或治疗病毒感染的用途。
本发明的另一个目的是提供抗病毒组合物在制备用于预防或治疗病毒感染的药物中的用途。
根据本发明的一个方面,上述和其他目的可以通过提供以下来实现:
一种抗病毒组合物,包括与核仁素(NCL)特异性结合的AGM肽,其中,所述AGM肽包括选自由以下组成的组的氨基酸序列:
(a)由SEQ ID NOS:1至8中任一项表示的氨基酸序列;以及
(b)包括在由SEQ ID NO:1表示的氨基酸序列中的选自以下组的至少一个氨基酸突变的氨基酸序列:
(i)自N-末端的第五个甲硫氨酸残基的置换;
(ii)自N-末端的第七个酪氨酸残基的置换;以及
(iii)在C-末端处亮氨酸或赖氨酸残基的插入。
根据本发明的另一方面,提供了一种包括AGM肽-CPP融合肽的抗病毒组合物,其中与核仁素(NCL)特异性结合的AGM肽与细胞穿透肽(CPP)融合。
根据本发明的另一方面,提供了一种包括肽、融合肽或抗病毒组合物的用于预防或治疗病毒感染的组合物。
根据本发明的另一方面,提供了一种预防或治疗病毒感染的方法,所述方法包括向受试者给药肽、融合肽或抗病毒组合物。
根据本发明的另一方面,提供了肽、融合肽或抗病毒组合物用于预防或治疗病毒感染的用途。
根据本发明的另一方面,提供了肽、融合肽或抗病毒组合物在制备用于预防或治疗病毒感染的药物中的用途。
附图说明
图1是说明根据本发明的AGM-330和PEG的缀合物的单体(AGM-330m)、二聚体(AGM-330d)和四聚体(AGM-330t)结构的图。
图2说明了AGM-330-CPP融合肽的结构,其中AGM-330-PEG缀合物与根据本发明的细胞穿透肽(CPP)融合。
图3是说明肽库合成和筛选步骤的示意图:1.通过分开-混合合成法(split-mixsynthesis)构建OBOC组合库;2.合成约2,600,000个库;3.OBOC库与癌细胞一起在CO
图4示出了用于癌症特异性配体和MAP合成的OBOC库的筛选。
图4A示出了肽与癌细胞系和正常细胞的结合特异性,并且图4B示出了全细胞结合分析的结果,其示出了所选定的8种珠粒的细胞结合特异性,其中多个乳腺和结肠直肠癌细胞以及正常乳腺和结肠直肠细胞以10
图5示出了通过AGM-330(AGM-330m、AGM-330d、AGM-330t)进行的肽体内稳定性的测试结果,其中,在将2mg/kg的AGM-330给药于小鼠的尾静脉之后,使用肝素包被的管每0、0.167、1、2、4、6、8、12、24和48小时从眼睛收集血液,使血液在4℃下凝结,并通过在4℃下以5,000rpm离心10分钟来收集血清,将血清中的肽残余物通过抗AGM-330抗体立即固定在ELISA板上,使用VersaMax ELISA板读数器(Molecular Devices)在450nm波长处测量吸光度,并使用phoenix WinNonlin 8.1(Pharsight Corporation,Mountain View,CA,USA)程序分析药代动力学。
图6示出了AGM-330的分子靶标和特征的鉴定结果。
图6A是说明生物素下拉分析、质谱和蛋白质印迹的示意图。图6B示出了通过10%SDS-PAGE分离后从亲和柱洗脱的蛋白质的考马斯亮蓝染色结果,其中泳道1:蛋白质标志物;泳道2:生物素下拉实验前的总裂解物;泳道3:用AGM-330-生物素孵育后的流穿(flow-through)液;泳道4-6:珠粒洗涤级分;泳道7-8:AGM-330结合蛋白的洗脱,并且*红星表示在切下蛋白条带用于在凝胶中裂解后进行LC-MS/MS分析。图6C示出了通过由MS检测的肽的蛋白质数据库搜索,将NCL鉴定为AGM-330结合配偶体的结果。图6D示出了通过LC-MS/MS分析获得的基因列表,其中置信度得分代表经鉴定的蛋白质的mascot得分。图6E示出了使用抗NCL抗体通过生物素下拉洗脱的蛋白质的免疫印迹分析结果,箭头表示NCL的存在。图6F示示了NCL结构域与AGM-330结合的分析结果,将不同的GFP-NCL构建体转染入HEK293T细胞中,将AGM-330-生物素加入至与链霉亲和素珠粒结合的NCL残基1-710和1-322,或残基323-710,并且使用抗GFP抗体通过免疫印迹分析珠粒上的蛋白质。
图7示出了通过SPR测试AGM-330对NCL的亲和力的结果,以K
图8示出了通过生物素下拉分析的AGM-330和纯化的NCL之间的直接相互作用分析的结果。经洗脱的蛋白质的免疫印迹分析示出了使用抗NCL抗体的生物素下拉的形成。泳道1:蛋白质标志物;泳道2:经纯化的NCL的输入;泳道3:与AGM-330-生物素孵育后的流穿液;泳道4-6:珠粒洗涤级分;泳道7-8:AGM-330结合蛋白的洗脱。箭头表示NCL的存在。
图9是示出AGM-330t-mCPP融合肽的合成过程的图。
图10示出了AGM-330t-mCPP融合肽、AGM-330t和马来酰亚胺-CPP的HPLC和MS分析结果。
图11示出了AGM-330针对甲型流感病毒(IAV)增殖的抑制作用。
图12示出了AGM-330针对牛冠状病毒(BCoV)的抑制作用。
图13示出了AGM-330针对猪流行性腹泻病毒(PEDV)的抑制作用。
图14示出了AGM-330针对牛轮状病毒(RVA)的抑制作用。
图15是示出AGM-330针对猪繁殖与呼吸综合征病毒(PRRSV)增殖的抑制作用的图。
图16是示出AGM-330对猪札如病毒(PSaV)增殖的抑制作用的图。
图17是示出AGM-330的半数最大细胞毒性浓度(CC
图18是示出AGM-330的半数最大细胞毒性浓度(CC
图19是示出在经SARS-CoV-2感染的仓鼠中AGM-330d-mCPP(AGM-380D)对体重变化的影响的图。
图20示出了在经SARS-CoV-2感染的仓鼠中AGM-330d-mCPP(AGM-380D)的改善的肉眼可见的肺部病变。
图21示出了在经SARS-CoV-2感染的仓鼠中阴性对照(NC)肺组织的肉眼可见的肺部病变。
图22示出了在经SARS-CoV-2感染的仓鼠中病毒对照(VC)肺组织的肉眼可见的肺部病变。
图23示出了经给药AGM-330d-mCPP(AGM-380D,0.2mg/kg)的经SARS-CoV-2感染的仓鼠的肺组织的肉眼可见的肺部病变。
图24示出了经给药AGM-330d-mCPP(AGM-380D,2mg/kg)的经SARS-CoV-2感染的仓鼠的肺组织的肉眼可见的肺部病变。
图25示出了经给药AGM-330d-mCPP(AGM-380D,6mg/kg)的经SARS-CoV-2感染的仓鼠的肺组织的肉眼可见的肺部病变。
图26示出了经SARS-CoV-2感染的仓鼠的对照组和试验组的肺组织的组织病理学分析。
图27示出了AGM-330针对甲型流感病毒(IAV)感染的体内抗病毒效果。
图28示出了AGM-330和奥司他韦的联合给药对甲型流感病毒(IAV)感染的体内抗病毒效果。
图29示出了AGM-330对甲型流感病毒(IAV)复制的抑制作用。
具体实施方式
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的技术人员所理解的相同含义。通常,本文所用的术语是本领域公知的,并且是通常使用的。
在一个方面,本发明涉及:
一种抗病毒组合物,包括与核仁素(NCL)特异性结合的AGM肽,其中所述AGM肽包括选自由以下组成的组的氨基酸序列:
(a)由SEQ ID NOS:1至8中任一项表示的氨基酸序列;以及
(b)包括在由SEQ ID NO:1表示的氨基酸序列中的选自以下组的至少一个氨基酸突变的氨基酸序列:
(i)自N-末端的第五个甲硫氨酸残基的置换;
(ii)自N-末端的第七个酪氨酸残基的置换;以及
(iii)在C-末端处亮氨酸或赖氨酸残基的插入。
能够功能性和特异性靶向肿瘤的肽配体的发现为癌症诊断和治疗提供了新的机遇。然而,由于肽配体的生物半衰期短,其使用受到很大限制。
在本发明中,使用一珠一化合物(OBOC)与多抗原肽(MAP)合成法一起合成了2,600,000个肽库,然后鉴定了AGM-330、AGM-331、AGM-332、AGM-333、AGM-334、AGM-335、AGM-336和AGM-337,它们是具有表1中所示氨基酸序列的新型癌症特异性肽配体(图3),通过细胞结合测定、流式细胞仪和荧光共聚焦显微镜鉴定在体外和体内与癌细胞特异性结合的肽配体。
此外,通过下拉分析和LC-MS/MS分析发现膜核仁素(NCL)是AGM-330、AGM-331、AGM-332、AGM-333、AGM-334、AGM-335、AGM-336和AGM-337的靶蛋白。
[表1]
八种肽中的三种(AGM-330、AGM-331和AGM-332)与乳腺癌细胞系(MDA-MB-231)和人类正常乳腺细胞系(MCF)具有强的、特异性和优先的结合,而不与人类正常乳腺细胞系(MCF-10A)结合或与其结合较弱(见图4A以及图4B)。
此外,证实了具有SEQ ID NO:1的氨基酸序列的AGM-330仍然保持与核仁素的强的且特异性结合,尽管它在一些氨基酸残基上有突变。
特别地,在本发明中,SEQ ID NO:1的氨基酸序列中的氨基酸突变可以包括选自由以下组成的组的至少一个突变:
(i)自N-末端的第五个甲硫氨酸残基的置换;
(ii)自N-末端的第七个酪氨酸残基的置换;以及
(iii)在C-末端处亮氨酸或赖氨酸残基的插入,
但不限于此。
优选地,在本发明中,SEQ ID NO:1的氨基酸序列中的氨基酸突变可以包括选自由以下组成的组的至少一个突变:
(i)用亮氨酸或正亮氨酸对自N-末端的第五个甲硫氨酸残基的置换;
(ii)用苯丙氨酸对自N-末端的第七个酪氨酸残基的置换;以及
(iii)在C-末端处亮氨酸或赖氨酸残基的插入,
但不限于此。
在本发明中,包括突变的氨基酸序列可以选自由以下组成的组:SEQ ID NO:9至SEQ ID NO:15以及SEQ ID NO:20,但不限于此(表2)。
[表2]
在SEQ ID NO:13的氨基酸序列中,“Nle”是指正亮氨酸。
如本文所用,术语“AGM”、“AGM肽”或“AGM肽配体”共同指具有选自SEQ ID NO:1至SEQ ID NO:20的氨基酸序列的肽,或指至少一种这样的肽。
在本发明中,AGM肽与核仁素(NCL)特异性结合。
在正常细胞中,核仁素主要存在于核仁中,但也存在于核质、细胞质或细胞膜中,并参与各种细胞功能,诸如核糖体生物合成、染色质重组和稳定、DNA和RNA代谢、rRNA转录、细胞周期调节、细胞分裂、血管生成和微小RNA加工(Dario Palmieri,et al.,Proc NatlAcad Sci USA.2015Jul28;112(30):9418-23)。
据报道,NCL的表达在各种癌细胞(甲状腺癌、乳腺癌、肺癌、胃癌、胰腺癌、前列腺癌等)中被显著上调(Shen N,et al.Oncotarget.2014;5:5494-509)以及NCL经上调的表达与恶性肿瘤和癌症转移相关。
在细胞质中过表达的NCL通过稳定抗凋亡因子诸如Bcl-2和IL2以及抑制肿瘤抑制因子诸如p53的表达而参与癌细胞的增殖和分化。在细胞膜中过表达的NCL充当生长因子诸如HDGF或VEGF的受体,通过胞吞作用移动到细胞核中,并促进癌细胞增殖和转移。细胞膜NCL介导病毒(RSV、HIV、H1N1、H3N2、H5N1和H7N9)附着或进入至宿主细胞中,并因此影响病毒的感染和增殖(Kotb Abdelmohsen and Myriam Gorospe,RNA Biology.2012;9:799-808)。
由于致癌作用和病毒感染,人类细胞异常地过表达核仁素,这些过表达的NCL以高浓度分布在细胞膜和细胞质中。因此,NCL可能成为开发抗肿瘤和抗病毒药物的新靶点。
在本发明的一种实施方式中,证实了AGM肽,特别是AGM-330不仅表现出抗癌活性,而且通过抑制病毒的增殖和复制表现出抑制病毒感染的抗病毒活性。
如本文所用,术语“抗病毒活性”或“抗病毒(功效)能力”是指抑制宿主细胞中病毒的各种亚型和突变颗粒的复制或增殖的能力。
在本发明中,抗病毒组合物包括与聚乙二醇(PEG)链缀合的AGM肽-PEG缀合物,所述聚乙二醇链在AGM肽中包括两个或更多个具有-[CH
在本发明中,聚乙二醇链不仅可以包括具有式1结构的普通聚乙二醇链,还可以包括其衍生物,并且聚乙二醇链的衍生物例如是具有式2结构的聚乙二醇羧酸,但不限于此。
与聚乙二醇(PEG)缀合(PEG化)已被广泛用于改善治疗性蛋白质的药理学性质(Gupta V,et al.J Cell Commun Signal.2019;13:319-30)。在本发明中,PEG化用于减少空间位阻以及增加亲水性。然而,由于其免疫原性,PEG对治疗分子具有负面的临床效果(Moreno A,et al.Cell Chem.Biol.2019;26:634-44.e3)。先前的研究表明,对PEG化分子的抗PEG免疫应答取决于与PEG化相对应的免疫原性和PEG的分子量(Wan X,et al.ProcessBiochem.2017;52:183-91)。
在本发明中,聚乙二醇链可以具有2至24个乙二醇单元,优选4至20个乙二醇单元,更优选6至18个乙二醇单元,最优选6至12个乙二醇单元,但不限于此。
聚乙二醇链可以通过接头连接到AGM肽。因此,AGM肽-PEG缀合物可以具有下面式1的结构,但不限于此。
AGM-L
在式1中,“PEG”代表聚乙二醇链,L
接头L
此外,在式1的AGM肽-PEG缀合物中,可以将用于缀合另一种物质,优选药物的官能团引入至与AGM结合的PEG的相对端。这种官能团的实例包括羧基(COOH)、胺(NH
例如,如式2至4中所示,在AGM肽-PEG缀合物中,具有胺(NH
AGM-L
AGM-L
AGM-L
例如,在本发明的一种实施方式中,AGM-300单体(AGMm)可以具有式5的结构,其中赖氨酸和半胱氨酸在与AGM-330结合的PEG的另一端处被引入,即AGM-330-PEG缀合物,其是AGM-300作为AGM肽与PEG的缀合物。
RHGAMVYLK-L
在式5中,PEG可以通过接头(L
在本发明中,所述组合物可以包含多聚体,所述多聚体包括两个或多个AGM肽-PEG缀合物,所述缀合物包括AGM肽-PEG缀合物。
在本发明中,多聚体可以包括2至8个AGM肽或AGM肽-PEG缀合物,优选2至6个AGM肽,或AGM肽-PEG缀合物,更优选2至4个AGM肽,或AGM肽-PEG缀合物,但不限于此。
例如,在本发明中,在多聚体中,二聚体可以具有其中两个AGM肽或AGM肽-PEG缀合物通过接头(L
例如,在本发明的一种实施方式中,根据本发明的AGM肽-PEG缀合物的二聚体和四聚体可以具有式7和式8所示的结构,但不限于此。
接头L
接头L
最优选地,接头L
此外,可以在AGM肽的一端或AGM肽-PEG缀合物的接头中引入用于缀合另一种物质,优选药物的官能团。例如,可以引入用于将药物与式7中的L
这种官能团的实例包括胺(NH
例如,在本发明的一种实施方式中,AGM-330二聚体(AGM-330d)和AGM-330四聚体(AGM-330t)可以具有下表3中所示的结构,但不限于此。
[表3]
在本发明中,组合物对选自由以下组成的组的至少一种具有抗病毒活性:冠状病毒(CoV)、流感病毒、猪流行性腹泻病毒(PEDV)、牛轮状病毒(RVA)、猪札如病毒、猪繁殖与呼吸综合征病毒、阿尔弗伊病毒(Alfuy virus)、班齐病毒(Banzi virus)、基孔肯亚病毒、登革热病毒、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人巨细胞病毒、人免疫缺陷病毒(HIV)、日本脑炎病毒、科科贝拉病毒(Kokobera virus)、昆津病毒(Kunjin virus)、基萨那森林病病毒(Kyasanur forest disease virus)、羊跳跃病病毒、麻疹病毒、偏肺病毒、花叶病毒、默里谷病毒(Murray Valley virus)、副流感病毒、脊髓灰质炎病毒、波瓦桑病毒(Powassan virus)、呼吸道合胞病毒(RSV)、罗西奥病毒(Rocio virus)、圣路易斯脑炎病毒(Saint Louis encephalitis virus)、蜱传脑炎病毒、西尼罗病毒和黄热病病毒,但不限于此。
优选地,冠状病毒是严重急性呼吸综合征冠状病毒2(SARS-CoV-2)或牛冠状病毒(BCoV),以及流感病毒是甲型流感病毒(IAV),但不限于此。
在本发明中,抗病毒组合物可以与本领域中使用的常规药物,优选抗病毒剂联合使用。
本发明的抗病毒组合物可以包括药学上可接受的载体。
药物组合物中使用的载体可以包括药学上可接受的载体、赋形剂和负载体,并且广义上指“药学上可接受的载体”。可用于本发明的药学上可接受的载体的实例包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(例如,人血清白蛋白)、缓冲物质(例如,几种磷酸盐、甘氨酸、山梨酸、山梨酸钾和饱和植物脂肪酸的偏甘油酯混合物)、水、盐或电解质(例如,硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠和锌盐)、胶态二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、基于纤维素的底物、聚乙二醇、羧甲基纤维素钠、多芳基化合物、蜡、聚乙烯-聚氧丙烯嵌段聚合物、聚乙二醇、羊毛脂等等。
本发明的组合物优选地通过口服或肠胃外来给药。肠胃外给药可以是鼻内、口腔、静脉内、肌内、动脉内、髓内、鞘内、心内、经皮、皮下、真皮内、腹膜内、肠内、局部、舌下或直肠给药,但不限于此。
优选地,该组合物可以通过口服、鼻内或口腔来给药,特别地,鼻内或肠胃外给药优选地通过喷雾或气溶胶给药,或更优选通过吸入给药,但不限于此。用于鼻内或口腔给药的药物组合物根据药学领域众所周知的技术制备,并使用苯甲醇或其它合适的防腐剂、提高生物利用度的吸收促进剂、碳氟化合物和/或本领域已知的其它增溶剂或分散剂将该药物组合物制备成盐水溶液。
在实施方式中,药物组合物也可以以无菌注射制剂的形式提供,作为无菌注射水性或油性悬浮液。可以根据本领域已知的方法,使用合适的分散剂或湿润剂(例如,吐温80)和悬浮剂来配制这种悬浮液。无菌注射制剂也可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌注射溶液或悬浮液(例如,在1,3-丁二醇中的溶液)。可接受的负载体和溶剂包括甘露醇、水、林格氏溶液和等渗氯化钠溶液。此外,通常将无菌非挥发性油用作溶剂或悬浮介质。为此,可以使用任何非挥发性油,包括合成的单甘油酯或二甘油酯。脂肪酸诸如油酸及其甘油酯衍生物可用作可注射的制剂,像是药学上可接受的天然油(例如,橄榄油或蓖麻油),尤其是其聚氧乙烯化形式。
本发明的组合物可以以任何口服可接受的制剂通过口服给药,包括但不限于胶囊、片剂和水性悬浮液和溶液。口服片剂包括作为常用载体的乳糖和玉米淀粉。通常,口服片剂还包括润滑剂诸如硬脂酸镁。胶囊制剂中用于口服给药的稀释剂包括乳糖和干玉米淀粉。当口服给药水性悬浮液时,活性成分与乳化剂和悬浮剂结合。如果需要,可以加入甜味剂和/或调味剂和/或着色剂。
本发明的组合物也可以以用于直肠给药的栓剂形式来给药。这种组合物可以通过将本发明的化合物与合适的无刺激性赋形剂混合来制备,所述无刺激性赋形剂在室温下为固体,但在直肠温度下为液体。这些物质包括但不限于可可脂、蜂蜡和聚乙二醇。
本发明的组合物可以配制成丸剂、糖衣丸、胶囊、溶液、凝胶、糖浆、浆液或悬浮液。
在优选实施方式中,用于口服给药的药物组合物可以通过将活性成分与固体赋形剂混合来制备,并且可以以颗粒的形式制备以获得片剂或糖衣丸制剂。合适的赋形剂包括糖形式诸如乳糖、蔗糖、甘露醇和山梨糖醇,来自玉米、面粉、稻、马铃薯或其它植物的淀粉,或纤维素诸如甲基纤维素、羟丙基甲基纤维素或羧甲基纤维素钠,碳水化合物诸如树胶,包括阿拉伯树胶和黄蓍胶,或蛋白质填料诸如明胶和胶原。如果需要,可以加入崩解剂或增溶剂,诸如交联聚乙烯吡咯烷酮、琼脂和海藻酸或其盐形式,例如,海藻酸钠。
另一方面,
本发明涉及一种包括AGM肽-CPP融合肽的抗病毒组合物,其中与核仁素(NCL)特异性结合的AGM肽与细胞穿透肽(CPP)融合,其中所述AGM肽包括由以下组成的组的氨基酸序列:
(a)由SEQ ID NOS:1至8中任一项表示的氨基酸序列;以及
(b)包括在由SEQ ID NO:1表示的氨基酸序列中的选自以下组的至少一个氨基酸突变的氨基酸序列:
(i)自N-末端的第五个甲硫氨酸残基的置换;
(ii)自N-末端的第七个酪氨酸残基的置换;以及
(iii)在C-末端处亮氨酸或赖氨酸残基的插入。
如本文所用,术语“细胞穿透肽(CPP)”是一种信号肽,它是用于将大分子诸如蛋白质、DNA、RNA等递送到细胞中的特定氨基酸序列的组合。迄今为止,细胞穿透肽(CPP)已被用于各种低分子量化合物、蛋白质、肽、RNA和高分子量物质诸如DNA的细胞内递送。大多数细胞穿透肽衍生于蛋白质转导结构域或膜转运序列,与外来物质进入至细胞中的一般进入途径不同,细胞穿透肽(CPP)预计在将即使已知不能穿过细胞膜的DNA或蛋白质递送到细胞中而不引起细胞膜损伤方面具有关键作用。
本发明的融合肽使用细胞穿透肽,并且细胞穿透肽不受特别限制,只要它通过胞吞作用进入细胞,并且优选选自下表4中所示的细胞穿透肽或其突变体。
[表4]
/>
更优选地,细胞穿透肽可以选自由细胞穿透肽或其变体组成的组,并且下表5中所示的肽的生产和特征参见韩国专利号1169030。最优选地,细胞穿透肽可以包括SEQ ID NO:38的氨基酸序列。
[表5]
/>
/>
在本发明的一种实施方式中,选择由表5中的DS4-3肽表示的SEQ ID NO:38的细胞穿透肽并用于进行实验,并且对于本领域技术人员来说显而易见的是,除了实际使用的细胞穿透肽之外的细胞穿透肽与本发明的肽的融合物发挥了与本发明的那些相似的效果。
在本发明中,AGM肽-PEG缀合物和细胞穿透肽可以通过接头连接。优选地,AGM肽-PEG缀合物和细胞穿透肽可以通过马来酰亚胺-羧基双功能接头连接,但不限于此。
在本发明中,包括AGM肽-CPP融合肽的抗病毒组合物的描述可以与包括AGM肽的抗病毒组合物的描述相同,并且氨基酸序列、AGM肽-PEG缀合物、多聚体和病毒类型如上所定义。
另一方面,本发明涉及一种用于预防或治疗病毒感染的药物组合物,所述药物组合物包括AGM肽、AGM肽-CPP融合肽或抗病毒组合物。
另一方面,本发明涉及一种预防或治疗病毒感染的方法,所述方法包括向受试者给药肽、融合肽或抗病毒组合物。
另一方面,本发明涉及肽、融合肽或抗病毒组合物用于预防或治疗病毒感染的用途。
另一方面,本发明涉及肽、融合肽或抗病毒组合物在制备用于预防或治疗病毒感染的药物中的用途。
在本发明中,由于药物组合物、方法、用途以及应用包括根据本发明的AGM肽、AGM肽-CPP融合肽或抗病毒组合物,因此将不再再次描述所述AGM肽、AGM肽-CPP融合肽或抗病毒组合物的细节。
如本文所用,术语“预防”是指通过给药AGM肽、AGM肽-CPP融合肽或抗病毒组合物来抑制病毒感染或延缓其进展的任何行动。如本文所用,术语“治疗”是指通过给药AGM肽、AGM肽-CPP融合肽或抗病毒组合物来改善或完全治愈病毒感染的症状的任何行动。
根据本发明的用于预防或治疗病毒感染的组合物可以包括药学有效量的AGM肽、AGM肽-CPP融合肽或单独的抗病毒组合物,或者还可以包括一种或多种药学上可接受的载体、赋形剂或稀释剂。表述“药学有效量”是指足以预防、改善和治疗病毒感染症状的量。
此外,本文使用的术语“药学上可接受的”是指一种组合物是生理上可接受的,并且当给药于人时,通常不会引起过敏反应诸如胃肠疾患和头晕或类似反应。药物组合物中所包含的载体、赋形剂或稀释剂的具体实例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯树胶(acacia rubber)、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁、矿物油等等。此外,还可以包括填充剂、抗凝剂、润滑剂、湿润剂、调味剂、乳化剂和防腐剂。合适的药学上可接受的载体和试剂在Remington's PharmaceuticalSciences(19th ed.,1995)有详细的描述。
此外,本发明的药物组合物可以包括一种或多种已知的对病毒感染具有治疗作用的活性成分,以及AGM肽、AGM肽-CPP融合肽或抗病毒组合物。
可以使用本领域已知的方法配制本发明的组合物,以在给药于哺乳动物后提供活性成分的快速、持续或延迟释放。该制剂可以是呈粉末、颗粒、片剂、乳剂、糖浆、气溶胶、软或硬明胶胶囊、无菌注射溶液或无菌粉末的形式。
根据本发明的组合物可以通过各种给药途径中的任何一种来给药,所述给药途径包括口服、经皮、皮下、静脉内或肌内给药,活性成分的剂量可以根据各种因素适当选择,诸如给药途径、患者的年龄、性别和体重以及患者疾病的严重程度,并且根据本发明的用于预防或治疗病毒感染的组合物可以与具有预防、改善或治疗病毒感染症状的效果的已知化合物联合给药。
在本发明中,病毒感染可以由表现出抗病毒活性的抗病毒组合物所针对的病毒引起,其非限制性实例包括伤风、流感(流行性感冒)、传染性单核细胞增多症、巨细胞病毒感染、麻疹、脊髓灰质炎、黄热病、登革热、乙型肝炎、丙型肝炎、AIDS和Covid-19。
另一方面,本发明涉及一种用于预防或改善病毒感染的健康功能性食品组合物,其包括AGM肽、AGM肽-CPP融合肽或抗病毒组合物。
本发明的功能性食品可用于各种应用,诸如药物、食品和饮料用于防止氧化。本发明的功能性食品的实例包括各种食品、糖果、巧克力、饮料、口香糖、茶、维生素复合物、健康补充剂等,并且可以以粉末、颗粒、片剂、胶囊或饮料的形式使用。
可以将本发明的抗病毒组合物添加到食物或饮料中以预防或改善病毒感染。在这种情况下,本发明的健康功能性食品组合物通常以食品总重量的按重量计0.01至50%,优选按重量计0.1至20%的量添加,并且健康饮料组合物基于100ml的食品总重量以0.02至10g,优选0.3至1g的量添加。
本发明的健康饮料组合物对液体成分没有特别的限制,除了它包含指定量的提取物作为基本成分,并且像常规饮料一样可以包含各种风味剂或天然碳水化合物作为附加成分。天然碳水化合物的实例包括单糖诸如葡萄糖和果糖,二糖诸如麦芽糖和蔗糖,多糖,例如,普通糖诸如糊精和环糊精,以及糖醇诸如木糖醇、山梨糖醇和赤藓糖醇。除了上面提到的那些之外,有用的调味剂包括天然调味剂(奇异果甜蛋白和甜菊提取物诸如莱鲍迪甙A(rebaudioside A)和甘草甜素(glycyrrhizin))和合成调味剂(诸如糖精和阿斯巴甜)。天然碳水化合物的量通常为每100ml的本发明组合物约1至20g,优选约5至12g。
本发明的组合物可以包括各种营养物、维生素、电解质、调味剂诸如合成调味剂和天然调味剂、着色剂和填料(诸如芝士和巧克力)、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体增稠剂、pH调节剂、稳定剂、防腐剂、甘油、醇和碳酸饮料中使用的碳酸盐。此外,本发明的组合物可以包括用于生产天然果汁、果汁饮料和蔬菜饮料的果肉。这些成分可以单独使用或组合使用。这些添加剂的含量通常选择在每100重量份的本发明组合物0至约20重量份的范围内,尽管这并不重要。
在本发明中,由于健康功能性食品组合物包括根据本发明的AGM肽、AGM肽-CPP融合肽或抗病毒组合物,因此将不再再次描述所述AGM肽、AGM肽-CPP融合肽或抗病毒组合物的细节。
在下文中,将参考实施例更详细地描述本发明。然而,对于本领域技术人员来说,显然这些实施例仅用于说明本发明,而不应被解释为限制本发明的范围。
实施例1:材料和方法
实施例1-1:OBOC库合成
OBOC库在固相TentaGel MB NH
实施例1-2:伦理学与细胞培养
所有与人体组织相关的研究都经过了光州科学技术研究所研究伦理审查委员会(the Research Ethics Review Board(IRB)of the Gwangju Institute of Science andTechnology)(IRB)的预先批准(#20191008-BR-48-03-02)。所有动物实验均按照光州科学技术研究所机构动物护理和使用委员会(the guidelines of the Institutional AnimalCare and Use Committee(IACUC)of the Gwangju Institute of Science andTechnology)(IACUC)的指南(GIST-2019-040)进行。所有培养物都于保持在37℃、95%空气/5%CO
实施例1-3:癌症特异性配体的OBOC库筛选
在筛选之前,将珠粒用双蒸水和磷酸盐缓冲盐水(PBS;Welgene Inc.,大韩民国)充分洗涤。使用胰蛋白酶/EDTA(Gibco)从培养皿中分离癌细胞和正常细胞,并用相应的培养基洗涤。将细胞以10
实施例1-4:血清稳定性试验
使用预热的100%人血清(Sigma-Aldrich)将肽储备溶液(100μM)稀释10倍,并在37℃下孵育0、3、6、9和24小时。PBS中的肽用作对照。血清蛋白用终浓度为3M的尿素在4℃下变性10分钟,用终浓度为7%(v/v)的三氯乙酸沉淀(4℃下10分钟),并且然后离心(17,000×g,10分钟)以终止反应。回收每个样品的上清液,分析柱以1ml/min的流量运行25分钟,同时使用在溶剂B(在溶剂A(在H2O中的0.05%(v/v)TFA)中的乙腈90%(v/v)与0.045%(v/v)TFA)在215nm处进行监测。从时间0开始用PBS样品观察每个肽的洗脱曲线。通过比较在时间点0处获得的肽峰的高度和在每个时间点获得的肽峰的高度,确定保留在血清处理的样品中的肽的百分比。每个实验一式三份进行。
实施例1-5:生物素下拉实验
将细胞裂解物(500μg/ml)与生物素化的AGM-330(500ng/ml)在4℃下孵育12小时,然后在室温下将链霉亲和素珠粒(Thermo Fisher Scientific,罗克福德(Rockford),IL)下拉1小时。孵育后,用洗涤缓冲液洗涤珠粒3次。向珠粒中加入洗脱缓冲液,从珠粒中提取蛋白质,以及最后通过SDS-PAGE分析。LC-偶联的ESI-MS/MS分析由ProteomeTech(首尔,韩国)进行,以鉴定和表征生物素下拉实验产生的蛋白质。
实施例1-6:AGM-330结合域的鉴定
包括GFP-NCL(残基1-710)、GFP-ΔN-NCL(残基322-710)和GFP-ΔC-NCL(残基1-321)的NCL构建体由人NCL cDNA克隆(Addgene)产生,并亚克隆到pEGFP-C2载体(Addgene)的XhoI和BamHI位点。按照制造商的建议,用Lipofectamine 2000(Invitrogen,卡尔斯巴德(Carlsbad),CA,USA)转染这些载体。将生物素化的AGM-330肽加入到链霉亲和素珠粒(Thermo Fisher Scientific),将混合物在室温下振荡孵育1小时。用洗涤缓冲液洗涤珠粒3次。洗涤后,将珠粒加入到从包含GFP标记的NCL蛋白的转染细胞裂解物制备的裂解物(300μl)中。将反应混合物在4℃下孵育12小时以使AGM-330与GFP标记的NCL蛋白结合。然后,用洗涤缓冲液洗涤珠粒。向珠粒中加入等体积的2X电泳样品缓冲液,并在95℃下加热5分钟以从珠粒中提取蛋白质。最后通过SDS-PAGE和免疫印迹分析对蛋白质进行分析。
实施例1-7:对来自Jurkat细胞的NCL的纯化
在25ml的20mM Tris/HCl、pH 7.5、150mM NaCl、5mM的MgCl
实施例1-8:结合亲和力
通过表面等离子体共振(SPR)光谱(Biacore T-200)测试AGM-330的结合亲和力。将重组核仁素蛋白固定在CM5传感器芯片上,并用各个浓度(20nM-2.5μM)的AGM-330处理,分析其感测图,并测定K
实施例1-9:统计学分析
所有统计学数据均表示为平均值±SD(n=3)。两组之间的统计学比较由学生t检验确定,多个组之间的比较由具有Dunnett多重比较的单向ANOVA确定。对于体内实验,小鼠的数量在每个图例中标明。对数秩检验用于卡普兰一梅尔(Kaplan-Meier)分析。*、**和***分别表示P<0.05、P<0.01和P<0.001。
实施例2:通过OBOC组合筛选以及MAP合成对癌症靶向肽配体的鉴定和表征
为了鉴定新型癌症特异性肽配体,使用5g的Tentagel MB NH
目前,由于肽的低稳定性:肽在体内主要被蛋白酶和肽酶降解,肽作为治疗剂的用途受到很大限制(Bottger R,et al.PLoS One.2017;12:e0178943)。在本发明中,为了提高肽配体的稳定性,合成了呈MAP树枝状聚合物形式的AGM-330,由于获得了对蛋白酶和肽酶活性的抗性,AGM-330可以表现出增加的稳定性。在20%哌啶和DMF存在下,通过Fmoc-Cys(Trt)Wang树脂(1)和Fmoc-Lys(Fmoc)-OH引发AGM-330的合成(图4E)以产生赖氨酸核心缀合的Wang树脂(2,3)。然后,在20%哌啶的存在下,通过用RHGAMVYLK-PEG12-OH处理生成Fmoc保护的和Trt保护的AGM-330(4)。使用在DMF中的哌啶快速去除AGM-330(4)的Fmoc保护基和Trt保护基团以制备AGM-330(5)。
为了增强所选肽配体AGM-330的体内稳定性和结合亲和力,通过多抗原肽(MAP)合成将其合成为二聚体和四聚体。
为了确定肽的稳定性是否得到增强,分析了肽的体内半衰期。经由C57BL/6小鼠的尾静脉注射2mg/kg的AGM-330m、AGM-330d或AGM-330t,并将剩余的血清肽立即固定在具有抗AGM-330抗体的ELISA板上。使用Versa Max ELISA板读数器(Molecular Devices)在450nm波长处测量吸光度,并使用phoenix WinNonlin 8.1(Pharsight Corporation,山景城(Mountain View),CA,USA)程序分析药代动力学。分析结果表明,AGM-330m、AGM-330d和AGM-330t的半衰期(T
然后,为了确定MAP配体是否选择性地与癌细胞结合,将用FITC标记的AGM-330(AGM-330-FITC)处理的癌细胞与未处理的细胞进行比较。AGM-330-FITC与细胞(1X10
实施例3:NCL,作为AGM-330的潜在靶点的癌细胞生长的有效调节剂
为了鉴定AGM-330的未知靶蛋白,使用亲和柱色谱和基于质谱的蛋白质组学方法从MDA-MB-231细胞的细胞裂解物中鉴定AGM-330相互作用蛋白(图6的A)。亲和柱色谱后,SDS-PAGE分析显示出仅存在于洗脱级分中的几个不同的蛋白条带(55-100kDa)(图6B)。使用LC-MS/MS分析鉴定了六种蛋白质,以及通过对这些切除条带的肽的鉴定显示出,100kDa处的主要蛋白质条带之一被表征为核仁素(NCL)。NCL由710个氨基酸组成,并且通过LC-MS/MS分析鉴定的22个其他肽片段对应于NCL的氨基酸序列(对于NCBI数据库中人NCL(登录号:gi189306),总分881和24%序列覆盖率)(图6C以及图6D)。此外,使用抗NCL抗体的免疫印迹分析进一步示出了来自AGM-330亲和柱的洗脱液中NCL的富集(图6E)。因此,蛋白质组学研究表明NCL是一种AGM-330相互作用蛋白。
为了确定AGM-330对NCL的结合亲和力,使用AGM-330进行表面等离子体共振(SPR)测试。如图7中所示,K
生物素下拉实验用于确定AGM-330和NCL之间相互作用中涉及的结构域。使用生物素化的AGM-330(AGM-330-生物素)作为诱饵(bait),将NCL突变体拉下来。已经产生了几个NCL的缺失突变体。从用表达载体转染的HEK293T细胞制备细胞提取物,所述表达载体编码野生型和各种NCL突变体,NCL1(1-710)、NCL2(323-710)和NCL3(1-322),它们都与GFP融合。AGM-330-生物素拉下了野生型NCL1(1-710)和NCL3(1-322),但是NCL2(323-710)没有拉下它们(图6F)。这些结果表明NCL的N-末端区域(1-322)对于AGM-330的结合是重要的。为了进一步确定AGM-330和NCL之间的直接相互作用,将纯化的NCL和AGM-330-生物素用于生物素下拉实验。使用抗NCL抗体通过免疫印迹分析证实了洗脱级分中NCL的富集(图8)。总的来说,AGM-330直接与NCL相互作用。
实施例4:AGM-330与CPP融合的融合肽的合成
为了增加AGM-330的细胞渗透性,将细胞穿透肽(CPP)与AGM-330融合以制备融合肽。
当AGM-330t与马来酰亚胺结合的CPP(RIMRILILKLAR;SEQ ID NO:38)在7.0至7.5的pH下反应时,通过硫醇基-马来酰亚胺反应与硫醇基(AGM-330t的官能团)融合来合成AGM-330t-mCPP融合肽(图9)。
所制备的AGM-330t-mCPP融合肽的HPLC和MS分析结果显示保留时间为23.2分钟,分子量为7,876Da。AGM-330t和马来酰亚胺-mCPP的分析结果如图10中所示。
实施例5:通过体外实验证实AGM-330对甲型流感病毒(IAV)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对甲型流感病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合生长的A549细胞(肺癌细胞系,美国典型培养物保藏中心[ATCC])的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次,并弃去洗涤溶液。然后,用甲型流感病毒(IAV,波多黎各(Puerto Rico)/8(PR8)(H1N1),ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度化合物、1μg/mL的TPCK(N-甲苯磺酰基-L-苯丙氨酸氯甲基酮)处理的胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育24小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对甲型流感病毒PB1抗原的兔多克隆一抗和HRP缀合的山羊抗兔IgG二抗进行蛋白质印迹。此外,为了测量被AGM-380d-mCPP和AGM-380t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的小鼠单克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图11A)。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对甲型流感病毒增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合生长的A549细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用甲型流感病毒(IAV,波多黎各/8(PR8)(H1N1),ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度化合物、1μg/mL的TPCK(N-甲苯磺酰基-L-苯丙氨酸氯甲基酮)处理的胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育8小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对甲型流感病毒M2抗原的小鼠单克隆一抗加入到每个室中,并在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor 594缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,用包含DAPI的SlowFade金抗荧光衰减溶液(antifade solution)密封每个载玻片以使细胞核染色,并用LSM 800共聚焦显微镜观察(图11B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对甲型流感病毒增殖的抑制引起的病毒基因组的数量的减少。首先,将包含汇合生长的A549细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用甲型流感病毒(IAV,波多黎各/8(PR8)(H1N1),ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、1μg/mL的TPCK(N-甲苯磺酰基-L-苯丙氨酸氯甲基酮)处理的胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中孵育24小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP引起的甲型流感病毒子代病毒的产生减少。首先,将包含汇合生长的A549细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用甲型流感病毒(IAV,波多黎各/8(PR8)(H1N1),ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的TPCK(N-甲苯磺酰基-L-苯丙氨酸氯甲基酮)处理的胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中孵育8小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,以及将上清液连续稀释10x,并且然后接种在包含汇合生长的A549细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对甲型流感病毒核蛋白(NP)的小鼠单克隆一抗加入到每个孔中,并在4℃下反应12小时。用磷酸盐-缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与Alexa Fluor 488缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,用倒置荧光显微镜计数阳性细胞的数量(图11D)。
结果,病毒蛋白质(PB1)的量、细胞内病毒抗原(M2)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图11)。因此,证实了NCL靶向的肽配体抑制了甲型流感病毒感染。
实施例6:通过体外实验证实AGM-330对牛冠状病毒(BCoV)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛冠状病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合地生长的HRT-18G细胞(人直肠腺癌细胞系,ATCC)的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次,并弃去洗涤溶液。然后,用牛冠状病毒(BCoV,KWD20株,ATCC)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度的化合物、5μg/mL的猪胰酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育36小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对牛冠状病毒刺突(S)抗原的小鼠单克隆一抗和HRP缀合的山羊抗小鼠IgG二抗进行蛋白质印迹。此外,为了测量被AGM-330d-mCPP和AGM-330t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的小鼠单克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图12的(A))。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛冠状病毒增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合生长的HRT-18G细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用牛冠状病毒(BCoV,KWD20株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、5μg/mL的猪胰酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育24小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对牛冠状病毒刺突(S)抗原的小鼠单克隆一抗加入每个室中,并允许在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor594缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并用包含DAPI的SlowFade金抗荧光衰减溶液密封每个载玻片以使细胞核染色,然后用LSM 800共聚焦显微镜观察(图12B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛冠状病毒增殖的抑制引起的病毒基因组的数量的减少。首先,将包含汇合生长的HRT-18G细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用牛冠状病毒(BCoV,KWD20株,ATCC)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、5μg/mL的猪胰酶、1%青霉素和1%链霉素的保藏培养基中孵育24小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP引起的牛冠状病毒子代病毒的产生减少。首先,将包含汇合生长的HRT-18G细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用牛冠状病毒(BCoV,KWD20株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、5μg/mL的猪胰酶、1%青霉素和1%链霉素的保藏培养基中孵育8小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,以及将上清液连续稀释10x,并且然后接种在包含汇合生长的HRT-18G细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对牛冠状病毒刺突(S)抗原的小鼠单克隆一抗加入到每个孔中,并在4℃下反应12小时。用磷酸盐-缓冲盐水(pH7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与Alexa Fluor 488缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,用倒置荧光显微镜计数阳性细胞的数量(图12D)。
结果,病毒蛋白(S)的量、细胞内病毒抗原(S)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图12)。因此,证实了NCL靶向的肽配体抑制了牛冠状病毒感染。
实施例7:通过体外实验证实AGM-330对猪流行性腹泻病毒(PEDV)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪流行性腹泻病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合地生长的Vero E6细胞(非洲绿猴肾上皮细胞系,ATCC)的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次,并弃去洗涤溶液。然后,用猪流行性腹泻病毒(PEDV,QIAP1401,来自韩国动植物检疫局(the Animal and Plant Quarantine Agency)的善意赠送)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度的化合物、3μg/mL的猪胰腺胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育36小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对猪流行性腹泻病毒核衣壳(N)抗原的小鼠单克隆一抗和HRP缀合的山羊抗小鼠IgG二抗进行蛋白质印迹。此外,为了测量被AGM-330d-mCPP和AGM-330t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的小鼠单克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图13A)。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪流行性腹泻病毒增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合地生长的Vero E6细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪流行性腹泻病毒(PEDV,QIAP1401,来自韩国动植物检疫局的善意赠送)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、3μg/mL的猪胰腺胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育24小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对猪流行性腹泻病毒核衣壳(N)抗原的小鼠单克隆一抗加入每个室中,并允许在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor 594缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,用包含DAPI的SlowFade金抗荧光衰减溶液密封每个载玻片以使细胞核染色,并用LSM 800共聚焦显微镜观察(图13B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪流行性腹泻病毒增殖的抑制引起的病毒基因组的数量的减少。首先,将包含汇合地生长的Vero E6细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用猪流行性腹泻病毒(PEDV,QIAP1401,来自韩国动植物检疫局的善意赠送)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、3μg/mL的猪胰腺胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中孵育36小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP引起的猪流行性腹泻病毒子代病毒的产生减少。首先,将包含汇合地生长的Vero E6细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪流行性腹泻病毒(PEDV,QIAP1401,来自韩国动植物检疫局的善意赠送)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、3μg/mL的猪胰腺胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中孵育18小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,以及将上清液连续稀释10x,并且然后接种在包含汇合生长的HRT-18G细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对猪流行性腹泻病毒核衣壳(N)抗原的小鼠单克隆一抗加入每个孔中,并在4℃下反应12小时。用磷酸盐-缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与Alexa Fluor 488缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,用倒置荧光显微镜计数阳性细胞的数量(图13D)。
结果,病毒蛋白质(N)的量、细胞内病毒抗原(N)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图13)。因此,证实了NCL靶向的肽配体抑制了PEDV感染。
实施例8:通过体外实验证实AGM-330对牛轮状病毒(RVA)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛轮状病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合地生长的MA104细胞(非洲绿猴肾上皮细胞系,ATCC)的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次并弃去洗涤溶液。然后,用10μg/mL的经结晶胰蛋白酶激活的牛甲型轮状病毒(RVA,NCDV株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育12小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对甲型轮状病毒VP6抗原的小鼠单克隆一抗和HRP缀合的山羊抗小鼠IgG二抗进行蛋白质印迹。此外,为了测量被AGM-330d-mCPP和AGM-330t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的小鼠单克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图14的(A))。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛轮状病毒增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合生长的MA104细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用10μg/mL的经结晶胰蛋白酶激活的牛A型轮状病毒(RVA,NCDV株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育8小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对甲型轮状病毒VP6抗原的小鼠单克隆一抗加入每个室中,并在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor 594缀合的山羊抗小鼠IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并用包含DAPI的SlowFade金抗荧光衰减溶液密封每个载玻片以使细胞核染色,并用LSM 800共聚焦显微镜观察(图14B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对牛轮状病毒增殖的抑制引起的病毒基因组的数量的减少。首先,将包含汇合生长的MA104细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用10μg/mL的结晶胰蛋白酶激活的牛A型轮状病毒(RVA,NCDV株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育12小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测AGM-330d-mCPP和AGM-330t-mCPP引起的牛轮状病毒子代病毒的产生减少。首先,将包含汇合生长的MA104细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用10μg/mL的结晶胰蛋白酶激活的牛A型轮状病毒(RVA,NCDV株,ATCC)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育8小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,以及将上清液连续稀释10x,并且然后接种在包含汇合生长的MA104细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个孔用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对甲型轮状病毒VP6抗原的山羊多克隆一抗加入每个孔中,并在4℃下反应8小时。用磷酸盐-缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与异硫氰酸荧光素(FITC)缀合的兔抗山羊IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,用倒置荧光显微镜计数阳性细胞的数量(图14D)。
结果,病毒蛋白质(VP6)的量、细胞内病毒抗原(VP6)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图14)。因此,证实了NCL靶向的肽配体抑制了牛轮状病毒感染。
实施例9:通过体外实验证实AGM-330对猪繁殖和呼吸综合征病毒(PRRSV)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪繁殖和呼吸综合征病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合地生长的MARC-145细胞(非洲绿猴肾上皮细胞系,ATCC)的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次并弃去洗涤溶液。然后,用猪繁殖和呼吸综合征病毒(PRRSV,LMY株,韩国动植物检疫局的善意赠送)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育36小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对猪繁殖和呼吸综合征病毒膜(M)抗原的兔多克隆一抗和HRP缀合的山羊抗兔IgG二抗进行蛋白质印迹。此外,为了测量被AGM-330d-mCPP和AGM-330t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的兔多克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图15A)。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪繁殖和呼吸综合征病毒增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合生长的MARC-145细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪繁殖和呼吸综合征病毒(PRRSV,LMY株,韩国动植物检疫局的善意的礼物)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育16小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对猪繁殖与呼吸综合征病毒膜(M)抗原的兔多克隆一抗加入每个室中,并在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor 594缀合的山羊抗兔IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH7.4)洗涤每个室三次,弃去洗涤溶液,并用包含DAPI的SlowFade金抗荧光衰减溶液密封每个载玻片以使细胞核染色,并用LSM 800共聚焦显微镜观察(图15B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪繁殖与呼吸综合征病毒增殖的抑制引起的病毒基因组的数量的减少。首先,将包含汇合生长的MARC-145细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用猪繁殖和呼吸综合征病毒(PRRSV,LMY株,韩国动植物检疫局的善意赠送)以0.1MOIFFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育36小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP引起的PRRSV病毒子代病毒的产生减少。首先,将包含汇合生长的MARC-145细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪繁殖和呼吸综合征病毒(PRRSV,LMY株,韩国动植物检疫局的善意赠送)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、1μg/mL的结晶胰蛋白酶、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育16小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,以及将上清液连续稀释10x,并且然后接种在包含汇合生长的MARC-145细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个孔用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对PRRSV M抗原的兔多克隆一抗加入每个孔中,并在4℃下反应8小时。用磷酸盐-缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与Alexa Fluor 488缀合的山羊抗兔IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,以及用倒置荧光显微镜计数阳性细胞的数量(图15D)。
结果,病毒蛋白质(M)的量、细胞内病毒抗原(M)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图15)。因此,证实了NCL靶向的肽配体抑制了猪繁殖和呼吸综合征病毒。
实施例10:通过体外实验证实AGM-330对猪札如病毒(PSaV)的抑制作用
进行蛋白质印迹分析以检测由AGM-330d-mCPP和AGM-330t-mCPP对猪札如病毒增殖的抑制引起的病毒抗原含量的减少。首先,将包含汇合地生长的LLC-PK细胞(猪肾上皮细胞系,ATCC)的12孔板的每个孔用DPBS(dul becco’s磷酸盐缓冲盐水)洗涤两次并弃去洗涤溶液。然后,用猪札如病毒(PSaV,Cowden株,来自Dr.K.O.Chang的善意赠送,堪萨斯州,USA)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞再次用DPBS洗涤两次,并在包含预定浓度的化合物、200μMGCDCA(甘氨鹅脱氧胆酸)、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育24小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并使用针对PSaV VPg抗原的兔多克隆一抗和HRP缀合的山羊抗兔IgG二抗进行蛋白质印迹。此外,为了测量被AGM-330d-mCPP和AGM-330t-mCPP减少的病毒抗原的量,使用HRP缀合的山羊抗小鼠IgG二抗和针对宿主蛋白的兔多克隆一抗,GAPDH(甘油醛3-磷酸脱氢酶),进行蛋白质印迹(图16A)。
进行免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP对PSaV增殖的抑制引起的细胞质中病毒抗原量的减少。首先,将包含汇合地生长的LLC-PK细胞的8孔室载玻片的每个室用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪札如病毒(PSaV,Cowden株,来自Dr.K.O.Chang的善意赠送,堪萨斯州,USA)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、200μM GCDCA(甘氨鹅脱氧胆酸)、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育16小时。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个室中,并在20℃下固定10分钟。为了提高细胞渗透性,每个室用0.2%Triton-X在20℃下处理10分钟。然后,用DPBS洗涤每个孔两次,并弃去洗涤溶液。然后,将针对PSaV VPg抗原的兔多克隆一抗加入每个室中,并在4℃下静置12小时。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个室中加入与Alexa Fluor 594缀合的山羊抗兔IgG二抗的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,用包含DAPI的SlowFade金抗荧光衰减溶液密封每个载玻片以使细胞核染色,并用LSM 800共聚焦显微镜观察(图16B)。
进行实时PCR以检测由AGM-330d-mCPP和AGM-330t-mCPP对PSaV增殖的抑制引起的病毒基因组的数量的减少。首先,将包含LLC-PK细胞的12孔板的每个孔用DPBS(Dulbecco磷酸盐缓冲盐水)洗涤两次,以及然后弃去洗涤溶液。然后,用猪札如病毒(PSaV,Cowden株,来自Dr.K.O.Chang的善意赠送,堪萨斯州,USA)以0.1MOI FFU/mL接种细胞,并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定量的化合物、200μM GCDCA(甘氨鹅脱氧胆酸)、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育24小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,然后使用RNeasy mini试剂盒(Qiagen)提取RNA。使用包含随机六聚体和poly(rA)-oligo(dT)的TOPscript
进行细胞培养免疫荧光测定以检测由AGM-330d-mCPP和AGM-330t-mCPP引起的PsaV子代病毒的产生减少。首先,将包含汇合地生长的LLC-PK细胞的12孔板的每个孔用DPBS洗涤两次,并弃去洗涤溶液。然后,用猪札如病毒(PSaV,Cowden株,来自Dr.K.O.Chang的善意赠送,堪萨斯州,USA)以0.1MOI FFU/mL接种细胞并孵育(吸附)1小时。病毒吸附后,将细胞用DPBS洗涤两次,并在包含预定浓度的化合物、200μM GCDCA(甘氨鹅脱氧胆酸)、1%青霉素和1%链霉素的保藏培养基中于36℃下孵育16小时。然后,将每个板冷冻和解冻三次,以将细胞从每个孔脱离,并且将上清液连续稀释10x,以及然后接种在包含汇合生长的LLC-PK细胞的96孔板的每个孔中。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。将4%多聚甲醛固定剂加入每个孔中,并在20℃下固定10分钟。为了提高细胞渗透性,每个孔用0.2%Triton-X在20℃下处理10分钟。然后,用磷酸盐缓冲盐水(pH 7.4)洗涤每个孔两次,并弃去洗涤溶液。然后,将针对PSaV VPg抗原的兔多克隆一抗加入每个孔中,并允许在4℃下反应8小时。用磷酸盐-缓冲盐水(pH 7.4)洗涤每个室三次,弃去洗涤溶液,并向每个孔中加入与Alexa Fluor 488缀合的山羊抗兔IgG多克隆抗体的稀释液,然后在20℃下孵育1小时。用磷酸盐缓冲盐水(pH 7.8)洗涤每个孔三次,并弃去洗涤溶液,用碘化丙啶染色细胞核并用甘油密封,并且用倒置荧光显微镜计数阳性细胞的数量(图16D)。
结果,病毒蛋白质(VPg)的量、细胞内病毒抗原(VPg)的量、病毒基因组的数量和病毒子代的数量的减少依赖于处理的NCL靶肽配体的浓度(图16)。因此,证实了NCL靶向的肽配体抑制了猪札如病毒感染。
实施例11:通过体外实验证实AGM-330的CC
为了确定AGM-330的半数最大细胞毒性浓度(CC
[表6]
由不同细胞系中的细胞NAD(P)H-依赖性细胞氧化还原酶测定法(MTT测定法)确定的AGM-380d-mCPP和AGM-380t-mCPP的半数最大细胞毒性浓度(CC
为了确定AGM-330对每种病毒的半数最大抑制浓度(IC
[表7]
AGM-380d-mCPP和AGM-380t-mCPP对6种RNA病毒的半数最大抑制浓度(IC
结果表明,NCL靶向的肽配体(AGM-330d-mCPP、AGM-330t-mCPP)即使在10μM的高浓度下也没有表现出显著的细胞毒性,并且即使在低浓度下也抑制了甲型流感病毒、牛冠状病毒、猪流行性腹泻病毒、牛轮状病毒、猪繁殖和呼吸综合征病毒和猪札如病毒的感染(图17)。
实施例12:通过体外实验证实AGM-330对SARS-CoV-2的抑制作用
为了确定AGM-330的半数最大细胞毒性浓度(CC
为了测定AGM-330对SARS-CoV-2的半数最大抑制浓度(IC
[表8]
结果表明,与用作阳性对照的常规药物相比,NCL靶向的肽配体表现出增加的IC
结果表明,NCL靶向的肽配体抑制了SAR-CoV-2感染。
实施例13:用仓鼠Corona 19感染的模型评估AGM-330的抗病毒效果
通过鼻内冲洗用SARS-CoV-2(2x10
将NCL靶向的肽配体AGM-330d-mCPP(AGM-380D)(0.2、2、6mg/kg)以间隔12小时腹膜内给药于感染的仓鼠动物模型八次,持续四天。感染后5天观察死亡率和全身症状。结果表明,在试验期间没有动物死亡,也没有观察到与试验物质相关的临床异常。在感染当天、感染后第二天和感染后第四天测量体重。结果表明,除正常对照组(NC)外,试验组和病毒对照组(VC)的体重均下降。在病毒对照组和试验组之间没有观察到显著的体重变化(图19)。
感染后第四天进行尸体解剖。结果表明,在除正常对照组之外,试验组和病毒对照组的肺中检测到包括由病毒感染引起的充血/出血和水肿的肉眼可见的变化。与病毒对照组相比,在给药AGM-330d-mCPP(6mg/kg)的组中,肉眼可见的变化显著减轻(图20至25)。
在对肺进行组织病理学观察时,观察到发现诸如由于病毒感染、出血和肺透明膜形成导致的肺泡腔和间质组织中的炎性细胞浸润(表9)。与病毒对照组相比,给药AGM-330d-mCPP(6mg/kg)的组中的组织病理学损伤显著减少(图26)。
[表9]
肺部组织病理学发现的发生率和严重程度(AGM-1:AGM-380D 0.2mg/kg,AGM-2:AGM-380D 2mg/kg,AGM-3:AGM-380D 6mg/kg)
/>
实施例14:AGM-330对甲型流感病毒的体内抗病毒效果的证实
通过鼻内给药(1x10
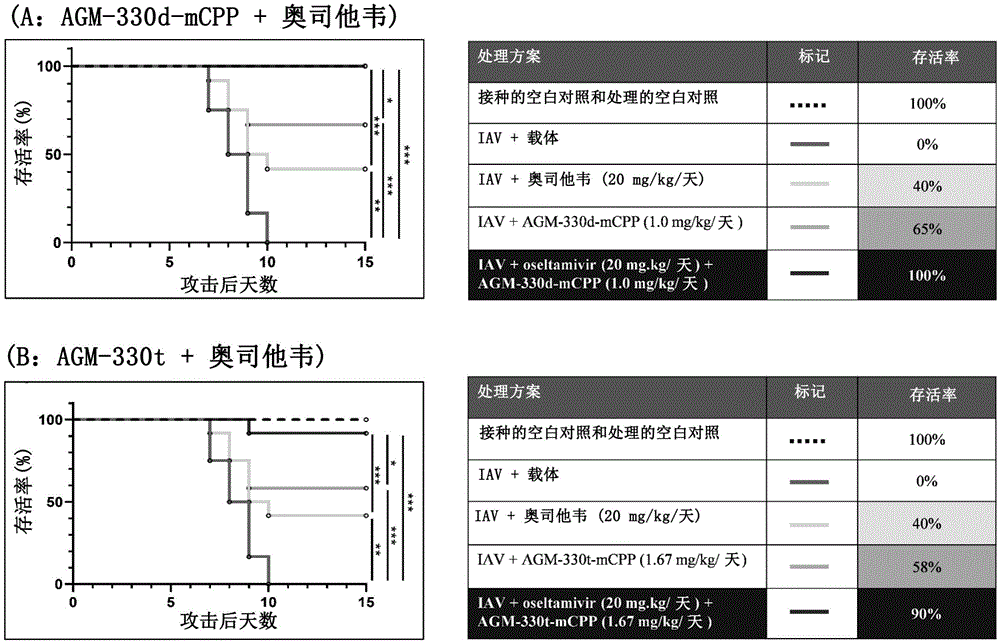
实施例15:AGM-330和奥司他韦联合给药对甲型流感病毒的体内抗病毒效果的证实
在用甲型流感病毒(1x10
实施例16:AGM-330对甲型流感病毒复制的体内抑制作用的证实
在实施例14中,在感染后天数(DPI)为4和6时,在NCL靶向的肽配体试验组的小鼠的肺组织中测量PB1 mRNA和蛋白质表达水平以及病毒滴度。
结果表明,PB1的mRNA和蛋白表达水平分别在DPI为4和6处显著降低。此外,检测病毒滴度的结果表明,NCL靶向的肽抑制了甲型流感病毒感染,并且病毒数量显著减少。该结果意味着由于NCL靶向的肽配体,病毒的数量减少,并且该结果与实施例14的存活率相关(图29)。
工业实用性
本发明证明了使用MAP合成和OBOC组合筛选的AGM肽配体及其突变体抑制了病毒的增殖和复制(体外和体内)。因此,NCL靶向的AGM可用于抗病毒活性。
尽管已经详细描述了本发明的具体配置,但是本领域的技术人员将会理解,提供该描述是为了说明的目的而阐述优选实施方式,并且不应该被解释为限制本发明的范围。因此,本发明的实质范围由所附权利要求及其等同物来限定。
序列表自由文本
附上电子文件。
<110> 安尼根有限公司(ANYGEN CO., LTD.)
<120> 包括核仁素结合肽的抗病毒组合物
<130> PP-B2765
<150> KR 2021-0064140
<151> 2021/5/18
<160> 82
<170> 3.0
<210> 1
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 1
Arg His Gly Ala Met Val Tyr Leu Lys
1 5
<210> 2
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-331
<400> 2
Ala Asp His Arg His Arg Arg Ser Gly
1 5
<210> 3
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-332
<400> 3
Ala Val Ala Arg Ala Arg Arg Arg Arg
1 5
<210> 4
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-333
<400> 4
Arg Phe Leu Lys Asn Lys Lys Ala Arg
1 5
<210> 5
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-334
<400> 5
Arg Trp Leu Lys Asn Lys Lys Ala Arg
1 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-335
<400> 6
Phe Gly Arg Leu Lys Lys Pro Leu Lys
1 5
<210> 7
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-336
<400> 7
Lys Arg Arg Arg Arg Glu Arg Ala Gly
1 5
<210> 8
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-337
<400> 8
Lys Arg Arg Arg Lys Ala Pro Thr Asp
1 5
<210> 9
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 9
Lys His Gly Ala Met Val Tyr Leu Lys
1 5
<210> 10
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 10
Arg Arg Gly Ala Met Val Tyr Leu Lys
1 5
<210> 11
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 11
Arg His Gly Leu Met Val Tyr Leu Lys
1 5
<210> 12
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 12
Arg His Gly Ala Leu Val Tyr Leu Lys
1 5
<210> 13
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 13
Arg His Gly Ala Xaa Val Tyr Leu Lys
1 5
<210> 14
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 14
Arg His Gly Ala Met Ala Tyr Leu Lys
1 5
<210> 15
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 15
Arg His Gly Ala Met Val Phe Leu Lys
1 5
<210> 16
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 16
Gly Ala Met Val Tyr Leu Lys
1 5
<210> 17
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 17
Arg His Arg His Gly Ala Met Val Tyr Leu Lys
1 5 10
<210> 18
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 18
Arg His Arg His Arg His Gly Ala Met Val Tyr Leu Lys
1 5 10
<210> 19
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 19
Lys Leu Tyr Val Met Ala Gly His Arg
1 5
<210> 20
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> AGM-330
<400> 20
Arg His Gly Ala Met Val Tyr Leu Lys Leu Lys Leu Lys
1 5 10
<210> 21
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> TAT
<400> 21
Tyr Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg
1 5 10
<210> 22
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> TAT(48-60)
<400> 22
Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg Pro Pro Gln
1 5 10
<210> 23
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> TAT(49-57)
<400> 23
Arg Lys Lys Arg Arg Gln Arg Arg Arg
1 5
<210> 24
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> Penetratin
<400> 24
Arg Gln Ile Lys Ile Trp Phe Gln Asn Arg Arg Met Lys Trp Lys Lys
1 5 1015
<210> 25
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> R8
<400> 25
Arg Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 26
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> R9-TAT
<400> 26
Gly Arg Arg Arg Arg Arg Arg Arg Arg Arg Pro Pro Gln
1 5 10
<210> 27
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> Pep-1
<400> 27
Lys Glu Thr Trp Trp Glu Thr Trp Trp Thr Glu Trp Ser Gln Pro Lys
1 5 1015
Lys Lys Arg Lys Val
20
<210> 28
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> Hph-1
<400> 28
Tyr Ala Arg Val Arg Arg Arg Gly Pro Arg Arg
1 5 10
<210> 29
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> MAP
<400> 29
Lys Leu Ala Leu Lys Leu Ala Leu Lys Ala Leu Lys Ala Ala Leu Lys
1 5 1015
Leu Ala
<210> 30
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> pVEC
<400> 30
Leu Leu Ile Ile Leu Arg Arg Arg Ile Arg Lys Gln Ala His Ala His
1 5 1015
Ser Lys
<210> 31
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> DS4
<400> 31
Val Gln Ile Phe Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Leu Ala
1 5 1015
Arg His Ser Thr
20
<210> 32
<211> 27
<212> PRT
<213> 人工序列
<220>
<223> 转运素
<400> 32
Gly Trp Thr Leu Asn Ser Ala Gly Tyr Leu Leu Gly Lys Ile Asn Leu
1 5 1015
Lys Ala Leu Ala Ala Leu Ala Lys Lys Ile Leu
2025
<210> 33
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> gH625
<400> 33
His Gly Leu Ala Ser Thr Leu Thr Arg Trp Ala His Tyr Asn Ala Leu
1 5 1015
Ile Arg Ala Phe
20
<210> 34
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> VP22
<400> 34
Asn Ala Lys Thr Arg Arg His Glu Arg Arg Arg Lys Leu Ala Ile Glu
1 5 1015
Arg
<210> 35
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> DS4
<400> 35
Val Gln Ile Phe Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Leu Ala
1 5 1015
Arg His Ser Thr
20
<210> 36
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> DS4-1
<400> 36
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg His Ser Thr
1 5 1015
<210> 37
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> DS4-2
<400> 37
Val Gln Ile Phe Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Leu Ala
1 5 1015
Arg
<210> 38
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> DS4-3
<400> 38
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 39
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> KS4
<400> 39
Phe Arg Leu Val Arg Leu Leu Arg Phe Leu Arg Ile Leu Leu Ile Ile
1 5 1015
Ser
<210> 40
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> KS4-1
<400> 40
Phe Arg Leu Val Arg Leu Leu Arg Phe Leu Arg Ile Leu Leu
1 5 10
<210> 41
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> KS4-2
<400> 41
Arg Leu Val Arg Leu Leu Arg Phe Leu Arg
1 5 10
<210> 42
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> N1
<400> 42
Arg Ile Leu
1
<210> 43
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> N3
<400> 43
Arg Ile Leu Arg Ile Leu Arg Ile Leu
1 5
<210> 44
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> N5
<400> 44
Arg Ile Leu Arg Ile Leu Arg Ile Leu Arg Ile Leu Arg Ile Leu
1 5 1015
<210> 45
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> N7
<400> 45
Arg Ile Leu Arg Ile Leu Arg Ile Leu Arg Ile Leu Arg Ile Leu Arg
1 5 1015
Ile Leu Arg Ile Leu
20
<210> 46
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> K3
<400> 46
Arg Ile Phe Trp Val Ile Lys Leu Ala Arg His Phe Ile
1 5 10
<210> 47
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> C3
<400> 47
Lys Ser Leu Arg Val Leu Arg Val Leu Arg Pro Leu Lys Thr Ile Lys
1 5 1015
<210> 48
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> C4
<400> 48
Arg Leu Phe Arg Val Met Arg Leu Val Lys Leu Leu Ser Arg Gly
1 5 1015
<210> 49
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> S2
<400> 49
Arg Ser Phe Arg Leu Leu Arg Val Phe Lys Leu Ala Lys Ser Trp
1 5 1015
<210> 50
<211> 22
<212> PRT
<213> 人工序列
<220>
<223> S4
<400> 50
Arg Val Ile Arg Leu Ala Arg Ile Gly Arg Ile Leu Arg Leu Val Lys
1 5 1015
Gly Ala Lys Gly Ile Arg
20
<210> 51
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D1
<400> 51
Arg Ala Gly Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 52
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D2
<400> 52
Arg Ile Met Arg Gly Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 53
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D3
<400> 53
Arg Ile Met Arg Ile Leu Arg Leu Met Lys Leu Ala Arg
1 5 10
<210> 54
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D4
<400> 54
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Met Phe Arg
1 5 10
<210> 55
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D5
<400> 55
Arg Ile Met Arg Ile Leu Arg Ala Leu Lys Leu Ala Arg
1 5 10
<210> 56
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D6
<400> 56
Arg Ile Met Arg Gly Met Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 57
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D7
<400> 57
Arg Leu Phe Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 58
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D8
<400> 58
Arg Ile Met Arg Met Val Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 59
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D9
<400> 59
Arg Ile Met Arg Ile Leu Arg Leu Val Lys Leu Ala Arg
1 5 10
<210> 60
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D10
<400> 60
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Gly Val Arg
1 5 10
<210> 61
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D11
<400> 61
Arg Asn Leu Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 62
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D12
<400> 62
Arg Ile Met Arg Asp Ile Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 63
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D13
<400> 63
Arg Ile Met Arg Ile Leu Arg Glu Leu Lys Leu Ala Arg
1 5 10
<210> 64
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D14
<400> 64
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Gln Leu Arg
1 5 10
<210> 65
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D15
<400> 65
Arg Ile Met Arg Ile Leu Arg His Met Lys Leu Ala Arg
1 5 10
<210> 66
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D16
<400> 66
Arg Ile Met Arg Ser Val Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 67
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D17
<400> 67
Arg Thr Met Arg Ile Leu Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 68
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D18
<400> 68
Arg Ile Met Arg Tyr Ala Arg Ile Leu Lys Leu Ala Arg
1 5 10
<210> 69
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D19
<400> 69
Arg Ile Met Arg Ile Leu Arg Gln Ile Lys Leu Ala Arg
1 5 10
<210> 70
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> D20
<400> 70
Arg Ile Met Arg Ile Leu Arg Ile Leu Lys Glu Val Arg
1 5 10
<210> 71
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 71
ctgccagaag acaatgaacc 20
<210> 72
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 72
ggccattgct tccaatacac 20
<210> 73
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 73
tggatcaaga ttagagttgg c 21
<210> 74
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 74
ccttgtccat tcttctgacc 20
<210> 75
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 75
gctatgctca gatcgccagt 20
<210> 76
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 76
tctcgtaaga gtccgctagc tc 22
<210> 77
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 77
tagaccaaat aacgttgaag ttga 24
<210> 78
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 78
gattcacaaa ctgcagattc aa 22
<210> 79
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 79
cacctccaga tgccgtttg 19
<210> 80
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 80
atgcgtggtt atcatttgcc 20
<210> 81
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 81
cgaaagggaa aaacaaacgc 20
<210> 82
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 82
tcactcactg tcataggtgt cacc 24
- 包括由两种聚合物的共混物形成的粘合剂的锂离子电池用电极,第一聚合物为第一聚丙烯酸盐或其衍生物之一,第二聚合物为第二聚丙烯酸盐或羧甲基纤维素或其衍生物之一,用于制造该电极的墨
- 乳杆菌、使用其制备色素的方法、乳杆菌培养物与包括其的色素组合物
- 包括溶解在氟化溶剂中的双膦酸根型化合物的组合物及其用于覆盖部件表面的用途
- 新型核仁素结合肽及其应用
- 用于治疗糖尿病的包括长效胰岛素缀合物和长效促胰岛素肽缀合物的组合物
