一种用于检测霍乱弧菌核酸的引物探针组合及试剂盒
文献发布时间:2024-04-18 19:58:21
技术领域
本申请涉及基因检测技术领域,特别是涉及一种用于检测霍乱弧菌核酸的引物探针组合及试剂盒。
背景技术
霍乱是由霍乱弧菌(Vibrio cholerae)引起的急性肠道传染病,具有发病急、传播快、波及面广的特点,是我国《传染病防治法》规定的两种甲类传染病之一,也是《国际卫生检疫条例》规定国际检疫的三种传染病之一。霍乱弧菌是革兰氏阴性菌,菌体短小呈逗点状,有单鞭毛、菌毛,部分有荚膜。根据霍乱弧菌O抗原的不同,霍乱弧菌可分出200个以上的O血清群,但仅发现O1群和O139群霍乱弧菌能引发霍乱。而非O1群霍乱弧菌或非O139群霍乱弧菌大量存在于自然界水生生态系统中偶尔引起腹泻,少数非O1群霍乱弧菌或非O139群霍乱弧菌会导致毒力增加。霍乱毒素是霍乱的主要致病因子,其他致病因子包括溶血素等,这些致病因子致病力强,易引起流行和暴发。因此,分型及对霍乱毒素、溶血素的检测对判断流行株、非流行株,判定疫情的严重程度,从而采取不同防制策略和措施有着重要作用。
根据中国疾病预防控制中心发布的《全国霍乱监测方案-2017》中推荐对霍乱弧菌O1和O139菌群进行分型,同时以霍乱毒素基因作为检测标准,且标准方法为荧光定量PCR法。但常规荧光定量PCR探针采用Taqman的方法进行检测,然对于序列相似/相近、或引起症状相似的同源菌群,检测特异性效果不甚理想,尤其是对于多重扩增的试剂其更易引起非特异性扩增。因此,急需开发一种特异性效果好、灵敏度高、稳定性好的引物探针组合及试剂盒。
发明内容
本申请的目的在于提供一种用于检测霍乱弧菌核酸的引物探针组合及试剂盒,提高了检测的特异性、灵敏度和稳定性。具体技术方案如下:
本申请的第一方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测霍乱弧菌溶血素基因(hlyA)的引物探针组合;其中,所述用于检测hlyA的引物探针组合选自H1、H2和H3中的任一组合:
H1包括序列如SEQ ID NO:1所示的上游引物hF1、序列如SEQ ID NO:2所示的下游引物hR1、序列如SEQ ID NO:3所示的上游探针hP1-1和序列如SEQ ID NO:4所示的下游探针hP2-1;
H2包括序列如SEQ ID NO:5所示的上游引物hF2、序列如SEQ ID NO:6所示的下游引物hR2、序列如SEQ ID NO:7所示的上游探针hP1-2和序列如SEQ ID NO:8所示的下游探针hP2-2;
H3包括序列如SEQ ID NO:9所示的上游引物hF3、序列如SEQ ID NO:10所示的下游引物hR3、序列如SEQ ID NO:11所示的上游探针hP1-3和序列如SEQ ID NO:12所示的下游探针hP2-3。
本申请的第二方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测霍乱弧菌毒力基因(ctxA)的引物探针组合;其中,所述用于检测ctxA的引物探针组合选自C1和C2中的任一组合:
C1包括序列如SEQ ID NO:13所示的上游引物cF1、序列如SEQ ID NO:14所示的下游引物cR1、序列如SEQ ID NO:15所示的上游探针cP1-1和序列如SEQ ID NO:16所示的下游探针cP2-1;
C2包括序列如SEQ ID NO:17所示的上游引物cF2、序列如SEQ ID NO:18所示的下游引物cR2、序列如SEQ ID NO:19所示的上游探针cP1-2和序列如SEQ ID NO:20所示的下游探针cP2-2。
本申请第三方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测O1型霍乱弧菌O抗原基因(O1-rfb)的引物探针组合;其中,所述用于检测O1-rfb的引物探针组合选自O1-1和O1-2中的任一组合:
O1-1包括序列如SEQ ID NO:21所示的上游引物o1F1、序列如SEQ ID NO:22所示的下游引物o1R1、序列如SEQ ID NO:23所示的上游探针o1P1-1和序列如SEQ ID NO:24所示的下游探针o1P2-1;
O1-2包括序列如SEQ ID NO:25所示的上游引物o1F2、序列如SEQ ID NO:26所示的下游引物o1R2、序列如SEQ ID NO:27所示的上游探针o1P1-2和序列如SEQ ID NO:28所示的下游探针o1P2-2。
本申请第四方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测O139型霍乱弧菌O抗原基因(O139-rfb)的引物探针组合;其中,所述用于检测O139-rfb的引物探针组合选自O139-1和O139-2中的任一组合:
O139-1包括序列如SEQ ID NO:29所示的上游引物o139F1、序列如SEQ ID NO:30所示的下游引物o139R1、序列如SEQ ID NO:31所示的上游探针o139P1-1和序列如SEQ ID NO:32所示的下游探针o139P2-1;
O139-2包括序列如SEQ ID NO:33所示的上游引物o139F2序列如SEQ ID NO:34所示的下游引物o139R2、序列如SEQ ID NO:35所示的上游探针o139P1-2和序列如SEQ ID NO:36所示的下游探针o139P2-2。
本申请的第五方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测hlyA的引物探针组合、用于检测ctxA的引物探针组合及用于检测O1-rfb的引物探针组合和用于检测O139-rfb的引物探针组合;
其中,所述用于检测hlyA的引物探针组合选自H1、H2和H3中的任一组合:
H1包括序列如SEQ ID NO:1所示的上游引物hF1、序列如SEQ ID NO:2所示的下游引物hR1、序列如SEQ ID NO:3所示的上游探针hP1-1和序列如SEQ ID NO:4所示的下游探针hP2-1;
H2包括序列如SEQ ID NO:5所示的上游引物hF2、序列如SEQ ID NO:6所示的下游引物hR2、序列如SEQ ID NO:7所示的上游探针hP1-2和序列如SEQ ID NO:8所示的下游探针hP2-2;
H3包括序列如SEQ ID NO:9所示的上游引物hF3、序列如SEQ ID NO:10所示的下游引物hR3、序列如SEQ ID NO:11所示的上游探针hP1-3和序列如SEQ ID NO:12所示的下游探针hP2-3;
其中,所述用于检测ctxA的引物探针组合选自C1和C2中的任一组合:
C1包括序列如SEQ ID NO:13所示的上游引物cF1、序列如SEQ ID NO:14所示的下游引物cR1、序列如SEQ ID NO:15所示的上游探针cP1-1和序列如SEQ ID NO:16所示的下游探针cP2-1;
C2包括序列如SEQ ID NO:17所示的上游引物cF2、序列如SEQ ID NO:18所示的下游引物cR2、序列如SEQ ID NO:19所示的上游探针cP1-2和序列如SEQ ID NO:20所示的下游探针cP2-2;
其中,所述用于检测O1-rfb的引物探针组合选自O1-1和O1-2中的任一组合:
O1-1包括序列如SEQ ID NO:21所示的上游引物o1F1、序列如SEQ ID NO:22所示的下游引物o1R1、序列如SEQ ID NO:23所示的上游探针o1P1-1和序列如SEQ ID NO:24所示的下游探针o1P2-1;
O1-2包括序列如SEQ ID NO:25所示的上游引物o1F2、序列如SEQ ID NO:26所示的下游引物o1R2、序列如SEQ ID NO:27所示的上游探针o1P1-2和序列如SEQ ID NO:28所示的下游探针o1P2-2;
其中,所述用于检测O139-rfb的引物探针组合选自O139-1和O139-2中的任一组合:
O139-1包括序列如SEQ ID NO:29所示的上游引物o139F1、序列如SEQ ID NO:30所示的下游引物o139R1、序列如SEQ ID NO:31所示的上游探针o139P1-1和序列如SEQ ID NO:32所示的下游探针o139P2-1;
O139-2包括序列如SEQ ID NO:33所示的上游引物o139F2序列如SEQ ID NO:34所示的下游引物o139R2、序列如SEQ ID NO:35所示的上游探针o139P1-2和序列如SEQ ID NO:36所示的下游探针o139P2-2。
在本申请的一种实施方案中,所述用于检测hlyA的引物探针组合选自H2,所述用于检测ctxA的引物探针组合选自C1,所述用于检测O1-rfb的引物探针组合选自O1-1,所述用于检测O139-rfb的引物探针组合选自O139-2。
在本申请的一种实施方案中,所述引物探针组合中上游探针的3’端均标记荧光报告基团,下游探针的5’端均标记荧光淬灭基团;其中,所述荧光报告基团选自FAM、HEX、TEXAS、CY3、CY5、TAMRA、TET、JOE、VIC、NED和ROX中的任意一种;所述荧光淬灭基团选自TAMRA、BHQ1和DABCY中的任意一种。
在本申请的一种实施方案中,所述上游探针hP1-1、上游探针hP1-2、上游探针hP1-3的3’端各自独立地标记荧光报告基团FAM,所述下游探针hP2-1、下游探针hP2-2、下游探针hP2-3的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针cP1-1、上游探针cP1-2的3’端各自独立地标记荧光报告基团VIC,所述下游探针cP2-1、下游探针cP2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针o1P1-1、上游探针o1P1-2的3’端各自独立地标记荧光报告基团ROX,所述下游探针o1P2-1、下游探针o1P2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针o139P1-1、上游探针o139P1-2的3’端各自独立地标记荧光报告基团CY5,所述下游探针o139P2-1、下游探针o139P2-2的5’端各自独立地标记荧光淬灭基团BHQ1。
本申请的第六方面提供了本申请第一方面至本申请第五方面所述的引物探针组合在制备用于检测霍乱弧菌核酸的试剂盒中的应用。
本申请的第七方面提供了一种用于检测霍乱弧菌核酸的试剂盒,所述试剂盒包括本申请第一方面至本申请第五方面所述的引物探针组合。
本申请的有益效果:
本申请提供了一种用于检测霍乱弧菌核酸的引物探针组合,分别选取hlyA、ctxA、O1-rfb或O139-rfb的核酸序列的特异性保守区,设计特异性引物探针组合,能够对霍乱弧菌核酸精准检测,可防止漏检,与副溶血弧菌、创伤弧菌、溶藻弧菌、拟态弧菌等与霍乱弧菌具有相似感染症状的常见病原体无交叉反应。进一步地,本申请提供的用于检测霍乱弧菌核酸的试剂盒的特异性好、灵敏度高、稳定性好,操作简便,全程闭管检测,一管完成霍乱弧菌核酸检测,避免了由于样本间的交叉污染引起的假阳性和环境污染。
当然,实施本申请的任一产品或方法并不一定需要同时达到以上所述的所有优点。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的实施例。
图1为实施例2中含副溶血弧菌TDH基因的质粒样本、含创伤弧菌GBSB基因的质粒样本、含溶藻弧菌acFa基因的质粒样本、含拟态弧菌omp基因的质粒样本的扩增曲线;
图2为实施例3中含hlyA的质粒样本的扩增曲线;
图3为实施例3中含ctxA的质粒样本的扩增曲线;
图4为实施例3中含O1rfb的质粒样本的扩增曲线;
图5为实施例3中含O139rfb的质粒样本的扩增曲线。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。本领域技术人员基于本申请所获得的所有其他实施例,都属于本申请保护的范围。
本申请的第一方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测hlyA的引物探针组合;其中,所述用于检测hlyA的引物探针组合选自H1、H2和H3中的任一组合:
H1包括序列如SEQ ID NO:1所示的上游引物hF1、序列如SEQ ID NO:2所示的下游引物hR1、序列如SEQ ID NO:3所示的上游探针hP1-1和序列如SEQ ID NO:4所示的下游探针hP2-1;
H2包括序列如SEQ ID NO:5所示的上游引物hF2、序列如SEQ ID NO:6所示的下游引物hR2、序列如SEQ ID NO:7所示的上游探针hP1-2和序列如SEQ ID NO:8所示的下游探针hP2-2;
H3包括序列如SEQ ID NO:9所示的上游引物hF3、序列如SEQ ID NO:10所示的下游引物hR3、序列如SEQ ID NO:11所示的上游探针hP1-3和序列如SEQ ID NO:12所示的下游探针hP2-3。
本申请的第二方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测ctxA的引物探针组合;其中所述用于检测ctxA的引物探针组合选自C1和C2中的任一组合:
C1包括序列如SEQ ID NO:13所示的上游引物cF1、序列如SEQ ID NO:14所示的下游引物cR1、序列如SEQ ID NO:15所示的上游探针cP1-1和序列如SEQ ID NO:16所示的下游探针cP2-1;
C2包括序列如SEQ ID NO:17所示的上游引物cF2、序列如SEQ ID NO:18所示的下游引物cR2、序列如SEQ ID NO:19所示的上游探针cP1-2和序列如SEQ ID NO:20所示的下游探针cP2-2。
本申请第三方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测O1-rfb的引物探针组合;其中,所述用于检测O1-rfb的引物探针组合选自O1-1和O1-2中的任一组合:
O1-1包括序列如SEQ ID NO:21所示的上游引物o1F1、序列如SEQ ID NO:22所示的下游引物o1R1、序列如SEQ ID NO:23所示的上游探针o1P1-1和序列如SEQ ID NO:24所示的下游探针o1P2-1;
O1-2包括序列如SEQ ID NO:25所示的上游引物o1F2、序列如SEQ ID NO:26所示的下游引物o1R2、序列如SEQ ID NO:27所示的上游探针o1P1-2和序列如SEQ ID NO:28所示的下游探针o1P2-2。
本申请第四方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其包括用于检测O139-rfb的引物探针组合;其中,所述用于检测O139-rfb的引物探针组合选自O139-1和O139-2中的任一组合:
O139-1包括序列如SEQ ID NO:29所示的上游引物o139F1、序列如SEQ ID NO:30所示的下游引物o139R1、序列如SEQ ID NO:31所示的上游探针o139P1-1和序列如SEQ ID NO:32所示的下游探针o139P2-1;
O139-2包括序列如SEQ ID NO:33所示的上游引物o139F2序列如SEQ ID NO:34所示的下游引物o139R2、序列如SEQ ID NO:35所示的上游探针o139P1-2和序列如SEQ ID NO:36所示的下游探针o139P2-2。
本申请第五方面提供了一种用于检测霍乱弧菌核酸的引物探针组合,其特征在于,包括用于检测hlyA的引物探针组合、用于检测ctxA的引物探针组合及用于检测O1-rfb的引物探针组合和用于检测O139-rfb的引物探针组合;
其中,所述用于检测hlyA的引物探针组合选自H1、H2和H3中的任一组合:
H1包括序列如SEQ ID NO:1所示的上游引物hF1、序列如SEQ ID NO:2所示的下游引物hR1、序列如SEQ ID NO:3所示的上游探针hP1-1和序列如SEQ ID NO:4所示的下游探针hP2-1;
H2包括序列如SEQ ID NO:5所示的上游引物hF2、序列如SEQ ID NO:6所示的下游引物hR2、序列如SEQ ID NO:7所示的上游探针hP1-2和序列如SEQ ID NO:8所示的下游探针hP2-2;
H3包括序列如SEQ ID NO:9所示的上游引物hF3、序列如SEQ ID NO:10所示的下游引物hR3、序列如SEQ ID NO:11所示的上游探针hP1-3和序列如SEQ ID NO:12所示的下游探针hP2-3;
其中,所述用于检测ctxA的引物探针组合选自C1和C2中的任一组合:
C1包括序列如SEQ ID NO:13所示的上游引物cF1、序列如SEQ ID NO:14所示的下游引物cR1、序列如SEQ ID NO:15所示的上游探针cP1-1和序列如SEQ ID NO:16所示的下游探针cP2-1;
C2包括序列如SEQ ID NO:17所示的上游引物cF2、序列如SEQ ID NO:18所示的下游引物cR2、序列如SEQ ID NO:19所示的上游探针cP1-2和序列如SEQ ID NO:20所示的下游探针cP2-2;
其中,所述用于检测O1-rfb的引物探针组合选自O1-1和O1-2中的任一组合:
O1-1包括序列如SEQ ID NO:21所示的上游引物o1F1、序列如SEQ ID NO:22所示的下游引物o1R1、序列如SEQ ID NO:23所示的上游探针o1P1-1和序列如SEQ ID NO:24所示的下游探针o1P2-1;
O1-2包括序列如SEQ ID NO:25所示的上游引物o1F2、序列如SEQ ID NO:26所示的下游引物o1R2、序列如SEQ ID NO:27所示的上游探针o1P1-2和序列如SEQ ID NO:28所示的下游探针o1P2-2;
其中,所述用于检测O139-rfb的引物探针组合选自O139-1和O139-2中的任一组合:
O139-1包括序列如SEQ ID NO:29所示的上游引物o139F1、序列如SEQ ID NO:30所示的下游引物o139R1、序列如SEQ ID NO:31所示的上游探针o139P1-1和序列如SEQ ID NO:32所示的下游探针o139P2-1;
O139-2包括序列如SEQ ID NO:33所示的上游引物o139F2序列如SEQ ID NO:34所示的下游引物o139R2、序列如SEQ ID NO:35所示的上游探针o139P1-2和序列如SEQ ID NO:36所示的下游探针o139P2-2。
在检测霍乱弧菌核酸的引物探针组合中,检测hlyA的引物探针组合用于区分霍乱弧菌与非霍乱弧菌,检测ctxA的引物探针组合用于鉴定产毒霍乱弧菌与非产毒霍乱弧菌,检测O1-rfb和O139-rfb的引物探针组合用于对O1型霍乱弧菌和O139型霍乱弧菌的分型,以提供精准的治疗和防治方案。
在本申请中,分别选取hlyA、ctxA、O1-rfb或O139-rfb的核酸序列的特异性保守区,设计特异性引物探针组合,能够实现对霍乱弧菌核酸精准检测,可防止漏检,与副溶血弧菌、创伤弧菌、溶藻弧菌、拟态弧菌等与霍乱弧菌具有相似感染症状的常见病原体无交叉反应。本申请引物探针组合用于检测霍乱弧菌核酸时特异性好、灵敏度高、稳定性好。
在本申请的一种实施方案中,所述用于检测hlyA的引物探针组合选自H2,所述用于检测ctxA的引物探针组合选自C1,所述用于检测O1-rfb的引物探针组合选自O1-1,所述用于检测O139-rfb的引物探针组合选自O139-2。
发明人在研究中发现,在用于检测霍乱弧菌核酸的引物探针组合中,检测hlyA的引物探针组合选自H2,检测ctxA的引物探针组合选自C1,检测O1-rfb的引物探针组合选自O1-1和检测O139-rfb的引物探针组合选自O139-2,在用于检测霍乱弧菌核酸及基因分型时灵敏度更好。
在本申请的一种实施方案中,所述引物探针组合中上游探针的3’端均标记荧光报告基团,下游探针的5’端均标记荧光淬灭基团;其中,所述荧光报告基团选自FAM、HEX、TEXAS、CY3、CY5、TAMRA、TET、JOE、VIC、NED和ROX中的任意一种;所述荧光淬灭基团选自TAMRA、BHQ1和DABCY中的任意一种。
在本申请中,FAM、HEX、TEXAS、CY3、CY5、TAMRA、TET、JOE、VIC、NED和ROX为荧光PCR所需的常规荧光报告基团,TAMRA、BHQ1和DABCY是荧光PCR所需的常规荧光淬灭基团,均可市售获得,本申请在此不做限定,例如,可以选用购自生工生物工程(上海)股份有限公司的荧光报告基团和荧光淬灭基团。
在本申请的一种实施方案中,所述上游探针hP1-1、上游探针hP1-2、上游探针hP1-3的3’端各自独立地标记荧光报告基团FAM,所述下游探针hP2-1、下游探针hP2-2、下游探针hP2-3的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针cP1-1、上游探针cP1-2的3’端各自独立地标记荧光报告基团VIC,所述下游探针cP2-1、下游探针cP2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针o1P1-1、上游探针o1P1-2的3’端各自独立地标记荧光报告基团ROX,所述下游探针o1P2-1、下游探针o1P2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
所述上游探针o139P1-1、上游探针o139P1-2的3’端各自独立地标记荧光报告基团CY5,所述下游探针o139P2-1、下游探针o139P2-2的5’端各自独立地标记荧光淬灭基团BHQ1。
本申请的第六方面提供了本申请第一方面至本申请第五方面所述的引物探针组合在制备用于检测霍乱弧菌核酸的试剂盒中的应用。
本申请的第七方面提供了一种用于检测霍乱弧菌核酸的试剂盒,所述试剂盒包括本申请第一方面至本申请第五方面所述的引物探针组合。
在本申请的一种实施方案中,所述试剂盒还包括进行荧光PCR所需的试剂。
在本申请中,对进行荧光PCR所需的试剂的选择没有特别限定,可以根据具体待测样品进行选择。例如,进行荧光PCR所需的试剂可以包括PCR反应液和Taq酶,其中PCR反应液包括本申请所述的引物探针组合和PCR反应缓冲液;进行荧光PCR所需的试剂还可以包括DNA提取液、阳性质控品、阴性质控品。PCR反应缓冲液、DNA提取液、Taq酶、阳性质控品、阴性质控品为PCR体系的常规通用试剂,均可市售获得,本申请在此不做限定。
本申请提供的特异性引物探针组合用于检测霍乱弧菌核酸的试剂盒检测时,特异性好、灵敏度高、稳定性好,操作简便,全程闭管检测,一管完成霍乱弧菌核酸检测,避免了由于样本间的交叉污染引起的假阳性和环境污染。
以下,举出实施例来对本申请的实施方式进行更具体地说明。各种的试验及评价按照下述的方法进行。另外,只要无特别说明,“份”、“%”为质量基准。
用于检测霍乱弧菌核酸的引物探针设计筛选:
根据美国国家生物技术信息中心(NCBI)数据库中霍乱弧菌溶血素基因hlyA(GenBank:CP043556.1)、霍乱弧菌毒力基因ctxA(GenBank:AF516341.1)、两组用于检测对O1抗原基因O1-rfb(GenBank:LC594800.1)和O139型霍乱弧菌O抗原基因O139-rfb(GenBank:X91246.1)的核酸序列的特异性保守区,设计用于检测霍乱弧菌核酸的特异性引物探针组合,见下表1:
表1引物探针及检测靶点信息
用于检测霍乱弧菌核酸的试剂盒:
用于检测霍乱弧菌核酸的试剂盒包含以下组分:
PCR反应液(购于南京诺唯赞生物科技股份有限公司,型号为Taq Pro U+MultipleProbe qPCR Mix);用于荧光PCR扩增的引物探针组合包括一组用于检测hlyA的引物探针组合(包括上游引物hF、下游引物hR、上游探针hP1和下游探针hP2)、一组用于检测ctxA的引物探针组合(包括上游引物cF、下游引物cR、上游探针cP1和下游探针cP2)及一组用于检测O1-rfb的引物探针组合(包括上游引物o1F、下游引物o1R、上游探针o1P1和下游探针o1P2)和一组用于检测O139-rfb的引物探针组合(包括上游引物o139F、下游引物o139R、上游探针o139P1和下游探针o139P2)。
其中,用于检测hlyA的引物探针组合选自表1中H1、H2和H3中的任一组合;用于检测ctxA的引物探针组合选自表1中C1和C2中的任一组合;用于检测O1-rfb的引物探针组合选自表1中O1-1和O1-2中的任一组合;用于检测O139-rfb的引物探针组合选自表1中O139-1和O139-2中的任一组合;
其中,上游探针hP1-1、上游探针hP1-2、上游探针hP1-3的3’端各自独立地标记荧光报告基团FAM,下游探针hP2-1、下游探针hP2-2、下游探针hP2-3的5’端各自独立地标记荧光淬灭基团BHQ1;
上游探针cP1-1、上游探针cP1-2的3’端各自独立地标记荧光报告基团VIC,下游探针cP2-1、下游探针cP2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
上游探针o1P1-1、上游探针o1P1-2的3’端各自独立地标记荧光报告基团ROX,下游探针o1P2-1、下游探针o1P2-2的5’端各自独立地标记荧光淬灭基团BHQ1;
上游探针o139P1-1、上游探针o139P1-2的3’端各自独立地标记荧光报告基团CY5,下游探针o139P2-1、下游探针o139P2-2的5’端各自独立地标记荧光淬灭基团BHQ1。
其中,上述各个上游引物和下游引物的浓度均为10μmol/L,上游探针和下游探针的浓度均为10μmol/L。
用于检测霍乱弧菌核酸的试剂盒的使用方法:
1、试剂准备:
(1)选择上述试剂盒中的各组分按照表2制备准备试剂;
表2
/>
注:设试剂管数的理论验证数量为“N”,具体配制数量为N+2,具体配制量应以实际测试数为准。
(2)将步骤(1)配置好的试剂震荡混匀,分装20μL至八联管内,每管分装2.5μL,将分装好的转移至样本准备去备用。
2、样本准备:具体步骤参见下述各实施例。
3、加样:分别向八联管内,每管加入10μL的样本,并拧紧管盖,用掌上离心机瞬时离心3~5s。
4、扩增检测:
将上述八联管放入实时荧光定量PCR仪(厂商:赛默飞,型号ABI7500)内,按照表3中的参数进行扩增。
表3
通道设定:同时选择FAM、VIC、ROX、Cy5通道。
5、结果判断:
Ct值(循环阈值,Cycle threshold value),即每个反应管内的荧光信号到达设定的阈值时所经历的循环数。检测样本Ct值≤37.00时,测定结果可直接报告为阳性样本;检测样本37.00时≤Ct值<40时,重复一次,如果Ct值仍小于40,取扩增曲线有明显的对数增长期,可报告样本阳性,否则报告样本阴性。
实施例1灵敏度检测
(1)样本准备:根据NCBI数据库得到hlyA(GenBank:CP043556.1)、ctxA(GenBank:AF516341.1)、O1rfb(GenBank:LC594800.1)、O139rfb(GenBank:X91246.1)的核酸序列,并委托生工生物工程(上海)股份有限公司合成含有hlyA、ctxA、O1rfb、O139rfb基因的质粒,利用超纯水分别对含有hlyA、ctxA、O1rfb、O139rfb基因的质粒进行梯度稀释,分别得到1×10
采用上述试剂盒的使用方法对表1中的引物探针组合的灵敏度进行验证,扩增检测Ct值见下表4:
表4
(2)样本准备:利用超纯水分别对含有hlyA、ctxA、O1rfb、O139rfb基因的质粒进行梯度稀释,分别得到1×10
采用上述试剂盒的使用方法对引物探针组合H2/C1/O1-1/O139-2的灵敏度进行验证,扩增检测Ct值见下表5:
表5
注:表5中“No Ct”代表检测不到Ct值。
从表4可以看出,对于浓度为1×10
实施例2特异性检测
样本准备:根据NCBI数据库得到副溶血弧菌TDH基因(GenBank:NC_004605.1)、创伤弧菌GBSB基因(GenBank:NZ_CP126699.1)、溶藻弧菌acFa基因(GenBank:NZ_JAGDKC000000000.1)和拟态弧菌omp基因(GenBank:NZ_GL989627.1)的核酸序列,并委托生工生物工程(上海)股份有限公司合成含副溶血弧菌TDH基因、创伤弧菌GBSB基因、溶藻弧菌acFa基因、拟态弧菌omp基因的质粒,利用超纯水分别稀释含副溶血弧菌TDH基因、创伤弧菌GBSB基因、溶藻弧菌acFa基因、拟态弧菌omp基因的质粒,得到浓度为1×10
采用上述试剂盒的使用方法对引物探针组合H2/C1/O1-1/O139-2的特异性进行验证,扩增检测Ct值见下表6,扩增曲线见图1。
表6
注:表6中“No Ct”代表检测不到Ct值。
从表6和图1可以看出,样本Rep1、Rep2、Rep3和Rep4的扩增曲线不呈S型,且检测不到Ct值。以上结果说明,本申请设计的特异性引物探针组合,与副溶血弧菌、创伤弧菌、溶藻弧菌、拟态弧菌等与霍乱弧菌具有相似感染症状的常见病原体无交叉反应。
实施例3稳定性检测
样本准备:利用超纯水分别对含有hlyA、ctxA、O1rfb、O139rfb基因的质粒进行梯度稀释,分别得到1×10
(1)hlyA基因检测结果:
表7
(2)ctxA基因检测结果
表8
(3)O1rfb基因检测结果
表9
(4)O139rfb基因检测结果
表10
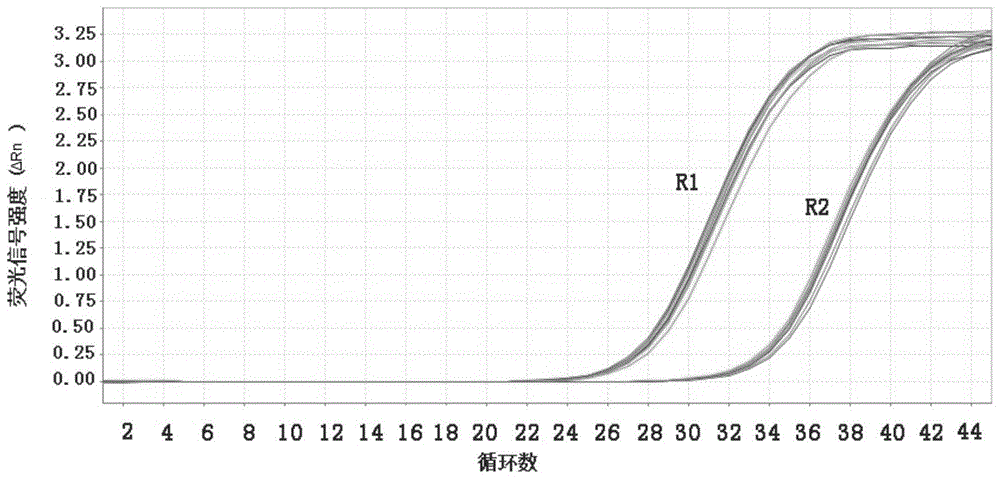
从表7和图2可以看出,含有hlyA基因的质粒的R1和R2样本的扩增曲线呈S型,且CV均小于1%;从表8和图3可以看出,含有ctxA基因的质粒的R1和R2样本的扩增曲线呈S型,且CV均小于1.5%;从表9和图4可以看出,含有O1rfb基因的质粒的R1和R2样本的扩增曲线呈S型,且CV均小于1%;从表10和图5可以看出,含有O139rfb基因的质粒的R1和R2样本的扩增曲线呈S型,且CV均小于1%。以上结果说明,本申请的引物探针组合在用于检测霍乱弧菌核酸及基因分型检测时的稳定性好。
综上所述,本申请提供了一种用于检测霍乱弧菌核酸的引物探针组合,分别过选取hlyA、ctxA、O1-rfb或O139-rfb的核酸序列的特异性保守区,设计特异性引物探针组合,能够对霍乱弧菌核酸精准检测,可防止漏检,与副溶血弧菌、创伤弧菌、溶藻弧菌、拟态弧菌等与霍乱弧菌具有相似感染症状的常见病原体无交叉反应。进一步地,本申请提供的用于检测霍乱弧菌核酸的试剂盒的特异性好、灵敏度高、稳定性好,操作简便,全程闭管检测,一管完成霍乱弧菌核酸检测,避免了由于样本间的交叉污染引起的假阳性和环境污染。
以上所述仅为本申请的较佳实施例,并不用以限制本申请,凡在本申请的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本申请保护的范围之内。
- 一种用于检测副猪嗜血杆菌的RPA引物、RPA探针、试剂盒及核酸检测方法
- 一种基于BTNAA体系检测犬瘟热病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种基于BTNAA体系检测犬细小病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种转基因玉米MON810的RPA检测引物与探针组合、试剂盒及检测方法
- 用于检测PIK3CD基因E1021K位点突变的探针和引物组合及试剂盒
- 一种霍乱弧菌检测引物探针组合物及一体化微流控芯片试剂盒
- 一种霍乱弧菌O1群与O139群产毒株的MIRA引物探针组合物、试剂盒及检测方法
