负载含磷树状大分子/蛋白的活性氧响应型双载药纳米平台的制备及应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于功能性纳米材料领域,特别涉及一种负载含磷树状大分子/蛋白的活性氧响应型双载药纳米平台的制备及应用。
背景技术
骨关节炎(OA)是最致残的关节疾病之一,影响全球超过2.5亿人口,并造成巨大的医疗和经济负担。OA导致膝关节疼痛和功能障碍,其特征是发生病理变化,包括软骨变性、滑膜炎症和软骨下骨重塑。巨噬细胞通过调节相关的炎症因子、生长因子和蛋白酶,在OA的发病机制中发挥关键作用。在炎症组织中,更多巨噬细胞被激活为促炎M1型,可产生促炎性细胞因子,导致组织损伤。M2型巨噬细胞具有抗炎功能,有助于组织修复和舒缓炎症。因此,促进巨噬细胞从M1型转为M2型能够有效降低炎症反应。同时,OA微环境中活性氧(ROS)的过度产生将导致软骨细胞功能障碍,可通过直接攻击或间接参与来诱导细胞凋亡、抑制基质合成和激活潜在金属蛋白酶的信号通路,导致软骨退化。因此清除过量的ROS对于重建软骨和OA的恢复至关重要。然而,由于巨噬细胞存在于身体的其它组织和器官中,全身性药物暴露可能导致免疫抑制。因此,迫切需要开发用于OA治疗的合理药物递送方法。
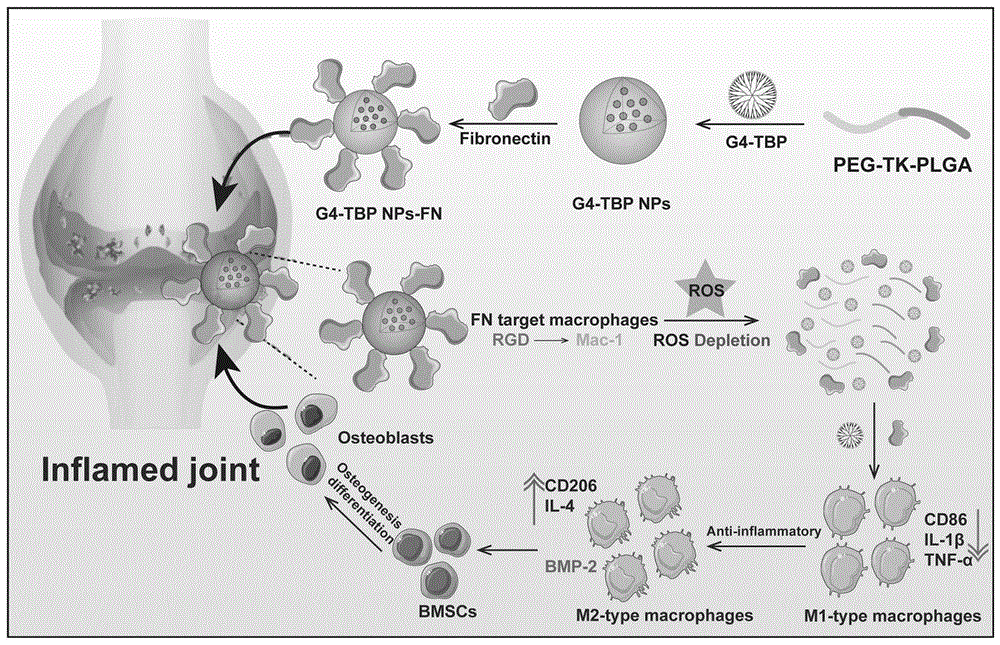
本发明利用具有ROS响应性的两亲性聚合物HOOC-PEG-TK-PLGA将G4-TBP包封在胶束疏水空腔,通过酰胺键将FN负载在胶束表面,得到双载药的炎症微环境响应型纳米平台,用于骨关节炎的精准高效治疗。检索国内外相关文献和专利,尚未发现以PEG-TK-PLGA作为载体同时负载G4-TBP及FN,用于骨关节炎的抗炎/抗氧化/促成骨分化的联合治疗的相关报道。
发明内容
本发明所要解决的技术问题是提供一种负载含磷树状大分子/蛋白的活性氧响应型双载药纳米平台的制备及应用。利用HOOC-PEG-TK-PLGA形成的胶束改善G4-TBP的水溶性,增强FN的胞内递送效率,并将G4-TBP与FN整合,高效清除炎症因子和ROS,诱导巨噬细胞从M1型转向M2型,改善缺氧炎症微环境,促进成骨分化,实现增强的抗炎/抗氧化/促成骨分化的联合骨关节炎精准高效治疗。
本发明的一种纳米复合材料,所述复合材料包括:两亲性聚合物HOOC-PEG-TK-PLGA胶束的疏水腔内包封G4-TBP,胶束表面负载蛋白。
所述蛋白包括纤连蛋白FN、牛血清白蛋白BSA中至少一种。
本发明的一种纳米复合材料的制备方法,包括:
(1)将第四代含磷树状大分子G4溶液、无水碳酸铯混合,冰浴,加入TBP溶液,室温反应,纯化,真空干燥,得到G4-TBP;
(2)将G4-TBP、HOOC-PEG-TK-PLGA(聚乙二醇-酮缩硫醇-聚乳酸-羟基乙酸)、溶剂混合,得到溶液,然后将溶液在超声条件下逐滴加入水中,搅拌反应,透析,过滤,超滤离心,得到G4-TBP NPs;
(3)将G4-TBP NPs与EDC溶液、NHS溶液进行反应,活化双亲性共聚物PEG末端羧基,然后与蛋白溶液混合,搅拌反应,离心,收集沉淀,得到纳米复合材料。
上述制备方法的优选方式如下:
所述步骤(1)中TBP的结构式如下:
所述步骤(1)中第四代含磷树状大分子G4溶液、TBP溶液的溶剂均为无水四氢呋喃THF;所述G4、TBP、无水碳酸铯的摩尔比为1:96:192-1:100:195。
所述步骤(1)中室温反应时间为24-48h;所述纯化工艺条件:将反应溶液浓缩后加入至甲醇溶液中搅拌,过滤收集沉淀,将得到的固体于乙醚溶液中洗涤。
所述步骤(2)中溶剂为二甲基亚砜DMSO;所述G4-TBP与HOOC-PEG-TK-PLGA的摩尔比为1:5-1:15;溶剂与水的体积比为1:10-1:15。
所述步骤(2)中所述超声时间为1-5min;搅拌反应时间为24-48h;透析为使用截留分子量为8000-14000Da的透析袋在超纯水中透析2~3天;过滤时使用孔径为1μm的微孔滤膜;超滤离心时使用截留分子量为3500Da的超滤离心管,以4500rpm离心30-60min。
所述步骤(3)中G4-TBP NPs与EDC溶液、NHS溶液进行反应具体为:将G4-TBP NPs的水溶液中,逐滴加入EDC溶液,在室温状态下搅拌30-60min;然后将NHS溶液加入上述混合溶液中,搅拌反应3-6h;其中G4-TBP NPs与EDC/NHS的摩尔比为1:10-1:30,EDC与NHS的摩尔比为1:1-1:2。
所述步骤(3)中蛋白包括纤连蛋白FN、牛血清白蛋白BSA中至少一种;所述G4-TBPNPs与蛋白的质量比是1:0.5-1:2;所述搅拌反应时间为24-48h;离心条件为13000rpm,20min。
所述纳米复合材料如G4-TBP NPs-FN、G4-TBP NPs-BSA。
本发明的一种基于复合纳米材料的活性氧响应型双载药纳米平台。
本发明提的一种负载第四代含磷树状大分子/蛋白的ROS响应型的双载药纳米平台,所述载药纳米平台是利用具有ROS响应性的两亲性聚合物HOOC-PEG-TK-PLGA将具有抗炎性能的G4-TBP包封在胶束疏水空腔内部,然后通过酰胺键作用将蛋白(如FN)和胶束PEG末端羧基连接,进而负载在胶束表面。
本发明的一种所述纳米复合材料在制备骨关节炎药物中的应用。
本发明的一种所述纳米复合材料在制备骨关节炎的抗炎、抗氧化、促成骨分化药物中的应用。
本发明还提供负载第四代含磷树状大分子/FN的ROS响应型的双载药纳米平台在骨关节炎的抗炎/抗氧化/促成骨分化的精准高效治疗应用。
本发明首先利用具有ROS响应性的两亲性聚合物HOOC-PEG-TK-PLGA将具有抗炎活性的第四代含磷树状大分子G4-TBP包封在胶束疏水空腔内部,然后通过酰胺键作用将FN和胶束PEG末端羧基连接,进而负载在胶束表面,得到G4-TBP NPs-FN。
本发明使用核磁共振(
本发明制备方法包括以活性氧响应性的两亲性聚合物HOOC-PEG-TK-PLGA胶束将具有抗炎活性的亚磷酸酯为末端的第四代含磷树状大分子G4-TBP包封在胶束疏水空腔内,通过酰胺键将具有抗氧化和抗炎活性的FN共价修饰在胶束表面,以形成双载药纳米平台。该方法反应条件简单,易于操作分离,具有良好的发展前景;制备得到的活性氧响应型双载药纳米平台能够主动靶向炎症部位的巨噬细胞,并在炎症微环境中响应性解离,释放G4-TBP和FN,清除活性氧(ROS),并通过上调过氧化氢酶的表达来消耗过氧化氢产生氧气,缓解氧化应激。自身具有抗炎活性的含磷树状大分子G4-TBP和FN能够抑制相关促炎性通路,促使巨噬细胞从M1促炎表型转向M2抗炎表型,降低促炎因子的分泌水平;同时M2型巨噬细胞分泌相关促成骨分化细胞因子,从而实现抗炎/抗氧化/促成骨分化联合治疗,所制备的纳米平台具有显著的骨关节炎治疗效果及潜在的临床应用价值。
有益效果
(1)本发明工艺简单,所需反应条件简单,易于操作分离,具有良好的发展前景;
(2)本发明制备的ROS响应型双载药纳米平台具有良好的生物相容性,可在炎症微环境响应解离并释放G4-TBP及FN,有效改善了G4-TBP的水溶性,增强FN的胞内递送效率,提高其生物利用度,为构建安全、智能的药物载体提供了新思路;
(3)本发明制备的纳米平台一方面可以主动靶向巨噬细胞,高效清除ROS以缓解过度的氧化应激,保护细胞免受凋亡;另一方面可以抑制相关促炎性通路,诱导巨噬细胞从M1型转为M2型,降低促炎因子的表达,发挥抗炎效果;同时,FN可通过上调过氧化氢酶的表达来消耗过氧化氢产生氧气,缓解氧化应激,而M2型巨噬细胞分泌相关促成骨分化的细胞因子,刺激骨髓间充质干细胞分化为成骨细胞,从而实现对骨关节炎的联合治疗,具有潜在的临床应用价值。
附图说明
图1为本发明中纳米材料G4-TBP NPs-FN的合成及应用示意图;
图2为实施例1中制备的G4-TBP的分子结构及其核磁共振磷谱图(A)和氢谱图(B);
图3为实施例1中制备的G4-TBP NPs、G4-TBP NPs、FN、G4-TBP NPs-FN及G4-TBPNPs-BSA的水合粒径(A)及表面电势(B);
图4为实施例1中制备的G4-TBP NPs(A)和G4-TBP NPs-FN(B)的TEM图;
图5为实施例1中制备的G4-TBP NPs、FN、G4-TBP NPs-FN的紫外吸收谱图;
图6为实施例1中制备的G4-TBP NPs、FN、G4-TBP NPs-FN(A)及BSA与G4-TBP NPs-BSA(B)的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)图;
图7为实施例1中制备的G4-TBP、HOOC-PEG-TK-PLGA、FN及G4-TBP NPs-FN与RAW264.7细胞共孵育24h后的细胞活力图;
图8为实施例1中制备的FN、G4-TBP NPs-FN复合物以及经FN阻断预处理后的G4-TBP NPs-FN复合物分别与RAW 264.7细胞共孵育4h后的流式图(A)与平均荧光强度定量图(B);
图9为实施例1中制备的G4-TBP NPs-FN复合物与不同内吞抑制剂或RGD预处理的RAW 264.7细胞共孵育3h后的流式图(A)与平均荧光强度定量图(B);
图10为实施例1中制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后细胞中ROS表达水平的流式分析图(A)和相对荧光强度定量图(B);
图11为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育12h后细胞内相对过氧化氢酶含量分析图;
图12为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后细胞内氧气表达水平的激光共聚焦图(A)和相对荧光强度定量图(B);
图13为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后细胞中CD86、CD206表达水平的流式分析图(A)和M2型巨噬细胞/M1型巨噬细胞的定量结果图(B);
图14为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后细胞凋亡的流式分析图(A)和定量结果图(B);
图15为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后对细胞质和细胞核中NF-κB蛋白的Westernblot试验结果,其中(A)为Western blot的蛋白条带图,(B)为细胞质中相对NF-κB蛋白表达定量图,(C)为细胞核中相对NF-κB蛋白表达定量图;
图16为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h后细胞中促炎性细胞因子(A)TNF-α分泌水平定量图,(B)相对IL-1β表达水平定量图以及抗炎性细胞因子(C)相对IL-4表达水平定量图;
图17为实施例1中制备的G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN分别与LPS激活的RAW 264.7细胞共孵育24h细胞中BMP-2mRNA的相对表达水平定量图;
图18为实施例1中经关节腔注射G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN治疗骨关节模型小鼠后,记录小鼠相对体重变化图;
图19为实施例17中膝关节腔内注射G4-TBP、FN、G4-TBP NPs-BSA和G4-TBP NPs-FN治疗骨关节模型小鼠后,小鼠膝关节部位的micro-CT成像结果图(A)以及micro-CT成像(B)BV/TV百分数定量结果图,(C)Tb.Sp定量结果图和(D)Tb.N定量结果图;
图20为实施例17中各实验组经治疗后,小鼠血清中各细胞因子(A)相对TNF-α水平定量图,(B)IL-1β表达水平定量图以及(C)MMP-13表达水平定量图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
除非特殊说明,否则所有化学试剂都无需进一步纯化即可直接使用。第四代含磷树状大分子G4来自法国国家科学研究中心J.P.Majoral教授课题组。TBP来自申请人已合成的原料(专利号:ZL 202110802153.8)。HOOC-PEG-TK-PLGA(Mw=7000)购自西安瑞禧生物科技有限公司(中国西安)。FN来自上海纤连生物科技有限公司(中国上海)。RAW 264.7细胞(小鼠巨噬细胞系)来自中国科学院生物化学与细胞生物学研究所。DMEM培养基、胎牛血清、青-链霉素双抗和胰蛋白酶购自杭州吉诺生物医学技术有限公司(中国杭州)。BCA assaykit、ROS检测试剂盒购买自上海碧云天生物科技有限公司(中国上海)。细胞凋亡试剂盒购自江苏凯基生物技术股份有限公司(中国江苏)。氧气探针购自上海懋康生物科技有限公司(中国上海)。BALB/c小鼠购自上海斯莱克实验动物中心(中国上海)。Anti-CD86-PE、Anti-CD206-FITC等抗体购自Thermo Fisher Scientific(Waltham,MA)。所有实验中使用的电阻率高于18.2MΩ.cm的水均通过实验室水净化系统(Cascada I,PALL,中国北京)进行净化。
实施例1
(1)将第四代含磷树状大分子G4(50mg)溶于12mL无水THF,加入无水碳酸铯(139.77mg),冰浴,逐滴加入溶解于8mL无水THF的TBP(85.96mg)溶液,搅拌48h,离心收集上清,旋转蒸发得到粗产物。将反应溶液浓缩至2mL后加入至20mL甲醇溶液中搅拌30min,过滤收集沉淀,将得到的固体于乙醚溶液中洗涤5min,真空干燥得到G4-TBP。
(2)将1.50mg第四代含磷树状大分子G4-TBP及1.05mg HOOC-PEG-TK-PLGA溶解在500μL DMSO中,然后将该溶液在超声条件下逐滴加入5mL超纯水中,搅拌反应24h。使用截留分子量为8000-14000Da的透析袋于超纯水中透析3天除去DMSO及未形成胶束的HOOC-PEG-TK-PLGA,透析结束后将产物通过孔径为1μm的微孔滤膜过滤,最后经截留分子量为3500Da的超滤离心管以4500rpm离心30min,得到G4-TBP NPs。通过ICP测量产物G4-TBP NPs中磷的含量,计算出G4-TBP的上载率为94.1wt%,包封率为57.3wt%。
(3)将20mg G4-TBP NPs溶于10mL超纯水中,逐滴加入5mL EDC溶液(2.192mg/mL溶于水),在室温状态下匀速搅拌30min后,加入5mLNHS溶液(1.316mg/mL溶于水)继续搅拌反应3h。加入10mL的FN溶液(2mg/mL),搅拌反应24h。反应结束后,于4℃,13000rpm离心20min,收集沉淀,分离含未上载的FN上清液,获得的沉淀为G4-TBP NPs-FN。同时,通过BCA试剂盒检测上清液在570nm处的吸光度,计算出未载上的FN的量,从而计算出FN的上载率为62.4wt%,包封率为38.4wt%。
将20mg G4-TBP NPs溶于10mL超纯水中,逐滴加入5mL EDC溶液(2.192mg/mL溶于水),在室温状态下匀速搅拌30min后,加入5mLNHS溶液(1.316mg/mL溶于水)继续搅拌反应3h。加入10mL的BSA溶液(2mg/mL),搅拌反应24h。反应结束后,于4℃,13000rpm离心20min,收集沉淀,分离含未上载的BSA上清液,获得的沉淀为G4-TBP NPs-BSA。制备得到的G4-TBPNPs-BSA作为G4-TBP NPs-FN的对照材料。
本发明使用核磁共振仪进行氢谱(
31
1
实施例2
取适量的G4-TBP,用DMSO使之完全溶解,随后滴加至超纯水中,配置成为0.5mg/mL的G4-TBP溶液(1%DMSO,超纯水作为溶剂)。分别取适量实施例1中制备的G4-TBP NPs、G4-TBP NPs-FN、G4-TBP NPs-BSA,用超纯水稀释,配制成浓度为0.5mg/mL的溶液,用于测定水合粒径和表面电势。结果如图3所示,G4-TBP的水合粒径为168.0nm,被包裹在HOOC-PEG-TK-PLGA胶束内获得G4-TBP NPs的水合粒径为229.3nm,电势从-0.20mV变为-15.7mV,水合粒径和电势的变化证明了G4-TBP NPs的成功合成。当G4-TBP NPs键合抗炎药物FN后,水合粒径增加至293.3nm,电势则进一步变化至-16.3mV,相比于单纯的FN(411.7nm),G4-TBP NPs-FN复合物粒径明显变小,并具有较好的单分散性(PDI:0.15)这些变化均证明了FN的成功负载。对照材料G4-TBP NPs-BSA的Zeta电势为-13.6mV,且其具有合适的水合动力学尺寸(273.5nm)和PDI(0.31)。
实施例3
取实施例1中制备的G4-TBP NPs及G4-TBP NPs-FN进行尺寸和形貌的表征。G4-TBPNPs的TEM图片如图4(A)所示,G4-TBP NPs呈均匀的球形,尺寸约为218nm。如图4(B),制备的G4-TBP NPs-FN尺寸约为268nm,证明了FN的成功负载。
实施例4
取实施例1中制备的G4-TBP NPs及G4-TBP NPs-FN进行UV-vis测试,如图5所示,G4-TBP NPs-FN在280nm处出现蛋白质的特征峰,证明FN的成功负载。
实施例5
取实施例1中制备的G4-TBP NPs、G4-TBP NPs-FN及G4-TBP NPs-BSA进行SDS-PAGE表征以验证FN和BSA的成功负载。通过BCA蛋白定量试剂盒测定FN、BSA、G4-TBP NPs-FN及G4-TBP NPs-BSA中的蛋白含量,并用PBS溶液调节各样品中蛋白含量为1mg/mL。将5μL蛋白Marker加入第一条蛋白泳道,再分别将20μL的G4-TBP NPs(浓度为G4-TBP NPs-FN中蛋白浓度为1mg/mL时对应的G4-TBP NPs浓度)、FN及G4-TBP NPs-FN加入蛋白泳道,电流设为100A,时间设为30min。如图6(A)所示,G4-TBP NPs组未出现任何蛋白条带,而G4-TBP NPs-FN组与FN组跑出了相似的蛋白条带,证明了FN被成功键合在G4-TBP NPs上。同样的,将蛋白Marker、BSA及G4-TBP NPs-BSA加入蛋白泳道进行SDS-PAGE实验,如图6(B)所示,G4-TBPNPs-BSA组与BSA组跑出了相似的蛋白条带,证明了BSA的成功负载。
实施例6
利用CCK-8评价实施例1中制备的G4-TBP、G4-TBP NPs及G4-TBP NPs-FN对RAW264.7细胞活力的影响。收集对数生长期的RAW 264.7细胞,按照1×10
实施例7
将荧光染料Cy5.5-NHS按照摩尔比为3:1的比例滴加到FN水溶液中,室温避光搅拌24h后,转移至截留分子量为5000Da的透析袋中,使用超纯水透析三天,冻干后获得Cy5.5标记的FN(Cy5.5-FN)。随后,按照实施例1的方法合成G4-TBP NPs-Cy5.5 FN。以RAW 264.7细胞为细胞模型来验证FN的细胞内递送效果。收集对数生长期的细胞,按照1×10
实施例8
为验证G4-TBP NPs-FN纳米复合物进入细胞内的机制,收集对数生长期的RAW264.7细胞,按照1×10
实施例9
为了验证制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞活性氧清除的效果,收集对数生长期的RAW264.7细胞,按照1×10
实施例10
以RAW264.7细胞为模型来评价不同材料G4-TBP、FN、G4-TBP NPs-BSA及G4-TBPNPs-FN纳米复合物对激活的巨噬细胞中过氧化氢酶水平的影响。收集对数生长期的RAW264.7细胞,按照2×10
实施例11
为了验证制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞产生氧气水平的影响,收集对数生长期的RAW264.7细胞,以1×10
进一步通过流式细胞术验证制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞氧气水平的影响,收集对数生长期的RAW264.7细胞,按照1×10
实施例12
为了验证制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞极化的影响,按照1×10
实施例13
为了验证制备的G4-TBP、FN、G4-TBP NPs、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞抗凋亡的影响,按照1×10
实施例14
为了进一步探索G4-TBP NPs-FN调节巨噬细胞进行抗炎的分子机理,通过Westernblot实验评价不同材料对巨噬细胞的细胞核和细胞质中NF-κB表达水平的影响。按照2×10
实施例15
为了验证制备的G4-TBP、FN、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对激活的巨噬细胞炎症因子表达的影响,按照1×10
实施例16
为了验证制备的G4-TBP、FN、G4-TBP NPs-BSA及G4-TBP NPs-FN纳米复合物对成骨分化的影响,按照1×10
实施例17
所有动物实验均严格按照动物保护协会标准进行。实验用的6周雄性BALB/c小鼠购自上海斯莱克实验动物中心(中国,上海)。为诱导骨关节炎,小鼠单次经关节内注射5mg/kg碘乙酸钠(MIA),诱导3天后,将小鼠随机分为5组(每组7只),以正常未建模组作为对照。具体分组如下:PBS、G4-TBP、FN、G4-TBP NPs-BSA及G4-TBP NPs-FN组(G4-TBP浓度为5mg/kg),将各组材料在膝关节腔内注射。开始治疗的当天记为第0天,在整个给药期间,所有小鼠分别于第0、4、8、12、16、20天给药一次,期间,每4天记录小鼠体重,第23天处死小鼠。通过眼球取血牺牲小鼠,收集各组小鼠的血清,利用ELISA检测血清中各细胞因子(TNF-α、IL-1β、MMP-13)的表达水平。处死后,采集小鼠的膝关节于组织固定液浸泡24h,运用小动物Micro-CT分析小鼠膝关节的骨质变化。小鼠相对体重变化如图18所示,除了OA模型组(PBS组)中小鼠体重略微下降,经过其它各组的处理,小鼠的体重均有所增长,表明G4-TBP NPs-FN在体内具有良好的生物相容性。Micro-CT结果如图19所示,OA模型组(PBS组)中关节软骨周围出现严重的软骨侵蚀,骨体积/总体积(BV/TV)明显下降,骨小梁数(Tb.N)下降和骨小梁分离(Tb.Sp)的增加,说明PBS组的骨分解代谢大于骨合成代谢,骨量减少且伴随骨质疏松。相比之下,G4-TBP NPs-FN组处理后的膝关节几乎没有病理改变,且BV/TV和Tb.N增加,Tb.Sp下降与正常组水平相当,说明G4-TBP NPs-FN的治疗能够有效地抑制关节软骨的退化。小鼠血清各细胞因子表达结果如图20所示,在OA模型组中,促炎细胞因子TNF-α、IL-1β水平较高,经过G4-TBP和FN的处理,促炎因子水平有所下降。在G4-TBP NPs-FN组中,小鼠血清表现出最低的TNF-α和IL-1β表达水平。MMP-13作为一种软骨降解分子,与软骨的侵蚀息息相关。与OA模型组相比,G4-TBP NPs-FN能够显著降低MMP-13的含量,从而保护关节软骨免受侵蚀。这些结果证明了,纳米复合物能够通过有效抑制促炎因子和软骨降解相关蛋白的表达,抑制软骨组织的细胞外基质被降解,维持软骨表面的完整性,从而高效治疗骨关节炎。
- 一种具有pH响应性的席夫碱共聚物包覆的介孔二氧化硅载药纳米粒子及其制备方法和应用
- 细胞膜仿生的负载含磷树状大分子铜络合物/丰加霉素的响应型纳米平台及其制备和应用
- 细胞膜仿生的负载含磷树状大分子铜络合物/丰加霉素的响应型纳米平台及其制备和应用
