一种来源于岩茶茶渣的ACE抑制肽及其制备方法与应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于ACE抑制肽技术领域,具体涉及一种来源于岩茶的ACE抑制肽及其制备方法与应用。
背景技术
高血压是全球范围内最常见的慢性病之一,引发的并发症严重危害人类的健康。目前高血压无法根治,患者必须长期服用降压药。ACE抑制剂(ACEI)能够抑制ACE酶活性,起到调节血压作用。当前常见的治疗高血压的药物依那普利、氯沙坦、厄贝沙坦等都属于合成的ACE抑制剂,虽然其降压效果显著,但是在应用过程中也出现了严重的负作用,如咳嗽、血管性水肿、头痛等不良反应。
食品源的ACE抑制肽,对高血压具有定向抑制功能,且不影响正常血压,相对于传统降血压药而言,对人体无毒、副作用。目前植物蛋白质源的生物活性肽研究得到被重视,特别是降压肽,因其具有天然、安全性高、易吸收、无副作用的特点而备受关注。武夷岩茶茶渣含有丰富的蛋白质,具有很高的营养价值,可作为天然植物蛋白和生物活性肽的良好来源。
武夷岩茶产于福建闽北地区,具有独特的风味和营养价值,市场空间巨大。目前对岩茶的研究多集中在研究岩茶组成成分和香气物质等方面,对于岩茶蛋白的研究鲜有报道。本发明旨在对岩茶潜在的价值进行开发利用,首次对岩茶ACE抑制肽进行研究,丰富紫苏籽在功能食品中的应用,增加岩茶的附加值。
发明内容
本发明所要解决的技术问题是提供一种岩茶ACE抑制肽及其制备方法与应用,提高岩茶的附加价值,实现资源的综合利用。
为实现上述目的,本发明采用如下技术方案:
一种来源于岩茶的ACE抑制肽,其氨基酸序列为:Phe-Pro-Phe-Pro-Arg-Pro-Pro,缩写为FPFPRPP,即苯丙氨酸-脯氨酸-苯丙氨酸-脯氨酸-精氨酸-脯氨酸-脯氨酸,通过数据库AHTPDB、PlantPepD、biopepDB、UniProt比对,发现其为新型肽。
进一步,上述ACE抑制肽来源于岩茶天然提取或人工合成。
一种制备上述岩茶ACE抑制肽的方法,具体操作步骤如下:
(1)碱提酸沉法制备岩茶粗蛋白:粉碎后的岩茶碎渣与0.24mol/L的NaOH溶液以1:34w/v的料液比混合,66℃下水浴120min,水浴结束后,于4℃条件下12000r/min离心15min,将上清pH调到紫苏籽蛋白等电点1.4-1.8,过夜沉淀后,4℃条件下12000r/min离心15min,取沉淀复溶,pH调到7.0,冷冻干燥即得到岩茶粗蛋白;
(2)酶解制备粗岩茶ACE抑制肽:选用中性蛋白酶酶解岩茶粗蛋白,酶解条件为:加酶6800U/g、温度45℃、pH值7.0、底物浓度2%w/v、酶解时间3h,酶解后沸水浴10min灭酶,冷却后调节pH至中性,于4℃条件下12000rpm离心15min,取上清液冷冻干燥,即得到粗岩茶ACE抑制肽;
(3)岩茶ACE抑制肽的分离纯化:将粗岩茶ACE抑制肽加入蒸馏水配成浓度为50mg/mL的溶液,将溶液过0.22μm滤膜后,用Sephadex G-15凝胶色谱进行分离,以过滤后的去离子水为洗脱液,流速0.3mL/min,测量洗脱组分在214nm波长处的吸光值;收集具有最佳ACE抑制活性的峰,利用反相高效液相色谱RP-HPLC进一步分离;RP-HPLC的洗脱梯度为0-3min,5%v/v乙腈(含0.05%TFA);3-43min,5%-40%v/v乙腈(含0.05%TFA);43-53min,40%v/v乙腈(含0.05%TFA);流速为2.0mL/min,检测波长214nm,收集洗脱时间为46-47min的洗脱峰,真空冷冻干燥即得所述ACE抑制肽。
上述岩茶ACE抑制肽可应用于制备高血压预防药物。
上述岩茶ACE抑制肽在引用于制备降血压保健食品。
本申请的有益效果在于:通过体外ACE抑制活性测定发现,该岩茶ACE抑制肽的IC
附图说明
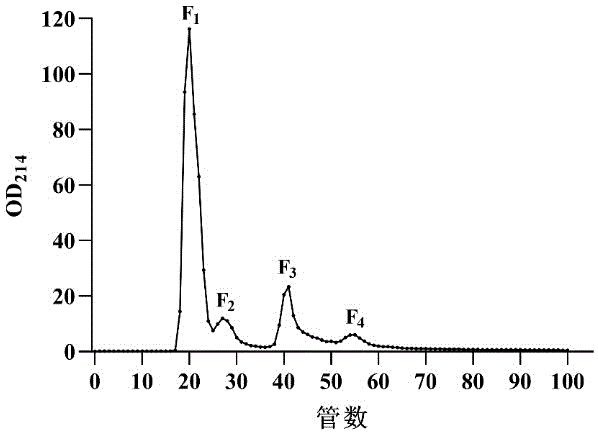
图1:岩茶ACE抑制肽Sephadex G-15色谱图。
图2:Sephadex G-15洗脱峰F1的半制备反相高效液相色谱图。
图3:岩茶ACE抑制肽FPFPRPP质谱图。
图4:FPFPRPP的ACE抑制活性IC
图5:不同浓度的FPFPRPP对人脐静脉内皮细胞毒性的影响。
图6:不同浓度的FPFPRPP对人脐静脉内皮细胞NO释放的影响。
图7:不同浓度的FPFPRPP对人脐静脉内皮细胞ROS释放的影响。
图8:不同浓度的FPFPRPP对人脐静脉内皮细胞内皮素ET-1释放的影响。
图9:FPFPRPP与ACE的分子对接结果。其中,A为ACE与FPFPRPP分子对接结果图;B为相互作用位点放大图;C为相互作用的二维显示图,无虚线连接的ACE上的氨基酸与FPFPRPP的相互作用为范德华力。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
实施例1
本发明所述ACE抑制肽的分离纯化包括Sephadex G-15凝胶过滤色谱和反相高效液相色谱(RP-HPLC)两个步骤。
碱提酸沉法制备岩茶粗蛋白:粉碎后的岩茶碎渣与0.24mol/L的NaOH溶液以1:34w/v的料液比混合,66℃下水浴120min,水浴结束后,于4℃条件下12000r/min离心15min,将上清pH调到紫苏籽蛋白等电点1.4-1.8,过夜沉淀后,4℃条件下12000r/min离心15min,取沉淀复溶,pH调到7.0,冷冻干燥即得到岩茶粗蛋白;
酶解制备岩茶粗多肽:选用中性蛋白酶酶解岩茶粗蛋白,酶解条件为:加酶6800U/g、温度45℃、pH值7.0、底物浓度2%w/v、酶解时间3h,酶解后沸水浴10min灭酶,冷却后调节pH至中性,于4℃条件下12000rpm离心15min,取上清液冷冻干燥,即得到粗岩茶ACE抑制肽;
凝胶过滤色谱(Sephadex G-15)分离:将上述粗岩茶ACE抑制肽溶解于去离子水中,使其浓度为50mg/mL,于4℃条件下15000rpm离心15min。取上清液用0.22μm微滤膜过滤除杂后上样。Sephadex G-15凝胶柱(1.6cm×100cm)用去离子水平衡,将已过滤的样品上柱。用去离子水洗脱,流速0.3mL/min,于214nm波长处检测洗脱液吸光值,绘制洗脱曲线,如图1所示。收集各组分进行ACE抑制活性测定,以检测ACE抑制肽不同分子量的组分的ACE抑制活性情况。组分F1的ACE抑制率最高,其值为74.08%,于是对F1进行富集,以备后续反相高效液相色谱分离纯化。
反相高效液相(RP-HPLC)色谱分离纯化:去离子水溶解上述组分F1冻干粉,浓度为40mg/mL,采用高效液相色谱柱(SP-120-10-C18-AP,250mm×10mm)进行进一步分离纯化,用水和乙腈(均含0.05%(v/v)的三氟乙酸)构成的洗脱系统进行梯度洗脱。参数选择二元泵,A泵为超纯水,B泵为乙腈(均含0.05%(v/v)三氟乙酸);流动相时间参数:0-3min,5%B;3-43min,5-40%B;43-53min,40%B。柱温为25℃,流速为2mL/min,上样体积为100μL,紫外检测波长为214nm,共得到21个洗脱峰,如图2所示。收集46-47min的20号洗脱峰,冷冻干燥后即得所述岩茶ACE抑制肽。对其进行对其进行液相色谱质谱联用(LC-ESI-MS/MS)分析和鉴定,所得岩茶ACE抑制肽的氨基酸序列为Phe-Pro-Phe-Pro-Arg-Pro-Pro(FPFPRPP),质谱图如图3所示。
实施例2
固相合成FPFPRPP,纯度为98%以上,测定其ACE抑制活性IC
式中,ΔA
如图4所示,得到FPFPRPP的ACE抑制活性IC
实施例3
固相合成FPFPRPP,纯度为98%以上,测定其对人脐静脉血管内皮细胞(HUVECs)毒性:选择生长状态良好的HUVEC细胞,加入DMEM培养基制成单细胞悬液,用血细胞计数板计数,以1×10
公式中:A:样品组吸光度;B:对照组吸光度;C:空白组吸光度;
由图5可以发现,当FPFPRPP浓度为0.125、0.25、0.5和1mg/mL时,HUVECs细胞存活率略微有下降的趋势,存活率分别为95.58%、95.34%、95.04%、94.56%,与对照组相比存活率略微下降,但均大于94.5%,仍在安全浓度范围内(细胞存活率大于80%)。
实施例4
固相合成FPFPRPP,纯度为98%以上,测定其降血压功能:选择生长状态良好的HUVEC细胞,加入DMEM培养基,制成单细胞悬液,用血细胞计数板计数,以1×10
由图6可以发现,对照组在Ang II的刺激下,细胞的NO水平显著降低(P<0.01)。与Ang II对照组相比,不同浓度的FPFPRPP处理组NO释放量均显著增加,说明ACE抑制肽FPFPRPP可以刺激HUVECs细胞释放NO,可减少血管收缩剂Ang II对细胞的影响,起到一定的降血压的作用。
实施例5
固相合成FPFPRPP,纯度为98%以上,测定其降血压功能:选择生长状态良好的HUVEC细胞,加入DMEM培养基,制成单细胞悬液,用血细胞计数板计数,以1×10
由图7可以发现,在Ang II的刺激下,细胞的ROS水平显著提高(P<0.01)。随着多肽FPFPRPP的加入,细胞的ROS水平显著降低(P<0.01),但随着浓度的逐步提升,细胞的ROS水平无显著性差异,说明低至0.05mg/mL的FPFPRPP就能起到抑制Ang II诱导的细胞氧化应激的效果,在细胞水平上能够发挥较好的抗氧化作用。
实施例6
固相合成FPFPRPP,纯度为98%以上,测定其降血压功能:选择生长状态良好的HUVEC细胞,加入DMEM培养基,制成单细胞悬液,用血细胞计数板计数,以1×10
由图8可以发现,不同浓度的FPFPRPP均能显著降低细胞中ET-1含量(P<0.05),并在一定范围内,细胞内ET-1的分泌量与FPFPRPP浓度呈负相关,说明ACE抑制肽FPFPRPP可以起到一定的降血压的作用。
实施例7
岩茶ACE抑制肽FPFPRPP与ACE的分子对接:ACE晶体结构(ID:1O8A)从NCBI数据库(https://www.ncbi.nlm.nih.gov/)获得,使用AutoDockTools 1.5.6结合AutoDockVina对蛋白和多肽进行对接,对接位点坐标为:x:40.79,y:33.61,z:43.48。由图9可以发现,FPFPRPP与ACE的残基Arg522、Tyr523、Ser517、Ala354、Glu384形成5个氢键,与Ala63、Ala356、Tyr62、Glu403、Phe512、Phe391、Glu411、Glu123、Trp220、Trp200、His353、His383、Ser355存在范德华力相互作用,与Trp357以π-π作用力结合,与Ala207、Arg124、Ile204、His410、His387、Met223、Pro407以π-烷基作用力结合,从而起到抑制ACE的作用。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 一种西兰花蛋白来源的ACE抑制肽、ACE抑制肽酶切代谢产物及其制备方法和应用
- 一种血管紧张素转化酶ACE抑制肽及其制备方法
- 一种食源性牛蹄筋ACE抑制肽、果蔬咀嚼片及其制备方法
- 一种用固定化酶生产牡蛎ACE抑制肽的方法
- 一种来源于紫苏籽粕的ACE抑制肽及其制备方法与应用
- 一种来源于紫苏籽粕的ACE抑制肽及其制备方法与应用
