基于P-ERCA的赭曲霉毒素A可视化检测方法及试剂盒
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及一种赭曲霉毒素A的检测方法,具体涉及一种基于挂锁式指数级滚环扩增(P-ERCA)的赭曲霉毒素A可视化检测方法及试剂盒,属于生化检测技术领域。
背景技术
赭曲霉毒素A(OTA)广泛存在于被霉菌污染的大麦、玉米、燕麦和大豆等农作物中,当动物摄入了霉变的饲料后,赭曲霉毒素A会在动物体内积累并随着被加工咸肉制品后,进入人体进而侵害肝脏和肾脏,同时还对人体的免疫力造成损害。由于赭曲霉毒素A在真菌毒素中的毒性最强、分布最广、与人类健康关系最密切,所以具有高灵敏度的OTA微量检测方法对监测动物饲料质量安全以及保护人类健康具有重大的意义。
目前检测粮食和饲料中赭曲霉毒素A的仪器方法主要有仪器法和试纸条法。其中仪器法包括高效液相色谱法、气相色谱法、质谱法和荧光光度法等,这些方法灵敏度较高,结果稳定可重复,但所需仪器较昂贵且样品前处理步骤繁琐,耗时时间长,不适用于大量待测样品的现场检测,限制了其应用。试纸条法主要为测流向试纸条法,其实际上主要应用了免疫法的原理,即采用抗原抗体的高特异性对赭曲霉毒素A进行检测,但制备抗体所需时间长且价格昂贵,难以满足现场检测所需的低成本、高通量等要求。
发明内容
本发明的主要目的是提供一种基于P-ERCA的赭曲霉毒素A可视化检测方法,其具有成本低、操作便捷、灵敏度高、特异性好和检测时间短等优点,从而克服现有技术的不足。
本发明还提供了一种基于P-ERCA的赭曲霉毒素A可视化检测试剂盒。
本发明的一个方面提供了一种基于P-ERCA的赭曲霉毒素A可视化检测方法,其包括:
S1、使修饰在赭曲霉毒素A适配体上的第一修饰物与固定在固相载体的第二修饰物特异性结合,之后使所述赭曲霉毒素A适配体与经过亲和力及竞争释放能力筛选后的单链DNA引物杂交结合,获得第一液相反应体系;
S2、在所述第一液相反应体系中加入赭曲霉毒素A,并使赭曲霉毒素A与所述赭曲霉毒素A适配体特异性结合,以使至少部分的所述单链DNA引物与所述赭曲霉毒素A适配体分离,并游离于液相反应体系中,从而获得第二液相反应体系;
S3、从所述第二液相反应体系中分离出上清液,并基于所述上清液构建挂锁式指数级滚环扩增反应体系,再进行挂锁式指数级滚环扩增,获得含有目标DNA的第三液相反应体系;
S4、以修饰有显色标记的信号探针和固定有检测探针的试纸条对所述第三液相反应体系进行检测,从而实现对赭曲霉毒素A的可视化检测,其中所述信号探针、检测探针的核苷酸序列分别与所述目标DNA的部分核苷酸序列互补。
本发明的另一个方面提供了一种基于P-ERCA的赭曲霉毒素A可视化检测试剂盒,其包括赭曲霉毒素A适配体、单链DNA引物、挂锁式指数级滚环扩增反应组件、修饰有显色标记的信号探针和试纸条等;所述挂锁式指数级滚环扩增反应组件包括DNA连接酶、脱氧核苷酸三磷酸、DNA聚合酶和挂锁式模板探针;所述试纸条的检测线、质控线上分别固定有检测探针、质控探针。
相较于现有技术,本发明利用指数级滚轮扩增将信号进行放大,并首次与试纸条相结合,实现了赭曲霉毒素的高灵敏和可视化检测,其具有成本低、操作便捷、灵敏度高、特异性好和检测时间短等优点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将实施例或现有技术描述中所需要使用的附图作简单地介绍。
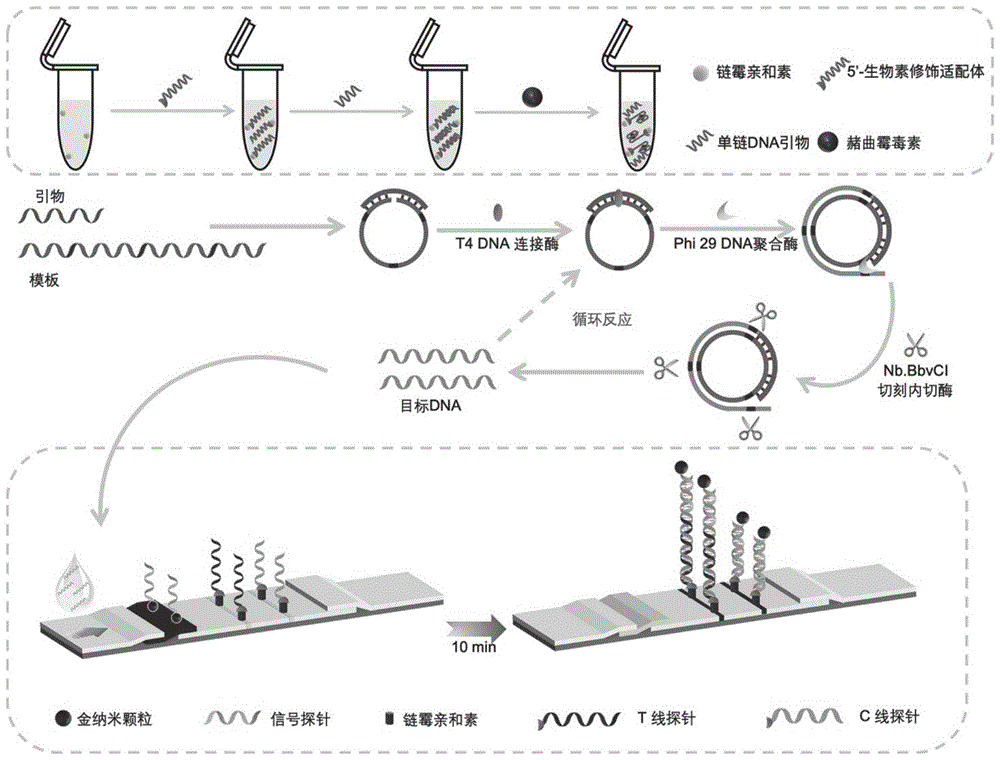
图1是本发明的一些实施例中一种赭曲霉毒素A可视化检测方法的原理图;
图2是本发明一实施例中一种赭曲霉毒素A可视化检测方法的可行性测试结果;
图3是本发明一实施例中一种赭曲霉毒素A可视化检测方法的灵敏度测试结果;
图4是本发明一实施例中一种赭曲霉毒素A可视化检测方法的特异性测试结果;
图5是本发明一实施例中与赭曲霉毒素适配体互补的不同单链DNA引物的OTA竞争值测试图。
具体实施方式
针对现有赭曲霉毒素A检测技术上的不足,本案发明人经长期研究和大量实践,得以提出本发明的技术方案,其主要是一种基于挂锁式指数级滚环扩增和金标试纸条可视化检测赭曲霉毒素A的方法,该方法的特异性好、灵敏度高、操作简便且检测成本低,符合现场快速检测的要求。如下将对该技术方案、其实施过程及原理等作进一步的解释说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用其他不同于在此描述的方式来实施,因此,本发明的保护范围并不受下面公开的具体实施例的限制。
本发明的一些实施例提供的一种基于P-ERCA的赭曲霉毒素A可视化检测方法包括:
S1、使修饰在赭曲霉毒素A适配体上的第一修饰物与固定在固相载体的第二修饰物特异性结合,之后使所述赭曲霉毒素A适配体与单链DNA引物杂交结合,获得第一液相反应体系;
S2、在所述第一液相反应体系中加入赭曲霉毒素A,并使赭曲霉毒素A与所述赭曲霉毒素A适配体特异性结合,以使至少部分的所述单链DNA引物与所述赭曲霉毒素A适配体分离,并游离于液相反应体系中,从而获得第二液相反应体系;
S3、从所述第二液相反应体系中分离出上清液,并基于所述上清液构建挂锁式指数级滚环扩增反应体系,再进行挂锁式指数级滚环扩增,其中扩增产物富含酶切位点,可形成边扩增边切割效应,获得含有目标DNA的第三液相反应体系,其中目标DNA可以继续参与激发挂锁式指数级滚环扩增。
S4、以修饰有显色标记的信号探针和固定有检测探针的试纸条对所述第三液相反应体系进行检测,从而实现对赭曲霉毒素A的可视化检测,其中所述信号探针、检测探针的核苷酸序列分别与所述目标DNA的部分核苷酸序列互补。
在一个实施例中,所述赭曲霉毒素A适配体的核苷酸序列如SEQ ID NO.1所示。所述单链DNA引物的核苷酸序列如SEQ ID NO.2所示,它是经过特异性设计和优化的,从而可以保障本申请方法的敏感性和下游挂锁式指数级滚环扩增的特异性。
在一个实施例中,所述第一修饰物包括生物素,所述第二修饰物包括链霉亲和素。
在一个实施例中,所述固相载体为用于容置所述第一液相反应体系的容器的内壁。所述容器可以是PCR管等。在一些情况下,所述固定载体还可以是诸如磁性微球等。
在一个实施例中,所述挂锁式指数级滚环扩增反应体系还包含DNA连接酶、脱氧核苷酸三磷酸、DNA聚合酶和挂锁式模板探针等。如本领域技术人员所知悉的,所述挂锁式指数级滚环扩增反应体系还可以包含缓冲盐等其他常规组分。
在一个实施例中,所述挂锁式模板探针的5′端修饰有磷酸基团,保证在引物互补配对结合的条件下,通过DNA连接酶将挂锁式模板探针的5′端和3′端连接成环。进一步的,所述挂锁式模板探针的核苷酸序列中设计有三个切刻内切酶酶切位点,在滚环扩增产生双链的条件下可以被特异性识别,进而产生发生酶切反应。相较于含有两个以下酶切位点的挂锁式探针,采用本申请的挂锁式模板探针,可以显著提升扩增效率,从而有效提高检测灵敏度和特异性。
较为优选的,所述挂锁式模板探针的核苷酸序列如SEQ ID NO.3所示。
在一个实施例中,所述信号探针的核苷酸序列如SEQ ID NO.4所示。
在一个实施例中,所述显色标记包括纳米金颗粒,或称胶体金,其粒径可以设置为20~35nm。示例性的,可以在所述检测探针的5′端修饰巯基,并利用所述巯基将纳米金颗粒与所述检测探针共价连接,进而使所述检测探针亦称金标探针。
在一个实施例中,所述试纸条具有检测线(T线)和质控线(C线),所述检测线上固定有所述检测探针(亦称T线探针),所述质控线上固定有质控探针(亦称C线探针),所述检测探针的核苷酸序列如SEQ ID NO.5所示,所述质控探针的核苷酸序列如SEQ ID NO.6所示。
进一步的,所述试纸条可以采用本领域常用的试纸条,其可以包括样品吸收垫、金标垫、硝酸纤维素膜、吸水垫和底板等常规组件。所述硝酸纤维素膜上偶联有T线探针和C线探针,所述金标垫上偶联有金标探针。在一些情况下,所述样品吸收垫、金标垫、硝酸纤维素膜、吸水垫依次粘贴在底板上,所述金标垫在长度方向上约有1/3~1/2被覆盖于样品吸收垫下,依次组装成试纸条。
在一个实施例中,所述检测探针的3′端修饰生物素,能够与链霉亲和素结合进而固定在T线上,检测探针与目标DNA能够发生特异性结合。更确切的讲,目标DNA是挂锁式指数级滚环扩增的单链DNA产物,其一部分序列与检测探针互补,另一部分序列与信号探针互补。
在一个实施例中,所述质控探针的5′端修饰生物素,能够与链霉亲和素结合进而固定在C线上,质控探针与信号探针特异性结合。
在一个实施例中,所述赭曲霉毒素A是从被污染的谷物中分离获得。
参阅图1,本发明的所述可视化检测方法主要包括扩增步骤和检测步骤。其中扩增步骤包括适配体竞争和引物引发的挂锁式指数级滚环扩增(P-ERCA)步骤两个部分。
该适配体竞争步骤是指赭曲霉毒素A竞争适配体的部分互补链(引物),掉落的单链DNA引物悬浮在竞争体系中,吸取引物引发后续扩增反应。示例性的,将用生物素修饰的赭曲霉毒素A适配体加入固定有链霉亲和素的PCR管中后,适配体会因生物素与链霉亲和素的特异性结合作用而固定在PCR管中,之后加入具有与适配体的部分核苷酸序列互补的核苷酸序列的单链DNA引物时,适配体会与单链DNA引物杂交结合,然后向PCR管中加入赭曲霉毒素A时,适配体与赭曲霉毒素A发生特异性结合,至少部分的单链DNA引物会被竞争下来,游离在反应体系中。
该引物引发的挂锁式指数级滚环扩增步骤包括连接成环、滚环扩增和切刻酶切刻反复交替的过程。具体的,连接成环的过程是通过DNA连接酶将挂锁式模板探针在单链DNA引物的结合下,连接成环状DNA,进而引发等温扩增。继而,扩增后的大量单链产物在挂锁式模板探针存在的条件下,切刻内切酶产生切口,在DNA聚合酶的作用下,继续扩增产生单链产物(即目标DNA),进而实现指数级滚环扩增。
示例性的,所述赭曲霉毒素适配体的5′端修饰有生物素,与固定修饰有链霉亲和素的PCR管结合,所述引物与适配体的3′端序列部分互补。在赭曲霉毒素识别阶段,赭曲霉毒素与适配体发生特异性结合,所述引物被竞争下来,与挂锁式模板探针的5′端和3′端发生特异性结合,在等温扩增(RCA)的连接反应阶段,DNA连接酶将挂锁式模板探针的5′和3′连接在一起,挂锁式模板探针被连接成环;在RCA延伸阶段,DNA聚合酶沿着挂锁式模板探针链从5′到3′的方向合成新链,当切刻内切酶到达切刻酶切酶的识别位点时,发生切刻反应,在DNA聚合酶的作用下继续进行扩增,掉落的单链片段继续结合环式挂锁式模板探针进行进一步扩增-切刻-扩增循环,实现指数级扩增。
其中,所述赭曲霉毒素适配体的工作浓度可以为1~100nM;所述单链DNA引物的工作浓度可以为1~100nM,其与所述赭曲霉毒素适配体的体积浓度比可以为1:1;所述挂锁式模板探针的工作浓度可以为0.1~1μM。
其中,所述等温扩增的反应程序可以包括:于22℃左右连接反应30min左右,于30℃左右扩增切割反应4h左右。
在扩增步骤结束后,使用试纸条分析检测扩增后的产物,根据试纸条的T线的深浅程度,得到所述待测样品的检测结果,从而实现待测样品的可视化检测。
本发明的一些实施例提供的一种基于P-ERCA的赭曲霉毒素A可视化检测试剂盒包括:
赭曲霉毒素A适配体,其核苷酸序列如SEQ ID NO.1所示;
单链DNA引物,其核苷酸序列如SEQ ID NO.2所示;
挂锁式指数级滚环扩增反应组件,包括DNA连接酶、脱氧核苷酸三磷酸、DNA聚合酶和挂锁式模板探针,其中挂锁式模板探针的核苷酸序列如SEQ ID NO.3所示;
修饰有显色标记的信号探针,其核苷酸序列如SEQ ID NO.4所示;
试纸条,其检测线、质控线上分别固定有检测探针、质控探针,所述检测探针的核苷酸序列如SEQ ID NO.5所示,所述质控探针的核苷酸序列如SEQ ID NO.6所示。
在一个实施例中,所述显色标记包括共价键合于所述信号探针5′端的纳米金颗粒。
在一个实施例中,所述试纸条包括底板和依次粘贴在底板上的样品吸收垫、金标垫、硝酸纤维素膜及吸水垫等。也可以认为,所述底板的上端面包括沿设定方向依次设置的上样区、标记区、划线区及吸水区。所述标记区结合有修饰有显色标记的信号探针,例如偶联有纳米金颗粒的信号探针,即前述的金标探针。所述划线区内设置有检测线和质控线,所述检测线和质控线分别通过链霉亲和素结合有生物素修饰的检测探针、质控探针。
其中,所述底板的材质可以包括塑料等,上样区的材质可以包括玻璃纤维或聚酯膜等,划线区的材料可以包括硝酸纤维素膜或纯纤维素膜等;吸水区的材质可以包括滤纸等。
示例性的,一种制备所述试纸条的方法可以包括:
将用巯基修饰的信号探针与胶体金偶联,制得探针偶联的胶体金,即前述金标探针;
将金标探针施加于金标记区,将生物素修饰的检测探针、质控探针分别和链霉亲和素偶联制成划线区的检测线以及质控线;
以及,将上样区、金标记区、划线区和吸水区沿设定方向依次设置在底板上。
其中,所述金标探针的工作浓度可以为1.0~2.0μM;所述胶体金的粒径可以为20~35nm;所述链霉亲和素的浓度可以为2.5~5.0mg/mL;所述T线探针的工作浓度为0.2~0.8μM;所述C线探针的工作浓度为0.2~0.5μM。
本发明的所述可视化检测方法的定性检测限为0.0001-10000pg/mL。与现有的用于检测OTA的仪器法或试纸条法相比,本发明的方法摆脱了对昂贵仪器(如荧光定量PCR仪等)和精密操作的依赖,简化了OTA的检测手段,提高了灵敏度,成本更低,更便捷,灵敏度更高,特异性更强,有效提高了检测准确性,能充分满足现场、高通量的检测要求。
下面结合若干优选实施例及附图对本发明的技术方案进一步详细说明,本实施例在以发明技术方案为前提下实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
如无特殊说明,如下实施例中所采用的实验材料均可由常规的生化试剂公司购买得到。其中所使用的赭曲霉毒素A适配体、单链DNA引物1~引物6、挂锁式模板探针、胶体金修饰的信号探针、检测探针、质控探针的核苷酸序列如下表1所示。
表1本发明实施例中所使用的部分试剂的核苷酸序列
实施例1一种赭曲霉毒素A可视化检测方法包括如下步骤:
(1)PCR管上适配体-引物复合物的固定:
将20μL 0.8wt%戊二醛加入PCR管中37℃孵育5h,之后吸出戊二醛,加入超纯水清洗3遍,然后加入10μg/mL的链霉亲和素37℃孵育2h,其后吸出链霉亲和素,加入PBST溶液清洗2遍,之后加入2μL 1μM5′端修饰生物素的适配体和18μL 50mM PBS,室温摇床孵育2h,而后吸出适配体混合液,加入PBST溶液清洗3遍,再加入2μL 1μM单链DNA引物1(如下简称引物1)和18vL结合溶液(含10mM Tris-HCl,120mM NaCl,10mM KCl,20mM MgCl
(2)PCR管内引物的竞争反应:在步骤(1)得到的偶联有适配体-引物复合物的PCR管内,吸取多余蔗糖溶液,并分别加入10μL不同浓度(0、0.001pg/mL、0.01pg/mL、0.1pg/mL、10pg/mL、1ng/mL、10ng/mL)的OTA水溶液和10μL结合溶液,室温混匀1h,发生引物竞争反应,吸取2μL进行后续挂锁式指数级滚环扩增。其中,OTA水溶液是将OTA溶于DEPC水形成。
(3)挂锁式指数级滚环扩增(P-ERCA)
首先,分别加入2μL步骤(2)中包含引物1的上清液,再加入1μL挂锁式模板探针、2μL 10×T4 DNA连接酶缓冲液、1μL T4 DNA连接酶(5U/μL),22℃下孵育30min形成滚环体系;其次,加入2μL 25mM dNTPs、1μL Phi 29DNA聚合酶(1000U/mL)、2μL Phi 29DNA聚合酶缓冲液、1μL Nb.BbvCI切刻内切酶(1000U/mL)和2μL rCut Smart,用DEPC水补充体系至20μL,37℃孵育4h,这将触发滚环扩增产生大量具有切刻内切酶识别位点的单链DNA,并在切刻内切酶的作用下形成短的目标DNA,继续参与滚环扩增,从而实现目标DNA数量的指数级增长;最终,将混合物在65℃下加热10min以使酶失活。
其中,P-ERCA反应体系的组成如表2所示(20μL)。
表2本实施例中P-ERCA反应体系的组成
(4)胶体金分散液的制备:
所用的锥形瓶用王水浸泡,双蒸水反复煮沸清洗干净后,烘箱烘干备用;制备时,锥形瓶装入约200mL的去离子水和2.55mL质量分数为0.5%的氯金酸溶液以及一个搅拌子,中速搅拌后静置,加热至微沸时加入3mL质量分数为1%的柠檬酸三钠溶液,边加热边搅拌,直至溶液颜色由深紫色变为酒红色,当颜色不再变化时关闭加热继续搅拌5min使反应完全;最后制得胶体金分散液,并于4℃保存备用。
(5)胶体金标记的信号探针的制备:
每个1.5mL离心管中加入1mL制备好的胶体金分散液和4μL 10%的吐温80,震荡孵育30min后,13000rpm离心15min,弃去上清液后加入100μL去离子水复溶备用;每个5mL玻璃瓶中分别加入10μL 10μM的胶体金标记的信号探针和5μL 1mM的TCEP进行活化,室温静置1h;在每个玻璃瓶中加入复溶好的胶体金分散液和100μL PBS溶液,混匀后放置于50℃水浴锅水浴2h;将每个玻璃瓶中加入100μL 100μM的dATP进行1h室温封闭;偶联完成后将混合物于10000rpm离心10min,弃上清液用重悬液恢复至原体积的1/10,构成胶体金标记的信号探针复合物,取6μL滴加至金标垫进行烘干备用。
(6)检测线和质控线探针的制备:
将6μL T线探针、2.5μL 5mg/mL链霉亲和素以及2μL C线探针、2.5μL 5mg/mL链霉亲和素分别用50mM PBS补齐体积至20μL,避光旋转孵育2h;分别将偶联好的T线探针和C线探针以2cm/s的喷速均匀喷涂至硝酸纤维素膜上,并于30℃烘箱烘干备用。
(7)在步骤(3)结束后,取各P-ERCA反应扩增产物分别滴加到步骤(6)制备的试纸条的上样区,观察试纸条上T线、C线的显色情况,实现对OTA的检测。
请参阅图2,当样品中不含OTA时(OTA浓度为0,实际为DEPC水,即阴性对照组),引物竞争反应无法进行,溶液中不会出现引物,无法引发后续指数级滚环扩增,检测线T线无信号响应;当样品中存在OTA,尤其是浓度在0.01pg/mL以上的OTA时,引物竞争反应正常进行,溶液中出现引物,引发后续指数级滚环扩增,T线有信号响应。
同时,还可以通过肉眼观察试纸条上检测线颜色的深浅来判断样本的检测结果。具体的,请参阅图3,当样品中OTA浓度为0.01pg/mL时,T线的显色强度与阴性结果相比有明显的增强。证明本实施例的检测方法有很好的灵敏度。而且,随着样品中OTA浓度的逐渐提高,T线的显色强度也随之逐渐提高,说明本实施例的检测方法还适用于对含有浓度为0.01pg/mL~10ng/mLOTA的样品进行定量检测。
另外,为测试本实施例检测方法的选择性,还将步骤(2)中的10μL OTA水溶液分别替换为10μL 5ng/mL AFM1、ZEN、DON、OTB、OTC、mixture和OTA水溶液作为阳性对照,并以10μL DEPC水作为阴性对照,以及利用前述试纸条进行了实验,实验结果如图4所示。可以看到,当样品中不含OTA时,试纸条的T线没有信号响应,表明本实施例的检测方法对OTA有良好的特异性,且能肉眼直接观察出最终结果,有助于提升OTA检测的准确性和方便性。
实施例2~实施例6
该实施例2~实施例6提供的一种赭曲霉毒素A可视化检测方法均与实施例1基本相同,区别仅在于:分别将前述引物1替换为前述物2、引物3、引物4、引物5、引物6。其中,在实施例1所提供的反应条件下,引物1~引物6与核酸适配体结合形成的DNA双链的Tm值分别为62.3℃、60.2℃、62.3℃、66.9℃、60.2℃、52.4℃,OTA竞争值F/F
另外,发明人还利用Primer Premier软件设计了其他一系列引物,并也参照实施例1的方式进行实验,结果表明,当采用这些引物时,均无法同时获得对OTA的高灵敏度、高特异性的可视化检测效果。
尽管已参考说明性实施例描述了本申请,但所属领域的技术人员将理解,在不背离本申请的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所述实施例的元件。另外,可在不背离本申请的范围的情况下做出许多修改以使特定情形或材料适应本申请的教示。因此,本文并不打算将本申请限制于用于执行本申请的所揭示特定实施例,而是打算使本申请将包含归属于所附权利要求书的范围内的所有实施例。
- 黄曲霉毒素B1的核酸适配体、含有该核酸适配体的黄曲霉毒素B1检测试剂盒及检测方法
- 一种基于自供电光电分析可视化检测赭曲霉毒素A的方法
- 基于量子点的赭曲霉毒素A的sFLISA快速检测方法和试剂盒
