洋葱伯克霍尔德菌复合群PCR检测引物及其检测方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及生物检测技术领域,具体涉及一种洋葱伯克霍尔德菌复合群PCR检测引物及其检测方法。
背景技术
洋葱伯克霍尔德菌复合群(Burkholderia cepacia complex,Bcc)是一类革兰氏阴性、非发酵需氧型表型相近、基因型上存在差异的变形菌门β亚纲细菌总称。截止目前,已被分类命名的BCC成员达到24个种。BCC可在严苛、低营养的环境中存活。近些年发现,BCC是引起菌血症、尿路感染、脓毒性关节炎、腹膜炎、诱发囊性纤维化(cystic fibrosis,CF)和慢性肉芽肿病等呼吸系统病的重要条件病原体,可导致感染人群和免疫缺陷病人群的高死亡率。由于BCC具有多种毒力因子、天然的抑菌剂和抗生素的多重耐药性,也是导致医疗机构和护理机构内部感染的重要病原菌之一。每年由于BCC污染而导致的非无菌产品召回事件层出不穷,因此亟需开展洋葱伯克霍尔德菌复合群的检查和研究。
《中国药典》洋葱伯克霍尔德菌群检查法草案公示稿明确要求,需对《中国药典》列出的24株洋葱伯克霍尔德菌进行检测。由于洋葱伯克霍尔德菌复合群中洋葱伯克霍尔德菌数量较多,若对各个菌种单独进行检测,则检测试剂、工作量均较大,操作繁琐,耗时过长。因此,亟需开发高通量的快速洋葱伯克霍尔德菌复合群检查方法。
申请号为202111216769.3的中国发明专利公开了一种伯克霍尔德氏菌的数字PCR检测试剂盒,利用引物、探针组能够准确鉴定样品中是否含有洋葱伯克霍尔德氏菌、鼻疽伯克霍尔德菌、假鼻疽伯克霍尔德菌的DNA。但是洋葱伯克霍尔德菌复合群中洋葱伯克霍尔德菌数量较多,该PCR检测试剂盒并不能保证完全能检测出24株洋葱伯克霍尔德菌,且在检测的过程中,洋葱伯克霍尔德氏菌可能会与鼻疽伯克霍尔德菌、假鼻疽伯克霍尔德菌发生交叉,影响洋葱伯克霍尔德氏菌复合群的检测结果。
发明内容
针对现有技术中的上述不足,本发明的目的在于提供一种洋葱伯克霍尔德菌复合群PCR检测引物及其检测方法,可对洋葱伯克霍尔德菌群24个种水平成员进行统一检测。
为了达到上述发明目的,本发明采用的技术方案为:
第一方面,提供一种洋葱伯克霍尔德菌PCR检测引物,该引物为第一组PCR引物或第二组PCR引物中的任意一种;
第一组PCR引物的序列为:
Primer F:ATGCGCAATGCGATGACC
Primer R:ATTTCCGTGCGCTTGCT
Taqman probe:FAM-AACGGCACGCTCGCGAGCGG-BHQ1;
第二组PCR引物的序列为:
Primer F:CGTACAAGGCCGCCGA
Primer R:AGCGCCTTCTTCATGTC
Taqman probe:FAM-TTCAAGAAGCCGCGCAAC-BHQ1。
进一步地,优选第一组PCR引物。
第二方面,提供一种利用上述引物检测洋葱伯克霍尔德菌复合群的方法,该方法包括以下步骤:
步骤1、提取待检测洋葱伯克霍尔德菌样本的DNA;
步骤2、以步骤1提取的DNA为模板,利用第一组PCR引物或第二组PCR引物进行PCR扩增,将Ct值大于30的样本判定为阴性,Ct值小于等于30的样本判定为阳性。
进一步地,步骤2中,PCR反应体系如下表所示:
反应程序为95℃ 5min;95℃ 15s,60℃ 1min,40cycles。
本发明的有益效果为:
本发明提供的洋葱伯克霍尔德菌复合群PCR检测引物及其检测方法,可对洋葱伯克霍尔德菌复合群24个种水平成员进行统一检测,该方法准确性高、特异性强、灵敏度高。
附图说明
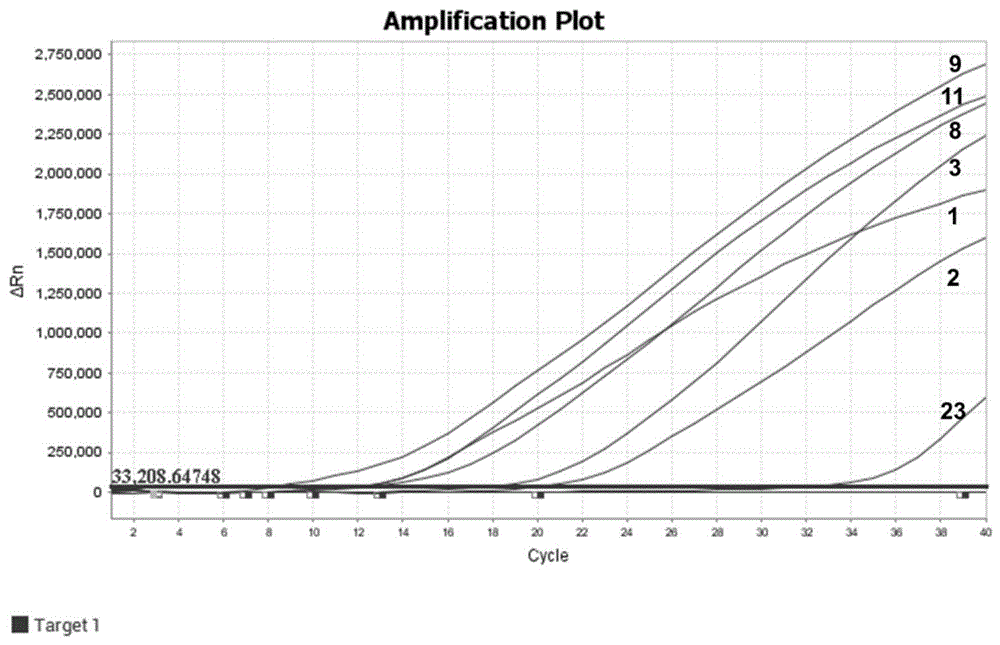
图1为样本1 2 3 8 9 11 23采用第一组PCR引物(syto 9染料法,退火温度60℃)检测结果示意图;
图2为样本1 2 3 8 9 11 23采用第二组PCR引物(syto 9染料法,退火温度60℃)检测结果示意图;
图3为样本1 2 3 8 9 11 23采用第三组PCR引物(syto 9染料法,退火温度60℃)检测结果示意图;
图4为样本1 2 3 8 9 11 23采用第一组PCR引物(syto 9染料法,退火温度58℃)检测结果示意图;
图5为样本1 2 3 8 9 11 23采用第二组PCR引物(syto 9染料法,退火温度58℃)检测结果示意图;
图6为样本1 2 3 8 9 11 23采用第一组PCR引物检测结果(syto 9染料法,退火温度62℃)检测结果示意图;
图7为样本1 2 3 8 9 11 23采用第二组PCR引物(syto 9染料法,退火温度62℃)检测结果示意图;
图8为样本1 2 3 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23采用第一组PCR引物(syto 9染料法)检测结果示意图;
图9为样本1 2 3 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23采用第一组PCR引物(Taqman探针法)检测结果示意图;
图10为样本24 25 26 27 28 29 30 31采用第一组PCR引物(Taqman探针法)检测结果示意图;
图11为样本32 33 34 37 38 39 40 41采用第一组PCR引物(Taqman探针法)检测结果示意图;
图12为样本35 36采用第一组PCR引物(Taqman探针法)检测结果示意图。
具体实施方式
下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
实施例1、基因组DNA的提取
按照商业化试剂盒标准方法提取DNA,具体操作如下:
①称取1ml菌液,加入1.5mL离心管中,离心去上清,加入200μL缓冲液GA,振荡至混匀;
②加入20μL蛋白酶K溶液混匀,70℃酶解15min,期间颠倒混合样品2~3次;
③加入200μL缓冲液GB,充分颠倒混匀,溶液变清亮,简短离心以去除管盖内壁的水珠。
④加入200μL无水乙醇,充分振荡混匀15秒,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠;
⑤将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12000rpm(~13400g)离心30秒,倒掉废液,将吸附柱CB3放回收集管中;
⑥向吸附柱CB3中加入500μL缓冲液GD(使用前请先检查是否加入无水乙醇),12000rpm(~13400g)离心30秒,倒掉废液,将吸附柱CB3放入收集管中;
⑦向吸附柱CB3中加入600μL漂洗液PW(使用前先检查是否已加入无水乙醇),12000rpm(~13400g)离心30秒,倒掉废液,将吸附柱CB3放入收集管中;
⑧重复操作步骤7;
⑨将吸附柱CB3放回收集管中,12000rpm(~13400g)离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
⑩将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μL洗脱缓冲液TE,室温静置2-5min,12000rpm(~13400g)离心2min,将溶液收集到离心管中,置于-20℃保存,此即为下一步核酸检测的模板。
实施例2、PCR扩增检测
2.1PCR引物设计:
根据2022年9月15日获得的保守基因序列信息,设计PCR引物。选择所有菌株中重复次数最多的碱基序列,且尽量保持引物3’端无碱基错配。
1)第一组PCR引物
ATGCGCAATGCGATGACCACGAACGGCACGCTCGCGAGCGGCAACCG CTACGCGATCGTCGGCATCGCCGAGTACGCGCTCAGCAAGCGCACGGAAA T(SEQ ID NO.1)
Primer F:ATGCGCAATGCGATGACC
Primer R:ATTTCCGTGCGCTTGCT
Taqman probe:FAM-AACGGCACGCTCGCGAGCGG-BHQ1。
2)第二组PCR引物
CGTACAAGGCCGCCGACTTCAAGAAGCCGCGCAACCTGATCGGCCTG CAGAAGACGCTGCCCGATGCCGACATGAAGAAGGCGCT(SEQ ID NO.2)
Primer F:CGTACAAGGCCGCCGA
Primer R:AGCGCCTTCTTCATGTC
Taqman probe:FAM-TTCAAGAAGCCGCGCAAC-BHQ1。
3)第三组PCR引物
CGTGTCGATCTACAACATCTCCGCATGGGGCAGCGGTTATGCGATCCACCAGGGCGACTTCGACCGCTTCAACGGCGACCGCCTGCCGAATTCGGTGAAGTTCCTGTCGAACGACCTCAGCGGCTTCAAGTTCGGCGCGATGTACTCGT TCGGCAACGTCGC(SEQ ID NO.3)
Primer F:CGTGTCGATCTACAACAT
Primer R:GCGACGTTGCCGAAC
Taqman probe:FAM-CAGGGCGACTTCGACCG-BHQ1。
2.2PCR反应体系:
PCR反应体系如下表1所示。反应总体积为25μL,其中核酸模板为2μL。实时PCR反应在QuantStudioTM3实时PCR仪器上进行,反应程序为95℃ 5min;95℃ 15s,60℃ 1min,40cycles。
表1PCR反应体系
实施例3、PCR引物及退火温度的优化
选择表2中自编号为1 2 3 8 9 11 23的菌株进行PCR检测(syto 9染料法),此时退火温度为60℃。结果第一组PCR引物和第二组PCR引物均能检测到1 23 8 9 11号菌株,23号铜绿假单胞菌检测信号较弱,Ct值大于35(如图1-2所示),但是第三组PCR引物无法完全检测到上述菌株(如图3所示),表明第一组PCR引物和第二组PCR引物可用于检测洋葱伯克霍尔德菌复合群,第三组PCR引物无法用于检测洋葱伯克霍尔德菌复合群。
为选择出两组引物中检测效果最优的引物及其最优退火温度,本发明实施例还有以下设计。
选择表2中自编号为1 2 3 4 8 9 11 23的菌株进行PCR检测(syto 9染料法),对第一组引物和第二组引物PCR反应的退火温度进行优化。图1、图4、图6表明,第一组PCR引物退火温度为60℃时,反应速度较快且23号铜绿假单胞菌的检测信号较弱。图2、图5、图7表明,第二组PCR引物退火温度为58℃时扩增速度较快,但23号铜绿假单胞菌有检测信号,引物退火温度为60℃时扩增速度较慢,23号铜绿假单胞菌无检测信号。以上结果表明,第一组引物、退火温度为60℃时检测效果最佳。因此,此后实验均采用此条件进行菌株检测。
实施例4、syto 9染料法和Taqman探针法的检测效果对比
根据实施例3中PCR引物及退火温度优化结果,选择使用第一组PCR引物对表2中自编号为1 2 3 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23的菌株进行PCR检测(分别采用syto 9染料法和Taqman探针法)。
syto 9染料法结果如图8所示,除23号铜绿假单胞菌无检测信号或信号较弱以外,别的菌株都有检测信号,且Ct值均小于24。Taqman探针法结果如图9所示,除了23号铜绿假单胞菌无信号或信号极弱,别的菌株都有检测信号,且Ct值均小于22。
上述结果表明,相较于syto 9染料法,Taqman探针法的检测效果更优,因此,此后实验均采用Taqman探针法进行菌株检测。
实施例5、Taqman探针法的检测结果
利用Taqman探针PCR法(第一组PCR引物)对表2中自编号为24-41的菌株进行检测,结果如图10-12所示,编号37、38、39、40、41的菌株Ct值较靠后,大于30,其他菌株Ct值均小于24。
根据上述检测数据,现将检测结果小结如下表2:
表2菌株信息及PCR检测结果
根据检测结果,可将Ct值大于30的样本判定为阴性;Ct值小于等于30的样本判定为阳性。
本发明首先利用生物信息学方法,对24株洋葱伯克霍尔德菌的分子生物信息进行分析,筛选出洋葱伯克霍尔德菌所特有的多个候选序列片段;根据这些序列片段,设计相应的引物及探针;利用所设计的引物和探针对洋葱伯克霍尔德菌复合群进行实际检测,根据实际检测的效果,最终得到能够特异性检测洋葱伯克霍尔德菌复合群的引物及探针体系。
本发明提供的洋葱伯克霍尔德菌复合群PCR检测引物及其检测方法,可对洋葱伯克霍尔德菌复合群24个种水平成员进行统一检测,该方法准确性高、特异性强、灵敏度高。
于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 唐菖蒲伯克霍尔德氏菌及米酵菌酸产毒株的检测方法、检测用荧光PCR引物和探针
- 用于检测洋葱伯克霍尔德菌群的试剂盒、引物和方法及应用
